PENJERAPAN LOGAM Cd, Fe DAN Zn
DENGAN ADSORBEN CANGKANG TELUR
BEBEK YANG TELAH DIAKTIVASI
SKRIPSI
Oleh
KRISNAWATI
090405023
DEPARTEMEN TEKNIK KIMIA
FAKULTAS TEKNIK
PENJERAPAN LOGAM Cd, Fe DAN Zn
DENGAN ADSORBEN CANGKANG TELUR
BEBEK YANG TELAH DIAKTIVASI
SKRIPSI
Oleh
KRISNAWATI
090405023
SKRIPSI INI DIAJUKAN UNTUK MELENGKAPI SEBAGIAN
PERSYARATAN M ENJADI SARJANA TEKNIK
DEPARTEMEN TEKNIK KIMIA
FAKULTAS TEKNIK
PERNYATAAN KEASLIAN SKRIPSI
Saya menyatakan dengan sesungguhnya bahwa skripsi dengan judul:
PENJERAPAN LOGAM Cd, Fe DAN Zn DENGAN ADSORBEN CANGKANG TELUR BEBEK YANG TELAH DIAKTIVASI
yang dibuat untuk melengkapi sebagian persyaratan menjadi Sarjana Teknik pada Departemen Teknik Kimia Fakultas Teknik Universitas Sumatera Utara, sejauh yang saya ketahui bukan merupakan tiruan atau duplikasi dari skripsi yang sudah dipublikasikan dan atau pernah dipakai untuk mendapatkan gelar kesarjanaan di lingkungan Universitas Sumatera Utara maupun di Perguruan Tinggi atau instansi manapun, kecuali bagian yang sumber informasinya dicantumkan sebagaimana
mestinya.
Medan, 21 Agustus 2013
PRAKATA
Puji dan syukur penulis panjatkan kehadirat Allah SWT atas limpahan rahmat dan karunia-Nya sehingga skripsi ini dapat diselesaikan. Tulisan ini merupakan skripsi dengan judul “Penjerapan Logam Cd, Fe dan Zn dengan Adsorben Cangkang Telur Bebek yang Telah Diaktivasi”, berdasarkan hasil penelitian yang penulis lakukan di Departemen Teknik Kimia Fakultas Teknik Universitas Sumatera Utara. Skripsi ini merupakan salah satu syarat untuk mendapatkan gelar sarjana teknik.
Hasil penelitian ini dapat membantu pengolahan limbah logam berat sehingga tidak akan membahayakan kehidupan masyarakat. Selain itu penelitian ini pernah dipublikasikan dalam jurnal Teknik Kimia USU yang berjudul “Penjerapan Logam Kadmium (Cd2+
) dengan Adsorben Cangkang Telur Bebek Yang Telah Diaktivasi”. Penelitian ini juga di-accepted di prosiding Asean 2013++: Moving Forward dengan judul “Adsorption of Heavy Metal Iron Fe(III) Using Activated Powdered Duck Eggshell Adsorbent” di Chiang Mai, Thailand.
Selama melakukan penelitian sampai penulisan skripsi ini penulis banyak mendapat bantuan dari berbagai pihak, untuk itu penulis mengucapkan terima kasih dan penghargaan yang sebesar – besarnya kepada Dr. Ir. Iriany, M.Si.
selaku Pembimbing, Prof. Dr. Ir. Rosdanelli Hasibuan, MT. selaku dosen penguji I dan Dr. Eng. Ir. Irvan, M.Si selaku dosen penguji II.
Penulis menyadari bahwa skripsi ini masih jauh dari sempurna oleh karena itu penulis mengharapkan saran dan masukan demi kesempurnaan skripsi ini. Semoga skripsi ini memberikan manfaat bagi pengembangan ilmu pengetahuan.
Medan, Agustus 2013
DEDIKASI
Penulis mendedikasikan skripsi ini kepada:
1. Bapak Hartono Wijaya dan Ibu Lili sebagai orang tua dari penulis yang telah banyak membantu penulis dalam menyelesaikan penelitian dan penulisan skripsi ini.
2. Keluarga yang telah membantu penulis dalam menyelesaikan penelitian dan penulisan skripsi ini.
3. Teman Sejawat terutama stambuk 2009 yang telah membantu penulis dalam menyelesaikan penelitian dan penulisan skripsi ini.
4. Jasinda sebagai partner penelitian yang telah bekerja sama dengan penulis dalam menyelesaikan penelitian.
5. Mimi Richell Gunawan, Syervy Tanata, Elmer Surya, Ida Ayuningrum, Ahmad Rozi Tanjung, Tommy Arisa Putra dan Michael yang telah banyak membantu penulis dalam menyelesaikan penelitian dan penulisan skripsi ini.
6. Staf Pengajar Jurusan Teknik Departemen Teknik Kimia Universitas
RIWAYAT HIDUP PENULIS
Nama: Krisnawati NIM: 090405023
Tempat / Tanggal Lahir: Medan / 06 Juli 1991 Nama Orang Tua: Hartono Wijaya
Alamat Orang Tua: Jl. Kapten Jumhana No. 100H Medan 20216
Asal Sekolah
TK Methodist – 3 Medan tahun 1994 – 1997
SD Methodist – 3 Medan tahun 1997 – 2003
SMP Methodist – 3 Medan tahun 2003 – 2006
SMA Methodist – 3 Medan tahun 2006 – 2009 Pengalaman Organisasi / Kerja
Himatek periode 2012 – 2013 sebagai Anggota Litbang
KMB periode 2009 – 2010 sebagai Anggota Organisasi
Asisten Lab. OTK tahun 2012 – 2013 modul Absorpsi Gas dan Sedimentasi Jurnal / Karya Tulis
Dipublikasikan di Jurnal Teknik Kimia USU Edisi II No. 2
ABSTRAK
Penelitian ini bertujuan untuk mengetahui kemampuan adsorpsi dan menentukan waktu setimbang, kinetika adsorpsi, isotherm adsorpsi dan kapasitas adsorpsi dari penjerapan ion logam berat Cd (II), Fe (III) dan Zn (II) dengan adsorben cangkang telur bebek. Bahan – bahan yang digunakan antara lain adsorben cangkang telur bebek, larutan logam Cd (II), larutan logam Fe (III) dan larutan logam Zn(II), HCl dan aquabides. Variabel – variabel yang diamati antara lain waktu yang dicapai pada saat kesetimbangan dan konsentrasi sisa ion logam Cd (II), Fe (III) dan Zn (II). Adsorben dicampur ke dalam larutan logam berat. Setiap 10 menit diambil sampel larutan logam berat untuk diuji hingga diperoleh konsentrasi ion logam yang setimbang. Hasil penelitian memperlihatkan semakin banyak jumlah adsorben yang digunakan maka persentase adsorpsi akan semakin meningkat dan waktu setimbang akan lebih lama untuk dicapai. Logam berat yang berbeda akan memberikan waktu setimbang dan persentase adsorpsi yang berbeda. Kinetika adsorpsi untuk penjerapan ion logam Cd (II) mengikuti persamaan orde satu Lagergen dan Fe (III) mengikuti persamaan Bangham. Isotherm adsorpsi untuk penjerapan ion logam Cd (II) mengikuti persamaan Freundlich dan isotherm adsorpsi untuk penjerapan ion logam Fe (III) dan Zn (II) mengikuti persamaan Langmuir.
ABSTRACT
The purpose of this research is to study the ability of adsorption, equilibrium time, adsorption kinetics, adsorption isotherm and capacity adsorption of heavy metals like Cd (II), Fe (III) and Zn (II) using duck egg’s shell adsorbent. Materials that used in this research are duck egg’s shell adsorbent, heavy metals Cd (II), Fe (III) and Zn (II), HCl and aquabidest. Observed variables are the equilibrium time and residual concentration of Cd (II), Fe (III) and Zn (II). Adsorbent was mixed with heavy metal solution. The sample was being taken every 10 minutes. The concentration was analyzed with AAS in order to get the equilibrium concentration of heavy metals. The result of this research shows that if the amount of adsorbent was in great quantities then percentage adsorption will be increasing and equilibrium time will be slower to reach. Different heavy metals will give different percentage adsorption and equilibrium time. Kinetics of adsorption Cd (II) in accordance with Lagergen order one equation and Fe (III) in accordance with Bangham equation. Isotherm of adsorption Cd (II) in accordance with Freundlich equation and for Fe (III) and Zn (II) in accordance with Langmuir equation.
DAFTAR ISI
Halaman
PERNYATAAN KEASLIAN SKRIPSI i
PENGESAHAN UNTUK UJIAN SKRIPSI ii
PENGESAHAN iii
PRAKATA iv
DEDIKASI v
RIWAYAT HIDUP PENULIS vi
ABSTRAK vii
ABSTRACT viii
DAFTAR ISI ix
DAFTAR GAMBAR xi
DAFTAR TABEL xiv
DAFTAR LAMPIRAN xvi
DAFTAR SINGKATAN xvii
DAFTAR SIMBOL xviii
BAB I PENDAHULUAN 1
1.1 LATAR BELAKANG 1
1.2 PERUMUSAN MASALAH 3
1.3 TUJUAN PENELITIAN 3
1.4 MANFAAT PENELITIAN 3
1.5 RUANG LINGKUP PENELITIAN 4
BAB II TINJAUAN PUSTAKA 5
2.1 LIMBAH LOGAM Cd 5
2.2 LIMBAH LOGAM Fe 6
2.3 LIMBAH LOGAM Zn 7
2.4 PROSES PENGOLAHAN LIMBAH LOGAM
BERAT 8
2.5 ADSORPSI 10
2.6 MODEL KINETIKA ADSORPSI 13
2.8 ADSORBEN 17
2.9 PEMILIHAN JENIS – JENIS ADSORBEN 19
2.10 DESKRIPSI PROSES 19
2.11 ANALISA BIAYA 21
BAB III METODOLOGI PENELITIAN 25
3.1 LOKASI DAN WAKTU PENELITIAN 25
3.2 BAHAN 25
3.3 PERALATAN 25
3.4 PROSEDUR PENENTUAN WAKTU SETIMBANG ADSORPSI, PERSENTASE ADSORPSI, KINETIKA
ADSORPSI, ISOTHERM ADSORPSI DAN
KAPASITAS ADSORPSI
26
BAB IV HASIL DAN PEMBAHASAN 28
4.1 PENGARUH JUMLAH ADSORBEN TERHADAP
WAKTU SETIMBANG DAN PERSENTASE
ADSORPSI
28
4.2 PENENTUAN WAKTU SETIMBANG ADSORPSI
ION LOGAM Cd, Fe DAN Zn 33
4.3 PENENTUAN PERSENTASE ADSORPSI ION
LOGAM Cd, Fe DAN Zn 37
4.4 PENENTUAN KINETIKA ADSORPSI UNTUK
PENJERAPAN ION LOGAM Cd, Fe DAN Zn 38
4.5 PENENTUAN ISOTHERM ADSORPSI DAN KAPASITAS ADSORPSI DARI PENJERAPAN ION LOGAM Cd, Fe DAN Zn
44
BAB V KESIMPULAN DAN SARAN 50
5.1 KESIMPULAN 50
5.2 SARAN 50
DAFTAR PUSTAKA 52
LAMPIRAN 1 56
LAMPIRAN 2 62
DAFTAR GAMBAR
Halaman
Gambar 2.1 Proses Adsorpsi 10
Gambar 3.1 Flowchart Penentuan Waktu Setimbang Adsorpsi, Persentase Adsorpsi, Kinetika Adsorpsi, Isotherm
Adsorpsi dan Kapasitas Adsorpsi
27
Gambar 4.1 Hubungan Konsentrasi Ion Logam Cd yang Tersisa di
Filtrat terhadap Waktu dengan Variasi Jumlah Adsorben 29
Gambar 4.2 Hubungan Konsentrasi Ion Logam Fe yang Tersisa di
Filtrat terhadap Waktu dengan Variasi Jumlah Adsorben 31
Gambar 4.3 Hubungan Konsentrasi Ion Logam Zn yang Tersisa di
Filtrat terhadap Waktu dengan Variasi Jumlah Adsorben 32
Gambar 4.4 Hubungan Konsentrasi Sisa Ion Logam dalam Larutan
terhadap Waktu Adsorpsi dengan Variasi Logam Berat 33
Gambar 4.5 Hubungan Waktu Setimbang dengan Jumlah Adsorben
pada Variasi Jenis Logam Berat 34
Gambar 4.6 Hubungan Persentase Adsorpsi terhadap Waktu
Adsorpsi dengan Variasi Ion Logam 37
Gambar 4.7 Grafik Kinetika Adsorpsi Persamaan Orde Satu
Langergen untuk Penjerapan Ion Logam Cd 39 Gambar 4.8 Grafik Kinetika Adsorpsi Persamaan Bangham untuk
Penjerapan Ion Logam Fe 40
Gambar 4.9 Grafik Kinetika Adsorpsi Persamaan Orde Satu Semu
Lagergen untuk Penjerapan Ion Logam Zn 41 Gambar 4.10 Grafik Kinetika Adsorpsi Persamaan Orde Dua untuk
Penjerapan Ion Logam Zn 42
Gambar 4.11 Grafik Kinetika Adsorpsi Persamaan Difusi Intra
Partikel untuk Penjerapan Ion Logam Zn 42
Gambar 4.12 Grafik Kinetika Adsorpsi Persamaan Bangham untuk
Penjerapan Ion Logam Zn 43
Gambar 4.13 Grafik Kinetika Adsorpsi Persamaan Elovich untuk
Penjerapan Ion Logam Zn 43
Gambar 4.14 Grafik Kinetika Adsorpsi Persamaan Langmuir –
Hinshelwood untuk Penjerapan Ion Logam Zn 44
Gambar 4.15 Pola Isotherm Adsorpsi Cangkang Telur Bebek terhadap
Gambar 4.16 Kurva Isotherm Adsorpsi Freundlich Cangkang Telur
Bebek terhadap Ion Logam Cd 45
Gambar 4.17 Pola Isotherm Adsorpsi Cangkang Telur Bebek terhadap
Ion Logam Fe 46
Gambar 4.18 Kurva Isotherm Adsorpsi Langmuir Cangkang Telur
Bebek terhadap Ion Logam Fe 47
Gambar 4.19 Pola Isotherm Adsorpsi Cangkang Telur Bebek terhadap
Ion Logam Zn 49
Gambar 4.20 Kurva Isotherm Adsorpsi Langmuir Cangkang Telur
Bebek terhadap Ion Logam Zn 49
Gambar L2.1 Plot Kinetika Orde Satu Semu Lagergen untuk
Penjerapan Ion Logam Fe 63
Gambar L2.2 Plot Kinetika Orde Dua untuk Penjerapan Ion Logam Fe 65 Gambar L2.3 Plot Kinetika Difusi Intra Partikel untuk Penjerapan Ion
Logam Fe 66
Gambar L2.4 Plot Kinetika Bangham untuk Penjerapan Ion Logam Fe 67 Gambar L2.5 Plot Kinetika Elovich untuk Penjerapan Ion Logam Fe 68 Gambar L2.6 Plot Kinetika Langmuir – Hinshelwood untuk
Penjerapan Ion Logam Fe 69
Gambar L2.7 Kurva Isotherm Langmuir untuk Ion Logam Fe yang
Dijerap oleh Adsorben Cangkang Telur Bebek 70
Gambar L2.8 Kurva Isotherm Freundlich untuk Ion Logam Fe yang
Dijerap oleh Adsorben Cangkang Telur Bebek 71
Gambar L2.9 Kurva Isotherm Tempkin untuk Ion Logam Fe yang
Dijerap oleh Adsorben Cangkang Telur Bebek 72
Gambar L2.10 Kurva Isotherm DKR untuk Ion Logam Fe yang Dijerap
oleh Adsorben Cangkang Telur Bebek 74
Gambar L2.11 Kurva Isotherm BET untuk Ion Logam Fe yang Dijerap
oleh Asorben Cangkang Telur Bebek 75
Gambar L3.1 Foto Larutan Logam Berat yang Dibuat 77 Gambar L3.2 Foto Larutan Logam Berat yang Diadsorpsi dengan
Adsorben 77
Gambar L3.3 Tempat Penempatan Sampel yang akan Diuji dengan
AAS 78
Gambar L3.4 Pelarutan Logam Berat dengan Larutan HCl 78
Gambar L3.5 Peralatatan AAS yang Digunakan 79
Gambar L3.7 Pipa Penyalur Gas 80
DAFTAR TABEL
Halaman
Tabel 2.1 Sifat Fisik Logam Cd 5
Tabel 2.2 Sifat Fisik Logam Fe 6
Tabel 2.3 Sifat Fisik Logam Zn 7
Tabel 2.4 Proses Pengolahan Limbah Logam Berat 9
Tabel 2.5 Jenis – Jenis Adsorben 20
Tabel 4.1 Persentase Adsorpsi yang Diperoleh dari Penjerapan Ion
Logam Cd 29
Tabel 4.2 Persentase Adsorpsi yang Diperoleh dari Penjerapan Ion
Logam Fe 31
Tabel 4.3 Persentase Adsorpsi yang Diperoleh dari Penjerapan ion
Logam Zn 32
Tabel 4.4 Waktu Setimbang yang Diperoleh dari Penjerapan Ion
Logam Fe, Zn dan Cd 34
Tabel 4.5 Persentase Adsorpsi yang Diperoleh dari Penjerapan Ion
Logam Fe, Zn dan Cd 37
Tabel 4.6 Persamaan dan R2 dari Beberapa Persamaan Kinetika
pada Penjerapan Ion Logam Cd 39
Tabel 4.7 Persamaan dan R2 dari Beberapa Persamaan Kinetika
pada Penjerapan Ion Logam Fe 40
Tabel 4.8 Persamaan dan R2 dari Beberapa Persamaan Kinetika
pada Penjerapan Ion Logam Zn 42
Tabel 4.9 Persamaan dan R2 dari Beberapa Jenis Isotherm
Adsorpsi pada Penjerapan Ion Logam Cd 45
Tabel 4.10 Persamaan dan R2 dari Beberapa Jenis Isotherm
Adsorpsi pada Penjerapan Ion Logam Fe 47
Tabel 4.11 Persamaan dan R2 dari Beberapa Jenis Isotherm
Adsorpsi pada Penjerapan Ion Logam Zn 48
DAFTAR LAMPIRAN
Halaman
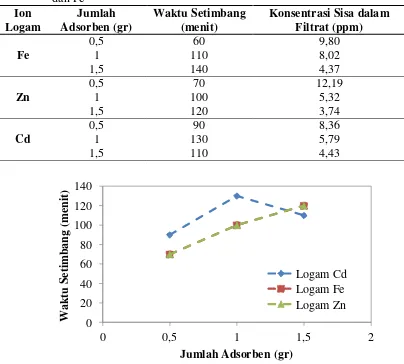
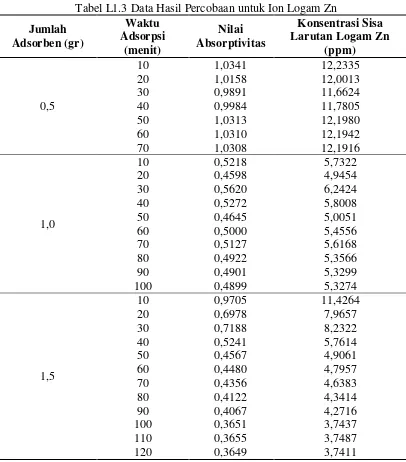
Lampiran 1 Data Hasil Percobaan 56
1.1 Data Hasil Percobaan 56
1.1.1 Data Hasil Percobaan Untuk Ion Logam Cd 56 1.1.2 Data Hasil Percobaan Untuk Ion Logam Fe 57 1.1.3 Data Hasil Percobaan Untuk Ion Logam Zn 58
1.2 Data Hasil Perhitungan 59
1.2.1 Data Hasil Perhitungan Untuk Ion Logam Cd 59 1.2.2 Data Hasil Perhitungan Untuk Ion Logam Fe 60 1.2.3 Data Hasil Perhitungan Untuk Ion Logam Zn 61
Lampiran 2 Contoh Hasil Perhitungan 62
2.1 Perhitungan Banyak Ion Logam yang Dijerap 62
2.2 Perhitungan Persentase Adsorpsi 62
2.3 Perhitungan Kinetika Adsorpsi 63
2.4 Perhitungan Isotherm Adsorpsi 70
Lampiran 3 Foto Hasil Percobaan 77
3.1 Foto Percobaan Adsorpsi Logam Berat 77
DAFTAR SINGKATAN
WHO World Health Organization
AAS Atomic Absorption Spectrophotometer
DKR Dubinin – Kaganer – Radushkevich pH power of Hydrogen
DAFTAR SIMBOL
Simbol Keterangan Dimensi
Cd Kadmium
Fe Besi / Ferum Zn Seng / Zinkum
Al Aluminium
CaCO3 Kalsit
Pb Timbal
KMnO4 Kalium Permanganat
ZnS Zinkum Sulfida HCl Asam Klorida
Cu Tembaga
Ca(OH)2 Kapur / Kalsium Hidroksida
Na2CO3 Soda Abu / Natrium Karbonat
NaOH Soda Api / Natrium Hidroksida CN- Sianida
Cl- Klorida
Ca Kalsium
R2 Koefisien korelasi Wads Berat yang terjerap
qeq Jumlah adsorbat yang terjerap per berat adsorben pada
kesetimbangan mg/gr
qt Jumlah adsorbat yang terjerap per berat adsorben pada
t menit mg/gr
k1 Konstanta kecepatan adsorpsi orde satu Lagergen L/min
k Konstanta kecepatan adsorpsi orde dua gr/mmol.min
ki Konstanta laju difusi intra partikel
t Waktu min
dq Perubahan jumlah adsorbat yang terjerap per berat
adsorben mg/gr
C Konsentrasi adsorbat yang tersisa dalam
kesetimbangan mg/L
Co Konsentrasi awal adsorbat dalam larutan mg/L
V Volume larutan ml
m Berat adsorben gr
km Konstanta persamaan Bangham
ɑ Laju adsorpsi awal mg/gr.min
ß Konstanta yang berhubungan dengan luas permukaan
yang tetutup dan energi aktivasi mg/gr
Ct Konsentrasi ion logam yang tersisa setelah adsorpsi
selama waktu t mg/L
ko Konstanta kesetimbangan di persamaan Langmuir –
Hinshelwood
k1` Konstanta laju adsorpsi di persamaan Langmuir –
Hinshelwood
Ce Konsentrasi adsorbat pada kesetimbangan pada fasa
cair mg/L
qm Kapasitas adsorpsi optimum mg/g
bqm Konstanta kesetimbangan isotherm Langmuir
Kt Konstanta kesetimbangan isotherm Tempkin L/mol
B1 Konstanta dalam isotherm Tempkin
R Konstanta gas kJ/kmol.K
T Temperatur K
b Konstanta proses adsorpsi isotherm Tempkin
x Banyaknya adsorbat yang terjerap mg
k2 Konstanta adsorpsi untuk isotherm Freundlich
n Konstanta adsorpsi
Xm Kapasitas penjerapan maksimum mg/gr
ß Koefisien aktivasi isotherm DKR mol2/J2
ɛ Potensi Polanyi E Energi penjerapan
KB Koefisien dalam persamaan BET
h Nilai laju adsorpsi mg/gr.min
ABSTRAK
Penelitian ini bertujuan untuk mengetahui kemampuan adsorpsi dan menentukan waktu setimbang, kinetika adsorpsi, isotherm adsorpsi dan kapasitas adsorpsi dari penjerapan ion logam berat Cd (II), Fe (III) dan Zn (II) dengan adsorben cangkang telur bebek. Bahan – bahan yang digunakan antara lain adsorben cangkang telur bebek, larutan logam Cd (II), larutan logam Fe (III) dan larutan logam Zn(II), HCl dan aquabides. Variabel – variabel yang diamati antara lain waktu yang dicapai pada saat kesetimbangan dan konsentrasi sisa ion logam Cd (II), Fe (III) dan Zn (II). Adsorben dicampur ke dalam larutan logam berat. Setiap 10 menit diambil sampel larutan logam berat untuk diuji hingga diperoleh konsentrasi ion logam yang setimbang. Hasil penelitian memperlihatkan semakin banyak jumlah adsorben yang digunakan maka persentase adsorpsi akan semakin meningkat dan waktu setimbang akan lebih lama untuk dicapai. Logam berat yang berbeda akan memberikan waktu setimbang dan persentase adsorpsi yang berbeda. Kinetika adsorpsi untuk penjerapan ion logam Cd (II) mengikuti persamaan orde satu Lagergen dan Fe (III) mengikuti persamaan Bangham. Isotherm adsorpsi untuk penjerapan ion logam Cd (II) mengikuti persamaan Freundlich dan isotherm adsorpsi untuk penjerapan ion logam Fe (III) dan Zn (II) mengikuti persamaan Langmuir.
ABSTRACT
The purpose of this research is to study the ability of adsorption, equilibrium time, adsorption kinetics, adsorption isotherm and capacity adsorption of heavy metals like Cd (II), Fe (III) and Zn (II) using duck egg’s shell adsorbent. Materials that used in this research are duck egg’s shell adsorbent, heavy metals Cd (II), Fe (III) and Zn (II), HCl and aquabidest. Observed variables are the equilibrium time and residual concentration of Cd (II), Fe (III) and Zn (II). Adsorbent was mixed with heavy metal solution. The sample was being taken every 10 minutes. The concentration was analyzed with AAS in order to get the equilibrium concentration of heavy metals. The result of this research shows that if the amount of adsorbent was in great quantities then percentage adsorption will be increasing and equilibrium time will be slower to reach. Different heavy metals will give different percentage adsorption and equilibrium time. Kinetics of adsorption Cd (II) in accordance with Lagergen order one equation and Fe (III) in accordance with Bangham equation. Isotherm of adsorption Cd (II) in accordance with Freundlich equation and for Fe (III) and Zn (II) in accordance with Langmuir equation.
BAB I
PENDAHULUAN
1.1 LATAR BELAKANG
Air merupakan kebutuhan dasar dari kehidupan karena peranan air yang begitu kompleks bagi makhluk hidup dan lingkungannya. Ketersediaan air di alam dibutuhkan dari segi kualitas dan kuantitasnya. Akan tetapi seiring dengan berkembangnya IPTEK, memacu terjadinya pencemaran baik pencemaran air, udara maupun tanah. Pencemaran yang terjadi selalu memberikan efek bagi makhluk hidup, terutama manusia, yaitu akan membahayakan kesehatan manusia. Pencemaran ini bisa disebabkan oleh limbah yang dibuang oleh industri.
Limbah yang paling banyak mendapatkan perhatian adalah limbah logam-logam berat, karena memiliki toksisitas yang tinggi. Logam – logam berat yang ada seperti Cd, Fe dan Zn.
Potensi berbahaya yang paling tinggi untuk logam Cd terdapat diantara berbagai industri seperti dalam industri elektroplating, mesin metal, plastik, keramik, cat dan pengelasan. Bahaya utama dari logam ini dapat disebabkan
melalui pernafasan dari debu dan kabut serta ketidaksengajaan debu yang terikut pada tangan, makanan atau rokok. Menurut Peraturan Pemerintah Nomor 82
Tahun 2001 tentang Pengolahan Kualitas Air dan Pengendalian Pencemaran Air, konsentrasi Cd (II) yang aman untuk air minum manusia tidak lebih dari 1 ppm [1].
Senyawa Fe banyak ditemukan di industri pencucian batu bara dan industri lain yang menggunakan bahan bakar yang berupa batu bara. Konsentrasi Fe (III) yang dianggap tidak berbahaya dalam limbah cair yang dibuang oleh industri tercantum dalam Keputusan Menteri Lingkungan Hidup Nomor 113 Tahun 2003 adalah 7 mg/L [2].
Senyawa Cd dan Zn merupakan hasil industri elektroplating dan senyawa Fe merupakan hasil dari pencucian batu bara dan industri yang menggunakan batu bara. Hasil dari kedua industri ini merupakan limbah B3. Pada tahun 2008, jumlah
limbah B3 yang dihasilkan sebanyak 402 juta ton. Sementara pada tahun 2009,
jumlah limbah B3 yang dihasilkan naik menjadi 438 juta ton [5]. Dengan adanya
kenaikan jumlah limbah B3 maka perlu ditemukan cara untuk mengolah limbah B3
tersebut agar tidak membahayakan lingkungan.
Cangkang telur memiliki sifat-sifat adsorpsi yang baik, seperti struktur pori, CaCO3 dan protein asam mukopolisakarida yang dapat dikembangkan menjadi
adsorben. Para peneliti sebelumnya meneliti bahwa kalsit yang ada pada cangkang telur bebek dapat digunakan sebagai adsorben untuk mengadsorpsi logam – logam berat [6].
Sumber bahan baku (cangkang telur) tersedia cukup banyak dan pada saat
ini belum dimanfaatkan. Oleh karena itu, pemanfaatan cangkang telur sebagai adsorben merupakan usaha yang cukup relevan untuk meningkatkan nilai
ekonomi cangkang telur dan mengurangi beban lingkungan. Sebagai referensi jumlah cangkang telur bebek di Indonesia, pada tahun 2009 produksi telur bebek sebesar 1.071,398 ton. Jika rata – rata berat telur bebek 60 gram maka kulit telur bebek yang dihasilkan dalam setahun adalah 107.139 ton. Berat ini setara dengan 100.710,66 ton kalsium karbonat, 4.285,56 ton magnesium karbonat dan 1.339,25 ton kalsium fosfat [7].
1.3000C selama 4 jam. Adsorben cangkang telur ayam dan bebek yang dihasilkan oleh Pongtonglor [10] merupakan adsorben yang baik jika digunakan dalam proses penjerapan limbah dalam industri.
Dengan memperhatikan beberapa hal diatas, kesesuaian logam berat seperti Cd (II), Fe (III) dan Zn (II) yang diadsorpsi oleh adsorben cangkang telur yang telah diaktivasi perlu diteliti. Oleh karena itu, perlu dilakukan penelitian mengenai adsorpsi logam Cd (II), Fe (III) dan Zn (II) dengan cangkang telur bebek yang telah diaktivasi secara termal yaitu pada suhu 6000C.
1.2 PERUMUSAN MASALAH
Dalam penelitian ini yang menjadi rumusan masalah adalah kesesuaian dari adsorben cangkang telur bebek dalam penjerapan logam berat seperti Cd (II), Fe (III) dan Zn (II). Selain itu, beberapa hal yang perlu diperhatikan dalam
penentuan waktu setimbang, persentase adsorpsi, kinetika adsorpsi, isotherm
adsorpsi serta kapasitas adsorpsi pada proses adsorpsi.
1.3 TUJUAN PENELITIAN
Tujuan dilakukan penelitian ini yaitu sebagai berikut:
1. Untuk mengetahui kemampuan adsorben cangkang telur bebek dalam menjerap logam berat Cd (II), Fe (III) dan Zn (II).
2. Untuk menentukan waktu setimbang, persentase adsorpsi dan kinetika adsorpsi dari penjerapan logam Cd (II), Fe (III) dan Zn (II).
3. Untuk menentukan isotherm adsorpsi dan kapasitas adsorpsi dari penjerapan logam Cd (II), Fe (III) dan Zn (II).
1.4 MANFAAT PENELITIAN
1.5 RUANG LINGKUP PENELITIAN
Penelitian ini dilakukan di Laboratorium Kimia Analisa dan Laboratorium Operasi Teknik Kimia, Departemen Teknik Kimia, Fakultas Teknik, Universitas Sumatera Utara, Medan serta Laboratorium Penelitian, Fakultas Farmasi, Universitas Sumatera Utara, Medan.
Penelitian ini memiliki ruang lingkup dan batasan sebagai berikut:
1. Sampel yang digunakan adalah adsorben cangkang telur bebek yang telah diaktivasi pada suhu 1100C, 6000C dan 8000C.
2. Proses yang digunakan dalam penelitian ini adalah adsorpsi.
3. Variabel penelitian adalah jumlah adsorben, waktu pencampuran dan jenis logam berat adalah sebagai berikut:
Jumlah adsorben yang digunakan memiliki rasio sebesar
0,5 gram/1000 ml larutan logam berat; 1 gram/1000 ml larutan logam berat dan 1,5 gram/1000 ml larutan logam berat.
Interval waktu pencampuran dengan magnetic stirrer dengan selang waktu 10 menit sampai mencapai waktu setimbang.
Logam berat yang digunakan adalah Cd (II), Fe (III) dan Zn (II).
BAB II
TINJAUAN PUSTAKA
2.1 LIMBAH LOGAM Cd
Logam Cd memiliki karakteristik berwarna putih keperakan seperti logam Al, tahan panas, tahan terhadap korosi dan berstruktur kristal heksagonal. Logam Cd digunakan untuk elektrolisis, bahan pigmen untuk industri cat, enamel dan plastik. Logam Cd biasanya selalu dalam bentuk campuran dengan logam lain terutama dalam pertambangan timah hitam dan Zn [11]. Sifat – sifat fisik logam Cd ditampilkan pada tabel 2.1.
Tabel 2.1 Sifat Fisik Logam Cd [12]
Sifat- Sifat Fisika
Nama Kadmium
Simbol Cd
Nomor atom 40
Massa Atom Relatif 112,4
Titik Didih 7670C
Titik Leleh 3210C
Ion logam berat masuk ke dalam jaringan tubuh makhluk hidup melalui beberapa cara seperti pernafasan, pencernaan dan penetrasi melalui kulit. Di dalam tubuh hewan logam diabsorpsi darah, berkaitan dengan protein darah yang kemudian didistribusikan ke seluruh jaringan tubuh [11].
Ion logam Cd akan mengalami proses biotransformasi dan bioakumulasi dalam organisme hidup (tumbuhan, hewan dan manusia). Dalam tubuh biota
perairan jumlah ion logam yang terakumulasi akan terus mengalami peningkatan (biomagnifikasi) dan dalam rantai makanan biota yang tertinggi akan mengalami akumulasi ion logam Cd yang lebih banyak [12].
interaksi antara ion logam Cd dan protein tersebut, sehingga menimbulkan hambatan terhadap aktivitas kerja enzim dalam tubuh [11].
Ion logam Cd merupakan salah satu jenis ion logam berat yang berbahaya karena elemen ini berisiko tinggi terhadap pembuluh darah. Ion logam Cd berpengaruh terhadap manusia dalam jangka waktu panjang dan dapat terakumulasi pada tubuh khususnya hati dan ginjal. Menurut Peraturan Pemerintah Nomor 82 Tahun 2001 tentang Pengolahan Kualitas Air dan Pengendalian Pencemaran Air, konsentrasi Cd (II) yang aman untuk air minum manusia tidak lebih dari 1 ppm [12].
2.2 LIMBAH LOGAM Fe
Logam Fe berasal dari bijih besi (tambang) yang banyak digunakan untuk kehidupan manusia sehari – hari dari yang bermanfaat sampai dengan yang
merusak. Logam Fe adalah logam yang paling banyak dan paling beragam penggunaannya. Hal itu disebabkan beberapa hal, diantaranya adalah karena
kelimpahan Fe di kulit bumi cukup besar, pengolahannya relatif mudah dan murah, serta Fe mempunyai sifat – sifat yang menguntungkan dan mudah dimodifikasi. Logam Fe berstruktur kristal body – centre cubic [13]. Sifat – sifat fisik logam Fe ditampilkan pada tabel 2.2.
Tabel 2.2 Sifat Fisik Logam Fe [13]
Sifat- Sifat Fisika
Nama Besi
Simbol Fe
Nomor atom 26
Massa Atom Relatif 55,847 Titik Didih 2.8620C Titik Leleh 1.5380C
Dalam proses pencucian industri batubara, volume dan kapasitas yang sangat besar berpotensi menghasilkan limbah dalam volume yang banyak pula. Limbah cair ini banyak mengandung senyawa Fe. Untuk itu dilakukan tindakan pengolahan limbah sebelum dibuang ke lingkungan sesuai dengan Keputusan Menteri Lingkungan Hidup Nomor 113 Tahun 2003. Berdasarkan keputusan Menteri Lingkungan Hidup Nomor 113 Tahun 2003 tentang Baku Mutu Air Limbah bagi Usaha dan atau Kegiatan Pertambangan Batubara bahwa kandungan total Fe di dalam limbah cair dibatasi yaitu 7 mg/L [2].
2.3 LIMBAH LOGAM Zn
Logam Zn adalah logam yang putih – kebiruan, berkilau dan bersifat diamagnetik. Logam ini cukup mudah ditempa dan liat pada temperatur 1000C – 1500C. Logam Zn sedikit kurang padat daripada Fe dan berstruktur kristal
heksagonal. Logam ini keras dan rapuh pada kebanyakan temperatur. Pada umumnya, Zn berada di alam dalam bentuk persenyawaan sulfida yaitu ZnS [14].
Sifat – sifat fisik logam Zn ditampilkan pada tabel 2.3.
Tabel 2.3 Sifat Fisik Logam Zn [13]
Sifat- Sifat Fisika
Nama Seng / Zinkum
Simbol Zn
Nomor atom 30
Massa Atom Relatif 65,38
Titik Didih 9060C
Titik Leleh 4100C
alami utama Zn adalah calamite (ZnO), sphalerite (ZnS), smithsonite (ZnCO3),
dan wilemite (Zn2SiO4) [3].
Logam Zn ditemukan pada industri besi, baja, elektroplating, cat, karet, tekstil, kertas, bubur kertas, galvanisasi, saluran pembuangan pertambangan asam, bijih dan pengolahan air kota. Limbah logam Zn tidak bersifat biodegradable
serta memenuhi rantai makanan melalui bioakumulasi [3].
Logam Zn termasuk unsur yang essensial bagi makhluk hidup, yakni berfungsi membantu kerja enzim. Logam Zn juga diperlukan dalam proses fotosintesis sebagai agen bagi transfer hidrogen dan berperan dalam pembentukan protein [20]. Untuk mencegah dampak negatif dari logam berat Zn terhadap kesehatan manusia maka WHO menyatakan jumlah Zn (II) yang aman dalam air minum sebesar 5 mg/L [4].
2.4 PROSES PENGOLAHAN LIMBAH LOGAM BERAT
Limbah logam berat umumnya bersumber dari industri elekroplating dan
industri yang menggunakan batu bara. Elektroplating merupakan suatu proses elektrokimia terhadap perlakuan permukaan suatu logam. Logam – logam yang biasa digunakan untuk pelapis yaitu kadmium, tembaga, zinkum, emas, nikel, perak dan logam – logam sejenisnya. Proses ini melibatkan perlakuan pendahuluan (pencucian, pembersihan dan langkah – langkah persiapan lain), pelapisan, pembilasan dan pengeringan [15]. Industri yang menggunakan batubara seperti industri tekstil, kertas, sepatu, minyak sawit, karet, dan lain – lain. Beberapa industri ini beralih dari penggunaan minyak ke batubara. Limbah yang dihasilkan cukup berbahaya jika dibuang langsung ke badan air penerima seperti sungai, danau dan laut [16]. Air yang mengandung berbagai jenis ion logam berat dapat dilakukan pengolahan dengan berbagai proses (cara) yang dapat dilihat pada tabel 2.4.
Tabel 2.4 Proses Pengolahan Limbah Logam Berat
Proses / Cara Kelebihan Kekurangan
Presipitasi Proses ini mudah untuk dilaksanakan karena hanya perlu mengetahui sifat koagulasi limbah logam berat [17].
Pada proses ini terjadi reaksi lebih lanjut akibat penambahan materi sebagai presipitan. Dengan adanya penambahan ini maka limbah logam berat akan semakin tercemar [17].
Pertukaran Ion Proses ini dapat menghasilkan bahan kimia baru yang dapat dimanfaatkan dari proses regenerasi resin dengan bahan kimia. Persentase penyisihan logam dengan proses ini lebih besar (> 95%) [17].
Jenis dan jumlah resin yang digunakan harus ditentukan secara tepat terlebih dahulu. Selain itu, resin yang digunakan memiliki harga yang mahal [17].
Koagulasi Penambahan zat aditif dalam proses ini dapat memperbanyak agregat sehingga akan lebih mudah untuk dipisahkan secara fisik [17].
Pada proses ini memerlukan wadah yang luas dan supply
pengkoagulasian secara kontinu [17].
Adsorpsi Untuk konsentrasi ion yang rendah dalam limbah juga dapat digunakan proses adsorpsi dengan karbon aktif. Karbon aktif yang digunakan dalam proses penjerapan dapat diregenerasi [18].
Adsorben karbon aktif yang digunakan memiliki harga yang relatif mahal [18].
Elektrolisis Proses ini termasuk ke dalam proses yang sederhana dan efisien dimana proses ini berdasarkan pada pembentukan koagulan melalui elektro – oksidasi anoda aluminium dan katoda hidrogen sehingga polutan dapat dihilangkan melalui flotasi [17].
Dengan pemakaian gas hidrogen dalam proses elektrolisis mengakibatkan biaya dalam proses pengolahan limbah logam berat menjadi lebih mahal [17].
Ultrafiltrasi Proses ini menggunakan ukuran pori membran berkisar antara 0,05 µm hingga 1 nm. Semua garam terlarut dan molekul yang lebih kecil dari ukuran tersebut akan melewati membran, sedangkan koloid, protein, kontaminan mikrobiologi, molekul organik yang berukuran besar akan tertahan [15].
menjadi murah. Selain itu, proses adsorpsi lebih mudah untuk diterapkan dalam industri.
2.5 ADSORPSI
Adsorpsi adalah proses pemisahan dimana komponen tertentu dari suatu fasa fluida berpindah ke permukaan zat padat yang menjerap (adsorben). Biasanya partikel-partikel kecil, zat penjerap ditempatkan dalam suatu hamparan tetap kemudian fluida dialirkan melalui hamparan tersebut sampai zat padat itu mendekati jenuh dan proses pemisahan yang dikehendaki tidak dapat berlangsung lagi.
Adsorpsi biasanya dapat dijelaskan dari tegangan permukaan suatu zat padat. Molekul-molekul yang ada dalam zat padat mendapat gaya-gaya yang tidak sama sehingga untuk mengimbangi gaya-gaya bagian dalam maka
molekul-molekul, biasanya gas atau cairan, menjadi tertarik ke permukaan. Gaya ini relatif rendah dan disebut gaya Van der Waals.
[image:33.595.134.496.470.723.2]Dalam peristiwa adsorpsi, zat-zat yang tertarik pada permukaan zat padat disebut dengan adsorbat, sedangkan adsorben adalah suatu adsorber dalam suatu peristiwa adsorpsi [19]. Gambar 2.1 adalah sketsa proses adsorpsi yang terjadi.
Gambar 2.1 Proses Adsorpsi [20]
Adsorben Fasa Padat
Heterogen Homogen
Adsorpsi Desorpsi Fasa Cair
Proses adsorpsi terjadi pada permukaan pori-pori dalam adsorben. Untuk bisa teradsorpsi, logam dalam cairan mengalami berbagai proses [21]. Secara umum, proses adsorpsi berlangsung dalam tiga tahapan yaitu [22]:
1. Transfer adsorbat dari larutan ke permukaan adsorben yang mana ini sering disebut sebagai difusi.
2. Migrasi adsorbat ke dalam pori (untuk ion Fe memiliki radius ion sebesar 0,064 nm).
3. Interaksi ion dengan sisi yang tersedia pada permukaan pori.
Proses adsorpsi melibatkan kontak antara ion logam dengan pori – pori adsorben. Oleh karena itu, ada berbagai faktor yang mempengaruhi proses adsorpsi yaitu sebagai berikut:
1. Jenis adsorbat
a) Ukuran molekul adsorbat
Ukuran molekul yang sesuai merupakan hal penting agar proses adsorpsi dapat terjadi. Hal ini disebabkan molekul-molekul yang
dapat diadsorpsi adalah molekul-molekul yang diameternya lebih kecil atau sama dengan diameter pori adsorben [23]. b) Kepolaran zat
Apabila berdiameter sama, molekul-molekul polar lebih kuat diadsorpsi daripada molekul-molekul tidak polar. Molekul-molekul yang lebih polar dapat menggantikan Molekul-molekul-Molekul-molekul yang kurang polar yang terlebih dahulu teradsorpsi [23].
2. Karakteristik adsorben a) Kemurnian adsorben
Sebagai zat untuk mengadsorpsi, maka adsorben yang lebih murni lebih diinginkan karena kemampuan adsorpsi lebih baik [23].
b) Luas permukaan dan volume pori adsorben
3. Tekanan (P)
Tekanan yang dimaksud adalah tekanan adsorbat. Kenaikan tekanan adsorbat dapat menaikkan jumlah yang diadsorpsi [23].
4. Temperatur absolut (T)
Temperatur yang dimaksud adalah temperatur adsorbat. Pada saat molekul-molekul gas atau adsorbat melekat pada permukaan adsorben akan terjadi pembebasan sejumlah energi yang dinamakan peristiwa eksotermis. Berkurangnya temperatur akan menambah jumlah adsorbat yang teradsorpsi demikian juga untuk peristiwa sebaliknya [23].
5. Interaksi potensial (E)
Interaksi potensial antara adsorbat dengan dinding adsorben sangat bervariasi tergantung dari sifat adsorbat dan adsorben [23].
Dalam proses adsorpsi secara umum, terdapat dua jenis proses adsorpsi
yaitu:
1. Proses Adsorpsi Kimia (Chemisorption)
Chemisorption adalah adsorpsi kimia yang mana adsorpsi disebabkan oleh formasi ikatan kimia antara permukaan padatan (adsorben) dan ion logam berat (adsorbat). Jadi energi dari
2. Proses Adsorpsi Fisika (Physisorption)
Physisorption adalah proses adsorpsi fisika yang melibatkan gaya intermolekuler (gaya Van der Walls) yang mana tidak melibatkan perubahan yang terlalu besar dalam pola orbital elektron dari zat. Interaksi energi diantara adsorbat dan adsorben memiliki energi magnitudo yang sama. Jadi proses adsorpsi fisika tidak diperlukan energi aktivasi. Dalam hal ini, temperatur yang rendah diinginkan untuk adsorpsi fisika. Adsorpsi fisika secara umum bersifat reversibel, dengan menurun dalam konsentrasi bahan yang diadsorpsi dengan jumlah yang sama dengan yang diadsorpsi [22].
2.6 MODEL KINETIKA ADSORPSI
Model kinetika adsorpsi yang diperoleh digunakan untuk memeriksa
kinetika adsorpsi dari logam berat dan untuk mengetahui skala kuantitas yang dijerap pada proses adsorpsi [24]. Adapun model kinetika adsorpsi adalah sebagai
berikut:
1. Persamaan kecepatan reaksi orde satu semu Lagergen [19]
Persamaan kecepatan reaksi orde satu semu Lagergen pernah digunakan dalam penjerapan logam Cd dan Zn dengan adsorben (abu sekam padi yang diaktifkan).Persamaan umum ditunjukkan pada persamaan 2.1.
d
dt = k1 (qeq– qt) (2.1)
Setelah dilakukan intergrasi dengan kondisi batas, untuk t = 0, q = 0, bentuknya ditunjukkan pada persamaan 2.2.
log (qeq– q) = log (qeq) –
k1
2,303 t (2.2)
2. Persamaan kecepatan orde dua [19] [1]
d
dt = k (qeq– q)2 (2.3)
Pengintegrasian persamaan ini dengan kondisi batas t = 0, q = 0 dapat dilihat dalam persamaan 2.4.
t = 1
k e + t
e (2.4)
Intersep dari linearisasi persamaan kecepatan orde dua adalah konstanta kecepatan orde dua.
3. Difusi intra partikel [24] [21]
Difusi Intra Partikel digunakan dalam proses adsorpsi secara umum. Studi difusi intra partikel yang digunakan mengikuti persamaan yang dinyatakan dengan persamaan 2.5.
qt = ki . t0,5 + C (2.5)
Sebuah plot qt versus t0,5 akan didapatkan garis lurus dengan slope ki dan
intersep C ketika mekanisme adsorpsi mengikuti proses difusi intra partikel.
4. Persamaan Bangham [25]
Persamaan Bangham dapat digunakan untuk mewakili proses penjerapan secara umum. Persamaan Bangham digunakan untuk mempelajari tahap
waktu terjadinya sistem adsorpsi dan persamaannya digambarkan dengan persamaan 2.6 pada ɑ (<1) dan ko adalah tetap dan konstan:
log log[CCo
o- tm] = log [
km
2,303 ] + ɑ log t (2.6)
5. Persamaan Elovich [21]
Persamaan Elovich berasumsi bahwa permukaan padat sesungguhnya adalah sepenuhnya heterogen. Persamaan Elovich digunakan untuk proses penjerapan secara umum. Persamaan Elovich dapat dinyatakan dengan persamaan 2.7.
d t dt = ɑe
Integrasi persamaan 2.7 dan penggunaan kondisi awal qt = 0 dan pada
t = 0 dan qt = qt akan diperoleh model Elovich yang dapat ditunjukkan
dengan persamaan 2.8.
qt = 1
ln (ɑ ) + 1 ln t (2.8)
6. Persamaan Langmuir – Hinshelwood [26]
Persamaan Langmuir – Hinshelwood digunakan untuk mewakili penjerapan secara umum. Persamaan model kinetika Langmuir –
Hinshelwood dapat diekspresikan seperti pada persamaan 2.9. Konstanta laju adsorpsi dapat ditentukan dari nilai slope kurva linear
ln (CoCt)
Co- Ct
versus
t Co- Ct
.
ln (CoCt)
Co- Ct + ko =
k1t
Co- Ct
(2.9)
2.7 ADSORPSI ISOTHERMAL
Adsorpsi isothermal merupakan adsorpsi yang terjadi pada kondisi temperatur konstan. Adsorpsi yang terjadi harus dalam keadaan kesetimbangan, yaitu laju desorpsi dan adsorpsi berlangsung relatif sama. Kesetimbangan adsorpsi biasanya digambarkan dengan persamaan isotherm. Parameternya menunjukkan sifat permukaan dan afinitas dari adsorben pada kondisi temperatur dan pH tetap. Beberapa penelitian telah dilakukan untuk menyelidiki isotherm adsorpsi ion logam berat dan hubungannya terhadap pH, jumlah adsorben, konsentrasi ion sekutu, waktu kontak dan temperatur [18].
Terdapat beberapa jenis persamaan isotherm adsorpsi yang sering digunakan secara luas, yaitu:
1. Isotherm Langmuir
Isotherm ini berdasarkan asumsi bahwa [27] [28]:
a) Adsorben mempunyai permukaan yang homogen dan hanya dapat mengadsorpsi satu molekul adsorbat untuk setiap molekul
c) Hanya terbentuk satu lapisan tunggal saat adsorpsi maksimum. d) Tiap atom teradsorpsi pada lokasi tertentu di permukaan adsorben. e) Tiap bagian permukaan hanya dapat menampung satu molekul
atau atom.
Adapun persamaan isotherm Langmuir ditunjukan dalam persamaan 2.10 [18]:
Ce e =
1 b m + (
1
m) Ce (2.10)
2. Isotherm Tempkin [25]
Model isotherm Tempkin menjelaskan tentang interaksi antara adsorben dengan adsorbatnya. Parameter Tempkin ditentukan dengan persamaan 2.11.
qt =
T
b ln (KtCe) (2.11)
Model linearnya ditunjukkan dengan persamaan 2.12.
qe = B1ln Kt + B1ln Ce (2.12)
Koefisien dari B1 ditunjukkan dengan persamaan 2.13.
B1 =
T
b
(2.13)
Plot dari qe versus ln Ce yang digunakan untuk menentukan konstanta
isotherm Tempkin, Kt dan B1.
3. Isotherm Freundlich [27]
Untuk rentang konsentrasi yang kecil dan campuran yang cair, isotherm
adsorpsi dapat digambarkan dengan persamaan empirik yang dikemukakan oleh Freundlich. Isotherm Freundlich berdasarkan asumsi bahwa adsorben mempunyai permukaan yang heterogen dan tiap molekul mempunyai potensi penjerapan yang berbeda-beda. Persamaan ini merupakan persamaan yang paling banyak digunakan saat ini. Persamaannya ditunjukkan dalam persamaan 2.14.
Dari persamaan tersebut, jika konsentrasi larutan dalam kesetimbangan diplot sebagai ordinat dan konsentrasi adsorbat dalam adsorben sebagai absis pada koordinat logaritmik, akan diperoleh gradien n dan intersep k. Dari isotherm Freundlich akan diketahui kapasitas adsorben dalam menjerap air. Isotherm Freundlich digunakan dalam penelitian yang dilakukan karena dengan isotherm Freundlich dapat ditentukan efisiensi dari suatu adsorben.
4. Isotherm DKR [22]
Isotherm DKR dilaporkan lebih umum daripada isotherm Langmuir dan Freundlich. Model DKR memiliki bentuk linear seperti yang ditunjukkan pada persamaan 2.15.
ln qe = ln Xm - ßɛ2 (2.15)
Dimana:
ɛ = RT ln(1 + 1
Ce) (2.16)
Slope dari grafik ln qe versus ɛ2 memberikan ß (mol2/J2) dan nilai
intersep adalah kapasitas penjerapan, Xm (mg/g). Nilai dari ß dan Xm,
seperti fungsi dari temperatur dengan nilai dari R2. Ini bisa ditinjau bahwa nilai ß meningkat seiring dengan temperatur yang meningkat ketika nilai Xm menurun dengan bertambahnya temperatur.
Nilai dari energi penjerapan, E, diperoleh dari hubungan yang dinyatakan dalam persamaan 2.17.
E = (-2ß
-1
2
(2.17)
2.8 ADSORBEN
1. Luas permukaannya besar sehingga kapasitas adsorpsinya tinggi. 2. Memiliki aktifitas terhadap komponen yang diadsorpsi.
3. Memiliki daya tahan guncang yang baik.
4. Tidak ada perubahan volume yang berarti selama proses adsorpsi dan desorpsi.
Dengan beberapa karakteristik adsorben yang telah diketahui maka pada saat sekarang ini telah banyak jenis adsorben yang digunakan dalam proses adsorpsi. Macam – macam adsorben yang umum digunakan, antara lain:
1. Silika gel
Silika gel cenderung mengikat adsorbat dengan energi yang relatif lebih kecil dan membutuhkan temperatur yang rendah untuk proses desorpsinya, dibandingkan jika menggunakan adsorben lain seperti karbon aktif dan zeolit. Kemampuan desorpsi silika gel meningkat
seiring dengan meningkatnya temperatur. Silika gel terbuat dari silika dengan ikatan kimia mengandung air kurang lebih 5%. Pada umumnya
temperatur silika gel sampai pada 2000C, jika dioperasikan lebih dari batas temperatur kerjanya maka kandungan air dalam silika gel akan hilang dan menyebabkan kemampuan adsorpsinya hilang [23].
2. Karbon Aktif
Karbon aktif dapat dibuat dari batu bara, kayu dan tempurung kelapa melalui proses pyrolizing dan carburizing pada temperatur 7000C sampai 8000C. Hampir semua adsorbat dapat diserap oleh karbon aktif kecuali air. Karbon aktif dapat ditemukan dalam bentuk bubuk dan granular. Pada umumnya karbon aktif dapat mengadsorpsi metanol atau ammonia sampai dengan 30%, bahkan karbon aktif super dapat mengadsorpsi sampai dua kalinya [23].
3. Zeolit
khusus, diantaranya 4A, 5A, 10X dan 13X yang memiliki volume rongga antara 0,05 sampai 0,30 cm3/gram dan dapat dipanaskan sampai 5000C tanpa harus kehilangan kemampuan adsorpsi dan regenerasinya. Zeolit 4A (NaA) digunakan untuk mengeringkan dan memisahkan campuran
hydrocarbon. Zeolit 5A (CaA) digunakan untuk memisahkan paraffins
dan beberapa cyclic hydrocarbon. Zeolit 10X (CaX) dan 13X (NaX) memiliki diameter pori yang lebih besar sehingga dapat mengadsorpsi adsorbat pada umumnya [23].
2.9 PEMILIHAN JENIS – JENIS ADSORBEN
Berdasarkan pemilihan cara pengolahan limbah logam berat maka dipilih proses adsorpsi untuk mengolah limbah logam berat. Pada penelitian yang telah dilakukan, ditemukan berbagai macam jenis bahan pembuatan adsorben. Jenis –
jenis bahan pembuatan adsorben yang digunakan dapat dilihat pada tabel 2.5. Dari beberapa jenis bahan adsorben pada tabel 2.5 disimpulkan bahwa
adsorben dari cangkang telur merupakan adsorben yang lebih baik. Hal ini disebabkan cangkang telur merupakan limbah dapur yang banyak dibuang dari perumahan, hotel, rumah makan dan lain sebagainya. Selain itu, cangkang telur bernilai nonekonomis karena tidak memiliki manfaat bagi masyarakat. Dengan mengetahui bahwa pada cangkang telur mengandung kalsit yang dapat menjerap logam maka cangkang telur digunakan sebagai adsorben yang sesuai untuk proses adsorpsi dalam penelitian ini.
2.10 DESKRIPSI PROSES
Berdasarkan pemilihan proses pengolahan limbah logam berat, dipilih proses adsorpsi untuk mengolah limbah logam berat. Proses adsorpsi merupakan proses yang lebih banyak dipilih dalam dunia industri. Hal ini disebabkan biaya yang murah dan kapasitas dari adsorpsi yang baik untuk digunakan dalam penjerapan limbah logam berat.
Tabel 2.5 Jenis – jenis Adsorben
Bahan Adsorben Kelebihan Kekurangan
Tempurung Tanaman
Banyak tanaman yang memiliki tempurung seperti tanaman jarak pagar dan kemiri. Tanaman ini akan diolah menjadi arang aktif. Arang aktif inilah yang sama dengan karbon aktif. Namun tidak semua tanaman memiliki kapasitas adsorpsi yang sama. Maka dari itu selalu dicari tanaman yang dapat diolah menjadi adsorben dan memiliki kapasitas adsorpsi yang sama dengan karbon aktif [26].
Karena tidak semua tanaman memiliki kapasitas penjerapan yang sama maka tidak semua tanaman layak digunakan untuk diolah menjadi karbon aktif. Dengan demikian, bahan baku adsorben karbon aktif semakin berkurang dan membuat harganya menjadi mahal [26].
Batu Kapur Batu kapur memiliki kalsit pada permukaannya sehingga ikatan antara logam Cd (II) dan Pb (II) dan adsorben membentuk larutan padat yang stabil [27].
Batu kapur memiliki kegunaan lain selain sebagai adsorben, sehingga penggunaan batu kapur sebagai adsorben akan menjadi semakin sedikit [27].
Cangkang Telur Cangkang telur merupakan limbah yang tidak dimanfaatkan. Jumlah cangkang telur terdapat di lingkungan dalam jumlah yang banyak dan harga yang murah. Selain itu, cangkang telur memiliki kalsit yang sama seperti batu kapur sehingga dapat digunakan sebagai adsorben [9].
Kapasitas penjerapan dari cangkang telur tidak sebesar kapasitas penjerapan karbon aktif [9].
Birnessite Sintetis Birnessite sintetis merupakan hasil kalsinasi antara asam sitrat dengan KMnO4. Birnessite sintetis ini merupakan adsorben yang baik dalam penjerapan logam Cd [28].
Pembuatan Birnessite sintetis ini lebih mahal. Hal ini disebabkan penggunaan bahan kimia dalam pembuatan birnessite sintetis seperti asam sitrat, KMnO4 dan HCl [28].
Limbah Serbuk Kayu
Pada limbah serbuk kayu memiliki lignin yang dapat digunakan sebagai adsorben untuk menjerap logam Cu [29].
ion logam berat. Selain itu, harga cangkang telur murah dan dapat ditemukan di lingkungan.
Berdasarkan kedua hal diatas maka dilakukanlah penelitian mengenai adsorpsi menggunakan cangkang telur. Cangkang telur yang dipilih merupakan cangkang telur bebek. Hal ini didasarkan pada hasil penelitian Arunlertaree [30], cangkang telur bebek memiliki persentase penyisihan yang paling besar. Maka dari itu, cangkang telur bebek digunakan dalam proses adsorpsi logam berat. Cangkang telur bebek yang digunakan dalam penelitian ini diolah lebih lanjut sebagai adsorben. Cangkang telur bebek dicuci dan digerus sehingga diperoleh serbuk cangkang telur bebek dengan ukuran 140 mesh. Serbuk cangkang telur akan dipanaskan pada temperatur 1100C, 6000C dan 8000C.
Adsorben yang telah dihasilkan pada berbagai temperatur akan ditentukan luas permukaannya. Penentuan luas permukaan adsorben dilakukan dengan
pengujian dengan penggunaan metilen blue. Hasil pengujian ini dilaporkan dari hasil penelitian Jasinda [31], luas permukaan adsorben dengan temperatur 6000C
adalah adsorben dengan luas permukaan terbesar. Maka adsorben jenis ini digunakan dalam proses adsorpsi penelitian ini.
Proses adsorpsi penelitian ini digunakan larutan logam Cd (II), Fe (III) dan Zn (II). Ketiga jenis larutan ini akan diadsorpsi dengan adsorben cangkang telur bebek. Proses adsorpsi ini akan dibantu dengan menggunakan pengadukan dari
magnetic stirrer. Filtrat akan diambil setiap 10 menit sampai mencapai waktu setimbang. Filtrat yang diambil akan diuji dengan menggunakan peralatan AAS. Data yang diperoleh dari peralatan AAS akan diolah untuk memperoleh waktu setimbang, persentase adsorpsi, kinetika adsorpsi, isotherm adsorpsi dan kapasitas adsorpsi.
2.11 ANALISA BIAYA
1. Netralisasi Limbah Cair 2. Pengaturan pH Limbah Cair 3. Penambahan Koagulan
4. Membiarkan pengendapan terjadi selama beberapa hari
Pada keempat metode yang digunakan tersebut membutuhkan zat kimia seperti larutan Ca(OH)2, HCl, Na2CO3, NaOH dan tawas. Berikut adalah harga
dari zat kimia di pasaran yaitu:
1. Larutan Ca(OH)2 = Rp 935.000/ton
2. HCl = Rp 15.000/liter (teknis)
3. Na2CO3 = Rp 25.000/kg
4. NaOH = Rp 25.000/kg
5. Tawas = Rp 35.000/kg
Contoh perhitungan pengolahan limbah B3 akan dilakukan pengolahan
100 L limbah elektroplating. Dalam pengolahan limbah cair elektroplating
sebanyak 100 L membutuhkan 1 – 2 kg Na2CO3 dan NaOH serta 1 kg tawas.
Untuk larutan Ca(OH)2 dan HCl ditambahkan sesuai kebutuhan hingga tercapai
pH 8 – 10 [32]. Berikut adalah estimasi perhitungan bahan kimia yang dibutuhkan dalam pengolahan 100 L limbah cair elektroplating:
1. Larutan Ca(OH)2 = 2 kg = Rp 2.000,-
2. HCl (teknis) = 1 liter = Rp 15.000,-
3. Na2CO3 = 2 kg = Rp 50.000,-
4. NaOH = 2 kg = Rp 50.000,-
5. Tawas = 1 kg = Rp 35.000,-
Total = Rp 187.000,-
Peralatan yang digunakan adalah bak yang luas, pengaduk dan penyaring (screening). Berikut adalah estimasi biaya peralatan dan bangunan untuk pengolahan limbah cair elektroplating:
1. Bak = 1 buah = Rp 50.000.000,-
2. Pengaduk = 1 buah = Rp 80.000.000,- 3. Penyaring (Screening) = 1 buah = Rp 40.000.000,-
Total = Rp 170.000.000,- Proses Sedimentasi dan Koagulasi memerlukan proses lanjutan agar dapat memenuhi syarat baku mutu untuk dibuang ke lingkungan, maka estimasi total biaya yang diperlukan untuk pengolahan limbah cair elektroplating dengan teknik sedimentasi dan koagulasi adalah sebagai berikut:
1. Biaya Bahan Baku = Rp 187.000,-
2. Biaya Peralatan = Rp 170.000.000,-
3. Biaya Pengolahan Lanjutan = Rp 100.000.000,- Total = Rp 270.187.000,-
Setelah diperoleh biaya untuk pengolahan limbah elektroplating dengan proses sedimentasi dan koagulasi maka akan dihitung biaya untuk pengolahan limbah elektroplating dengan proses adsorpsi. Dalam pengolahan limbah cair elektroplating sebanyak 100 L dengan metode adsorpsi membutuhkan 1 kg adsorben. Berdasarkan penelitian Jasinda [36] diperoleh harga adsorben cangkang telur bebek sebesar Rp150.000,-/kg. Berikut adalah estimasi perhitungan biaya untuk adsorben yang digunakan:
Adsorben Cangkang Telur Bebek = 1 kg X Rp 150.000,- / kg = Rp 150.000,-
Penjerapan dengan adsorben tidak akan menimbulkan senyawa kompleks yang dapat menimbulkan pencemaran di badan air.
1. Tangki Pengaduk = 1 buah = Rp 200.000.000,- 2. Penyaring (Screening) = 1 buah = Rp 40.000.000,-
Total = Rp 240.000.000,-
Estimasi total biaya yang diperlukan untuk pengolahan limbah cair elektroplating dengan proses adsorpsi oleh adsorben cangkang telur bebek adalah sebagai berikut:
1. Biaya Bahan Baku = Rp 150.000,-
2. Biaya Peralatan = Rp 240.000.000,-
3. Operasional = Rp 75.000.000,-
Total = Rp 315.150.000,-
Dari analisis biaya yang telah diperoleh terlihat bahwa biaya untuk proses
sedimentasi dan koagulasi lebih mahal daripada biaya untuk proses adsorpsi. Akan tetapi ditinjau dari prosesnya, proses adsorpsi lebih menguntungkan
BAB III
METODOLOGI PENELITIAN
3.1 LOKASI DAN WAKTU PENELITIAN
Penelitian dilakukan di Laboratorium Kimia Analisa dan Laboratorium Operasi Teknik Kimia, Departemen Teknik Kimia, Fakultas Teknik, Universitas Sumatera Utara, Medan serta Laboratorium Penelitian, Fakultas Farmasi, Universitas Sumatera Utara, Medan. Penelitian ini dilakukan selama lebih kurang 4 bulan.
3.2 BAHAN
Pada penelitian ini bahan yang digunakan antara lain:
1. Adsorben cangkang telur bebek yang telah diaktivasi pada suhu 6000C 2. Larutan Cd2+
3. Larutan Fe3+ 4. Larutan Zn2+ 5. Aquabidest
6. Larutan HCl
3.3 PERALATAN
Pada penelitian ini peralatan yang digunakan antara lain: 1. Magnetic Stirrer
3.3.1 PROSEDUR PENENTUAN WAKTU SETIMBANG ADSORPSI,
PERSENTASE ADSORPSI, KINETIKA ADSORPSI ISOTHERM
ADSORPSI DAN KAPASITAS ADSORPSI
1. Dimasukkan masing-masing 0,5; 1 dan 1,5 gram sampel serbuk adsorben cangkang telur bebek ke dalam beaker glass 1000 ml.
2. Ditambahkan 1000 ml larutan Cd (II) 12,5 ppm ke dalam erlenmeyer yang telah berisi sampel.
3. Campuran diaduk dengan magnetic stirrer dengan interval waktu pengambilan sampel 10 menit hingga mencapai waktu setimbang.
4. Hasil pengadukan disaring dengan menggunakan kertas saring.
5. Filtrat diambil untuk diukur konsentrasi akhir ion logam Cd (II) dengan
menggunakan peralatan AAS.
6. Hasil pengukuran akan berupa konsentrasi dari filtratnya.
7. Banyaknya ion logam Cd (II) yang terjerap oleh setiap gram sampel dapat dihitung dengan persamaan 3.1:
Wads = 1000 C1 x V) – (
C2
1000x V)] x 1
m
(3.1)
8. Waktu setimbang diperoleh dengan membuat grafik antara banyaknya ion logam Cd (II) yang dijerap terhadap waktu.
9. Dari grafik akan diperoleh waktu setimbang untuk penjerapan ion logam Cd (II) oleh cangkang telur bebek.
10.Persentase adsorpsi diperoleh dengan cara memplot grafik % adsorpsi vs t 11.Data yang diperoleh dicocokkan dengan persamaan seperti persamaan
kecepatan reaksi orde 1 semu Lagergren, persamaan orde 2 dan persaman yang lain untuk menentukan model kinetika reaksi.
12.Ditentukan isotherm adsorpsi dengan menggunakan persaman yang sesuai seperti persamaan Langmuir, Freundlich serta persamaan yang lain.
13.Dari parameter yang telah diperoleh pada persamaan isotherm adsorpsi maka ditentukan kapasitas adsorpsinya.
Adapun aliran dari proses penelitian ini dapat dilihat pada gambar 3.1.
Gambar 3.1 Flowchart Penentuan Waktu Setimbang Adsorpsi, Persentase Adsorpsi, Kinetika Adsorpsi, Isotherm Adsorpsi dan Kapasitas Adsorpsi
1000 ml larutan Cd (II) dimasukkan ke dalam beaker glass yang telah berisi 0,5; 1 dan 1,5 gram adsorben
Campuran diaduk dengan magnetic stirrer
dengan interval pengambilan filtrat 10 menit
Filtrat disaring dengan kertas saring
Dihitung waktu setimbang dan persentase adsorpsi
Selesai
Mulai
Filtrat diukur dengan peralatan AAS
Apakah ada larutan logam berat lain?
Tidak
BAB IV
HASIL DAN PEMBAHASAN
Pada bagian ini dilaporkan hasil penelitian mengenai adsorpsi ion logam Cd, Fe dan Zn dengan menggunakan adsorben cangkang telur bebek. Adsorben yang digunakan merupakan cangkang telur bebek yang telah diaktivasi pada temperatur 6000C. Pembuatan adsorben cangkang telur dilakukan pada temperatur 1100C, 6000C dan 8000C. Adsorben yang dihasilkan pada berbagai temperatur diuji luas permukaan dan morfologi dari adsorben tersebut. Setelah diuji maka didapat adsorben dengan temperatur aktivasi 6000C memiliki luas permukaan paling besar yaitu 2.700,978 m2/gr. Oleh karena itu dalam penelitian ini digunakan adsorben cangkang telur bebek yang diaktivasi pada temperatur 600oC. Pada penelitian ini konsentrasi awal larutan logam Cd, Fe dan Zn yang digunakan sebesar 12,5 ppm. Tahapan penelitian yang dilakukan meliputi:
1. Penentuan Waktu Setimbang 2. Penentuan Persentase Adsorpsi 3. Penentuan Kinetika Adsorpsi
4. Penentuan Isotherm Adsorpsi 5. Penentuan Kapasitas Adsorpsi
4.1 PENGARUH JUMLAH ADSORBEN TERHADAP WAKTU
SETIMBANG DAN PERSENTASE ADSORPSI
Waktu setimbang dan persentase adsorpsi dipengaruhi oleh jumlah adsorben seperti yang dapat dilihat pada Gambar 4.1. Gambar 4.1 merupakan hasil pengukuran AAS untuk mengetahui konsentrasi sisa logam Cd, Fe dan Zn dalam larutan. Peralatan AAS yang digunakan serta hasil pengukuran dapat dilihat pada lampiran C.
semakin sedikit jumlah adsorben maka semakin besar konsentrasi ion logam Cd yang tersisa pada filtrat dan sebaliknya.
Gambar 4.1 Hubungan Konsentrasi Ion Logam Cd yang Tersisa di Filtrat terhadap Waktu dengan Variasi Jumlah Adsorben
Dari gambar 4.1 juga dapat dilihat waktu setimbang yang dicapai pada masing – masing jumlah adsorben yang digunakan. Hasil yang diperoleh dari pengaruh jumlah adsorben dengan waktu setimbang dan persentase adsorpsi dapat dilihat pada tabel 4.1.
Tabel 4.1 Persentase Adsorpsi yang Diperoleh dari Penjerapan Ion Logam Cd
Jumlah Adsorben (gr) Waktu Setimbang (menit) Persentase Adsorpsi
0,5 90 33,2632
1 130 53,7895
1,5 110 64,6667
Jumlah adsorben adalah parameter penting yang menyatakan kapasitas dari adsorben untuk memberikan konsentrasi awal dari adsorbat pada kondisi operasi. Dari hasil penelitian Ghazy [33] dan Nurhasni [1] diperoleh hasil bahwa konsentrasi ion logam semakin menurun dengan bertambahnya jumlah adsorben yang digunakan. Hal ini disebabkan semakin banyak jumlah adsorben yang digunakan maka akan meningkatkan jumlah partikel dan luas permukaan sehingga menyebabkan jumlah tempat mengikat ion logam bertambah dan efisiensi adsorpsinya pun meningkat. Oleh karena itu, semakin banyak jumlah adsorben yang digunakan maka semakin meningkat persentase adsorpsinya. Persentase
adsorpsi dapat dihitung dengan menggunakan persamaan 4.1. 0 2 4 6 8 10 12 14
0 20 40 60 80 100 120 140
Ko n se n tr as i L o gam Cd yan g te r sis a d i fil tr at ( p p m ) Waktu (menit)
% Adsorpsi = Co- C
Co x 100% (4.1)
Berdasarkan penelitian Siti [34], waktu adsorpsi berpengaruh terhadap persentase adsorpsi. Pada awal kenaikan waktu adsorpsi akan menaikkan efisiensi adsorpsi ion logam. Semakin lama proses adsorpsi berlangsung maka persentase adsorpsi tidak akan mengalami kenaikan yang berarti. Hal ini disebabkan bahan penyerap telah jenuh, sehingga perpanjangan waktu tidak akan mempengaruhi persentase adsorpsi. Selain itu jumlah adsorben akan mempengaruhi waktu setimbang dimana semakin banyak jumlah adsorben yang digunakan maka akan semakin lama waktu setimbang dicapai. Hal ini disebabkan kesesuaian dari ukuran molekul ion logam dengan pori adsorben. Ion logam denan ukuran yang tidak sesuai dengan pori adsorben akan sering terlepas dari pori adsorben. Dengan demikian, waktu setimbang akan semakin lama tercapai. Dengan kata lain,
fenomena dalam penelitian Ghazy [33], Nurhasni [1] dan Siti [34] menjelaskan bahwa semakin banyak jumlah adsorben yang digunakan akan meningkatkan
persentase adsorpsi dan waktu setimbang akan semakin lama untuk dicapai. Jadi hasil yang diperoleh pada penelitian ini memiliki fenomena yang berbeda dengan penelitian yang dilakukan Ghazy [33], Nurhasni [1] dan Siti [34]. Hal ini terlihat pada jumlah adsorben 1,5 gram memiliki waktu setimbang yang lebih singkat dibandingkan waktu setimbang yang diperoleh 1 gram adsorben. Hasil yang serupa diperoleh untuk pengulangan proses penjerapan logam Cd dengan penggunaan 1 gram dan 1,5 gram adsorben. Seharusnya dengan semakin banyak jumlah adsorben maka waktu setimbang yang diperoleh semakin lama. Hal ini disebabkan meningkatnya frekuensi tumbukan antara adsorbat dan adsorben sehingga menyebabkan sebagian besar ion logam Cd yang ada pada filtrat telah terjerap ke dalam adsorben sehingga adsorben menjadi cepat jenuh. Selain itu, adanya pengaruh dari ukuran adsorbat yang akan dibahas pada sub bab 4.2. Adapun kemungkinan lain dari fenomena ini adalah penggunaan jumlah adsorben sebanyak 1 gram merupakan jumlah adsorben optimum dalam penjerapan logam Cd dengan menggunakan adsorben cangkang telur bebek.
pada gambar 4.2. Gambar 4.2 merupakan grafik antara konsentrasi ion logam Fe yang tersisa di filtrat dengan waktu adsorpsi pada variasi jumlah adsorben. Pada gambar 4.2 ini dapat dilihat bahwa konsentrasi larutan Fe yang tersisa dalam larutan cenderung menurun dengan bertambahnya waktu hingga mencapai waktu setimbang. Dari gambar 4.2 juga terlihat bahwa jumlah adsorben yang semakin sedikit membuat waktu setimbang semakin singkat. Hasil yang diperoleh dari pengaruh jumlah adsorben dengan waktu setimbang dan persentase adsorpsi dapat dilihat pada tabel 4.2.
Gambar 4.2 Hubungan Konsentrasi Ion Logam Fe yang Tersisa di Filtrat terhadap Waktu dengan Variasi Jumlah Adsorben
Tabel 4.2 Persentase Adsorpsi yang Diperoleh dari Penjerapan Ion Logam Fe
Jumlah Adsorben (gr) Waktu Setimbang (menit) Persentase Adsorpsi
0,5 60 21,5652
1 110 35,8261
1,5 140 65,0435
Hasil penelitian yang diperoleh memiliki fenomena yang sama dengan penelitian yang dilakukan Nurhasni [1], Ghazy [33] dan Siti [34]. Dengan
semakin banyak jumlah adsorben yang digunakan maka akan semakin lama waktu setimbang dicapai. Selain itu dengan semakin banyak jumlah adsorben maka persentase adsorpsi akan semakin meningkat.
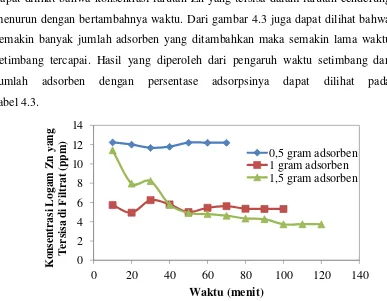
Hubungan antara waktu adsorpsi terhadap konsentrasi ion logam Zn yang tersisa dalam filtrat pada variasi jumlah adsorben dapat dilihat pada gambar 4.3. Gambar 4.3 merupakan grafik antara konsentrasi ion logam Zn yang tersisa di filtrat dengan waktu adsorpsi pada variasi jumlah adsorben. Pada gambar 4.3 ini
0 2 4 6 8 10 12 14
0 20 40 60 80 100 120 140 160
Ko n se n tr as i L o gam F e yan g te r sis a d i F il tr at ( p p m ) Waktu (menit)
dapat dilihat bahwa konsentrasi larutan Zn yang tersisa dalam larutan cenderung menurun dengan bertambahnya waktu. Dari gambar 4.3 juga dapat dilihat bahwa semakin banyak jumlah adsorben yang ditambahkan maka semakin lama waktu setimbang tercapai. Hasil yang diperoleh dari pengaruh waktu setimbang dan jumlah adsorben dengan persentase adsorpsinya dapat dilihat pada tabel 4.3.
Gambar 4.3 Hubungan Konsentrasi Ion Logam Zn yang Tersisa di Filtrat terhadap Waktu dengan Variasi Jumlah Adsorben
Tabel 4.3 Persentase Adsorpsi yang Diperoleh dari Penjerapan Ion Logam Zn
Jumlah Adsorben (gr) Waktu Setimbang (menit) Persentase Adsorpsi
0,5 70 2,4670
1 100 57,3807
1,5 120 70,0711
Penjerapan logam Zn dengan menggunakan adsorben sebanyak 1 gram memiliki perbedaan dengan jumlah adsorben yang lain. Pada 50 menit awal penjerapan dengan jumlah adsorben sebanyak 1 gram memiliki efektifitas penjerapan yang baik dibandingkan dengan yang lain. Setelah menit ke 50 maka terjadi penjerapan yang maksimum pada jumlah adsorben sebanyak 1 gram. Hal ini disebabkan jenis logamnya sendiri yang memiliki ukuran yang kurang sesuai
dengan pori adsorben dan gaya yang bekerja antara ion logam Zn dengan adsorben. Namun semakin lama waktu adsorpsi berjalan maka hasil yang
diperoleh telah sama dengan hasil penelitian yang diperoleh Nurhasni [1], Ghazy [33] dan Siti [34].
0 2 4 6 8 10 12 14
0 20 40 60 80 100 120 140
Ko n se n tr as i L o gam Z n yan g T e r sis a d i F il tr at ( p p m ) Waktu (menit)
Untuk persentase adsorpsi ion logam Zn terdapat penyimpangan pada penjerapan ion logam Zn dengan jumlah adsorben seban

![Gambar 2.1 Proses Adsorpsi [20]](https://thumb-ap.123doks.com/thumbv2/123dok/306581.27350/33.595.134.496.470.723/gambar-proses-adsorpsi.webp)