TUNAS JATI EMAS (
Cordia subcordata)
SECARA
IN VITRO
SKRIPSI
Oleh
Imanudin 20120210096
Program Studi Agroteknologi
FAKULTAS PERTANIAN
UNIVERSITAS MUHAMMADIYAH YOGYAKARTA YOGYAKARTA
PENGARUH PE
PENAMBAHAN AIR REBUSAN KENTANG P DAN NAA TERHADAP INDUKSI TUNA
(Cordia subcordata)SECARAIN VITRO
Yang dipersiapkan dan disusun oleh:
Imanudin 20120210096
elah dipertahankan di depan Dewan Penguji Pada tanggal 25 Mei2016
lah diterima sebagai bagian persyaratan yang di memperoleh derajat Sarjana Pertanian
uji Utama Anggota Peng
Dengan ini saya menyatakan:
1. Karya tulis saya, skripsi ini, adalah asli dan belum pernah diajukan untuk mendapatkan gelar akademik, baik di Universitas Muhammadiyah Yogyakarta maupun di perguruan tinggi lainnya.
2. Karya tulis ini murni gagasan, rumusan dan penelitian saya sendiri, tanpa bantuan bantuan pihak lain, kecuali arahan Tim Pembimbing.
3. Karya tulis ini ada gagasan, rumusan dan penilaian saya setelah mendapatkan arahan dan saran dari Tim Pembimbing. Oleh karena itu, saya menyetujui pemanfaatan karya tulis ini dalam berbagai forum ilmiah, maupun pengembangannya dalam bentuk karya ilmiah lain oleh Tim Pembimbing.
4. Dalam karya tulis ini tidak terdapat karya atau pendapat yang telah ditulis atau dipublikasikan orang lain, kecuali secara tertulis dengan jelas dicantumkan sebagai acuan dalam naskah dengan disebutkan nama pengarang dan dicantumkan dalam daftar pustaka
5. Pernyataan ini saya buat sesungguhnya dan apabila di kemudian hari terdapat penyimpangan dan ketidakbenaran dalam pernyataan ini, maka saya bersedia menerima sanksi akademik berupa pencabutan gelar yang telah saya peroleh karena karya tulis ini, serta sanksi lainnya sesuai dengan norma yang berlaku di perguruan tinggi ini.
Yogyakarta, 13 Juni 2016 Yang membuat pernyataan
Assalamu’alaikum Wr. Wb.
Alhamdulillahi rabbil’alamiin, segala puji bagi Allah SWT penguasa segala alam. Shalawat serta salam selalu tercurah kepada junjungan kita Nabi Muhammad SAW, Saiyyidil awwalin wal akhirin, sehingga penulis dapat menyelesaikan penulisan skripsi yang berjudul Pengaruh Penambahan Air Rebusan Kentang (Solanum Tuberosum L.), BAP dan NAA Terhadap Induksi Tunas Jati Emas (Cordia subcordata)SecaraIn Vitro. Skripsi ini disusun sebagai salah satu syarat untuk memperoleh derajat Sarjana Pertanian pada Fakultas Pertanian Universitas Muhammadiyah Yogyakarta.
Dari awal hingga terselesaikannya skripsi ini, penulis banyak mendapat bantuan dari berbagai pihak. Oleh karenanya, penulis ingin mengucapkan terimakasih kepada:
1. Dr. Innaka Ageng Rineksane, S.P, M.P selaku dosen pembimbing utama, dan Ketua Program Studi Agroteknologi yang senatiasa memberi masukan, arahan serta ilmu kepada penulis sehingga terlaksananya penelitian dan penyusunan skripsi.
2. Ir. Sukuriyati Susilo Dewi, M.S selaku dosen pendamping, selalu memotivasi dan memberikan bimbingan, ilmu masukan dan arahan dalam terlaksananya penyusunan skripsi.
3. Ir. Agung Astuti, MSi. Selaku dosen penguji yang memberi arahan dan masukan demi kesempurnaan penulisan.
4. Bu Harini sebagai laboran lab kultur in vitro yang senantiasa membantu dan membimbing dalam kegiatan teknis saat pelaksanaan penelitian.
5. Ibu dan bapak yang senantiasa memberi dukungan dan motivasi dalam setiap urusan yang menyangkut akademik.
6. Dhanita, Nur Asiayang selalu memberikan do’a dan motivasi dari awal penelitian hingga penyusunan skripsi selesai.
7. Shandy, Bayu, Julio, Badri, Thoha, Muhamad Laode, Nofison, Imam Susila, yang senantiasa membantu dalam pelaksanaan penelitian
8. Teman-teman Agroteknologi UMY yang sampai saat ini menjaga kekompakan dalam memotivasi teman-teman.
sampai saat ini masih mensupport dan memberikan motivasi walaupun hanya lewat media sosial.
Atas segala bantuan, do’a dan dukungan yang telah diberikan semoga mendapat balasan dari Allah SWT. Penulis berharap semoga skripsi ini membawa manfaat yang besar baik bagi penulis maupun pembaca.
Wassalamu’alaikum Wr. Wb.
Yogyakarta, 13 Juni 2016
PENGESAHAN ... iii
PERNYATAAN... iv
KATA PENGANTAR ... v
DAFTAR ISI... vii
DAFTAR TABEL... ix
DAFTAR GAMBAR ... x
DAFTAR LAMPIRAN ... xi
INTISARI... xii
ABSTRACT... xiii
I. PENDAHULUAN ... 1
A. Latar Belakang ... 1
B. Perumusan Masalah ... 3
C. Tujuan Penelitian ... 3
II. TINJAUAN PUSTAKA ... 4
A. Jati Emas (Cordia subcordata) ... 4
B. KulturIn Vitro... 6
C. Air Rebusan Kentang (Salonum tuberosumL)... 9
D. Zat Pengatur Tumbuh (ZPT)... 11
E. Hipotesis ... 12
III. TATACARA PENELITIAN... 13
C. Metode Penelitian ... 13
D. Cara Penelitian ... 14
1. Tahapan Penelitian ... 14
2. Persiapan Alat dan Bahan ... 15
3. Pembuatan medium ... 15
4. Persiapan Eksplan ... 16
E. Parameter Pengamatan... 17
1. Persentase Eksplan Hidup (%) ... 17
2. Persentase Eksplan Kontaminasi (%)... 17
3. Persentase EksplanBrowning(%) ... 18
4. Jumlah Calon Tunas ... 18
F. Analisis Data ... 18
IV. HASIL ANALISIS DAN PEMBAHASAN... 19
A. Persentase Eksplan Hidup... 20
B. Persentase Eksplan Kontaminasi ... 23
C. Persentase EksplanBrowning... 27
D. Jumlah Calon Tunas... 31
V. KESIMPULAN DAN SARAN... 37
A. Kesimpulan ... 37
B. Saran ... 37
DAFTAR PUSTAKA ... 38
Tabel Halaan
1. Komposisi dan Kandungan Kentang Rebus...Error! Bookmark not defined. 2. Pengaruh Air Rebusan Kentang, BAP dan NAA terhadap Persentase
Gambar Halaman.
1. Tahapan Pengujian Efektivitas Air Rebusan Kentang untuk Induksi Tunas Jati Emas SecaraIn Vitro...Error! Bookmark not defined. 2. (a) Eksplan Kalus Jati Kontaminasi Bakteri 2 MST dan (b) Kontaminasi
Jamur 3 MST. ...Error! Bookmark not defined. 3. Grafik Persentase Eksplan Kontaminasi 1-8 MSTError! Bookmark not defined. 4. Grafik Persentase EksplanBrowning1-8 MST ..Error! Bookmark not defined.
5. (a) Persentase EksplanBrowningdan (b) Persentase EksplanRecoveryError! Bookmark not defi 6. Pengaruh Air Rebusan Kentang, BAP dan NAA terhadap Jumlah Calon
Tunas Jati Emas pada 7 dan 8 MST ...Error! Bookmark not defined. 7. Pengaruh Air Rebusan Kentang terhadap Jumlah Calon Tunas Jati Emas
Lampiran Halaman.
1.LayoutPenelitian...Error! Bookmark not defined. 2. Komposisi Medium...Error! Bookmark not defined. 3. Alur Pembuatan Medium WPM 0 ...Error! Bookmark not defined. 4. Alur Pembuatan Medium Perlakuan ...Error! Bookmark not defined. 5. Hasil Analisis Anova dan Sidik Ragam Jumlah Calon Tunas Minggu ke-7
dan 8 MST ...Error! Bookmark not defined.
This research aimed to know the influence of boiedl water potato combined with Benzyl Amino Purin and Naphtalene Acetic Acid in inducing shoot of golden teak in vitro. This research was held in laboratory in vitro culture, Faculty of Agriculture Universitas Muhammadiyah Yogyakarta on February until April 2016.
This research used single factor experimental method, with five treatments which consist of BAP(0,5;,1,0;,1,5;,2,0; 2,5 mg/l), NAA( 0.1;,0,2;,0,3;, 0,4;, 0,5 mg/l) and boiled water potato(100, 200, 300, 400, 500 ml/l).The parameter observed were are percentage of contamination, percentage of Browning, percentage of life and number of shoot bud.
The result showed that the addition of boiled water potato 300 ml/l + BAP 1,5 mg/l and NAA 0,3 mg/l was the best treatment as shown by the parameter highest shoot (40,66) on the 8th week, the percentage explant of life (90%), the percentage explant of contamination (10%), the percentage explants of Browning (30%) and the percentage explant of recovery (30%).
A.Latar Belakang
Tanaman Jati Emas (Cordia subcordata) merupakan salah satu tanaman
yang memberikan kontribusi nyata dalam menyediakan bahan baku kayu. Jati
Emas disebut juga Fast Growth Golden Teak (FGGT) yang artinya Jati Emas
berdaya tumbuh cepat. Jika Jati biasa (lokal) baru bisa dipanen pada umur 45
tahun, maka Jati Emas ini bisa dipanen pada umur 10-15 tahun. Kayu Jati Emas
banyak dicari untuk konstruksi dekoratif misalnya parquet flooring (lantai kayu),
dinding, mebel dan kusen kayu/jendela berkualitas tinggi, kayu yang berkualitas
ekspor. Kebutuhan menunjukkan peningkatan dari tahun ke tahun yaitu 120,111
m3 (2009), 147,563 m3 (2010), 136,952 m3 (2011), 138,130 m3 (2012), 169,121
m3 (2013), 30,882 m3 (2014) (BPS Jateng, 2014).
Kebutuhan bahan baku kayu terutama Jati yang semakin berkembang telah
meningkatkan kebutuhan bibit Jati. Bibit Jati biasanya diproduksi
secara konvensional menggunakan biji (generatif) sehingga produksi bibit dengan
jumlah besar dalam waktu tertentu menjadi terbatas. Bibit yang baik merupakan
bibit yang berkualitas tinggi artinya bebas dari penyakit baik yang disebabkan
patogen maupun sifat genetis. Tanaman Jati dapat diperbanyak secara generatif
tetapi hasil perbanyakan secara generatif memiliki umur yang lebih panjang.
Sementara, perbanyakan secara vegetatif khususnya kultur in vitro dapat
mengasilkan tanaman dalam jumlah banyak, seragam dan dalam waktu yang
singkat. Perbanyakan dengan kultur in vitro merupakan metode memperbanyak
Penelitian yang dilakukan Yasodha et al. (2005) telah berhasil
memultiplikasi tunas Jati dengan mengkulturkan eksplan biji Jati dalam medium
MS yang mengandung 22,2 µM BAP dan 11,62 µM Kinetin.Wattimena (1992)
menyatakan salah satu faktor yang menentukan keberhasilan kultur in vitro adalah
zat pengatur tumbuh. Benzyl Amino Purin (BAP) adalah zat pengatur tumbuh
golongan sitokinin yang jika dikombinasikan dengan Naphtalene Acetic Acid
(NAA) dari golongan auksin akan mendorong pembelahan sel dan morfogenesis
tanaman. Medium kultur in vitro yang dirancang untuk tanaman berkayu seperti
buah-buahan adalah Woody Plant Medium atau WPM, hasil komposisi dari Lloyd
dan McCown, 1981 (George dan Sherrington, 1984 dalamRahayu, 1993).
Penambahan zat orgaik kompleks dalam medium kultur in vitro merupakan
salah satu alternatif untuk mengurangi penggunaan bahan sintetis, kandungan
yang terdapat dalam zat orgaik ompleks yang di tambahkan ke dalam medium
bersifat esensial bagi pertumbuhan tanaman secara in vitro. Penelitian ini
mencoba menggunakan air rebusan kentang yang dikombinasikan dengan BAP
dan NAA untuk menginduksi tunas Jati. Air rebusan kentang digunakan sebagai
zat organik kompleks yang ditambahkan ke dalam medium kultur in vitro, dimana
air rebusan kentang ini dapat meningkatkan pertumbuhan eksplan. Hal tersebut
dikarenakan adanya kandungan vitamin A, Tiamin (vitamin B1), riboflavin
(vitamin B2), piridoksin (vitamin B6), asam korbat (vitamin C), asam amino,
protein, kalsium, magnesium, fosfor, dan besi (Molnar et al., 2011). Hasil
penelitian Imanudin dkk. (2015) dengan penambahan air rebusan kentang 300 ml/l
menginduksi kalus pada eksplan Jati Emas (Cordia subcordata) 23,60 HST dan
diameter kalus mencapai 4.64 cm. Sementara hasil penelitian Hadi (2013)
menyatakan penambahan air rebusan kentang dengan konsentrasi 300 ml/l
kedalam medium dapat meningkatkan jumlah akar planlet Pisang Ambon
mencapai 4,33 cm.
B. Perumusan Masalah
Penambahan air rebusan kentang merupakan salah satu alternatif sebagai
penambah nutrisi dalam medium, hal tersebut dikarenakan harganya murah dan
mempunyai kandungan vitamin A, Tiamin (vitamin B1), riboflavin (vitamin B2),
piridoksin (vitamin B6), asam askorbat (vitamin C), asam amino, protein,
kalsium, fosfor dan besi yang sifatnya esensial untuk pertumbuhan eksplan secara
in vitro. Oleh karena itu kajian mengenai seberapa besar pengaruh air rebusan
kentang untuk induksi tunas Jati Emas secara in vitro perlu dilakukan.
C. Tujuan Penelitian
1. Mengetahui pengaruh air rebusan kentang (Solanum tuberosum L.) terhadap
pertumbuhan tunas Jati Emas (Cordia subcordata) secara in vitro.
2. Menentukan konsentrasi BAP dengan NAA yang dikombinasikan dengan air
rebusan kentang sebagai ZPT kultur yang efektif untuk pertumbuhan tunas
II. TINJAUAN PUSTAKA
A. Jati Emas (Cordia subcordata)
Jati Emas (Cordia subcordata) merupakan bibit unggul hasil teknologi
kultur in vitro dengan induk tanaman pada mulanya berasal dari Myanmar. Jati
Emas ini sudah ditanam secara luas di Myanmar dan Thailand sejak tahun 1980.
Sementara itu penanaman Jati Emas di Malaysia secara meluas dilakukan pada
tahun 1990 dan di Indonesia dimulai pada tahun 1996 dengan penanaman Jati
Emas hingga 1 juta pohon di daerah Indramayu Jawa Barat. Untuk
perbandingan, tanaman Jati Emas berumur 5-7 tahun sudah mempunyai batang
dengan diameter 27 cm dan tinggi pohon mencapai 16 meter, pada umur yang
sama Jati biasa (Konvensional) memiliki diameter batang sekitar 3,5 cm dan
tinggi pohonnya sekitar 4 meter (Daru, 1994).
Jati Emas disebut juga Fast Growth Golden Teak (FGGT) yang artinya
Jati Emas berdaya tumbuh cepat, jika Jati biasa (lokal) baru bisa dipanen pada
umur 45 tahun, maka Jati Emas ini bisa dipanen pada umur 10-15 tahun. Pada
umur 5 tahun ditebang untuk penjarangan, hasil penebangan tersebut mempunyai
nilai ekonomi dan sudah laku dijual. Jati Emas diklasifikasikan sebagai kayu
keras, tekstur serat kayu lurus sehingga mudah dikerjakan dengan alat-alat
permesinan. Warna kayu putih kekuningan dan menjadi trend setter warna
furniture di Jepang dan Eropa. Kayu Jati Emas banyak dicari untuk konstruksi
dekoratif misalnya, parquet flooring (lantai kayu), dinding, mebel dan kusen kayu
atau jendela berkualitas tinggi. Sebagai kayu yang berkualitas ekspor, Jati Emas
Jati Emas cocok ditanam diperkebunan yang berada di daerah tropis,
sebagaimana umumnya tanaman Jati. Jati Emas juga termasuk tanaman pioner
yang dapat tumbuh di berbagai jenis tanah, kecuali tanah gambut atau rawa.
Meskipun demikian, tanah yang ideal untuk penanaman Jati Emas adalah jenis
tanah aluvial dengan pH 5-8. Jati Emas diketahui sangat menyukai tanah yang
banyak mengandung kapur, Topografi tanah dengan kemiringan kurang dari 20 %
(Daru, 1994).
Jati Emas dapat tumbuh dengan baik jika ditanam di daerah dataran
rendah (50-80 m dari permukaan air laut), tetapi Jati mas bisa ditanam di lokasi
yang berada di ketinggian 0-700 m di atas permukaan laut. Artinya lokasi yang
dekat pantaipun dapat dijadikan tempat penanaman Jati Emas. Perbanyakan Jati
Emas biasanya diperbanyak dengan biji (generatif). Perbanyakan dengan biji
membutuhkan waktu yang relatif lama, hal ini dikarenakan umur Jati untuk
menghasilkan biji 7-10 tahun sedangkan untuk umur panen Jati Emas bisa di
panen umur 5-7 tahun. Siklus umur panen Jati Emas lebih cepat dibandingkan
dengan Jati biasa (lokal) oleh karena itu perlu teknologi untuk perbanyakan Jati
Emas dalam waktu singkat dan seragam. Teknologi kultur in vitro telah terbukti
dapat digunakan sebagai teknologi pilihan yang sangat menjanjikan untuk
pemenuhan kebutuhan bibit tanaman Jati Emas (Cordia subcordata). Metode
kultur in vitro dikembangkan untuk membantu memperbanyak tanaman,
untuk dikembangbiakkan secara lama
relatif tanaman yang
untuk khususnya
generatif. Bibit yang dihasilkan dari kultur in vitro mempunyai beberapa
diperbanyak dalam jumlah yang besar sehingga tidak terlalu membutuhkan tempat
yang luas, mampu menghasilkan bibit dengan jumlah besar dalam waktu yang
singkat, kesehatan dan mutu bibit lebih terjamin, kecepatan tumbuh bibit lebih
cepat dibandingkan dengan perbanyakan konvensional.
Perbanyakan secara vegertatif menggunakan teknik kultur in vitro dengan
teknik kultur kalus atau kultur sel, jika suatu eksplan ditanam pada medium padat
atau dalam medium cair dalam waktu 2-4 minggu, tergantung spesiesnya, akan
terbentuk massa kalus yaitu suatu massa amorf yang tersusun atas sel-sel
parenkim berdinding sel tipis yang berkembang dari hasil proliferasi sel-sel in
vitro induk. Kalus mempunyai pertumbuhan yang abnormal dan berpotensi untuk
berkembang menjadi akar, tunas dan embrioid yang nantinya akan dapat
membentuk plantlet. Plantlet dapat disubkultur dengan cara mengambil sebagian
plantlet dan memindahkannya pada medium baru.
B. Kultur In Vitro
Kultur in vitro didefinisikan sebagai suatu teknik menumbuhkan bagian
baik berupa sel,
tanaman, in vitro, atau organ dalam kondisi aseptik dalam
medium buatan dengan kandungan nutrisi lengkap dan ZPT (Zat Pengatur
Tumbuh) serta kondisi ruang kultur yang suhu dan pencahayaannya terkontrol
(Yusnita, dkk. 1996). Kebutuhan hara sel dan in vitro yang dikulturkan akan
mempengaruhi keberhasilan dalam teknologi serta penggunaan metode in vitro.
Hara yang terdapat dalam medium terdiri atas komponen utama meliputi garam
mineral, sumber karbon (gula), vitamin dan zat pengatur tumbuh (Wetter dan
Perbanyakan tanaman secara in vitro merupakan teknik alternatif yang
tidak dapat dihindari bila penyediaan bibit tanaman harus dilakukan dalam skala
besar dan dalam waktu relatif singkat (Hendaryono dan Wijayani, 1994).
Menurut Wetter dan Constabel (1991) bahwa kultur in vitro tanaman terdiri dari
sejumlah teknik untuk menumbuhkan organ, in vitro dan sel tanaman. In vitro
dapat dikulturkan pada agar padat atau dalam medium hara cair. Jika ditanam
dalam agar, in vitro akan membentuk kalus, yaitu massa sel atau sel-sel yang tidak
tertata. Kultur agar juga merupakan teknik untuk meristem dan juga untuk
mempelajari organogenesis. Untuk mengembangkan tanaman secara in vitro
sampai menjadi plantlet dan akhirnya menjadi tanaman lengkap yang siap
dipindah ke medium tanah, maka terdapat beberapa tahapan utama yang harus
dilakukan, yaitu: (1) pemilihan sumber tanaman yang akan digunakan sebagai
bahan awal (in vitro meristem, eksplan, dan lain-lain), (2) penanaman dalam
medium yang sesuai sampai terjadi perbanyakan (misalnya dalam bentuk kalus),
(3) pembentukan tunas dan akar sampai terbentuk plantlet, (4) aklimatisasi, yaitu
proses adaptasi di luar sistem in vitro, (5) penanaman pada medium biasa (tanah
atau medium bukan artifisial lainnya) (Yuwono, 2006).
Formulasi dasar dari garam mineral buatan Murashige dan Skoog
merupakan medium kultur yang khas dan biasa digunakan dalam propagasi
tanaman secara in vitro. Nutrisi mineral dapat dibagi dalam tiga kelas: garam
mineral nutrisi makro, garam mineral nutrisi mikro dan sumber besi (Wetherel,
1982). Tunas–tunas yang terbentuk dari eksplan pada bagian yang bukan
Tunas-tunas ini dapat terbentuk langsung dari eksplan melalui proses terbentuknya kalus
terlebih dahulu. Teknik ini merupakan salah satu teknik mikropropagasi yang juga
banyak dilakukan dan dapat menghasilkan plantlet dalam jumlah jauh lebih
banyak dari teknik pembentukan tunas aksilar. Hasil penelitian dengan pemberian
BAP dan NAA yang optimum untuk pertumbuhan tunas anggrek pada perlakuan
1 mg/l BAP + 0,5 mg/l NAA menghasilkan tunas dengan waktu rerata 13,33 HST,
tunas 2,33 dan jumlah daun 5,67 helai (Markal dkk, 2015).
Faktor yang berpengaruh terhadap pertumbuhan (morfogenesis) kultur dan
sintesis metabolit sekunder adalah komponen organik dan anorganik dari medium,
zat pengatur tumbuh, cahaya dan temperatur. Medium merupakan faktor yang
sangat penting karena digunakan sebagai tempat tumbuhnya eksplan. Medium
dalam kultur in vitro merupakan campuran air dan hara yang mengandung
garam-garam organik dan zat pengatur tumbuh. Garam-garam-garam anorganik menyediakan
unsur makro seperti (N, P, K ,Ca, Mg dan Na) dan unsur hara mikro (B, Co, Mn,
I, Fe, Zn dan Cu) (Umi, 2008). Beberapa medium yang digunakan dalam kultur
in vitro antara lain, medium Nitsch and Nitsch, MS (Murashige and Skoog),
medium B5, medium WPM (Woody Plant medium). Medium yang sering
digunakan untuk sebagian besar spesies tanaman berkayu yaitu WPM (Dixon and
Gonzales, 1984). Zat-zat organik yang biasanya ditambahkan dalam medium
kultur in vitro seperti air rebusan kentang, ekstrak ragi, air kelapa. Penambahan air
rebusan kentang dengan konsentrasi 200 ml/l memberikan pengaruh nyata
terhadap pertumbuhan jumlah akar pisang ambon secara in vitro dengan rata-rata
C. Air Rebusan Kentang (Salonum tuberosum L)
Kentang ( Solanum tuberosum L) adalah tanaman dari suku Solanaceae
yang memiliki umbi batang dan merupakan salah satu sumber utama karbohidrat.
Tanaman ini merupakan herba (tanaman pendek tidak berkayu) semusim dan
hidup di iklim yang sejuk. Air rebusan kentang digunakan sebagai zat organik
kompleks yang ditambahkan ke dalam medium kultur in vitro, dimana air rebusan
kentang dapat meningkatkan pertumbuhan eksplan karena mengandung beberapa
zat organik yang bersifat esensial bagi tanaman dalam kultur in vitro. Beberapa
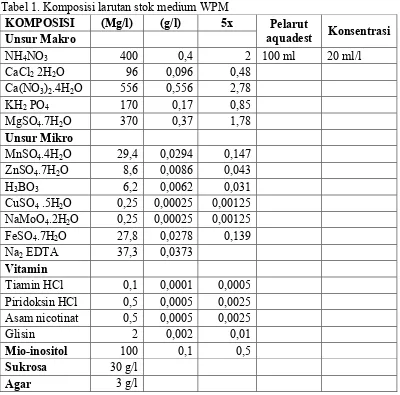
kandungan dalam kentang disajikan pada tabel 1.
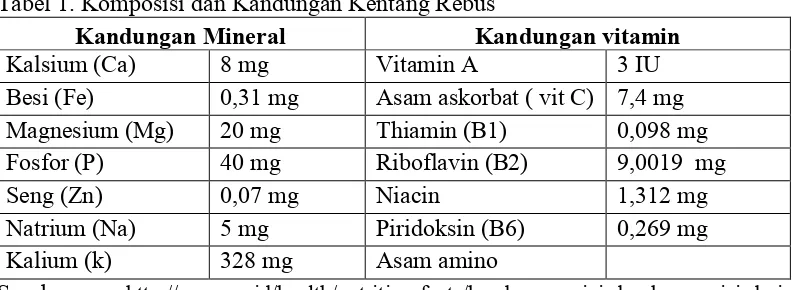
Tabel 1. Komposisi dan Kandungan Kentang Rebus
Kandungan Mineral Kandungan vitamin
Kalsium (Ca) 8 mg Vitamin A 3 IU
Besi (Fe) 0,31 mg Asam askorbat ( vit C) 7,4 mg Magnesium (Mg) 20 mg Thiamin (B1) 0,098 mg Fosfor (P) 40 mg Riboflavin (B2) 9,0019 mg
Seng (Zn) 0,07 mg Niacin 1,312 mg
Natrium (Na) 5 mg Piridoksin (B6) 0,269 mg Kalium (k) 328 mg Asam amino
Sumber: http://asgar.or.id/health/nutrition-facts/kandungan-gizi-dan-komposisi-dari-kentang-rebus-tanpa-garam.
Nutrisi yang terdapat pada air rebusan kentang dapat dimanfaatkan sebagai
sumber nutrisi pada medium tumbuh karena mengandung unsur hara diantaranya
adalah asam amino dan fosfor serta Tiamin (vitamin B1). Asam amino berfungsi
untuk pertumbuhan dan diferensiasi kalus, selain itu unsur fosfor yang diberikan
dalam jumlah tinggi berpengaruh terhadap penambahan jumlah akar, sedangkan
Tiamin berfungsi untuk mempercepat pembelahan sel pada meristem akar dan
karbohidrat (Salisbury dan Ross, 1995). Air rebusan kentang yang
dikombinasikan dengan zat pengatur tumbuh dalam medium kultur diketahui
meningkatkan pertumbuhan kultur anther pada tanaman gandum, serealia dan
anggrek (Thorpe et al., 2008 dalam Molnar et al., 2011).
Penggunaan medium WPM sebagai medium dasar dalam penelitian ini
didasarkan pada jenis tanaman yang dikulturkan. Tanaman berkayu sering
mengeluarkan ekskresi yang mungkin menyebabkan racun terhadap medium
tanam, sehingga mengganggu pertumbuhan dan perkembangan kultur. Penelitian
multiplikasi jeruk (Citrus nobilis L.) yang dilakukan Miryam et al. (2008)
menunjukkan bahwa penggunaan medium WPM dengan kombinasi Benzil Amino
Purin (BAP) dan Naphtalene Asetic Acid (NAA) menghasilkan persentase hidup
eksplan sebesar 82,42%. Sementara penelitian yang dilakukan oleh Qosim (2006)
melaporkan bahwa penggunaan WPM dengan penambahan BAP menghasilkan
regenerasi tunas pada kultur kalus nodular manggis (Garcinia mangostana L).
Berdasarkan hasil penelitian Mohammad (2014) dengan kombinasi ZPT terhadap
tunas apikal jati terbanyak diperoleh dari medium dengan pemberian BAP 1,0
mg/L dan NAA 0,05 mg/L yakni 1 tunas per eksplan. Sedangkan tunas apikal Jati
akan efektif apabila dikulturkan padamedium WPM dengan penambahan BAP 1,0
mg/L dan NAA 0,05 mg/L. Sementara hasil penelitian Imanudin dkk. (2015)
dengan penambahan air rebusan kentang 300 ml/l pada medium WPM mampu
mengiduksi kalus pada eksplan Jati Emas (Cordia subcordata) 23,60 HST dan
diameter kalus mencapai 4,640 cm dengan konsentrasi 300ml/l dengan
D. Zat Pengatur Tumbuh (ZPT)
Zat pengatur tumbuh adalah senyawa yang umumnya aktif pada
konsentrasi yang sangat rendah dan dihasilkan dalam tubuh tanaman. Dewasa ini
ZPT bisa diproduksi secara buatan dengan fungsi yang sama. Ada beberapa
kelompok zat pengatur tumbuh yaitu: auksin, sitokinin, giberilin, etilen dan asam
absisik. Auksin dan sitokinin adalah senyawa yang paling penting untuk
pertumbuhan kultur in vitro. George dan Sherrington (1984) menyatakan bahwa
untuk proses caulogenesis atau rhizogenesis, morfogenesis akar dan tunas dari
kultur kalus biasanya dibutuhkan imbangan taraf zat pengatur tumbuh auksin dan
sitokinin. Auksin yang paling sering digunakan untuk menginisiasi pembentukan
kalus adalah jenis NAA, sedang untuk jenis sitokinin bisa dipakai kinetin atau
BAP.
Zat pengatur tumbuh yang banyak digunakan adalah auksin dan sitokinin.
Golongan auksin dan sitokinin akan mempengaruhi respon eksplan yang
dikulturkan. Proporsi yang relatif tinggi dari auksin terhadap sitokinin
menyebabkan diferensiasi mengarah pada pertumbuhan akar dan jika sitokinin
lebih tinggi dari auksin maka in vitro akan terdiferensiasi ke arah pertumbuhan
tunas. Dalam percobaan kultur in vitro jenis auksin dan sitokinin yang digunakan
adalah NAA dan BAP karena kedua zat pengatur tumbuh tersebut relatif tahan
terhadap degradasi, sedangkan medium yang banyak dipakai adalah medium MS
(George and Sherrington, 1984).
Rahayu (1993) menggunakan potongan kotiledon yang berasal dari kultur
pada penambahan BAP 0,1 mg/l dengan kombinasi 0,1 mg/l NAA, namun
persentase tunas yang muncul adalah paling kecil. Sementara kalus lebih sedikit
muncul pada penambahan 10 mg/l BAP dan 1,0 mg/l NAA, tapi inisiasi tunas
adalah maksimum. Perlakuan BAP 0,5 mg/l dan NAA 0,1 mg/l memberikan
jumlah tunas total terbanyak pada medium MS dengan eksplan yang berasal dari
epikotil jeruk (Troyer Citrange) yang dikecambahkan secara in vitro.
Hasil penelitian kultur in vitro Jati menunjukkan bahwa penambahan 1
mg/l BAP dan 1 mg/l Kinetin ke dalam medium MS menghasilkan persentase
pertumbuhan kalus sebesar 23,64% dan tunas sebesar 12,79% dari eksplan ujung
apikal tanaman Jati (Lina dkk, 2013). Sementara multiplikasi tunas Jati telah
berhasil dilakukan dengan mengkulturkan eksplan biji Jati dalam medium MS
yang mengandung 22,2 µM BAP dan 11,62 µM Kinetin (Yosadha et al., 2005).
E. Hipotesis
Penambahan Air rebusan kentang ( Solanum tuberesum L) 300 ml/l
dengan kombinasi BAP 1,5 ml/l + NAA 0,3 ml/l diduga dapat meningkatkan
III. TATACARA PENELITIAN
A. Tempat dan Waktu Penelitian
Penelitian dilaksanakan di Laboratorium Kultur In Vitro Fakultas Pertanian
Universitas Muhammadiyah Yogyakarta pada bulan Februari-April 2016.
B. Bahan dan Alat Penelitian
Bahan yang digunakan berupa Air rebusan kentang, kalus Jati dan medium
WPM.
Alat penelitan yang digunakan meliputi: alat sterilisasi seperti, lampu
Bunsen, Autoklaf, alat inokulasi seperti LAF, pinset, plastik wrap, lampu bunsen,
alumunium foil, alat pengukur yaitu pH stik, gelas ukur, pipet ukur, timbangan
analitik dan peralatan glassware.
C. Metode Penelitian
Penelitian ini menggunakan rancangan acak lengkap (RAL) dengan faktor
tunggal terdiri dari lima perlakuan yaitu konsentrasi air rebusan kentang (K)
dalam medium WPM yang mengandun BAP,0,5; 1,0; 1,5; 2,0; 2,5 mg/l dan NAA
0,1; 0,2; 0,3; 0,4; 0,5 mg/l. Masing-masing perlakuan diulang sebanyak 10 kali,
sehingga didapat 50 unit percobaan. Adapun perlakuan yang diuji sebagai berikut :
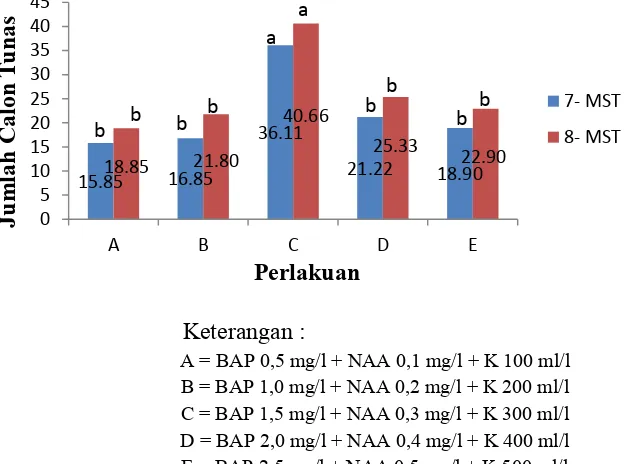
A = BAP 0,5 mg/l + NAA 0,1 mg/l + K 100 ml/l.
B = BAP 1,0 mg/l + NAA 0,2 mg/l + K 200 ml/l.
C = BAP 1,5 mg/l + NAA 0,3 mg/l + K 300 ml/l.
D = BAP 2,0 mg/l + NAA 0,4 mg/l + K 400 ml/l.
D. Cara Penelitian
1. Tahapan Penelitian
Penelitian ini terdiri atas beberapa tahapan yaitu: (1) Persiapan alat dan
bahan, (2) Pembuatan medium, (3) Homogenisasi Eksplan, (4) Induksi tunas
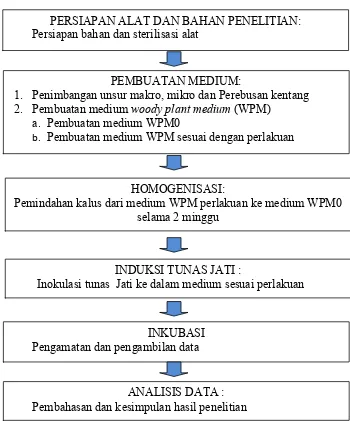
Jati, (5) Inkubasi, (6) Analisis data (Gambar 1).
Gambar 1. Tahapan Pengujian Efektivitas Air Rebusan Kentang untuk Induksi Tunas Jati Emas Secara In Vitro.
PERSIAPAN ALAT DAN BAHAN PENELITIAN: Persiapan bahan dan sterilisasi alat
INDUKSI TUNAS JATI :
Inokulasi tunas Jati ke dalam medium sesuai perlakuan PEMBUATAN MEDIUM:
1. Penimbangan unsur makro, mikro dan Perebusan kentang 2. Pembuatan medium woody plant medium (WPM)
a. Pembuatan medium WPM0
b. Pembuatan medium WPM sesuai dengan perlakuan
INKUBASI Pengamatan dan pengambilan data
ANALISIS DATA : Pembahasan dan kesimpulan hasil penelitian
HOMOGENISASI:
2. Persiapan Alat dan Bahan
Bahan yang digunakan dalam penelitian terdiri dari : Eksplan berupa
kalus Jati dari hasil penelitian sebelumya ; medium inokulasi berupa medium
WPM, Air rebusan kentang, BAP, NAA. Alat-alat yang digunakan meliputi :
Laminar Air Flow cabinet, lampu Bunsen, autoklaf, pinset, plastik wrap,
lampu bunsen, alumuniumfoil, pH stik, gelas ukur, pipet ukur, timbangan
analitik, dan peralatan glassware (lampiran 7 Gambar 1).
Sterilisasi alat-alat berupa glassware yang akan digunakan untuk
inokulasi eksplan dilakukan menggunakan autoklaf pada tekanan 1 atm dan
suhu 1210 C selama 20 menit sedangkan sterilisasi bakar dilakukan pada
peralatan dissecting kits (Pinset, gunting dan skalpel) di dalam LAF dengan
cara mencelupkan alat pada alkohol 70% dan membakarnya di atas bunsen
sebelum digunakan. Sterilisasi LAF dilakukan sebelum sterilisasi basah dan
bakar dimulai, dengan menyalakan lampu UV selama 15 menit.
3. Pembuatan Medium
Medium yang digunakan dalam penelitian ini adalah medium WPM.
Pembuatan medium diawali dengan penimbangan komposisi medium Makro,
mikro, ZPT, agar, sukrosa dan perebusan kentang. Air rebusan kentang
didapatkan dengan merebus kentang yang telah dikupas terlebih dahulu dan di
potong-potong menjadi bagian kecil dengan perbandingan kentang yaitu 1:1
(1 Liter aquades, 1 kg kentang), kemudian kentang direbus dan diambil airnya
tanpa disaring (lampiran 3 dan Gambar 2). Bahan yang digunakan terdiri dari
medium WPM. Semua bahan tersebut ditimbang terlebih dahulu sesuai
takaran berdasarkan perlakuan. Bahan-bahan tersebut dicampur dengan
menambahkan zat pengatur tumbuh BAP dan NAA sesuai perlakuan
kemudian diencerkan dengan aquades sampai campuran bahan-bahan
mencapai 400 ml. Kemudian ditambahkan sukrosa sebanyak 30 g/l. Agar
campuran tersebut merata, diaduk sampai homogen, selanjutnya yaitu
pengukuran pH larutan. pH larutan disesuaikan menjadi 6 yaitu dengan
penambahan NaOH 1 N untuk menaikkan pH atau HCl 1 N untuk
menurunkan pH. Apabila pH telah sesuai, maka pada larutan ditambahkan
bahan pemadat medium, yaitu agar-agar sebanyak 3g/l dan ditunggu sampai
mendidih. Setelah mendidih, larutan dituangkan ke botol-botol kultur, kurang
lebih 20 ml setiap botolnya. (Lampiran 7 Gambar 4).
Botol ditutup dengan plastik PP, kemudian dilakukan sterilisasi dengan
cara autoclave pada suhu 1210 C, pada tekanan 1 atm selama 30 menit.
Kemudian, botol diangkat dari autoclave, tutup dirapatkan dan didinginkan
agar medium menjadi padat. Botol-botol kultur berisi medium selanjutnya
disimpan pada rak-rak kultur.
4. Persiapan Eksplan
Eksplan yang digunakan dalam penelitian ini adalah kalus Jati dari
hasil penelitian sebelumnya, persiapan yang dilakukan sebagai berikut:
a. Homogenisasi
Homogenisasi eksplan dilakukan dengan cara memindahkan eksplan
minimal dua (2) minggu sebelum dipindahkan ke medium yang diberi
perlakuan. Tujuan dari homogenisasi adalah untuk menyeragamkan eksplan
terlebih dahulu sebelum dipindahkan ke medium perlakuan dengan taraf
konsentrasi yang berbeda, sehingga diharapkan efek dari perlakuan
sebelumnya tidak berpengaruh terhadap pertumbuhan eksplan pada
perlakuan yang berbeda.
b. Induksi Tunas
Induksi kalus dilakukan dengan memacu pembelahan sel secara
terus-menerus menggunakan zat pengatur tumbuh, kalus selanjutnya akan
beregenerasi melalui organogenesis hingga menjadi tanaman baru, induksi
tunas dilakukan dengan memindahkan kalus dari medium homogenisasi
(WPM0) ke dalam medium perlakuan dengan berat kalus yang sama 0,5
gram per botol kultur ( Lampiran 7 gambar 3 ).
E. Parameter Pengamatan
1. Persentase Eksplan Hidup (%)
Jumlah eksplan yang hidup dihitung setiap minggu. Kriteria eksplan
hidup apabila warna hijau atau tumbuh tunas pada eksplan .
Rumus:
% eksplan hidup
=
2. Persentase Eksplan Kontaminasi (%)
Eksplan yang terkontaminasi dihitung setiap minggu, eksplan dikatakan
Rumus:
3. Persentase Eksplan Browning (%)
Eksplan yang mengalami pencoklatan/Browning dihitung setiap
minggu, kriteria eksplan Browning apabila pencoklatan pada eksplan lebih
dari separuh eksplan.
Rumus :
% eksplan Browning
=
4. Jumlah CalonTunas
Calon tunas dihitung sejak terbentuknya tonjolan-tonolan atau bakal
tunas pada eksplan. Eksplan yang diamati yaitu eksplan telah menunjukan
kemunculan calon tunas dengan dicirikan terbentuknya tonjolan-tonjolan
berwarna hijau pada kalus, pengamatan dilakukan dengan menghitung jumlah
calon tunas yang terbentuk dengan kaca pembesar (Lup).
F. Analisis Data
Setelah data hasil penelitian diperoleh, kemudian dilakukan analisis
menggunakan sidik ragam (Analysis of variance) dengan software SAS, bila ada
beda nyata antar perlakuan maka dilakukan uji lanjut dengan menggunakan uji
DMRT (Duncan’s Multiple Range Test) dengan taraf 5%. Hasil analisis data
IV. HASIL ANALISIS DAN PEMBAHASAN
Keberhasilan suatu penelitian kultur in vitro dipengaruhi oleh eksplan yang
hidup, terkontaminasi dan eksplan Browning. Gejala kontaminasi yang timbul
dapat dicirikan dengan adanya koloni-koloni bakteri maupun spora jamur pada
permukaan medium atau permukaan eksplan dengan warna putih abu-abu atau
kehitaman dan berwarna merah muda. Kontaminasi jamur umumnya baru terlihat
pada 1-2 minggu setelah tanam (MST). Pengamatan kontaminasi eksplan meliputi
kontaminasi bakteri dan jamur, sedangkan eksplan Browning yaitu terjadinya
pencoklatan pada eksplan dipengaruhi oleh senyawa fenol yang dikeluarkan oleh
eksplan. Jumlah eksplan yang hidup dicirikan eksplan berwarna hijau atau
terbentuknya kalus maupun tunas. Hasil pengamatan terhadap persentase eksplan
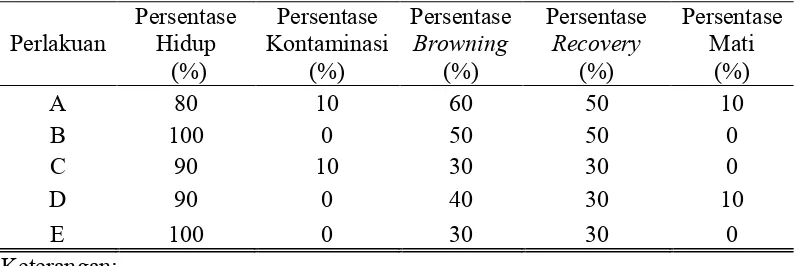
hidup, kontaminasi dan Browning dapat dilihat pada tabel 1.
Tabel 1. Pengaruh Air Rebusan Kentang, BAP dan NAA terhadap Persentase Eksplan Hidup, Kontaminasi, Browning, Recovery dan Eksplan Mati Tanaman Jati Emas pada minggu ke-8.
A. Persentase Eksplan Hidup
Persentase eksplan hidup merupakan kemampuan suatu eksplan untuk
tumbuh dan berkembang dalam kultur in vitro. Persentase eksplan hidup dapat
dipengaruhi oleh persentase eksplan kontaminasi dan Browning, tujuan
pengamatan persentase eksplan hidup adalah untuk mengetahui seberapa besar
pengaruh sterilisasi eksplan yang digunakan dalam penelitian.
Hasil pengamatan pada tabel 1 menunjukkan pada perlakuan BAP 1,0
mg/l + NAA 0,2 mg/l + K 200 ml/l dan BAP 2,5 mg/l + NAA 0,5 mg/l + K 500
ml/l, persentase eksplan hidup mencapai 100%. Hal tersebut diikuti dengan
jumlah persentase eksplan hidup pada perlakuan BAP 1,5 mg/l + NAA 0,3 mg/l +
K 300 ml/l dan BAP 2,0 mg/l + NAA 0,4 mg/l + K 400 ml/l mencapai 90%,
sementara persentase eksplan hidup terendah pada perlakuan BAP 0,5 mg/l +
NAA 0,1 mg/l + K 100 ml/l sebesar 80 %. Hasil pengamatan jika lebih dari 50 %
persentase eksplan hidup dinyatakan tinggi, hal ini dapat dilihat bahwa dari semua
perlakuan menunjukkan persentase eksplan hidup tinggi mencapai 80 % - 100%.
Tingginya persentase eksplan hidup dikarenakan eksplan yang digunakan
dalam penelitian ini adalah eksplan yang steril dari hasil penelitian sebelumnya,
sehingga tingkat kontaminasi terhadap eksplan rendah, selain itu penggunaan zat
pengatur tumbuh juga dapat mempengaruhi persentase hidup. Hal ini didukung
hasil penelitian Triwari et al., (2002) dengan penggunaan BAP terhadap
persentase hidup eksplan Jati dengan perlakuan BAP 22,2 µm mencapai 76,8 %.
Tingginya persentase eksplan hidup juga disebabkan oleh komposisi zat dalam
menyatakan bahwa kemampuan hidup eksplan pada kultur in vitro sangat
tergantung dari eksplan itu sendiri, jenis dan komposisi medium sangat
mempengaruhi besarnya daya tahan eksplan untuk hidup pada medium tersebut.
Selain itu diduga penggunaan medium WPM untuk induksi tunas Jati Emas
mampu memberikan persentase eksplan hidup yang cukup tinggi, dikarenakan
medium WPM secara umum biasa digunakan dalam kultur in vitro pada berbagai
jenis tanaman berkayu. Menurut Pardal et al. (2004) medium WPM banyak
digunakan pada berbagai spesies tanaman berkayu, karena memiliki kandungan
total ion yang rendah, tetapi kandungan sulfatnya tinggi. Unsur makro yang
terdapat pada medium WPM seperti unsur magnesium yang tinggi sangat
mendukung dalam pertumbuhan in vitro tanaman. Wetherell (1982) juga
menyatakan di dalam medium terkandung mineral, gula, vitamin dan hormon
dengan perbandingan yang dibutuhkan secara tepat.
Kultur in vitro merupakan budidaya secara heterotrof, dimana sel tidak
dapat melakukan fotosintesis untuk menghasilkan karbon seperti halnya tanaman
autotrof, sehingga sumber karbon harus diperoleh dalam bentuk karbohidrat yang
ditambahkan dari luar, sehingga gula merupakan sumber karbon. Jika tidak ada
sukrosa, maka aktivitas dan pertumbuhan kalus tidak dapat berlangsung dan pada
akhirnya sel-sel tersebut akan mati, karena tidak ada sumber energi (Campbell et
al., 2003). Hasil pengamatan terhadap persentase eksplan hidup yang diamati
selama 8 minggu, persentase eksplan hidup minggu 1 dan 2 pada semua perlakuan
menunjukkan persentase eksplan hidup mencapai 100%, tetapi pada minggu ke-3
ml/l. Penurunan persentase eksplan hidup ini disebabkan oleh kontaminasi pada
eksplan yang bersifat endogen, hal ini dicirikan dengan terjadinya kontaminasi
pada minggu ke-3. Menurut Santoso dan Nursandi (2004) kontaminasi yang
bersifat endogen atau internal yang terdapat dalam eksplan responnya muncul
setelah beberapa hari bahkan sampai satu bulan. Penurunan persentase eksplan
hidup tidak hanya dipengaruhi oleh mikroorganisme, penurunan persentase hidup
pada eksplan juga dapat dipengeruhi oleh kematian eksplan akibat senyawa fenol
yang dikeluarkan oleh ekspan terlihat pada minggu ke-6, diikuti dengan
penurunan persentase eksplan hidup pada perlakuan BAP 1,5 mg/l + NAA 0,3
mg/l + K 300 ml/l pada minggu ke- 4. Denish (2007) mengungkapkan apabila
pencoklatan dibiarkan terus-menerus maka penyerapan unsur hara oleh eksplan
akan terhambat, sehingga pertumbuhan eksplan juga terhambat bahkan dapat
menyebabkan kematian.
Penurunan persentase eksplan hidup pada perlakuan BAP 2,0 mg/l + NAA
0,4 mg/l + K 400 ml/l, terjadi bukan disebabkan kontaminasi oleh
mikroorganisme melainkan terjadinya penurunan persentase eksplan hidup pada
minggu ke-4 karena eksplan mengalami kematian akibat pengeluaran senyawa
fenol oleh eksplan yang bersifat toksik, sehingga menyebabkan kematian pada
eksplan, sementara pada minggu ke-5 sampai minggu ke-8 persentase eksplan
hidup konstan tidak terjadi kontaminasi maupun mati akibat senyawa fenol yang
dikeluarkan oleh eksplan. Sari dkk, (2013) mengungkapkan bahwa akumulasi
senyawa fenol pada eksplan tersebut dapat menghambat, bahkan bersifat toksik
B. Persentase Eksplan Kontaminasi
Pengamatan eksplan kontaminasi bertujuan untuk mengetahui tingkat
keberhasilan sterilisasi baik eksplan, alat maupun medium. Persentase eksplan
kontaminasi dapat dilihat dengan adanya bakteri dan jamur yang tumbuh di
permukaan eksplan maupun medium. Mencegah dan menghindari kontaminasi
merupakan hal yang mutlak dilakukan pada seluruh rangkaian percobaan dalam
kultur in vitro, karena lingkungan yang aseptik harus selalu dijaga.
Hasil dari tabel 1 menunjukkan bahwa pada perlakuan BAP 1,0 mg/l +
NAA 0,2 mg/l + K 200 ml/l ;, BAP 2,0 mg/l + NAA 0,4 mg/l + K 400 ml/l dan
BAP 2,5 mg/l + NAA 0,5 mg/l + K 500 ml/l persentase eksplan mencapai 0 %,
sementara pada perlakuan BAP 0,5 mg/l + NAA 0,1 mg/l + K 100 ml/l, dan BAP
1,5 mg/l + NAA 0,3 mg/l + K 300 ml/l mencapai 10%. Kontaminasi diakibatkan
oleh mikroorganisme yaitu jamur dan bakteri, kontaminasi yang diakibatkan
bakteri dicirikan dengan timbulnya lendir pada permukaan medium maupun di
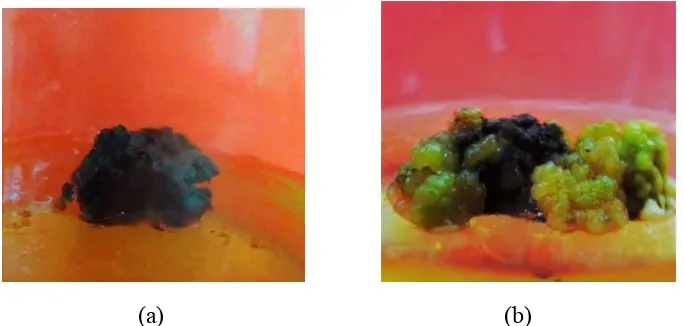
permukaan eksplan (Gambar2.a), sedangkan kontaminasi yang disebabkan oleh
jamur dicirikan dengan tumbuhnya miselium jamur pada permukaan medium
maupun eksplan dengan warna putih keabu-abuan, sehingga miselium jamur
menyelimuti eksplan dan terjadi kematian pada eksplan (Gambar 2.b). Sumber
kontaminasi pada eksplan dapat dipengaruhi oleh tingkat sterilisasi eksplan, alat
yang digunakan serta kontaminasi yang bersifat endogen atau internal. Menurut
Ermayanti (1997) sumber kontaminasi berasal dari mikroorganisme yang tumbuh
pada material tanaman yang dibiakkan, serta alat-alat yang digunakan. Ciri-ciri
(a) (b)
Gambar 1. (a) Eksplan Kalus Jati Kontaminasi Bakteri 2 MST dan (b) Kontaminasi Jamur 3 MST.
Eksplan yang terkontaminasi hanya dapat bertahan hidup sampai beberapa
hari setelah kontaminan menyebar ke seluruh permukaan eksplan dan medium.
Matinya eksplan disebabkan adanya persaingan antara eksplan dengan
kontaminan dalam penyerapan unsur hara. Mengingat eksplan maupun
kontaminan memerlukan suplai makanan berupa glukosa untuk dapat tumbuh dan
berkembang.
Kontaminasi dalam kultur in vitro adalah segala bentuk organisme atau
mikroorganisme lain yang tumbuh pada medium biakan in vitro di lingkungan
aseptik. Sumber kontaminan bisa berasal dari mikroorgansime yang tumbuh pada
material tanaman yang dibiakkan, alat-alat yang digunakan, dan lingkungan
tempat penyimpanan biakan di ruang inkubasi. Kontaminan seringkali tumbuh
lebih cepat dari in vitro yang sengaja ditumbuhkan sehingga akan terjadi
kompetisi penyerapan nutrien antara kontaminan dan in vitro yang sengaja
dapat menyebabkan kematian pada eksplan yang dikulturkan. Pengamatan
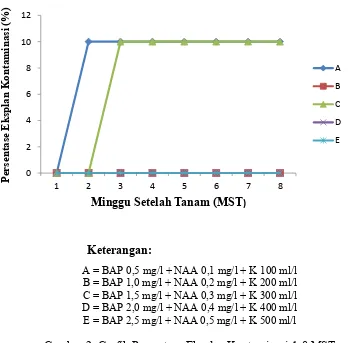
Persentase Eksplan Kontaminasi setiap minggu disajikan pada Gambar 3.
Keterangan:
Gambar 2. Grafik Persentase Eksplan Kontaminasi 1-8 MST
Hasil pengamatan terhadap persentase eksplan kontaminasi yang diamati
selama 8 minggu pada gambar 3 menunjukkan bahwa persentase eksplan
kontaminasi pada minggu 1 semua perlakuan mencapai 0 %. Kontaminasi mulai
terjadi pada minggu ke-2 pada perlakuan BAP 0,5 mg/l + NAA 0,1 mg/l + K 100
mg/l + NAA 0,4 mg/l + K 400 ml/l dan BAP 2,5 mg/l + NAA 0,5 mg/l + K 500
ml/l persentase eksplan kontaminasi sebesar 0 %.
Kontaminasi pada minggu ke-2 diakibatkan oleh bakteri dengan ciri-ciri
lendir berwarna kuning maupun merah muda. Kontaminasi bakteri dapat diketahui
dengan terlihatnya lapisan seperti lendir yang membentuk koloni-koloni di sekitar
bawah eksplan, serta di tepi medium dengan koloni bakteri yang berwarna
kekuning-kuningan. Ciri-ciri eksplan terkontaminasi oleh jamur pada minggu
ke-3, kontaminasi akibat jamur pertumbuhannya lebih cepat dibandingkan dengan
bakteri, hal ini disebabkan dalam medium terdapat nutrisi yang cukup untuk
pertumbuhan jamur,tumbuhnya miselium jamur pada permukaan medium maupun
eksplan dengan warna putih keabu-abuan, sehingga miselium jamur menyelimuti
eksplan dan terjadi kematian pada eksplan.
Bidwell (1979) mengungkapkan bahwa sifat spora jamur yang kecil dan
ringan membuatnya mudah terbawa oleh aliran udara. Kontaminasi yang terjadi
bersifat endogen ditunjukkan dengan kontaminasi muncul pada minggu ke-2 dan
ke-3. Menurut Andriyani (2005) kontaminan endogen yang berada dalam in vitro
tanaman muncul satu minggu setelah inokulasi, sedangkan menurut Santoso dan
Nursandi (2003) bakteri internal yang terdapat dalam eksplan, responnya muncul
setelah beberapa hari bahkan sampai satu bulan. Mikroorganisme dapat
mensekresikan senyawa tertentu yang bersifat toksik pada medium tumbuh
C. Persentase Eksplan Browning
Pencoklatan atau Browning merupakan suatu karakter munculnya warna
coklat atau hitam yang mengakibatkan tidak terjadinya pertumbuhan dan
perkembangan eksplan. Selain itu Browning juga timbul karena adanya senyawa
fenol yang dikeluarkan akibat pemotongan atau pelukaan pada eksplan.
Hasil pengamatan persentase Browning pada Tabel 1 menunjukkan bahwa
terjadinya pencoklatan eksplan pada minggu ke-2 setelah inokulasi sebesar 60 %
pada perlakuan BAP 0,5 mg/l + NAA 0,1 mg/l + K 100 ml/l dan pada perlakuan
BAP 1,0 mg/l + NAA 0,2 mg/l + K 200 ml/l, mencapai 50%, sementara pada
perlakuan BAP 2,0 mg/l + NAA 0,3 mg/l + K 400 ml/l mencapai 40%.
Pengamatan persentase eksplan mengalami pencoklatan diakibatkan oleh senyawa
fenol yang dikeluarkan eksplan. Sementara persentase eksplan Browning yang
terendah pada perlakuan BAP 1,5 mg/l + NAA 0,4 mg/l + K 300 ml/l dan BAP
2,5 mg/l + NAA 0,4 mg/l + K 500 ml/l sebesar 30 %. Tingginya persentase
eksplan Browning diakibatkan oleh proses biologis tanaman yang mengeluarkan
senyawa berupa senyawa fenol. Pengeluaran senyawa fenol tinggi dapat
mengakibatkan kematian pada eksplan. Senyawa fenol merupakan enzim
polifenol oksidase dan tirosinase, dalam kondisi oksidatif akibat pelukaan enzim
secara alami disintesis oleh eksplan dimana saat sel rusak isi dari sitoplasma dan
vakuola menjadi tercampur, kemudian senyawa fenol akan teroksidasi yang
bersifat racun dan dapat merusak in vitro tanaman (Laukkanen et al., 1999).
Santoso dan Nursandi (2003) mengungkapkan bahwa terjadinya pencoklatan
atau biokimia seperti pengupasan, memar, pemotongan, serangan penyakit dan
kondisi yang tidak normal. Sementara rendahnya persentase Browning pada
eksplan diduga akibat respon eksplan terhadap senyawa atau zat pengatur tumbuh
yang diberikan dapat mendorong pertumbuhan mengarah pada pembelahan sel
sehingga eksplan dapat pulih kembali setelah perlakuan fisik berupa pemotongan
eksplan. Hasil pengamatan persentase Browning setiap minggu disajikan pada
gambar 4.
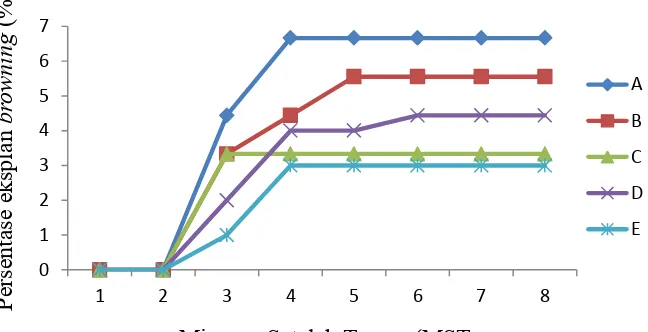
Gambar 3. Grafik Persentase Eksplan Browning1-8 MST
Hasil pengamatan terhadap persentase eksplan Browning yang diamati
selama 8 minggu, menunjukkan bahwa persentase eksplan Browning semua
perlakuan pada minggu pertama mencapai 0 %. Pencoklatan pada eksplan mulai
0
Minggu Setelah Tanam (MST)
A
B
C
D
terlihat pada minggu ke-2. Gambar 4 menunjukkan bahwa persentase eksplan
Browning pada perlakuan BAP 0,5 mg/l + NAA 0,1 mg/l + K 100 ml/l mencapai
60 % sampai minggu ke- 4, sementara pada perlakuan BAP 1,0 mg/l + NAA 0,2
mg/l + K 200 ml/l persentase Browning 50 % sampai minggu ke- 5 dan diikuti
persentase eksplan Browning pada perlakuan BAP 2,0 mg/l + NAA 0,4 mg/l + K
400 ml/l mencapai 40 % sampai minggu ke-6, sedangkan laju eksplan Browning
terendah pada perlakuan BAP 1,5 mg/l + NAA 0,3 mg/l + K 300 ml/l dan BAP
2,5 mg/l + NAA 0,5 mg/l + K 500 ml/l mencapai 30 % hanya sampai minggu ke-3
dan 4 (Gambar 4). Peningkatan laju persentase Browning disebabkan oleh
meningkatnya produksi senyawa fenol yang diikuti oleh aktivitas oksidasi
senyawa fenol sehingga terjadi pencoklatan pada eksplan (Prawiranata dkk. 1995).
Pencoklatan yang terjadi tidak selalu mengakibatkan kematian pada eksplan
sebagaimana terlihat pada gambar 5.
(a) (b)
Gambar 4. (a) Persentase Eksplan Browning dan (b) Persentase Eksplan Recovery
Hasil pengamatan menunjukkan bahwa beberapa eksplan dapat tumbuh
kembali setelah mengalami pencoklatan atau recovery. Recovery merupakan
sebagaimana terlihat pada gambar (5.b). Sebaliknya beberapa eksplan yang
mengalami pencoklatan atau Browning tidak mengalami recovery atau mati
(Gambar 5.a).
Hasil pengamatan menunjukkan perlakuan yang mengalami recovery dari
Browning yaitu BAP 0,5 mg/l + NAA 0,1 mg/l + K 100 ml/l sebesar 50 % dan
BAP 1,0 mg/l + NAA 0,2 mg/l + K 200 ml/l terjadi recovery sebesar 50 % dari
eksplan yang Browning. Sementara perlakuan BAP 1,5 mg/l + NAA 0,3 mg/l + K
300 ml/l, perlakuan BAP 2,0 mg/l + NAA 0,4 mg/l + K 400 ml/l dan BAP 2,5
mg/l + NAA 0,5 mg/l + K 500 ml/l terdapat 30 % eksplan mengalami recovery
dari keseluruhan eksplan yang mengalami pencoklatan (Browning). Recovery
dimungkinkan bahwa eksplan telah mampu beradaptasi dan dapat menyerap
nutrisi yang terdapat dalam medium, eksplan yang mengalami recovery
mengalami perubahan dari sebelumnya yaitu dengan terbentuknya kalus baru hasil
dari diferensiasi pembelahan sel baru, hal ini didukung oleh Andriyani (2005)
bahwa recovery terjadi karena eksplan telah mampu beradaptasi dengan medium
tumbuh dan ZPT yang cukup tinggi.
Pierik (1987) mengungkapkan bahwa sel-sel yang telah terdiferensiasi
menjadi hidup kembali, hal ini disebabkan eksplan sebenarnya tidak mati namun
karena adanya air, nutrisi, dan zat pengatur tumbuh pada medium maka eksplan
mengalami imbibisi dan terjadi metabolisme sel sehingga eksplan yang awalnya
D. Jumlah CalonTunas
Pembentukan tunas merupakan salah satu faktor penting di dalam
perbanyakan tanaman dengan metode kultur in vitro. Hasil pengamatan
menunjukkan pada minggu ke-1 sampai 6 calon tunas belum muncul pada semua
perlakuan. Munculnya calon tunas terbentuk mulai pada minggu ke-7 dicirikan
dengan terbentuknya tonjolan-tonjolan warna hijau pada eksplan. Pengamatan
jumlah calon tunas pada eksplan Jati Emas disajikan pada gambar 6.
Keterangan :
Gambar 5. Pengaruh Air Rebusan Kentang, BAP dan NAA terhadap Jumlah Calon Tunas Jati Emas pada 7 dan 8 MST
Hasil analisis sidik ragam pada minggu ke-6 dan 7 menunjukkan adanya
beda nyata terhadap jumlah calon tunas Jati Emas ( Lampiran 5, Tabel Anova).
Pembentukan calon tunas pada kalus Jati Emas pada perlakuan BAP 1,5 mg/l +
NAA 0,3 mg/l+ K 300 ml/l minggu ke-7 mencapai 36,11 calon tunas, sedangkan
pembentukan calon tunas pada minggu ke-8 mencapai 40,66 calon tunas (Gambar
6 dan Lampiran 6). Jumlah calon tunas tertinggi pada perlakuan BAP 1,5 mg/l +
NAA 0,3 mg/l + K 300 ml/l baik pada minggu ke-7 maupun ke-8. Hal ini
menunjukkan bahwa eksplan mampu merespon zat organik kompleks berupa air
rebusan kentang dengan kombinasi BAP dan NAA ke dalam medium. Sumardi
(1996), menyatakan bahwa auksin dan sitokinin bekerja bersama-sama dalam
menciptakan kondisi optimum untuk pertumbuhan ekspan dan mendorong
pembentukan tunas maupun akar.
Manfaat dari hormon sitokinin ini diantaranya adalah untuk mempercepat
pertumbuhan tunas, mempercepat penambahan jumlah daun, memperbanyak
anakan, dan menghambat penuaan organ tanaman. Wetherell (1992) menyatakan
bahwa sitokinin mempunyai peran yang penting untuk propagasi secara in vitro,
yaitu mendorong pembelahan sel dalam in vitro eksplan dan mendorong
pertumbuhan tunas. Wareing dan Phillips (1970) mengemukakan bahwa sitokinin
merangsang pembelahan sel tanaman dan berinteraksi dengan auksin dalam
menentukan arah diferensiasi sel.
Peambahan NAA sejenis hormon auksin berfungsi untuk merangsang
pemanjangan sel karena auksin terdapat pada pucuk-pucuk tunas muda atau pada
in vitro meristem di pucuk, menyebar luas ke dalam seluruh tubuh tanaman.
Penyebarluasan auksin ini arahnya dari atas ke bawah hingga sampai pada titik
tumbuh akar, melalui in vitro pembuluh tipis (floem) atau in vitro parenkhim
(Hendaryono dan Wijayani, 1994). Mekanisme kerja auksin salah satunya adalah
akar dikarenakan dapat menginduksi sekresi ion H+ keluar melalui dinding sel,
pengasaman dinding sel menyebabkan K+ diambil dan pengambilan ini
mengurangi potensial air dalam sel. Akibatnya air masuk ke dalam sel juga
mendorong enzim sellulase memotong-motong ikatan selulosa pada dinding
primer hingga dinding elastis dan sel membesar (Gunawan, 1987) .
Penambahan air rebusan kentang sebagai bahan organik yang banyak
mengandung hara berperan baik bagi pertumbuhan tanaman secara in vitro.
Vitamin yang terkandung dalam Air rebusan kentang dapat membantu dalam
pertumbuhan tanaman secara in vitro. Hal ini dikarenakan sel bagian tanaman
yang dikulturkan belum mampu membuat vitamin sendiri untuk kehidupannya,
sehingga air rebusan kentang yang mengandung tiamin (vitamin B1), piridoksin
(vitamin B6), riboflavin (vitamin B2) dan vitamin C (asam askorbat), sebagai zat
suplemen untuk mendorong pertumbuhan dan morfogenesis (George dan
Sherrington, 1984). Menurut Wetherell (1992), vitamin berfungsi sebagai
katalisator, stimulator pertumbuhan dan meminimalkan stres eksplan dalam
kultur. Hendaryono dan Wijayani (1994), menambahkan bahwa tiamin adalah
vitamin esensial untuk hampir semua kultur in vitro tanaman. Fungsi tiamin
adalah untuk mempercepat pembelahan sel pada meristem akar dan juga berperan
sebagai koenzim dalam reaksi yang menghasilkan energi dari karbohidrat.
Hasil pengamatan pada perlakuan BAP 0,5 mg/l + NAA 0,1 mg/l + K 100
ml/l; BAP 1,0 mg/l + NAA 0,2 mg/l + K 200 ml/l dan BAP 2,0 mg/l + NAA 0,4
mg/l + K 400 ml/l; BAP 2,5 mg/l + NAA 0,5 mg/l + K 500 ml/l, dengan
jumlah calon tunas cenderung setara (Gambar 6). Menurut Tripepi (1997) hal ini
kemungkinan berhubungan dengan kemampuan sel dalam mencapai batas
optimum, sehingga dengan konsentrasi zat pengatur tumbuh yang optimum dapat
memacu diferensiasi pembentukan tunas. Eksplan mempunyai batas fisiologi
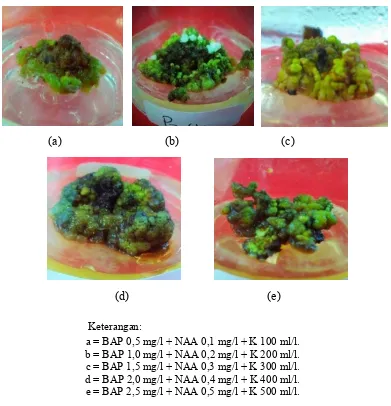
untuk dapat berdiferensiasi dapat dilihat pada gambar 7.
(a) (b) (c)
(d) (e)
Keterangan:
a = BAP 0,5 mg/l + NAA 0,1 mg/l + K 100 ml/l. b = BAP 1,0 mg/l + NAA 0,2 mg/l + K 200 ml/l. c = BAP 1,5 mg/l + NAA 0,3 mg/l + K 300 ml/l. d = BAP 2,0 mg/l + NAA 0,4 mg/l + K 400 ml/l. e = BAP 2,5 mg/l + NAA 0,5 mg/l + K 500 ml/l.
Gambar 6. Pengaruh Air Rebusan Kentang terhadap Jumlah Calon Tunas Jati Emas Minggu ke-8
Hasil pengamatan menunjukkan pada minggu ke-8 lebih terlihat jelas pada
calon tunas ditandai dengan adanya tonjolan-tonjolan berwarna kehijauan pada
eksplan (gambar 7). Perbedaan warna yang terjadi pada kalus menunjukkan
tingkat perkembangan kalus yang berbeda-beda pula, hal ini dipengaruhi oleh
konsentrasi zat pengatur tumbuh yang diberikan pada medium tumbuh. Warna
hijau pada kalus adalah akibat efek sitokinin dalam pembentukan klorofil.
Menurut Wattimena (1992), sitokinin berperan dalam memperlambat proses
senesensi (penuaan) sel dengan menghambat perombakan butir-butir klorofil dan
protein dalam sel. Pada penambahan sitokinin dengan konsentrasi yang semakin
meningkat cenderung menunjukkan warna hijau cerah. Kalus dengan warna yang
hijau tidak hanya dimungkinkan mengandung banyak pigmen klorofil akan tetapi,
kalus yang terbentuk juga memiliki ukuran cukup besar yang menandakan bahwa
kalus beregenerasi dengan baik dan sel-selnya masih aktif membelah dan
memiliki kemampuan untuk membentuk tunas (Lizawati 2012).
Pembentukan calon tunas pertama kali muncul pada eksplan merupakan
hasil dari diferensiasi kalus yang terus membelah dan berkembang sehingga
dengan adanya hormon sitokinin yang seimbang dapat memacu dalam
pembentukan calon tunas pada eksplan Jati Emas. Sitokinin yang sering
digunakan dalam kultur in vitro adalah BAP (Benzyl Amino Purine). BAP adalah
sitokinin yang sering digunakan karena paling efektif untuk merangsang
pembentukan tunas, lebih stabil dan tahan terhadap oksidasi serta paling murah
diantara sitokinin lainnya. Mekanisme kerja sitokinin dipengaruhi oleh
konsentrasi auksin. Sitokinin berperan dalam menghambat pertumbuhan akar
akar lateral melalui sel periskel dan memblok program pengembangan
pembentukan akar lateral sehingga menndorong pembentukan tunas (Santoso dan
Nursandi, 2003). Sitokinin mempunyai peran yang penting untuk propagasi secara
in vitro, yaitu mendorong pembelahan sel in vitro eksplan dan mendorong
pembentukan tunas (Wetherell, 1992).
Pengamatan terhadap parameter jumlah calon tunas bertujuan untuk
mengetahui seberapa besar pengaruh efektifitas BAP dan NAA yang
dikombinasikan dengan air rebusan kentang dengan konsentrasi tertentu untuk
menginduksi tunas pada kalus Jati Emas secara in vitro. Penambahan konsentrasi
BAP lebih dari 2 mg/l dan NAA 0,5 mg/l ke dalam medium mengakibatkan
terjadi penurunan calon tunas, diduga bahwa pemberian nutrisi dan zat pengatur
tumbuh melebihi batas optimum sehingga terjadinya penurunan jumlah calon
tunas (Gambar 7.e). Selain itu diduga bahwa eksplan Jati sudah memiliki senyawa
endogen sehingga eksplan tercukupi. George dan Sherrington (1984) menyatakan
bahwa kemampuan suatu eksplan untuk berdiferensisasi tidak hanya bergantung
pada penambahan sitokinin dan auksin pada medium pertumbuhan tetapi
A. Kesimpulan
1. Pemberian Air Rebusan Kentang pada medium WPM memberikan
pengaruh yang nyata terhadap pertumbuhan Jati Emas secara in vitro
pada perlakuan BAP 1,5 mg/l + NAA 0,3 mg/l dan Air rebusan
kentang 300 ml/l.
2. Konsentrasi BAP 1,5 mg/l + NAA 0,3 mg/l dan 300 ml/l Air rebusan
kentang yang terbaik dalam menginduksi tunas ditunjukkan oleh
jumlah calon tunas pada minggu ke-8 mencapai 40,66 calon tunas.
B. Saran
1. Perlu dilakukan penelitian lebih lanjut mengenai penambahan medium
untuk mengurangi tingkat Browning akibat senyawa fenol yang relatif
tinggi pada kalus Jati Emas.
2. Perlu dilakukan penelitian lebih lanjut untuk mengetahui pertumbuhan
DAFTAR PUSTAKA
1993. Dasar Z.
Abidin, -dasar pengetahuan tentang zat pengatur tumbuh. Angkasa. Bandung. 85 hal.
2005. Pengaruh Macam dan Konsentrasi Auk
Andriyani. sin terhadap Induksi
Kalus Embriogenik Manggis (Garcinia mangostana L.) Asal Biji Secara In Vitro. Skripsi UMY. Tidak Dipublikasikan.
2013. Kandungan Gizi Dan Komposisi Kentang Rebustanpa Garam. Asgar.
ttp://asgar.or.id/health/nutrition-facts/kandungan-gizi-dan-komposisi-dari-kentang-rebus-tanpa-garam. Diakses 27 Mei 20016.
Bidwell, R.G.S., 1979. Plant Physiology. Mac Millan Publishing Co. Inc., New York.
BPS Jateng. 2014. Volume Penjualan Dalam Negeri Beberapa Macam Produksi Hasil Hutan di Jawa Tengah Tahun 2009 - Maret 2014.http://jateng.bps.go.id/webbeta/frontend/linkTabelStatis/view/id/ 1026. Diakses 14 April 2015.
Campbell. N.A, Reece. J.B, and Mitchell. L.W. 2003. Biologi. Alih Bahasa: Wasmen Manalu.. Erlangga. Jakarta.
Daru, M. 1994. Budidaya Tanaman Jati Emas. Kanisus,Yogykarta. Hal 24-30.
Denish A. 2007. Percobaan perbanyakan vegetatif kemaitan (Lunasia amara Blanco) melalui kultur in vitro [skripsi]. Bogor : Fakultas Kehutanan. Institut Pertanian Bogor. Hal. 21-30.
Dixon, R.A. & Gonzales. 1994. Plant cell culture. A Practical Approach. 2nd edition. New York: Oxford University Press. p 230.
Ermayanti, T.M. 1997. Mengenal dan Mengatasi Kontaminan Pada Biak Jaring Tanaman. Warta Biotek XI (3). 4-9.
George, E. F. Dan Sherrington, 1984. Plant Propagation by Tissue Culture. Eastern Press, Reading Berks. 709 p.
Hadi, S. 2013. Pengaruh Penambahan Air Rebusan kentang (Solanum Tuberosum L) Terhadap pertumbuhan Pisang Ambon ( Musa acuminate AAA) dalam teknik kultur in vitro. Program Serjana Pendidikan Biologi. Semarang.
Hendaryono, D. P. S dan A. Wijayani. 1994. Teknik Kultur In vitro, Pengenalan dan Petunjuk Perbanyakan Tanaman Secara Vegetatif-Modern. Kanisius. Yogyakarta. Konservasi Tanaman Jati (Tectona grandis) Secara In Vitro.Universitas Muhammadiyah Yogyakarta.
H, Haggman H, Kontunen
Laukkanen -Soppela S, Hohtola A. 1999. Tissue browning of in vitro cultures of Scots pine: Role of peroxidase and polyphenol oxidase. Physiol. Plant. 106:337-34.
Lina, Evie R, Rahmad W. 2013. Pengaruh BAP dan Kinetin pada Media MS terhadap Pertumbuhan Eksplan Ujung Apikal Tanaman Jati Secara In Vitro. LenteraBio 2 (1): 57-61.
Lizawati, 2012. Induksi Kalus Embriogenik Dari Eksplan Tunas Apikal Tanaman Jarak Pagar (Jatropha curcas L.) Dengan Penggunaan 2,4 D DAN TDZ. 1 (2): 75-80.
Markal, A. Isda, M.N, Fatonah S. 2015. Perbanyakan Anggrek Grammatophyllum scriptum (Lindl.) Bl. Melalui Induksi Tunas Secara In Vitro Dengan Penambahan BAP dan NAA. JOM FMIPA 2 (1):108- 114.
A,
Miryam . Suliansyah I, dan Djamaran A. 2008. Multiplikasi jeruk kacang (Citrusnobilis L.) pada beberapa konsentrasi NAA dan BAP pada medium WPM secara in vitro. Jurnal Agronomi Indonesia 1:97-104.
Mohammad ,W.D.2014. Pengaruh Zat Pengatur Tumbuh BAP dan NAA Terhadap Pertumbuhan Ulin (Eusideroxylon zwageri T. et B.) Secara In Vitr. Depareen Silvikultur fakultas Kehutanan.IPB.
Pardal, S. J., Ika, M., E. G. Lestari., dan Slamet. 2004. Regenerasi Tanaman dan Transformasi Genetik Salak Pondoh untuk Rekayasa Buah partenokarpi. J. Bioteknologi Pertanian. 9 (2) : 49-55.
Pierik, R.I.M.,1987. In vitro Culture of Higher Plant. Marinus nijhoff Publisher. Netherland.213-217p.
Prawiranata W, Said H, Pin T. 1995. Dasar-dasar Fisiologi Tumbuhan. Jilid 2. Departemen Botani Fakultas Matematika dan IPA IPB: Bogor
Qosim. WA. 2006. Studi iradiasi sinar gamma pada kultur kalus nodular manggis untuk meningkatkan keragaman genetik dan morfologi regeneran. disertasi. Pascaserjana IPB. Bogor P:148.
M.S. 1993. Pengaruh
Rahayu, medium, auksin, dan sitokinin terhadap perbanyakan, perbanyakan tunas jeruk Troyer Citrange secara in vitro. Dalam Seminar Program Pascasarjana IPB. Bogor. 74 hal.
Sari YP. 2013. Pengaruh NAA dan BAP terhadap inisisasi tunas pada eksplan nodus tanaman zodia (Evodia suavelones sceff) secara invitro. Bioprospek, 6 (1): 1-11.
Salisbury, F. B. dan C.W. Ross. 1995. Fisiologi Tumbuhan Jilid Tiga Perkembangan Tumbuha dan Fisiologi Lingkungan. Bandung. ITB.
U, F Nursandi. 2003. Kultur
Santoso In vitro Tanaman. Universitas
Muhammadiyah Malang: Malang.
Sumardi. 1996. Penggunaan arang aktif pada beberapa komposisi NAA dan BAP dalam kultur durian (Durio zibethinus Murr.) secara in vitro. Tesis S2. Program Pascasarjana Universitas Andalas. Padang 76 hal.
Tripod.com 2013. Prospek berkebun Jati Emas. http://Jatiemas. tripod. com/id21. htm. Diakses 6 Mei 2015.
Tripepi, R.R. 1997. Adventitious Shoot Regeneration. In R.I. Gereve (eds.) Biotechnology of ornaments plants. USA, CAB. International. p 112 – 121.