PENENTUAN KADAR ION LOGAM BERAT DALAM DEBU
BATUBARA DENGAN METODE INDUCTIVELY COUPLE
PLASMA- MASS SPECTROSCOPY (ICP-MS)
SKRIPSI
IRPAN
080822032
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
UNIVERSITAS SUMATERA UTARA
MEDAN
2011
PERSETUJUAN
Judul : PENENTUAN KADAR ION LOGAM BERAT
DALAM DEBU BATUBARA DENGAN METODE INDUCTIVELY COUPLE PLASMA- MASS SPECTROSCOPY (ICP-MS)
Kategori : SKRIPSI
Nama : IRPAN
Nomor Induk Mahasiswa : 080822032
Program Study : KIMIA EKSTENTION
Fakultas : MATEMATIKA DAN ILMU PENGETAHUAN
ALAM UNIVERSITAS SUMATERA UTARA
Disetujui
Medan , Oktober 2011
Komisi Pembimbing
Dosen Pembimbing II Dosen PembimbingI
Ahmad Darwin Bangun.Msi Prof.Dr.Harlem Marpaung
NIP 195211161940031001 NIP 194701251974031001
Diketahui / disetujui oleh
Departemen Kimia FMIPA USU Ketua
PERNYATAAN
PENENTUAN KONSENTRASI ION LOGAM BERAT DALAM DEBU BATUBARA DENGAN METODE INDUCTIVELY COUPLE PLASMA-MASS
SPECTROSCOPY (ICP-MS) SKRIPSI
Saya mengakui bahwa skripsi ini adalah hasil kerja saya sendiri,kecuali beberapa kutipan dan ringkasan yang masing-masing saya sebutkan sumbernya.
Medan, Oktober 2011
PENGHARGAAN
Puji syukur penulis panjatkan kehadirat Allah SWT, karena berkat rahmatnya
sehingga skripsi ini mampu untuk diselesaikan.Adapun skripsi ini dapat ditulis dengan terwujud atas bantuan serta bimbingan dari berbagai pihak baik secara langsung ataupun tidak langsung. Oleh karena itu dengan segala kerendahan hati penulis mengucapkan terima kasih kepada :
1. Kedua orang tua saya yang telah memberikan bantuan material serta moral kepada saya.
2. Bapak Prof.Dr.Harlem Marpaung selaku dosen pembimbing I penelitian 3. Bapak Ahmad Darwin MSi selaku dosen pembimbing II penelitian. 4. Bapak Dr.Sutarman ,MS selaku Dekan FMIPA USU.
5. Ibu Dr.Rumondang Bulan,MSi selaku ketua Departemen Kimia FMIPA USU
6. Seluruh Dosen FMIPA bidang studi Kimia yang telah membimbing saya dimasa perkuliahan.
ABSTRAK
Telah dilakukan analisa terhadap debu batubara terbang (fly ash) serta debu batubara dasar (bottom ash) untuk menentukan konsentrasi ion logam Mangan, Timbal, Tembaga, Seng, Nikel, Kromium, Kobalt. Sampel diambil secara random dari tempat penimbunan debu batubara pada industri yang memakai batubara sebagai bahan bakar boiler. Sampel dilarutkan dengan HNO3 pekat (pa) yang selanjutnya dianalisa dengan
ABSTRACT
DETERMINATION OF HEAVY METALS IONIC IN COAL ASH BY INDUCTIVELY COUPLE PLASMA-MASS SPECTROSCOPY ( ICP-MS)
The analysis of fly ash and bottom ash of coal to determine of concentration Manganese, Lead, Copper, Zinc, Nickel, Chromium, Cobalt has been carry out. The sampel is taken randomly from ash handling disposal of factory which uses coal as boiler system. Sampel was dissolved with concentrated nictric acid(HNO3pa) and then
DAFTAR ISI
Halaman
Persetujuan ii
Pernyataan iii
Penghargaan iv
Abstrak v
Abstrac vi
Daftar Isi vii
Daftar Tabel x
Daftar Gambar xi
Daftar Grafik xii
Bab 1 Pendahuluan 1
1.1.Latar belakang 1
1.2.Permasalahan 3
1.3.Pembatasan Permasalahan 4
1.4.Tujuan Penelitian 4
1.5.Manfaat Penelitian 3
1.6.Metodologi Penelitian 3
1.7.Lokasi Penelitian 4
Bab 2 Tinjauan Pustaka 5
2.1.Sejarah Batubara 5
2.1.2.Proses Pembentukaan Batubara 7
2.1.3.Abu batubara 8
2.2.Metode destruksi 17
2.2.1.Destruksi kering 17
2.2.2.Destruksi basah 17
2.3.Inductively Couple Plasma MS 18
2.3.1.Prinsip Kerja Alat Inductively Couple Plasma 19
Bab 3 Metodologi Penelitian 28
3.1.Bahan dan Alat 28
3.1.1.Bahan-bahan yang digunakan 28
3.1.2.Alat yang digunakan 28
3.2.Prosedur Percobaan 29
3.2.1.Pembuatan Larutan Baku Cr3+ 5 mg/L 29
3.2.1.1.Pembuatan Larutan Baku Cr3+ 0; 0,25; 0,50; 0,75; 1 mg/L 29
3.2.2.1.Pembuatan Larutan Baku Pb2+ 0; 0,25; 0,50; 0,75; 1 mg/L 30
3.3.Penentuan Konsentrasi Logam 30
3.3.1.Kondisi Alat 31
3.4.Bagan Penelitian 32
3.4.1.Pembuatan Larutan Baku Cr2+ 5 mg/L 32 3.4.2.Pembuatan Larutan Baku Pb2+ 5 mg/L 32 3.4.3.Penentuan Konsentrasi Logam 33
Bab 4 Hasil dan Pembahasan 34
4.1.Hasil percobaan 34
4.1.1. Penurunan Persamaan Garis Regresi ,Koefisien Korelasi,serta Penentuan Kadar Analit ion Logam Mn2+ dengan Metode Kurva
Kalibrasi Standard 34
4.1.2. Penurunan Persamaan Garis Regresi 34
4.1.3. Koefisien Korelasi 35
4.1.4. Penentuan Kadar Ion Logam Mn2+ 35 4.1.5. Penentuan Konsentrasi Ion Logam Mn2+ pada Debu Batubara
Dasar Dalam Satuan mg/Kg 36
4.1.6. Penentuan Konsentrasi Ion Logam Mn2+ pada Debu Batubara
Terbang Dalam Satuan mg/Kg 36
4.2. Penurunan Persamaan Garis Regresi,Koefisien Korelasi, serta Penen tuan Kadar Analit Ion Logam Zn2+ dengan Metode Kurva Kalibrasi
Standard 37
4.2.1. Penurunan Persamaan Garis Regresi 37
4.2.2. Koefisien Korelasi 38
4.2.3. Penentuan Kadar Ion Logam Zn2+ 38 4.2.4. Penentuan Konsentrasi Ion Logam Zn2+ pada Debu Batubara
Dasar Dalam Satuan mg/Kg 39
4.2.5. Penentuan Konsentrasi Ion Logam Zn2+ pada Debu Batubara
Terbang Dalam Satuan mg/Kg 39
4.3. Penurunan Persamaan Garis Regresi,Koefisien Korelasi, serta Penen tuan Kadar Analit Ion Logam Pb2+ dengan Metode Kurva Kalibrasi
Standard 40
4.3.1. Penurunan Persamaan Garis Regresi 40
4.3.2. Koefisien Korelasi 41
4.3.3. Penentuan Kadar Ion Logam Pb2+ 41 4.3.4. Penentuan Konsentrasi Ion Logam Pb2+ pada Debu Batubara
Dasar Dalam Satuan mg/Kg 42
4.3.5. Penentuan Konsentrasi Ion Logam Pb2+ pada Debu Batubara
Terbang Dalam Satuan mg/Kg 42
4.4. Penurunan Persamaan Garis Regresi,Koefisien Korelasi, serta Penen tuan Kadar Analit Ion Logam Cu2+ dengan Metode Kurva Kalibrasi
Standard 43
4.4.1. Penurunan Persamaan Garis Regresi 43
4.4.3. Penentuan Kadar Ion Logam Cu2+ 44 4.4.4. Penentuan Konsentrasi Ion Logam Cu2+ pada Debu Batubara
Dasar Dalam Satuan mg/Kg 45
4.4.5. Penentuan Konsentrasi Ion Logam Cu2+ pada Debu Batubara
Terbang Dalam Satuan mg/Kg 45
4.5. Penurunan Persamaan Garis Regresi,Koefisien Korelasi, serta Penen tuan Kadar Analit Ion Logam Cr3+ dengan Metode Kurva Kalibrasi
Standard 46
4.5.1. Penurunan Persamaan Garis Regresi 46
4.5.2. Koefisien Korelasi 47
4.5.3. Penentuan Kadar Ion Logam Cr3+ 47 4.5.4. Penentuan Konsentrasi Ion Logam Cr3+ pada Debu Batubara
Dasar Dalam Satuan mg/Kg 48
4.5.5. Penentuan Konsentrasi Ion Logam Cr3+ pada Debu Batubara
Terbang Dalam Satuan mg/Kg 48
4.6. Penurunan Persamaan Garis Regresi,Koefisien Korelasi, serta Penen tuan Kadar Analit Ion Logam Ni2+ dengan Metode Kurva Kalibrasi
Standard 49
4.6.1. Penurunan Persamaan Garis Regresi 49
4.6.2. Koefisien Korelasi 50
4.6.3. Penentuan Kadar Ion Logam Ni2+ 50 4.6.4. Penentuan Konsentrasi Ion Logam Ni2+ pada Debu Batubara
Dasar Dalam Satuan mg/Kg 51
4.6.5. Penentuan Konsentrasi Ion Logam Ni2+ pada Debu Batubara
Terbang Dalam Satuan mg/Kg 51
4.7. Penurunan Persamaan Garis Regresi,Koefisien Korelasi, serta Penen tuan Kadar Analit Ion Logam Co2+ dengan Metode Kurva Kalibrasi
Standard 52
4.7.1. Penurunan Persamaan Garis Regresi 52
4.7.2. Koefisien Korelasi 53
4.7.3. Penentuan Kadar Ion Logam Co2+ 53 4.7.4. Penentuan Konsentrasi Ion Logam Co2+ pada Debu Batubara
Dasar Dalam Satuan mg/Kg 54
4.7.5. Penentuan Konsentrasi Ion Logam Co2+ pada Debu Batubara
Terbang Dalam Satuan mg/Kg 54
4.8. Pembahasan 55
Bab 5 Kesimpulan dan Saran 58
5.1. Kesimpulan 58
5.2. Saran 58
DAFTAR TABEL
Halaman
Tabel 4.1. Data Hasil Penurunan Persamaan Garis Regresi ion Mn2+ 34 Tabel 4.1.2. Data Hasil Penurunan Persamaan Garis Regresi ion Zn2+ 37 Tabel 4.1.3. Data Hasil Penurunan Persamaan Garis Regresi Pb2+ 40 Tabel 4.1.4. Data Hasil Penurunan Persamaan Garis Regresi Cu2+ 43 Tabel 4.1.5. Data Hasil Penurunan Persamaan Garis Regresi Cr3+ 46 Tabel 4.1.6. Data Hasil Penurunan Persamaan Garis Regresi Ni2+ 49 Tabel 4.1.7. Data Hasil Penurunan Persamaan Garis Regresi Co2+ 52 Tabel 4.2. Perbandingan konsentrasi logam berbagai Negara 56 Tabel 5. Kondisi Alat ICP-MS tipe Liberty RL pada pengukuran konsentrasi
ion Mn2+ 64
Tabel 6. Kondisi Alat ICP-MS tipe Liberty RL pada pengukuran konsentrasi
ion Zn2+ 64
Tabel 7. Kondisi Alat ICP-MS tipe Liberty RL pada pengukuran konsentrasi
ion Pb2+ 65
Tabel 8. Kondisi Alat ICP-MS tipe Liberty RL pada pengukuran konsentrasi
ion Cu2+ 65
Tabel 9. Kondisi Alat ICP-MS tipe Liberty RL pada pengukuran konsentrasi
ion Cr3+ 66
Tabel 10. Kondisi Alat ICP-MS tipe Liberty RL pada pengukuran konsentrasi
ion Ni2+ 66
Tabel 11. Kondisi Alat ICP-MS tipe Liberty RL pada pengukuran konsentrasi
DAFTAR GAMBAR
Halaman
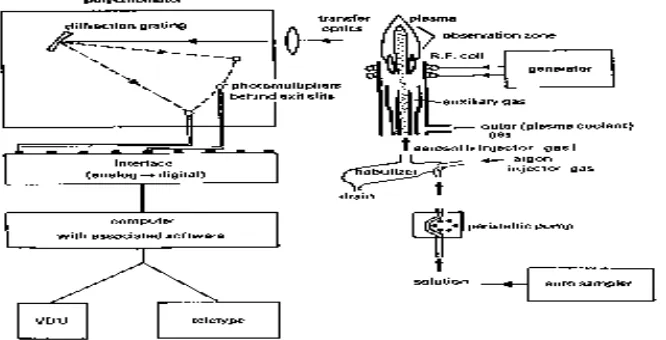
Gambar 2.1. Skema Alat ICP 20
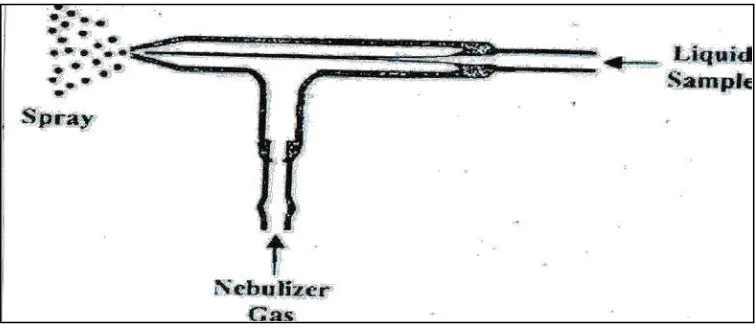
Gambar 2.2. Nebulizer Meinhard 21
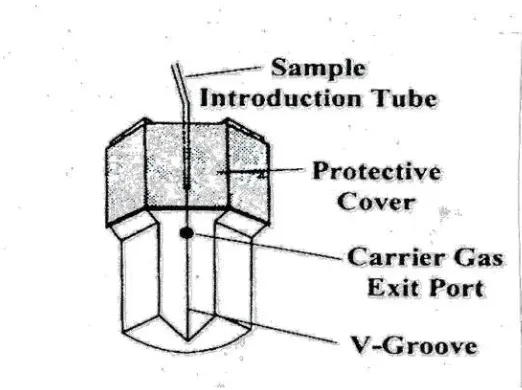
Gambar 2.3. Babington nebulizer 22
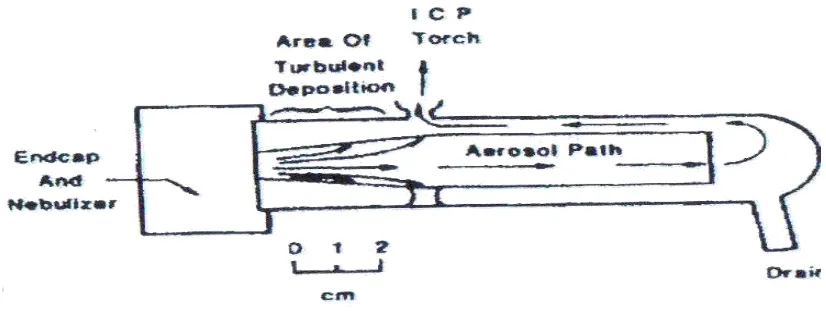
Gambar 2.4. Spray Chamber 23
Gambar 2.5. Obor ICP 24
Gambar 2.6. Bagian antara plasma serta spektroskopi massa 25 Gambar 2.7. Skema diagram dari quadropole 26
DAFTAR GRAFIK
ABSTRAK
Telah dilakukan analisa terhadap debu batubara terbang (fly ash) serta debu batubara dasar (bottom ash) untuk menentukan konsentrasi ion logam Mangan, Timbal, Tembaga, Seng, Nikel, Kromium, Kobalt. Sampel diambil secara random dari tempat penimbunan debu batubara pada industri yang memakai batubara sebagai bahan bakar boiler. Sampel dilarutkan dengan HNO3 pekat (pa) yang selanjutnya dianalisa dengan
ABSTRACT
DETERMINATION OF HEAVY METALS IONIC IN COAL ASH BY INDUCTIVELY COUPLE PLASMA-MASS SPECTROSCOPY ( ICP-MS)
The analysis of fly ash and bottom ash of coal to determine of concentration Manganese, Lead, Copper, Zinc, Nickel, Chromium, Cobalt has been carry out. The sampel is taken randomly from ash handling disposal of factory which uses coal as boiler system. Sampel was dissolved with concentrated nictric acid(HNO3pa) and then
BAB I PENDAHULUAN
1.1. Latar Belakang
Sejak Indonesia mengalami krisis bahan bakar minyak, nama batubara saat ini begitu terkenal, baik dikalangan masyarakat umum maupun industriawan Semua sumber tenaga yang menggunakan bahan bakar yang berasal dari minyak bumi kalau memungkinkan diganti dengan batubara. Berdasarkan data dari BP Statistical Review of Energy, 2004, Indonesia mempunyai cadangan batubara terbesar ke lima dunia setelah Amerika Serikat, Jerman, Afrika Selatan dan Ukraina.
Saat ini penggunaan batubara di kalangan industri semakin meningkat volumenya, karena selain harga yang relatif murah juga kian langka dan harga bahan bakar minyak untuk industri cenderung naik. Penggunaan batubara sebagai sumber energi pengganti BBM,disatu sisi sangat menguntungkan namun disisi yang lain menimbulkan masalah, yaitu abu batubara yang merupakan hasil samping pembakaran batubara. Dari sejumlah pemakaian batubara akan dihasilkan abu batubara sekitar 2 – 10 % (tergantung jenis batubaranya, low calory atau hight calory). Sampai saat ini pengelolaan limbah abu batubara oleh kalangan industri hanya ditimbun dalam areal pabrik saja (ash disposal). Abu batubara adalah bagian dari sisa pembakaran batubara yang berbentuk partikel halus amorf dan abu tersebut merupakan bahan anorganik yang terbentuk dari perubahan bahan mineral (mineral matter) karena proses pembakaran.
sisanya sekitar 80 - 90 % berupa abu terbang. Abu terbang ditangkap dengan electric precipitator sebelum dibuang ke udara melalui cerobong (Tim Kajian 2006).
Produksi abu terbang batubara (fly ash) didunia pada tahun 2000 diperkirakan berjumlah 349 milyar ton. Penyumbang produksi abu terbang batubara terbesar adalah sektor pembangkit listrik. Produksi abu terbang dari pembangkit listrik di Indonesia terus meningkat, pada tahun 2000 jumlahnya mencapai 1,66 milyar ton dan diperkirakan mencapai 2 milyar ton pada tahun 2006.
Abu terbang (fly ash) mempunyai butiran yang cukup halus, yaitu lolos ayakan No.325 (45 mili mikron) sedangkan abu batubara dasar memiliki diameter 1-1,5 mm dengan spesific gravity antara 2,15 –2,6 dan berwarna abu-abu kehitaman. Abu batubara mengandung silika dan alumina sekitar 80 % dengan sebagian silika berbentuk amorf. Sifat-sifat fisik abu batubara antara lain densitasnya 2,23 g/cm3, kadar air sekitar 4 % dan komposisi mineral yang dominan adalah α-kuarsa dan mullite. Selain itu abu batubara mengandung SiO2 ; 58,75 %, Al2O3 ; 25,82 %, Fe2O3 ; 5,30 % CaO; 4,66 %,
alkali ; 1,36 %, MgO = 3,30 % dan bahan lainnya ; 0,81 % (Palar heryanto 2008). Abu terbang batubara umumnya dibuang di landfill atau ditumpuk begitu saja di dalam area industri. Penumpukan abu terbang batubara ini menimbulkan masalah bagi lingkungan. Berbagai penelitian mengenai pemanfaatan abu terbang batubara sedang dilakukan untuk meningkatkan nilai ekonomisnya serta mengurangi dampak buruknya terhadap lingkungan karena menurut PP No 85 tahun 1999 tentang perubahan atas Peraturan Pemerintah tentang pengelolaan limbah Bahan Berbahaya dan Beracun bahwa abu terbang serta abu dasar termasuk dalam jenis limbah B-3.
logam sekaligus dalam sekali penentuan. Degan alas an ini maka timbul keinginan untuk menggunakan metode Inductively Couple Plasma – Mass Spectoscopy (ICP-MS) yang mampu melakukan analisa beberapa ion logam sekaligus.
1.2 Permasalahan
Menurut Badan Lingkungan Hidup yang menyatakan bahwa abu terbang serta abu dasar dari pembakaran batubara adalah termasuk limbah B-3 yang dapat membahayakan kesehatan manusia, karena jumlah penggunaan batubara dikalangan industri terus meningkat maka penelitian ini bertujuan untuk menentukan konsentrasi ion logam berat seperti Mangan, Kromium, Timbal, Nikel, Kobalt Tembaga serta Seng dengan menggunakan metode ICP-MS.
1.3 Pembatasan Masalah
Analisa kandungan ion logam berat Cu2+,Mn2+, Pb2+, Zn2+, Ni2+, Cr3+, Co2+ pada debu terbang serta abu dasar dengan menggunakan teknik destruksi basah, serta dengan menggunakan alat inductively couple plasma MS (ICP-MS).
1.4 Tujuan Penelitian
Tujuan penelitian ini adalah untuk mengetahui berapa konsentrasi logam berat yang terdapat didalam abu terbang serta abu dasar batubara dan untuk mengetahui perbedaan kandungan ion logam tersebut dalam debu batubara terbang serta debu dasar.
1.5 Manfaat Penelitian
1.6 Metodologi Penelitian
Penelitian bersifat eksperiment laboraturium yang dilakukan dengan cara
1. Sampel abu batubara terbang serta abu batubara dasar diambil secara acak dari tempat penimbunan (ash disposal) pada industri yang memakai batubara sebagai bahan bakar boiler.
2. Sampel didestruksi basah dengan menggunakan HNO3 selanjutnya dianalisa dengan ICP-MS.
3. Analisis data dilakukan dengan metode Least Quare.
1.7 Lokasi Penelitian
BAB II
TINJAUAN PUSTAKA
2.1.Sejarah Batubara
Batubara adalah salah satu bahan bakar fosil. Yang secara umum adalah batuan sedimen yang dapat terbakar,terbentuk dari endapan organik,utamanya adalah dari tumbuhan dan terbentuk dari proses pembatubaraan.Batubara sebagai sumber energi primer memiliki riwayat pemanfaatan yang sangat panjang. Beberapa ahli sejarah menyakini jika penggunaan batubara pertama sekali di China dengan laporan pada tahun 1000 SM terdapat tambang di timur laut China yang menggunakan batubara untuk mencairkan tembaga dan untuk mencetak uang logam.Bahkan petunjuk paling awal tentang pengunaan batubara berasal dari filosof Yunani yaitu Aristoteles yang menyebutkan adanya arang seperti abu. Abu batubara yang ditemukan di reruntuhan bangunan romawi di Inggris juga menunjukkan bahwa batubara juga telah digunakan oleh bangsa Romawi pada tahun 400 SM (Kamus 2010).
menempati posisi paling atas sebagai bahan bakar. Meskipun demikian bukan berarti batubara tidak berperan sebagai bahan bakar sebagai salah satu sumber energi primer.
Krisis minyak pada tahun 1973 menyadarkan banyak pihak bahwa ketergantungan yang berlebihan pada salah satu sumber energi primer dalam hal ini minyak bumi akan menyulitkan upaya pemenuhan pasokan energi yang kontiniu,selain itu labilnya kondisi keamanan di Negara timur tengah yang merupakan produsen minyak terbesar juga sangat berpengaruh pada fluktuasi harga maupun stabilitas pasokan. Keadaan inilah yang menjadikan salah satu alasan batubara sebagai alternatif bahan bakar sumber energi primer. Disamping itu juga terdapat beberapa faktor diantaranya :
1. Cadangan batubara sangat banyak dan tersebar luas.
Diperkiarakan terdapat lebih dari 984 milyar ton cadangan batubara terbukti (proven coal reserves) diseluruh dunia yang tersebar pada 70 negara.Dengan asumsi produksi pada tahun 2004 yaitu sekitar 4.63 milyar ton pertahun untuk produksi batubara keras (hard coal) dan 879 ton juta ton untuk batubara muda (brown coal), maka cadangan batubara diperkirakan bertahan hingga 164 tahun. Sebaliknya dengan tingkat produksi saat ini minyak diperhitungkan akan habis dalam waktu 41 tahun, sedangkan gas adalah 67 tahun. Disamping itu sebarannya pun terbatas, dimana 68 % cadangan minyak dan 67 % cadangan gas terkonsentrasi di Timur tengan dan Rusia.
2. Negara maju dan negara berkembang terkemuka memiliki banyak cadangan batubara.
Berdasarkan data dari BP Statistic review of Energi 2004, pada tahun 2003, 8 besar negara – negara dengan cadangan batubara terbanyak adalah Amerika Serikat, Rusia, China, India, Australia, Jerman , Afrika Selatan dan Ukraina. 3. Batubara dapat diperoleh dipasaran dunia dengan pasokan yang stabil.
Melihat pemaparan diatas, dapat dimengerti bahwa peranan batubara dalam penyediaan kebutuhan energi sangatlah penting sehingga penggunaan batubara akan menjadi semakin meningkat berjalan dengan semakin berkurangnya cadangan minyak dan gas alam.
2.1.2. Proses Pembentukan Batubara
Batubara adalah mineral organik yang dapat terbakar, terbentuk dari sisa tumbuhan purba yang mengendap yang selanjutnya berubah bentuk akibat proses fisika dan kimia yang berlangsung selama jutaan tahun. Oleh karena itu, batubara termasuk
dalam kategori baha
batubara tadi disebut dengan pembatubaraan (coalification).Faktor tumbuhan purba yang jenisnya berbeda-beda sesuai dengan jaman geologi dan lokasi tempat tumbuh dan berkembangnya, ditambah dengan lokasi pengendapan (sedimentasi) tumbuhan, pengaruh tekanan batuan dan panas bumi serta perubahan geologi yang berlangsung kemudian, akan menyebabkan terbentuknya Oleh karena itu, karakteristi (coal field) dan lapisannya (coal seam).
Pembentukan batubara dimulai sejak periode pembentukan Karbon (Carboniferous Period) yang dikenal sebagai zaman batu bara pertama yang berlangsung antara 360 juta sampai 290 juta tahun yang lalu. Kualitas dari setiap endapan batu bara ditentukan oleh suhu dan tekanan serta lama waktu pembentukan, yang disebut sebagai 'maturitas organik'. Proses awalnya, endapan tumbuhan berubah menjadi gambut (peat), yang selanjutnya berubah menjadi batu bara muda (lignite) atau disebut pula batu bara coklat (brown coal). maturitas organik rendah.
batu bara menjadi lebih keras dan warnanya lebih hitam sehingga membentuk bituminus (bituminous) atau antrasit (anthracite). Dalam kondisi yang tepat, peningkatan maturitas organik yang semakin tinggi terus berlangsung hingga membentuk antrasit (Klik Saya 2010).
2.1.3Abu Batubara
Sejak Indonesia mengalami krisis bahan bakar minyak, nama batubara saat ini begitu terkenal, baik dikalangan masyarakat umum maupun industriawan Semua sumber tenaga yang menggunakan bahan bakar yang berasal dari minyak bumi kalau memungkinkan diganti dengan batubara. Berdasarkan data dari BP Statistical Review of Energy, 2004, Indonesia mempunyai cadangan batubara terbesar ke lima dunia setelah Amerika Serikat, Jerman, Afrika Selatan dan Ukraina.
Saat ini penggunaan batubara di kalangan industri semakin meningkat volumenya, karena selain harga yang relatif murah juga kian langka dan harga bahan bakar minyak untuk industri cenderung naik. Penggunaan batubara sebagai sumber energi pengganti BBM,disatu sisi sangat menguntungkan namun disisi yang lain menimbulkan masalah, yaitu abu batubara yang merupakan hasil samping pembakaran batubara. Dari sejumlah pemakaian batubara akan dihasilkan abu batubara sekitar 2 – 10 % (tergantung jenis batubaranya, low calory atau hight calory). Sampai saat ini pengelolaan limbah abu batubara oleh kalangan industri hanya ditimbun dalam areal pabrik saja (ash disposal). Abu batubara adalah bagian dari sisa pembakaran batubara yang berbentuk partikel halus amorf dan abu tersebut merupakan bahan anorganik yang terbentuk dari perubahan bahan mineral (mineral matter) karena proses pembakaran.
Produksi abu terbang batubara (fly ash) didunia pada tahun 2000 diperkirakan berjumlah 349 milyar ton. Penyumbang produksi abu terbang batubara terbesar adalah sektor pembangkit listrik. Produksi abu terbang dari pembangkit listrik di Indonesia terus meningkat, pada tahun 2000 jumlahnya mencapai 1,66 milyar ton dan diperkirakan mencapai 2 milyar ton pada tahun 2006.
Abu terbang batubara umumnya dibuang di landfill atau ditumpuk begitu saja di dalam area industri. Penumpukkan abu terbang batubara ini menimbulkan masalah bagi lingkungan. Berbagai penelitian mengenai pemanfaatan abu terbang batubara sedang dilakukan untuk meningkatkan nilai ekonomisnya serta mengurangi dampak buruknya terhadap lingkungan. Saat ini umumnya abu terbang batubara digunakan dalam pabrik semen sebagai salah satu bahan campuran pembuat beton. Selain itu, sebenarnya abu terbang batubara memiliki berbagai kegunaan yang amat beragam:
1. Penyusun beton untuk jalan dan bendungan 2. Penimbun lahan bekas pertambangan 3. Recovery magnetit, cenosphere, dan karbon
4. Bahan baku keramik, gelas, batu bata, dan refraktori 5. Bahan penggosok (polisher)
6. Filler aspal, plastik, dan kertas 7. Pengganti dan bahan baku semen
8. Aditif dalam pengolahan limbah (waste stabilization) 9. Konversi menjadi zeolit dan adsorben
banyak dikonsumsi dalam pemurnian air, pengolahan tanah. Zeolit dibuat dengan cara mengkonversi aluminosilikat yang terdapat pada abu terbang batubara menjadi kristal zeolit melalui reaksi hidrotermal (Yoga Pratama 2006).
Sifat kimia dari abu terbang batubara dipengaruhi oleh jenis batubara yang dibakar dan teknik penyimpanan serta penanganannya. Pembakaran batubara lignit dan sub-bituminous menghasilkan abu terbang dengan kalsium dan magnesium oksida lebih banyak daripada bituminus. Namun, memiliki kandungan silika, alumina, dan karbon yang lebih sedikit daripada bituminous. Kandungan karbon dalam abu terbang diukur dengan menggunakan Loss On Ignition Method (LOI).
Abu terbang batubara terdiri dari butiran halus yang umumnya berbentuk bola padat atau berongga. Ukuran partikel abu terbang hasil pembakaran batubara bituminous lebih kecil dari 0,075mm. Kerapatan abu terbang berkisar antara 2100 sampai 3000 kg/m3 dan luas area spesifiknya (diukur berdasarkan metode permeabilitas udara Blaine) antara 170 sampai 1000 m2/kg. Menurut ACI Committee 226, dijelaskan bahwa abu terbang (fly ash) mempunyai butiran yang cukup halus, yaitu lolos ayakan No.325 (45 mili mikron) 5 – 27 % dengan spesific gravity antara 2,15 –2,6 dan berwarna abu-abu kehitaman. Abu batubara mengandung silika dan alumina sekitar 80 % dengan sebagian silika berbentuk amorf. Sifat-sifat fisik abu batubara antara lain densitasnya 2,23 g/cm3, kadar air sekitar 4 % dan komposisi mineral yang dominan adalah α-kuarsa dan mullite. Selain itu abu batubara mengandung SiO2 ; 58,75 %,
Al2O3 ; 25,82 %, Fe2O3 ; 5,30 % CaO ; 4,66 %, alkali ; 1,36 %, MgO ;3,30 % dan
bahan lainnya ;0,81 %.Beberapa logam berat yang terkandung dalam abu batubara seperti tembaga (Cu), timbal (Pb), seng (Zn), kadmium (Cd), Chrom (Cr).
a.Khromium ( Cr )
Kata Khromium berasal dari bahasa Yunani ( Chroma ) yang berarti warna,dan dilambangkan dengan Cr.Sebagai salah satu logam berat yang pertama sekali ditemukan oleh Vagueline pada tahun 1797. Pada alam unsur ini ditemukan dalam bentuk persenyawaan padat atau mineral dengan unsur-unsur lain.Sebagai bahan mineral maka Khrom banyak dijumpai dalam bentuk Chromite ( FeOCr2O3).
Khromium masuk kedalam lingkungan apakah itu dalam strata perairan tanah ataupun dalam udara.Khromium yang masuk kedalam strata lingkungan dapat datang dari bermacam-macam sumber.Akan tetapi sumber masukan logam kromium yang paling banyak adalah dari kegiatan-kegiatan perindustrian, kegiatan rumah tangga dan dari pembakaran serta mobilisasi bahan bakar.
Sumber utama masuknya logam Khromium ke lapisan udara dari suatu strata lingkungan adalah pembakaran serta mobilisasi batubara serta minyak bumi.Dari pembakaran yang dilakukan terhadap batubara maka akan dilepaskan Khromium ke udara sebesar 10 ppm,sedangkan dengan pembakaran minyak bumi maka akan dilepaskan keudara sebesar 0,3 ppm.Dengan keadaan ini maka akan dapat dihitung pada tiap tahunnya akan dilepaskan 1400 ton Khromium keudara dari pembakaan batubara serta 50 ton Cr yang didapat dari pembakaran minyak bumi.
Serupa halnya dengan logam-logam berat terdahulu,Khromium didalam strata udara ditemukan dalam bentuk debu dan atau partikulat- partikulat.Debu atau partikulat Khromium tersebut akan dapat masuk kedalam tubuh hewan dan manusia ketika berlangsungnya kegiatan pernapasan.Partikel dan debu Cr terhirup manusia lewat rongga hidung kemudian akan berikatan dengan darah diparu-paru sebelum dibawa arah keseluruh tubuh.
Khromium yang paling banyak dipelajari sifat racunnya, bila dibandingkan dengan Cr2+ ataupun Cr3+ sifat racun yang dibawa logam ini mengakibatkan keracunan akut ataupun keracunan kronis.
Data keracunan akut oleh Khromium umumnya merupakan hasil penelitian atau percobaan yang dilakukan pada hewan. Percobaan tersebut adalah dengan memperlakukan hewan tersebut dengan senyawa-senyawa Khromat yang sudah dilarutkan yang kemudian senyawa tersebut dimasukkan kedalam tubuh hewan tersebut dengan menggunakan dosis yang berbeda-beda. Pemberian dilakukan dengan cara memasukkannya kedalam mulut serta kedalam kulit hewan (Philip 2004).
b.Timbal (Pb)
Timbal yang dalam bahasa keseharian lebih dikenal dengan nama timah putih hitam atau dalam bahasa ilmiahnya dikatakan plumbum serta logam ini disimbolkan dengan Pb. Logam ini termasuk kedalam golongan IV-A pada table priodik unsur kimia mempunyai nomor atom (NA) 82 dengan berat atomnya 207,2.Logam timbal dialam terkonsentrasi dalam defosit seperti biji logam. Persenyawaan biji logam timbal ditemukan didalam galena (PbS), anglesit ( PbSO4) dalam bentuk minim ( Pb3O4 )
boleh dikatakan bahwa timbal tidak pernah ditemukan dalam bentuk logam murninya.
Logam timbal mempunyai sifat – sifat yang khusus seperti berikut ini
- Merupakan logam yang lunak, sehingga dapat dipotong dengan menggunakan pisau atau dengan menggunakan tangan dan dapat dibentuk dengan mudah.
- Merupakan logam yang tahan terhadap korosi atau karat, sehingga logam timbal sering digunakan dalam proses coating.
- Mempunyai titik lebur yang rendah hanya 327,5 oC.
- Merupakan penghantar listrik yang baik.
Timbal dan persenyawaannya banyak digunakan dalam berbagai bidang seperti didalam industri baterai yang menggunakan Pb – Bi dengan perbandingan 93 : 7Emisi Pb kedalam lapisan atmosfir bumi dapat berbentuk gas dan partikulat. Emisi Pb yang masuk kedalam bentuk gas berasal dari buangan kendaraan bermotor. Emisi tersebut berasal dari pembakaran dari mesin-mesin kendaraan bermotor. Pb yang merupakan hasil samping kendaraan bermotor ini berasal dari persenyawaan tetrametil-Pb atau tetraetil-Pb yang merupakan bahan tambahan didalam kendaraan bermotor yang berfungsi untuk anti knocking pada mesin-mesin kendaraan bermotor.Disamping itu kendaraan bermotor biasanya juga ditambahkan pula bahan yang bernama scavenger yaitu etilenbromida serta etilendiklorida dimana seyawa ini akan mengikat sisa timbal dari pembakaran yang nantinya didalam sisa pembakaran akan menghasilkan timbal serta persenyawaan klorida.
Bahan aditif yang biasa dimasukkan kedalam bahan bakar kendaraan bermotor secara umum terdiri atas 62 % tetraetil timbal 18 % tetraetildiklorida 18 % etilendibromida serta sekitar 2 % bahan campuran dari bahan-bahan lainnya. Sumber-sumber Pb yang menyebabkan tingginya kandungan Pb didalam udara adalah pembakaran batubara, asap dari pabrik-pabrik yang mengolah senyawa alkil Pb, Pb oksida serta peleburan biji Pb. Secara alamiah Pb didalam batu bara sangatlah sedikit. Akan tetapi dikarenakan penambangan serta penggunaan batubara yang semakin meluas maka kandungan logam pb yang terbuang keudara bebas juga akan semakin besar.
Pada pengamatan yang dilakukan terhadap pekerja yang bekerja menangani senyawa Pb,tidak ditemukan keracunan yang kronis yang berat. Gejala keracunan kronis yang ringan ditemukan berupa insomnia serta beberapa gangguan tidur lainnya. Sedangkan gejala pada kasus keracunan akut ringan adalah menurunnya tekanan darah serta berat badan. Keracunan yang akut dapat mengakibatkan koma serta kematian.
Meskipun jumlah Pb yang terserap oleh tubuh hanya sedikit,akan tetapi logam ini sangatlah berbahaya. Hal ini disebabkan karena senyawa-senyawa Pb akan memberikan efek racun bagi seluruh organ tubuh manusia. Beberapa contoh keracunan yang menyerang manusia adalah kegagalan dalam sintesa hemoglobin yang melibatkan 2 macam enzim yaitu enzim ALAD ( amino Levulinic Acid Dehidrase) serta enzim ferro kelatase. Enzim ALAD adalah enzim jenis sitoplasma dimana enzim ini akan bereaksi secara aktif pada tahap awal sintesa dan selama sirkulasi sel darah merah berlangsung. Adapun enzim ferrokelatase adalah jenis enzim mitokondria, dimana enzim ini akan aktif pada akhir sintesa yaitu mengkatalisis pembentukan kompleks hemoglobin (Heryanto 2008).
Dengan adanya logam Pb didalam darah maka akan mengikat gugus aktif dari enzim ALAD yang akan mengakibatkan pembentukan intermediate porphobilinogen dan kelanjutan dari proses reaksi ini tidak dapat berlanjut. Keracunan yang terjadi akibat kontaminasi dari logam Pb dapat menimbulkan hal-hal sebagai berikut :
-Meningkatkan kadar ALA dalam darah serta urin
-Meningkatkan kadar protoporphirin dalam sel darah merah -Memperpendek umur sel darah merah
-Menurunkan jumlah sel darah merah
Keracunan yang disebabkan oleh keberadaan logam Pb dalam tubuh mempengaruhi banyak jaringan serta organ tubuh. Organ – organ tubuh banyak menjadi sasaran dari peristiwa keracunan logam Pb adalah sistem syaraf, sistem ginjal, sistem reproduksi, sistem endokrin serta jantung. Setiap bagian yang diserang oleh logam Pb akan memperlihatkan efek yang berbeda-beda.
c.Tembaga (Cu)
Tembaga dengan nama kimia Cuprum yang dilambangkan dengan Cu. Unsur logam ini berbentuk Kristal dengan warna yang kemerah-merahan. Dalam tabel unsur priodik kimia, Tembaga menempati posisi dengan nomor atom 29 serta mempunyai berat atom 63.5. Unsur tembaga dialam dapat ditemukan dalam bentuk logam bebas,akan tetapi lebih banyak ditemukan dalam bentuk persenyawaan sebagai senyawa padat dalam bentuk mineral. Dalam badan perairan laut Tembaga dapat ditemukan dalam bentuk persenyawaan seperti CuCO3+. Sedangkan pada batuan mineral atau
lapisan tanah tembaga dapat ditemukan dalam bentuk seperti : -chalcocote (Cu2S)
-covellite (CuS)
-chalcopyrite (CuFeS2)
-bornite (Cu5FeS4)
-enargite [Cu3(AsSb)S4]
Selain dari bentuk mineral tersebut logam tembaga juga banyak ditemukan dalam bentuk teroksidasi seperti bijih :
-cuprite (Cu2O)
-tenorite (CuO)
-malachite [CuCO3.Cu(OH)2]
-chrysocolla (CuSiO3.2H2O)
-bronchantite [Cu4(OH)6SO4]
Secara alamiah logam tembaga dapat masuk kedalam lingkungan sebagai akibat dari peristiwa alam. Dimana unsur ini dapat terjadi dari erosi dari batuan mineral. Sedangkan sumber lain adalah debu-debu atau partikulat Cu yang ada didalam lapisan udara yang dibawa turun bersama hujan. Didalam badan perairan laut dengan kondisi ini maka diperkirakan akan memasok 325.000 ton per tahun.Sedangkan melalui jalur non alamiah Cu akan masuk kedalam tatanan lingkungan melalui aktifitas manusia sebagai contohnya adalah industri yang mempergunakan logam Cu dalam pengolahan kayu serta pembakaran batubara.
Pada umumnya logam Cu diperoleh dari penambangan. Untuk mendapatkan logam Cu yang baik harus melalui tahap-tahap proses. Tahap-tahap proses tersebut meliputi penghalusan biji tembaga, pemekatan secara flotasi, pembakaran pada suhu 600 sampai 800 oC dimana untuk menghilangkan kandungan sulfurnya serta proses peleburan dimana akan dibakar paada suhu 1100 sampai 1600 oC.
Sumber-sumber dari keberadaan debu Cu diudara sangat banyak. Namun yang terpenting diantaranya adalah berasal dari peleburan biji Cu serta pengelasan yang mengandung logam Cu yang dikarenakan proses pekerjaan tersebut banyak menghasilkan debu Cu yang akan terlepas keudara.Pembakaran batubara juga menyumbang uap debu keudara bebas (Heryanto 2008).
2.2 Metode Destruksi
2.2.1 Destruksi Kering
Destruksi kering merupakan penguraian (perombakan) senyawa organik logam dalam sampel menjadi logam-logam anorganik dengan jalan pengabuan sampel dan memerlukan suhu pemanasan tertentu. Pada teknik ini sampel dipanaskan secara bertahap diudara terbuka untuk menguapkan kandungan air,menguraikan dan mengoksidasi sampel,dimana akhirnya sampel diabukan pada tanur dengan suhu pengabuan 450 – 550 oC.Bila oksidasi logam yang bersifat mudah menguap sepertinya analisis Kadmium dan Krom maka perlakuan tidak memberikan hasil yang baik,sebab pada suhu tinggi oksida-oksida logam ini telah habis menguap (untuk analisis Kadmium dan Krom dilakukan pada suhu antara 300 – 320 oC.Namun terdapat juga perlakuan destruksi kering pada suhu pengabuan pada suhu 750 oC atau bahkan 980 oC (Raimon 1992).
dilakukan didalam tanur sehingga kita dapat mengatur temperatur dan menentukan temperatur yang cocok dimana temperatur yang dipakai harus disesuaikan dengan unsur yang akan dianalisa (Haswel 1991).
2.2.2 Destruksi basah
Destruksi basah merupakan penguraian (perombakan) sampel dengan cara melarutkan sampel dengan menggunakan asam-asam kuat baik tunggal ataupun campuran kemudian dioksidasi dengan oksidator yang umum yaitu Hidrogen Peroksida.Asam-asam
kuat yang dapat digunakan untuk mendestruksi sampel organik adalah asam nitrat (HNO3),asam sulfat H2SO4,asam perklorat dan asam klorida yang dapat digunakan
secara tunggal ataupun secara campuran.
Jika didalam sampel dimasukkan asam pengoksidasi,lalu dipanaskan pada temperatur yang cukup tinggi dan jika dipanaskan secara kontiniu pada waktu yang cukup lama,maka sampel akan teroksidasi sempurna sehingga akan meninggalkan berbagai elemen-elemen pada larutan asam dalam bentuk senyawa anorganik yang sesuai untuk dianalisis.
Destruksi basah sangat baik digunakan apabila sampel mengandung materi dalam jumlah sedikit (trace element),bahan yang bersifat sebagai racun seperti Hg,As,Se dan unsur-unsur yang mudah menguap .Prosedur pengabuan basah biasanya menggunakan labu Kjedahl.
2.3.Spectrometry massa induksi plasma berpasangan (ICP mass Spectrometry)
ini.Kelebihan alat ini adalah sangat selektif dan dapat digunakan untuk mengukur beberapa unsur sekaligus didalam sampel pada saat pengukuran.
Akan tetapi dengan semakin banyaknya permintaan pengukuran ternyata alat ini mempunyai kelemahan yaitu akan menjadi kurang sensitif terhadap pengukuran unsur yang mempunyai panjang gelombang dibawah 200 nm.Keterbatasan pengukuran tersebut ditunjukkan dengan nilai limit deteksi yang diperoleh.Pada penelitian yang dilakukan sebelumnya tanpa menggunakan asupan gas N2 maka diperoleh limit deteksi
sebesar 2.4370 ppm untuk unsur Arsenik dan 3.8625 ppm untuk unsur Stibium.Sehingga untuk menganalisa konsentrasi sampel yang lebih rendah tidak dapat dilakukan.
Menurut petunjuk pengoperasian alat ICP AES Plasma 40 dan Annaul Book of ASTM standard,ada cara untuk mengatasi masalah ini antara lain dengan cara mengalirkan gas N2 pada sistim optik.Gas N2 digunakan untuk menghilangkan
pengaruh udara atmosfir dari sistim optik yang diharapkan akan meningkatkan sensitifitas sinar yang dihasilkan dari unsur yang mempunyai panjang gelombang dibawah 200 nm (dekat daerah ultra violet) dapat dideteksi dengan baik dan menurunkan limit deteksi pengukuran (Siti Amina 1997 & Yulia 2003).
2.3.1 Prinsip Kerja Alat Inductively Couple Plasma (ICP)
komponen optik.Sinar yang terdispersi ,secara berurutan akan muncul pada masing-masing panjang gelombang unsur dan dirubah dalam bentuk sinyak listrik yang besarnya sebanding dengan sinar yang dipancarkan oleh besarnya konsentrasi unsur.Sinyal ini kemudian diperoses oleh bagian sistim pengolahan data (Siti Amina 1997).
Langkah kerja ICP-OES 1.Preparasi sampel
Beberapa sampel memerlukan langkah preparasi khusus seperti penambahan asam,pemanasan,dan destruksi dengan microwave.
2.Nebulisasi
Proses pengubahan cairan menjadi aerosol 3.Desolvasi/Volatisasi
Pelarut dihilangkan sehingga terbentuk aerosol kering.
4.Atomisasi
Ikatan atom diputus dan hanya ada atom bebas, suhu plasma dan temperatur sangat penting pada tahap ini.
5.Eksitasi/Emisi
Atom memperoleh energi dari tumbukan dan memancarkan cahaya dari panjang gelombang yang khas.
6.Deteksi/Pemisahan
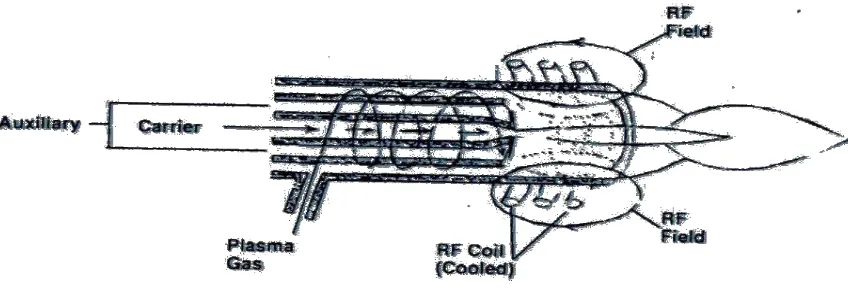
Secara skematik maka alat ICP-MS dapat digambarkan serangkaian berikut ini
Gambar 2.1.Skema alat ICP
Bagian ICP-MS sendiri terdiri atas :
Pengkabutan (nebulisasi) dan bagian penyemprot (chamber)
pengkabutan. Tugas yang utama dari sistem pengkabutan adalah untuk menghasilkan aerosol dengan besar diameter adalah < 10 µ m. Tipe-tipe nebulizer yang umum digunakan didalam alat ICP-MS adalah Meinhard Nebulizer serta Babington Nebulizer, sedangkan untuk tipe nebulizer yang lainnya adalah ultrasonic, concentric serta hydraulic temperature tinggi nebulizer (Thompson 1983).
[image:36.595.152.530.437.601.2]Dengan model Meinhard concentric nebulizer (seperti yang ditunjukkan pada gambar 2.2 larutan sampel mengalir melalui celah pipa kapiler. Gas pada sistem pengkabutan akan memproduksi aerosol dari sampel pada kapiler pengeluaran yang akan mengalir sepanjang kapiler. Sedangkan model microconsentric nebulizer akan bekerja hampir sama seperti model meinhard.
Sedangkan model Babington nebulizer (pada gambar 2.3) sampel akan mengalir membentuk ulir v. Aerosol dibentuk dari film sampel didalam ulir dengan menggunakan gas pembawa melalui lubang yang kecil didasar ulir.
Gambar.2.3 Babington nebulizer
Pada model hydraulic temperatur tinggi nebulizer (HHPN) aerosol dibentuk dengan memompakan memalui nozzle yang berukuran 10 µ m keatas sebuah bola gelas. Gas pengkabutan membawa aerosol kebagian desolvasi, yang diperlukan karena muatan pelarut yang besar. Aerosol yang kering secara langsung akan dibawa ke plasma (Haswell 1981).
perubahan arah sendirinya. Tetesan yang besar tidak akan mengalir langsung pada dinding bagian penyemprot dan akan menuju bagian pembuangan. Maka bagian penyemprot akan memastikan hanya tetesan-tetesan yang cukup kecil yang akan tetap dibagian gas pembawa yang akan dibawa menuju bagian plasma.
Gambar 2.4. Spray camber.
Obor Inductively couple plasma
Gambar 2.5 Obor ICP
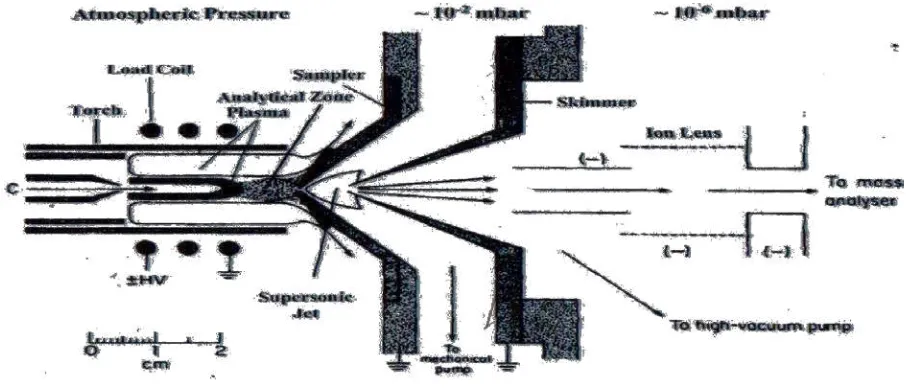
Ekstraksi Ion
Gambar 2.6.Bagian antara plasma serta spektroskopi massa
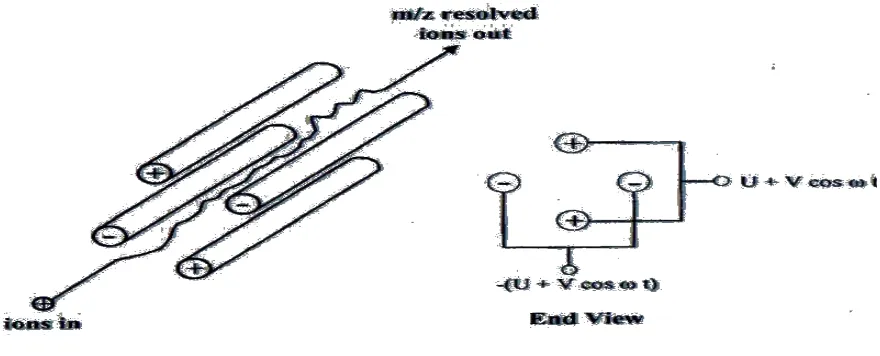
Spektroskopi masssa dengan 4 muatan
Gambar 2.7 skema diagram dari quadropole
Deteksi ion
banyak. Elektron akan terbaca/terdeteksi sebagai sinyal elektron tunggal. Metode ini biasanya dilakukan pada range konsentrasi analit sampai 1mg/l. sedangkan metode analog ( 1 ion yang akan menghasilkan 104 elektron) adalah cocok untuk konsentrasi analit dari 1 sampai 100 mg/L. Pada metode ini multifier tidak akan penuh. Intensitas ion akan dikonversikan dalam suatu pulse yang akan dihitung sebagai sebuah sinyal.
BAB III
METODOLOGI PENELITIAN
3.1.Bahan dan Alat
3.1.1 Bahan-Bahan yang Digunakan
- debu terbang batubara - debu dasar batubara
- HNO3 (pa) E.Merck
- Aquadest - Gas Argon
- Larutan standard Cr(NO3)3 1000 mg/L dalam HNO3 0.5 mol E.Merck
- Larutan standard Mn(NO3)2 1000 mg/L dalam HNO3 0.5 mol E.Merck
- Larutan standard Pb(NO3)2 1000 mg/L dalam HNO3 0.5 mol E.Merck
- Larutan standard Zn (NO3)2 1000 mg/L dalam HNO3 0.5 mol E.Merck
- Larutan standard Cu(NO3)2 1000 mg/L dalam HNO3 0.5 mol E.Merck
- Larutan standard Ni(NO3)2 1000 mg/L dalam HNO3 0.5 mol E.Merck
- Larutan standard Co(NO3)2 1000 mg/L dalam HNO3 0.5 mol E.Merck
3.1.2 Alat yang Digunakan
- InductivelyCouple Plasma (ICP) Liberty RL
- Labu ukur Pyrex
- Corong Scot Duran
- Erlemeyer Pyrex
- Neraca Listrik Mettler
- Pipet tetes - Spatula
- Gelas ukur Pyrex
- Statif - Kaca arloji
- Hot plate Cyramex
- Kertas saring no 42 Whatman
- Botol aquadest
3.2 Prosedur percobaan
3.2.1 Pembuatan Larutan Baku Cr3+ 5mg/L
- Dipipet 5 ml larutan baku Cr3+ 1000 mg/L kedalam labu takar 1000 ml. - Ditambahkan dengan aquadest hingga garis tanda.
- Dihomogenkan.
3.2.1.1 Pembuatan Larutan Baku Cr3+ 0 , 0.25 , 0.50 , 0.75 , 1 mg/L
- Dipipet 0, 5, 10, 15, 20 ml larutan baku Cr3+ 5 mg/L kedalam labu ukur 100 ml.
- Ditambahkan dengan aquadest hingga garis tanda sehingga akan diperoleh kadar Cr3+ 0 , 0.25 , 0.5 , 0.75 , 1 mg/L
3.2.2 Pembuatan Larutan Baku Pb2+ 5 mg/L
- Dipipet 5 ml larutan baku Pb2+ 1000 mg/L kedalam labu takar 1000 ml. - Ditambahkan dengan aquadest hingga garis tanda.
- Dihomogenkan.
3.2.2.1 Pembuatan Larutan Baku Pb2+ 0 , 0.25 , 0.50 , 0.75 , 1 mg/L
- Dipipet 0, 5, 10, 15, 20 ml larutan baku Pb2+ 5 mg/L kedalam labu ukur 100 ml.
- Ditambahkan dengan aquadest hingga garis tanda sehingga akan diperoleh kadar Pb2+ 0 , 0.25 , 0.5 , 0.75 , 1 mg/L
- Dimasukkan masing-masing larutan kedalam gelas erlemeyer 250 ml Dibuat larutan seri standard Zn 2+, Mn2+, Cu2+, Ni2+, Co2+, Cr3+ dengan cara yang sama seperti diatas.
3.3 Penentuan konsentrasi Logam
- 3 g sampel debu batubara ditimbang kedalam erlemeyer 250 ml - ditambahkan 10 ml HNO3 (pa)
- dipanaskan pada hot plate pada suhu 180 oC dan sambil diaduk dengan stirrer selama 20 menit
- diangkat dan didinginkan
- ditambahkan dengan aquadest 50 ml
- dianalisa dengan menggunakan alat ICP MS - dibaca intensitas dari masing-masing ion logam
- dibuat kurva kalibrasi dan dihitung kadar analit dari kurva kalibrasi
3.3.1 Kondisi Alat
3.4.Bagan Penelitian
3.4.1 Pembuatan Larutan Baku Cr3+ 5 mg/L
Dipipet 5 ml larutan standard Cr3+ 1000 mg/L Dimasukkan kedalam labu ukur 1000 ml
Ditambahkan dengan aquadest hingga garis tanda
3.4.2.Pembuatan Larutan Baku Pb2+ 5 mg/L
Dipipet 5 ml larutan standard Pb2+ 1000 mg/L Dimasukkan kedalam labu ukur 1000 ml
Ditambahkan dengan aquadest hingga garis tanda
Pembuatan larutan baku Zn2+, Mn2+, Cu2+, Co2+, Ni2+, dilakukan dengan cara yang sama seperti diatas
Larutan standard Cr3+ 1000 mg/L
Larutan Cr3+ 5 mg/L
Larutan standard Pb2+ 1000 mg/L
3.4.3. Pengukuran konsentrasi Logam Pada Debu Batubara
Dimasukkan kedalam erlemeyer 250 ml Ditambahkan dengan HNO3 (pa) 10 ml
Dipanaskan diatas hotplate sambil diaduk dengan stirrer pada suhu 180 oC selama 20 menit
Diangkat dan didingankan
Ditambahkan dengan aquadest 50 ml Disaring kedalam labu takar 100 ml Diencerkan hingga garis tanda
Dianalisa dengan ICP-MS
Dibaca intensitas dari masing-masing ion logam Dibuat kurva kalibrasi
Dihitung kadar analit dari kurva kalibrasi
( Vidya S.Batra 2006) Hasil
Filtrat Residu
BAB IV
HASIL DAN PEMBAHASAN
4.1. Hasil Percobaan
4.1.1. Penurunan Persamaan Garis Regresi, Koefisien Korelasi, serta penentuan kadar analit Ion logam Mn2+ dengan metode Kurva kalibrasi standard
Hasil Pengukuran intensitas dari suatu seri larutan standard Mn2+ diplotkan terhadap konsentrasi larutan standard sehingga diperoleh suatu kurva kalibrasi berupa garis linear (Kurva 1). Persamaan garis regresi untuk kurva kalibrasi ini dapat diturunkan dengan metode least square yang ditunjukan pada table 4.1 sebagai berikut ini : Tabel 4.1 Data Hasil Penurunan Persamaan Garis Regresi untuk Ion logam Mn2+
Xi (ppm) Yi (Xi- ) (Yi-Y) (Xi- )2 (Yi-Y)2 (Xi- )(Yi- )
0.5 7040 -1 -13056 1 170459136 13056
1 13280 -0.5 -6816 0.25 46457856 3408
1.5 20000 0 -96 0 9216 0
2 26720 0.5 6624 0.25 43877376 3312
2.5 33440 1 13344 1 178062336 13344
∑ 7.5 100480 0 0 2.5 438865920 33120 = = 7.5 / 5 = 1.5 = = 100480 / 5 = 20096
4.1.2. Penurunan Persamaan Garis Regresi
Dimana harga a
=
=
33120 / 2.5 = 13248harga b = – a = 224
Maka persamaan yang diperoleh adalah Y = 13248X + 224
4.1.3.Koefisien korelasi
Koefisien korelasi dapat ditentukan dengan menggunakan persamaan sebagai berikut :
r
=
r
=
= 0.999895
4.1.4. Penentuan Kadar Analit Ion logam Mn2+
Kadar analit ion logam Mn2+ ditentukan dengan menggunakan metode kurva kalibrasi dengan mensubstitusi nilai Y (intensitas) yang diperoleh dari hasil pengukuran terhadap garis regresi dan kurva kalibrasi
Intensitas ion logam Mn2+ pada debu batubara dasar
I1 = 2433,5014 I2 = 2433,5021 I3 = 2433,5017
Dengan mensubstitusi nilai Y ( Intensitas ) kedalam persamaan regresi Y = 13248X + 224 diperoleh
X1 = 0,16677 X2= 0,16678 X3 = 0,16678
X =
=
=
0,16677 mg/LIntensitas ion logam Mn2+ dalam debu batubara terbang
I1 = 6534,0224 I2 = 6534,0231 I3 = 6534,0228
Dengan mensubstitusi nilai Y ( Intensitas ) kedalam persamaan regresi Y = 13248X + 224 diperoleh :
X1 = 0,4763 X2 = 0,4764 X3 = 0,4763
Dengan demikian kadar ion logam Mn2+ dalam debu batubara terbang adalah :
X
=
=
=
0,4763 mg/L4.1.5.Penentuan Konsentrasi ion Logam Mn2+ pada debu batubara dasar dalam satuan mg/Kg
Kadar ion logam Mn2+ = x 106 mg/Kg
= x 106 mg/Kg
=5.5566 mg/Kg
4.1.6.Penentuan Konsentrasi ion Logam Mn2+ pada debu batubara terbang dalam satuan mg/Kg
Kadar ion logam Mn2+ = x 106 mg/Kg
=15.8766 mg/Kg
4.2. Penurunan Persamaan Garis Regresi, Koefisien Korelasi, serta penentuan kadar analit ion logam Zn2+ dengan metode Kurva kalibrasi standard
[image:52.595.107.498.345.471.2]Hasil Pengukuran intensitas dari suatu seri larutan standard Zn2+ diplotkan terhadap konsentrasi larutan standard sehingga diperoleh suatu kurva kalibrasi berupa garis linear (Kurva 2). Persamaan garis regresi untuk kurva kalibrasi ini dapat diturunkan dengan metode least square yang ditunjukan pada table 4.1.2 sebagai berikut ini : Tabel 4.1.2 Data Hasil Penurunan Persamaan Garis Regresi untuk ion logam Zn2+
Xi
(ppm) Yi (Xi-X) (Yi-Y) (Xi-X)2 (Yi-Y)2 (Xi-X)(Yi-Y) 0.5 22765.7 -1 -37675.4 1 1419438779 37675.44
1 40537.1 -0.5 -19904 0.25 396170808.3 9952.02 1.5 60085.7 0 -355.44 0 126337.5936 0
2 79634.3 0.5 19193.16 0.25 368377390.8 9596.58 2.5 99182.9 1 38741.76 1 1500923968 38741.76
∑ 7.5 302205.7 0 0 2.5 3685037284 95965.8 = = 7.5 / 5 = 1.5 = = 302205.7/ 5 = 60441,14
4.2.1. Penurunan Persamaan Garis Regresi
Persamaan garis regresi untuk kurva kalibrasi dapat diturunkan dari persamaan garis Y = aX + b
Dimana harga a
=
=
95965,8/ 2,5 = 38386,32harga b = – a = 2861,66
4.2.2.Koefisien korelasi
Koefisien korelasi dapat ditentukan dengan menggunakan persamaan sebagai berikut :
r
=
r
=
= 0.999829
4.2.3. Penentuan Kadar Analit Ion logam Zn2+
Kadar analit dari ion logam Zn2+ ditentukan dengan menggunakan metode kurva kalibrasi dengan mensubstitusi nilai Y (intensitas) yang diperoleh dari hasil pengukuran terhadap garis regresi dan kurva kalibrasi
Intensitas ion logam Zn2+ pada debu batubara dasar I1 = 3395,2298 I2 = 3395,2302 I3 = 3395,2300
Dengan mensubstitusi nilai Y ( Intensitas ) kedalam persamaan regresi Y = 38386,32X + 2861,66 diperoleh :
X1 = 0,0138 X2 = 0,0139 X3 = 0.0139
Dengan demikian kadar Zn2+ dalam debu batubara dasar adalah :
Intensitas ion logam Zn2+ dalam debu batubara terbang I1= 5802,8198 I2= 5802,8201 I3 = 5802,8196
Dengan mensubstitusi nilai Y ( Intensitas ) kedalam persamaan regresi Y = 38386,32X + 2861,66 diperoleh :
X1 = 0,07662 X2= 0,07662 X3= 0,07661
Dengan demikian kadar ion ion logam Zn2+ dalam debu batubara terbang adalah :
X
=
=
= 0,07661 mg/L
4.2.4.Penentuan Konsentrasi ion Logam Zn2+ pada debu batubara dasar dalam satuan mg/Kg
Kadar ion logam Zn2+ = x 106 mg/Kg
= x 106 mg/Kg
=0.4633 mg/Kg
4.2.5.Penentuan Konsentrasi ion Logam Zn2+ pada debu batubara terbang dalam satuan mg/Kg
Kadar ion logam Zn2+ = x 106 mg/Kg
= x 106 mg/Kg
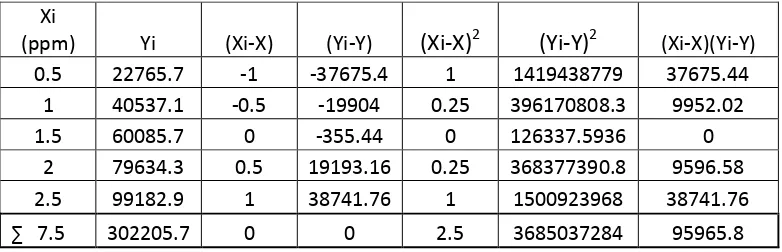
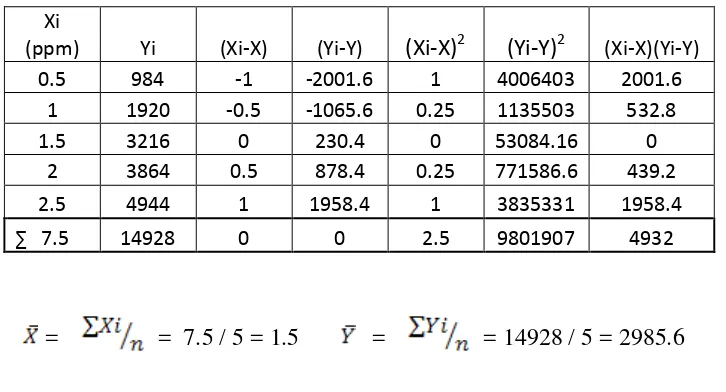
4.3. Penurunan Persamaan Garis Regresi, Koefisien Korelasi, serta penentuan kadar analit ion logam Pb2+ dengan metode Kurva kalibrasi standard
[image:55.595.105.468.312.508.2]Hasil Pengukuran intensitas dari suatu seri larutan standard Pb2+ diplotkan terhadap konsentrasi larutan standard sehingga diperoleh suatu kurva kalibrasi berupa garis linear (Kurva 3). Persamaan garis regresi untuk kurva kalibrasi ini dapat diturunkan dengan metode least square yang ditunjukan pada table 4.1.3 sebagai berikut ini : Tabel 4.1.3 Data Hasil Penurunan Persamaan Garis Regresi untuk ion logam Pb2+
Xi
(ppm) Yi (Xi-X) (Yi-Y) (Xi-X)2 (Yi-Y)2 (Xi-X)(Yi-Y) 0.5 984 -1 -2001.6 1 4006403 2001.6
1 1920 -0.5 -1065.6 0.25 1135503 532.8
1.5 3216 0 230.4 0 53084.16 0
2 3864 0.5 878.4 0.25 771586.6 439.2
2.5 4944 1 1958.4 1 3835331 1958.4
∑ 7.5 14928 0 0 2.5 9801907 4932
= = 7.5 / 5 = 1.5 = = 14928 / 5 = 2985.6
4.3.1. Penurunan Persamaan Garis Regresi
Persamaan garis regresi untuk kurva kalibrasi dapat diturunkan dari persamaan garis Y = aX + b
Dimana harga a
=
=
4932 / 2.5 = 1972,8harga b = – a = 26.4
4.3.2.Koefisien korelasi
Koefisien korelasi dapat ditentukan dengan menggunakan persamaan sebagai berikut :
r
=
r
=
= 0.996318
4.3.3.Penentuan Kadar Analit ion logam Pb2+
Kadar analit ion logam Pb2+ ditentukan dengan menggunakan metode kurva kalibrasi dengan mensubstitusi nilai Y (intensitas) yang diperoleh dari hasil pengukuran terhadap garis regresi dan kurva kalibrasi
Intensitas ion logam Pb pada debu batubara dasar I1 = 64,1988 I2 = 64,1990 I3 = 64,1984
Dengan mensubstitusi nilai Y ( Intensitas ) kedalam persamaan regresi Y = 1972,8X + 26,4 diperoleh :
X1 = 0,019159 X2 = 0,019160 X3 = 0,019157
Dengan demikian kadar Pb2+ dalam debu batubara dasar adalah :
Intensitas Pb2+ dalam debu batubara terbang
I1 = 62,3839 I2 = 62,3842 I3 = 62,3839
Dengan mensubstitusi nilai Y ( Intensitas ) kedalam persamaan regresi Y = 1972,8X + 26,4 diperoleh :
X1 = 0,0182400 X2 = 0,0182402 X3 = 0,0182400
Dengan demikian kadar ion logam Pb2+ dalam debu batubara terbang adalah :
X
=
=
= 0,01824 mg/L
4.3.4.Penentuan Konsentrasi ion Logam Pb2+ pada debu batubara dasar dalam satuan mg/Kg
Kadar ion logam Pb2+ = x 106 mg/Kg
= x 106 mg/Kg
=0.6386 mg/Kg
4.3.5.Penentuan Konsentrasi ion Logam Pb2+ pada debu batubara terbang dalam satuan mg/Kg
Kadar ion logam Pb2+ = x 106 mg/Kg
= x 106 mg/Kg
4.4. Penurunan Persamaan Garis Regresi, Koefisien Korelasi, serta penentuan kadar analit Ion logam Cu2+ dengan metode Kurva kalibrasi standard
[image:58.595.106.586.308.435.2]Hasil Pengukuran intensitas dari suatu seri larutan standard Cu2+ diplotkan terhadap konsentrasi larutan standard sehingga diperoleh suatu kurva kalibrasi berupa garis linear (Kurva 4). Persamaan garis regresi untuk kurva kalibrasi ini dapat diturunkan dengan metode least square yang ditunjukan pada table 4.1.4 sebagai berikut ini : Tabel 4.1.4. Data Hasil Penurunan Persamaan Garis Regresi untuk Ion logam Cu2+
Xi
(ppm) Yi (Xi-X) (Yi-Y) (Xi-X)2 (Yi-Y)2 (Xi-X)(Yi-Y)
0.5 617.7 -1 -1142.98 1 1306403.28 1142.98
1 1201.7 -0.5 -558.98 0.25 312458.6404 279.49
1.5 1785.7 0 25.02 0 626.0004 0
2 2369.7 0.5 609.02 0.25 370905.3604 304.51
2.5 2828.6 1 1067.92 1 1140453.126 1067.92
∑ 7.5 8803.4 0 0 2.5 3130846.408 2794.9
= = 7,5 / 5 = 1,5 = = 8803,4 / 5 = 1760,68
4.4.1. Penurunan Persamaan Garis Regresi
Persamaan garis regresi untuk kurva kalibrasi dapat diturunkan dari persamaan garis Y = aX + b
Dimana harga a
=
=
2794,9 / 2,5 = 1117,96harga b = – a = 83,74
4.4.2.Koefisien korelasi
Koefisien korelasi dapat ditentukan dengan menggunakan persamaan sebagai berikut :
r
=
r
=
= 0.999
4.4.3. Penentuan Kadar Analit Ion logam Cu2+
Kadar analit ion logam Cu2+ ditentukan dengan menggunakan metode kurva kalibrasi dengan mensubstitusi nilai Y (intensitas) yang diperoleh dari hasil pengukuran terhadap garis regresi dan kurva kalibrasi
Intensitas ion logam Cu2+ pada debu batubara dasar I1 = 94,9419 I2 = 94,9420 I3 = 94,9415
Dengan mensubstitusi nilai Y ( Intensitas ) kedalam persamaan regresi Y = 1117,96X + 83,74 diperoleh :
X1 = 0,01002 X2= 0,01002 X3 = 0,01001
Dengan demikian kadar Cu2+ dalam debu batubara dasar adalah :
Intensitas Cu2+ dalam debu batubara terbang I1= 94,0476 I2 = 94,0470 I3 = 94,0471
Dengan mensubstitusi nilai Y ( Intensitas ) kedalam persamaan regresi Y = 1117,96X + 83,74 diperoleh :
X1 = 0,009220 X2 = 0,009219 X3 = 0,009219
Dengan demikian kadar ion logam Cu2+ dalam debu batubara terbang adalah :
X
=
=
= 0,00922 mg/L
4.4.4.Penentuan Konsentrasi ion Logam Cu2+ pada debu batubara dasar dalam satuan mg/Kg
Kadar ion logam Cu2+ = x 106 mg/Kg
= x 106 mg/Kg
=0.334 mg/Kg
4.4.5.Penentuan Konsentrasi ion Logam Cu2+ pada debu batubara terbang dalam satuan mg/Kg
Kadar ion logam Cu2+ = x 106 mg/Kg
= x 106 mg/Kg
4.5. Penurunan Persamaan Garis Regresi, Koefisien Korelasi, serta penentuan kadar analit Ion logam Cr3+ dengan metode Kurva kalibrasi standard
[image:61.595.105.523.304.498.2]Hasil Pengukuran intensitas dari suatu seri larutan standard Cr3+ diplotkan terhadap konsentrasi larutan standard sehingga diperoleh suatu kurva kalibrasi berupa garis linear (Kurva 5). Persamaan garis regresi untuk kurva kalibrasi ini dapat diturunkan dengan metode least square yang ditunjukan pada table 4.1.5 sebagai berikut ini : Tabel 4.1.5. Data Hasil Penurunan Persamaan Garis Regresi untuk Ion logam Cr3+
Xi
(ppm) Yi (Xi-X) (Yi-Y) (Xi-X)2 (Yi-Y)2 (Xi-X)(Yi-Y)
0.5 984 -1 -2116.8 1 4480842.24 2116.8
1 2064 -0.5 -1036.8 0.25 1074954.24 518.4
1.5 3072 0 -28.8 0 829.44 0
2 4368 0.5 1267.2 0.25 1605795.84 633.6
2.5 5016 1 1915.2 1 3667991.04 1915.2
∑ 7.5 15504 0 0 2.5 10830412.8 5184
= = 7,5 / 5 = 1,5 = = 15504 / 5 = 3100,8
4.5.1. Penurunan Persamaan Garis Regresi
Persamaan garis regresi untuk kurva kalibrasi dapat diturunkan dari persamaan garis Y = aX + b
Dimana harga a
=
=
5184 / 2,5 = 2073,6harga b = – a = -9,6
4.5.2.Koefisien korelasi
Koefisien korelasi dapat ditentukan dengan menggunakan persamaan sebagai berikut :
r
=
r
=
= 0.9962
4.5.3. Penentuan Kadar Analit Ion logam Cr3+
Kadar analit ion logam Cr3+ ditentukan dengan menggunakan metode kurva kalibrasi dengan mensubstitusi nilai Y (intensitas) yang diperoleh dari hasil pengukuran terhadap garis regresi dan kurva kalibrasi.
Intensitas ion logam Cr3+ pada debu batubara terbang I1 = 0,7675 I2 = 0,7678 I3 = 0,7676
Dengan mensubstitusi nilai Y ( Intensitas ) kedalam persamaan regresi Y = 2073,6X – 9,6 diperoleh :
X1 = 0,004999 X2 = 0,004999 X3 = 0,004999
Dengan demikian kadar Cu2+ dalam debu batubara terbang adalah :
Intensitas Cr2+ dalam debu batubara dasar I1= 6,9887 I2= 6,9883 I3 = 6,9881
Dengan mensubstitusi nilai Y ( Intensitas ) kedalam persamaan regresi Y = 2073,6X – 9,6 diperoleh :
X1 = 0,00799 X2 = 0,00799 X3 = 0,00799
Dengan demikian kadar Cr3+ dalam debu batubara dasar adalah :
X
=
=
= 0,008 mg/L
4.5.4.Penentuan Konsentrasi ion Logam Cr3+ pada debu batubara dasar dalam satuan mg/Kg
Kadar ion logam Cr3+ = x 106 mg/Kg
= x 106 mg/Kg
=0.2666 mg/Kg
4.5.5.Penentuan Konsentrasi ion Logam Cr3+ pada debu batubara terbang dalam satuan mg/Kg
Kadar ion logam Cr3+ = x 106 mg/Kg
= x 106 mg/Kg
4.6. Penurunan Persamaan Garis Regresi, Koefisien Korelasi, serta penentuan kadar analit Ion logam Ni2+ dengan metode Kurva kalibrasi standard
Hasil Pengukuran intensitas dari suatu seri larutan standard Ni2+ diplotkan terhadap konsentrasi larutan standard sehingga diperoleh suatu kurva kalibrasi berupa garis linear (Kurva 6). Persamaan garis regresi untuk kurva kalibrasi ini dapat diturunkan dengan metode least square yang ditunjukan pada table 4.1.6 sebagai berikut ini : Tabel 4.1.6.Data Hasil Penurunan Persamaan Garis Regresi untuk Ion logam Ni2+
Xi
(ppm) Yi (Xi-X) (Yi-Y) (Xi-X)2 (Yi-Y)2 (Xi-X)(Yi-Y)
0.5 155.5 -1 -284.36 1 80860.6096 284.36
1 298.7 -0.5 -141.16 0.25 19926.1456 70.58
1.5 441.9 0 2.04 0 4.1616 0
2 574.9 0.5 135.04 0.25 18235.8016 67.52
2.5 728.3 1 288.44 1 83197.6336 288.44
∑ 7.5 2199.3 0 0 2.5 202224.352 710.9
= = 7,5 / 5 = 1,5 = = 2199,3 / 5 = 439,86
4.6.1. Penurunan Persamaan Garis Regresi
Persamaan garis regresi untuk kurva kalibrasi dapat diturunkan dari persamaan garis Y = aX + b
Dimana harga a
=
=
710,9 / 2,5 = 284,36harga b = – a = 13,32
4.6.2.Koefisien korelasi
Koefisien korelasi dapat ditentukan dengan menggunakan persamaan sebagai berikut :
r
=
r
=
= 0.9998
4.6.3. Penentuan Kadar Analit Ion logam Ni2+
Kadar analit ion logam Ni2+ ditentukan dengan menggunakan metode kurva kalibrasi dengan mensubstitusi nilai Y (intensitas) yang diperoleh dari hasil pengukuran terhadap garis regresi dan kurva kalibrasi
Intensitas ion logam Ni2+ pada debu batubara dasar I1 = 15,8224 I2 = 15,8230 I3 = 15,8222
Dengan mensubstitusi nilai Y ( Intensitas ) kedalam persamaan regresi Y = 284,36X + 13,32 diperoleh :
X1 = 0,008800 X2 = 0,008802 X3= 0,008799
Dengan demikian kadar Ni2+ dalam debu batubara dasar adalah :
Intensitas Ni2+ dalam debu batubara terbang
I1 = 32,2470 I2 = 32,2471 I3 = 32,2477
Dengan mensubstitusi nilai Y ( Intensitas ) kedalam persamaan regresi Y = 284,36X + 13,32
Maka akan diperoleh :
X1 = 0,066559 X2 = 0,066560 X3 = 0,066562
Dengan demikian kadar Ni2+ dalam debu batubara terbang adalah :
X
=
=
=
0,06656 mg/L4.6.4.Penentuan Konsentrasi ion Logam Ni2+ pada debu batubara dasar dalam satuan mg/Kg
Kadar ion logam Ni2+ = x 106 mg/Kg
= x 106 mg/Kg
=0.2933 mg/Kg
4.6.5.Penentuan Konsentrasi ion Logam Ni2+ pada debu batubara terbang dalam satuan mg/Kg
= x 106 mg/Kg
=0.2186 mg/Kg
4.7. Penurunan Persamaan Garis Regresi, Koefisien Korelasi, serta penentuan kadar analit Ion logam Co2+ dengan metode Kurva kalibrasi standard
[image:67.595.105.503.388.515.2]Hasil Pengukuran intensitas dari suatu seri larutan standard Co2+ diplotkan terhadap konsentrasi larutan standard sehingga diperoleh suatu kurva kalibrasi berupa garis linear (Kurva 7). Persamaan garis regresi untuk kurva kalibrasi ini dapat diturunkan dengan metode least square yang ditunjukan pada table 4.1.7 sebagai berikut ini : Tabel 4.1.7. Data Hasil Penurunan Persamaan Garis Regresi untuk Ion logam Co2+
Xi
(ppm) Yi (Xi-X) (Yi-Y) (Xi-X)2 (Yi-Y)2 (Xi-X)(Yi-Y) 0.5 426.9 -1 -805.58 1 648959.1364 805.58
1 820.6 -0.5 -411.88 0.25 169645.1344 205.94
1.5 1214.3 0 -18.18 0 330.5124 0
2 1638.3 0.5 405.82 0.25 164689.8724 202.91 2.5 2062.3 1 829.82 1 688601.2324 829.82
∑ 7.5 6162.4 0 0 2.5 1672225.888 2044.25 = = 7,5 / 5 = 1,5 = = 6162,4 / 5 = 1232,48
4.7.1. Penurunan Persamaan Garis Regresi
Persamaan garis regresi untuk kurva kalibrasi dapat diturunkan dari persamaan garis Y = aX + b
Dimana harga a
=
=
2024,25 / 2,5 = 817,7Maka persamaan yang diperoleh adalah Y = 817,7X + 5,93
4.7.2.Koefisien korelasi
Koefisien korelasi dapat ditentukan dengan menggunakan persamaan sebagai berikut :
r
=
r
=
= 0.9998
4.7.3. Penentuan Kadar Analit Ion logam Co2+
Kadar analit ion logam Co2+ ditentukan dengan menggunakan metode kurva kalibrasi dengan mensubstitusi nilai Y (intensitas) yang diperoleh dari hasil pengukuran terhadap garis regresi dan kurva kalibrasi
Intensitas ion logam Co2+ pada debu batubara dasar I1 = 16,5764 I2 = 16,5732 I3 = 16,5770
Dengan mensubstitusi nilai Y ( Intensitas ) kedalam persamaan regresi Y = 817,7 X + 5,93 diperoleh :
X1 = 0,01302 X2 = 0,01301 X3= 0,01302
Dengan demikian kadar Co2+ dalam debu batubara dasar adalah :
Intensitas Co2+ dalam debu batubara terbang I1 = 8,1623 I2 = 8,1619 I3 = 8,1623
Dengan mensubstitusi nilai Y ( Intensitas ) kedalam persamaan regresi Y = 817,7X + 5,93 diperoleh :
X1 = 0,0027290 X2 = 0,0027294 X3 = 0,0027297
Dengan demikian kadar Co2+ dalam debu batubara terbang adalah :
X
=
=
=
0,002729 mg/L4.7.4.Penentuan Konsentrasi ion Logam Co2+ pada debu batubara dasar dalam satuan mg/Kg
Kadar ion logam Co2+ = x 106 mg/Kg
= x 106 mg/Kg
=0.434 mg/Kg
4.7.5.Penentuan Konsentrasi ion Logam Co2+ pada debu batubara terbang dalam satuan mg/Kg
= x 106 mg/Kg
=0.0909 mg/Kg
4.8. Pembahasan
Proses pembakaran batubara merupakan salah satu sumber utama dari emisi hasil pembakaran yang tidak diinginkan oleh lingkungan, baik ditinjau dari kualitas maupun bahan polusi yang dikenal dengan nama bahan polutan. Pada pembakaran batubara pengendalian emisi bahan polusi selama pembakaran adalah merupakan salah satu perioritas. Bahan polusi tersebut adalah salah satunya berbentuk abu terbang. Abu terbang ini apabila terlepas ke atmosfir maka akan mengakibatkan udara akan menjadi kotor dan tidak layak lagi untuk menjadi salah satu keperluan hidup manusia.
Kenyataan dalam prakteknya menunjukkan bahwa partikel halus dari abu batubara tersebut masih dapat lepas dan masuk kedalam lapisan atmosfer meskipun telah menggunakan teknik penangkapan debu batubara yang seefektif mungkin. Pengurangan partikel emisi halus paling minimum menggunakan system penangkap debu yang mempunyai tingkat efisiensi tingggi. Electriostatic presipitator dirancang untuk menangkap abu terbang dari proses pembakaran batubara. ( Sukandarmadji 2006) Telah dilakukan analisa terhadap debu batubara terbang serta debu batubara dasar untuk menentukan konsentrasi ion logam Cr3+,Mn2+,Pb2+,Zn2+,Cu2+,Ni2+,Co2+. Sampel diambil secara acak dari tempat penimbunan abu batubara dari pabrik yang menggunakan batubara sebagai bahan bakar boiler. Debu batubara dilarutkan dengan menggunakan HNO3(pa) yang selanjutnya dilakukan pemanasan pada suhu 180 0C serta
Analisa dengan menggunakan alat ICP MS memiliki beberapa keunggulan jika dibandingkan dengan menggunakan teknik analisa seperti AAS ataupun Flame fotometer. Kelebihan alat ini jika dibandingkan dengan metode tersebut adalah tidak dibutuhkan jenis lampu katoda untuk tiap unsur logam yang akan dianalisa serta mampu melakukan analisa multi element secara bersamaan didalam 1 sampel sekaligus. Gangguan spectral yang biasa terjadi pada metode AAS sudah diminimalisasikan dengan pembebasan muatan pada bagian nyala obor yang menggunakan gas pembawa Argon serta penggunaan gelombang radio untuk menarik muatan yang tidak diiginkan. Dari hasil penelitian ini diperoleh konsentrasi ion logam pada debu batubara terbang Mn2+ 15.8766 mg/Kg; Zn2+ 2.554 mg/Kg; Pb2+ 0.6386 mg/Kg; Cu2+ 0.334 mg/Kg; Co2+ 0.091 mg/Kg; Ni2+ 2.2186 mg/Kg; Cr3+ 0.1667 mg/Kg. Sedangkan pada debu batubara dasar Mn2+ 5.5533 mg/Kg; Zn2+ 0.4633 mg/Kg; Pb2+ 0.608 mg/Kg; Cu2+ 0.3073 mg/Kg; Co2+ 0.434 mg/Kg; Ni2+ 0.2933 mg/Kg; Cr3+ 0.2666 mg/Kg. Perhitungan konsentrasi ion logam ini diperoleh dari kurva kalibrasi standard yang dibuat dari pengukuran intensitas dari masing-masing seri standard logam tersebut.
Jika diamati secara keseluruhan maka konsentrasi ion-ion logam paling terakumulatif terdapat pada abu terbang batubara, terkecuali Kromium serta Kobalt.Kandungan ion logam ini akan berbeda jika jenis batubara yang digunakan juga berbeda. Dalam analisa ini jenis batu bara yang diapakai sebagai bahan bakar adalah jenis antrasit. Perbedaan yang terdapat pada kandungan debu terbang serta debu dasar diasumsikan adanya perbedan massa atom. Unsur dengan massa atom yang lebih rendah dapat terbawa dan terakumulatif pada debu terbang seperti Tembaga serta Seng,serta suhu yang tinggi yang mencapai 1000 oC yang juga akan menyebabkan ion logam banyak terbebaskan serta terakumulatif pada debu batubara terbang.( Vidya Batra 2006 ).
Tabel 4.2 Perbandingan konsentrasi ion logam berbagai Negara dari debu terbang
(mg/Kg)