PENGARUH JENIS KOAGULAN TERHADAP VISKOSITAS
LARUTAN PENCUCI PIRING (DISHWASHING LIQUID)
SKRIPSI
OSBAL SUGONDO PASARIBU
090822014
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
UNIVERSITAS SUMATERA UTARA
PENGARUH JENIS KOAGULAN TERHADAP VISKOSITAS LARUTAN PENCUCI PIRING (DISHWASHING LIQUID)
SKRIPSI
Diajukan untuk melengkapi tugas dan memenuhi syarat mencapai gelar Sarjana Sains
OSBAL SUGONDO PASARIBU 090822014
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS SUMATERA UTARA
PERSETUJUAN
Judul : PENGARUH JENIS KOAGULAN TERHADAP
VISKOSITAS LARUTAN PENCUCI PIRING (DISHWASHING LIQUID)
Kategori : SKRIPSI
Nama : OSBAL SUGONDO PASARIBU
Nomor Induk Mahasiswa : 090822014
Program Studi : SARJANA (S-1) KIMIA EKSTENSI
Departemen : KIMIA
Fakultas : MATEMATIKA DAN ILMU PENGETAHUAN
ALAM (MIPA) UNIVERSITAS SUMATERA UTARA
Disetujui di
Medan, Nopember 2011
Komisi Pembimbing :
Pembimbing 2 Pembimbing 1
Dr. Marpongahtun, M.Sc Drs. Abdi Negara Sitompul NIP 196111151988032002 NIP 194607161974031001
Diketahui/Disetujui oleh
Departemen Kimia FMIPA USU Ketua,
PERNYATAAN
PENGARUH JENIS KOAGULAN TERHADAP VISKOSITAS LARUTAN PENCUCI PIRING (DISHWASHING LIQUID)
SKRIPSI
Saya mengakui bahwa Skripsi ini adalah hasil kerja saya sendiri, kecuali beberapa kutipan dan ringkasan yang masing-masing disebutkan sumbernya.
Medan, Nopember 2011
PENGHARGAAN
Puji dan syukur penulis panjatkan kepada Tuhan Yang Maha Esa, atas berkat dan karuniaNya penulis dapat menyelesaikan Skripsi ini yang merupakan salah satu syarat untuk mencapai gelar Sarjana Sains pada Fakultas Matematika dan Ilmu Pengetahuan Alam Universitas Sumatera Utara, Medan. Adapun Judul Skripsi ini adalah: PENGARUH JENIS KOAGULAN TERHADAP VISKOSITAS LARUTAN PENCUCI PIRING (DISHWASHING LIQUID).
Penulis mengucapkan terima kasih yang sebesar-besarnya kepada Ayahanda J. Pasaribu dan Ibunda P. Br Sinaga, Abang, Kakak dan Adik yang tidak dapat saya sebut satu persatu yang memberikan kasih sayangnya, dukungan moril dan materiil kepada penulis dari awal hingga akhir studi penulis.
Pada kesempatan ini, dengan segala ketulusan dan kerendahan hati, Penulis mengucapkan terima kasih kepada Bapak Drs. Abdi Negara Sitompul selaku Dosen pembimbing 1 dan Ibu Dr. Marpongahtun, M.Sc selaku Dosen pembimbing 2 yang telah memberikan segala perhatian, saran dan bimbingan kepada Penulis selama penelitian hingga penulisan skripsi ini. Ucapan terima kasih juga ditujukan kepada Ibu Dr. Rumondang Bulan Nasution, MS dan Bapak Drs. Albert Pasaribu, M.Sc selaku ketua dan wakil ketua Departemen Kimia FMIPA USU, Dekan dan Pembantu Dekan FMIPA USU, beserta semua Dosen di Departemen Kimia FMIPA USU. Syamsul Bahri, MS selaku kepala Laboratorium Kimia Fisika-USU beserta seluruh staf dan asisten Laboratorium Kimia Fisika-US. Seluruh teman-teman yang turut serta dalam memberikan saran dan dorongan dalam penyelesaian skripsi ini.
ABSTRAK
INFLUENCE OF TYPE OF COAGULAN TO VISCOSITY DISHWASHING LIQUID
ABSTRACT
DAFTAR ISI
2.2. Penggolongan Deterjen ... 7
2.3. Komponen Penyusun Deterjen ... 8
2.3.1. Surfaktan ... 8
2.4.1. Penggolongan Koloid ... 12
2.4.2. Sifat-sifat Koloid ... 13
2.5. Koagulasi ... 15
2.5.1. Faktor-Faktor yang mempengaruhi Koagulasi ... 16
2.5.2. Pembentukan Koagulan ... 16
2.6. Kegunaan Koloid ... 17
2.7. Viskositas ... 18
2.7.1. Faktor-Faktor Yang Mempengaruhi Viskositas ... 19
2.7.2. Pengukuran Viskositas ... 20
2.7.3. Viskositas Hopler ... 20
2.7.4. Viskositas Ostwald ... 21
BAB 3. BAHAN DAN METODE PENELITIAN 3.1. Alat-Alat ... 23
3.2. Bahan-Bahan ... 24
3.3. Metode Penelitian ... 24
3.3.1. Populasi ... 24
3.3.3. Randomisasi ... 25
3.3.4. Persiapan ... 26
3.3.4.1. Pencucian Alat ... 26
3.3.4.2. Kalibrasi Alat ... 26
3.3.5. Pembuatan Larutan ... 27
3.3.5.1. Pembuatan Larutan NaCl 30% ... 27
3.3.5.2. Pembuatan Larutan Na2SO4 15% ... 27
3.3.5.3. Pembuatan Larutan Na3PO4 10 % ... 27
3.3.5.4. pembuatan Larutan Natrium Lauril Eter Sulfat 33,3 % ... 27
3.3.5.5. Pembuatan Larutan Natrium Lauril Sulfat 33,33 % ... 28
3.3.5.6. pembuatan larutan pencuci piring ... 28
3.3.6. Pengumpulan Data ... 28
3.3.6.2. Pengukuran Waktu Alir ... 28
3.3.6.3. Penentuan Densitas ... 29
3.4. Pengolahan dan Analisa Data ... 29
3.4.1. Penentuan Kesalahan ... 29
3.4.1.1. Sumber Kesalahan Sistematik ... 29
3.4.1.2. Kesalahan random (Intermediate) ... 30
3.4.1.3. Kesalahan Gabungan Dari Kesalahan Random ... 30
3.4.2.Penentuan Ketidakpastian Dalam Signifikan Figur ... 30
3.4.2.1. Perhitungan Ketidakpastian Persentase NaCl ... 30
3.4.2.2. Perhitungan Ketidakpastian Persentase Na2SO4 ... 31
3.4.2.3. Perhitungan Ketidakpastian Persentase Na3PO4 ... 32
3.4.4.4. Ketidakpastian Pipet Volum 5 mL ... 33
3.4.4.5. Ketidakpastian Pipet Volum 10 mL ... 34
3.4.4.6. Ketidakpastian Gelas Ukur 10 mL ... 35
3.4.4.7. Ketidakpastian Gelas Ukur 100 mL ... 35
3.4.3. Pengolahan Data ... 36
3.4.3.1.Perhitungan Nilai Densitas Larutan Pencuci Piring ... 36
3.4.3.2.Perhitungan Nilai Viskositas Larutan Pencuci Piring ... 37
3.4.4. Analisa Data ... 37
3.4.4.1. Analisa Variansi ... 37
3.4.4.2. Uji Hipotesa ... 39
3.5. Skema Pengambilan Data ... 40
3.5.1. Skema Pembuatan Larutan Pencuci Piring ... 40
3.5.2. Skema Penentuan Waktu Alir Larutan Pencuci Piring ... 41
3.5.3. Skema Penentuan Densitas Larutan Pencuci Piring ... 41
BAB 4. HASIL DAN PEMBAHASAN 4.1. Hasil ... 42
4.2. Pembahasan ... 43
4.2.1. Hipotesa ... 44
BAB 5. KESIMPULAN DAN SARAN 5.1. Kesimpulan ... 46
5.2. Saran ... 46
DAFTAR TABEL
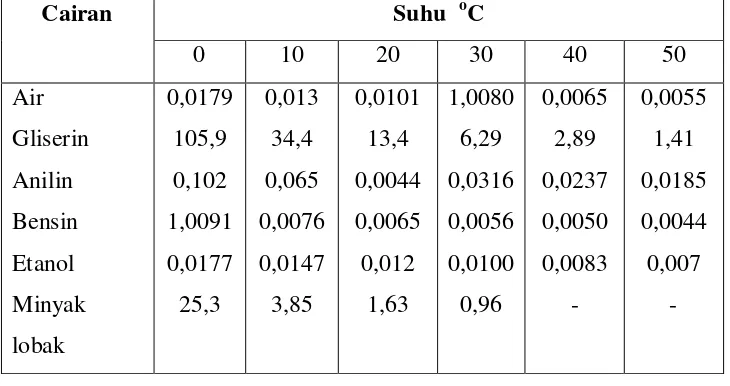
Tabel 2.1 Viskositas Cairan Dalam Berbagai Suhu ... 21 Tabel 4.1 Data Hasil Pengukuran Viskositas Larutn Pencuci piring ... 42 Tabel 4.2 Data Hasil Perhitungan Pengaruh Jenis Koagulan Terhadap Nilai
Viskositas Larutan Pencuci Piring ... 43 Tabel 4.3 Analisa Sidik Ragam Pengaruh Jenis Koagulan Terhadap Viskositas
Larutan Pencuci Piring ... 43 Tabel 4.4 Analisis Sidik Ragam Pengaruh Jenis Koagulan Terhadap Nilai
DAFTAR GAMBAR
Gambar 2.1 Tahap Pembuatan Surfaktan Natrium Laurel Sulfat ...6 Gambar 2.2 Lambang Umum Untuk Suatu Surfaktan ...8 Gambar 2.3 Alkil Benjen Sulfonat Linier ...9 Gambar 4.1 Grafik Pengaruh Jenis Koagulan Terhadap Viskositas Larutan
ABSTRAK
INFLUENCE OF TYPE OF COAGULAN TO VISCOSITY DISHWASHING LIQUID
ABSTRACT
BAB 1
PENDAHULUAN
1.1. Latar Belakang
Larutan pencuci piring merupakan salah satu produk yang sangat penting dalam kehidupan sehari-hari, terutama untuk keperluan rumah tangga. Larutan pencuci piring berfungsi untuk membersihkan peralatan dan peralatan jenis berdasarkan bentuk fisiknya. Berbentuk bubuk atau serbuk, berbentuk pasta atau lebih dikenal dengan sabun colek, dan produk ketiga dalam bentuk cairan kental.
Pemakaian produk pencuci piring (dishwashing liquid) dari waktu ke waktu mengalami peningkatan yang cukup tinggi. Hal ini diakibatkan terjadinya pergeseran pola pencucian piring, termasuk alat rumah tangga lain dari cara yang tradisional dengan menggunakan abu gosok dan sabun colek menuju cara baru yang lebih praktis. Larutan pencuci piring memiliki nilai lebih dibandingkan dengan produk pencuci piring lainnya. Hal ini dikarenakan bentuknya yang berupa cair kental sehingga lebih praktis untuk digunakan dan memiliki aroma yang khas.
Pada dasarnya cukup banyak bahan baku yang dapat dipakai dalam pembuatan cairan pencuci piring. Bahan baku untuk pembuatan detergen terdiri dari bahan aktif, koagulan yang juga sebagai pengisi (filler) yang berfungsi sebagai pembentuk inti pada proses pemadatan yang dapat mempengaruhi viskositas larutan, dan bahan tambahan (additif). Bahan aktif yang digunakan adalah jenis surfaktan yang merupakan bahan utama pembuatan deterjen karena bahan ini mempunyai kemampuan mengikat dan mengangkat kotoran. Bahan surfaktan dari larutan pencuci piring akan menghasilkan busa.1
1
Koagulan dalam pembuatan larutan pencuci piring adalah garam Natrium Klorida
(NaCl), Natrium Sulfat (Na2SO4), dan Natrium Pospat (Na3PO4) yang berfungsi sebagai pembentuk inti pada proses pemadatan yang dapat mempengaruhi viskositas larutan sehingga terjadi perubahan viskosoitas larutan pencuci piring. Penambahan koagulan menjadikan larutan pencuci piring semakin mudah penggunaannya.
Pemilihan garam NaCl, Na2SO4, dan Na3PO4 sebagai koagulan karena larut dalam air, mudah terurai, dan tidak menyebabkan pencemaran lingkungan. Bahan aditif seperti pewarna dan pewangi hanyalah bertujuan sebagai komersialisasi produk.2
Larutan pencuci piring digolongkan kedalam jenis koloid yang dinamakan koloid assosiasi, kadang kadang dinamakan koloid elektrolit. Bahan pencuci piring adalah sol yaitu disperse koloid dimana partikel padat terdispersi dalam cairan. Proses
koagulasi ini terjadi akibat tidak stabilnya sistem koloid. Jika muatan pada sistem koloid tersebut dilucuti dengan cara menetralkan muatannya dengan menambahkan koloid yang lain, atau dengan penambahan elektrolit maka koloid tersebut menjadi tidak stabil lalu terkoagulasi.3
Mutu dari suatu Larutan pencuci piring dapat diketahui dari sifat fisik maupun sifat kimianya. Sihombing J. Bony Boy (2010) telah meneliti efek penambahan larutan natrium sulfat (Na2SO4) 25% terhadap viskositas larutan pencuci piring.
Dimana dengan memvariasikan volume larutan Na2SO4 25% untuk memperoleh viskositas maksimum larutan pencuci piring.
Dalam penelitian ini penulis membahas viskositas larutan pencuci piring dengan variasi jenis koagulan pada volume tetap. Suatu zat cair mempunyai kekentalan yang berbeda-beda dan Secara kualitatif kekentalan suatu cairan dinyatakan dengan angka kekentalan yang dinamakan konstanta viskositas. Untuk
mengetahui kekentalan suatu larutan perlu dilakukan pengukuran viskostas. Dalam hal ini alat uji yang digunakan adalah Viskosimeter Ostwald. Dari uraian di atas dan melalui penelitian ini penulis ingin mengetahui bagaimana pengaruh anion dari jenis koagulan larutan Natrium Klorida, Natrium Sulfat dan Natrium Pospat terhadap perubahan viskositas larutan pencuci piring.
2
.Ibid
3
1.2.Perumusan Masalah
1. Adakah pengaruh jenis koagulan terhadap viskositas larutan pencuci piring (dishwashing liquid) ?
2. Bagaimanakah nilai viskositas larutan pencuci piring (dishwashing liquid) dengan penambahan jenis koagulan larutan NaCl, Na2SO4, dan Na3PO4 ?
1.3.Pembatasan Masalah
Dalam penelitian ini penulis membatasi masalah penelitian dengan menentukan viskositas larutan pencuci piring setelah penambahan koagulan. Bahan baku utama yang digunakan untuk pembuatan larutan pencuci piring adalah natrium lauril eter sulfat. Jenis koagulan yang digunakan adalah larutan Natrium Klorida (NaCl), Natrium Sulfat (Na2SO4), dan Natrium Pospat (Na3PO4). Viskositas larutan pencuci
piring ditentukan dengan menggunakan Viskosimeter Ostwald. Volume koagulan yang digunakan adalah 50 mL. Penelitian ini dilakukan pada suhu laboratorium yaitu 25 oC, hal ini dikarenakan adanya pengaruh suhu terhadap viskositas larutan.
1.4.Tujuan penelitian
1. Untuk mengetahui bagaimana pengaruh jenis koagulan terhadap viskositas larutan
pencuci piring.
2. Untuk mengetahui bagaimana nilai viskositas larutan pencuci piring dengan penambahan jenis koagulan laruan NaCl, larutan Na2SO4, dan latuan Na3PO4.
1.5.Manfaat Pelelitian
1.6.Metodologi Penelitian
Penelitian ini adalah eksperimen laboratorium dengan memvariasikan jenis koagulan yaitu larutan NaCl, Na2SO4, Na3PO4 (sebagai variabel bebas). Viskositas larutan pencuci piring diuji dengan menggunakan Viskosimeter Ostwald (sebagai variabel terikat). Faktor pengadukan yang menentukan tingkat kehomogenan dan faktor suhu yang mempengaruhi viskositas larutan pencuci piring, sehingga ditetapkan pada suhu laboratorium 25 oC (sebagai variabel tetap).
Pernambahan koagulan dilakukan pada volume tetap dan replikasi dilakukan tiga kali untuk setiap perlakuan dari masing-masing sampel. Subjek penelitian adalah larutan pencuci piring yang bersifat homogen, sehingga perlakuan untuk
masing-masing sampel dilakukan secara acak. Karena ada tiga jenis koagulan yang diteliti maka rancangan yang digunakan adalah rancangan acak kelompok sederhana.
1.7.Lokasi Penelitian
BAB 2
TINJAUAN PUSTAKA
2.1. Deterjen
Deterjen berasal dari bahasa latin yaitu detergere yang berarti membersihkan. Detergen merupakan penyempurnaan dari produk sabun. Deterjen sering disebut dengan istilah detergen sintetis yang mana detergen berasal dari bahan-bahan turunan minyak bumi. Dibanding dengan produk terdahulu yaitu sabun, deterjen mempunyai keunggulan antara lain mempunyai daya cuci yang lebih baik serta tidak terpengaruh oleh kesadahan air.
Kebutuhan akan detergen meningkat dengan adanya dua kelemahan pada sabun. Pertama, sabun merupakan garam dari asam lemah, larutannya agak basa karena adanya hidrolisis parsial. Masalah kedua ialah bahwa sabun biasa membentuk garam dalam air sadah yang mengandung kation logam-logam tertentu seperti Ca, Mg, Fe, dan Kation-kation tersebut menyebabkan garam-garam natrium atau kalium dari
asam karboksilat yang semula larut menjadi garam-garam karboksilat yang tidak larut mengakibatkan warna cokelat pada pakaian.1
Masalah sabun dapat dikurangi dengan menciptakan deterjen yang lebih
efektif yaitu deterjen sintetik. Deterjen sintetik ini harus mempunyai beberapa sifat, termasuk rantai hipofilik yang panjang dan ujung ionik polar. Juga ujung yang polar tidak membentuk garam yang mengendap dengan ion-ion dalam air sadah, sehingga tidak mempengaruhi keasaman air.2
1
Rigby Heinemann., 1992, Chemistry Two, Australian Pty. Ltd. Heinemann Education : Australia.
2
Deterjen dipengaruhi jenis kotoran yang akan dihilangkan dan air yang
digunakan. Deterjen, khususnya surfaktannya memiliki kemampuan yang unik untuk mengangkat kotoran, baik yang larut dalam air maupun yang tak larut dalam air. Salah satu ujung dari molekul surfaktan bersifat lebih suka minyak atau tidak suka air, akibatnya bagian ini menetrasi kotoran yang berminyak. Ujung molekul surfaktan
satunya lebih suka air, bagian inilah yang berperan mengendorkan dan mendispersikan kotoran dari cucian.
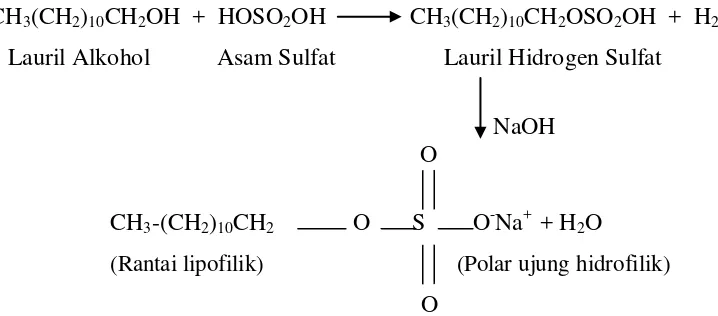
Natrium lauril sulfat adalah deterjen yang baik, karena garamnya berasal dari asam kuat dan larutannya netral. Garam kalsium dan magnesiumnya tidak mengendap dalam larutannya, sehingga dapat di pakai dengan air sadah. Sintesis garam natrium dari alkil hidrogen sulfat menghasikan detergen. Alkohol berantai panjang di buat dengan cara penghidrogenan lemak dan minyak. Alkohol berantai panjang direaksikan dengan asam sulfat menghasilkan alkil hidrogen sulfat dan kemudian dinetralkan dengan basa. Tahap pembuatan surfaktan natrium laurel sulfat diperlihatkan pada Gambar 2.1 dibawah ini:
Gambar 2.1 Tahap Pembuatan Surfaktan Natrium Laurel Sulfat
Dewasa ini, deterjen yang umum digunakan ialah alkil benzene sulfonat berantai lurus. Pembuatannya melalui tiga tahap. Alkena rantai lurus dengan jumlah karbon 10-14 direaksikan dengan benzene dan katalis Friedeft-Craft (AlCl3 atau HF) akan membentuk ikatan alkil benzene. Sulfonasi dan penetralan dengan basa akan melengkapi proses ini. Deterjen jenis ini mudah didegradasi secara biologis oleh mikroorganisme dan tidak berakumulasi pada lingkungan.3
3
2.2. Penggolongan Deterjen
Deterjen merupakan salah satu produk industri yang sangat penting dalam kehidupan sehari-hari, terutama untuk keperluan rumah tangga dan industry. Setelah Perang Dunia II, deterjen sintetik mulai dikembangkan akan tetapi karena gugus utama
surfaktant ABS yang sulit di biodegradasi maka pada tahun 1965 industri mengubahnya dengan yang biodegradabel yaitu dengan gugus utama surfaktant LAS.
Proses pembuatan deterjen dimulai dengan membuat bahan penurun tegangan permukaan, misalnya alkilbenzena sulfonat dengan gugus alkil yang sangat bercabang disintesis dengan polimerisasi propilena dan dilekatkan pada cincin benzena dengan reaksi alkilasi Friedel-Craft Sulfonasi, yang disusul dengan pengolahan dengan basa.4
Berdasarkan dapat tidaknya zat aktif terdegradasi, detergen terbagi atas dua bagian yaitu, detergen keras dan detergen lunak.
a. Deterjen Keras
Deterjen keras mengandung zat aktif yang sukar dirusak oleh mikroorganisme meskipun bahan itu telah di pakai dan telah di buang. Hal ini diakibatkan adanya rantai cabang pada atom karbon, akibatnya zat tersebut masih aktif dan jenis inilah
yang dapat menyebabkan pencemaran air, seperti Alkil Benzene Sulfonat.
b. Deterjen Lunak
Deterjen ini mengandung zat aktif yang relatif mudah untuk di rusak mikroorganisme karena umumnya zat aktif ini memiliki rantai karbon yang tidak bercabang, sehingga setelah dipakai, zat aktif ini akan rusak, contohnya Linier Alkil Benzene Sulfonat.5
15 Juli 2008
5
2.3. Komponen Penyusun Deterjen
Deterjen adalah Surfaktan anionik dengan gugus alkil (umumnya C9 – C15) atau garam dari sulfonat atau sulfat berantai panjang dari Natrium (RSO3- Na+ dan ROSO3-Na+) yang berasal dari derifat minyak nabati atau minyak bumi (fraksi parafin dan olefin).
Komponen penyusun deterjen adalah surfaktan sebagai bahan baku utama yang memiliki sifat pembersih, bahan penguat (builder), bahan pengisi (filler), bahan tambahan (additif), dan air sebagai bahan pelarut larutan pencuci piring.
2.3.1. Surfaktan
Detejen termasuk dalam kelas umum yang disebut dengan surfaktan yakni senyawa yang dapat menurunkan tegangan permukaan air. Molekul surfaktan mengandung suatu ujung hidrofobik dan satu ujung hidrofobik. Surfaktan (surface active agents) menurunkan tegangan permukaan air dan mematahkan ikatan-ikatan hidrogen pada permukaan. Hal ini dilakukan dengan menaruh kepala hidrofiliknya pada permukaan air dengan ekor hidrofiliknya terentang menjauhi permukaan air. Secara umum lambing untuk surfaktan diperlihatkan pada Gambar 2.2 dibawah ini.
Ekor hidrofobik Kepala hidrofilik
Gambar 2.2 Lambang umum untuk suatu Surfaktan
Molekul-molekul dan ion-ion yang diadsorbsi pada antar muka dinamakan
surfaktan. Nama lainnya adalah amfifil, yang menunjukkan bahwa molekul atau ion tersebut mempunyai affinitas tertentu baik solven polar maupun non polar. Tergantung dari jumlah dan sifat dari gugus-gugus polar dan non polar yang ada padanya, amfifil dapat bersifat hidrofilik (suka air), lipofilik (suka minyak) atau bersifat seimbang.6
6
Sebagai contoh, alkohol-alkohol berantai lurus, amina-amina dan asam asam
semuanya adalah amfifil yang sifatnya dapat berubah dari hidrofilik atau lipofilik jika jumlah atom-atom karbon dalam rantai alkilnya bertambah. Oleh karena itu, etil akohol dapat bercampur dengan air dalam semua perbandingan. Sebagai bandingan, kelarutan amil akohol dalam air sangat berkurang, sedang setil alkohol dapat
dikatakan bersifat lipofilik dan tidak larut dalam air.7
Surfaktan digolongkan berdasarkan struktur kimianya atau berdasarkan sifat gugus hidrofilik dan gugus hidrofobiknya. Surfaktan memiliki rantai atom karbon yang panjang yang merupakan bagian yang hidrofobik. Oleh karena adanya kedua bagian ini dalam suatu senyawa maka disebut dengan ampifilik.
1. Surfaktan Anionik
Surfaktan anionik merupakan surfaktan dengan bagian aktif pada permukaannya mengandung muatan negatif. Contoh dari jenis surfaktan anionik adalah alkil benzena sulfonat linier pada Gambar 3 di bawah ini, Alkohol Sulfat (AS), Alkohol Eter Sulfat (AES), Natriuum Laurel Eter Sulfat (SLES).
SO3-Na+
Gambar2.3 Alkil Benzena Sulfonat Linier
2. Surfaktan Kationik
Surfaktan ini merupakan surfaktan dengan bagian aktif pada permukaannya mengandung muatan positif. Surfaktan ini terionisasi dalam air serta bagian aktif pada permukaannya adalah bagian kationnya. Contoh jenis surfaktan ini adalah ammonium kuarterner.8
7 ibid 8
3. Surfaktan Nonionik
Surfaktan yang tidak terionisasi di dalam air adalah surfaktan nonionik yaitu surfaktan dengan bagian aktif permukaanya tidak mengandung muatan apapun, contohnya: alkohol etoksilat, polioksietilen (R-OCH2CH).
4. Surfaktan Ampoterik
Surfaktan ampoterik dapat bersifat sebagai non ionik, kationik, dan anionik di dalam larutan, jadi surfaktan ini mengandung muatan negatif maupun muatan positif pada bagian aktif pada permukaannya. Contohnya: Sulfobetain (RN+(CH3)2CH2CH2SO3-.9
2.3.2. Builder (Bahan Penguat)
Builder adalah suatu bahan yang dapat menambah kerja dari bahan penurun tegangan permukaan dengan cara menonaktifkan mineral penyebab kesadahan air. Builders digunakan untuk melunakkan air sadah dengan cara mengikat mineral-mineral yang terlarut, sehingga surfaktan dapat berkonsentrasi pada fungsi utamanya. Builder juga membantu menciptakan kondisi keasaman yang tepat agar proses pembersihan dapat berlangsung lebih baik serta membantu mendispersikan dan mensuspensikan kotoran yang telah lepas.
Dalam pembuatan detergen, builder sering ditambahkan dengan maksud meningkatkan efisiensi pencuci dari surfaktan dengan cara menon-aktifkan mineral penyebab kesadahan air. Baik berupa Phosphat (Sodium Tri Poly Phosphate/STPP), Asetat (Nitril Tri Acetat/NTA, Ethylene Diamine Tetra Acetat/EDTA), Silikat (Zeolit), dan Sitrat (asam sitrat). Builder juga berfungsi untuk mencegah mengendapnya kembali kotoran-kotoran yang terdapat pada bahan yang akan dicuci.10
9
Sastrohamidjojo, H. 2005, Kimia Organik, Gadjah Mada University Press : Yogyakarta.
10
2.3.3. Pengisi (Filler)
Bahan ini berfungsi sebagai pengisi dari seluruh campuran bahan baku yang berguna untuk memperbanyak atau memperbesar volume. Keberadaan bahan ini dalam campuran bahan baku detergen semata-mata ditinjau dari aspek ekonomis. Namun selain digunakan sebagai pembantu proses, bahan pengisi ini juga berfungsi meningkatkan kekuatan ionik dalam larutan pencuci. Pada umumnya sebagai bahan pengisi digunakan Natrium Sulfat (Na2SO4) Natrium Klorida, dan Natrium Pospat.11
Sekitar 50% dari Natrium Sulfat yang dikonsumsi di Amerika Serikat digunakan untuk membuat pulp Kraft. Kerk Garam, sesudah direduksi menjadi Natriun Sulfida atau sesudah dihidrolisis menjadi kaustik, digunakan sebagai bahan
penolong untuk mencernakan kapur pulp dalam melarutkan lignin. Kira-kira 30% masuk kedalam ramuan detegen rumah tangga dan sisanya digunakan untuk berbagai tujuan, antara lain pembuatan Kaca, Pakan ternak, Zat warna, Tekstil, dan Obat-obatan. Membuat Natrium Sulfat bermutu tinggi adalah dengan proses Hargreaves. Persamaan reaksinya adalah:
4NaCl + 2SO2 + 2H2O + O2 2 Na2SO4 + 4HCl.
Dari keseluruhan produksi natrium sulfat yang dihasilkan, 46% berasal dari air garam alam. Sumber utama Natrium Sulfat yang berasal dari hasil sampingan industri seperti industri pembuatan bahan kimia krom. Persama pembuatan Natrium Sulfat dari asam sulfat dan garam menurut proses Mannheim adalah sebagai berikut:
NaCl + H2SO4 NaHSO4 + HCl NaHSO4 + NaCl Na2SO4 + HCl
Bila suhu didalam tanur sudah mencapai tingkat yang diperlukan, maka garam yang sudah digiling halus dan bahan baku lainnya pun diisikan. Tanur itu dijalankan secara kontinu, tumpak demi tumpak sampai kemudian dihentikan dan ditutup untuk pembersihan dan pemeliharaan berkala.12
11 Purnomo Ajar., 2002, Membuat Cairan Pencuci Piring, Penebar Swadaya : Jakarta. 12
2.3.4. Bahan Tambahan (Additif)
Bahan tambahan (additif) digunakan untuk membuat produk lebih menarik, misalnya pewangi, pemutih, pelembut, pewarna, dan lain sebagainya. Bahan ini tidak berhubungan langsung dengan daya cuci deterjen, bahan ini ditambahkan lebih untuk maksud komersialisasi produk.
2.3.5. Air
Kadar air menunjukkan banyaknya terdapat dalam suatu bahan. Kualitas air yang digunakan adalah air yang dapat di minum yang berarti air yang bebas kandungan dari bakteri berbahaya dan ketidakmurnian kimiawi. Air ini harus jernih, tidak berwarna, tidak berbau, dan tidak mengandung bahan tersuspensi atau kekeruhan.13
2.4. Koloid
Koloid merupakan suatu sistem dispersi karena terdiri dari dua fase terdispersi dan fase pendispersi. Fase terdispersi umumnya memiliki jumlaah yang lebih kecil atau mirip dengan zat terlarut dan fase pendispersi jumlahnya lebih besar atau mirip pelarut pada suatu larutan. Salah satu perbedaan nya antara antara koloid dan kristaloid adalah ukuran partikelnya. Berdasarkan ukuran partikel ini, campuran zat dapat dibedakan
menjadi tiga yaitu : kristaloid (larutan sejati) memiliki diameter partikel lebih kecil dari 1 nm, koloid memiliki diameter partikel antara 1-100 nm, dan suspense yang memiliki diameter partikel lebih besar dari 100 nm.
2.4.1. Penggolongan Koloid
Berdasarkan cara pembentukannya koloid dibedakan menjadi koloid dispersi, koloid asosiasi dan koloid makromolekul.14
13
Purnomo Ajar., 2002, Membuat Cairan Pencuci Piring, Penebar Swadaya : Jakarta.
14
1. Koloid disprsi, yaitu koloid yang terbentuk dari penyebaran partikel-partikel
kecil yang tidak larut dalam medium (fase pendispersi) dengan membentuk agregat molekul atau atom yang sangat banyak.contohnya dispersi koloid emas dan belerang.
2. Koloid asosiasi yaitu koloid yang terbentuk dari gabungan molekul-molekul kicil, atom atau ion yang larutdalam medium sehingga membentuk agregat-agregat yang disebut misel. Koloid asosiasi kadang-kadang dinamakan koloid
elektrolit. System ini terdiri dari molekul-molekul yang berat molekulnya yang rendah yang beragregasi membentuk partikel berukuran koloid. Contoh koloid asosiasi adalah sabun dan detergen.
3. Koloid makromolekul, yaitu koloid yang terbentuk dari makromolekul tunggal yang sangat besar. Contoh dari koloid ini adalah polimer tingggi seperti karet dan plastik.
Ditinjau dari interaksinya antasa fase pendispersi dan fase terdispersi koloid dibedakan menjadi koloid liofil dan koloid liofob. Koloid liofob yaitu koloid yang memiliki daya tatik kuat dengan medium pendispersinya, sehingga sulit dpisahkan (stabil). Bila mediumnya air disebut koloid hidrofil. Koloid liofob yaitu koloid yang daya tariknya kecil terhadap medium pendispersinya, sehingga cenderung memisah (tidak stabil). Bila mediumnya air disebut koloid hidrofob. Contohnya koloid Fe(OH)3 dan sol emas dalam air.15
2.4.2. Sifat–Sifat Koloid
Koloid mmpunyai sifat yang berbeda dengan larutan. Sifat khusus koloid timbul akibat ukuran partikelnya yang lebih besar daripada larutan. Sifat sifat tersebut adalah sebagai berikut:
1. Sifat Fisik
pendispersinya. Sedangkan koloid hidrofil karena terjadi hidrasi sifat fisiknya sangat
berbeda dengan sifat mediumnya, viskositasnya lebih besar dan tegangan mukanya lebih kecil. Bila sol tersebut menggunakan air sebagai medium, maka kedua jenis koloid tersebut adalah sol hidrofil dan sol hidrofob.
Sol liofil lebih kental daripada mediumnya dan tidak terkoagulasi jika
ditambah sedikit elektrolit. Oleh karena itu, koloid liofil lebih stabil jika dibandingkan dengan koloid liofob. Untuk mengumpalkan koloid liofil diperlukan elektrolit dalam jumlah banyak, sebab selubung molekul-molekul cairan yang berfungsi sebagai pelindung harus dipecahkan terlebih dahulu. Untuk memisahkan mediumnya. Pada koloid liofil, dapat dilakukan dengan cara pengendapan atau penguraian. Akan tetapi, jika zat mediumnya ditambah lagi, maka akan terbentuk koloid liofil lagi. Dengan kata lain, koloid liofil bersifat reversibel. Koloid liofob mempunyai sifat yang berlawanan dengan koloid liofil.
2. Sifat Koligatif
Suatu koloid dalam medium cair juga mempunyai siifat koligatif. Sifat ini hanya bergantung pada jumlah partikel koloid bukan pada jenisnya. Sifat-sifat koligatif koloid umumnya lebih kecil daripada larutan sejati dengan jumlah partikel yang sama. Sifat koligatif berguna untuk menghitung konsentrasi atau jumlah partikel koloid.
3. Sifat Listrik
Partikel permukaan koloid mempunyai muatan listrik disebabkan terjadinya ionisasi
atau penyerapan ion-ion dalam larutan. Jika sepasang elektroda dimasukkan ke dalam sistem koloid, partikel koloid yang bermuaran positif akan menuju elektroda negatif (katoda) dan partikel koloid yang bermuatan negatif akan menuju elektroda positif (anoda). Pergerakan partikel-partikel koloid dalam medan listrik ke masing-masing
elektrode disebut elektroforesis. Dari penjelasan di atas dapat disimpulkan bahwa elektroforesis dapat digunakan untuk menentukan jenis muatan koloid.16
15
Ibid 16
4. Sifat Kinetik
Selain menunjukkan efek tyndall, koloid bila diamati dibawah mikroskop ultra nampak sebagai bintik-bintik bercahaya yang bergerak secara acak dan berliku-liku. Gerak Brown terjadi akibat adanya tumbukan yang tidak seimbang antara
partikel-partikel koloid dengan molekul-molekul pendispersinya. Gerak Brown akan makin cepat, jika partikel-partikel koloid makin kecil. Gerak Brown adalah bukti dari teori kinetik molekul.
5. Sifat Optis
Cara yang paling mudah untuk membedakan suatu campuran merupakan larutan, koloid atau suspensi adalah menggunakan sifat efek Tyndall . Jika berkas cahaya
dilewatkan melalui larutan, nyatanya berkas cahaya seluruhnya dilewatkan. Jika seberkas cahaya dilewatkan melalui suatu sistem koloid, maka berkas cahaya tersebut kelihatan dengan jelas. Hal itu disebabkan penghamburan cahaya oleh partikel-partikel koloid. Gejala seperti itulah yang disebut efek Tyndall koloid.17
2.5. Koagulasi
Suatu koloid bila dibiarkan dalam waktu tertentu akan berpengaruh oleh gaya grafitasi bumi, sehingga antara partikel dapat bergabung membentuk gumpalan yang akan mengendap di dasar wadah. Peristiwa penggumpalan atau pengendapan partikel partikel koloid ini disebut koagulasi, atau dengan kata lain koagulasi adalah peristiwa destabilisasi dari pada partikel-partikel koloid di mana gaya tolak-menolak (repulsi) di antara partikel-partikel tersebut dikurangi ataupun ditiadakan.
Partikel-partikel koloid yang terdapat dalam suatu wadah ataupun aliran air pada dasarnya bermuatan negatip pada permukaannya. Muatan ini menyebabkan gaya tolak-menolak di antara partikel-partikel sehingga menghalangi terjadinya agregasi dari pada partikel-paartikel menjadi agregat yang lebih besar.18
17
Sukardjo., 2002, Kimia Fisika, Cetakan Ketiga, PT. Rineka Cipta : Jakarta.
18
2.4.1. Faktor-Faktor Yang Mempengaruhi Koagulasi
Proses koagulasi dipengaruhi oleh beberapa faktor antara lain suhu dan efek pengadukan.
a. Suhu
Selama proses koagulasi berlangsung pengendapan dari flok-flok yang terbentuk semakin berkurang. Dengan turunnya suhu, maka viskositas air semakin tinggi sehingga kecepatan flok untuk mengendap semakin turun. Penurunan suhu menyebabkan kecepatan reaksi berkurang sehingga flok lebih sukar mengendap.
b. Kondisi pengadukan
Pengadukan ini diperlukan agar tumbukan antar partikel untuk netralisasi menjadi sempurna. Dalam proses koagulasi ini, pengadukan dilakukan dengan cepat. Air yang memiliki turbiditas yang rendah memerlukan pengadukan yang lebih banyak. 19
2.4.2. Pembentukan Koagulan
Pada dasarnya koagulasi disebabkan oleh ion-ion yang muatannya berlawanan dengan parikel koloid, dalam hal ion-ion koagulan yang bermuatan positip akan menetralisir muatan negatip partikel koloid yang menyebabkan dapat mengurangi gaya tolak-menolak antar partikel-partikel koloid sehingga terjadi pengendapan. Koagulasi dapat dilakukan dengan empat cara yaitu :
a. Elektroforesis
Dalam cara ini koloid diberi arus listrik sehingga patikel bergerak ke elektroda yang
berlawanan muatannya. Akibatnya partikel menjadi netral dan akhirnya menggumpal dan mengendap di sekitar elektroda itu.
19
b. Pemanasan
Suatu koloid bila dipanaskan akan terkoagulasi karena energi partikel menjadi lebih besar, dan tabrakan sesama dapat mengakibatkan partikel menjadi netral dan akhirnya menggumpal dan mengendap.
c. Penambahan Elektrolit
Koloid yang dapat menyerap ion akan terkoagulasi bila ditambah larutan elektrolit, karena menjadi tidak stabil. Contoh koloid Fe(OH)3, bila ditambahkan ion negatif seperti PO43-. Koloid Fe(OH)3 distabilkan oleh ion Fe3+ dengan cara teradsorpsi di permukaannya. Bila ditambahkan PO43-, maka mengakibatkan Fe3+ di permukaan itu lepas karena membentuk FePO4. Akibatnya, koloid menjadi tidak stabil dan terkoagulasi. Koloid yang distabilkan oleh ion negtif, seperti sol As2S3 akan terkoagulasi bila ditambahkan ion positif, karena ion negatif yang teradsorpsi ditarik oleh ion positif tersebut. Kekuatan ion mengkoagulasi tergantug pada jenis ion dan besarnya muatan.20
2.6. Kegunaan Koloid
Suatu partikel koloid akan bermuatan listrik apabila terjadi penyerapan ion pada permukaan partikel koloid tersebut. Contohnya, koloid Fe(OH)3 dalam air akan menyerap ion H + sehingga bermuatan positif, sedangkan koloid As2S3 akan menyerap ion-ion negatif. Peristiwa ketika permukaan suatu zat dapat menyerap zat lain disebut absorpsi.
Suatu koloid mempunyai kemampuan mengabsorpsi ion-ion. Hal itu terjadi karena koloid tersebut mempunyai permukaan yang sangat luas. Sifat absorpsi partikel-partikel koloid ini dapat dimanfaatkan Membersihkan benda-benda dengan mencuci memakai deterjen yang didasarkan pada prinsip absorpsi. Buih detergen
mempunyai permukaan yang luas sehingga mampu mengemulsikan kotoran yang melekat pada benda yang dicuci.21
20
Rajaram, J., kuriacose.j., 1983, Chemistry In Engineering And Technology Jilid I, Tata Mc Graw-Hill Publishing Compeny Limited : New Delhi
21
2.7. Viskositas
Beberapa cairan dapat mengalir secara cepat, sedangkan yang lainnya mengalir dengan lambat. Viskositas cairan tidak lain daripada gaya tahan lapisan cairan dengan lapisan lainnya. Viskositas (kekentalan) cairan akan menimbulkan gesekan antara bagian-bagian atau lapisan-lapisan cairan yang bergerak satu terhadap yang lain. Hambatan atau gesekan yang tejadi ditimbulkan oleh gaya kohesi dalam zat cair. Sedangkan viskositas gas ditimbulkan oleh peristiwa tumbukan yang terjadi antara
molekul-molekul gas.
Koefien viskositas adalah kekuatan dalam dyne yang menggunakan tekanan di antara dua lapisan sejajar, koefisien kekentalan dapat juga dianggap sebagai gaya per
satuan luas yang diperlukan untuk mengerakkan ataupun memindahkan satu lapisan cairan yang mempunyai kecepatan 1cm detik-1 melewati garis sejajar yang lain yang berjarak 1 cm.22
Dalam Satuan Internasional (SI), satuan viskositas adalah Nsm-2 (kgm-1s-1)
atau Pa s (Pascal sekon). Dalam CGS satuan viskositas adalah dyne s cm-2 (gcm-2s-1). Satuan ini disebut Poise di beri simbol P (1 Poise = 0,1 Pa s). Ini merupakan penghargaan kepada ilmuan Prancis, “Poisseuille” yang menurunkan rumus penentuan viskositas dan metode untuk menentukan viskositas larutan. Satuan viskositas lain adalah sentipoise (1/100 poise) dan milipoise (1/1000 poise).
Ketika suatu zat cair mengalir melalui suatu pipa, lapisan dari cairan dalam kontak dengan dinding pipa adalah tetap dimana cairan pada pusatnya mempunyai
kecepatan yang tertinggi untuk mengalir. Konstanta, “η” adalah koefisien viskositas
dalam unit cgs mempunyai dimensi gcm-1det-1 dan unitnya adalah poise. Kuantitas
lain adalah fluiditas, f = 1/ η dan viskositas kinematik (v) didefenisikan sebagai
viskositas di bagi densitas (v = η/d).23
22
Sukardjo,. 2002, Kimia Anorganik. Cetakan Ke -2, Penerbit Rineka Cipta : Yogyakarta
23
2.7.1. Faktor Yang Mempengaruhi Viskositas
a. Besar dan Bentuk Molekul
Molekul-molekul yang mudah berasosiasi mempunyai viskositas yang besar,
seperti air dan etanol. Zat ini membentuk asosiasi molekul dengan ikatan hidrogen. Makin besar berat molekul, makin besar pula viskositas.
b. Suhu
Pada kebanyakan cairan viskositasnya turun dengan naiknya suhu. Menurut teori ”lubang” terdapat kekosongan dalam cairan dan molekul bergerak secara kontinyu ke dalam kekosongan ini, sehingga kekosongan akan bergerak keliling. Proses ini menyebabkan aliran, tetapi memerlukan energi karena ada energi pengaktifan yang harus mempunyai suatu molekul agar dapat bergerak ke dalam kekosongan. Energi pengaktifan lebih mungkin terdapat pada suhu yang lebih tinggi dan dengan demikian cairan lebih mudah mengalir.
c. Tekanan
Viskositas cairan naik dengan bertambahnya tekanan. Hal ini disebabkan jumlah lubang berkurang, sehingga bagi molekul lebih sukar untuk bergerak
keliling satu terhadap yang lain.
d. Konsentrasi
Untuk suatu larutan viskositasnya bergantung pada konsentrasi atau kepekatan larutan. Umumnya larutan yang konsentrasinya tinggi, viskositasnya juga tinggi, sebaliknya larutan yang konsentrasinya rendah viskositasnya juga rendah.24
24
2.7.2. Pengukuran Viskositas
Viskositas dari cairan dapat ditentukan dengan bermacam cara. Cara-cara ini berdasarkan hukum stokes atau poiseiuille. Alat yang dipakai disebut viskosimeter. Viskosimeter bola jatuh berdasarkan hukum Stokes, sedangkan Viskosimeter Ostwald berdasarkan hukum poiseiuille.
2.7.3. Viskosimeter Hoppler
Pada viskosimeter ini yang diukur adalah waktu yang dutuhkan oleh sebuah bola logam untuk melewati cairan setinggi tertentu. Suatu benda karena adanya gravitasi akan jatuh melalui medium yang berviskositas (seperti cairan misalnya) dengan kecepatan yang semakin besar sampai mencapai kecepatan maksimun. Kecepatan maksimum akan dicapai bila gaya gravitasi sama dengan frictional resistance
medium. Besarnya frictional resistance untuk benda berbentuk bola dapat dihitung menggunakan hukum Stokes :
f = 6πηrv ( 2.1) Dimana :
f = Frictional resistance
η = Viskositas
r = Jari-jari bola
v = Kecepatan yaitu jarak yang ditempuh per satuan waktu.
Pada keseimbangan, gaya ke bawah (m-m0)g sama dengan frictional resistance
sehingga,
η
=
(2.2)
Dimana :
m = Massa bola logam
m0 = Massa cair yang dipindahkan oleh bola logam g = Konstanta gravitasi
25
2.7.4. Viskosimeter Ostwald
Viskositas suatu cairan murni atau larutan merupakan indeks hambatan alir cairan. Viskositas dapat di ukur dengan mengukur laju alir yang melalui tabung berbentuk silinder. Cara ini merupakan salah satu cara yang paling mudah dan dapat digunakan baik dalam cairan maupun gas.
Pada viskosimeter Ostwald, yang di ukur adalah waktu yang dibutuhkan oleh
sejumlah tertentu cairan untuk mengalir melalui pipa kapiler dengan gaya yang disebabkan oleh berat cairan itu sendiri. Pada percobaan sebenarnya, sejumlah tertentu cairan (misalkan 10 cm3, bergantung pada ukuran viskosimeter) di pipet ke dalam viskosimeter. Cairan kemudian di isap melalui labu pengukur dari viskosimeter
sampai permukaan cairan lebih tinggi dari batas “atas”. Cairan kemudian dibiarkan turun. Ketika permuakaan cairan turun melewati batas “atas”, stop-watch mulai dinyalakan dan ketika cairan melewati batas “bawah”, stop-watch dimatikan. Jadi waktu yang dibutuhkan cairan untuk melalui jarak antara “atas” dan “bawah” dapat ditentukan.26
Pengukuran viskositas Ostwald dapat dihitung berdasarkan hukum Poisseuille berikut :
η = Viskositas larutan (poise) V = Total volume larutan (mL)
t = Waktu yang dibutuhkan larutan dengan volume V untuk mengalir melalui viskosimeter (detik)
P = Tekanan yang bekerja pada cairan
l = Panjang pipa
Untuk dua cairan yang berbeda dengan pengukuran alat yang sama, diperoleh
hubungan :
karena tekanan berbanding lurus dengan rapatan cairan (d), maka berlaku :
η = viskositas larutan (poise) d = densitas larutan (g/cm3)
Jadi, bila η dan d cairan pembanding diketahui, maka dengan mengukur waktu yang diperlukan untuk mengalir kedua cairan melalui alat yang sama dapat
ditentukan η cairan yang sudah diketahui rapatannya.26
Tabel 1. Viskositas Cairan berbagai suhu (dalam satuan poise ).
Cairan Suhu oC
Bird, T., 1993, Kimia Fisika Untuk Universitas, Cetakan Ke -2, Penerbit PT. Gramedia Pustaka Utama: Jakarta. 27
BAB 3
BAHAN DAN METODE PENELITIAN
3.1. Alat
Adapun alat-lat yang digunakan dalam penelitian ini adalah sebagai berikut:
− Viskosimeter Ostwald (Presisi ± 0,02 mL) Sibata
− Piknometer 5 mL (Presisi ± 0,01 mL) Iwaki
− Gelas Ukur 10 mL (Presisi ± 0,02 mL) Pirex − Gelas Beaker 250 mL (Presisi ± 0,2 mL) Pirex − Gelas Ukur 100 mL (Presisi ± 0,05 mL) Pirex − Gelas Beaker 1000 mL (Presisi ± 0,8 mL) Pirex − Pipet Volume 10 mL (Presisi ± 0,02 mL) Pirex − Neraca Analitik (Presisi ± 0,0001 g) -
− Pengaduk (Magnetik Stirer) Fisher
− Wadah Penampung (Ember Plastik) -
− Bola karet penghisap -
− Statif Dan Klem -
− Stop Watch -
3.2. Bahan
Adapun bahan-bahan yang digunakan dalam penelitian ini adalah sebagai berikut:
- Natrium Lauril Eter Sulfat
- Natrium Lauril Sulfat - Natrium Clorida - Natrium Pospat - Natrium Sulfat
- Zat Pewarna Hijau Sintetik - Parfum Lemon
- Aquades
3.3. Metode Penelitian
Jenis penelitian ini adalah eksperimen laboratorium dengan menggunakan hipotesa dan analisa variansi dengan 3 jenis koagulan pada suatu jenis larutan pencuci piring.
3.3.1. Populasi
Dalam penelitian eksperimen ini yang digunakan sebagai populasi sasaran adalah larut pencuci piring.
3.3.2. Sampling
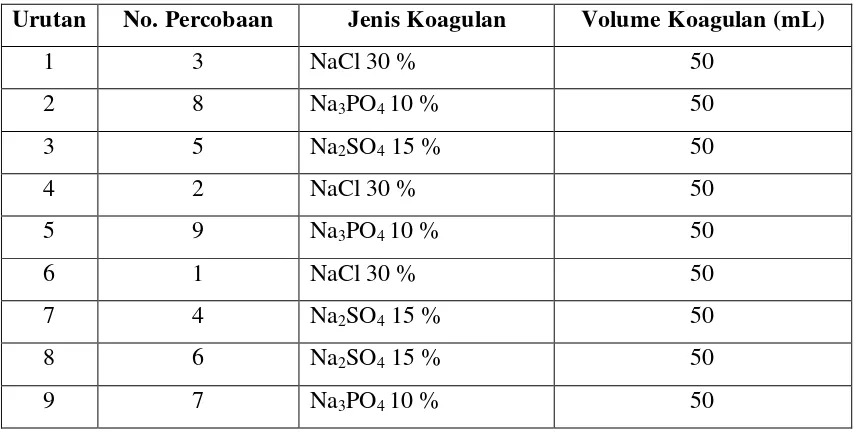
Berdasarkan sifat populasi yang homogen, maka teknik sampling yang digunakan adalah teknik rancangan acak kelompok sederhana dengan metode undi dan replikasi dilakukan tiga kali untuk setiap perlakuan dari masing-masing sampel.
Karena ada tiga variasi jenis koagulan pada volume tetap yang masing-masing dilakukan replikasi perlakuan sebanyak tiga kali, maka total pengamatan yang harus dilakukan dalam urutan sembarang untuk masing-masing sampel adalah 9 kali perlakuan.
Tabel 3.1. Disain percobaan (3x3) model tetap untuk nilai viskositas
Jenis Sampel Jenis Koagulan
Larutan Pencuci Piring
NaCl 30% Na2SO4 15 % Na3PO4 10%
1 4 7
2 5 8
3 6 9
Satu angka sembarang di pilih dari angka 1 sampai 9 dengan cara undian. Angka yang
terpilih pertama kali adalah 3. Proses ini diulang sampai ke-9 pengamatan yang telah diberikan satu posisi dalam urutan.
Tabel 3.2. Randomisasi urutan perlakuan
Urutan No. Percobaan Jenis Koagulan Volume Koagulan (mL)
1 3 NaCl 30 % 50
2 8 Na3PO4 10 % 50
3 5 Na2SO4 15 % 50
4 2 NaCl 30 % 50
5 9 Na3PO4 10 % 50
6 1 NaCl 30 % 50
7 4 Na2SO4 15 % 50
8 6 Na2SO4 15 % 50
3.3.4. Persiapan
3.3.4.1. Pencucian Alat
Kedalam 7,5 mL aquades dilarutkan 10 g Kalium Bikromat. Kemudian melalui dinding gelas kimia ditambahkan 200 mL Asam Sulfat secara perlahan sambil di aduk. Pindahkan larutan ke dalam botol reagen bertutup gelas. Simpan dan biarkan sampai satu malam sebelum di pakai. Kemudian alat kaca diisi dengan larutan pencuci
Dan dibiarkan selama 15 menit kemudian larutan dikeluarkan dan alat kaca dibilas dengan aquades paling sedikit 3 kali Dan diperhatikan apakah air mengalir tampa meninggalkan tetesan pada dinding, jika tidak pembersihan harus diulang.
3.3.4.2. Kalibrasi Alat
Alat-alat kaca volumetrik dikalibrasi dengan menghitung berat larutan (biasanya aquades) yang diisi dalam dalam alat volumetrik yang telaqh diketahui densitas Dan temperaturnya. Data penimbangan terlebih dahulu dikoreksi dengan persamaan :
Keterangan : W1 = Berat sesungguhnya
W2 = Berat pengukuran
Lalu volume alat pada temperatur kalibrasi (T) ditentukan dengan mengalikan densitas larutan dengan berat yang dikoreksi. Sehingga volume ini dikoreksi terhadap temperatur standar 20 0C.
3.3.4.3. Kalibrasi Piknometer
Disesuaikan level air pada tabel densitas air yang telah ditentuka, dicatat
temperatus t2 dari yang ditentukan, yang mendekati 0,1 oC, ditimbang dan dicatat total massanya sebagai M2. Volume Vt dari piknometer adalah sebagai berikut :
Keterangan : mo = massa piknometer kosong (g)
m2 = massa piknometer yang telah terisi air (g)
H2O t2 = densitas air pada t2 0C
0.000025 = koefisien ekspansi kubik untuk piknometer gelas
3.3.5. Pembuatan Larutan
3.3.5.1. Pembuatan Larutan NaCl 30 %
NaCl ditimbang sebanyak 90 g, dimasukkan ke dalam gelas beaker, ditambahkan aquades sebanyak 300 g dan diaduk sampai homogen.
3.3.5.2. Pembuata Larutan Na2SO4 15 %
Na2SO4 ditimbang sebanyak 45 g, dimasukkan ke dalam gelas beaker, ditambahkan aquades sebanyak 300 g dan diaduk sampai homogen.
3.3.5.3. Pembuatan Larutan Na3PO4 10 %
Na3PO4 ditimbang sebanyak 30 g, dimasukkan ke dalam gelas beaker, ditambahkan aquades sebanyak 300 g dan diaduk sampai homogen.
3.3.5.4. Pembuatan Larutan Natrium Lauri Eter Sulfat (SLES) 33, 33 %
SLES ditimbang sebanyak 500 g, dimasukkan ke dalam ember , ditambahkan aquades sebanyak 1000 g dan diaduk sampai homogen.
SLS ditimbang sebanyak 500 g, dimasukkan ke dalam ember, ditambahkan aquades sebanyak 1000 g, dan diaduk sampai homogen.
3.3.5.6. Pembuatan Bahan Pencuci Piring 500 mL
Ke dalam beaker glass 1000 mL dimasukkan 150 mL larutan Natrium Lauril Eeter Sulfat. Ditambahkan 20 mL Natrium Lauril Sulfat sambil diaduk hingga larutan
homogen. Kedalam larutan homogen ditambahkan 50 mL larutan natrium klorida 30% dan diaduk hingga homogen. Ditambahkan larutan pewangi dan parfum secukupnya sambil diaduk, ditambahkan aquades hingga menunjukkan volume larutan 500 mL sambil diaduk hingga larutan homogen. Bahan pencuci piring didiamkan
selama 24 jam untuk mendapatkan larutan pencuci piring yang bening. Dengan perlakuan yang sama dilakukan pembuatan bahan pencuci piring untuk jenis koagulan Na2SO4 15 % dan Na3PO4 10 %.
3.3.6. Pengumpulan Data
3.3.6.1. Pengukuran Waktu Alir
1. Alat viskosimeter dirangkai pada statif dan klem.
2. Larutan pencuci piring dipipet 10 mL dan dimasukkan ke dalam viskosimeter. 3. Dengan alat bola karet penghisap, di isap larutan pencuci piring hingga melewati
garis batas atas viskosimeter.
4. Bola karet penghisap di lepas setelah melewati batas garis atas sehingga larutan pencuci piring akan mulai mengalir turun kembali.
5. Secara teliti diukur waktu alir dengan menggunakan stop watch yaitu waktu (t) yang diperlukan untuk mengalirkan sampel mulai dari garis batas atas hingga garis batas bawah.
6. Perlakuan dilakukan untuk pengukuran waktu alir larutan pencuci piring dengan variasi jenis koagulan Na2SO4 15 % dan Na3PO4 10 %.
7. Setiap perlakuan diulangi sebanyak 3 kali.
1. Piknometer 5 mL (kosong) ditimbang pada neraca analitik. 2. Catat berat piknometer kosong (5 mL).
3. Larutan pencuci piring yang telah diukur waktu alirnya dipipet sebayak 5 mL ke dalam piknometer 5 mL.
4. Timbang piknometer berisi pada neraca analitik. 5. Dicatat berat piknometer berisi.
6. Perlakuan dilakukan untuk pengukuran densitas Na2SO4 15%, dan Na3PO4 10 %.
7. Setiap perlakuan diulagi sebanyak 3 kali.
3.4. Pengolahan dan Analisa Data
3.4.1. Penentuan Kesalahan
3.4.1.1. Sumber Kesalahan Sistematik
a. Kesalahan instrument, yaitu bersumber dari alat atau instrumentnya sendiri, misalnya penyimpangan nol dalam pembacaan skala. Kesalahan ini dapat diminimalkan dengan cara kalibrasi atau penggunaan blangko.
b. Kesalahan metode, dalam penelitian ini metode yang digunakan adalah Viskosimeter Ostwald.
c. Kesalahan personal, yaitu kesalahan yang dilakukan seorang peneliti ataupun karena kesalahan prosedur. Kesalahan ini dapat diminimalkan dengan meningkatkan ketelitian peneliti.
3.4.1.2. Kesalahan Random (Intermediate)
Tipe kesalahan ini disebabkan oleh banyaknya variabel bebas dan pengulangan dalam setiap pengukuran kimia dan fisika. Kesalahan terjadi ketika sebuah sistem pengukuran diteruskan hingga kesensifitas maksimumnya. Terdapat banyak kontributor kesalahan random, namun tidak ada yang dapat diidentifikasi dan di hitung karena sangat kecil dan tidak dapat di deteksi tersendiri. Kesalahan ini dapat di lihat dari rata-rata yang merefleksikan ketelitian.
Kebanyakan hasil akhir dalam kimia fisika dihasilkan dari perhitungan pengukuran pengukuran yang digabungkan. Hal ini penting untuk memastikan bagaimana kesalahan pengukuran individual mempengaruhi hasil akhir penjumlahan atau pengurangan.
3.4.2. Penentuan Ketidakpastian Dalam Signifikan Figure
Data yang diperoleh ditentukan nilai ketidakpastiannya berdasarkan sumber- sumber ketidakpastian. Baik pada saat menimbang, pengukuran volume maupun penggunaan alat untuk setiap penentuan dalam penelitian ini. Kemudian data yang diperoleh dianalisa secara statistik dengan analisis varians (ANAVA) dan grafik dengan tingkat signifikansi 5 % untuk menerima atau menolak hipotesa yang diajukan.
3.4.2.1. Perhitungan ketidak pastian persentase NaCl
Parameter yang di ukur adalah persentase larutan NaCl yang tergantung pada berat natrium klorida, kemurniannya, dan berat molekul natrium klorida.
Massa Natrium Klorida (m NaCl)
Sertifikat kalibrasi timbangan tercantum ± 0,15 mg untuk linieritas. Produsen timbangan merekomendasikan untuk menggunakan distribusi rektangular untuk mendapatkan kontribusi linier deviasi standar.
3 15 , 0
= 0,087 mg
u(mNaCl) = 2x
(
0,087)
2 = 0,123 mgP NaCl = 99,50% = 100% ± 0,50%
Massa Molar Natrium Klorida (MNaCl)
Dari tabel IUPAC, berat atom dan daftar ketidakpastian untuk unsur-unsur pembentukan natrium klorida adalah atom Na dan Cl.
u(MNaCl) = sNa2 +sCl2
3.4.2.2. Perhitungan ketidakpastian persentase Na2SO4
Parameter yang di ukur adalah persentase larutan Na2SO4 yang tergantung pada berat natrium sulfat, kemurniannya dan berat molekul natrium sulfat.
Massa Natrium Sulfat (m 4 2SO
Na )
Sertifikat kalibrasi timbangan tercantum ± 0,15 mg untuk linieritas. Produsen timbangan merekomendasikan untuk menggunakan distribusi rektangular untuk mendapatkan kontribusi linier deviasi standar.
P
Dari tabel IUPAC, berat atom dan daftar ketidakpastian untuk unsur-unsur pembentukan natrium sulfat adalah atom Na, S dan O.
u( )
3.4.2.3. Perhitungan Ketidak Pastian Persentase Na3PO4
Parameter yang di ukur adalah persentase larutan Na3PO4 yang tergantung pada berat natrium posfat, kemurniannya dan berat molekul natrium posfat.
Massa (m
4 3PO
Na )
Sertifikat kalibrasi timbangan tercantum ± 0,15 mg untuk linieritas. Produsen timbangan merekomendasikan untuk menggunakan distribusi rektangular untuk mendapatkan kontribusi linier deviasi standar.
P
Dari tabel IUPAC, berat atom dan daftar ketidakpastian untuk unsur-unsur pembentukan natrium sulfat adalah atom Na, Pdan O.
u( M
3.4.2.4. Ketidakpastian Pipet Volume 5 mL (VT1)
Ketidakpastian pipet volume 5 mL dengan presisi ± 0,01 mL dapat di hitung dari
penggabungan dua pengaruh utama terhadap volume, yaitu : kalibrasi dan pengaruh suhu.
b. Perbedaan suhu laboratorium dengan suhu kalibrasi
Suhu yang tertera pada alat gelas volumetri adalah 20 0C, sedangkan suhu laboratorium bervariasi antara ± 10 0C. Ketidakpastian dapat di hitung dari perbedaan
suhu dengan koefisien pemuaian volume air (γ = 2,1 x 10-4 0
C), dan koefisien
± 5 x 10 x 2,1 x 10-4 = 0,0105 mL
Ketidakpastian gabungan pipet volume 5 mL
u(V5) = u
(
V5_cal) (
2 +uV5_temp)
2= 0,0082 mL
3.4.2.5. Ketidakpastian Pipet Volume 10 mL (VT1)
Ketidakpastian pipet volume 10 mL dengan presisi ± 0,02 mL dapat di hitung dari penggabungan dua pengaruh utama terhadap volume, yaitu : kalibrasi dan pengaruh
suhu.
b. Perbedaan suhu laboratorium dengan suhu kalibrasi
Suhu yang tertera pada alat gelas volumetri adalah 200C, sedangkan suhu laboratorium bervariasi antara ± 100C. Ketidakpastian dapat di hitung dari perbedaan suhu dengan
koefisien pemuaian volume air (γ = 2,1 x 10-40C), dan koefisien rektangular di mana akan memberikan
u(V10) = u
(
V10_cal)
2 +u(
V10_temp)
2= 0,0146 mL
3.4.2.6. Ketidakpastian Gelas Ukur 10 mL
a. Kalibrasi
b. Perbedaan suhu laboratorium dengan suhu kalibrasi
± V x ∆t x γ
3.4.2.7. Ketidakpastian Gelas Ukur 100 mL
a. Kalibrasi
± V x ∆t x γ
Ketidakpastian gabungan gelas ukur 50 ml
u(V50) =
(
)
(
) (
)
3.4.3.1. Perhitungan Nilai Densitas Larutan Pencuci Piring
Nilai Densitas di hitung berdasarkan persamaan berikut :
)
keterangan: d = Densitas larutan (g/mL) M = Massa Piknometer (g) V = Volume (mL)
3.4.3.2. Pehitungn Nilai Viskositas Larutan Pencuci Piring
Nilai viskositas dihitung berdasarkan persamaan :
= viskositas larutan pencuci piring (poise)
= densitas air ( g / mL )
= densitas larutan pencuci piring( g / mL )
= waktu alir air (detik)
= waktu alir larutan pencuci piring (detik)
3.4.3.3. Contoh Perhitungan
Larutan pencuci piring dengan penambahan Na3PO4 10% 50 mL, memiliki waktu alir pada Viskosimeter Ostwald 146 detik. Dari hasil penimbangan piknometer 5 mL,
diperoleh M0 (massa piknometer kosong) = 11,744 g dan Mi (massa piknometer berisi
larutan pencuci piring) = 16,868 g. Nilai η aquades = 0,008 poise dengan waktu alir 57 detik dan densitas aquades (d) = 0,998 g/cm2.
Penentuan densitas larutan pencuci piring di hitung berdasarkan persamaan berikut:
= 1.024 g/cm2
Nilai viskositas dihitung berdasarkan persamaan:
= 0.027 Poise
3.4.4.1. Analisis Variansi
Dalam menguji hipotesa yang telah diajukan maka di pakai rancangan acak kelompok sederhana. Dalam rancangan ini tidak terdapat lokal kontrol, sehingga sumber keragaman yang diamati hanya perlakuan yang di ragam sebanyak kelompok.
Analisis jumlah kuadrat untuk nilai Viskositas
1. Jumlah kuadrat total (JKT)
JKT = -
2. Jumlah kuadrat antar kelompok (JKA)
JKA = + + -
3. Jumlah kuadrat dalam kelompok (JKD) JKD = JKT – JKA
4. Rata-rata kuadrat antar kelompok (RKA)
RKA =
5. Rata-rata kuadrat dalam kelompok (RKD)
RKD =
FHitung =
Analisis sidik ragam
Derajat Bebas (dB)
dBa = m – 1 = 3 -1 = 2 dBT = n – 1 = 9 – 1 = 8 dBd = dBT - dBa = 8 – 2 = 6
1. Hipotesa Nol
0 A :
H10 i =
Yang berarti bahwa tidak ada pengaruh jenis koagulan terhadap nilai viskositas larutan pencuci piring.
2. Hipotesa Alternatif
0 A :
H11 i ≠
Yang berarti bahwa ada pengaruh jenis koagulan terhadap nilai viskositas larutan pencuci piring.
Kriteria Pengujian
Pada batas ketangguhan = 5 % pada daerah kritis pengujian berlaku :
H10 di terima bila FHitung ≤ F0,05 dan di tolak bila FHitung ≥ F0,05
H11 di terima bila FHitung ≥ F0,05 dan di tolak bila FHitung ≤ F0,05
3.5.1. Skema Pembuatan Larutan Pencuci Piring
ditambahkan ditambahkan ditambahkan
aquades 1000 g aquades 1000 g aquades 210 g diaduk hingga homogen diaduk hingga diaduk hingga
homogen homogen
dimasukkan 150 mL larutan natrium
lauril eter sulfat ke dalam beaker gelas 1000 mL
ditambahkan larutan 50 mL NaCl 30% sambil diaduk
ditambahkan 20 mL larutan natrium lauril sulfat sambil diaduk
ditambahkan parfum dan pewangi secukupnya
diaduk hingga homogen
didiamkan larutan pencuci piring
selama 24 jam
Dengan cara yang sama prosedur dilakukan terhadap koagulan Na2SO4 15% dan Na3PO4 10%.
3.5.2. Skema Penentuan Waktu Alir Larutan Pencuci Piring
diukur 10 mL, dimasukkan kedalam
Viskosimeter Ostwald yang telah dirangkai
pada statif
dihisap larutan pencuci piring dengan bola karet hingga batas atas
dihidupkan stop watch saat larutan menyentuh batas atas
dimatikan stop watch setelah larutan menyentuh batas batas bawah
dicatat waktu alir yang diperoleh perlakuan diulangi sebanyak 3 kali
3.5.3. Skema Penentuan Densitas Larutan Pencuci Piring
Ditimbang sebagai M(piknometer kosong), dan dicatat massanya
Dipipet 5 mL Larutan Pencuci Piring (waktu alirnya telah diukur) hingga penuh dan ditutup Ditimbang sebagai M(piknometer berisi), dan
dicatat massanya.
Perlakuan diulangi sebanyak 3 kali Larutan Pencuci
Piring
Data
Piknometer Kosong (5 mL)
BAB 4
HASIL DAN PEMBAHASAN
4.1. Hasil
Dari penelitian yang telah dilakukan, diperoleh hasil bahwa jenis koagulan yang digunakan memberikan pengaruh yang nyata terhadap viskositas larutan pencuci priring. Dimana dengan penambahan koagulan dengan variasi jenis koagula diperoleh perubahan nilai viskositas larutan pencuci piring.
Data hasil perhitungan nilai viskositas larutan pencuci piring dengan penambahan jenis koagulan ditunjukkan pada Tabel 4.1 di bawah ini:
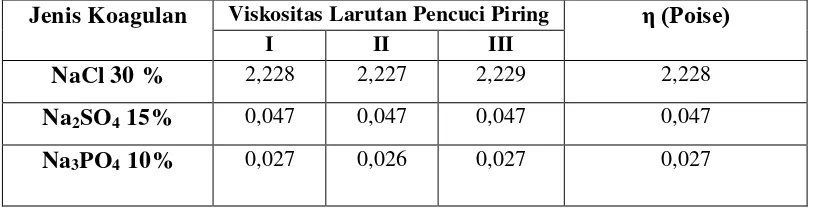
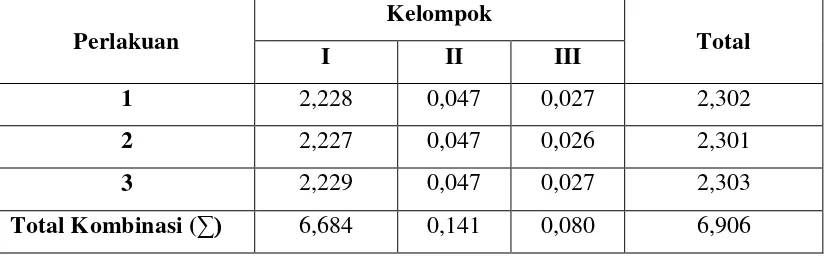
Tabel 4.1 Data Hasil Perhitungan Viskositas Larutan Pencuci Piring
Jenis Koagulan Viskositas Larutan Pencuci Piring η (Poise)
I II III
NaCl 30 % 2,228 2,227 2,229 2,228
Na2SO4 15% 0,047 0,047 0,047 0,047
Na3PO4 10% 0,027 0,026 0,027 0,027
Tabel 4.2 Hasil Perhitungan Pengaruh Jenis Koagulan Terhadap Viskositas
Hasil analisa variansi sederhana model tetap menunjukkan bahwa adanya interaksi antara koagulan larutan NaCl, larutan Na2SO4, dan larutan Na3PO4 yang digunakan terhadap nilai viskositas larutan pencuci piring. Hal ini dapat di lihat pada Tabel 4.3.
Tabel 4.3 Analisa Sidik Ragam Pengaruh Jenis Koagulan Terhadap Viskositas
4.2. Pembahasan
4.2.1. Hipotesa
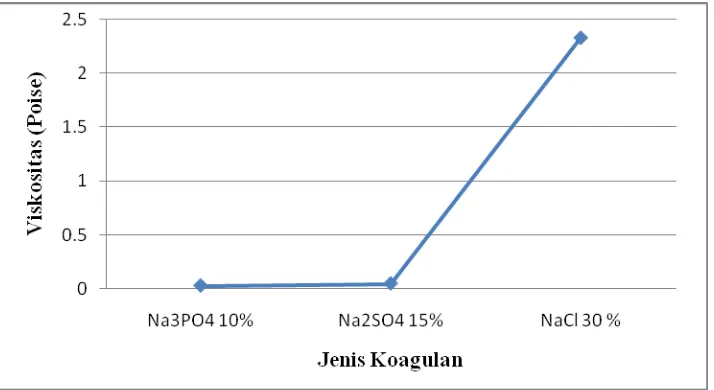
Dari uji hipotesa diperoleh harga Fhitung lebih besar dari Ftabel, dimana Fhitung
= 5,249 dan Ftabel = 5,14 maka H11 di terima dan H10 di tolak, yang berarti ada
pengaruh jenis koagulan terhadap nilai viskositas larutan pencuci piring. Dalam hal ini, dari variasi jenis koagulan yang paling nyata menaikkan nilai viskositas larutan pencuci piring adalah larutan natrium klorida seperti yang ditunjukkan pada Gambar 4.1 di bawah ini.
Gambar 4.1 Grafik Pengaruh Jenis Koagulan Terhadap Viskositas Larutan Pencuci Piring
Dari hasil penelitian dapat dijelaskan bahwa jenis koagulan memberikan pengaruh terhadap nilai viskositas larutan pencuci piring. Hal ini disebabkan adanya interaksi partikel-partikel molekul atau ion-ion dari medium dispersi. Koloid yang tidak stabil cenderung untuk menggumpal, walaupun kecepatan penggumpalannya sangat lambat. Kecepatan penggumpalan ini ditentukan oleh banyaknya kontak antar partikel koloid dan efektifitas kontak yang terjadi. Penggabungan partikel-partikel koloid dapat terjadi karena: Gerak Brown dan Gradien kecepatan dalam media suspensi yang bergantung pada temperatur, jumlah partikel koloid, konsentrasi dan
Perbedaan nilai viskositas larutan pencuci piring juga diakibatkan oleh
pengaruh garam-garam terlarut yang ditambahkan pada larutan pencuci piring. Pengaruh anion lebih besar daripada kation, sehingga ion seperti Natrium, Kalsium dan Magnesium tidak memberikan pengaruh yang berarti terhadap proses koagulasi. Ion-ion negatif memperbesar daerah pH optimum koagulasi untuk koagulasi ke arah
bagian yang sama, yang tergantung juga pada valensi ion-ion tersebut. Dengan kata lain ion-ion monovalen seperti klorida, nitrat dan sebagainya tidak memberikan pengaruh yang berarti dibandingkan dengan pengaruh yang diberikan oleh ion-ion sulfat, pospat dan anion-anion bervalensi lainnya.
Kemampuan mengkoagulasikan koloid elektrolit tergantung pada jenis elektrolit dan banyaknya muatan. Makin besar muatan ion berlawanan yang ditambahkan, makin sedikit elktrolit-elektrolit yang digunakan untuk mengendapkan. Dengan penambahan elerktrolit akan terjadi solvasi ion-ion yang bersangkutan dan juga netralisasi. Menurut aturan seri Hofmeister urutan daya pengendapan kation adalah: Sn4+ > Al3+ > Mg2+ > Na+ > K+ > Ca+, sedangkan untuk sol negating atau anion adalah: PO43- > SO42- > Cl- > NO3-. Suatu viskositas dari medium dispersi biasanya bertambah secara cepat dengan adanya fase dispersi. Pada konsentrasi yang cukup tinggi, sol dapat berubah menjadi gel.
Sistem yang mengandung partikel-partikel koloid yang berinteraksi dengan medium dispersi dinamakan koloid liofilik (suka solven). Karena mempunyai affinitas terhadap medium dispersi, maka zat-zat yang demikian itu membentuk dispersi koloid atau sol dengan mudah. Jadi, sol koloid yang bersifat liofilik biasanya diperoleh secara mudah dengan melarutkan zat dalam solven yang digunakan. Seperti halnya penambahan larutan NaCl, larutan Na2SO4, dan larutan Na3PO4 dalam pembuatan
larutan pencuci piring yang menyebabkan terbentuknya suatu sol.
BAB 5
KESIMPULAN DAN SARAN
5.1. Kesimpulan
Dari penelitian dan pembahasan yang telah dilakukan, maka dapat diambil kesimpulan bahwa ada pengaruh dari penambahan jenis koagulan yang digunakan terhadap nilai viskositas larutan pencuci piring. Dimana dengan penambahan koagulan NaCl menunjukkan nilai viskositas yang paling besar dibandingkan dengan nilai viskositas larutan pencuci piring dengan penambahan koagulan Na2SO4 15% dan Na3PO4 10%. Berdasarkan penelitian yang telah dilakukan maka nilai viskositas yang paling tinggi diperoleh pada penambahan koagulan larutan NaCl 30% sebesar 2,227 Poise.
5.2. Saran
DAFTAR PUSTAKA
Anonim., Metode Pengolahan Deterjen (Tinjauan Pada Suatu Instalasi Pengolahan
Air),
Bird. T., 1993. Kimia Fisika Untuk Universitas. Cetakan ke-2. Penerbit PT. Gramedia Pustaka Utama: Jakarta.
Commons. C., 1992. Chemistry Two. Chemistry End The Market Place, Energy End Matter. Australian PTY. ltd: Australia.
Fessenden. J., 1982. Kimia Organik, Edisi ke-4, Jilid II, Penerbit Erlangga: Jakarta.
Findlay. A., 1960. Practical Physical Chemistry. Eight Edition. William Clowes and Sons Limited: London
George. T. A., 1996. Industri Proses Kimia. Edisi ke-5. Jilid 1. Penerbit Erlangga: Jakarta.
Hart. H., 1998. Kimia Organik. Edisi ke-6. Penerbit Erlangga: Jakarta.
Hadi. S., 1978. Metodologi Research. Bagian Pertama. Yayasan Penerbit Fakultas Psikologi Universitas Gajah Mada: Yokyakarta.
Sihombing J.B.B., 2010. Studi Efek Penambaha Natrium Sulfat (Na2SO4) 25%
Terhadap Viskositas Larutan Pencuci Piring (Dishwashing Liquid). Skripsi. Universitas Sumatera Utara: Medan.
Luis. S. 1994. Soap and DetergentsA Theoretical and Practical Review. AOCS Press: New York.
Myers. D., 2006. Surfactant Science and Technology. 3rd Edition. Jhon Wiley and Son, Inc: New Jersey.
Nurgiyantoro, B., 2003. Statistik Terapan Untuk Penelitian Ilmu-Ilmu Sosial. Penerbit Gadjah Mada University Press. Yokyakarta.
Permono. A., 2002. Membuat Detergen Cair, Penebar Swadaya: Jakarta.
Permono, A., 2002. Membuat Cairan Pencuci Piring, Penebar Swadaya: Jakarta.
Rajaram. J., Kuriacose. J., 1983. Chemistry in Engineering And Technology, Jilid I, Tata McGraw-Hill Publishing Compeny Limited: New Delhi.
Sastrohamidjojo. H., 2005. Kimia Organik, Stereokimia, Karbohidrat, Lemak, dan Protein. Gadjah Mada University Press: Yogyakarta.
Schwartz. A.M ., 1958. Surface Aktive Agents and Detergents. Interscience Publisher, Inc: New York.
Sudjana., 1992. Metode Statistika. Edisi Ke 5. Penerbit Tarsito: Bandung.
Sukardjo., 1989. Kimia Anorganik. Cetakan Ke-2. Penerbit Rineka Cipta: Yogyakarta.
Sukardjo., 2003. Kimia Fisika. Penerbit Rineka Cipta: Yogyakarta.
Syukri. S., 1999. Kimia Dasar 2. Penerbit ITB: Bandung.
Wasito. H., Pengantar Metodologi Penelitian, Buku Panduan Mahasiswa. Penerbit PT. Gramedia Pustaka Utama: Jakarta.
Lampiran 1
Tabel 1. Nilai Dan Ketidakpastian Dalam Penentuan Persentase Natrium
Klorida
Deskripsi Nilai x Ketidakpastian
Standar u(x)
Tabel 2. Nilai Dan Ketidakpastian Dalam Penentuan Persentase Natrium Sulfat
Deskripsi Nilai x Ketidakpastian
Standar u(x)
Natrium Sulfat 142,0421 g/mol 0,005 g/mol 0,0000352
Tabel 3. Nilai Dan Ketidakpastian Dalam Penentuan Persentase Natrium Posfat
Deskripsi Nilai x Ketidakpastian
Standar u(x)
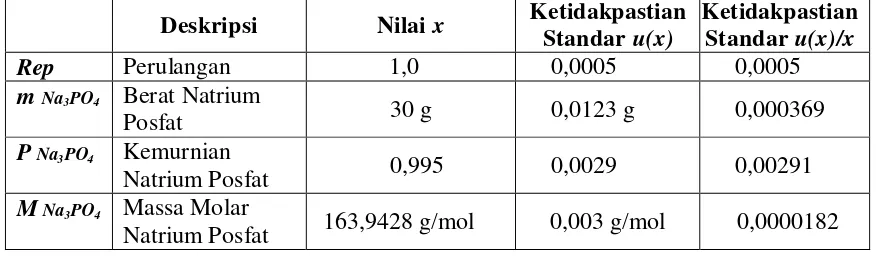
Natrium Posfat 163,9428 g/mol 0,003 g/mol 0,0000182
Lampiran 2
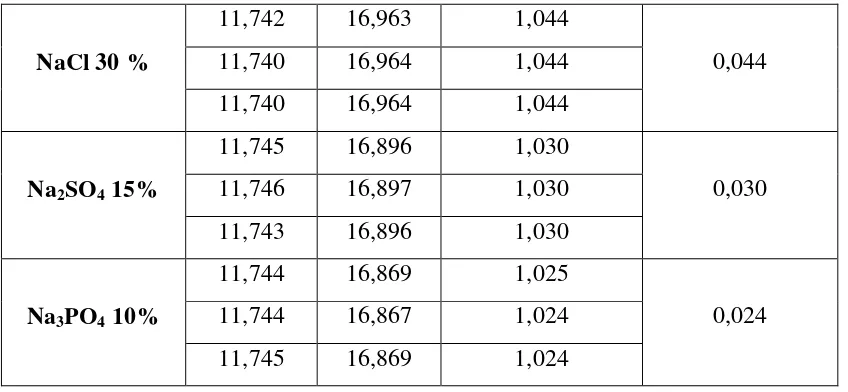
Tabel 4. Pengukuran Densitas Larutan Pencuci Piring
Jenis Koagulan (50 mL)
Massa Picnometer (g) Densitas (g/cm2)
Densitas rata-rata (g/cm2)
NaCl 30 %
Tabel 5. Pengukuran Viskositas Larutan Pencuci Piring