UNIVERSITAS ISLAM NEGERI SYARIF HIDAYATULLAH JAKARTA
UNTUK MENGETAHUI KEMUNGKINAN MENDERITA
IRON REFRACTORY DEFICIENCY ANEMIA DENGAN MENGGUNAKAN
TEKNIK REAL TIME POLYMERASE CHAIN REACTION-
HIGH RESOLUTION MELT
Laporan Penelitian ini ditulis sebagai salah satu syarat untuk memperoleh gelar SARJANA KEDOKTERAN
OLEH :
Amatillah Raifah
NIM: 1112103000024
PROGRAM STUDI PENDIDIKAN DOKTER
FAKULTAS KEDOKTERAN DAN ILMU KESEHATAN
UNIVERSITAS ISLAM NEGERI
SYARIF HIDAYATULLAH
JAKARTA
ii Dengan ini saya menyatakan bahwa:
1. Laporan penelitian ini merupakan hasil karya asli saya yang diajukan
untuk memenuhi salah satu persyaratan memperoleh gelar Strata 1 di
Universitas Islam Negeri (UIN) Syarif Hidayatullah Jakarta.
2. Semua sumber yang saya gunakan dalam penulisan ini telah saya
cantumkan sesuai dengan ketentuan yang berlaku di UIN Syarif
Hidayatullah Jakarta.
3. Jika dikemudian hari terbukti bahwa karya ini bukan karya asli saya atau
merupakan hasil jiplakan dari karya orang lain, maka saya bersedia
menerima sanksi yang berlaku di UIN Syarif Hidayatullah Jakarta
Ciputat, 16 Oktober 2015
iii
SKRINING SINGLE NUCLEOTIDE POLYMORPHYSM rs855791 (C>T) PADA MAHASISWA PROGRAM STUDI PENDIDIKAN DOKTER UNIVERSITAS
ISLAM NEGERI SYARIF HIDAYATULLAH JAKARTA UNTUK MENGETAHUI KEMUNGKINAN MENDERITA IRON REFRACTORY DEFICIENCY ANEMIA DENGAN MENGGUNAKAN TEKNIK REAL TIME
POLYMERASE CHAIN REACTION-HIGH RESOLUTION MELT
Laporan Penelitian
Diajukan kepada Program Studi Pendidikan Dokter Fakultas Kedokteran dan Ilmu Kesehatan
untuk Memenuhi Persyaratan Memperoleh Gelar Sarjana Kedokteran (S. Ked)
Oleh Amatillah Raifah NIM: 1112103000024
Pembimbing I Pembimbing II
Chris Adhiyanto, S.Si, M.Biomed, PhD dr. Nouval Shahab, Sp.U, FICS, PhD, FACS
NIP: 19721103 200604 1 001 NIP: 19690511 200312 1 001
PROGRAM STUDI PENDIDIKAN DOKTER FAKULTAS KEDOKTERAN DAN ILMU KESEHATAN UNIVERSITAS ISLAM NEGERI SYARIF HIDAYATULLAH
iv
POLYMORPHYSM rs855791 (C>T) PADA MAHASISWA PROGRAM STUDI PENDIDIKAN DOKTER UNIVERSITAS ISLAM NEGERI SYARIF HIDAYATULLAH JAKARTA UNTUK MENGETAHUI KEMUNGKINAN MENDERITA IRON REFRACTORY DEFICIENCY
ANEMIA DENGAN MENGGUNAKAN TEKNIK REAL TIME
POLYMERASE CHAIN REACTION-HIGH RESOLUTION MELT yang diajukan oleh Amatillah Raifah (NIM 1112103000024), telah diujikan dalam sidang di Fakultas Kedokteran dan Ilmu Kesehatan pada tanggal 16 Oktober 2015. Laporan penelitian ini telah diperbaiki sesuai dengan masukan dan saran penguji, serta telah diterima sebagai salah satu syarat memperoleh gelar Sarjana Kedokteran (S. Ked) pada Program Studi Pendidikan Dokter.
Ciputat, 16 Oktober 2015
DEWAN PENGUJI Ketua Sidang
dr. Nouval Shahab, Sp.U, FICS, PhD, FACS NIP: 19721103 200604 1 001
Pembimbing I
Chris Adhiyanto, S.Si, M.Biomed, PhD NIP: 19690511 200312 1 001
Pembimbing II NIP. 19671119 200501 2 001
PIMPINAN FAKULTAS
Dekan FKIK UIN
Dr. Arif Sumantri, S.K.M., M.Kes NIP.19650808 198803 1 002
Kaprodi PSPD
v
Assalamualaikum wr. wb.
Puji syukur peneliti panjatkan kepada Allah SWT yang telah melimpahkan rahmat dan hidayah-Nya sehingga penelitian ini dapat diselesaikan dengan baik. Shalawat serta salam tidak lupa peneliti sampaikan kepada Nabi Muhammad SAW beserta keluarga dan sahabatnya.
Alhamdulillahi rabbil ‘alamin, penelitian ini telah selesai, dan akan sulit terselesaikan jika tanpa bantuan dan bimbingan dari berbagai pihak. Oleh karena itu, saya mengucapkan banyak terima kasih kepada:
1. Prof. Dr. H. Arif Sumantri, M.Kes selaku Dekan Fakultas Kedokteran dan Ilmu Kesehatan Universitas Islam Negeri Syarif Hidayatullah Jakarta.
2. dr. Achmad Zaki, M.Epd, Sp.OT selaku Kepala Program Studi Pendidikan Dokter FKIK UIN Syarif Hidayatullah Jakarta.
3. Chris Adhiyanto, S.Si, M.Biomed, PhD dan dr. Nouval Shahab, SpU, Ph.D, FICS, FACS selaku dosen pembimbing yang telah membimbing, mengarahkan, dan memberikan dukungan kepada peneliti mulai dari awal hingga akhir penelitian.
4. dr. Mukhtar Ikhsan, Sp.P(K), MARS dan Nurlaely Mida R., S.Si, M. Biomed, DMS selaku penguji sidang laporan penelitian ini. 5. dr. Nouval Shahab, SpU, Ph.D, FICS, FACS dan dr. Flori Ratna
Sari, Ph.D. selaku penanggung jawab riset Program Studi Pendidikan Dokter angkatan 2012 yang telah memberikan motivasi untuk dapat menyelesaikan penelitian tepat pada waktunya.
6. dr. Fika Ekayanti, M.Med Ed selaku pembimbing akademik yang telah sabar menasehati dan memberikan dukungan dalam proses pembelajaran di Program Studi Pendidikan Dokter.
7. Kedua orang tua saya yang tercinta, terhebat, ayahanda alm. H.
Asy’ari, S.Ag dan ibunda DR. Hj. Lailial Muhtifah, M.Pd yang
vi
Fauziah, S.Pd, Nur Rahmiani, S.KM, Niya Latul Muna, S.Kom serta seluruh keluarga besar saya yang senantiasa membuat saya semangat dan kuat dalam mengikuti proses pembelajaran di Program Studi Pendidikan Dokter FKIK UIN Syarif Hidayatullah Jakarta.
9. Rafiqy Sa’adiy Faizun yang selalu menasehati, mendukung, dan
memotivasi peneliti.
10. Untuk teman seperjuangan kelompok penelitian saya, Nurul Hasanah, Hipni Solehudin, Rizky Ananda Prawira, dan Adamilzary Fikry yang berjuang bersama.
11. Untuk Mba Ai dan Mba Sur selaku Laboran yang ikut membantu saya dalam melakukan penelitian ini.
12. Untuk Sahabat terdekat saya Ranita, Harlia, Amel, Melia, Binayu, Silvi, dan Barbie Anis, Muthi, Putri, Fitri yang selalu memberikan dukungan.
13. Untuk Official CIMSA UIN 2014-2015 Adit, Fiizhda, Octa, Firda, Reni, Dewi, Shaby, Raka, Linda, Eel, Galang, Ijul, Nadya, Hylman, dan SCOMEDIAN CIMSA UIN yang senantiasa memberikan dukungan kepada peneliti.
14. Untuk seluruh mahasiswa PSPD 2012 hingga 2014 yang bersedia menjadi responden dalam penelitian ini.
15. Untuk semua pihak yang tidak dapat saya sebutkan satu persatu.
Peneliti menyadari bahwa laporan penelitian ini masih terdapat ketidaksempurnaan. Oleh karena itu, peneliti mengharapkan kritik dan saran yang membangun bagi penelitian ini. Semoga penelitian ini dapat bermanfaat bagi masyarakat dan para pembaca.
Ciputat, 16 Oktober 2015
vii
Nucleotide Polymorphysm rs855791 (C>T) pada Mahasiswa Program Studi Pendidikan Dokter Universitas Islam Negeri Syarif Hidayatullah Jakarta untuk Mengetahui Kemungkinan Menderita Iron Refractory Deficiency Anemia dengan Menggunakan Teknik Real Time Polymerase Chain Reaction -High Resolution Melt.
SNP rs855791 (TMPRSS6) diketahui menyebabkan produksi berlebihan dari hepsidin yang dapat menyebabkan penurunan penyerapan zat besi pada Iron Refractory Deficiency Anemia. Untuk mengetahui frekuensi SNP rs855791 dan hubungannya dengan tingkat Hb, sebuah studi asosiasi genom dilakukan di UIN Syarif Hidayatullah Jakarta. Sampel diperoleh dari mahasiswa Program Studi Pendidikan Dokter angkatan 2012-2014 (N=102). Metode yang digunakan adalah
High Resolution Melt (HRM) dengan menggunakan Light Cycler 480® Roche untuk skrining Iron Refractory Deficiency Anemia dan pemeriksaan kadar hemoglobin menggunakan Easy Touch® GCHb meter. Hasilnya, frekuensi genotip SNP rs855791 (C> T) adalah wildtype (3,9%), heterozigot (72,5%), dan mutan (23,5%). Hasilnya tidak menunjukkan perbedaan yang signifikan antara genotip dengan kadar hemoglobin (p=0,818) dan anemia (p =0,466). Fragmen DNA sampel menunjukkan 1 delesi dan double-hetero di urutan basa lainnya yang menyebabkan perbedaan dalam penelitian ini.
viii
Nucleotide Polymorphysm rs855791 (C>T) on Student of Medical Education Study Program of State Islamic University Syarif Hidayatullah Jakarta Grade 2012-2014 to Know Iron Refractory Deficiency Anemia Possibility Using Real Time Polymerase Chain Reaction-High Resolution Melt Technique.
SNPs rs855791 (TMPRSS6) is known to cause excessive production of hepcidin that may lead to decreased iron absorption in Iron Refractory Deficiency Anemia. To know the frequency of SNP rs855791 and its relationship with the levels of Hb, a genome-wide association studies was conducted in UIN Syarif Hidayatullah Jakarta. Samples was obtained from student of Medical Education Study Program grade 2012-2014 (N=102). The method was used High Resolution Melt (HRM) by using Light Cycler 480® Roche for screening Iron Refratory Deficiency Anemia and hemoglobin level examination using Easy Touch® GCHb meters. The result, frequency of genotyping SNPs rs855791 (C>T) is wildtype (3,9%), heterozygote (72,5%), and mutant (23,5%). The result did not show any significant difference between genotyping with hemoglobin levels (p=0,818) and anemia (p = 0,466). The sequence of DNA sample shows 1 deletion and double-hetero in other base sequence causes the difference in this study.
ix
LEMBAR JUDUL ... i
LEMBAR PERNYATAAN ... ii
LEMBAR PERSETUJUAN ... iii
LEMBAR PENGESAHAN ... iv
KATA PENGANTAR ... v
2.1.1.1 Kajian Islam Tentang Larangan Menikah Sedarah ... 5
2.1.2 Anemia ... 6
2.1.2.1 Kajian Islam Tentang Makanan yang Halal Lagi Baik ... 7
2.1.3 Siklus Hidup Eritrosit ... 8
2.1.4 Metabolisme Zat Besi ... 9
2.1.5 Iron Refractory Deficiency Anemia (IRIDA) ... 11
2.1.6 Regulasi Ekspresi Hepsidin ... 14
2.1.7 Isolasi Genom ... 16
2.4 Definisi Operasional ... 28
BAB 3 METODE PENELITIAN ... 30
3.1 Desain Penelitian ... 30
3.2 Lokasi dan Waktu Penelitian ... 30
3.3 Populasi dan Sampel ... 30
x
4.1.2 Data Karakteristik Responden ... 43
4.1.3 Hasil Pengukuran Kadar Hemoglobin ... 45
4.1.4 Hasil Analisis Kurva HRM ... 45
4.1.4.1 Analisis Kurva Genotyping (Wildtype, Heterozygote, dan Mutant) ... 45
4.1.5 Hasil Hubungan Jenis Kelamin dengan Kadar Hemoglobin ... 46
4.1.6 Hasil Hubungan Jenis Kelamin dengan Kategori Kadar Hemoglobin ... 47
4.1.7 Hasil Hubungan Jenis Kelamin dengan Genotyping (Wildtype, Heterozygote, dan Mutant) ... 47
4.1.8 Hasil Hubungan Genotyping (Wildtype, Heterozygote, dan Mutant) dengan Kadar Hemoglobin ... 48
4.1.9 Hasil Hubungan Genotyping (Wildtype, Heterozygote, dan Mutant) dengan Kategori Kadar Hemoglobin ... 49
4.2 Pembahasan ... 50
4.3 Kelebihan Penelitian ... 52
4.4 Keterbatasan Penelitian ... 52
BAB 5 SIMPULAN DAN SARAN ... 54
5.1 Simpulan ... 54
5.2 Saran ... 54
DAFTAR PUSTAKA ... 55
xi
Gambar 2.2 Sintesis Hemoglobin pada Pembentukan Sel Darah Merah ... 12
Gambar 2.3 Letak Gen TMPRSS6 ... 13
Gambar 2.4 Siklus Zat Besi – Mekanisme Adaptasi Tubuh pada Defisiensi Besi . 15 Gambar 2.5 Ekspresi gen HAMP ... 15
Gambar 2.6 Analisis data HRM dari SNP tipe 4 (A/T) ... 25
Gambar 2.7 Kerangka Teori ... 27
Gambar 2.8 Kerangka Konsep ... 28
Gambar 3.1 Alur Penelitian ... 42
Gambar 4.1 Rerata Kadar Hemoglobin Menurut Jenis Kelamin ... 46
xii
Tabel 2.2 Klasifikasi anemia berdasarkan morfologi dan etiologi ... 8
Tabel 2.3 Proporsi relatif besi didalam tubuh pada dewasa muda sehat ... 10
Tabel 2.4 Konsentrasi DNA yang Dianjurkan untuk Berbagai Template ... 26
Tabel 2.5 Definisi Operasional ... 28
Tabel 3.1 Alat dan Bahan Penelitian ... 31
Tabel 3.2 Tahapan Isolasi Genom DNA ... 37
Tabel 3.3 Parameter PCR yang direkomendasikan untuk Light Cycler 480® System PCR Run ... 39
Tabel 4.1 Karakteristik Jenis Kelamin Responden ... 44
Tabel 4.2 Karakteristik Usia Responden ... 44
Tabel 4.3 Indeks Massa Tubuh Responden ... 44
Tabel 4.4 Kategori Kadar Hemoglobin Responden ... 45
Tabel 4.5 Genotyping SNP rs855791 dari genom DNA responden ... 46
Tabel 4.6 Distribusi Frekuensi Kategori Kadar Hemoglobin Berdasarkan Jenis Kelamin ... 47
xiii
BMP Bone Morphogenetic Protein
CFU-E Colony Forming Unit-Erythroid
EPO Erythropoetin
Hb Hemoglobin
HJV Hemojuvelin
HRM High Resolution Melt
IRIDA Iron Refractory Deficiency Anemia
MT2 Matriptase-2
PCR Polymerase Chain Reaction
SNP Single Nucleotide Polymorphysm
TfR1 Transferin Receptor 1
TfR2 Transferin Receptor 2
TMPRSS6 Transmembran Protease, Serin 6
WHO World Health Organization
xiv
Lampiran 2. Lembar Tanda Terima Komisi Etik Penelitian ... 59
Lampiran 3. Fragmen gBlock dan Primer ... 60
Lampiran 4. Alat dan Bahan Penelitian ... 61
Lampiran 5. Gel Documentation hasil Elektroforesis Agarose dari Isolasi Genom DNA Sampel ... 63
Lampiran 6. Hasil Kemurnian dan Konsentrasi DNA Sampel ... 64
Lampiran 7. Hasil Kurva HRM dan Sekuensing ... 67
Lampiran 8. Hasil Analisis Statistik ... 73
1 1.1. Latar Belakang
Anemia sangat banyak terjadi di berbagai negara belahan dunia. Menurut WHO dari tahun 1993 hingga 2005, secara global anemia mengenai 1,62 juta orang.1 Prevalensi tertinggi terjadi pada anak usia pra sekolah sebesar 47,4 % dan paling rendah pada laki-laki 12,7 %. Namun untuk jumlah populasi yang paling banyak terkena adalah perempuan tidak hamil yakni sekitar 468 juta di dunia. Di Indonesia, anemia gizi besi masih merupakan masalah kesehatan masyarakat dengan prevalensi pada anak balita sebesar 28,1 %, anak 5-12 tahun 29 %, ibu hamil 37,1 %, remaja perempuan 13-18 tahun dan perempuan usia subur 15-49 tahun masing-masing sebesar 22,7%.2
Masalah anemia defisiensi besi sebagian besar di saluran gastrointestinal. Penurunan absorbsi besi dapat terjadi pada penyakit inflammatory bowel disease,
gastritis atrofi, infeksi Helicobacter pylori, dan setelah dilakukan tindakan pembedahan seperti gastrectomi, duodenal bypass, bariatric surgery. Kehilangan darah kronik seperti pada esofagitis, gastritis erosif, ulkus peptikum, divertikulitis, tumor jinak, kanker intestinal, hemorrhoids, infestasi cacing, menstruasi yang banyak, menorrhagia, hemolisis intravaskular, schistomiasis kronik, dan sindrom munchausen juga dapat menjadi penyebab. Konsumsi obat-obatan seperti glukokortikoid, salisilat, NSAIDs, dan PPI sama dapat menyebabkan anemia. Pada keadaan bayi baru lahir, remaja, perempuan yang sedang menstruasi, kehamilan, konsumsi besi yang kurang, malnutrisi, dan diet pada vegetarian dapat menyebabkan anemia. Asupan zat besi yang kurang dan perdarahan akibat infeksi cacing merupakan salah satu penyebab yang banyak di negara berkembang.3
(IRIDA) merupakan anemia herediter resesif yang disebabkan oleh defek pada gen TMPRSS6 yang mengkode matriptase-2 (MT2). MT2 merupakan regulator negatif transkripsi hepsidin. Kadar hepsidin yang tinggi dapat mencegah penyerapan zat besi di usus halus. Pada tahun 1981, tiga orang bersaudara diketahui tidak menunjukkan respon terhadap pemberian zat besi secara parenteral. Kemudian ditemukan pula dua saudara perempuan mengalami hal yang sama dengan orang tua tidak mengalami hal serupa. Pada kasus lainnya, hal yang sama juga ditemukan dengan hasil pemeriksaan tambahan yang telah menyingkirkan anemia akibat gangguan gastrointestinal maupun perdarahan. Saat itu diduga bahwa pasien menderita anemia akibat gangguan dalam metabolism zat besi yang diturunkan secara genetik. Pada tahun 1997, seorang anak dari ras Afrika berusia 18 bulan dengan iron resistant iron deficiency anemia dan mikrositosis berat dilaporkan.4 Prevalensi dari IRIDA sendiri masih belum banyak diketahui, terlebih di Indonesia.
1.2. Rumusan Masalah
Uraian dalam latar belakang masalah di atas memberikan dasar bagi peneliti untuk merumuskan pertanyaan penelitian sebagai berikut :
a. Berapa frekuensi genotyping Single Nucleotide Polymorphysm (SNP) rs855791 (TMPRSS6) (C>T) asam amino prolin menjadi serin pada mahasiswa Program Studi Pendidikan Dokter (PSPD) Universitas Islam Negeri (UIN) Syarif Hidayatullah Jakarta angkatan 2012 – 2014 menggunakan teknik Real Time Polymerase Chain Reaction-High Resolution Melt (PCR-HRM)?
1.3. Hipotesis
Terdapat hubungan antara genotyping SNP rs855791 (TMPRSS6) (C>T) dengan kadar hemoglobin mahasiswa PSPD UIN Syarif Hidayatullah Jakarta menggunakan teknik Real Time PCR-HRM.
1.4. Tujuan
a. Mengetahui frekuensi genotyping SNP rs855791 (TMPRSS6) (C>T) pada mahasiswa PSPD UIN Syarif Hidayatullah Jakarta angkatan 2012 – 2014 menggunakan teknik Real Time PCR-HRM.
b. Mengetahui hubungan antara genotyping SNP rs855791 (TMPRSS6) (C>T) dengan nilai Hb pada mahasiswa PSPD UIN Syarif Hidayatullah angkatan 2012 – 2014 menggunakan teknik Real Time
PCR-HRM.
1.5. Manfaat Penelitian
a. Bagi peneliti, menambah khazanah ilmu pengetahun dan ketrampilan khususnya bidang biologi molekuler serta meningkatkan kemampuan penulis dalam penelitian.
b. Bagi penelitian selanjutnya, sebagai sumber informasi dan bahan referensi.
c. Bagi masyarakat, sebagai sumber informasi dalam mengatur pola makan yang sehat dan bergizi cukup.
4 BAB 2
TINJAUAN PUSTAKA
2.1. Landasan Teori
2.1.1. Genomik
Menurut National Human Genome Research Institute, genomik merupakan istilah yang banyak digunakan untuk menggambarkan studi tentang seluruh gen manusia (genom), termasuk interaksi antar gen dan dengan lingkungannya. Genomik mempelajari studi ilmiah mengenai berbagai macam penyakit yang kompleks, seperti penyakit jantung, asma, diabetes, dan kanker.5 Menurut WHO, genomik didefinisikan sebagai studi tentang gen dan fungsi mereka, dan teknik terkait.6
Satu gen dapat divisualisasikan sebagai satu segmen molekul DNA yang mengandung kode dari urutan asam amino dari rantai polipeptida dan mengatur ekspresinya secara sederhana. Pada genom manusia terdapat banyak gen yang mengkode berbagai macam protein dan juga area non-koding. Area non-koding tersebut disebut dengan intron. Intron awalnya ditranskripsi menjadi RNA di dalam inti tetapi tidak hadir dalam mRNA matang di sitoplasma. Dengan demikian, informasi dari urutan intron tidak terwakili dalam produk protein akhir. Intron terletak bergantian dengan ekson. Ekson merupakan area koding yang mengkode produk akhir protein.7 Mutasi pada area ekson maupun intron dapat mempengaruhi hasil akhir dari mutasi tersebut.
para ilmuwan menemukan gen yang berhubungan dengan penyakit. Ketika SNP terjadi dalam gen atau di intra gen, mereka dapat memainkan peran lebih langsung dalam penyakit dengan mempengaruhi fungsi gen. Kebanyakan SNP tidak berpengaruh pada kesehatan atau perkembangan. Beberapa perbedaan genetik ini, bagaimanapun, telah terbukti sangat penting dalam studi kesehatan manusia. Para peneliti telah menemukan SNP yang dapat membantu memprediksi respon seseorang terhadap obat tertentu, kerentanan terhadap faktor lingkungan seperti racun, dan risiko perkembangan penyakit tertentu. SNP juga dapat digunakan untuk melacak warisan gen penyakit dalam keluarga. Penelitian selanjutnya yang ada dapat mengidentifikasi SNP yang berkaitan dengan penyakit kompleks seperti penyakit jantung, diabetes, dan kanker, termasuk IRIDA.8
2.1.1.1 Kajian Islam Tentang Larangan Pernikahan Sedarah
Artinya : “Diharamkan atas kamu (mengawini) ibu-ibumu; anak-anakmu yang perempuan; saudara-saudaramu yang perempuan, saudara-saudara bapakmu
yang perempuan; saudara-saudara ibumu yang perempuan; anak-anak
perempuan dari saudara-saudaramu yang laki-laki; anak-anak perempuan dari
saudara-saudaramu yang perempuan; ibu-ibumu yang menyusui kamu; saudara
perempuan sepersusuan; ibu-ibu isterimu (mertua); anak-anak isterimu yang
dalam pemeliharaanmu dari isteri yang telah kamu campuri, tetapi jika kamu
belum campur dengan isterimu itu (dan sudah kamu ceraikan), maka tidak
berdosa kamu mengawininya; (dan diharamkan bagimu) isteri-isteri anak
kandungmu (menantu); dan menghimpunkan (dalam perkawinan) dua perempuan
yang bersaudara, kecuali yang telah terjadi pada masa lampau; sesungguhnya
Allah Maha Pengampun lagi Maha Penyayang”. (QS. An Nisa: 23)
Dari ayat tersebut sudah jelas, bahwa Allah SWT mengharamkan adanya pernikahan sedarah. Secara genetik, pernikahan sedarah lebih beresiko mendatangkan suatu penyakit dibandingkan tidak.9 Sebagai contoh, seorang perempuan yang memiliki sifat pembawa gen talasemia. Kemungkinan yang sama dapat terjadi pada saudaranya, karena adanya hubungan sedarah. Maka, apabila adanya pernikahan sedarah kemungkinan untuk melahirkan anak dengan talasemia dapat terjadi.
2.1.2 Anemia
Anemia didefinisikan sebagai penurunan konsentrasi hemoglobin, hematokrit atau hitung eritrosit. Hemoglobin merupakan “major oxygen-carryng pigment” dalam darah, gram hemoglobin per 100 mL darah (g/dL). Hemoglobin
digunakan dalam penelitian ini untuk hemoglobin pada laki-laki 13,5-16,5 g/dL dan perempuan 12,1-15,1 g/dL. Anemia dapat terjadi oleh berbagai macam penyebab. Tabel 2.2 menjelaskan beberapa penyebab anemia.
Secara genetik, anemia dapat terjadi pada penyakit talasemia. Pada talasemia terjadi mutasi pada gen yang membentuk rantai globin.10 Gangguan pada pembentukan enzim delta aminolevulenat dehidratase (ᵹ-ALAD) oleh timbal juga dapat menyebabkan anemia.
2.1.2.1 Kajian Islam Tentang Makanan yang Halal Lagi Baik
Penyakit anemia merupakan kondisi yang dapat disebabkan oleh berbagai hal. Salah satu penyebab yang paling banyak terjadi di Indonesia adalah karena defisiensi zat besi. Hal ini dapat terjadi karena kurangnya kesadaran masyarakat akan kebutuhan zat besi setiap hari. Bila kita lihat, masyarakat Indonesia sering mengonsumsi teh setelah makan. Hal ini dapat mengganggu penyerapan zat besi dari makanan yang telah dimakan. Allah SWT berfirman dalam QS. Al-Baqarah ayat 168 sebagai berikut.
Artinya : “Wahai manusia! Makanlah dari (makanan) yang halal dan baik yang
terdapat di bumi.” (QS. Al-Baqarah: 168)
Tabel 2.1. Kadar hemoglobin berdasarkan usia menurut WHO, Hb dalam (g/L)
Populasi Non-Anemia Anemia
Ringan Sedang Berat Bayi dan balita umur 6-59
Bulan
Anak 5-11 tahun Anak 12-14 tahun
Perempuan yang sedang tidak hamil (usia 15 tahun keatas)
Perempuan yang sedang hamil
Tabel 2.2. Klasifikasi anemia berdasarkan morfologi dan etiologi
I. Anemia hipokromik mikrositer a. Anemia defisiensi besi b. Talasemia major
c. Anemia akibat penyakit kronik d. Anemia sideroblastik
II.Anemia normokromik normositer a. Anemia pasca berdarahan akut b. Anemia aplastik
c. Anemia hemolitik didapat d. Anemia akibat penyakit kronik e. Anemia pada gagal ginjal kronik f. Anemia pada sindrom
a. Anemia defisiensi asam folat b. Anemia defisiensi B12
Sumber : Sudoyo dkk, 2006
2.1.3. Siklus Hidup Eritrosit
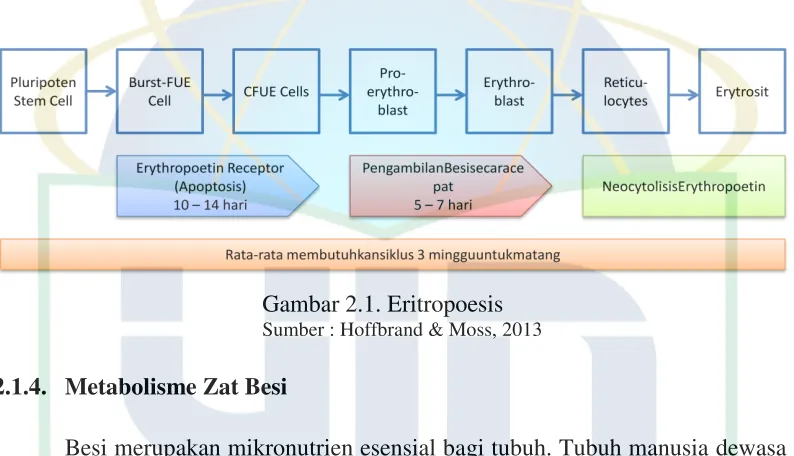
Eritrosit dewasa atau matang berada dalam sirkulasi selama 110 – 120 hari. Kemudian ditangkap oleh makrofag. Eritropoesis dipengaruhi oleh sitokin,
dari sel burst forming unit-erythroid (BFU-E) menjadi sel colony forming unit-erythroid (CFU-E). Kemudian menjadi pro-eritrosit, eritroblas, lalu menjadi retikulosit. Retikulosit bertahan di dalam sirkulasi selama satu hari, kemudian menjadi eritrosit matur, sekitar 1% dari jumlah eritrosit. Retikulosit dapat meningkat apabila terjadi perdarahan akut, sebagai kompensasi sum-sum tulang yang adekuat. Sehingga retikulosit dapat menilai respon sum-sum tulang adekuat atau tidak. Retikulosit normal sekitar 0,5-1,5 %.10 Evaluasi morfologi dari eritrosit bergantung pada kriteria ukuran, bentuk, distribusi dan konsentrasi Hb, kemampuan menyerap zat warna, hapusan darah tepi, dan inklusi.
Gambar 2.1. Eritropoesis
Sumber : Hoffbrand & Moss, 2013
2.1.4. Metabolisme Zat Besi
Besi merupakan mikronutrien esensial bagi tubuh. Tubuh manusia dewasa mempunyai dua penyimpanan besar untuk besi, pertama besi yang terdapat pada hemoglobin, mioglobin, enzim dan kedua penyimpanan besi pada ferritin, hemosiderin, dan transferrin (protein transport di dalam darah). Laki-laki dewasa sehat mempunyai kurang lebih 3,6 gram besi dari seluruh total tubuh, pada perempuan sekitar 2,4 gram. Tabel berikut menunjukkan proporsi besi di dalam tubuh manusia dewasa sehat.16
tahun membutuhkan zat besi sebanyak 8 mg/hari. Perempuan pada kelompok umur 9-13 tahun membutuhkan zat besi sebanyak 8 mg/hari, kemudian kebutuhan meningkat seiring berjalannya umur yakni pada kelompok umur 14-18 tahun membutuhkan sekitar 15 mg zat besi/hari dan 18 mg/hari untuk usia 19-50 tahun. Kebutuhan zat besi pada perempuan kembali menurun pada usia 51 hingga lebih dari 70 tahun.16
Tabel 2.3. Proporsi relatif besi didalam tubuh pada dewasa muda sehat
Tipe Besi
Sumber : Mahan & Escott-Stumpt, 2004
Berdasarkan ketersediaannya, terdapat dua jenis zat besi yaitu zat besi non heme dan zat besi heme. Zat besi heme banyak ditemukan dalam makanan hewani, yang ditemukan dalam hemoglobin, mioglobin, dan beberapa enzim dan zat besi non heme banyak ditemukan dalam sayuran dan kacang-kacangan. Zat besi dari hewani sudah dalam bentuk ferro (Fe2+), sedangkan zat besi dari tanaman berbentuk ferri (Fe3+). Zat besi ferro diabsorbsi di brush border (mukosa) melalui pembentukan vesikel disekitar zat besi heme di enterosit intestinal. Setelah zat besi ferro masuk ke sitosol, besi ferro secara enzimatis dipisahkan dari kompleks
untuk membentuk feritin dan pada saat yang bersamaan ion besi non heme yang bebas berikatan dengan apoferitin. Feritin merupakan penyimpanan besi intraseluler dan satu feritin membawa zat besi dengan cara berikatan dengannya dari brush border ke membran basolateral sel. Tahap akhir dari absorpsi ini adalah ion besi berpindah ke sirkulasi dari membran basolateral dengan mekanisme transport aktif. Pada tahap ini dilakukan baik pada besi heme maupun non heme.16 Makanan dan sekresi dari gastrointestinal kecil mempengaruhi penyerapan besi. Pada individu yang mengonsumsi berbagai jenis makanan, sekitar 5-10% kandungan zat besi heme berasal dari makanan dan absorpsinya mencapai 25%, sedangkan zat besi non heme hanya diabsorpsi sebesar 5%. Pada seseorang vegetarian yang hanya mengkonsumsi makanan yang berasal dari tumbuhan, dibutuhkan konsumsi sumber makanan nabati dalam jumlah yang banyak untuk memenuhi kebutuhan zat besi di dalam tubuh. Oleh karena itu, pada pasien dengan anemia lebih disarankan untuk mengonsumsi sumber makanan zat besi dari hewani dibandingkan dari nabati.16
Besi non heme diabsorpsi di duodenum dan jejunum dalam bentuk terionisasi. Sekresi asam lambung meningkatkan kelarutan besi dan merubahnya menjadi bentuk ion baik ferri (Fe+3) dan ferro (Fe+2). Asam askorbat atau vitamin C dapat mengoksidasi zat besi ferri menjadi ferro, sehingga dapat meningkatkan penyerapannya di usus. Molekul makanan lain seperti gula dan sulfur yang mengandung asam amino juga dapat meningkatkan absorpsi besi.16
Besi dibutuhkan untuk sintesis protein hemoglobin. Hemoglobin sangat berperan penting dalam transport O2 di dalam darah. Sintesis hemoglobin terjadi di dalam mitokondria melalui reaksi biokimia. Reaksi dimulai dengan kondensasi antara glisin dan suksinil koenzim A membentuk enzim δ-aminolaevulinic acid
Gambar 2.2. Sintesis hemoglobin pada pembentukan sel darah merah
Sumber : Hoffbrand & Moss, 2006
2.1.5. Iron Refractory Deficiency Anemia (IRIDA)
IRIDA merupakan penyakit autosomal resesif yang jarang terjadi. IRIDA ditandai oleh anemia mikrositik hipokrom yang parah, rendahnya serum besi dan saturasi transferin, sedangkan level feritin normal hingga tinggi diikuti dengan tingginya level hormon hepsidin secara berlebihan. Penyakit ini disebabkan oleh hilangnya fungsi akibat mutasi pada gen TMPRSS6 yang mengkode matriptase-2 (MT2) sebagai suatu regulator negatif transkipsi hepsidin. Pada individu dengan level hepsidin yang tinggi, hepsidin mencegah absorbsi zat besi pada duodenum dan besi yang diproses ulang oleh makrofag. Lebih jauh lagi, variasi genetik TMPRSS6 dapat memodulasi fenotip hematologis dan status besi.4
mengontrol kadar protein lain yang disebut hepsidin, yang merupakan tombol pengatur keseimbangan zat besi dalam tubuh. Ketika kadar besi darah rendah, jalur sinyal ini akan mengurangi produksi hepsidin, yang memungkinkan lebih banyak zat besi dari makanan yang akan diserap melalui usus dan diangkut dari situs penyimpanan (terutama di hati dan limpa) ke dalam aliran darah. Besi merupakan komponen penting dari hemoglobin, yang merupakan molekul dalam sel darah merah yang membawa oksigen. Nama resmi dari gen ini "Transmembran Protease, Serin 6". TMPRSS6 adalah simbol resmi gen. Gen TMPRSS6 adalah bagian dari PRSS (peptidase serin). Gen TMPRSS6 terletak di 22q12.3 lokasi sitogenetik pada kromosom 22. Gen TMPRSS6 terletak di lengan panjang (q) kromosom 22 pada posisi 12,3.18
Gambar 2.3. Letak gen TMPRSS6
Sumber : http://ghr.nlm.nih.gov/gene/TMPRSS6
rs855791 merupakan SNP pada gen TMPRSS6. SNP ini memiliki genotip normal atau wildtype (C;C), dan heterozygot pada (C;T) dengan nilai hemoglobin rata-rata lebih rendah 0,1 g/dL, serta mutant (T;T) dengan nilai hemoglobin rata-rata lebih rendah 0,2 g/dL.19 Hasil penelitian yang dilakukan oleh Benyamin, dkk (2009), memperlihatkan hubungan yang kuat antara SNP rs855791 dengan kadar Hb dan MCV pada remaja Australia. Alel T pada rs855791 memperlihatkan penurunan rata-rata kadar Hb dan MCV. Hubungan antara TMPRSS6 dengan kadar Hb memiliki hasil yang bermakna pada setiap kelompok sampel (remaja, dewasa, dan campuran).20 Sehingga kadar Hb dapat digunakan sebagai alat ukur.
darah. SNP diidentifikasi dari ras Eropa dan India Asia, hasilnya memperlihatkan hubungan yang sangat kuat pada rs855791 (G>A). Alel A pada RS855791 lebih banyak berhubungan dengan level hemoglobin yang rendah pada ras India Asia dibanding dengan ras Eropa. Sebesar 19% individu dengan ras Eropa dan 27% individu dengan ras India Asia yang memiliki genotip AA pada rs855791 memiliki konsentrasi hemoglobin rata-rata 0,2% lebih rendah dibandingkan dengan individu yang memiliki genotip GG. Hasil analisis penelitian tersebut, menunjukkan bahwa alel A memiliki persamaan dengan alel T. Setiap alel A mengindikasikan asosiasi 0,11 g/dL konsentrasi Hb yang lebih rendah.21
2.1.6. Regulasi Ekspresi Hepsidin
Jumlah besi dalam plasma menentukan availabilitas besi pada eritropoiesis dan fungsi selular. Besi berikatan dengan transferin [Fe(III)-Tf] dan dapat segera diambil oleh seluruh jenis sel melalui ekspresi reseptor transferin 1 (TfR1). Homeostasis besi dijaga oleh liver-expressed peptide hormone hepcidin yang menjadi pusat dari regulasi besi dalam plasma. Hepsidin meregulasi absorbsi besi di usus yang masuk ke dalam plasma, dalam hal ini makrofag mendaur ulang eritrosit yang sudah rusak, dan mobilisasi besi dari penyimpanan hepar. Hepsidin yang berikatan dengan iron exporter ferroportin yang berada pada permukaan
iron-releasing cells akan menurunkan regulasinya, hal tersebut menyebabkan degradasi dan menurunkan level besi dalam plasma. Availabilitas besi secara sistemik, kebutuhan besi untuk eritropoesis, hipoksia, dan inflamasi meregulasi level hepsidin dalam plasma. Penelitian mengenai mekanisme yang mendasari
frequent iron related disorders, seperti hemokromatosis herediter, talasemia, atau anemia akibat penyakit kronik menyediakan pengetahuan terhadap regulasi hepsidin.3
fosfolirasi protein reseptor activated SMAD, dan pada akhirnya protein hepsidin dibentuk. Proses ini terjadi di dalam sel hepar.3
Gambar 2.4. Siklus zat besi–mekanisme adaptasi tubuh pada defisiensi besi
Sumber : Camaschella, 2015.
Gambar 2.5. Ekspresi gen HAMP
2.1.7. Isolasi Genom
2.1.7.1. Persiapan untuk Human Genomic DNA
Secara umum, sekitar 90% DNA terdapat di dalam nukleus (kromosom). Pada studi genetika, isolasi DNA lebih banyak berasal dari sel darah tepi. Namun karena prosedurnya yang invasif, sulit untuk memperoleh sampel dari teknik tersebut. Sumber DNA lain dapat berasal dari sel mukosa pipi yang diperoleh dengan pencucian mulut menggunakan salin (teknik yang non invasif dan tidak menyebabkan perdarahan). Isolasi DNA dari sel bucal lebih murah dan membutuhkan jumlah yang sedikit, dan dapat disimpan dalam waktu yang lama. Teknik lain menggunakan folikel rambut dan biasa digunakan sebagai teknik investigasi pada kasus kriminal. Sampel yang berasal dari urin bermanfaat dalam mendeteksi kasus doping dan drug screening test. Tujuan dari isolasi DNA adalah mengisolasi dan mempurifikasi berat DNA dalam jumlah yang banyak.22 Berikut beberapa tahapan dalam purifikasi DNA.
a. Cell breakage (pemecahana sel)
Pemecahan sel merupakan langkah awal dalam purifikasi DNA. Teknik ini dapat membuka sel dan memperoleh DNA yang intak menggunakan bahan kimia berupa detergent dan/atau prosedur enzimatis. Detergen dapat melarutkan asam lemak membran sel dan mengakibatkan sel lisis. Detergen juga memiliki efek inhibitor terhadap seluruh DNAse enzim selular dan dapat mendenaturasi protein, dengan demikian membantu dalam pembersihan protein dari larutan tersebut.23
b. Removal of protein (Membuang protein)
Langkah kedua dalam purifikasi adalah membuang kontaminan berupa protein dari sel lisis. Prosedur ini disebut dengan deproteinisasi. Prinsip kerja prosedur ini bergantung pada perbedaan antara bentuk fisik antara asam nukleat dan protein. Perbedaan ini terletak pada kelarutan, volume spesifik parsial, sensitifitas terhadap enzim pencernaan.23
larut di dalam air. Sedangkan protein, mengandung banyak residu hidrofobik yang menyebabkan protein secara parsial larut di dalam pelarut organik. Pelarut organik biasanya mengandung fenol dan kloroform. Metode yang menggunakan fenol sebagai agen deproteinisasi dikenalkan oleh Kirby (1957), sehingga dikenal sebagai Metode Kirby. Penggunaan campuran kloroform isoamil alkohol dikenalkan oleh Marmur, sehingga dikenal Metode Marmur. Metode ini mendasari banyak modifikasi dan pengembangan dari waktu ke waktu.23
Penggunaan fenol pada metode Kirby memiliki beberapa prinsip. Fenol pada suhu ruang akan membentuk kristal, dengan adanya kandungan air 20% akan membentuk suspensi yang mengandung butiran-butiran fenol tersebar di dalam molekul air. Molekul protein secara umum mengandung banyak residu hidrofobik, yang mana terkonsentrasi dibagian tengah molekul. Ketika protein bercampur dengan fenol dalam volume yang sama, beberapa molekul fenol akan terlarut dalam fase cair (kurang lebih 20% air dan 80% fenol). Sehingga fenol dapat menembus masuk ke dalam protein, menyebabkan protein membengkak dan rusak. Protein yang telah terdenaturasi akan larut di dalam fenol. Sehingga tersisa asam nukleat. Asam nukleat tidak memiliki molekul yang bersifat hidrofobik sehingga tidak larut di dalam fenol.23
Kekurangan metode Kirby adalah produk oksidasi dari fenol dapat bereaksi secara kimia dengan molekul DNA (dan RNA). Fenol juga sangat toksik dan membutuhkan prosedur pembuangan. Untuk mengurangi efek tersebut, beberapa modifikasi yang dapat dilakukan sebagai berikut.23
Menggunakan detergen ionik.
Menggunakan reaksi enzimatis untuk membuang protein sebelum ekstraksi fenol. Hal tersebut menurunkan kebutuhan fenol yang akan digunakan. Sehingga kemungkinan hilangnya molekul DNA dapat diturunkan.
berwarna kuning dan saat teroksidasi menjadi tidak berwarna, hal ini merupakan indikator yang baik yang dapat terlihat.
Penggunaan dari metode Marmur berdasarkan pada karakteristik dari pelarut organik. Kloroform tidak larut dalam air dan meskipun banyak ektraksi tidak mengakibatkan hilangnya DNA ke dalam fase organik.23
c. Removal of RNA (Membuang RNA)
Prinsip pembersihan RNA dari DNA menggunakan reaksi enzimatik. Konsekuensi dari prosedur ini tidak dapat membuang semua RNA secara bersih. Prosedur ini menggunakan dua ribonuklease, yaitu ribonuklease A dan ribonuklease T1.
Ribonuklease A (RNase A) merupakan endoribonuklease yang dapat memotong RNA setelah residu C dan U. Reaksi tersebut menghasilkan oligonukleotida yang diakhiri dengan 3’–phosphorylated pyrimidine nucleotide. Ribonuklease T1 (RNase T1) memotong dsRNA dan ssRNA setelah residu G,
menghasilkan oligonukleotida yang diakhiri dengan 3’–phosphorilated guanosine
nucleotide. Karena kedua enzim tersebut spesifik terhadap RNA, penggunaan kedua enzim tersebut dalam RNA removal pada sampel DNA sangat direkomendasikan. Penggunaan hanya salah satu enzim akan menghasilkan DNA yang terkontaminasi dengan oligonukleotida dalam jumlah yang banyak. Sehingga dapat mengganggu pembacaan spektofotometri.23
d. Concentrating the DNA (pemekatan DNA)
DNA didapatkan dengan cara pengendapan menggunakan alkohol. Dalam prosedur ini digunakan dua macam alkohol yakni ethanol dan isopropanol. Pengendapan menggunakan alkohol berdasarkan pada fenomena penurunan kelarutan asam nukleat di dalam air. Kutub positif air berinteraksi secara kuat dengan kutub negatif kelompok fosfodiester DNA. Interaksi ini menyebabkan DNA larut dalam air. Sedangkan ethanol tidak dapat berinteraksi dengan kutub negatif DNA seperti air. Sehingga asam nukleat tidak larut di dalam ethanol.23
e. Determination of the purity and quantity of DNA (Pengukuran kemurnian dan jumlah konsenrasi DNA)
Untuk mengukur kemurnian DNA hasil isolasi, dapat dilakukan pembacaan dengan alat spektofotometer menggunakan cahaya ultraviolet (UV). Keberadaan kontaminan berupa protein dapat diketahui dari rasio nilai optical density (OD) hasil isolasi pada panjang gelombang 260 nm dan 280 nm. Hasil isolasi dinyatakan murni bila nilai rasio A260 : A280 adalah 2,0. Jika rasio kurang dari 2,0, maka konsentrasi DNA dapat dihitung dengan menggunakan rumus berikut.23
N (μg ml-1
) = 70 A260 – 40 A280
A260 dan A280 merupakan daya serap DNA pada panjang gelombang 260 nm dan 280 nm. Indikator yang lebih baik dari kemurnian sampel DNA adalah rasio A260 : A234. DNA memiliki daya serap minimum pada 234 nm dan daya serap protein tinggi pada 205 nm. Rasio A260 : A234 merupakan indikator yang sangat sensitif untuk menentukan kontaminasi protein. Rasio antara 1,8-2,0 menunjukkan asam nukleat yang murni. A260 dan A234 merupakan daya serap sampel DNA pada panjang gelombang 260 nm dan 234 nm. Dengan menggunakan kedua panjang gelombang tesebut, konsentrasi DNA dapat dihitung dengan menggunakan rumus berikut.23
N(μg ml-1) = 52,6 A260– 5,24 A234
2.1.8 Polymerase Chain Reaction (PCR)
Prinsip dasar PCR dapat dikatakan sederhana. Seperti namanya yakni reaksi berantai: satu molekul DNA digunakan untuk menghasilkan dua salinan, lalu empat, delapan dan seterusnya. Penggandaan terus menerus ini dilakukan oleh protein tertentu yang dikenal sebagai polimerase, enzim yang mampu membuat satu untaian DNA individu untuk membentuk untaian molekul yang panjang. Oleh karena itu diperlukan fragmen DNA yang terdiri dari empat asam nukleat, yakni adenin (A), timin (T), sitosin (C) dan guanin (G). Mereka juga membutuhkan fragmen kecil DNA, yang dikenal sebagai primer. Jika bahan telah tersedia, enzim akan membentuk fragmen baru sama seperti pada template. PCR adalah metode digunakan untuk memperbanyak salinan dari setiap untai tertentu asam nukleat. Hal ini berarti PCR selektif memperkuat sebuah segmen tertentu DNA.25
Secara umum PCR membutuhkan target DNA sepanjang 100-1000 base pairs (bp). Secara teknik sulit untuk mengamplifikasi DNA dengan panjang >500 bp. Primer yang biasa digunakan memiliki panjang 20-20 nukleotida. Dalam proses PCR, dibutuhkan beberapa bahan seperti thermal cycler dan PCR amplification mix, yang terdiri dari sampel dsDNA, thermostable DNA polymerase, dua primer oligonukleotida, deoxynucleotide triphosphat (dNTPs), dan penyangga reaksi yang mengandung ion magnesium dan komponen lainnya (22). Berikut prosedur dalam PCR yang umum digunakan :
a. DNA didenaturasi oleh panas dengan suhu 90-95oC selama 20 detik. Dua untai terpisah karena rusaknya hidrogen yang mengikat mereka.
c. Setiap helai molekul DNA mengalami proses annealing dengan primer oligonukleotida melengkapi kedua ujung urutan target yang membutuhkan waktu 20 detik.
d. Suhu dinaikkan ke 60-75oC dan primer diperluas oleh aksi polimerase DNA selama 30 detik. Polimerase yang mensintesis urutan komplementer 5 'ke 3' arah dari masing-masing primer. Jika template
mengandung nukleotida A, enzim menambahkan pada nukleotida T untuk primer. Jika template berisi G, ia menambahkan C untuk rantai baru. Pada titik ini ada akan persis dua salinan dari urutan DNA target.
e. Campuran dipanaskan lagi di 90-95oC untuk denaturasi molekul dan memisahkan helai dan siklus diulang. Setiap helai baru kemudian bertindak sebagai template untuk siklus sintesis berikutnya. Jadi amplifikasihasil pada eksponensial (logaritmik) tingkat, yaitu jumlah DNA yang dihasilkan ganda pada setiap siklus. Produk diperkuat pada akhir PCR yang disebut amplikon.
2.1.9. Metode High Resolution Melt (HRM)
Polymorphisms (SNPs)), identifikasi varian gen baru tanpa sekuensing (gene scanning) atau mendeterminasi variasi genetik pada populasi.26
Langkah awal dari protokol HRM adalah amplifikasi area yang akan dianalisis dengan menggunakan teknik PCR standar sehingga terdapat double stranded-DNA (dsDNA) yang dapat mengikat zat warna. Pewarna tersebut memiliki daya floresensi yang tinggi saat berikatan dengan dsDNA dan sangat lemah pada daerah yang tidak berikatan.Perubahan ini memungkinkan pengguna untuk memantau amplifikasi DNA selama PCR (sebagai PCR kuantitatif).26
Setelah langkah PCR selesai, target diperkuat secara bertahap dengan cara didenaturasi secara bertahap dengan meningkatkan suhu sedikit demi sedikit, untuk menghasilkan profil karakteristik leleh; ini yang disebut sebagai Melting Analysis. Target yang sudah diamplifikasi didenaturasi secara bertahap, melepaskan pewarna, yang menghasilkan penurunan fluoresensi.Ketika pengaturan sudah tepat, HRM cukup sensitif untuk memungkinkan deteksi perubahan basa tunggal antara urutan nukleotida yang dinyatakan identik. HRM menggunakan pewarna yang termasuk murah dan sedikit optimasi dibandingkan dengan sistem yang sama seperti Taqman dan Fluorescence Resonance Energy Transfer (FRET) probes. Dibandingkan dengan metode tersebut, HRM lebih sederhana dan lebih cost-effective untuk sampel yang banyak.26
2.1.9.1 Analisis Hasil HRM
Dengan softwareLight Cycler 480 Roche yang benar, analisis data dapat dilakukan terhadap beberapa sampel secara simultan. Hal ini penting untuk mengetahui apa yang harus dicari ketika menganalisis hasil; kesalahan tak terduga yang dilakukan selama pemasangan dapat diidentifikasi pada saat ini. Perubahan
a. Plot amplifikasi
Reproduksibilitas amplifikasi lebih penting pada analisis HRM daripada efisiensi amplifikasi (dibandingkan dengan PCR kuantitatif). Misalnya, analisis HRM masih bisa dilakukan jika produk amplifikasi lebih lambat daripada perkiraan (yaitu karena keterbatasan dalam desain primer), asalkan semua sampel konsisten.26
b. Data mentah kurva leleh
Data yang dikumpulkan selama HRM yang dianalisis memiliki rentang awal (pre-melt) pembacaan fluoresensi. Variasi ini membuat sulit untuk menganalisis hasil dengan benar, meskipun kelompok genotip yang berbeda dapat terlihat. Gambar 2.6 A menunjukkan bagaimana pemilihan daerah pre- dan post-melt digunakan untuk menyelaraskan data. Pre- dan daerah post-melt harus dipilih untuk setiap set primer, dengan posisi paralel ganda-bar seperti yang ditunjukkan. Hal ini penting untuk menyesuaikan bar ini sehingga wilayah lelehan tidak dipilih. Jika pre- atau post- daerah leleh tidak jelas, mungkin untuk mengulang HRM menjalankan saja (tanpa mengulangi langkah amplifikasi), dan menyesuaikan kisaran suhu yang diperlukan.26
c. Data Normalisasi
Jika data yang dinormalisasi benar, akan muncul seperti yang ditunjukkan pada gambar 2.6 B yang disebut 'data normalisasi'. Pada gambar 2.6 B, variasi fluoresensi yang dapat dilihat pada gambar 2.6 A telah dihilangkan, dan hanya kisaran suhu antara bar luar daerah sebelum dan sesudah mencair ditampilkan. Genotip sekarang lebih berbeda, tetapi dua sampel homozigot (merah dan biru) yang masih sulit untuk dibedakan.26
d. Perbedaan grafik
plot terhadap temperatur. Bentuk analisis HRM ini merupakan bantuan untuk memvisualisasikan normalisasi data.26
HRM memiliki sifat yang sangat sensitif sehingga desain uji nya sangat penting untuk dilakukan dengan baik. Perhatian khusus harus diberikan untuk desain primer, reagen PCR yang digunakan dan kondisi siklus. Perbedaan pengaturan awal dapat sangat mempengaruhi hasil akhir. Faktor-faktor seperti kualitas genom DNA, desain primer, dan konsentrasi MgCl2 semua akan mempengaruhi hasil. Bagian berikut membahas masing-masing faktor-faktor yang harus diperhatikan.26
Gambar 2.6. Analisis data HRM dari SNP tipe 4 (A/T).A. Data mentah memperlihatkan pre-melt, melt dan post-melt. Memperlihatkan variasi fluoresensi dan posisi pre dan post melting. B. Data normalisasi C. Grafik lain dari data normalisasi
Sumber : https://www.kapabiosystems.com/assets/Introduction_to_High_Resolution_Melt_ Analysis_Guide.pdf
Kualitas dan kuantitas DNA merupakan salah satu faktor utama yang dapat mengurangi kualitas hasil. Hal tersebut dapat terjadi karena akumulasi dari penyangga dari template DNA sampel atau pada saat proses persiapan. Pemurnian DNA yang tidak sesuai teknik dapat mempengaruhi hasil. Garam bisa mempengaruhi proses melting produk PCR, dan dapat mengakibatkan sensitivitas rendah, reproduktifitas sedikit dan keluaran hasil genotip yang salah. Bufer yang terakumulasi dari template DNA tidak hanya akan memodifikasi Tm, proses,
melting selama HRM, namun juga dapat mendorong amplifikasi yang spesifik selama PCR26. Untuk hasil yang optimal berikut dianjurkan beberapa hal dibawah ini:
• Idealnya, semua sampel DNA yang akan dianalisis (termasuk genotype
kontrol) harus diekstrak menggunakan ekstraksi DNA dengan metode atau kit yang sama.
• Beberapa kit menggunakan konsentrasi tinggi garam untuk elusi DNA dari kolom. Jadi, semua sampel template harus dielusi dengan kandungan rendah garam, idealnya 10 mM Tris-HCl, pH 8,5.
• Sampel DNA harus terkonsentrasi setelah pemurnian. Template
kemudian dapat diencerkan dengan 10 mM Tris-HCl, pH 8,5 sebelum A/A
A/T
digunakan. Hal ini membantu untuk mengurangi variasi larutan penyangga antara sampel.
• Penambahan volume yang sedikit pada template DNA akan
mengurangi akumulasi garam dalam reaksi; idealnya volume terendah
template yang dapat secara akurat ditambahkan harus digunakan (1-2 ml).
• Semua sampel harus memiliki konsentrasi akhir DNA yang sama disetiap uji. Tabel 2.4 menjelaskan rincian konsentrasi DNA yang dianjurkan untuk berbagai template. Pada template dengan konsentrasi rendah, ada kesempatan yang lebih besar menggabungkan mutasi di awal PCR yang akan mempengaruhi perilaku melting; konsentrasi tinggi DNA akan menghasilkan latar belakang fluoresensi yang tinggi karena meningkatnya interkalasi pewarna ke dalam dsDNA.
• Kontrol positif untuk semua genotip harus dimasukkan dan sebaiknya pada konsentrasi yang sama seperti sampel uji. DNA kontrol juga harus dielusi dan/atau diencerkan dalam bufer yang sama sebagai sampel.
Tabel 2.4. Konsentrasi DNA yang dianjurkan untuk berbagai template
Jenis DNA Rekomendasi Konsentrasi
DNA untuk analisis HRM
Genomic DNA (gDNA) 10 ng – 100 pg
Plasmid DNA (1-10kb) 1 ng – 10 fg
Amplicon DNA 10 pg – 1 fg
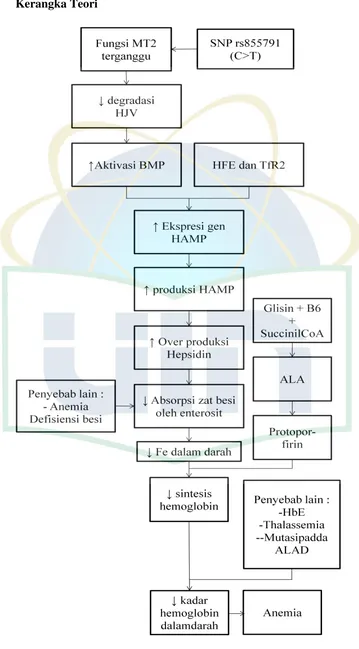
2.2. Kerangka Teori
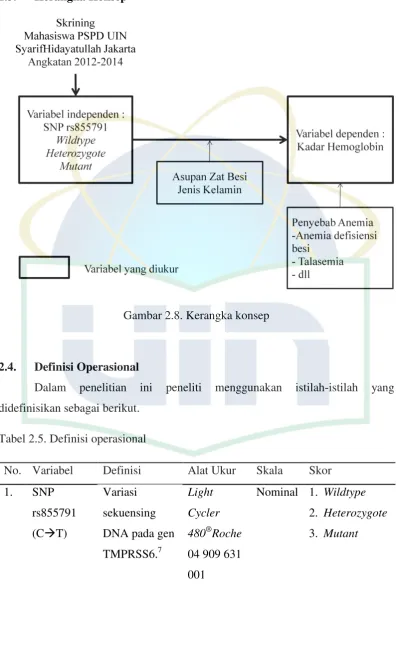
2.3. Kerangka Konsep
Gambar 2.8. Kerangka konsep
2.4. Definisi Operasional
Dalam penelitian ini peneliti menggunakan istilah-istilah yang didefinisikan sebagai berikut.
Tabel 2.5. Definisi operasional
No. Variabel Definisi Alat Ukur Skala Skor 1. SNP
rs855791 (CT)
Variasi sekuensing DNA pada gen TMPRSS6.7
Light
Cycler
480®Roche
04 909 631 001
Nominal 1. Wildtype
2. Heterozygote
30 3.1. Desain Penelitian
Metode yang digunakan pada penelitian ini adalah penelitian eksperimental. Penelitian ini dilakukan dengan menggunakan alat Light Cycler 480®Roche 04 909 631 001 dengan menggunakan primer spesifik rs855791 (C>T) untuk melakukan skrining Iron Refractory Deficiency Anemia dan pemeriksaan kadar hemoglobin dengan menggunakan Easy Touch®GCHb meter.
3.2. Lokasi dan Waktu Penelitian
Penelitian dilakukan di Fakultas Kedokteran dan Ilmu Kesehatan UIN Syarif Hidayatullah Jakarta dengan mengambil data primer yakni genom mahasiswa Program Studi Pendidikan Dokter angkatan 2012 hingga 2014. Penelitian dilakukan dari bulan Mei hingga Oktober 2015.
3.3. Populasi dan Sampel
3.3.1 Populasi Terjangkau
Populasi terjangkau penelitian ini adalah mahasiswa Program Studi Pendidikan Dokter angkatan 2012 hingga 2014.
3.3.2 Kriteria Pemilihan
3.3.3 Perkiraan Besar Sampel
Dalam penentuan jumlah sampel, peneliti menggunakan perhitungan Slovin dengan alasan total jumlah mahasiswa PSPD dari 2012-2014 kurang dari 500 orang. Rumus perhitungan adalah:
n = N/(1+Ne2)
Jadi besar sampel minimal yang dibutuhkan untuk penelitian ini adalah 75 orang sampel.
3.3.4 Teknik Pemilihan Sampel
Sampel yang dipilih berdasarkan Simple Random Sampling dimana sampel diambil secara acak berdasarkan tabel.
3.4 Alat dan Bahan Uji
Alat dan bahan yang digunakan dalam penelitian ini dijelaskan dalam tabel sebagai berikut.
Tabel 3.1. Alat dan bahan penelitian
Alat Bahan Keterangan
(Lanjutan)
Alat Bahan Keterangan
Pengukuran kadar hemoglobin Isolasi Genom DNA dari darah
Tabung mikrosentrifugasi 1,5 ml steril
Water bath AS ONE TRW-42TP, 60oC (untuk rehidrasi DNA yang cepat)
Tipmikro Biologix ukuran 10 μL, 200 μL, dan 1000 μL
Pengukuran kemurnian dan konsentrasi hasil isolasi DNA
Maestro Nano Drops Elektroforesis ATTO My Power II
(Lanjutan)
3.5. Cara Kerja Penelitian
3.5.1. Pengumpulan Data
Cara pengambilan data dalam penelitian ini yaitu data primer. Data responden diperoleh dengan cara tes kadar Hb mahasiswa dengan menggunakan alat EasyTouch GCHb® mater, dan punksi vena untuk skrining SNP rs855791 (C>T).
Responden sebanyak 102 orang yang telah mengisi lembar informed consent (lampiran 1) dilakukan pengambilan darah sebanyak 3 cc satu kali dan pemeriksaan kadar Hb. Sampel darah diberi nomor dan disimpan dalam cold room
untuk dilakukan isolasi genom DNA, kemudian dilakukan teknik Real Time PCR-HRM dan selanjutnya dianalisis.
3.5.2. Desain gblock dan Primer
Proses perancangan gblock dan primer membutuhkan TMPRSS6 Gene Sequence untuk melihat secara keseluruhan urutan basa nukleotida dan melihat area mutasinya. Langkah kerja desain primer yang spesifik untuk mendeteksi IRIDA pada penelitian ini adalah sebagai berikut :
b. Data sekuensing, primer forward dan reverse TMPRSS6 disalin dan dipindahkan kedalam kolom data primer3.
Primer yang digunakan dalam penelitian ini adalah5’ TCT GCA GAA AGT GGA TGT GC 3’ (forward) dan 5’ CTC ACC TGA CAG GCA TCC TT 3’
(reverse).
c. Tombol “Pick Primers” ditekan. Kemudian Primer3 OUTPUT berikut ini
Langkah kerja desain gBlock yang spesifik untuk mendeteksi IRIDA pada penelitian ini adalah sebagai berikut :
a. Website https://www.idtdna.com/pages/products/genes/gblocks-gene-fragments dibuka.
b. Tombol “Product & Services” ditekan. Kolom “gBlocks GeneFragments”
c. Data sekuensing DNA TMRSS6 dimasukkan kedalam kolom data sekuensing. Tombol “Test Complexity” ditekan.
3.5.3. Isolasi DNA
Setelah sampel darah diambil, dilakukan isolasi DNA untuk mendapatkan genom DNA dengan menggunakan Genomic DNA Mini Kit (Blood/Cultured Cell) Geneaid GB100 dengan langkah kerja seperti dalam tabel 3.2.Genom DNA yang telah diisolasi dinilai apakah sudah terisolasi atau tidak dengan cara elektroforesis dan dibaca menggunakan Gel documentation.
Tabel 3.2. Tahapan isolasi genom DNA
Persiapan Sampel
Fresh Blood
1. Darah sebanyak 300 μl kedalam 1,5 ml tabung mikrosentrifugasi dimasukkan
2. 900 μl RBC Lysis Buffer kemudian ditambahkan dan dikocok. 3. Tabung diinkubasi 10 menit dalam suhu ruangan
4. Tabung disentrifugasi selama 5 menit pada kecepatan 3000 rpm selama 5 menit, supernatan dibuang.
5. 100 μl RBC Lysis Buffer ditambahkan untuk meresuspensi endapan leukosit, kocok, kemudian diproses dengan cell lysis
Langkah 1
Cell Lysis
6. 200 μl GB Buffer ditambahkan kedalam tabung tadi
7. Tabung diinkubasi pada suhu 60o C selama 10 menit untuk memastikan sampel terlisiskan.
8. Pada saat yang sama tabung lain berisi 50 μl Elution Buffer untuk tiap satu sampel disiapkan, kemudian diinkubasi pada suhu 60o C. 9. Setelah tabung sampel tadi diinkubasi, tabung didinginkan di
suhu ruangan. kemudian secara cepat dikocok selama 10 detik.
11.GD Column pada 2 mL Collection Tube disiapkan. 12.Campuran ethanol tadi dipindahkan kedalam GD Column
13.Tabung disentrifugasi pada 14.000 – 16.000 x g selama 5 menit 14.Cairanpada 2 ml Collection Tube dibuang
15.GD Column ditempatkan kembali pada 2 ml Collection Tube
Langkah 3
Wash
16.400 μl W1 Buffer ditambahkan kedalam GD Column kemudian disentrifugasi pada 14.000 – 16.000 x g selama 1 menit
17.Cairan pada 2 ml Collection Tube dibuang
18.GD Column ditempatkan kembali pada 2 ml Collection Tube
19.600 μlWash Buffer ditambahkan kedalam GD Column
20.Tabung disentrifugasi pada 14.000 – 16.000 x g selama 1 menit 21.Cairan pada 2 ml Collection Tube dibuang
23.Tabung disentrifugasi kembali selama 1 menit untuk sekitar 30 –50 μl dapat meningkatkan konsentrasi DNA.
24.GD Column yang sudah kering dipindahkan ke dalam tabung mikrosentrifugasi yang steril
25.50 μl Elution Buffer yang sudah diinkubasi ditambahkan ke dalam matriks kolom, dibiarkan selama 3 menit
26.Tabung disentrifugasi pada 14.000 – 16.000 x g selama 1 menit untuk mendapatkan hasil
3.5.3. Real Time PCR-HRM
Setelah dilakukan isolasi genom DNA, pemeriksaan skrining dilakukan ketahap selanjutnya yakni Real Time PCR HRM dengan menggunakan alat Light Cycler 480® 04 909 631 001. Kondisi reaksi untuk amplifikasi dari sistem protokol untuk program High Resolution Melting adalah sebagai berikut.
Pre-inkubasi untuk aktivasi Fast Start Taq DNA Polimerase dan denaturasi template
Amplifikasi dari DNA target
Melting dari amplikonuntuk peroleh data dengan resolusi tinggi Pendinginan (cooling) dari kipas dan thermal chamber
Tabel 3.3 menunjukkan rekomendasi parameter yang digunakan dalam
Real Time PCR HRM sebagai gene scanning assay.
Langkah memulai genotyping analisa: 1. Pengenceran primer
Sebanyak 5 μL primer forward dari tabung induk diambil dan dipindahkan kedalam tabung mikro 1, kemudian ditambahkan 5 μL dH2O. Hasil pengenceran didapatkan konsentrasi sebesar 50 μM.
Tabel 3.3. Parameter PCR yang direkomendasikan untuk Light Cycler 480® System PCR Run untuk membuat gene scanning assay dengan menggunakan
Light Cycler 480® High Resolution Melting Master
Sebanyak 5 μL primer reverse dari tabung induk diambil dan dipindahkan kedalam tabung mikro 2, kemudian ditambahkan 5 μL dH2O. Hasil pengenceran didapatkan konsentrasi sebesar 50 μM. Sebanyak 1 μL primer forward dan 1 μL primer reverse dari
pengenceran diatas (50 μM) dipindahkan kedalam tabung mikro 3, kemudian ditambahkan 8 μL dH2O. Hasil pengenceran didapatkan konsentrasi 5 μM, hasil ini yang digunakan dalam mix untuk menjalankan RT PCR HRM.
2. Pengenceran template DNA (genom sampel)
DNA sampel induk yang telah diukur konsentrasinya, kemudian diambil 1 sebanyak 1 μL dan ditambahkan 9 μL dH2O. Hasil ini yang digunakan sebagai template dalam menjalankan RT PCR HRM.
Setelah dilakukan langkah diatas, kemudian dipersiapkan mix untuk HRM di dalam tabung yang berisi HRM kit 7,5 μL, MgCl2 1,2 μL, primer campuran hasil pengenceran 0,75 μL, dan dH2O 1,8 μL. DNA sampel dari hasil pengenceran yang digunakan adalah sebanyak 3,75 μL. Kemudian DNA sampel dimasukkan terlebih dahulu kedalam sumur template PCR baru ditambahkan mix tadi sebanyak 11,25 μL. Sumur ditutup dengan penutup plastiknya, kemudian dimasukkan kedalam alat Light Cycler dan dijalankan.
3.5.4. Analisis Data
Pengolahan data primer dilakukan dengan menggunakan program SPSS
versi 22. Agar analisis penelitian menghasilkan informasi yang benar, pengolahan data dilakukan dengan tahapan editing, coding, processing, dan cleaning. Editing
merupakan kegiatan untuk melakukan pengecekan kelengkapan data rekam medis.
Coding merupakan kegiatan merubah data berbentuk huruf menjadi data berbentuk angka atau bilangan. Setelah semua data diperiksa dan telah dilakukan
3.5.4. Etika Penelitian
3.5.5. Alur Penelitian
43 4.1. Hasil
4.1.1. Hasil Isolasi Genom DNA dari Whole Blood
Sampel yang digunakan pada penelitian ini berupa sampel DNA yang diisolasi dari sel darah (whole blood). Sampel DNA yang digunakan terdiri dari 102 sampel DNA mahasiswa Program Studi Pendidikan Dokter UIN Syarif Hidayatullah Jakarta. Isolasi dan purifikasi DNA dari sampel darah (whole blood) dilakukan berdasarkan protokol Genomic DNA Mini Kit (Blood/Cultured Cell) Geneaid GB100. Kemudian untuk memeriksa apakah DNA telah terisolasi dan terpurifikasi dengan baik dilakukan dengan gel elektroforesis yang dapat dilihat pada gambar (lampiran 5).
Setelah itu dilakukan pemeriksaan kemurnian dan konsentrasi dari 102 sampel DNA genom yang dapat dilihat pada tabel (lampiran 6). Dari 102 sampel, 44,1 % memiliki kategori kemurnian rasio A260/A280 (1,8-2,0) baik, 8,8% tinggi, dan 47,1% rendah. Rasio A260/A280 digunakan untuk identifikasi kontaminasi di dalam DNA sampel. Rasio A260/A280 yang rendah dapat disebabkan oleh kontaminasi fenol atau reagen pada saat isolasi, namun dapat pula disebabkan oleh konsentrasi yang sangat rendah (>10 ng/uL) dari asam nukleat.24 Sampel yang memiliki konsentrasi rendah sebanyak 8,8%. Meskipun rasio kemurnian menentukan kualitas dari sampel, indikator kualitas DNA bergantung dari aplikasi yang digunakan.24
4.1.2 Data Karakteristik Responden
Tabel 4.1. Karakteristik jenis kelamin responden
Tabel 4.2. Karakteristik usia responden
Usia Responden (tahun) Frekuensi Persentase (%)
17 3 2,9
Berdasarkan tabel 4.2 diketahui bahwa presentase usia terbanyak dari 102 responden adalah 20 tahun. Rerata usia responden adalah 20 (17-23).
Berdasarkan hasil statistik deskriptif diketahui bahwa rerata Indeks Massa Tubuh dari seluruh responden adalah 20,41 (15,22-33,61). Kemudian data indeks massa tubuh dikelompokkan berdasarkan kriteria IMT Asia Pasifik untuk mengetahui status gizi responden.
Tabel 4.3. Karakteristik Indeks Massa Tubuh responden
Kategori IMT Asia Pasifik Frekuensi Persentase (%)
Berdasarkan tabel 4.3 diketahui bahwa kategori IMT terbanyak yakni normal dengan presentase 58,8%.
4.1.3. Hasil Pengukuran Kadar Hemoglobin
Berdasarkan hasil statistik deskriptif diketahui bahwa rerata kadar hemoglobin dari seluruh responden adalah 11,35 g/dL (8,00-18,50). Kemudian data kadar hemoglobin dikelompokkan berdasarkan nilai rujukan untuk mengatahui status anemia responden. Nilai rujukan yang digunakan yakni pada laki-laki kadar normal hemoglobin (g/dL) adalah antara 13,5 hingga 16,5 dan pada perempuan 12,1 hingga 15,1. Bila kadar hemoglobin kurang dari rentang tersebut, responden dikelompokkan kedalam kategori anemia. Hasil dari pengelompokkan tersebut didapatkan data sebagai berikut.
Tabel 4.4. Kategori kadar hemoglobin responden
Kategori Kadar Hemoglobin Frekuensi Presentase (%)
Non Anemia 22 21,6
Anemia 80 78,4
Total 102 100,0
Berdasarkan tabel 4.4 diketahui bahwa persentase anemia adalah 78,4%.
4.1.4. Hasil Analisis Kurva HRM
4.1.4.1. Analisis Kurva Genotyping (Wildtype, Heterozygote, dan Mutant)
Sampel yang telah dilakukan pemeriksaan mutasi gen dengan Real Time
PCR HRM akan memberikan hasil berupa kurva yang berbeda berdasarkan temperatur leleh (lampiran 7). Berdasarkan analisis kurva HRM dari genom DNA sampel, didapatkan data genotyping dari 102 sampel seperti dalam tabel 4.6. Berdasarkan tabel 4.6 diketahui bahwa dari 102 sampel persentase wildtype 3,9%,
Tabel 4.5.Genotyping SNP rs855791 dari genom DNA responden
Genotyping Frekuensi Persentase (%)
Wildtype 4 3,9
Heterozygote 74 72,5
Mutant 24 23,5
Total 102 100,0
4.1.5. Hasil Hubungan Jenis Kelamin dengan Kadar Hemoglobin
Hasil data yang diperoleh dari 102 responden didapatkan nilai rerata kadar hemoglobin untuk jenis kelamin laki-laki sebesar 12,96 g/dL (SD 1,98) dan untuk jenis kelamin perempuan 10,71 g/dL (SD 1,54).
Gambar 4.1. Rerata kadar hemoglobin menurut jenis kelamin
berarti menunjukkan terdapat perbedaan bermakna antara jenis kelamin dengan kadar hemoglobin (g/dL).
4.1.6. Hasil Hubungan Jenis Kelamin dengan Kategori Kadar Hemoglobin
Hasil data yang diperoleh dari 102 responden didapatkan presentase penderita anemia pada perempuan sebesar 86,15 % yang lebih tinggi daripada laki-laki yakni 64,86 %. Sedangkan kategori non anemia sebanyak 13,85 % pada perempuan dan 35,14 % pada laki-laki.
Tabel 4.6. Distribusi frekuensi kategori kadar hemoglobin berdasarkan jenis kelamin
Jenis Kelamin
Kategori Kadar Hb
Anemia Non Anemia Total
N % N % N %
Laki-laki 24 64,86 13 35,14 37 100
Perempuan 56 86,15 9 13,85 65 100
Kemudian dicari hubungan antara kategori jenis kelamin dan kategori kadar hemoglobin (anemia dan non anemia). Dari hasil crosstabulation
didapatkan nilai observed 13, 24, 9, dan 56. Nilai expected yang didapatkan 8, 29, 14 dan 51. Sehingga tabel tersebut (lampiran 8) layak untuk diuji Chi-Square
karena tidak ada nilai expected yang kurang dari 5. Setelah dilakukan uji Chi-Square, didapatkan nilai signifikansi dari Pearson Chi-Square sebesar 0,012. Sehingga dapat disimpulkan terdapat perbedaan yang signifikan antara jenis kelamin dan kategori kadar hemoglobin (anemia dan non anemia).
4.1.7. Hasil Hubungan Jenis Kelamin dengan Genotyping (Wildtype, Heterozygote, dan Mutant)