PENGARUH PEMBERIAN ROTIFER (
Brachionus
rotundiformis
) DAN
Artemia
YANG DIPERKAYA
DENGAN DHA 70G TERHADAP KELANGSUNGAN
HIDUP DAN INTERMOLT PERIOD LARVA UDANG
VANAME (
Litopenaeus vannamei)
DODI HERMAWAN
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
SURAT PERNYATAAN
Dengan ini saya menyatakan bahwa tesis yang berjudul : Pengaruh Pemberian Rotifer (Brachionus rotundiformis) dan Artemia Yang Diperkaya Dengan DHA 70G Terhadap Kelangsungan Hidup dan Intermolt Period Larva Udang Vaname (Litopenaeus vannamei), adalah hasil karya saya sendiri dibawah arahan komisi pembimbing, dan belum diajukan dalam bentuk
apapun kepada Perguruan Tinggi manapun. Sumber informasi yang berasal atau
dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah
disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir
tesis ini.
Bogor, April 2007
ABSTRAK
DODI HERMAWAN. Pengaruh Pemberian Rotifer (Brachionus rotundiformis) dan
Artemia yang Diperkaya dengan DHA 70G Terhadap Kelangsungan Hidup dan Intermolt Period Larva Udang Vaname (Litopenaeus vannamei). Di bimbing oleh MUHAMMAD AGUS SUPRAYUDI dan ING MOKOGINTA.
Penelitian ini bertujuan untuk mengetahui pengaruh kadar DHA terhadap kandungan nutrien rotifer (Brachionus rotundiformis) dan Artemia melalui tekhnik pengkayaan dan pengaruhnya sebagai pakan alami terhadap tingkat kelangsungan hidup dan intermolt period larva udang vaname (Litopenaeus vannamei).
Penelitian ini dilakukan dengan dua tahap, pertama pengkayaan pada rotifer dengan DHA 70G yang diberikan pada larva vaname stadia zoea 2 sampai post larva (PL) 1, yang terdiri dari lima perlakuan yaitu: A. Pakan buatan tanpa pemberian rotifer, B. Rotifer+minyak kelapa 100 µL/L+pakan buatan, C. Rotifer+DHA 70G 25 µL/L+minyak kelapa 75 µL/L+pakan buatan, D. Rotifer+DHA 70G 50 µL/L+minyak kelapa 50 µL/L+pakan buatan, E. Rotifer+DHA 70G 75 µL/L+minyak kelapa 25 µL/L+pakan buatan . Sedangkan tahap kedua pengkayaan naupli Artemia dengan DHA 70G yang diberikan pada post larva vaname stadia PL1-PL10, yang terdiri dari empat perlakuan yaitu: A.
Artemia+minyak kelapa 100 µL/L+pakan buatan, B. Artemia+DHA 70G 25 µL/L+minyak kelapa 75 µL/L+pakan buatan, C. Artemia+DHA 70G 50 µL/L+minyak kelapa 50 µL/L+pakan buatan, perlakuan D. Artemia+DHA 70G 75 µL/L+minyak kelapa 25 µL/L+pakan buatan. Parameter yang diamati adalah tingkat kelangsungan hidup, intermolt period dan kandungan asam lemak .
Hasil penelitian ini menunjukkan bahwa pengkayaan dengan DHA 70G pada rotifer dan Artemia sebanyak 25 µL/L dapat meningkatkan nilai nutrien dari rotifer dan Artemia sehingga menghasilkan tingkat kelangsungan hidup yang lebih baik dan mempercepat intermolt period larva udang vaname.
Kata kunci : Litopenaeus vannamei, asam lemak, DHA, kelangsungan hidup,
Period Larva Udang Vaname (Litopenaeus vannamei)
(The effect of Rotifers (Brachionus rotundiformis) and Artemia enriched with DHA 70G on survival and intermolt period in white shrimp
(Litopenaeus vannamei) larvae)
Abstract
Two experiments was conducted to determine the effect of docosahexaenoic acid (DHA) on the nutritional value of rotifers (Brachionus rotundiformis) and Artemia as live food on the survival and intermolt period of white shrimp (Litopenaeus vannamei) larvae. The experiment I consisted of five treatments, where L. vannamei larvae from zoea 2 to mysis 3 fed on rotifers enriched with DHA 70G. This treatment: A. artificial feed without rotifers, B. rotifers+coconut oil 100μL/L + artificial feed, C. rotifers + DHA 70G 25μL/L + coconut oil 75μL/L + artificial feed, D. rotifers + DHA 70G 50μL/L + coconut oil 50μL/L + artificial feed, E. rotifers + DHA 70G 75μL/L + coconut oil 25μL/L + artificial feed. The experiment II consisted of four treatments, where L.vannamei
larvae from post larvae 1 to post larvae 10 fed on Artemia enriched with DHA 70G. This treatmens: A. Artemia + coconut oil 100μL/L + artificial feed, B.
Artemia + DHA 70G 25μL/L + coconut oil 75μL/L + artificial feed, C. Artemia + DHA 70G 50μL/L + coconut oil 50μL/L + artificial feed, D. Artemia + DHA 70G 75μL/L + coconut oil 25μL/L + artificial feed. Survival rate, intermolt period and fatty acid composition were used as evaluating parameters. Result of this experiment showed that rotifers and Artemia enriched with 25µL/L DHA 70G increase the nutritional value of live food, maintaining high survival and accelerating intermolt period in white shrimp larvae.
©Hak cipta milik Dodi Hermawan, 2007
Hak cipta dilindungi
Dilarang mengutip dan memperbanyak tanpa izin dari
Institut Pertanian Bogor, sebagian atau seluruhnya dalam bentuk apapun,
DENGAN DHA 70G TERHADAP KELANGSUNGAN
HIDUP DAN INTERMOLT PERIOD LARVA UDANG
VANAME (
Litopenaeus vannamei)
DODI HERMAWAN
Tesis
Sebagai salah satu syarat untuk memperoleh gelar Magister Sains pada Program Studi Ilmu Perairan
Sekolah Pascasarjana Institut Pertanian Bogor
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
LEMBAR PENGESAHAN
Judul Penelitian : Pengaruh Pemberian Rotifer (Brachionus rotundiformis ) dan
Artemia yang Diperkaya DHA 70G Terhadap Kelangsungan Hidup dan Intermolt Period Larva Udang Vaname (Litopenaeus vannamei)
Nama Mahasiswa : Dodi Hermawan
NRP : C151040121
Program Studi : Ilmu Perairan
Disetujui Komisi Pembimbing
Dr. M. Agus Suprayudi Prof. Dr. Ing Mokoginta Ketua Anggota
Diketahui
Ketua Program Studi Dekan Sekolah Pascasarjana
Ilmu Perairan
Prof. Dr. Enang Harris Prof. Dr. Khairil Anwar Notodiputro
Penulis dilahirkan pada tanggal 3 Maret 1978 di Ciamis Propinsi Jawa
Barat sebagai anak ketiga dari pasangan H. Achmad Uding (Alm) dan Hj.
Kusminah.
Penulis menyelesaikan pendidikan dasar di SD Negeri XIV Banjar pada
tahun 1990, pendidikan lanjutan tingkat pertama di SMP Negeri 1 Banjar pada
tahun 1993, pendidikan lanjutan tingkat atas di SMA Negeri 1 Banjar pada tahun
1996. Penulis masuk perguruan tinggi tahun 1996 pada Program Studi Budidaya
Perairan Fakultas Perikanan dan Ilmu Kelautan Institut Pertanian Bogor dan
mendapatkan gelar sarjana perikanan pada tahun 2001.
Pada tahun 2001 sampai dengan 2004 penulis bekerja di PT
Centralpertiwi Bahari. Dari tahun 2001 – 2003 menjabat sebagai Section Head
Life Food Production and Experiment, dan pada tahun 2003-2004 menjabat
sebagai Section Head Fry Production.
Kemudian penulis melanjutkan pendidikan dan diterima menjadi
mahasiswa pascasarjana pada Program Studi Ilmu Perairan (AIR) Sekolah
KATA PENGANTAR
Puji syukur penulis panjatkan kehadirat Allah SWT, yang telah
memberikan rahmat serta Hidayah-Nya, sehingga penulis dapat menyelesaikan
Tesis dengan judul ”Pengaruh Pemberian Rotifer (Brachionus rotundiformis) dan
Artemia yang Diperkaya dengan DHA 70G Terhadap Kelangsungan Hidup dan
Intermolt Period Larva Udang Vaname (Litopenaeus vannamei)”. Tulisan ini
merupakan salah satu syarat dalam menyelesaikan studi pada Sekolah
Pascasarjana, Institut Pertanian Bogor.
Pada kesempatan ini penulis mengucapkan terima kasih yang mendalam
kepada Bapak Dr. M. Agus Suprayudi selaku Ketua Komisi Pembimbing dan Ibu
Prof. Dr. Ing Mokoginta selaku Anggota Komisi Pembimbing, yang telah
berkenan memberikan saran, bimbingan serta pengarahan selama penelitian dan
penyusunan tesis.
Ucapan terima kasih juga penulis sampaikan kepada :
1. Bapak Ir. Subandriyo selaku AVP Breeding Operation PT Centralpertiwi
Bahari dan Bapak Edi Poncolaksito AMd selaku Senior Manager PT
Centralpertiwi Bahari yang telah memberikan ijin dan fasilitas kepada penulis
selama penelitian.
2. Bapak Dr. Dedi Jusadi atas kesediaannnya sebagai Penguji Luar Komisi.
3. Bapak Dr. Chairul Muluk dan istri yang telah memberi dukungan secara
ikhlas dan penuh perhatian sejak penulis masuk pada Program Studi Ilmu
Perairan.
4. Dekan Sekolah Pascasarjana Institut Pertanian Bogor beserta staf dan Ketua
Program Studi Ilmu Perairan beserta staf yang telah memberi bantuan dan
fasilitas selama penulis mengikuti pendidikan.
5. Khusus kepada Ayahanda (Alm) yang semasa hidupnya telah menjadi suri
tauladan bagi penulis dan Ibunda tercinta yang selalu mengiringi penulis
dengan doa dan kasih sayangnya.
6. Kakakku Teh Neni, Teh Nina, Kang Dedi dan keponakanku Bayu, Lutfhi,
Nadhif yang terus berdoa dan mendorong keberhasilan penulis selama ini.
7. Devi Aristyani SPi yang telah memberikan kasih sayang yang tulus dan
dukungan kepada penulis selama penelitian dan penyusunan tesis.
8. Novianto Kurniawan beserta istri, Antonius Edi, Tursilo dan Yuni SPi yang
tidak dapat penulis sebutkan satu persatu tetapi penulis yakin mereka akan
bahagia karena do’a mereka terkabul.
Semoga segala bantuan dan kebaikan yang telah diberikan mendapatkan pahala
yang berlipat ganda dari Allah SWT. Amin.
Mudah-mudahan tesis ini dapat bermanfaat dalam bentuk yang nyata
sehingga tujuan pemanfaatan dari hasil penelitian ini dapat diperoleh.
Bogor, April 2007
DAFTAR ISI
Halaman
DAFTAR TABEL ... iii
DAFTAR GAMBAR ... iv
DAFTAR LAMPIRAN ... v
PENDAHULUAN ... 1
Latar Belakang ... 1
Perumusan Masalah ... 2
Tujuan dan Manfaat ... 3
Perumusan Hipotesa ... 3
TINJAUAN PUSTAKA ... 4
Perkembangan Larva Udang Vaname (Litopenaeus vannamei) ... 4
Jenis Stadia dan Lama Waktu Perkembangan Stadia ... 4
Tingkat Kelangsungan Hidup dan Masa Kritis Perkembangan Larva ... 5
Pemanfaatan Pakan Alami ... 6
Rotifer... ... 6
Artemia... ... 7
Faktor Penentu Perkembangan Larva Vaname ... 7
Lemak dan Asam Lemak Esensial ... 7
Kualitas Air... 9
BAHAN DAN METODE ... 10
Waktu dan Tempat Penelitian ... 10
Materi Penelitian... 10
Hewan Uji... ... 10
Pakan... ... 10
Wadah dan Media... ... 10
ii
Pengkayaan Rotifer dan Naupli Artemia... 12
Pengkayaan Rotifer ... 12
Pengkayaan Naupli Artemia ... 12
Pemeliharaan Induk ... 13
Penetasan Telur dan Pemanenan Naupli Vaname ... 13
Sampel Asam Lemak... 14
Rancangan Penelitian dan Analisa Data... 14
Rancangan Penelitian ... 14
Analisa Data... ... 15
Penelitian Tahap Pertama... 15
Penelitian Tahap Kedua... ... 15
Metode Pengukuran dan Pengamatan Peubah... 17
HASIL DAN PEMBAHASAN... ... 18
Hasil... 18
Penelitian Tahap Pertama... 18
Tingkat Kelangsungan Hidup Larva Stadia Z2-PL1... 18
Intermolt Period... ... 19
Komposisi Asam Lemak Rotifer dan Larva Vaname... .. 20
Penelitian Tahap Kedua... . 22
Tingkat Kelangsungan Hidup Larva Stadia PL1-PL10... 22
Komposisi Asam Lemak Artemia dan Larva Vaname... 23
Pembahasan... ... 24
SIMPULAN DAN SARAN... .. 29
Simpulan... 29
Saran... ... 29
DAFTAR PUSTAKA ... 30
iii
DAFTAR TABEL
Halaman
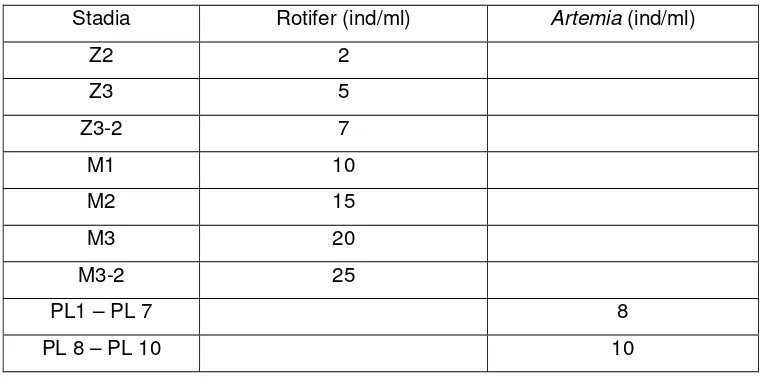
Tabel 1. Jumlah rotifer dan Artemia yang diberikan (ind/ml)... ... 16
Tabel 2. Intermolt period (hari) larva udang vaname setiap stadia (Z2-PL1)... 19
Tabel 3. Komposisi asam lemak pada rotifer dan larva udang vaname... 21
iv
v
DAFTAR LAMPIRAN
Halaman
1. Hasil pengamatan kualitas air... 36
2. Gambar kegiatan selama penelitian... 40
3. Schedul pakan larva udang vaname.. ... 41
4. Tingkat kelangsungan hidup larva udang vaname Z2-PL1... 42
5. Intermolt period larva udang vaname... ... 43
6. Kandungan asam lemak rotifer, Artemia dan larva vaname... 44
7. Tingkat kelangsungan hidup larva udang vaname PL1-PL10... 45
8. Prosedur pengukuran kadar lemak... 46
9. Prosedur pengukuran kadar asam lemak... 47
10. Analisa statistik kelangsungan hidup larva udang vaname Z2-PL1... . 48
11. Analisa statistik intermolt period larva udang vaname Z2-PL1... 51
Latar Belakang
Udang vaname (Litopenaeus vannamei) dewasa ini merupakan salah
satu komoditas andalan dalam sektor perikanan. Udang vaname di Indonesia
mulai berkembang sejak tahun 2001 dan semakin meningkat dalam beberapa
tahun terakhir ini karena teknis budidayanya yang lebih mudah dibandingkan
dengan udang windu, ketersediaan benur SPF (Specific Pathogen Free) dan
produktivitas yang tinggi. Hatchery sebagai salah satu penghasil benih udang
telah berkembang dengan baik. Untuk memenuhi kebutuhan benih, hatchery
harus mampu meningkatkan tingkat kelangsungan hidup udang sehingga
ketersediaan benih ukuran PL cukup banyak. Tersedianya benih yang cukup
dalam jumlah maupun kualitas merupakan faktor utama yang menentukan
keberhasilan budidaya udang. Benih yang berkualitas baik akan memberikan
pertumbuhan yang baik dan tingkat kelangsungan hidup yang tinggi .
Perkembangan hatchery udang yang semakin meningkat dengan padat
pemeliharaan larva yang tinggi, menjadikan kualitas pakan sebagai faktor yang
sangat penting karena udang mendapatkan nutrien dari pakan tersebut.
Meskipun berbagai macam kendala seperti faktor lingkungan, penyakit dan
nutrisi, tetapi produksinya yang bernilai tinggi terus naik setiap tahun (Shiau
1998). Salah satu masalah penting dalam budidaya udang vaname adalah
kurangnya informasi tentang kebutuhan nutrien udang terutama selama stadia
larva (Navvaro et al. 1996). Produktivitas dari upaya pembenihan harus tinggi,
dengan kondisi postlarva yang sehat dan tahan terhadap stress. Tingkat
produktivitas tersebut ditentukan oleh mutu induk, kualitas lingkungan dan pakan.
Kualitas lingkungan harus diupayakan layak, khususnya pengaturan salinitas
agar tetap isoosmotik bagi kehidupan larva dan postlarva. Induk dan kualitas
lingkungan telah dapat diupayakan layak dan potensial untuk menghasilkan larva,
sedangkan pakan bagi larva dan awal postlarva masih menjadi kendala.
Berbagai upaya untuk memperbaiki kualitas pakan telah dilakukan, antara lain
dengan pemberian pakan alami seperti Chaetoceros, Skeletonema, Artemia dan
rotifer (Brachionus rotundiformis).
Pada saat pertama kali larva makan perlu diperhatikan jenis dan ukuran
partikel pakan yang dapat dicerna. Tersedianya pakan yang sesuai dengan
2
yang baru menetas dengan sedikit atau tidak adanya cadangan kuning telur.
Pakan yang tersedia untuk larva harus memenuhi tiga kriteria, yaitu ukuran yang
sesuai sehingga memudahkan untuk menangkap dan mengkonsumsi, harus
selalu tersedia dalam jumlah yang mencukupi, dan mengandung nutrien pakan
yang esensial (Suprayudi et al. 2002b). Asam lemak merupakan salah satu
komponen penting dalam pakan yang mempengaruhi pertumbuhan dan
kelangsungan hidup larva udang.
Brachionus rotundiformis dan Artemia merupakan pakan alami yang
cocok diberikan pada pemeliharaan larva udang, karena selain memiliki ukuran
tubuh yang kecil juga memiliki nilai nutrisi yang cukup baik. Namun dari beberapa
hasil penelitian menunjukkan bahwa kandungan asam lemak n-3 HUFA,
terutama asam-asam lemak 20:5n-3 (EPA, eicosapentaenoic acid) dan 22:6n-3
(DHA, decosahexaenoic acid) dari rotifer dan Artemia sangat rendah (Sargent et
al. 1997, 1999; Han et al 2000; Sorgeloos et al. 2001 Suprayudi et al. 2002a).
Padahal EPA dan DHA merupakan asam lemak tidak jenuh berantai panjang
yang berperan penting dalam menunjang tingkat kelangsungan hidup dan
pertumbuhan larva krustasea (D’Abramo & Sheen 1993; Kanazawa 1997). Hasil
dari penelitian sebelumnya menyebutkan bahwa Artemia tidak dapat secara
efektif memperpanjang EPA menjadi DHA (Watanabe et al. 1978) dan rotifer
tampaknya juga mempunyai kemampuan terbatas untuk memperpanjang EPA
(Whyte & Nagata 1990).
Oleh karena itu, untuk mengatasi masa kritis yang terjadi pada perubahan
fase zoea dan mysis diperlukan perbaikan kualitas nutrien pada rotifer dan
Artemia dengan cara meningkatkan kandungan asam lemak esensialnya melalui
pengkayaan dengan DHA sehingga mampu meningkatkan tingkat kelangsungan
hidup dan mempercepat intermolt period.
Perumusan Masalah
Kendala yang dihadapi dalam budidaya udang vaname adalah
produktivitas yang masih rendah dan belum sesuai dengan harapan.
Produktivitas yang rendah tersebut berkenaan dengan kematian yang cukup
tinggi pada saat stadia zoea menjadi mysis. Lama waktu perkembangan proses
metamorfosis antara zoea menjadi mysis dan mysis menjadi postlarva terlalu
lama yang akhirnya diikuti oleh kematian. Tingkat kelangsungan hidup udang
Produksi benur udang vaname rendah karena terjadi hambatan pada
proses metamorfosis sehubungan dengan pasokan asam lemak tak jenuh yang
tidak memadai. Kecepatan proses metamorfosis pada kondisi isoosmotik tidak
diimbangi oleh ketersediaan pasokan pakan yang mengandung energi atau
asam lemak tak jenuh yang memadai untuk mengimbangi kecepatan proses
metamorfosis. Untuk mengatasi masalah tersebut perlu diupayakan pasokan
pakan yang mengandung asam lemak tak jenuh pada saat stadia zoea
menjelang mysis dan pada saat mysis menjadi post larva. Untuk kebutuhan
tersebut kiranya rotifer dan naupli Artemia dapat memenuhi syarat untuk
diperkaya dengan asam lemak tak jenuh sehingga potensial menunjang proses
metamorfosis menjadi postlarva.
Dengan pendekatan di atas maka diperoleh kerangka konseptual yang
jelas dan mendasar bagaimana rotifer dan Artemia yang diperkaya dengan DHA
mempengaruhi kecepatan intermolt period dan tingkat kelangsungan hidup larva
udang vaname.
Tujuan dan Manfaat
Penelitian ini bertujuan untuk mengetahui pengaruh rotifer (B.
rotundiformis) dan naupli Artemia yang telah diperkaya dengan DHA 70G
terhadap tingkat kelangsungan hidup dan intermolt period larva udang vaname
(Litopenaeus vannamei).
Manfaat dari percobaan ini adalah dapat memberikan informasi yang
dapat diaplikasikan di hatchery mengenai kadar DHA 70G yang harus diberikan
melalui teknik pengkayaan kepada rotifer (B. rotundiformis) dan naupli Artemia
untuk diberikan pada larva vaname sehingga dapat meningkatkan tingkat
kelangsungan hidup dan mempercepat intermolt period larva udang vaname
(Litopenaeus vannamei).
Perumusan Hipotesis
Apabila rotifer (B. rotundiformis) dan naupli Artemia dapat diperkaya
dengan DHA 70G sebagai sumber pasokan nutrien larva maka lama waktu
metamorfosis dan atau molting dapat dipercepat sehingga tingkat kelangsungan
TINJAUAN PUSTAKA
Perkembangan Larva Udang Vaname
Jenis Stadia dan Lama Waktu Perkembangan Stadia
Setelah fertilisasi, telur menetas sekitar 14-16 jam dan udang vaname mengalami tiga stadia perkembangan larva sebelum menjadi post larva, yaitu naupli, zoea dan mysis. Masing-masing stadia dalam perkembangannya mengalami metamorfosis. Dalam perkembangan dari stadia ke stadia lainnya diikuti pula dengan perubahan pola makannya. Setelah 30 menit menetas, naupli dapat berenang dalam jarak yang pendek dan bersifat fototaksis positif. Naupli yang baru menetas mengandalkan kuning telur untuk mensuplai semua kebutuhan nutrisinya. Naupli mengalami perubahan sebanyak lima kali, dan setiap perubahan terjadi dalam waktu 7 jam. Setelah perubahan tersebut cadangan kuning telurnya habis dan naupli mengalami metamorfosis menjadi zoea, diikuti dengan pola makannya yang mulai memakan mikroalge, seperti
Chaetoceros dan Skeletonema. Menurut Sweeney & Wyban (1991) stadia zoea 1 (Z1) dan zoea 2 (Z2) masing-masing akan berkembang dalam selang waktu 2 hari, sedangkan zoea 3 (Z3) akan berkembang menjadi mysis 1 (M1) dalam waktu 1 hari. Setelah tiga kali berubah, zoea mengalami metamorfosis menjadi mysis, dan terjadi perubahan pola makan dari herbivora menjadi karnivora, atau mulai memakan zooplankton, seperti rotifer dan naupli Artemia (Elovaara 2001). Setelah mengalami perubahan tiga kali mysis yang bersifat plankonik berubah menjadi postlarva. Postlarva sudah terlihat seperti udang dewasa, dan sudah bersifat bentik .
Kecepatan molting pada stadia zoea dipengaruhi oleh kondisi kultur. Di bawah kondisi kultur yang optimum, zoea berubah melalui 3 substadia (Z1-Z3) selama 5 hari (36 jam setiap stadia). Pada stadia Z1 mata tidak kelihatan, namun pada akhir stadia ini sudah terlihat. Tubuhnya ramping dan tidak dilindungi oleh karapas, telsonnya sudah berkembang dengan baik dan kelihatan seperti ekor yang bercabang.
perubahan menjadi Z3 dalam waktu 30-40 jam, ditandai dengan berkembangnya uropod pada ujung posterior. Setelah stadia Z3 lengkap, larva berubah menjadi mysis. Bentuk tubuhnya secara umum hampir sama dengan udang dewasa. Di bawah kondisi yang optimum, tiga substadia mysis dicapai dalam waktu 3 hari (24 jam per stadia). Zoea cenderung berenang dipermukaan air, tetapi mysis mulai berenang di bagian kolom air. Mysis berada dalam kolom air dengan posisi kepala dibawah dan ekor ke arah atas ke permukaan air.
Tingkat Kelangsungan Hidup dan Masa Kritis Perkembangan Larva
Pertumbuhan dan tingkat kelangsungan hidup merupakan indikator keberhasilan pemeliharaan larva (Bransden MP et al. 2005). Oleh karena itu dalam pemeliharaan larva dan post larva udang perlu ditunjang oleh kualitas larva yang baik. Persentase tingkat kelangsungan hidup yang mencapai stadia zoea, atau keberhasilan bermetamorphosis dari naupli menjadi zoea merupakan salah satu kriteria kualitas larva udang vaname. Morfologi larva, seperti panjang naupli, zoea dan mysis tidak berhubungan dengan tingkat kelangsungan hidup larva udang vaname (Racotta et al. 2004).
Stadia zoea dan mysis adalah fase pertumbuhan cepat, dan merupakan waktu yang sangat kritis karena pada saat itu larva udang sangat rentan dan sering terjadi tingkat kematian yang tinggi. Dengan pola pemeliharaan secara tradisional di bak outdoor menggunakan teknik yang sederhana, air yang tidak diberi perlakuan, kepadatan tebar yang rendah dan bak pemeliharaan yang kecil diperoleh tingkat kelangsungan hidup larva vaname sekitar 50%, sedangkan metode pemeliharaan yang intensif dengan padat tebar tinggi dengan kondisi lingkungan pemeliharaan yang terkontrol dapat mencapai tingkat kelangsungan hidup 70-80% (Elovaara 2001).
6
Pemanfaatan Pakan Alami
Rotifer
Sampai saat ini pakan alami masih merupakan pakan utama untuk larva ikan laut dan krustasea yang belum dapat digantikan kualitas nutriennya secara lengkap oleh pakan buatan (Sorgeloos et al. 2001; Suprayudi et al. 2004). Rotifer telah lama dan secara luas digunakan sebagai pakan alami untuk larva ikan laut dan krustasea yang baru menetas karena ukurannya sesuai dengan bukaan mulut larva, teknologi produksi massalnya sudah dikuasai dan terus dikembangkan (Sorgeloos 1998), memiliki kecepatan renang rendah, hidup melayang dalam air sehingga mudah ditangkap oleh larva (Waynarovich & Horvath 1980), serta dapat dilakukan pengkayaan dengan asam lemak tak jenuh rantai panjang sehingga zat-zat tersebut mudah ditransfer ke dalam tubuh larva (Sargent et al. 1989; Dhert et al. 2001)
Rotifer merupakan zooplankton yang dapat dimanfaatkan sebagai pakan alami udang vaname dan telah lama dikembangkan. Salah satu rotifer laut yang telah dikembangkan dewasa ini adalah Brachionus rotundiformis yang biasa disebut sebagai rotifer tipe-S, yang memiliki panjang lorika 100-210 μm (rerata 160 μm) (Sorgeloos 1996). Watanabe (1998) menyatakan bahwa rotifer merupakan pakan alami yang paling cocok bagi larva ikan laut yang baru menetas karena kebutuhan akan protein sebesar 40-60% dan lemak sebesar 13-16% dapat dipenuhi.
al. 2001). Suprayudi (2003) menyatakan bahwa asam lemak esensial dari rotifer ditentukan oleh jenis bahan pengkaya, lama waktu pengkayaan dan macam zat pengkaya. Hasil percobaan Fernandez-Reiriz et al. (1993) membuktikan bahwa kandungan gizi rotifer dapat ditingkatkan dengan memperkaya asam lemak n-3 melalui teknik pengkayaan.
Artemia
Artemia biasa digunakan sebagai pakan alami untuk larva ikan laut dan krustasea, tetapi naupli Artemia mengandung n-3 HUFA, terutama EPA dan DHA yang sangat rendah (Han et al. 2000; Suprayudi et al. 2002). Dengan keuntungan dari karakteristik cara makan naupli Artemia, dimungkinkan untuk meningkatkan nilai nutriennya yang kekurangan n-3 HUFA. Ketika berubah menjadi stadia instar 2 (8 jam setelah menetas), naupli Artemia merupakan zooplankton yang “non selektif particle feeders”, sehingga dikembangkan metoda yang sederhana untuk memasukkan berbagai macam nutrisi tambahan ke dalam
Artemia sebelum diberikan sebagai pakan pada larva. Metode ini disebut bioenkapsulasi, atau dinamakan juga pengkayaan Artemia, yang secara luas digunakan pada hatchery ikan laut dan krustasea untuk meningkatkan nilai nutrien Artemia dengan asam lemak esensial. Tidak sama dengan pakan alami lainnya seperti rotifer, pengkayaan Artemia dengan DHA lebih sulit karena sifat katabolisme dari asam lemak ini pada pengkayaan sehingga menghasilkan rasio DHA/EPA rendah(Sorgeloos et al. 2001).
Tingkat keberhasilan dalam memodifikasi profil asam lemak pada Artemia
dipengaruhi oleh tipe dari bahan pengkaya, kondisi pengkayaan dan jenis
Artemia yang diberikan (Han et al. 2000). Pada akhir stadia mysis, larva udang vaname mulai bersifat sebagai karnivora sehingga sudah dapat diberikan makanan berupa naupli Artemia. Beberapa penelitian memperlihatkan adanya peningkatan kandungan asam lemak n-3 HUFA naupli Artemia setelah dilakukan pengkayaan (Rees et al. 1994; Karim 1998; Robin JH 1998).
Faktor Penentu Perkembangan Larva Vaname
Lemak dan Asam Lemak Essensial
8
fosfolipid. Komponen penyusun fosfolipid adalah asam lemak. Ada dua asam lemak yang menyusun lemak yaitu asam lemak non esensial yang dapat disintesis oleh tubuh dan asam lemak esensial yang harus diperoleh dari luar tubuh (Jobling 2002).
Asam lemak esensial, terutama kelompok HUFA (highly unsaturated fatty acids) dan PUFA (poly unsaturated fatty acids) mempunyai peranan yang penting untuk kegiatan metabolisme tubuh organisme, komponen membran (fosfolipid dan kolesterol), hormon (metabolisme steroid dan vitamin D), aktivasi enzim-enzim tertentu, precursor dari prostanoids dan leukosit, memelihara struktur dan fungsi membran sel serta precursor eicosanoid (Bhagavan 1982; Sargent et al. 1989; Ibeas et al. 1994). Asam lemak yang essensial bagi krustasea yaitu 18:2n-6 (linoleat), 18:3n-3 (linolenat), 20:5n-3 (eicosapentaenoat, EPA) dan 20:6n-3 (docosahexanoat, DHA) (D’Abramo 1997). EPA dan DHA memegang peranan penting dalam mendukung pertumbuhan dan kelangsungan hidup krustasea (D’Abramo & Sheen 1993; Suprayudi et al. 2004).
HUFA seperti EPA, DHA dan arachidonic acid termasuk asam lemak esensial dan merupakan nutrisi penting karena terbatasnya kemampuan udang vaname untuk mengelongasi dan mendesaturasi rantai pendek PUFA menjadi HUFA sehingga pemenuhan kebutuhannya harus terdapat dalam pakannya (Gonzales-Felix et al. 2002).
Beberapa penelitian menunjukkan bahwa dengan penambahan asam lemak esensial n-3 yang diberikan dengan teknik pengkayaan pada rotifer dan
Artemia telah meningkatkan tingkat kelangsungan hidup, pertumbuhan, daya tahan tubuh dan mempercepat perkembangan beberapa jenis larva krustasea dan ikan laut (Kanazawa 1997; Gapasin & Duray 2001; Suprayudi et al. 2002a).
Kualitas Air
Berhasil tidaknya suatu usaha budidaya udang vaname antara lain ditentukan oleh kemampuan mengendalikan faktor-faktor lingkungan. Agar udang vaname yang dibudidayakan dapat hidup dan tumbuh dengan baik, maka selain harus tersedia pakan bergizi dalam jumlah yang cukup, kondisi lingkungan juga berada pada kisaran yang layak.
Salinitas merupakan masking faktor, yaitu faktor lingkungan yang merubah atau menghambat bekerjanya faktor lain. Salinitas sangat besar pengaruhnya terhadap proses metabolisme dan kelangsungan hidup udang. Bilamana terjadi perubahan salinitas maka kelangsungan hidupnya ditentukan oleh kemampuan adaptasi. Tingkat salinitas yang terlalu tinggi, atau rendah dan fluktuasinya lebar dapat menyebabkan kematian pada larva udang. Untuk stadia larva salinitas yang layak adalah 26-36 ppt (Sweeney & Wyban 1991; Elovaara 2001).
Suhu air mempengaruhi laju metabolisme dan pengeluaran energi udang. Di samping itu suhu juga akan mempengaruhi kelarutan gas-gas dalam air. Meskipun udang vaname mampu mentoleransi suhu pada kisaran tertentu, tetapi untuk dapat tumbuh dengan baik pada stadia larva diperlukan suhu sekitar 27-29ºC (Sweeney & Wyban 1991; Elovaara 2001).
Nilai pH air dapat berpengaruh terhadap meningkat tidaknya daya racun ammonia, di mana semakin meningkat pH pada kadar tertentu akan menyebabkan daya racun ammonia akan semakin meningkat. Untuk stadia larva pH yang layak untuk udang vaname berkisar antara 7.8-8.4, dengan pH optimum 8.0 (Elovaara 2001).
METODE PENELITIAN
Waktu dan Tempat Penelitian
Penelitian ini dilaksanakan pada bulan Mei sampai Juli 2006, di PT
Centralpertiwi Bahari yang berlokasi di Desa Suak, Kecamatan Sidomulyo,
Lampung Selatan. Analisa asam lemak dilakukan di Laboratorium Food
Technology Departement, PT Charoen Pokphan Indonesia.
Materi Penelitian
Hewan Uji
Hewan uji yang digunakan dalam penelitian ini adalah larva udang
vaname (Litopenaeus vannamei) stadia zoea 2 (Z2). Larva tersebut diperoleh
dari hasil penetasan induk di Maturation and Nauplii Production Department PT
Centralpertiwi Bahari.
Pakan
Pakan yang digunakan dalam penelitian ini terdiri dari pakan alami dan
pakan buatan. Pakan alami yang digunakan adalah rotifer (Brachionus
rotundiformis) dan naupli Artemia yang diperkaya dengan DHA 70 G. Rotifer
sebagai pakan uji diperoleh dari hasil kultur di Algae Production Department PT
Centralpertiwi Bahari, sedangkan naupli Artemia berasal dari penetasan kista
merk Mackay dengan hatching rate 90%. Pakan buatan yang digunakan adalah
CP Star 100, 200 dan 300 (protein 38%, lipid 9.5%, serat 4%, dan abu 15%),
Lanzy-Shrimp ZM, MPL dan PL (protein 48%, lipid 13%, serat kasar 2.5% dan
kadar air 8%). Bahan pengkaya rotifer dan Artemia adalah DHA 70G (Nippon
Kagaku Shiryo Co., LTD, Japan; mengandung 70.7% DHA dan 5.2% EPA).
Wadah dan Media
Wadah penelitian yang digunakan adalah toples plastik 1.5 liter yang diisi
dengan air laut sebanyak 1 liter. Air media yang digunakan adalah air laut
bersalinitas 31 ppt dan sebelum digunakan telah melewati proses ozonisasi.
Kemudian air laut tersebut ditampung dalam fiber 500 liiter dan diberi EDTA 5
ppm sebelum digunakan. Untuk mempertahankan suhu media pemeliharaan
bath yang diberi thermostat sehingga suhunya berada pada kisaran 29-31ºC.
Sedangkan untuk mempertahankan kandungan oksigen terlarutnya, setiap
wadah penelitian diberi aerasi dengan menggunakan selang yang dihubungkan
dengan pipet Pasteur. Wadah penelitian diperlihatkan pada Gambar 1.
Gambar 1. Wadah penelitian
Pengamatan kualitas air meliputi suhu, salinitas, pH dan oksigen terlarut.
Suhu diukur dengan thermometer batang dan salinitas diukur dengan hand
refraktrometer Atago Smill yang masing-masing diamati setiap hari. Oksigen
terlarut dan pH dilakukan pengukuran setiap dua hari sekali mengunakan DO
meter YSI 51B dan pH meter WTW 320.
Hasil pengamatan kualitas air selama penelitian suhu 30 ºC, salinitas 31
ppt, pH penelitian pertama 8.15-8.37 dan penelitian kedua 8.25-8.27, oksigen
terlarut pada penelitian pertama 5.40-5.55 mg/l dan penelitian kedua 5.06-5.48
12
Metode Pemeliharaan
Penyediaan Rotifer
Rotifer (Brachionus rotundiformis) diperoleh dari hasil kultur dengan
menggunakan bak bervolume 1 ton (Lampiran 2). Pakan yang digunakan untuk
rotifer adalah phytoplankton jenis Nannochloropsis sp yang sebelumnya dikultur
pada bak berukuran 1 ton (Lampiran 2).
Penetasan Kista Artemia
Untuk memperoleh naupli Artemia , kistanya diinkubasi selama 24 jam di
dalam wadah penetasan yang terbuat dari fiber dengan dasar berbentuk kerucut
berkapasitas 230 liter (Lampiran 2). Media air laut yang digunakan bersalinitas
30-32 ppt, dan kepadatan kista yang ditetaskan adalah 5 gr/lt. Selama proses
penetasan wadah diaerasi kuat. Kista yang menetas dipanen lewat bawah
dengan menyaring dengan planktonet mesh 300.
Pengkayaan Rotifer dan Naupli Artemia
Bahan yang digunakan untuk pengkayaan Brachionus rotundiformis dan
naupli Artemia adalah DHA 70 G (Nippon Kagaku Shiryo Co., LTD, Japan;
mengandung 70,7% DHA dan 5,2% EPA).
Pengkayaan Rotifer
Untuk teknik pengkayaan rotifer adalah dengan memasukkannya ke
dalam ember berkapasitas 10 liter yang diisi air laut dengan kepadatan 1000
ind/ml. Salinitas air laut berkisar 30-32 ppt dan dilakukan aerasi. Bahan
pengkaya dan kuning telur (sesuai dengan dosis perlakuan) dimasukkan ke
dalam air akuadest 200 ml dan diemulsikan selama 2 menit (Suprayudi et al.
2002). Setelah diemulsikan, media pengkaya tersebut dimasukkan ke dalam
wadah pengkayaan yang telah berisi rotifer. Pengkayaan dilakukan selama 6
jam.
Pengkayaan naupli Artemia
Untuk teknik pengkayaan naupli Artemia adalah dengan memasukannya
ke dalam fiber berkapasitas 230 liter yang diisi air laut dengan kepadatan 200000
dilakukan aerasi. Bahan pengkaya dan kuning telur (sesuai dengan dosis
perlakuan) dimasukkan ke dalam akuadest 200 ml dan diemulsikan selama 2
menit (Suprayudi et al. 2002). Setelah diemulsikan, media pengkaya tersebut
dimasukkan ke dalam wadah pengkayaan yang telah berisi naupli Artemia .
Pengkayaan dilakukan selama 12 jam (Karim 1998).
Pemeliharaan Induk
Induk yang digunakan merupakan jenis SPF (Spesific Pathogen Free)
yang berasal dari Hawaii, USA. Bobot induk betina yang digunakan sebesar 50 g
dan bobot induk jantannya sebesar 40 g. Induk udang vaname yang telah
diablasi dipelihara dalam bak beton yang berukuran 3x11x0,9 m yang diisi
dengan air laut sebanyak 24 – 28 ton dengan salinitas 30-32 ppt dan suhu 25ºC.
Pada bak pemeliharaan tersebut dilengkapi sistem sirkulasi dan diberi aerasi.
Selama pemeliharaan, induk udang vaname diberi pakan berupa cacing 6 kali
sehari sebanyak 25% bobot biomas/hari. Untuk menjaga kualitas air setiap hari
dilakukan pergantian air sebanyak 200% dan penyiponan untuk membersihkan
feces dan sisa pakan yang tidak termakan.
Seleksi induk matang telur dilakukan setiap hari selama pemeliharaan,
yang dimulai pada hari ke dua setelah ablasi. Seleksi dilakukan terhadap induk
betina yang telah mencapai tingkat kematangan gonad ke-4 (TKG-4), yang
ditandai dengan penuhnya ovary di daerah punggung, setelah itu induk
dipindahkan ke bak spawning bervolume 2,5 ton.
Penetasan Telur dan Pemanenan Naupli Vaname
Pelepasan telur biasanya terjadi 24 jam setelah induk dipindahkan ke bak
spawning. Selama proses penetasan telur dilakukan pengadukan telur untuk
mencegah terjadinya pengendapan di dasar bak. Induk yang telah mengeluarkan
telur kemudian dipindahkan lagi ke bak pemeliharaan. Penetasan telur biasanya
terjadi 12-18 jam setelah induk spent, dan dilakukan di bak spawning.
Naupli yang telah mencapai instar 5 kemudian dipanen dan harus
memenuhi kriteria bebas dari SEMBV, IHHNV, TSV, luminescent bakteri dan
jamur serta memiliki hatching rate > 30% . Pemanenan naupli dilakukan dengan
mematikan aerasi di bak spawning dan menghidupkan lampu pijar agar naupli
cepat naik ke permukaan dan siap dipanen dengan menggunakan seser halus
14
Sampel Asam Lemak
Untuk mengetahui kadar asam lemak n-3 yang ada pada rotifer, Artemia
dan larva udang vaname dilakukan dengan memelihara larva udang vaname di
wadah yang terpisah. Wadah yang digunakan adalah fiber berbentuk bulat
dengan volume 500 liter sebanyak 5 buah untuk penelitian tahap pertama dan 4
buah untuk penelitian tahap kedua. Wadah tersebut diisi air laut sebanyak 450
liter dan diisi dengan larva udang vaname dengan kepadatan 100 ind/l serta
diaerasi dan diberi thermostat. Setiap hari larva udang vaname diberi pakan
sesuai dengan perlakuan yang telah ditentukan. Setiap pengambilan sampel
diambil sebanyak 2 g dengan saringan kemudian dimasukkan dalam plastik
kedap udara dan disimpan di dalam freezer.
Rancangan Penelitian dan Analisa Data
Rancangan Penelitian
Penelitian dilakukan dengan menggunakan rancangan acak lengkap
(RAL) yang dilakukan dalam dua tahap dan masing-masing perlakuan dalam
kedua tahap tersebut terdiri dari 3 ulangan. Penelitian pertama adalah
pengkayaan dengan DHA 70G terhadap rotifer yang akan diberikan pada larva
udang vaname stadia Z2 sampai PL1. Perlakuan pada penelitian tahap pertama
ini adalah :
A. Pakan buatan tanpa pemberian rotifer
B. Rotifer+minyak kelapa 100 µL/L+pakan buatan
C. Rotifer+DHA 70G 25 µL/L+minyak kelapa 75 µL/L+pakan buatan
D. Rotifer+DHA 70G 50 µL/L+minyak kelapa 50 µL/L+pakan buatan
E. Rotifer+DHA 70G 75 µL/L+minyak kelapa 25 µL/L+pakan buatan
Pada tahap kedua adalah pengkayaan dengan DHA 70G terhadap
Artemia yang akan diberikan pada larva udang vaname stadia PL1 sampai PL10.
Perlakuan pada penelitian tahap kedua ini adalah :
A. Artemia+minyak kelapa 100 µL/L+pakan buatan
B. Artemia+DHA 70G 25 µL/L+minyak kelapa 75 µL/L+pakan buatan
C. Artemia+DHA 70G 50 µL/L+minyak kelapa 50 µL/L+pakan buatan
Analisis Data
Untuk mengetahui pengaruh rotifer dan Artemia yang telah diperkaya
dengan asam lemak terhadap tingkat kelangsungan hidup dan intermolt period,
data diplotkan dalam suatu tabel dan dilakukan analisis sidik ragam antar
perlakuan. Apabila hasil analisa sidik ragam menunjukkan perbedaan nyata
kemudian dilanjutkan dengan uji Duncan (Program SPSS 13.0 for Windows).
Untuk data kandungan asam lemak dan kualitas air akan ditampilkan dalam
bentuk tabel dan diinterprestasikan secara deskriptif.
Pelaksanaan Penelitian Penelitian Tahap Pertama
Setelah mendapatkan naupli dari induk udang vaname yang telah
dipijahkan, larva dipelihara pada tank 500 liter untuk dipelihara sampai dengan
stadia Z2. Setelah berubah menjadi stadia Z2, larva udang vaname dipindahkan
pada wadah penelitian. Sebelum memasukkan hewan uji dalam wadah
penelitian, wadah tersebut terlebih dahulu ditempatkan secara acak pada system
water bath dan diisi dengan air laut sebanyak 1 liter dan diberi aerasi. Kemudian
larva udang vaname dimasukkan dalam wadah penelitian dengan kepadatan 100
ind/l, kemudian diberikan pakan sesuai dengan perlakuan yang diberikan. Jumlah
rotifer yang diberikan ditunjukkan pada Tabel 1. Larva tersebut dipelihara sampai
dengan stadia PL1. Penelitian tahap pertama ini untuk melihat respon terhadap
tingkat kelangsungan hidup yang paling bagus dari 7 perlakuan tersebut.
Penelitian Tahap Kedua
Setelah mendapatkan naupli dari induk udang vaname yang telah
dipijahkan, larva dipelihara pada tank 500 liter untuk dipelihara sampai dengan
stadia mysis 3. Selama pemeliharaan larva udang vaname diberi pakan sesuai
hasil penelitian pertama yang memberikan respon terbaik untuk tingkat
kelangsungan hidup. Setelah berubah menjadi PL1, larva udang vaname
dipindahkan pada wadah penelitian. Sebelum memasukkan hewan uji dalam
wadah penelitian, wadah tersebut terlebih dahulu ditempatkan secara acak pada
system water bath dan diisi dengan air laut sebanyak 1 liter dan diberi aerasi.
Kemudian larva udang vaname dimasukkan dalam wadah penelitian dengan
16
diberikan. Jumlah naupli Artemia yang diberikan ditunjukkan pada Tabel 1. Larva
tersebut dipelihara sampai dengan stadia PL 10.
Pakan buatan ditimbang menggunakan timbangan analitik dengan skala
terkecil 0,0001 gr. Jumlah pakan buatan yang diberikan pada kedua tahap
percobaan seperti ditunjukkan pada Lampiran 3. Frekuensi pemberian pakan
dilakukan 5 kali sehari, 2 kali untuk pakan alami dan 3 kali untuk pakan buatan.
Pemberiannya dilakukan pada jam 04.00, 11.00, 15.00, 19.00 dan jam 23.00. Untuk
membuang pakan yang tersisa dan mempertahankan kualitas air dilakukan
pergantian air pada pagi hari. Pengamatan stadia larva dilakukan pagi hari, jika
ditemukan stadia yang berbeda pada wadah perlakuan yang sama, maka larva
tersebut dipisahkan pada wadah yang berbeda. Kualitas air yang diamati adalah
suhu air dan salinitas yang diamati setiap hari serta pH dan kandungan oksigen
terlarut yang diamati setiap dua hari sekali. Pengamatan kualitas air tersebut
dilakukan pada pagi hari.
Disamping penelitian dalam wadah 1 liter, juga dilakukan pemeliharaan
larva udang vaname pada wadah 500 liter dengan perlakuan yang sama dengan
wadah 1 liter untuk mengambilan sampel pada pengamatan kandungan asam
lemak larva udang vaname tersebut.
Tabel 1. Jumlah rotifer dan Artemia (ind/ml) yang diberikan
Stadia Rotifer (ind/ml) Artemia (ind/ml)
Z2 2
Z3 5
Z3-2 7
M1 10
M2 15
M3 20
M3-2 25
PL1 – PL 7 8
Metode Pengukuran dan Pengamatan Peubah
Tingkat Kelangsungan Hidup
Tingkat kelangsungan hidup larva udang vaname selama pemeliharaan
dihitung dengan menggunakan rumus :
SR = Nt/No x 100%
Keterangan :
SR = Tingkat kelangsungan hidup larva udang vaname (%)
Nt = Jumlah larva udang vaname yang hidup sampai akhir penelitian
No = Jumlah larva udang vaname pada awal penelitian
Intermolt Period
Intermolt periode larva udang vaname dihitung dengan menggunakan
rumus (Suprayudi et al. 2004), yaitu:
;
Keterangan :
Dt = Development time atau intermolt period (hari) N = jumlah larva dengan stadia pada waktu tertentu t = waktu
Analisis Kimia
Analisis asam lemak dilakukan pada rotifer, Artemia dan larva udang
vaname stadia zoea 3, mysis 2, PL1, PL5 dan PL10. Asam lemak yang diamati
meliputi eicosapentaenoic acid (EPA), docosahexaenoic acid (DHA), arachidonic
acid (AA), linoleic acid (LA) dan linolenic acid (LNA). Metode analisa asam lemak
tersebut dijelaskan lebih rinci pada Lampiran 4 dan 5.
HASIL DAN PEMBAHASAN
HASIL
Penelitian Tahap Pertama
Tingkat Kelangsungan Hidup Larva Stadia Z2-PL1
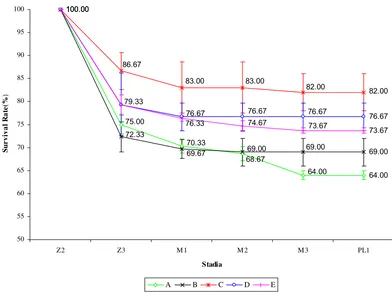
Tingkat kelangsungan hidup larva udang vaname yang diperoleh berdasarkan hasil penelitian ini diperlihatkan pada Lampiran 4 dan Gambar 2.
100.00
Gambar 2. Tingkat kelangsungan hidup (%) larva udang vaname stadia Z2-PL1
cenderung merata hingga stadia PL1. Pemberian rotifera yang diperkaya dengan DHA 70G memberikan tingkat kelangsungan hidup yang lebih tinggi dibandingkan dengan yang tidak diperkaya atau yang tidak diberi rotifera. Pada setiap stadia, perlakuan C (Z3: 86.67±4.04%, M1: 83.00±5.57%, M2: 83.00±5.57%, M3: 82.00±4.00%) menghasilkan tingkat kelangsungan hidup paling tinggi dibandingkan perlakuan A B, D dan E. Sedangkan tingkat kelangsungan hidup terendah pada setiap stadia diperoleh pada perlakuan A (Z3: 75.00±2.00%, M1: 70.33±1.53%, M2: 68.67±1.53%, M3: 64.00±1.00). Pada stadia PL1 tingkat kelangsungan hidup yang paling tinggi diperoleh perlakuan C dengan nilai 82.00±4.00% yang berbeda (p<0.05) dibandingkan perlakuan A (64.00±1.00%), B (69.00±3.00%), D (76.67±3.06%) dan E (73.67±0.58%)
Intermolt Period
Intermolt period larva udang vaname pada setiap stadia selama penelitian tahap pertama ditunjukkan pada Tabel 2 dan Lampiran 5.
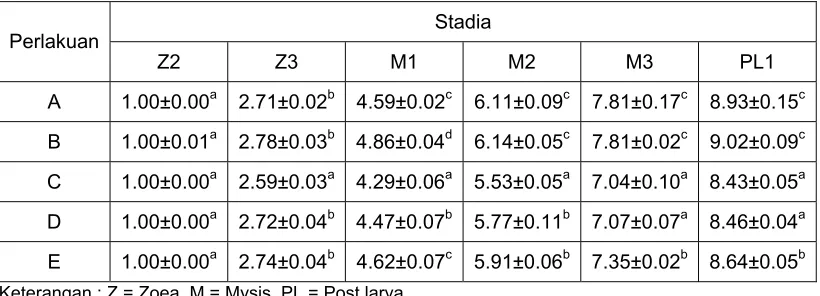
Tabel 2. Intermolt period (hari) larva udang vaname setiap stadia (Z2-PL1)
Stadia Perlakuan
Z2 Z3 M1 M2 M3 PL1 A 1.00±0.00a 2.71±0.02b 4.59±0.02c 6.11±0.09c 7.81±0.17c 8.93±0.15c B 1.00±0.01a 2.78±0.03b 4.86±0.04d 6.14±0.05c 7.81±0.02c 9.02±0.09c C 1.00±0.00a 2.59±0.03a 4.29±0.06a 5.53±0.05a 7.04±0.10a 8.43±0.05a D 1.00±0.00a 2.72±0.04b 4.47±0.07b 5.77±0.11b 7.07±0.07a 8.46±0.04a E 1.00±0.00a 2.74±0.04b 4.62±0.07c 5.91±0.06b 7.35±0.02b 8.64±0.05b
Keterangan : Z = Zoea, M = Mysis, PL = Post larva
Huruf yang sama dalam satu kolom tidak berbeda nyata (P<0.05)
20
Pada setiap stadia, perlakuan B menghasilkan intermolt period yang lebih lama. Stadia Z3 diperlakuan B mempunyai intermolt period yang lebih lama (p<0.05) dibandingkan dengan perlakuan C, tetapi tidak berbeda (p>0.05) dengan perlakuan A, D dan E, sedangkan pada stadia M1 berbeda (p<0.05) dengan semua perlakuan yang diberikan. Pada stadia M2, M3 dan PL1, perlakuan B juga mempunyai intermolt period yang lebih lama, tetapi tidak berbeda (p>0.05) dengan perlakuan A. Intermolt period untuk mencapai stadia M3 dan PL1 pada perlakuan C (7.04±0.10 dan 8.43±0.05) lebih cepat (p<0.05) bila dibandingkan dengan perlakuan A (7.81±0.17 dan 8.93±0.15), B (7.81±0.02 dan 9.02±0.09) serta E (7.35±0.02 dan 8.64±0.05), tetapi tidak berbeda (p>0.05) dengan perlakuan D (7.07±0.07 dan 8.46±0.04).
Komposisi Asam Lemak Rotifer dan Larva Vaname
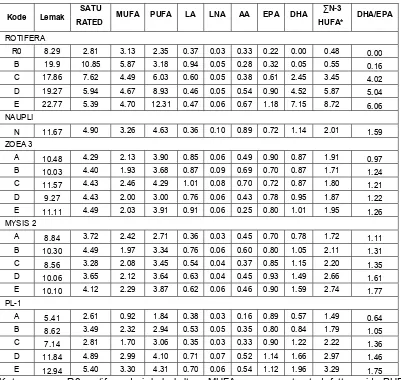
Komposisi asam lemak yang diperkaya oleh DHA 70G pada rotifer (Brachionus rotundiformis) dan larva udang vaname stadia naupli, zoea, mysis dan PL1 ditunjukkan pada Tabel 3 dan Lampiran 6.
Kandungan lemak pada rotifer berkisar antara 8.29-22.77%. Rotifer yang diperkaya dengan minyak kelapa mengandung EPA 0.32% dan sejumlah kecil DHA (0.05%). Pada rotifer yang diperkaya dengan DHA 70G, konsentrasi DHA dan n-3 HUFA pada rotifer tersebut meningkat sesuai dengan peningkatan dosis DHA yang diberikan. Konsentrasi EPA pada rotifer yang diperkaya dengan DHA 70G juga meningkat. Hal ini terjadi karena konversi DHA menjadi asam lemak lainnya atau penggunaannya sebagai sumber energi. Konsentrasi EPA, DHA dan n-3 HUFA pada semua perlakuan masing-masing berkisar antara 0.22-1.18%, 0-7.15% dan 0.48-8.72%.
HUFA pada perlakuan A mengalami penurunan sampai stadia PL1, sedangkan pada perlakuan B meningkat kembali pada stadia M2 kemudian menurun pada stadia PL1. Pada perlakuan pemberian rotifer yang diperkaya dengan DHA 70G, konsentrasi n-3 HUFA meningkat sampai stadia PL1.
Tabel 3. Komposisi asam lemak pada rotifer dan larva vaname (% berat kering).
Kode Lemak
22
Penelitian Tahap Kedua
Tingkat Kelangsungan Hidup Larva Stadia PL1-PL10
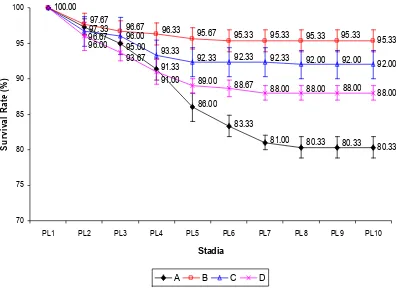
Tingkat kelangsungan hidup larva udang vannamei pada stadia PL-1 sampai PL-10 ditunjukkan pada Gambar 3 dan Lampiran 7. Data tersebut menunjukkan bahwa pada perlakuan A terjadi penurunan tingkat kelangsungan hidup dari PL1 sampai PL8, sedangkan pada perlakuan B, C dan D mengalami penurunan tingkat kelangsungan hidup dari stadia PL1 sampai PL5 dan stabil sampai dengan PL10.
80.33
95.67 95.33 95.33 95.33 95.33
96.67
PL1 PL2 PL3 PL4 PL5 PL6 PL7 PL8 PL9 PL10
Stadia
Gambar 3. Tingkat kelangsungan hidup (%) larva udang vaname stadia PL1-PL 10.
dan D, kecuali pada PL6 yang mana perlakuan B tidak berbeda dengan perlakuan C. Sedangkan tingkat kelangsungan hidup yang paling rendah (p<0.05) pada stadia PL6 sampai PL 9 diperoleh perlakuan A dibandingkan perlakuan B, C, dan D. Pada PL 10 tingkat kelangsungan hidup yang paling tinggi diperoleh perlakuan B dengan nilai 95.33±1.53% yang berbeda (p<0.05) dengan perlakuan A (80.33±1.53%), C (92.00±2.00%) dan D (88.00±1.00%).
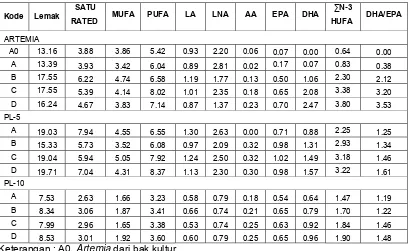
Komposisi Asam Lemak Artemia dan Larva Vaname
Kandungan lemak dan asam lemak pada Artemia yang diperkaya DHA 70G dan larva udang vaname stadia PL-5 dan PL-10 disajikan dalam Tabel 4 dan Lampiran 6. Kandungan lemak pada Artemia berkisar antara 13.16-17.55%. Artemia
yang diperkaya dengan minyak kelapa mengandung EPA 0.17% dan DHA 0.07%. Pada Artemia yang diperkaya dengan DHA 70G, konsentrasi DHA pada Artemia
meningkat sesuai dengan peningkatan dosis DHA 70G yang diberikan. Begitu pula dengan konsentrasi EPA dan n-3 HUFA yang meningkat. Konsentrasi EPA, DHA dan n-3 HUFA pada semua perlakuan berkisar antara 0.07-0.70%, 0-2.47% dan 0.64-3.80%.
Tabel 4. Komposisi asam lemak pada Artemia, PL-5 dan PL-10 (% berat kering)
24
Konsentrasi EPA, DHA dan n-3 HUFA pada tubuh larva udang vaname mengalami penurunan sesuai dengan semakin bertambahnya stadia. Pada perlakuan A penurunan yang tajam sudah terlihat ketika PL-5 dan semakin menurun di PL-10 dengan konsentrasi yang paling rendah dibandingkan perlakuan B, C dan D. Sedangkan pada perlakuan B, C, D penurunan konsentrasi EPA, DHA dan n-3 HUFA tidak terlalu tajam ketika PL-5, dan kemudian menurun kembali pada PL-10. Konsentrasi tertinggi diperoleh pada perlakuan D untuk nilai EPA, DHA dan n-3 HUFA pada masing-masing stadia yang diamati.
PEMBAHASAN
Hasil penelitian ini menunjukkan bahwa pengkayaan rotifer (Brachionus rotundiformis) dan Artemia dengan DHA 70G dapat meningkatkan kadar n-3 HUFA, terutama DHA sebelum diberikan sebagai pakan pada larva udang vaname. Sesuai dengan penelitian Barclay & Zeller (1996) bahwa rotifer dan naupli
Artemia dapat diperkaya dengan DHA yang merupakan asam lemak rantai panjang. Pengkayaan dengan DHA 70G pada rotifer (Brachionus rotundiformis) dan naupli
Artemia menyebabkan retroconversion asam lemak dari bentuk rantai yang lebih panjang menjadi EPA. Retroconversion DHA menjadi EPA dan 22:5n-6 menjadi AA (20:4n-6) melalui proses β-oksidasi yang telah lama dikenal terjadi pada mamalia (Hagve & Christopherson 1986). Prosesnya yang terjadi pada peroxisom atau mitokondria, yang meliputi dua reaksi: 1. docosapolyenoic acid (22:6n-3 or 22:5n-6) melepaskan ikatan gandanya pada ikatan ke 4, reaksinya melibatkan enzim 4-enol-CoA reductase, ketika rantai panjang karbon tetap tidak berubah, dan 2. kemudian rantai yang lebih pendek terjadi (Kunau & Bartnik 1974). DHA pertama-tama diubah menjadi 22:5n-3 dan kemudian diubah menjadi EPA, hal yang sama terjadi pada 22:5n-6 yang diubah menjadi 22:4n-6 dan kemudian menjadi 20:4n-6. Barclay & Zeller (1996) menunjukkan bahwa rotifer dan naupli Artemia yang diberi pakan
diberikan untuk larva ikan laut. Tetapi tampaknya AA tidak berperan dalam meningkatkan tingkat kelangsungan hidup dan atau mempercepat intermolt period. Hal ini terlihat dari kandungan AA yang rendah, kemungkinan hanya untuk memenuhi kebutuhan larva udang vaname selama pemberian rotifer dan Artemia.
Penelitian ini juga mendukung pernyataan bahwa DHA merupakan material penting yang digunakan untuk molting pada larva ikan laut dan krustasea, yang diindikasikan dengan berkurangnya kandungan DHA pada larva vaname setelah molting. Molting pada krustasea dan serangga diatur oleh ecdysteroids (Subramoniam 2000). Pada krustasea, ecdysteroids disekresi oleh organ Y yang terletak ditangkai mata yang dilepaskan ke dalam haemolimph, secara langsung mengatur proses molting. Doston et al (1993) juga menyatakan bahwa [3H]-ecdyson dimetabolisme menjadi 3 senyawa berbeda pada embrio dan larva Ornithodoras moubata. Mereka menemukan bahwa satu dari senyawa itu berkonjugasi dengan asam lemak C-22, sehingga dapat disimpulkan bahwa asam lemak C-22 seperti DHA mengatur molting pada larva udang vaname melalui metabolisme ecdysteroid.
Pada penelitian sebelumnya disebutkan bahwa pengkayaan naupli Artemia
dengan DHA lebih efektif dibandingkan pengkayaan dengan EPA (Suprayudi et al. 2004). Watanabe (1993) melaporkan bahwa pengkayaan naupli Artemia dengan EPA murni 99% (ethyl ester) menghasilkan peningkatan EPA pada tubuh naupli tetapi DHA tidak terdeteksi sedangkan pengkayaan naupli Artemia dengan DHA murni 99% (ethyl ester) menghasilkan peningkatan pada EPA dan DHA dengan rasio 1:4.
26
kelangsungan hidup larva udang vaname. Sedangkan pada larva udang vaname yang diberi pakan Artemia yang mengandung DHA 1.06% dan EPA 0.50% (perlakuan B dengan rasio DHA/EPA 2.12) menghasilkan tingkat kelangsungan hidup yang tinggi pada PL10 (95.33±1.53%) dibandingkan pakan yang mengandung DHA 0.07% dan EPA 0.17% (perlakuan A dengan rasio DHA/EPA 0.38) dengan tingkat kelangsungan hidup yang lebih rendah (83.33±1.53%). Peningkatan rasio DHA/EPA pada Artemia akan menurunkan tingkat kelangsungan hidup larva udang vaname. Sesuai dengan penelitian Takeuchi et al. 2000 pada larva Scylla tranquebarica yang diberi pakan rotifer mengandung konsentrasi DHA dan EPA tidak seimbang menghasilkan tingkat kelangsungan hidup yang rendah pada stadia megalopa.
Pada penelitian ini konsentrasi DHA pada rotifer lebih tinggi bila dibandingkan DHA pada naupli Artemia. Hasil yang sama diperoleh pada penelitian yang dilakukan oleh Dhert et al. (1993). Tidak sama dengan pakan alami lainnya seperti rotifer, pengkayaan Artemia dengan DHA lebih sulit karena sifat katabolisme dari asam lemak ini pada pengkayaan yang menghasilkan rasio DHA/EPA rendah (Sorgeloos et al. 2001). Teknik pengkayaan dengan waktu yang lebih lama pada naupli Artemia selama 12 jam menghasilkan kandungan lipid yang lebih rendah daripada pengkayaan rotifer dengan waktu yang lebih pendek yaitu 6 jam, seperti pada penelitian Rainuzzo et al. (1994b). Menurut Barclay & Zeller (1996) penyimpanan DHA pada Artemia selama dan setelah pengkayaan jauh lebih sulit daripada rotifer, hal ini karena perbedaan stadia dari siklus hidup kedua spesies ini. Rotifer berada pada stadia dewasa dimana aktivitas metabolik tidak seberat seperti pada stadia larva Artemia sehingga komposisi asam lemak pada rotifer lebih stabil dan tidak berubah selama pengkayaan atau kondisi pemuasaan. Keberhasilan pengkayaan dengan DHA pada naupli Artemia juga bergantung dari karakteristik genetik jenisnya sendiri.
yang paling rendah dan intermolt period yang lebih lama. Supriyadi et al. (2002a) menyatakan bahwa rotifer dan naupli Artemia yang digunakan sebagai pakan alami untuk larva ikan laut dan krustasea memiliki kandungan n-3 HUFA yang rendah terutama EPA dan DHA.
Semua perlakuan yang diberikan pada larva udang vaname dapat menyebabkan larva dapat hidup, baik penelitian tahap pertama (Z2-PL1) atau penelitian tahap kedua (PL1-PL10), yang membedakannya adalah tingkat kelangsungan hidup dan kecepatan intermolt period diantara perlakuan yang diberikan. Untuk mempertahankan tingkat kelangsungan hidup dan intermolt period yang lebih baik, pada stadia Z2-PL1 diberikan pakan alami berupa rotifer dengan konsentrasi DHA 2.45% sedangkan pada PL1-PL10 diberi naupli Artemia dengan konsentrasi DHA 1.06%.
Penurunan tingkat kelangsungan hidup yang tajam terjadi pada stadia zoea. Hal ini sesuai dengan Elovaara (2001) bahwa fase zoea merupakan fase kritis pada udang vaname dan kematian yang tinggi sering terjadi. Kematian ini disebut juga zoea syndrome yang menyebabkan kematian pada larva yang tinggi hingga 90% sebelum larva mencapai stadia mysis. Pengkayaan naupli Artemia dengan DHA sebelum diberikan kepada larva udang vaname membantu menyediakan asam lemak esensial selama fase kritis dalam perkembangan larva. Bell et al. (1994) menyatakan bahwa pemberian pakan dengan rotifer dan naupli Artemia yang diperkaya dengan DHA menghasilkan peningkatan EPA yang mempertinggi kemampuan imun larva ikan.
Tingkat kelangsungan hidup hingga mencapai stadia PL1 berangsur-angsur menurun dan perlakuan A (64%; 8.93) dan B (69%; 9.02) memiliki tingkat kelangsungan hidup yang rendah dan intermolt period yang lebih lambat dibandingkan perlakuan lainnya. Hal ini disebabkan karena larva pada stadia Z2-PL1 yang tidak diberi rotifer (perlakuan A) dan diberi rotifer yang tidak diperkaya (perlakuan B) memiliki kadar EPA dan DHA yang rendah. Larva P. trituberculatus
28
Pada pemeliharaan post larva (PL1-PL10) menunjukkan bahwa fase krirtis terjadi pada PL1 sampai PL5. Perlakuan yang diberi Artemia yang diperkaya dengan DHA menghasilkan tingkat kelangsungan hidup yang lebih baik. Tetapi hasil yang sama diperoleh pada post larva yang diberi kadar DHA kurang atau berlebih yang menyebabkan tingkat kelangsungan hidup yang rendah. Rees et al. (1994) menyatakan bahwa kelebihan n-3 HUFA yang diberikan kepada postlarva P. monodon akan menyebabkan terganggunya pertumbuhan dan kelangsungan hidup. Pada larva Scylla serrata yang diberi naupli Artemia yang diperkaya dengan kadar DHA rendah atau berlebih juga menurunkan tingkat kelangsungan hidupnya (Suprayudi et al. 2004).
Penelitian ini menunjukkan bahwa pengkayaan rotifer dan naupli Artemia
dengan DHA menghasilkan tingkat kelangsungan hidup yang lebih baik dan mempercepat intermolt period larva udang vaname. Beberapa penelitian pada larva ikan laut dan krustasea menunjukkan bahwa DHA mempunyai pengaruh yang lebih besar dibandingkan dengan EPA dalam mempercepat perubahan bentuk, pigmentasi, kelangsungan hidup dan pertumbuhan (Watanabe 1993; Rainuzzo et al. 1994a; Rodriguez et al. 1997; Blinkmeyer & Holt. 1998; Suprayudi et al. 2002a).
Simpulan
Berdasarkan hasil penelitian ini dapat disimpulkan bahwa DHA
merupakan asam lemak esensial yang diperlukan oleh larva udang vaname yang
dapat diberikan melalui pengkayaan terhadap rotifer (Brachionus rotundiformis)
dan Artemia sehingga nilai nutriennya dapat meningkat. Tingkat pengkayaan
DHA 70G yang diberikan selama pemberian rotifer (Z2-M3) dan Artemia
(PL1-PL10) adalah sebanyak 25µL/L sehingga dapat memperoleh tingkat
kelangsungan hidup yang tinggi dan mempercepat intermolt period larva udang
vaname (Litopenaeus vannamei).
Saran
Pada stadia Zoea 2 larva udang vaname sebaiknya diberi pakan alami
DAFTAR PUSTAKA
Bhagavan, N.V. 1982. Medical Biochemistry. John and Bartlett Publisher, Boston, London.
Barclay W, Zeller A. 1996. Nutritional enhancement of n-3 HUFA and n-6 fatty acids in rotifers and Artemia nauplii by feeding spray-dried Schizochytrium sp. World Aquaculture Society 27(3): 314-322.
Bell JG, Tocher DR, Sargent JR. 1994. Effect of supplementation with 20:3(n-6), 20:4(n-6) and 20:5(n-3) on the production of prostaglandins E and F of the 1-, 2- and 3-series in turbot (Scophthalmus maximus) brain astroglial cells in primary culture. Biochimica et Biophysica Acta 1211: 335-343.
Blinkmeyer RI, Holt GJ. 1998. Highly unsaturated fatty acids in diets for red drum (Sciaenops ocellatus) larvae. Aquaculture 161: 253-268.
Bransden MP et al. 2005. Dietary 22:6n-3 alters gut and liver structure and behaviour in larval striped trumpeter (Latris lineate). Aquaculture 248: 275-285.
D’Abramo LR, Sheen SS. 1993. Polyunsaturated fatty acid nutrition in juvenile fresh water prawn Macrobrachium rosenbergii. Aquaculture 115 : 63-86.
D’Abramo LR. 1997. Triacylglycerols and fatty acids. p. 71-84. In: D’Abramo LR, Conklin DE, Akiyama DM (edit). Crustacean Nutrition. Advances in World Aquaculture. The World Aquaculture Society, Baton Rouge, Louisiana, USA.
Dhert P, Sorgeloos P, Devresse B. 1993. Contribution toward a specific DHA enrichment in the live food Brachionus plicatilis and Artemia sp. p. 109-115. In: Reinertsen H, Dahle LA, Jorgensen L, Tuinnereim K, editor. Fish Farming Technology. Balkema, Rotterdam, Netherlands.
Doston EM, Connat JL, Diehl PA. 1993. Metabolism of [3H]-ecdyson in embryos and larvae of the tick Ornithodoras moubata. Arch. Insect Biochem. Physiol 23: 67-78.
Elovaara AK. 2001. Shrimp Farming Manual : Practical Technology For Intensive Commercial Shrimp Production. Carribian Press Ltd. USA. p. 200.
Fernandez-Reiriz MJ, Labarta U, Ferreiro MJ. 1993. Effect of Commercial Enrichment Diet on the Nutritional Value of the Rotifer (Brachionus plicatilis). Aquaculture, 112 : 195-206.
Hamasaki K, Takeuchi T, Sekiya S. 1998. Dietary value for larval swimming crab Portunus trituberculatus of marine rotifer Brachionus rotundiformis culture with several feeds. Nippon Suisan Gakkaishi 64: 841-846.
Han K, Igeurden I, Sorgeloos P. 2000. Enrichment strategies for Artemia using emulsions providing different levels on n-3 highly unsaturated fatty acids. Aquaculture 183: 335-347.
Hagve TA, Christoperson BO. 1986. Evidence for peroximal retroconversion of adrenic acid (22:4n-6) and docosahexaenoic acid (22:6n-3) in isolated liver cells. Biochemica et Biophysica Acta 6: 165-173.
Ibeas C, Izquieerdo MS, Lorenzo A. 1994. Influence of dietary n-3 highly unsaturated fatty acid level on juvenile gilthead seabream (Sparus aurata) growth and tissue fatty acid composition. Aquaculture 142 : 221-235.
Jobling M. 2002. Feed composition and analysis. p. 1-24. In: Houlihan D, Boujard T, Jobling M (edit). Food Intake in Fish. Blackwell Science, Malden, USA.
Jones DA, Yule AB, Holland DI. 1997. Larval nutrition. p. 353-389. In: D’Abramo LR, Conklin DE, Akiyama DM (edit). Crustacean Nutrition. Advances in World Aquaculture. The World Aquaculture Society, Baton Rouge, Louisiana, USA.
Kanazawa A. 1997. Effect docosahexaenoic acids and phospholipids on stress tolerance in fish. Aquaculture 155 : 135-148.
Kanazawa A, Teshima S, Tokiwa S. 1979. Nutritional Requirements of Prawn-III. Effect of Dietary Lipids on Growth. Bull. Jap. Soc. Sci. Fish., 43 : 849-856.
Karim, M.Y. 1998. Aplikasi Pakan Alami (Brachionus plicatilis dan Nauplius Artemia) yang Diperkaya dengan Asam Lemak Omega-3 dalam Pemeliharaan Larva Kepiting Bakau (Scylla serrata Forksal). Tesis. Program Pascasarjana IPB, Bogor. 95 hal.
Kayama M, Hirata H, Kanazawa A, Yokiwa S, Saito M. 1980. Essensial Fatty Acids in the Diet on Prawn-III. Lipid Metabolism and Fatty Acid Composition. Bull. Jap. Soc. Sci. Fish., 46 (4) : 483-488.
Kunau WF, Bartnik F. 1974. Studies on the partial degradation of polyunsaturated fattay acid in rat-liver mitochondria. European Journal of Biochemistry 48: 311-318.
Kurmaly K, Yule AB, Jones DA. 1989. Comparative analysis of the growth and survival of Penaeus monodon (Fabricus) larvae, from protozoea 1 to postlarva 1, on live feeds, artificial feeds and on combination of both. Aquaculture 81: 27-45.
32
Mourente G, Rodriguez DR, Tocher DR, Sargent JR. 1993. Effect of dietary docosahexaenoic acid (DHA;22-6n-3) on lipid and fatty acid compositions on growth in gilthead sea bream (Sparus aurata L.) larvae during first feeding. Aquaculture 112: 79-98.
Mourente G, Medina A, Gonzalez S, Rodriguez A. 1995. Variations in lipid content and nutricional status during larval development of the marine shrimp Penaeus kerathurus. Aquaculture 130: 187-199.
Navvaro JC, Montano M. 1996. Fatty acid of wild and cultured Penaeus vannamei larvae from Equador. Aquaculture 142: 259-268.
Racotta IS et al. 2004. Criteria for assessing larval and postlarval quality of Pasific white shrimp (Litopenaeus vannamei, Boone, 1931). Aquaculture 233: 181-195.
Rainuzzo JR, Reitan KI, Jorgensen L, Olsen Y. 1994a. Lipid composition in turbot larvae fed live feed cultured by emulsions of different lipid classes. Comp. Biochem. Physiol. 107A: 699-710.
Rainuzzo JR, Reitan KI, Jorgensen L, Olsen Y. 1994b. Effect of short and long term lipid enrichment on total lipids, lipid class and fatty acid somposition in rotifers. Aquacult. Int. 2: 19-32.
Rees JF, Cure K, Piyatiratitivorakul S, Sorgeloos P, Menasveta P. 1994. Highly unsaturated fatty acid requirements of Penaeus monodon postlarvae: an experimental approach based on Artemia enrichment. Aquaculture 164: 77-93.
Reitan KJ, Rainuzzo JR, Olsen Y. 1994. Influence of lipid composition of live feed on growth, survival and pigmentation of turbot (Scophthalmus maximus) larvae. Aquaculture.Int 2: 19-32.
Robin JH. 1998. Use of borage oil in rotifer production and Artemia enrichment: effect on growth and survival of turbot (Scophthalmus maximus) larvae. Aquaculture 161: 323-331.
Rodriguez C et al. 1997. Influence of the EPA/DHA ratio in the rotifers on gilthead seabream (Sparus aurata) larval development. Aquaculture 150: 77-89.
Sargent JR, McEvoy LA, Bell JG. 1997. Requirement, presentation and sources of polyunsaturated fatty acids in marine fish larval feeds. Aquaculture 155: 117-127.
Sargent JR, McEvoy LA, Estevez A, Bell JG, Bell M, Henderson J, Tocher D. 1999. Lipid nutrition of marine fish during early development: current status and future direction. Aquaculture 179: 217-229.
Shiau S-Y. 1998. Nutrient requirements of penaeid shrimps. Aquaculture 164: 77-93.
Sorgeloos P, Dhert P, Candreva P. 2001. Use of the brine shrimp, Artemia spp., in marine fish larviculture. Aquaculture 200: 147-159.
Subramoniam T. 2000. Crustacean ecdysteroids in reproduction and embryogenesis. Comp. Biochem. Physiol 125: 135-156.
Suprayudi MA, Hamasaki K, Takeuchi T. 2002. Effect of dietary N-3 HUFA on larval morphogenesis and metamorphosis to megalop in the seed production of the mud crab, Scylla serrata (Brachyura: Portunidae). Suisanzoshoku, Japan Aquaculture Society, 50 (3): 333-340.
Suprayudi MA, Takeuchi T, Hamasaki K, Hirakawa J. 2002a. The effect of N-3 HUFA content in rotifers on the development and survival of mud crab, Scylla serrata, larvae. Suisanzoshoku, Japan Aquaculture Society, 50 (2): 205-212.
Suprayudi MA, T Takeuchi, K Hamasaki, J Hirokawa. 2002b. Effect of Artemia feeding schedule and density on the survival and development of larval mud crab Scylla serrata. Fisheries science, 68: 1295-1303.
Suprayudi MA, Takeuchi T, Hamasaki K. 2004. Effects of Artemia enriched with eicosapentaenoic and docosahexaenoic acid on survival and occurrence of molting failure in megalop larvae of the mud crab Scylla serrata. Fisheries Science 70: 650-658.
Supriyadi MA. 2003. Pengaruh dari macam dan dosis pengkayaan terhadap kualitas nutrisi rotifera Brachionus rotundiformis khususnya n-3 HUFA. Jurnal Akuakultur Indonesia, 2(1): 21-25.
Sweeney & Wyban. 1991. Intensive shrimp production technology : The Oceanic Institute Shrimp Manual. The Oceanic Institut, Honolulu. Hawwai. p 158.
Takeuchi T, Toyota M, and Watanabe. 1992. Comparison of Lipid and n-3 Highly Unsaturated Fatty Acid Incorporation Between Artemia Enriched with Various Types Oil by Direct Method. Nippon Suisan Gakkaishi, 58 (2) : 277-281.
Takeuchi T, Kobayashi T, Shimidzu T and Sekiya S. 2000. The necessity and suitable feeding schedule of Artemia nauplii for larval mud crab. Nippon Suisan Gakkaishi 66: 1006-1013.
Watanabe T. 1993. Importance of docosahexaenoic acid in marine larval fish. Journal of the World Aquaculture Society 24: 152-161.
Watanabe T, Oowa F, Kitajima C, Fujita S. 1978. Nutritional quality of brine shrimp Artemia salina as a living feed from the viewpoint of essential fatty acids for fish. Bulletin of Japanese Society of Scientific Fisheries 40: 1115-1122.
34
Whyte JNC, Nagata WD. 1990. Carbohydrate and fatty acid composition of the rotifer, Brachionus plicatilis, fed monosfesific diets of yeast or phytoplankton. Aquaculture 89: 263-272.
Woynarovich E, Horvath L. 1980. The artificial propagation of warm water fisheries. A Manual for Extension. FAO. Fish. Tech. Pap (201); p 183.
Lampiran 1. Hasil pengamatan kualitas air untuk setiap perlakuan selama penelitian
Lampiran 1.1. Suhu air (°C)
Suhu penelitian tahap pertama
Perlakuan
Suhu penelitian tahap kedua
Salinitas penelitian tahap pertama
Salinitas penelitian tahap kedua