PRETREATMENT
BASA NaOH MAKROALGA
Caulerpa
racemosa
UNTUK PRODUKSI BIOETANOL
ANASTASYA HIDAYAT
DEPARTEMEN TEKNOLOGI INDUSTRI PERTANIAN FAKULTAS TEKNOLOGI PERTANIAN
INSTITUT PERTANIAN BOGOR BOGOR
PERNYATAAN MENGENAI SKRIPSI DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA
Dengan ini saya menyatakan bahwa skripsi berjudul “Pretreatment Basa NaOH Makroalga Caulerpa racemosa untuk Produksi Bioetanol” adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
ABSTRAK
ANASTASYA HIDAYAT. Pretreatment Basa NaOH Makroalga Caulerpa racemosa untuk Produksi Bioetanol. Dibimbing oleh DWI SETYANINGSIH.
Makroalga, termasuk Caulerpa racemosa, merupakan bahan baku yang potensial untuk pembuatan bioetanol, yaitu bahan bakar alternatif yang diolah dari bahan alami (tanaman), yang digunakan sebagai bahan substitusi untuk bensin. Penelitian ini bertujuan untuk mengetahui pengaruh perendaman basa pada makroalga Caulerpa racemosa dalam menghasilkan kadar gula pereduksi pada produksi bioetanol. Rumput laut kering yang telah dibersihkan direndam dalam air, NaOH 0.05 N, dan NaOH 0.1 N selama 3 hari, dan kembali dijemur di bawah sinar matahari. Hasil analisis proksimat menunjukkan sebagian besar komposisi kimia Caulerpa racemosa adalah karbohidrat dan serat kasar. Sampel perendaman air memiliki karbohidrat sebesar 36.69% dan serat kasar sebesar 40.87%. Sampel perendaman NaOH 0.05 N memiliki karbohidrat sebesar 36.12% dan serat kasar sebesar 44.50%. Sampel perendaman NaOH 0.1 N karbohidrat sebesar 38.97% dan serat kasar sebesar 46.73%. Hidrolisat sampel perendaman air memiliki kadar gula pereduksi sebesar 7.67% (b/v). Gula sederhana, yang diperoleh dari hasil hidrolisis rumput laut menggunakan asam, dikonversi menjadi bioetanol melalui proses fermentasi. Kadar etanol pada bioetanol dari sampel dengan perendaman air yaitu 0.70% (v/v) dengan efisiensi fermentasi 17.26.%.
Kata kunci: bioetanol, Caulerpa racemosa, perendaman basa
ABSTRACT
ANASTASYA HIDAYAT. Macroalgae Caulerpa racemosa NaOH Immersion Treatment for Bioethanol Production. Supervised by DWI SETYANINGSIH.
Macroalgae, including Caulerpa racemosa, is a potential feedstock for bioethanol production, an alternative fuels processed from natural materials (plants), which is used as material subtitute for gasoline. This research aimed to determine the effect of alkaline immersion on macroalgae (Caulerpa racemosa) in generating the reducing sugar content in bioethanol production. Dried seaweed, that has been cleaned, soaked in water, 0.05 N NaOH, and 0.1 N NaOH for 3 days, and again dried under the sun. Proximate analysis results showed most of the chemical composition of Caulerpa racemosa is a carbohydrate and crude fiber. Sample of water immersion has 36.69% carbohydrate and crude fiber was 40.87%. 0.05 N NaOH immersion sample has 36.12% carbohydrate and crude fiber was 44.50%. 0.1 N NaOH immersion sample has 38.97% carbohydrate and crude fiber was 46.73%. Hydrolyzate of water immersion sample has 7.67% (w/v) reducing sugar content. Simple sugar, which is obtained from seaweed using acid hydrolysis, converted into ethanol through fermentation. Ethanol content of bioethanol with water immersion is 0.70% (v/v) with 17.26% fermentation efficiency.
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Teknologi Pertanian
pada
Departemen Teknologi Industri Pertanian
PRETREATMENT
BASA NaOH MAKROALGA
Caulerpa
racemosa
UNTUK PRODUKSI BIOETANOL
ANASTASYA HIDAYAT
DEPARTEMEN TEKNOLOGI INDUSTRI PERTANIAN FAKULTAS TEKNOLOGI PERTANIAN
INSTITUT PERTANIAN BOGOR BOGOR
Judul Skripsi : Pretreatment Basa NaOH Makroalga Caulerpa racemosa untuk Produksi Bioetanol
Nama : Anastasya Hidayat NIM : F34090085
Disetujui oleh
Dr Dwi Setyaningsih, STP MSi Pembimbing
Diketahui oleh
Prof Dr Ir Nastiti Siswi Indrasti Ketua Departemen
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah subhanahu wa ta’ala atas segala karunia-Nya sehingga skripsi ini berhasil diselesaikan. Tema yang dipilih dalam penelitian yang dilaksanakan bulan Maret-Juli 2013 ini adalah proses produksi bioetanol dengan judul Pretreatment Basa NaOH Makroalga Caulerpa racemosa untuk Produksi Bioetanol.
Dengan selesainya penelitian hingga tersusunnya skripsi ini, penulis ingin menyampaikan penghargaan dan terima kasih sebesar-besarnya kepada:
1. Dr. Dwi Setyaningsih, STP, MSi sebagai dosen pembimbing atas segala arahan kepada penulis, baik selama penelitian, penyusunan skripsi, maupun selama perkuliahan di TIN.
2. Dr. Ir. Hj. Liesbetini Haditjaroko, MS dan Dr. Ir. Muslich, MSi sebagai dosen penguji yang telah banyak memberi masukan dalam penyelesaian skripsi ini.
3. Neli Muna, STP, Indah Khayati, SSi, dan Dahlia Wulan Sari SPi yang telah sangat membantu selama penelitian dan pengumpulan data.
4. Ibu, ayah, serta segenap keluarga besar dan sahabat, atas segala doa, semangat, dan kasih sayangnya.
Semoga karya ilmiah ini bermanfaat.
DAFTAR ISI
DAFTAR TABEL vi
DAFTAR GAMBAR vi
DAFTAR LAMPIRAN vi
PENDAHULUAN 1
Latar Belakang 1
Tujuan Penelitian 2
Manfaat Penelitian 2
Ruang Lingkup Penelitian 2
TINJAUAN PUSTAKA 2
METODE 4
Bahan 4
Alat 4
Prosedur Penelitian 5
Analisis Data 8
HASIL DAN PEMBAHASAN 8
SIMPULAN DAN SARAN 16
Simpulan 16
Saran 16
DAFTAR PUSTAKA 16
LAMPIRAN 19
DAFTAR TABEL
1 Komposisi kimia Caulerpa racemosa kering sebelum dan setelah
direndam selama 3 hari 9
2 Hasil Analisis Van Soest Caulerpa racemosa 11
DAFTAR GAMBAR
1 Diagram alir proses pembuatan media fermentasi dari C. racemosa 6
2 Diagram alir proses fermentasi etanol 7
3 Kandungan gula pereduksi setelah hidrolisis 12
4 Kandungan gula pereduksi setelah hidrolisis dengan konsentrasi asam,
konsentrasi padatan, dan perlakuan pembilasan yang berbeda 13 5 Kandungan gula pereduksi setelah penambahan kultur S. cerevisiae
dan setelah fermentasi 4 hari 14
6 Kadar etanol C. racemosa 15
7 Tingkat efisiensi fermentasi dan efisiensi substrat 15
DAFTAR LAMPIRAN
1 Prosedur Uji Proksimat (SNI 1992) 19
2 Uji Gula Pereduksi 22
3 Analisis uji keragaman kandungan gula pereduksi hidrolisat Caulerpa
racemosa setelah hidrolisis 23
4 Analisis uji keragaman kandungan gula pereduksi hidrolisat Caulerpa
racemosa sesaat setelah penambahan kultur S. cerevisiae 24 5 Analisis uji keragaman kandungan gula pereduksi hidrolisat Caulerpa
racemosa setelah fermentasi 4 hari 25
6 Analisis uji keragaman kadar etanol bioetanol dengan bahan dasar
Caulerpa racemosa 26
7 Analisis uji keragaman efisiensi fermentasi bioetanol dengan bahan
PENDAHULUAN
Latar Belakang
Bioetanol merupakan bahan bakar alternatif, diolah dari bahan alami (tanaman), digunakan sebagai bahan substitusi untuk bensin, bahan baku industri turunan alkohol, serta bahan dasar industri farmasi. Bioetanol dapat dibuat dari bahan alami, termasuk hasil pertanian yang memiliki kandungan karbohidrat. Karbohidrat yang dimaksud yaitu turunan gula, bahan yang mengandung pati, dan bahan yang mengandung selulosa.
Makroalga atau rumput laut, termasuk Caulerpa racemosa, merupakan bahan baku yang potensial untuk pembuatan bioetanol. Selain makroalga memiliki kandungan karbohidrat yang cukup tinggi, budidaya makroalga tidak dibatasi oleh perluasan lahan pertanian. Indonesia merupakan negara maritim, sehingga memiliki potensi yang besar untuk membudidaya berbagai jenis makroalga. Produksi rumput laut diperkirakan akan mencapai 17 juta ton per tahun dengan harga 4.5 juta rupiah per ton, apabila seluruh lahan di Indonesia dapat dimanfaatkan (DKP 2008). Proses pembudidayaan rumput laut juga relatif singkat, hanya memerlukan lebih kurang 45 hari untuk dapat dipanen.
C. racemosa merupakan ganggang hijau yang tumbuh di daerah tropis dan subtropis. Jenis ini dapat dikonsumsi sebagai sayuran segar atau lalap, namun konsumsinya masih terbatas diantara nelayan dan masyarakat pesisir saja. Serat polisakarida dari makroalga memiliki karakteristik yang berbeda dari tanaman darat karena terbentuk dari monosakarida tertentu seperti galaktosa, fukosa, xilosa dan manitol, serta terdapat juga gula sulfat yang tinggi (Yanagisawa et al 2011). C. racemosa tergolong dalam divisi alga hijau (Chlorophyta) yang memiliki dominasi pigmen berupa klorofil dan mengandung banyak polisakarida khususnya selulosa dan hemiselulosa (Santi et al. 2012). Selulosa dan hemiselulosa dapat dimanfaatkan untuk pembuatan bioetanol, namun konversinya tidak dapat dilakukan secara langsung karena umumnya selulosa berasosiasi dengan lignin. Proses delignifikasi harus dilakukan terlebih dahulu sehingga mempermudah pelepasan selulosa, salah satunya dengan cara kimia, yaitu menggunakan pelarut.
Perendaman rumput laut dalam larutan NaOH dapat menghilangkan kotoran yang larut dalam basa (Poncomulyo et al. 2006). Perendaman menggunakan basa melarutkan lignin sehingga struktur bahan menjadi lebih amorf setelah lignin terpisah dari selulosa dan hemiselulosa. Pretreatment yang dilakukan Wook Koo et al. (2011) dengan menggunakan NaOH 1% menunjukkan bahwa struktur Liriodendron tulipifera (pohon tulip) rusak. Treatment basa ini menyebabkan pembengkakan yang dapat meningkatkan luas permukaan dan penyerapan asam sehingga meningkatkan tingkat hidrolisis. Setyaningsih et al. (2011) melakukan treatment basa NaOH 0.075% pada E. cottoni, namun perolehan gula pereduksi pada hidrolisatnya lebih rendah dari gula pereduksi hidrolisat non-treatment atau tidak direndam. Sebaliknya, pengaruh treatment menggunakan NaOH 0.5% pada Sargassum sp. terlihat pada peningkatan gula pereduksi hingga 46%. Hal ini diduga dipengaruhi oleh jenis dan komposisi karbohidrat dan serat kasar.
2
bahan baku bioetanol karena kandungan karbohidratnya yang tinggi, yaitu di atas 30% bobot kering (Turangan 2000; Kusuma 2012). Oleh karena itu, pengaruh perendaman basa perlu dikaji untuk masing-masing jenis makroalga.
Tujuan Penelitian
Penelitian ini bertujuan untuk mengetahui pengaruh perendaman basa NaOH pada makroalga Caulerpa racemosa dalam menghasilkan gula reduksi untuk produksi bioetanol.
Manfaat Penelitian
Manfaat penelitian bagi peneliti yaitu menambah pengetahuan tentang pengembangan produksi bioetanol dengan bahan dasar makroalga, yaitu Caulerpa racemosa serta pengaruh perlakuan perendaman basa terhadap rendemen. Penelitian juga bermanfaat sebagai sumber informasi bagi masyarakat dan sebagai data dasar untuk penelitian selanjutnya.
Ruang Lingkup Penelitian
Penelitian dilakukan di Laboratorium Gedung Surfactant and Bioenergy Research Center, Lembaga Penelitian dan Pengembangan Masyarakat (LPPM) IPB. Jenis makroalga yang digunakan sebagai bahan baku pembuatan bioetanol adalah Caulerpa racemosa. Perlakuan yang digunakan adalah metode perendaman berupa perendaman dengan menggunakan air, basa NaOH 0.05 N, NaOH 0.1 N, dan tanpa perendaman. Hidrolisis dilakukan dengan menggunakan asam sulfat 2% (v/v), dan fermentasi dilakukan selama 4 hari dengan bantuan Saccharomyces cerevisiae.
TINJAUAN PUSTAKA
Caulerpa racemosa dan Kandungan Polisakarida Rumput Laut Hijau
3 Menurut Shevchenko et al. (2009), umumnya senyawa monosakarida yang terdapat pada genus Caulerpa sp. berupa glukosa, galaktosa, manosa, dan xilosa. Caulerpa sp. tergolong dalam divisi alga hijau yang mengandung SPs (sulfated polysaccharides) berupa ulvan dengan struktur kimia yang polimer-polimernya bervariasi pada masing-masing spesies alga (Wijesekara et al. 2011; Costa 2010). Polimer karbohidrat pada C. racemosa mengandung galaktosa, glukosa, arabinosa, dan xilosa sebagai komponen gula utamanya (Ghosh et al. 2004).
Alga hijau juga banyak mengandung selulosa dan hemiselulosa. Selulosa merupakan polimer glukosa yang membentuk rantai linier dan dihubungkan oleh ikatan β-1,4 glikosidik. Struktur yang linier menyebabkan selulosa bersifat kristalin dan tidak mudah larut. Selulosa tidak mudah didegradasi secara kimia maupun mekanis. Umumnya, selulosa berasosiasi dengan polisakarida lain seperti lignin dan hemiselulosa membentuk kerangka utama dinding sel tumbuhan. Selulosa yang berasosiasi dengan lignin sering disebut dengan lignoselulosa (Holtzapple 1993).
Polisakarida yang larut dalam alkali umumnya disebut sebagai hemiselulosa. Hemiselulosa sangat dengan asosiasinya dengan selulosa di dalam dinding sel tanaman. Perbedaan selulosa dan hemiselulosa terletak pada susunan gula, dimana selulosa hanya tersusun atas glukosa sedangkan hemiselulosa tersusun atas bermacam-macam jenis gula. Glukosa, manosa, dan galaktosa (heksosan), serta xilosa dan arabinosa (pentosan) merupakan komponen gula utama pada hemiselulosa (Fengel dan Wegener 1995).
Secara alamiah, molekul selulosa tersusun dalam bentuk fibril-fibril yang terdiri dari beberapa molekul selulosa yang dihubungkan dengan ikatan hidrogen. Fibril membentuk struktur kristal yang dibungkus oleh lignin, sehingga kebanyakan bahan yang mengandung selulosa bersifat kuat dan keras. Sifat ini membuat sebagian besar bahan yang mengandung selulosa tahan terhadap penguraian secara enzimatik (Fan et al. 1982). Menurut Ariestaningtyas (1991), selulosa dapat dikonversi menjadi produk-produk bernilai ekonomi, termasuk bioetanol melalui proses hidrolisis secara asam atau basa. Namun, lignin harus dihilangkan terlebih dahulu melalui proses delignifikasi. Fridia (1989) mengatakan bahwa proses pendahuluan ini dapat dilakukan dengan cara fisik (penggilingan, pemanasan uap, radiasi, atau pemanasan dengan udara kering) dan kimia (menggunakan pelarut).
Hidrolisis Asam
Hidrolisis dilakukan untuk mengkonversi polisakarida menjadi gula sederhana. Hidrolisis yang dilakukan pada C. racemosa merupakan hidrolisis asam, yaitu hidrolisis secara kimiawi yang menggunakan katalis berupa asam, karena bahan asam lebih mudah didapat dan biaya lebih murah. Asam sulfat (H2SO4) dan asam klorida (HCl) merupakan asam yang paling sering digunakan
4
hanya 86% pati terkonversi menjadi glukosa (Choi dan Mathews 1996). Penelitian yang dilakukan Kusuma (2012) menunjukkan bahwa hidrolisis asam dengan menggunakan asam sulfat pada C. racemosa optimum pada konsentrasi asam sulfat 2% (v/v) menggunakan konsentrasi padatan sebesar 15% (b/v) pada suhu 121°C dan tekanan 1 atm selama 45 menit. Hidrolisis selulosa menghasilkan glukosa, sementara hidrolisis hemiselulosa menghasilkan glukosa, xilosa, manosa, asam asetat, dan galaktosa.
Gula reduksi adalah gula yang memiliki kemampuan untuk mereduksi senyawa pengoksidasi karena mengandung gugus keton dan aldehid (-CHO) seperti glukosa, manosa, fruktosa, laktosa, maltosa, dan lain-lain. Kemampuan mereduksi berasal dari gugus hidroksil yang bebas dan reaktif.
Fermentasi
Gula sederhana yang diperoleh dari hasil hidrolisis dikonversi menjadi bioetanol melalui proses fermentasi. Fermentasi adalah suatu proses perubahan kimia pada substrat organik, baik karbohidrat, protein, lemak, dan lain-lain, melalui kegiatan katalis biokimia yang dikenal sebagai enzim dan dihasilkan oleh mikroba spesifik (Prescott dan Dunn 1981).
Proses fermentasi dilakukan menggunakan mikroba Saccharomyces cerevisiae dengan konsentrasi 10% (v/v). Mikroba ini sering digunakan pada fermentasi etanol karena menghasilkan etanol yang tinggi, toleran terhadap kadar etanol tinggi, dan tetap stabil selama kondisi fermentasi. S. cerevisiae toleran terhadap kadar alkohol 12-18% (v/v) dan tetap aktif melakukan fermentasi pada suhu 4-32°C (Reed dan Rehm 1983; Harrison dan Graham 1970). S. cerevisiae dapat memfermentasi gula sederhana berupa glukosa, sukrosa, galaktosa, dan rafinosa. Konversi gula sederhana menjadi etanol dan CO2 dilakukan melalui
suatu jalur metabolisme yang disebut glikolisis atau disebut juga sebagai jalur Embden-Meyerhof-Parnas (Kunkee dan Mardon 1970; Berry 1988).
METODE
Bahan
Bahan yang digunakan adalah rumput laut atau makroalga hijau (Chlorophyta) jenis Caulerpa racemosa (diambil dari Pulau Pari, Kepulauan Seribu, Jakarta Utara), NaOH 0.05 N, NaOH 0.1 N, akuades, H2SO4 2% (v/v),
NaOH 10%, kultur Saccharomyces cerevisiae IPBCC (IPB Culture Collection) AL IX, NPK, urea, fenol, dan asam 3,5-dinitrolisilat (DNS).
Alat
5 Prosedur Penelitian
C. racemosa dibilas dengan air agar bersih dari kotoran yang melekat pada rumput laut, lalu bahan dijemur di bawah sinar matahari hingga diperoleh bahan kering. Bahan kering, dengan kadar air 12.35% dan abu 16.83% (bk), mengalami pretreatment berupa perlakuan perendaman dalam air, NaOH 0.05 N, dan NaOH 0.1 N selama tiga hari, dibilas dan kembali dijemur di bawah sinar matahari. Bahan kemudian dipotong dengan gunting hingga terbentuk potongan-potongan kecil. Uji proksimat dan uji Van Soest dilakukan pada bahan yang telah mengalami perlakuan perendaman. Uji proksimat berupa perhitungan kadar air, abu, protein, lemak, karbohidrat dan serat kasar dilakukan dengan mengacu pada SNI (1992) yang dapat dilihat pada Lampiran 1.
Bahan yang telah mengalami perlakuan perendaman masing-masing dihidrolisis dengan konsentrasi padatan 5% (b/v) menggunakan asam sulfat konsentrasi 2% (v/v), pada otoklaf dengan suhu 121°C dan tekanan 1 atm selama 45 menit. Hasil hidrolisis dinetralisasi menggunakan NaOH 10% hingga pH 5-6, lalu disaring dengan pompa vakum dan corong buchner berisi kertas saring hingga didapat cairan hidrolisat. Cairan hidrolisat dipasteurisasi dalam penangas air pada suhu 70°-80°C selama 15 menit. Gambar 1 menunjukkan diagram alir proses pembuatan media fermentasi dari C. racemosa.
Kultur S. cerevisiae yang digunakan berasal dari IPBCC (IPB Culture Collection), yang telah mengalami adaptasi lambat ke-9. Adaptasi lambat dilakukan dengan menumbuhkan ragi ke dalam media hidrolisat selama 2 hari atau hingga mencapai jumlah sel maksimum. Kemudian kultur dipindahkan ke media PDA (Potato Dextrose Agar) dan koloni dengan pertumbuhan terbaik diisolasi dan disegarkan dalam media berikutnya, dilakukan tanpa terputus hingga 9 kali siklus (Setyaningsih et al. 2012).
6
Gambar 1 Diagram alir proses pembuatan media fermentasi dari C. Racemosa
Uji kadar gula reduksi
Pasteurisasi (dalam penangas air, T= 70°-80°C, 15 menit)
Hidrolisat C. racemosa
Media
Perendaman dalam NaOH 0.1 N Uji proksimat
dan Van Soest
Perendaman dalam NaOH 0.05 N Perendaman
dalam air
Rumput laut C. racemosa
Pencucian dan pengeringan
Rumput laut kering
Pembilasan, pengeringan, pemotongan (dengan gunting)
Hidrolisis (menggunakan asam H2SO4 2% (v/v), konsentrasi padatan 15% (b/v), T = 121°C, 45 menit, P = 1 atm di dalam otoklaf)
Penetralan dengan NaOH 10%
Penyaringan dengan pompa vakum dan corong buchner yang berisi kertas saring Uji proksimat
7
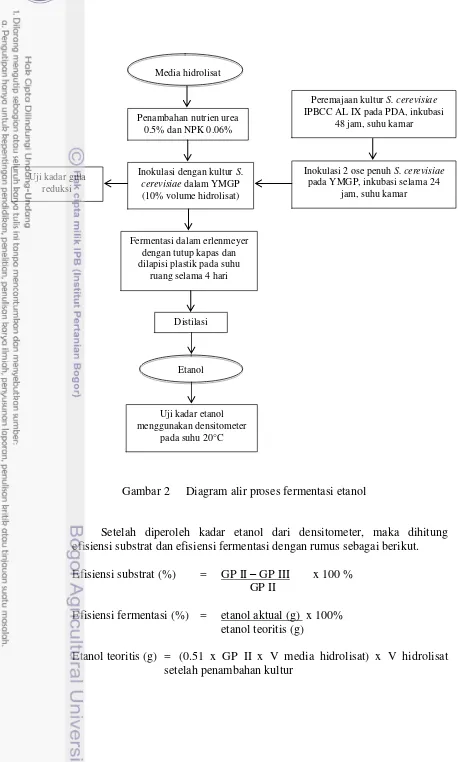
Gambar 2 Diagram alir proses fermentasi etanol
Setelah diperoleh kadar etanol dari densitometer, maka dihitung efisiensi substrat dan efisiensi fermentasi dengan rumus sebagai berikut. Efisiensi substrat (%) = GP II – GP III x 100 %
GP II
Efisiensi fermentasi (%) = etanol aktual (g) x 100% etanol teoritis (g)
Etanol teoritis (g) = (0.51 x GP II x V media hidrolisat) x V hidrolisat setelah penambahan kultur
Media hidrolisat
Penambahan nutrien urea 0.5% dan NPK 0.06%
Inokulasi dengan kultur S. cerevisiae dalam YMGP (10% volume hidrolisat)
Fermentasi dalam erlenmeyer dengan tutup kapas dan dilapisi plastik pada suhu
ruang selama 4 hari Uji kadar gula
reduksi
Distilasi
Etanol
Uji kadar etanol menggunakan densitometer
pada suhu 20°C
Peremajaan kultur S. cerevisiae IPBCC AL IX pada PDA, inkubasi
48 jam, suhu kamar
Inokulasi 2 ose penuh S. cerevisiae pada YMGP, inkubasi selama 24
8
Keterangan :
GP II = Gula pereduksi setelah penambahan kultur S. cerevisiae (%b/v) GP III = Gula pereduksi setelah fermentasi selama 4 hari (%b/v)
Analisis Data
Rancangan percobaan yang digunakan dalam analisis data gula pereduksi untuk hidrolisat Caulerpa racemosa (setelah hidrolisis, setelah penambahan inokulum, dan setelah fermentasi selama 4 hari), penentuan kadar etanol, dan efisiensi fermentasi dilakukan menggunakan Rancangan Acak Lengkap (RAL). Perlakuan yang dilakukan berupa metode perendaman, yaitu perendaman air, perendaman NaOH 0.05 N, perendaman NaOH 0.1 N, dan tanpa perendaman dengan dua kali ulangan pada tiap perlakuan. Rancangan Acak Lengkap (RAL) dinyatakan dengan model matematis :
Yij = μ + Ai +
ɛ
j(i)Keterangan :
Yij = Nilai pengamatan rumput laut perlakuan ke-i ulangan ke-j
μ = Nilai tengah umum Ai = Pengaruh perlakuan ke-i
ɛ
j(i) = Pengaruh galat ke-i ulangan ke-jHASIL DAN PEMBAHASAN
Analisis Komposisi Kimia Caulerpa racemosa
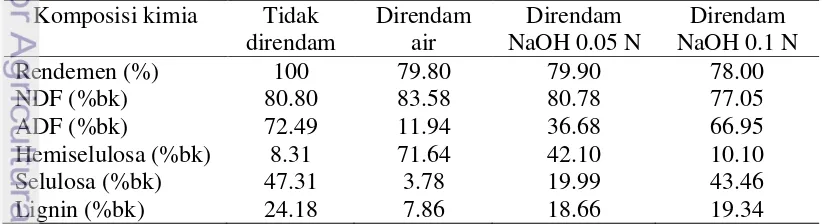
9 Tabel 1 Komposisi kimia Caulerpa racemosa kering sebelum dan
setelah direndam selama 3 hari
Kadar air tertinggi rumput laut Caulerpa racemosa terdapat pada sampel dengan perlakuan perendaman air, sedangkan kadar air terendah terdapat pada sampel perendaman NaOH 0.05 N. Menurut SNI (2008), dalam DKP (2009), umumnya kadar air rumput laut berkisar antara 15%-18%. Pengeringan dengan cara penjemuran di bawah sinar matahari mengakibatkan air yang terkandung bervariasi pada masing-masing bahan.
Kadar abu pada sampel dengan perendaman air lebih rendah dari kadar abu pada sampel dengan perendaman NaOH 0.05 N dan kadar abu pada sampel dengan perendaman NaOH 0.1 N. Semakin tinggi konsentrasi basa yang digunakan pada perendaman, meningkatkan kadar abu pada sampel. Abu merupakan zat anorganik sisa pembakaran bahan organik, dimana sisa pembakaran tersebut merupakan unsur mineral yang membentuk oksida-oksida atau bergabung dengan radikal negatif seperti fosfat, sulfat, nitrat atau klorida (Pearson 1970). Kadar abu dipengaruhi oleh spesies dan metode yang digunakan dalam proses mineralisasi (Winarno 2008). Pada sampel yang belum direndam, kadar abu masih tinggi karena sampel hanya mengalami satu kali pembilasan sehingga masih banyak kotoran yang melekat pada sampel. Sementara pada sampel setelah perendaman, sampel hanya dibilas saja sehingga basa (Na) dan kotoran masih ada yang melekat pada sampel sehingga terhitung sebagai mineral.
10
tetapi perubahan pada komposisi karbohidrat dan serat kasar dapat menyebabkan persen lemak turun.
Menurut Turangan (2000), kadar protein untuk Caulerpa sp. sebesar 10,70% (bk). C. racemosa mengandung asam amino berupa aspargin, treonin, serin, glutamin, polin, glisin, dan arginin (Shafik dan Manawy 2008). Hasil uji menunjukkan bahwa kadar protein rumput laut yang tidak direndam lebih tinggi dari rumput laut yang telah mengalami pretreatment. Hal ini disebabkan protein yang berupa asam amino larut dalam air dan pelarut polar lainnya, termasuk NaOH.
Kadar karbohidrat tertinggi (diukur dengan metode Luff Schoorl) terdapat pada sampel dengan perendaman NaOH 0.1 N dan kadar karbohidrat terendah terdapat pada sampel dengan perendaman NaOH 0.05 N. Karbohidrat merupakan produk utama hasil dari fotosintesis organisme berklorofil. Turangan (2000) mengatakan bahwa rumput laut hijau mengandung pigmen fotosintetik klorofil a dan b, karoten, xantofil, dan lutein. Pada metode Luff Schoorl, seluruh senyawa karbohidrat pada sampel dihidrolisis menjadi gula sederhana dengan bantuan asam klorida (HCl) dan panas. Monosakarida bebas bereaksi dengan larutan Luff Schoorl, mereduksi larutan basa dari garam logam menjadi bentuk oksida atau bentuk bebasnya (SNI 1992). Karbohidrat pada rumput laut terdiri dari polisakarida sulfat, serat kasar (hemiselulosa dan selulosa), dan bahan ekstrak tanpa nitrogen. Selain mengalami penyusutan lignin, bahan yang telah mengalami delignifikasi melalui perlakuan perendaman juga dapat mengalami penyusutan selulosa dan hemiselulosa karena lignin larut dalam basa pada saat masih berasosiasi dengannya dalam bentuk selulosa dan hemiselulosa. Akibatnya, kadar karbohidratnya menurun seperti pada sampel perendaman NaOH 0.05 N.
Kadar serat kasar yang diuji pada sampel C. racemosa meningkat seiring dengan meningkatnya konsentrasi perendaman basa. Hal ini disebabkan C. racemosa lebih mudah dihidrolisis setelah perendaman baik dengan air maupun basa NaOH. Serat kasar merupakan fraksi dari karbohidrat yang tidak larut dalam basa dan asam encer (H2SO4 1.25% dan NaOH 3.25%) setelah pendidihan selama
masing-masing 30 menit. Campuran hemiselulosa, selusosa, dan lignin yang tidak larut termasuk dalam komponen serat kasar (Anonim 2012).
Analisis serat kasar yang dilakukan sebagai bagian dari analisis proksimat merupakan salah satu dari analisis yang dikembangkan dari Wendee Experiment Station di Jerman oleh Henneberg dan Stokman pada tahun 1865. Serat kasar merupakan bagian dari karbohidrat yang telah dipisahkan dengan bahan ekstrak tanpa nitrogen (BETN), terutama terdiri dari karbohidrat berupa selulosa dan hemiselulosa, serta lignin. Namun, sistem yang telah digunakan selama bertahun-tahun dan menjadi perangkat yang berguna untuk memprediksi nilai kandungan nutrisi dalam makanan ini masih memiliki kekurangan dan membutuhkan perbaikan. Serat kasar yang dihitung bukan zat yang seragam secara kimiawi, tetapi merupakan campuran berbagai unsur dengan selulosa, hemiselulosa, dan lignin sebagai unsur utamanya. Hemiselulosa dan lignin yang terhitung hanya sebagian saja, sebagian lain terhitung sebagai BETN atau NFE (Nitrogen Free Extract), yang biasanya dianggap sebagian besar tersusun dari gula dan polisakarida yang mudah dicerna atau digestibililitasnya tinggi (Hasugian 2009).
11 dalam bahan dan fraksi-fraksinya ke dalam kelompok tertentu berdasarkan keterikatannya dengan anion atau kation deterjen (Anonim 2012). Prosesnya berupa pemisahan bahan kering ke dalam dua fraksi, yang memiliki daya cerna atau digestibilitas tinggi dan rendah, dengan mendidihkan 0.5-1.0 gram sampel dalam sebuah larutan deterjen netral (3% larutan sodium lauril sulfat yang dibufferkan ke pH 7) selama satu jam, kemudian disaring (Hasugian 2009).
Larutan deterjen netral yang mudah larut (Neutral Detergent Soluble/NDS) adalah bagian terbesar kandungan sel yang terdiri dari lipid, gula, polisakarida, dan protein yang masing-masing memiliki digestibilitas tinggi yaitu sekitar 98%. Larutan deterjen yang sulit larut disebut sebagai serat deterjen netral (Neutral Detergent Fiber/NDF). Larutan ini merupakan bagian terbesar dinding sel tanaman atau disebut juga sebagai unsur pembentuk dinding sel yang tersusun dari selulosa, lignin, silika, hemiselulosa, dan beberapa protein. Dalam prosedur Van Soest, semua lignin dan hemiselulosa dimasukkan dalam NDF, sementara pada metode Wendee, kedua unsur ini dihilangkan dari serat kasar ke NFE. Hal ini mengakibatkan nilai NDF yang ditentukan dengan prosedur Van Soest jauh lebih tinggi dari nilai kadar serat kasar konvensional untuk beberapa jenis bahan (Hasugian 2009).
Kandungan lignin dan selulosa ditentukan dengan mula-mula melarutkan 1 gram sampel kering dalam larutan deterjen asam (40.04 gram solutic acid dan 20 gram cetyl trimethylammonium bromide per liter) selama satu jam kemudian disaring. Larutan yang tidak dapat larut atau residunya disebut sebagai serat deterjen asam (Acid Detergent Fiber/ADF), terdiri dari selulosa, lignin, dan silika. Perbedaan jumlah NDF dan ADF dihitung sebagai hemiselulosa. ADF dicerna dalam H2SO4 pada suhu 15°C selama tiga jam kemudian disaring. Hasil saringan
dihitung sebagai selulosa. Residu yang tersisa setelah pencucian dan pengeringan ditimbang kemudian dibuat menjadi serbuk. Serbuk yang tersisa menunjukkan kandungan silika, sedangkan berkurangnya bobot selama pembentukan serbuk dihitung sebagai lignin yang tak larut dalam asam (Hasugian 2009).
Nilai NDF yang didapat untuk masing-masing perlakuan jauh lebih tinggi dari nilai kadar serat kasar yang telah diuji sebelumnya (dapat dilihat pada Tabel 2). Hal ini dikarenakan hemiselulosa dan lignin yang terhitung dalam serat kasar hanya sebagian saja. Bagian lain hemiselulosa dan lignin terhitung sebagai BETN, yaitu bagian yang mudah dicerna, mudah larut dalam asam atau basa. Komposisi NDF yang terhitung merupakan sebagian besar kandungan dari bahan, kecuali air dan abu.
12
Seiring meningkatnya konsentrasi basa pada perendaman, kandungan hemiselulosa menurun, sementara kandungan selulosa meningkat. Kandungan hemiselulosa meningkat sangat tinggi setelah perendaman. Hal ini menunjukkan adanya perubahan karakteristik pada polisakarida setelah perendaman, terutama pada perendaman air, sehingga lebih mudah larut dalam deterjen asam yang semula tidak larut. Molekul hemiselulosa lebih mudah menyerap menyerap air, bersifat plastis, dan mempunyai permukaan kontak antar molekul yang lebih luas dari selulosa (Oishima 1965). Perendaman basa (0.05 N dan 0.1 N) juga menyebabkan kandungan hemiselulosa meningkat, namun kelarutan bahan dalam deterjen asam masih lebih rendah daripada sampel perendaman air.
Kandungan lignin dan selulosa pada sampel dengan perlakuan perendaman lebih rendah dari kandungan lignin dan selulosa pada sampel tidak direndam. Hasil kadar lignin yang didapat merupakan lignin yang tidak larut asam, karena diperoleh setelah perhitungan ADF. Begitu juga dengan selulosa yang terhitung merupakan polisakarida yang tidak larut dalam deterjen asam. Peningkatan nilai lignin dan selulosa pada sampel dengan perendaman basa disebabkan adanya bahan bukan lignin dan selulosa berupa polisakarida lain yang tidak larut dalam deterjen asam setelah perlakuan perendaman. Perubahan komposisi hemiselulosa pada perendaman dengan konsentrasi basa tinggi juga mengakibatkan persentase kandungan selulosa dan lignin dalam bahan meningkat.
Hidrolisis Asam
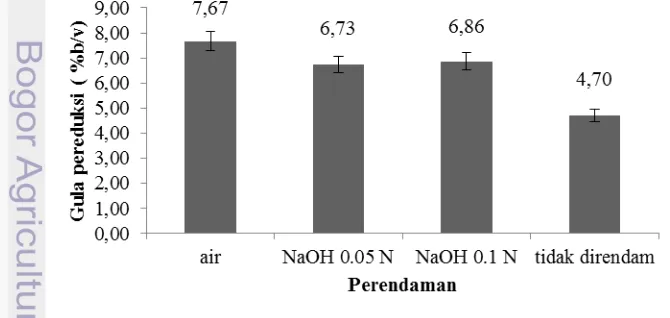
Hasil analisis varian (Anova) pada α=5% menunjukkan bahwa metode perendaman yang berbeda berpengaruh nyata pada kadar gula reduksi setelah hidrolisis. Uji lanjut Duncan menunjukkan bahwa metode tanpa perendaman berbeda nyata dengan ketiga metode perendaman lainnya. Tabel Anova dan uji lanjut Duncan dapat dilihat pada Lampiran 3. Kandungan gula pereduksi terendah terdapat pada sampel tidak direndam dan tertinggi terdapat pada cairan hidrolisat sampel perendaman air (dapat dilihat pada Gambar 3). Perlakuan perendaman dengan menggunakan air maupun basa NaOH (0.05 N dan 0.1 N) meningkatkan tingkat hidrolisis asam sehingga kadar gula pereduksinya lebih tinggi dari perlakuan tanpa perendaman.
13 Hidrolisis pada bahan yang mengandung selulosa dipengaruhi oleh konsentrasi asam, waktu hidrolisis, dan konsentrasi padatan. Semakin tinggi konsentrasi asam, maka semakin banyak ion (H+) yang terbentuk, dan reaksi hidrolisis untuk memecah senyawa polisakarida menjadi monosakarida semakin besar (Cleanments dan Beek 1985). Namun, tingginya konsentrasi asam yang digunakan dapat menghasilkan produk sisa berupa HMF (5-hydroxy methyl furfural) yang akan menghambat proses fermentasi serta menimbulkan pencemaran lingkungan.
Meskipun karbohidrat meningkat seiring meningkatnya konsentrasi basa untuk perendaman, kandungan gula pereduksi setelah hidrolisis pada sampel perendaman air lebih tinggi dari kandungan gula pereduksi pada sampel dengan perlakuan lainnya, yaitu sebesar 7.67% (v/v). Namun, sampel perendaman dengan air maupun basa menunjukkan peningkatan kandungan gula pereduksi jika dibandingkan dengan sampel yang tidak mengalami perendaman. Hidrolisis asam juga dapat menghasilkan gula non reduksi, yaitu gula yang gugus karbonilnya berikatan dengan monosakarida lain sehingga tidak bebas lagi.
Sampel kering yang tidak dibilas setelah proses perendaman mengakibatkan pH sampel belum netral pada saat hidrolisis. Hidrolisis menjadi terhambat, karena pemberian asam sulfat 1% (v/v) untuk hidrolisis akan menetralkan sampel terlebih dahulu sebelum memecah polisakarida kompleks pada rumput laut. Selain pembilasan dan konsentrasi asam, konsentrasi padatan juga mempengaruhi kandungan gula pereduksi setelah hidrolisis. Semakin tinggi konsentrasi padatan, semakin banyak kandungan polisakarida pada bahan yang dapat dikonversi menjadi gula sederhana sehingga meningkatkan kadar gula pereduksi. Peningkatan konsentrasi padatan diimbangi dengan peningkatan konsentrasi asam. Selain karena asam sulfat 2% (v/v) optimum untuk hidrolisis dengan konsentrasi padatan 15% (b/v) pada penilitian Kusuma (2012), asam sulfat 1% (v/v) belum mampu menghidrolisis sampel secara keseluruhan pada konsentrasi padatan 15% (v/v). Padatan pada hasil hidrolisis menggunakan asam sulfat 1% masih agak keras dan belum hancur. Perbandingan kandungan gula pereduksi dapat dilihat pada Gambar 4.
14
Fermentasi
Konsentrasi gula pereduksi pada media hidrolisat menurun setelah ditambah dengan kultur S. cerevisiae. Hal ini disebabkan terjadinya pengenceran pada saat penambahan kultur. Konsumsi gula serta konversi gula menjadi etanol oleh S. cerevisiae selama fermentasi mengakibatkan kandungan gula pereduksi juga semakin menurun (dapat dilihat pada Gambar 5).
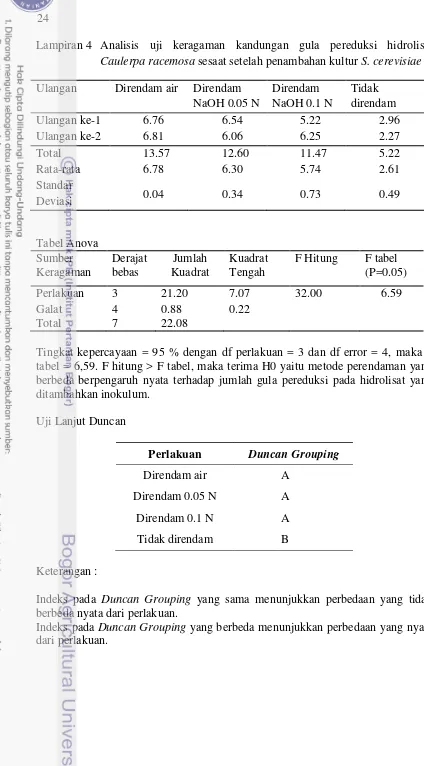
Hasil analisis varian menunjukkan bahwa metode perendaman yang berbeda berpengaruh nyata pada kadar gula reduksi setelah penambahan kultur S. cerevisiae dan setelah fermentasi selama 4 hari. Uji lanjut Duncan menunjukkan bahwa pada kadar gula pereduksi setelah penambahan kultur, metode tanpa perendaman berbeda nyata dengan ketiga metode perendaman lainnya. Uji lanjut Duncan juga menunjukkan bahwa pada kadar gula pereduksi setelah fermentasi 4 hari, metode tanpa perendaman dan metode perendaman air berbeda nyata dengan ketiga metode perendaman lainnya. Tabel Anova dan uji lanjut Duncan dapat dilihat pada Lampiran 4 dan 5.
Gambar 5 Kandungan gula pereduksi setelah penambahan kultur S. cerevisiae dan setelah fermentasi 4 hari
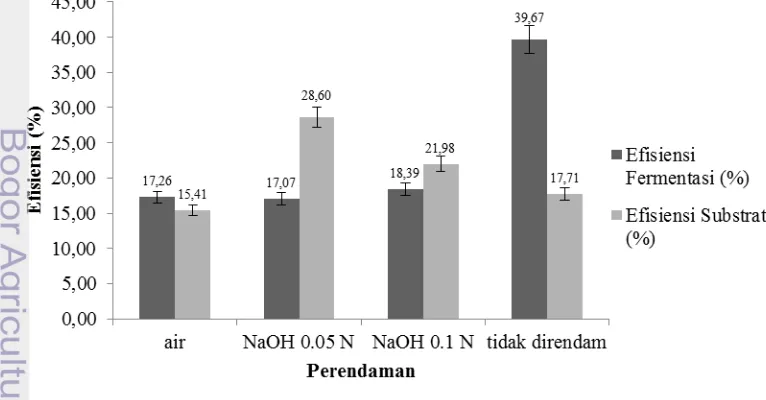
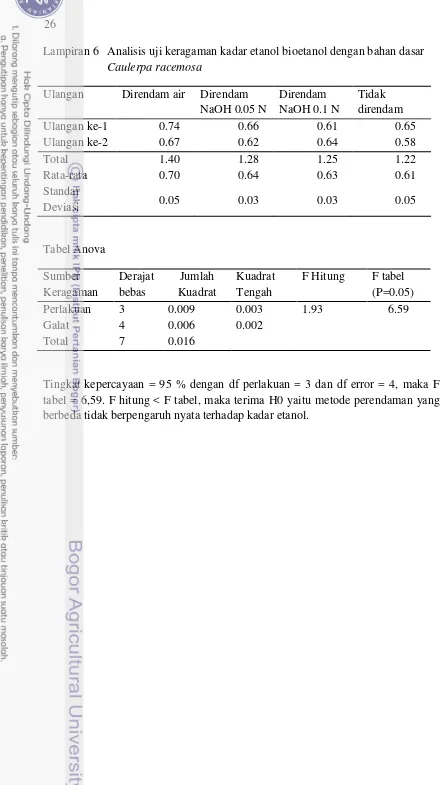
Gula pereduksi pada hidrolisat setelah ditambahkan inokulum meningkat hingga tiga kali lipat setelah rumput laut mengalami treatment. Namun, hasil analisis varian menunjukkan bahwa metode perendaman yang berbeda tidak berpengaruh nyata pada kadar etanol yang diperoleh, walaupun sampel dengan perendaman air dan basa NaOH menghasilkan kadar etanol yang lebih tinggi dari sampel perendaman air. Tabel Anova dapat dilihat pada Lampiran 6. Kadar etanol terbesar diperoleh pada bioetanol dari sampel dengan perendaman air yaitu sebesar 0.70% (v/v) dengan efisiensi fermentasi 17.26% (dapat dilihat pada Gambar 6 dan 7).
15 perlakuan perendaman. Hal ini disebabkan setelah proses hidrolisis asam, penetralan hidrolisat digunakan dengan basa kuat NaOH 10%. Penetralan dengan NaOH menyebabkan pembentukan garam yang dapat meningkatkan salinitas hidrolisat dan berpotensi menghambat produksi etanol oleh mikroorganisme (Setyaningsih et al. 2011). Penggunaan NaOH pada sampel dengan perlakuan perendaman lebih tinggi dari sampel tidak direndam. Oleh karena itu, efisiensi fermentasi sampel dengan treatment perendaman menjadi lebih rendah karena garam yang terbentuk akan lebih banyak seiring meningkatnya penggunaan NaOH.
Gambar 6 Kadar etanol C. racemosa
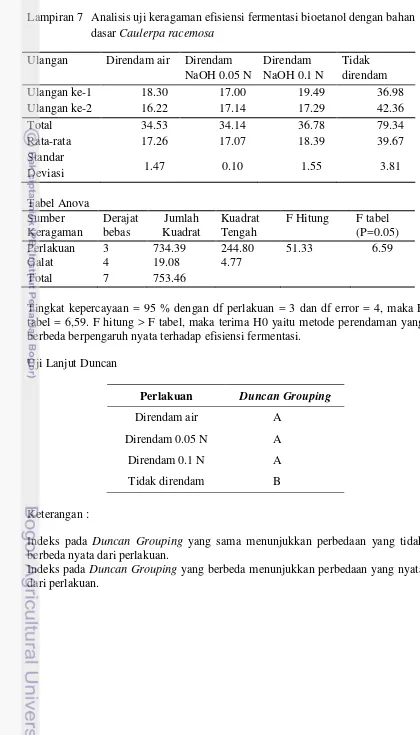
Efisiensi substrat dihitung dari konsumsi gula oleh S. cerevisiae selama proses fermentasi. Meskipun gula yang dikonsumsi tidak terlalu tinggi, efisiensi fermentasi tertinggi terdapat pada sampel tanpa perendaman. Selain karena penggunaan NaOH untuk penetralan hidrolisat, konsumsi gula yang terlalu tinggi dapat menghambat pertumbuhan mikroba dan menghambat produksi etanol sehingga efisiensi fermentasinya menjadi lebih rendah.
16
SIMPULAN DAN SARAN
Simpulan
Hasil analisis proksimat menunjukkan sebagian besar komposisi kimia Caulerpa racemosa adalah karbohidrat dan serat kasar. Sampel perendaman air memiliki karbohidrat sebesar 36.69% dan serat kasar sebesar 40.87%. Sampel perendaman NaOH 0.05 N memiliki karbohidrat sebesar 36.12% dan serat kasar sebesar 44.50%. Sampel perendaman NaOH 0.1 N karbohidrat sebesar 38.97% dan serat kasar sebesar 46.73%.
Kelarutan hemiselulosa dalam deterjen asam meningkat setelah perendaman, terutama pada perendaman air. Kandungan hemiselulosa pada perendaman basa NaOH 0.05 N dan NaOH 0.1 N juga meningkat, namun kelarutan bahan dalam deterjen asam masih lebih rendah daripada sampel perendaman air. Kandungan lignin dan selulosa mengalami penurunan setelah perlakuan perendaman, namun meningkat seiring peningkatan konsentrasi basa untuk perendaman. Peningkatan nilai lignin dan selulosa seiring meningkatnya konsentrasi basa disebabkan adanya bahan bukan lignin dan selulosa berupa polisakarida lain yang tidak larut dalam deterjen asam setelah perlakuan perendaman. Turunnya kandungan hemiselulosa seiring meningkatnya konsentrasi basa NaOH untuk perendaman mengakibatkan persentase kandungan selulosa dan lignin meningkat.
Hasil penelitian menunjukkan bahwa perlakuan perendaman, baik dengan air maupun basa NaOH, berpengaruh nyata pada kadar gula pereduksi setelah hidrolisis dan kadar gula pereduksi tertinggi pada sampel perendaman air. Hal ini disebabkan bahan lebih mudah dihidrolisis setelah perlakuan perendaman. Hidrolisat sampel perendaman air memiliki kadar gula pereduksi sebesar 7.67% (b/v). Namun, perendaman yang berbeda tidak berpengaruh nyata pada kadar etanol yang diperoleh. Kadar etanol pada bioetanol dari sampel dengan perendaman air yaitu 0.70 % (v/v) dengan efisiensi fermentasi 17.26%.
Saran
Sampel yang telah direndam dengan basa perlu mengalami pembilasan dengan air hingga pH sampel netral. Dengan demikian, hidrolisis dapat berlangsung lebih optimum dan kadar gula pereduksi meningkat. Konsentrasi basa NaOH yang digunakan untuk pretreatment dapat ditingkatkan untuk meningkatkan kadar gula pereduksi dan kadar etanol.
DAFTAR PUSTAKA
[DKP] Dinas Kelautan Perikanan. 2008. Statistik Perikanan Indonesia 2008. Jakarta: Departemen Kelautan dan Perikanan RI.
[DKP] Dinas Kelautan Perikanan. 2009. Profil Rumput Laut Indonesia. Jakarta: Direktorat Produksi Press.
17 Anonim. 2012. Pengetahuan Bahan Makanan Ternak. Bogor: CV Nutri Sejahtera. Ariestaningtyas Y. 1991. Pemanfaatan Tongkol Jagung untuk Produksi Enzim
Selulase oleh Trichoderma viride. [Skripsi]. Fateta, IPB, Bogor.
Berry DR.1988. Physiology of Industrial Fungi. Blackwell Scientific Publications, Oxford, London.
Choi CH, dan Mathews AP. 1996. Two Step Acid Hydrolysis Process Kinetics in The Saccharification of Low Grade Biomassa: Experimental Studies on The Formation and Degradation of Sugar. Bioresource Technology. 58 (5):101-106.
Cleanments DI, dan Beek SR. 1985. Best Available Technology Plants for Conversion of Cotton Residues (Cellulose Waste to Etanol. Biomass and Bioenergy. 23: 367-380.
Costa LS, Fidelis GP, Cordeiro SL, Oliveira RM, Sabry DA, Camara RBG. 2010. Biological Activities of Sulfated Polysaccharides from Tropical Seaweeds. Biomedicine and Pharmacotherapy. 64: 21-28.
Dennis C, Morancais M, Li M, Deniaud E, Gaudin P, Wielgosz-Collin G, Barnathan G, jaouen P, Fleurence J. 2010. Study of The Chemical Composition of Edible Red Macroalgae Grateloupia turuturu from Brittany (France). Food Chemistry (119) 913-917.
Fan LT, Lee YH, Gharpuray MM. 1982. The Nature of Lignocellulosics and Their Pretreatments for Enzymatic Hydrolisis. Adv. Biochemistry Eng. 23: 158-187. Fengel DG, dan Wegener. 1995. Wood: Chemistry, Ultrastructure, Reactions.
Penerjemah: S. Hardjono. UGM Press, Yogyakarta.
Fridia T. 1989. Pengaruh Cara Delignifikasi Terhadap Sakarifikasi Limbah Lignoselulosik. [Skripsi]. Fateta, IPB, Bogor.
Ghosh P, Adhikari U, Ghosal PK, Pujol CA, Carlucci MJ, Damonte EB, Ray B. 2004. In Vitro Anti-herpetic Activity of Sulfated Polysaccharides Fractions from Caulerpa racemosa. Phytochemistry. 65: 3151-3157.
Harrison JS, dan JGJ Graham.1970. Yeast in Distilery Practice. Academic press, London.
Hasugian N. 2009. Evaluasi Pakan. http://novalinahasugian.blogspot.com [10 September 2013].
Herbreteau F, Coiffard L, Derrien JM, Holtz DR. 1997. The Fatty Acid Composition of Five Species of Macroalgae. Botanica Marina. 40: 25-27. Holtzapple MT. 1993. Cellulose. In: Encylopedia of Food Science, Food
Technologi and Nutrition, 2: 2731-2738. London: Academic Press.
Kunkee KD, dan Mardon CJ. 1970. Yeast Wine Making forthe Production of Bioethanol. Korea: Bull.
Kusuma AH. 2012. Proses Hidrolisis Asam Senyawa Polisakarida Rumput Laut Caulerpa racemosa, Sargassum crassifolium, dan Gracilaria salicornia. [Skripsi]. Fakultas Perikanan dan Ilmu Kelautan, IPB, Bogor.
Miller GL. 1959. Use of Dinitrosalicylic Acid Reagent for Determination of Reducing Sugar. Anal Chem. 31:426-428.
Oishima M. 1965. Wood Chemistry Process Engineering Aspect. New York: Noyes Development Corp.
Pearson D. 1970. The Chemical Analysis of Food. J&A Churchil, New York. Poncomulyo T, Maryani H, Kristiana L. 2006. Budidaya dan Pengolahan Rumput
18
Prescott SC dan CG Dunn.1981. Industrial Microbiology. McGraw Hill Book Co., New York.
Prud'homme Van Reine WF dan Trono GC.2001. Plant Resource of South Asia. Backbuys Pub, Leiden.
Reed G, dan Rehm HJ. 1983. Biotechnology (Vol. III). Industrial Microbiology. AVI Publishing Company Inc, Connecticut.
Santi RA, Sunarti TC, Santoso D, Triwisari DA. 2012. Komposisi Kimia dan Profil Polisakarida Rumput Laut Hijau. Jurnal Akuatika Vol. III (2): Hal. 105-114 ISSN 0853-2523.
Setyaningsih D, Chasanah E, Utomo BS, Krismatin A, Yudiarto A, Windarwati S. 2011. Produksi Bioetanol Makroalga Melalui Teknik Sakarifikasi Enzimatik, Adaptasi Ragi dan Co-Fermentasi Simultan. [Laporan Penelitian]. IPB, Bogor. Setyaningsih D, Windarwati S, Khayati I, Muna, N, Hernowo P. 2012. Acid
Hydrolysis Technique and Yeast Adaptation to Increase Red Macroalgae Bioethanol Production. Int J Environ Bioener. 3(2):98-110.
Shafik MA dan Manawy IM. 2008. Physiologi and structural Characteristics of Three Varieties of C. racemosa (Forsskal) J. Agardh. From the Mediterranean Sea. Scientific Research. 3 (1):97-110.
Shevchenko NM, Burtseva YV, Zvyagintseva TN, Makareva TN, Sergeeva OS, Zakharenko AM, Isakow VV, Linh NT, Hoa NX, Ly BM, Huyen PV. 2009. Polysaccharides and Sterols from Green Algae. Chemistry of Natural Compounds. 45 (1): 50-54.
SNI 01-2891-1992. Cara Uji Makanan dan Minuman. Jakarta: Pusat Standarisasi Industri, Departemen Industri.
Turangan FAC. 2000. Pertumbuhan, Variasi Intraspesifik, Biomassa Total, dan Kandungan Nutrisi Alga Hijau Caulerpa racemosa J. Agardh di Perairan Tongkaine, Kota Manado, Sulawesi Utara. Summary Artikel Jurusan MSP, Fakultas Perikanan, Universitas Sam Ratulangi, Manado.
Wijesekara I, Ratih P, dan Se-Kwon K. 2011. Biological Activities and Potential Health benefits of Sulfated Polysaccharides Derived from Marine Algae. Carbohydrate Polimers. 84: 14-21.
Winarno FG. 2008. Kimia Pangan dan Gizi. Bogor: M-BRIO Press.
Wong KH, dan Cheung PC. 2000. Nutrional Evaluation of Some Subtropical Red and Green Seaweed Part I-Proximate Composition, Amino Acid Profiles and Some Physical-Chemical Properties. Food Chemist. 71 (4): 475-482.
Wook Koo B, Yong Kim H, Park N, Min Lee H, Yeo, dan I. 2011. Organosolv Pretreatment of Liriodendron tulipifera and Simultaneous Saccharification and Fermentation for Bioethanol Production. Biomass and Bioenergy. 35 (2011) 1833-1840.
Yanagisawa M, Kanami N, Osamu A, dan Kiyohiko N. 2011. Production of High Concentrations of Bioethanol from Seaweed that Contain Easily Hydrolysable Polysaccharides. Process Biochemistry 46 (2011) 2111-2116.
19 Lampiran 1 Prosedur Uji Proksimat (SNI 1992)
1. Kadar Air
1-2 gram sampel ditimbang pada botol timbang bertutup yang diketahui bobotnya, kemudian dikeringkan pada oven dengan suhu 105°C selama 3 jam dan didinginkan dalam desikator. Bobot botol timbang berisi sampel dihitung hingga diperoleh bobot tetap.
Kadar air = W1 x 100%
W Keterangan :
W = bobot sampel sebelum dikeringkan (gram) W1 = kehilangan bobot setelah dikeringkan (gram)
2. Abu
2-3 gram sampel ditimbang dalam cawan porselen yang telah diketahui bobotnya. Cawan berisi sampel diarangkan di atas nyala pembakar, lalu diabukan dalam tanur listrik pada suhu maksimum 550°C sampai pengabuan sempurna (sesekali pintu tanur dibuka sedikit agar oksigen bisa masuk). Kemudian cawan berisi sampel didinginkan dalam eksikator, dan ditimbang sampai bobot tetap.
Kadar abu = W1– W2 x 100%
W Keterangan :
W = bobot sampel sebelum diabukan (gram)
W1 = bobot contoh + cawan sesudah diabukan (gram)
W2 = bobot cawan kosong (gram)
3. Protein
0.51 gram sampel ditimbang dan dimasukkan ke dalam labu kjeldahl 100 ml. 2 gram campuran selen dan 25 ml H2SO4 pekat ditambahkan, lalu
dipanaskan di atas pemanas listrik atau api pembakar sampai mendidih dan larutan menjadi jernih kehijau-hijauan (sekitar 2 jam). Larutan dibiarkan dingin, kemudian diencerkan dan dimasukkan ke dalam labu ukur 100 ml dan ditera hingga tanda garis. 5 ml larutan dipipet dan dimasukkan ke dalam alat penyuling dan ditambahkan 5 ml NaOH 30% serta beberapa tetes indikator PP. Larutan disulingkan ± 10 menit. 10 ml larutan borat 2% yang telah dicampur indikator digunakan sebagai penampung. Ujung pendingin dibilas dengan air suling. Larutan dititar menggunakan HCl 0.01 N. Blanko dikerjakan.
Kadar protein = (V1– V2) x N x 0.014 x Fk x fp x 100%
W Keterangan :
W = bobot sampel (gram)
V1 = volume HCl 0.01 N yang dipergunakan untuk penitaran contoh
V2 = volume HCl 0.01 N yang dipergunakan untuk penitaran blanko
20
Fk = faktor konversi untuk protein dan makanan secara umum Fp = faktor pengenceran
4. Lemak
1-2 gram contoh ditimbang dan dimasukkan ke dalam selongsong kertas yang dialasi dengan kapas. Selongsong kertas tersebut disumbat dengan kapas, dikeringkan dalam oven pada suhu tidak lebih dari 80°C selama kurang lebih satu jam, kemudian dimasukkan ke dalam alat soxhlet vyang telah dihubungkan dengan labu lemak berisi batu didih yang telah dikeringkan dan diketahui bobotnya. Selongsong berisi sampel diekstrak dengan heksana atau pelarut lemak lainnya selama kurang lebih 3 jam. Heksana disuling dan ekstrak lemak dikeringkan dalam oven pada suhu 105°C. Ekstrak lemak didinginkan dalam eksikator dan ditimbang hingga tercapai bobot tetap.
Kadar lemak = W2– W1 x 100%
W Keterangan :
W = bobot sampel (gram)
W1 = bobot labu lemak sebelum ekstraksi (gram)
W2 = bobot labu lemak sesudah ekstraksi (gram)
5. Karbohidrat (metode Luff Schoorl)
5 gram sampel ditimbang ke dalam erlenmeyer 500 ml dan ditambahkan dengan 200 ml larutan HCl 3%, kemudian dididihkan selama 3 jam dengan pendingin tegak, setelah itu dinetralkan dengan dengan larutan NaOH 30% (ditambahkan indikator fenolftalin). Isi larutan dipindahkan ke dalam labu ukur 500 ml dan ditera kemudian disaring. 10 ml hasil saringan dipipet ke dalam erlenmeyer 500 ml, lalu ditambahkan 25 ml larutan Luff Schoorl (dengan pipet) dan beberapa butir batu didihserta 15 ml air suling. Campuran tersebut dipanaskan dengan nyala tetap dan diusahakan agar larutan dapat mendidih dalam waktu 3 menit. Campuran didihkan selama 10 menit (dihitung dari saat mulai mendidih) kemudian dengan cepat didihkan dalam bak berisi es. Setelah dingin, campuran ditambahkan dengan 15 ml larutan KI 20% dan 25 ml H2SO4
25% perlahan-lahan. Titar secepatnya dengan larutan Na-tiosulfat 0,1 N (dengan indikator pati 0.5%). Blanko dibuat.
Kadar glukosa = W1– fp x 100%
W
Kadar karbohidrat = 0,90 x kadar glukosa Keterangan :
W1 = bobot sampel (mg)
W = glukosa yang terkandung untuk ml Na-tio yang digunakan (mg, dari Tabel 3)
21
2-4 gram sampel yang telah bebas lemak dan dikeringkan ditimbang dan dimasukkan ke dalam erlenmeyer 500 ml. Sampel ditambahkan dengan 50 ml larutan H2SO4 1.25%, kemudian didihkan dengan menggunakan pendingin
22
Lampiran 2 Uji Gula Pereduksi metode DNS (Miller 1959)
Gula pereduksi merupakan gula yang mampu mereduksi dan mengubah gugus aldehid dan keton menjadi karboksilat. Uji gula pereduksi berupa tahapan proses persiapan pereaksi asam 3,5 dinitrosalisilat (DNS), penentuan kurva standar asam 3,5 dinitrosalisilat, dan penentuan kandungan gula pereduksi.
1. Persiapan pereaksi Asam 3,5 Dinitrosalisilat (DNS)
Sebanyak 10.6 gram asam 3,5 dinitrosalisilatdan 19.8 NaOH dilarutkan dalam 1.416 ml akuades. Larutan ditambahkan dengan 306 gram Na-K Tartarat, 7.6 gram fenol yang dicairkan pada suhu 50°C dan 8.3 gram Na-Metabisulfit. Larutan diaduk hingga merata lalu dititrasi dengan HCl 0.1 N dengan indikator phenolphtalein.
2. Penentuan Kurva Standar
Penentuan kurva standar dibuat dengan mengukur absorbansi sampel untuk mengetahui nilai kandungan gula pereduksi glukosa pada selang 10-50 ppm, kemudian kadar gula pereduksi ditentukan dengan metode DNS. Hasil yang didapat kemudian diplotkan ke dalam grafik secara linear.
3. Penentuan Gula Pereduksi
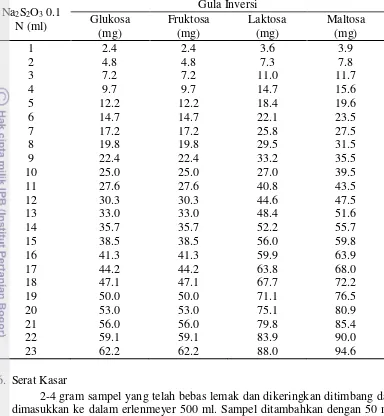
23 Lampiran 3 Analisis uji keragaman kandungan gula pereduksi hidrolisat
Caulerpa racemosa setelah hidrolisis
Ulangan Direndam air Direndam NaOH 0.05 N tabel = 6,59. F hitung > F tabel, maka terima H0 yaitu metode perendaman yang berbeda berpengaruh nyata terhadap jumlah gula pereduksi pada hidrolisat.
Uji Lanjut Duncan
Indeks pada Duncan Grouping yang sama menunjukkan perbedaan yang tidak berbeda nyata dari perlakuan.
24
Lampiran 4 Analisis uji keragaman kandungan gula pereduksi hidrolisat Caulerpa racemosa sesaat setelah penambahan kultur S. cerevisiae
Ulangan Direndam air Direndam NaOH 0.05 N tabel = 6,59. F hitung > F tabel, maka terima H0 yaitu metode perendaman yang berbeda berpengaruh nyata terhadap jumlah gula pereduksi pada hidrolisat yang ditambahkan inokulum.
Indeks pada Duncan Grouping yang sama menunjukkan perbedaan yang tidak berbeda nyata dari perlakuan.
25 Lampiran 5 Analisis uji keragaman kandungan gula pereduksi hidrolisat
Caulerpa racemosa setelah fermentasi 4 hari
Ulangan Direndam air Direndam NaOH 0.05 N tabel = 6,59. F hitung > F tabel, maka terima H0 yaitu metode perendaman yang berbeda berpengaruh nyata terhadap jumlah gula pereduksi pada hidrolisat setelah fermentasi selama 4 hari.
Indeks pada Duncan Grouping yang sama menunjukkan perbedaan yang tidak berbeda nyata dari perlakuan.
26
Lampiran 6 Analisis uji keragaman kadar etanol bioetanol dengan bahan dasar Caulerpa racemosa
Ulangan Direndam air Direndam NaOH 0.05 N
Direndam NaOH 0.1 N
Tidak direndam
Ulangan ke-1 0.74 0.66 0.61 0.65
Ulangan ke-2 0.67 0.62 0.64 0.58
Total 1.40 1.28 1.25 1.22
Rata-rata 0.70 0.64 0.63 0.61
Standar
Deviasi 0.05 0.03 0.03 0.05
Tabel Anova Sumber Keragaman
Derajat bebas
Jumlah Kuadrat
Kuadrat Tengah
F Hitung F tabel (P=0.05)
Perlakuan 3 0.009 0.003 1.93 6.59
Galat 4 0.006 0.002
Total 7 0.016
27 Lampiran 7 Analisis uji keragaman efisiensi fermentasi bioetanol dengan bahan
dasar Caulerpa racemosa Ulangan Direndam air Direndam
NaOH 0.05 N tabel = 6,59. F hitung > F tabel, maka terima H0 yaitu metode perendaman yang berbeda berpengaruh nyata terhadap efisiensi fermentasi.
Uji Lanjut Duncan
Indeks pada Duncan Grouping yang sama menunjukkan perbedaan yang tidak berbeda nyata dari perlakuan.
28
RIWAYAT HIDUP
Penulis dilahirkan di Bogor, 3 Mei 1992. Penulis adalah putri tunggal Almarhum Bapak Buchori Hidayat dan Ibu Indriaty Elizabeth Tobing.
Tahun 2006-2009 penulis menyelesaikan pendidikan di SMA Negeri 3 Bogor. Pada tahun 2009, penulis diterima sebagai mahasiswi Institut Pertanian Bogor, Fakultas Teknologi Pertanian, Departemen Teknologi Industri Pertanian melalui jalur USMI (Undangan Seleksi Masuk IPB).
Selama masa kuliah di Institut Pertanian Bogor, penulis menjadi tutor mata kuliah Pengantar Matematika dan Kalkulus untuk mahasiswa Tingkat Persiapan Bersama (TPB) tahun 2011-2012. Selain itu, penulis menjadi asisten Praktikum Bioproses tahun 2013. Penulis juga pernah menjadi anggota organisasi internal kampus yaitu, Departemen Komunikasi, Informasi, dan Jurnalistik Badan Eksekutif Mahasiswa Fakultas Teknologi Pertanian tahun 2011-2012 dan anggota Himpunan Mahasiswa Teknologi Pertanian (Himalogin) IPB.