PENGGUNAAN EKSTRAK TEPUNG PUPA ULAT SUTERA
(
Bombyx mori
) DALAM PAKAN DAN KINETIKA DARAH
TUBUH PUYUH (
Coturnix coturnix
)
NOVITA ANGGRAENI
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA*
Dengan ini saya menyatakan bahwa tesis berjudul Penggunaan Ekstrak Tepung Pupa Ulat Sutera (Bombyx mori) Dalam Pakan dan Kinetika Darah Tubuh Puyuh (Coturnix coturnix) adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apapun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Agustus 2015
RINGKASAN
NOVITA ANGGRAENI. Penggunaan Ekstrak Tepung Pupa Ulat Sutera (Bombyx mori) Dalam Pakan dan Kinetika Darah Tubuh Puyuh (Coturnix coturnix). Dibimbing oleh ACHMAD FARAJALLAH dan DEWI APRI ASTUTI.
Pupa ulat sutera merupakan limbah atau hasil samping industri pemintalan benang sutera. Pupa ulat sutera dalam bentuk tepung pupa banyak digunakan dalam pakan unggas, karena memiliki kandungan protein tinggi. Penemuan terbaru menunjukkan bahwa penggunaan tepung pupa ulat sutera pada ikan Red sea bream dalam bentuk ekstrak dapat meningkatkan respon kekebalan dan kemampuan menghambat beberapa mikroorganisme patogen. Tujuan dari penelitian ini untuk mengkaji penggunaan tepung pupa ulat sutera (Bombyx mori) berbasis ekstrak alkohol dalam pakan dan kinetika darah tubuh puyuh (Coturnix coturnix).
Polisakarida silkrosa diekstraksi menggunakan pelarut ethanol 95%. Polisakarida silkrosa dipekatkan dengan menggunakan rotary vacuum evaporator. Ekstrak tepung pupa diberikan langsung secara oral pada puyuh petelur umur 7 minggu dengan 7 perlakuan dan masing-masing 5 ulangan, yaitu R0 = ransum tanpa ekstrak tepung pupa, R1 = ransum + 1% ekstrak tepung pupa, R2 = ransum + 10% ekstrak tepung pupa, R3 = ransum + 1% residu ekstrak tepung pupa, R4 = ransum + 10% residu ekstrak tepung pupa, R5 = ransum + 1% tepung pupa, R6 = ransum + 10% tepung pupa. Peubah yang diamati adalah gambaran hematologi darah meliputi: jumlah leukosit, eritrosit dan diferensiasi leukosit. Kinetika darah puyuh (leukosit) diamati pada 12, 24 dan 48 jam setelah dicekok perlakuan dengan menghitung jenis sel darah putih. Pengambilan sampel darah dilakukan dua tahap. Tahap pertama (minggu ke-3 masa pemeliharaan) pada 12, 24 dan 48 jam setelah perlakuan. Tahap ke dua (31 hari setelah perlakuan cekok) pada 12, 24 dan 48 jam setelah dicekok.
Penggunaan ekstrak tepung pupa ulat sutera dosis 10% dapat meningkatkan jumlah sel darah putih terutama limfosit dan monosit puyuh petelur pada waktu 12 dan 24 jam setelah dicekok,dan mampu mempertahankan jumlah sel darah putih pada periode 31 hari setelah puyuh dicekok
SUMMARY
NOVITA ANGGRAENI. The Use of Silkworm Pupae (Bombyx mori) Powder Extract in Feed on The Body’s Blood Kinetics Quails (Cortunix cortunix).Supervised by ACHMAD FARAJALLAH and DEWI APRI ASTUTI
Silkworm pupae is a by-product of silk yarn spinning industry. Silkworm pupae in the form of powder has been widely used in poultry feed, because it has a high protein content. Recent findings indicate that the use of silkworm pupae powder on red bream fish in the form of extract contains of quite high polysaccharides silkrose, which can enhance the immune response and ability in inhibiting some pathogenic microorganisms. The aim of this research was to assess the use of silkworm pupae (Bombyx mori) powder based on ethanol extract on the body’s blood kinetics quails (Coturnix coturnix).
The process of obtaining polysaccharide silkrose begins with the extraction process using ethanol 95% as solvents, by maceration. Supernatant obtained in the form of polysaccharides silkrose was kept for being concentrated, while the residu of pupae powder extract was stored in 4˚C. Before it was used, polysaccharides silkrose was concentrated by using a rotary vacuum epavorator. To determine the ability of the polysaccharide silkrose as a modulator of the immune system by feeding on orally laying quail age of 7 weeks. Each quail in this study was set using completely randomized design with 7 treatments and 5 replications Each treatments consisted of R0 (feed without pupae powder extract), R1 (feed + 1 % of pupae powder extract), R2 (feed + 10% of pupae powder extract), R3 (feed + 1 % of residue of pupae powder extract), R4 (feed + 10% of residue of pupae powder extract), R5 (feed + 1 % of pupae powder, R6 (feed + 10% of pupae powder). The parameters were measured i.e blood hematology profiles included the number of leukocytes, erythrocytes and leukocytes differentiation. Blood kinetics was observed at 12, 24 and 48 hours after force feeding with the count of white blood cells type. Blood profile was evaluated in two stages. At the first stage (the 3rd week of the maintenance period), blood samples were taken from quail at 12th, 24th and 48th hour after force feeding treatment. This was done in order to observe the effect of treatment towards the number of leukocytes. The second stage (31 days after force feeding treatment), blood samples were taken from quail at 12th, 24th and 48th hour after force feeding which were done to observe the effect of treatment is able to maintain the number of leukocytes.
average number of leukocytes of laying quail on 48th hour of observation amount to 39.60 x 103/mm3. All treatments had no effect on the number of erythrocytes, hemoglobin, hematokrit and leukocyte differentiation. The increased value of leukocytes, especially the lymphocytes, and monocytes on quail with 10% pupae powder extract treatment (R2) in a condition of quail egg-laying period and ambient temperature heat, showed an increasing of immune system on quail.
The use of silkworm pupae powder extract 10% dose may increase the number of white blood cells, especially lymphocytes and monocytes laying quail at 12 and 24 hours after feedings, and were able to maintain the number of white blood cells in the period of 31 days after the quail feedings.
© Hak Cipta Milik IPB, Tahun 2015
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
Program Studi Biosains Hewan
PENGGUNAAN EKSTRAK TEPUNG PUPA ULAT SUTERA
(
Bombyx mori
) DALAM PAKAN DAN KINETIKA DARAH
TUBUH PUYUH (
Coturnix coturnix
)
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
BOGOR 2015
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah SWT atas segala karunia-Nya sehingga karya ilmiah ini berhasil diselesaikan. Judul yang dipilih adalah Penggunaan Ekstrak Tepung Pupa Ulat Sutera (Bombyx mori) dalam Pakan dan Kinetika Darah Tubuh Puyuh (Coturnix coturnix). Pupa ulat sutera merupakan limbah pemintalan sutera yang potensial dijadikan bahan pakan. Sebagian hasil penelitian ini dalam proses publikasi di jurnal ilmiah Media Peternakan Journal of Animal Science and Technology dengan judul “Leukocyte Differentiation Changes of Quails (Coturnix coturnix japonica) Fed Silkworm Pupae (Bombyx mori)
Powder Extract”. Hasil penelitian menunjukkan bahwa ekstrak tepung pupa ulat
sutera sangat potensial dijadikan bahan pakan peningkat sistem kekebalan tubuh. Pemberian ekstrak tepung pupa pada puyuh dapat meningkatkan kinerja leukosit, yaitu limfosit dan monosit, terutama pada puyuh petelur periode produksi.
Terima kasih penulis ucapkan kepada Bapak Dr Ir Achmad Farajallah MSi dan Ibu Prof Dr Dewi Apri Astuti MS selaku pembimbing, serta Ibu Prof Dr Erika Budiarti Laconi MS selaku penguji. Di samping itu, penghargaan penulis sampaikan kepada Ibu Tini Wahyuni dan Bapak Adi Surahman yang membantu persiapan di laboratorium serta di kandang Departemen Biologi, Ibu Lanjarsih SPt dari Laboratorium Nutrisi Ternak Unggas Departemen Ilmu Nutrisi, serta Ibu Asmarida dan Ibu Sri Hartini dari Laboratorium Fisiologi Departemen Anatomi, Fisiologi dan Farmakologi, yang telah membantu selama pengumpulan data. Ungkapan terima kasih juga disampaikan dengan penuh rasa hormat dan penuh kasih serta sayang kepada Bapak H. Komaruddin Effendy dan Mama Hj. Unay Julia (alm), Mimi Panca Dewi MHK, serta Bapak H. Haryono dan Mama Hj. Oyoh Ruchiyah yang selalu mendo’akan untuk keberhasilan penulis. Alhamdulillah ya Allah, telah Engkau titipkan hamba pada orang tua yang sangat menyanyangi hamba. Khusus untuk Suamiku Muhlis SPt, MM terima kasih atas do’a, izin kesabaran dan pengertian yang dicurahkan. Untuk anak-anakku kakak Ghiaz dan ade Nadhif yang ibu sayangi, dengan sepenuh hati ibu ucapkan terima kasih atas do’a yang tulus, motivasi, kesabaran dan pengertian ananda berdua selama ini, sehingga ibu dapat menyelesaikan semuanya. Kepada adik-adikku Dicky -Dewi -Dede -Lembah -Nando dan Zahra, serta seluruh keluarga, terima kasih atas do’a dan motivasi yang diberikan selama ini.
Semoga karya ilmiah ini bermanfaat.
DAFTAR ISI
DAFTAR TABEL xiii
DAFTAR GAMBAR xiii
DAFTAR LAMPIRAN xiii
1 PENDAHULUAN 1
Latar Belakang 1
Tujuan 2
2 METODOLOGI PENELITIAN 2
Lokasi Penelitian 2
Materi 2
Hewan Model 2
Bahan Baku Pakan Puyuh 3
Metode 3
Pembuatan Tepung Pupa Ulat Sutera 3
Ekstraksi Tepung Pupa Ulat Sutera 3
Pemeliharaan 3
Pengambilan Sampel Darah Puyuh 3
Pengamatan Profil Darah Puyuh 4
Rancangan Percobaan 5
Analisis Data 5
3 HASIL DAN PEMBAHASAN 6 Kinetika Rataan Leukosit Darah Puyuh Setelah Perlakuan Cekok (Penelitian Pendahuluan) 6
Kinetika Rataan Leukosit Darah Puyuh (Tahap 1) 7
Profil Hematologi Darah Puyuh (Tahap 1) 8
Kinetika Differensiasi Leukosit Darah Puyuh (Tahap 1) 15
Kinetika Rataan Leukosit Darah Puyuh (Tahap 2) 18
Profil Hematologi Darah Puyuh (Tahap 2) 19
Kinetika Differensiasi Leukosit Darah Puyuh (Tahap 2) 22
4 SIMPULAN DAN SARAN 23
Simpulan 23
Saran 24
DAFTAR PUSTAKA 24
LAMPIRAN 27
DAFTAR TABEL
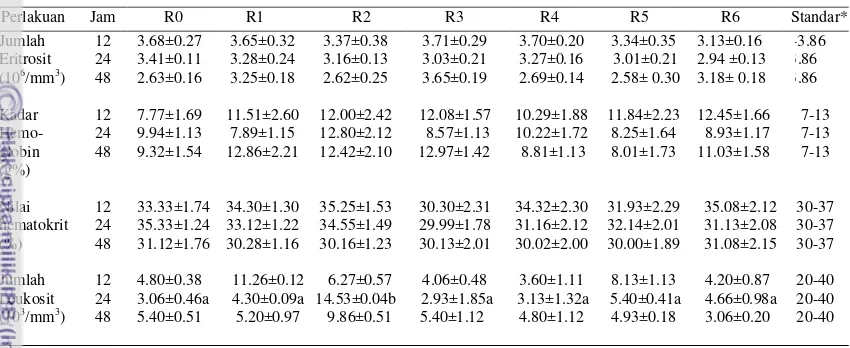
1 Rataan eritrosit, hemoglobin, hematokrit dan leukosit dalam darah puyuh petelur setelah perlakuan cekok pada pengamatan 12, 24 dan 48
jam 9
2 Persentase differensiasi leukosit dalam darah puyuh petelur setelah perlakuan cekok pada pengamatan 12, 24 dan 48 jam 13 3 Rataan eritrosit, hemoglobin, hematokrit dan leukosit dalam darah
puyuh petelur 31 hari setelah perlakuan cekok pada pengamatan 12, 24
dan 48 jam 19
4 Persentase differensiasi leukosit dalam darah puyuh petelur 31 hari setelah perlakuan cekok pada pengamatan 12, 24 dan 48 jam 21
DAFTAR GAMBAR
1 Tepung Pupa Residu ekstrak tepung pupa dan Ekstrak tepung pupa 3
2 Pemberian perlakuan force feeding pada puyuh 3
3 Kinetika rataan leukosit dalam darah puyuh umur setelah perlakuan
cekok (Penelitian Pendahuluan) 6
4 Kinetika rataan leukosit dalam darah puyuh setelah perlakuan cekok 7 5 Kinetika differensiasi leukosit dalam darah puyuh setelah perlakuan
cekok 16
6 Kinetika rataan leukosit dalam darah puyuh 31 hari setelah perlakuan
cekok 18
7 Kinetika differensiasi leukosit dalam darah puyuh 31 hari setelah
perlakuan cekok 22
DAFTAR LAMPIRAN
1 Kandang Penelitian Biologi Departemen Biologi FMIPA IPB 27 2 Komposisi dan kandungan nutrien ransum racikan puyuh petelur 28 3 Prosedur ekstraksi tepung pupa ulat sutera (Bombyx mori) 28
1 PENDAHULUAN
Latar Belakang
Serangga memiliki potensi besar sebagai sumber pangan dan pakan yang sebanding dengan daging dan ikan serta bisa menjadi sumber protein hewani andalan di masa depan (Rumpold dan Schluter 2013). Selain sebagai sumber protein hewan dalam produksi pangan dan pakan, serangga memberikan manfaat farmasi dan medis, yaitu mampu melindungi ternak dari berbagai resiko penyakit yang berbeda. Dalam tubuh serangga, baik pupa maupun dewasa, banyak ditemukan zat bioaktif yang bisa berfungsi sebagai anti kanker, anti tumor, anti virus dan anti mikroba (Hirose et al. 2013). Selain itu, khusus pupa meningkatkan sistem kekebalan tubuh terhadap berbagai penyakit pada manusia dan hewan (Chernysh et al. 2002).
Dalam siklus hidup serangga, telur akan menetas menjadi larva, pupa, kemudian bermetamorfosis dewasa. Dalam tahap-tahapan metamorfosis serangga, fase pupa dalam kondisi puasa tumbuh dalam kokon (pelindung yang keras). Kokon ulat sutera dimanfaatkan benangnya untuk dipintal menjadi benang sutera, sedangkan pupanya dimanfaatkan sebagai pakan hewan budidaya. Produksi kokon untuk sutera di Indonesia sejak tahun 2005-2009 mencapai 166 ton yang menghasilkan sekitar 23 ton benang. Dari proses itu, limbah yang dihasilkan sekitar 143 ton.
Pemanfaatan sisa berupa pupa sudah banyak. Di beberapa negara seperti Korea, Jepang dan Cina dimanfaatkan menjadi makanan ringan, makanan kaleng, makanan alternatif penderita diabetes, lilin serta produk kecantikan seperti sabun dan hair tonic (Yi et al. 2010) Pupa ulat sutera dapat dibuat menjadi tepung pupa yang dapat digunakan sebagai campuran dalam pembuatan pelengkap kue kering (crackers dan flakes), sponge cake, nugget (Astuti dan Clara 2009; Astuti et al. 2014), selain itu pupa ulat sutera dapat dimanfaatkan juga sebagai bioreaktor dalam pengembangan agen antivirus dan sebagai imunostimulan pada vertebrata (Yao et al. 2006; Sweevers et al. 2013; Yeo et al. 2013).
Efek imunostimulan dari pupa ulat sutera diidentifikasi berasal dari polisakarida. Polisakarida dengan berat molekul tinggi dapat mengaktifkan sistem kekebalan bawaan. Polisakarida tersebut merupakan situs pengenal. Polisakarida dipterosa disintesis oleh pupa serangga Diptera seperti melon fly, memiliki berat molekul 1.01x106 mol%, dan polisakarida silkrosa dengan berat molekul 3.15x105 mol%. Keduanya terdiri atas 9 monosakrida, yaitu glucose, D-mannose, D-galactose, D-ribose, L-rhamnose, L-fucose, D-glucoronic acid, N-acetyl-D-glucosamine, dan N-acetyl-D-galactosamine (Ohta et al. 2014). Silkrosa merupakan kelompok polisakarida larut ethanol, sehingga zat bioaktif silkrosa ini dapat diperoleh dari ekstraksi tepung pupa ulat sutera dengan pelarut ethanol.
2
menyerupai antigen dari membran sel. Polisakarida yang ada di sisi luar membran sel ini biasa digunakan sebagai situs pengenal dalam sistem kekebalan tubuh vertebrata.
Dipterosa dan Silkrosa yang diperoleh dari pupa Musca domestica, Bactrocera cucurbitae, Hermetia illucens, Antheraea yamamai dan Bombyx mori mampu mengaktifkan respon kekebalan bawaan untuk melawan mikroorganisme patogen dan infeksi virus (Ohta et al. 2014; Ido et al. 2015). Sebaliknya limbah pupa ulat sutera dalam bentuk tepung pupa yang tidak dimurnikan akan mematikan beberapa sel makrofage tikus (Anggraeni, unpublished). Kemampuan zat bioaktif yang dimiliki oleh serangga dalam mengaktifkan respon kekebalan untuk melawan mikroorganisme patogen dan infeksi virus pada ikan dan mamalia, menjadi alasan dilakukan penelitian untuk mengkaji penggunaan ekstrak tepung pupa ulat sutera (Bombyx mori) pada kinetika darah tubuh puyuh (Coturnix coturnix).
Tujuan Penelitian
Mengkaji penggunaan ekstrak ethanol pupa ulat sutera (Bombyx mori) dalam pakan terhadap kinetika darah tubuh puyuh (Coturnix coturnix).
2 METODOLOGI PENELITIAN
Lokasi Penelitian
Penelitian dilaksanakan pada bulan Juni sampai Desember 2014, bulan September 2014 dilakukan penelitian pendahuluan di Kandang Penelitian Biologi Departemen Biologi FMIPA IPB (Lampiran 1). Persiapan dan pengolahan pakan dilaksanakan di Laboratorium Nutrisi Ternak Unggas Departemen Ilmu Nutrisi Teknologi Pakan FAPET IPB. Analisis darah dilaksanakan di Laboratorium Fisiologi Departemen Anatomi, Fisiologi dan Farmakologi FKH IPB.
Materi
Hewan Model - Puyuh yang digunakan adalah puyuh petelur fase produksi umur 28 hari sebanyak 35 ekor dengan bobot rata-rata 76.36 g/ekor dan dipelihara selama 7 minggu.
Bahan Baku Pakan Puyuh - Bahan baku pakan yang digunakan adalah jagung, dedak padi, bungkil kedelai, tepung ikan, minyak sawit, DCP, CaCO3, NaCl,
3
Metode
1. Pembuatan Tepung Pupa Ulat Sutera
Pupa yang digunakan dalam penelitian ini diperoleh dari Rumah Sutera Alam, Ciapus-Bogor, Jawa Barat. Kokon kering direbus sebelum dipintal. Hasil pemintalan berupa benang dan limbah berupa pupa yang masih terbungkus dengan sedikit sisa benang. Limbah tersebut kemudian dibersihkan dari sisa benangnya. Pupa yang diperoleh kemudian dioven pada suhu 50˚C selama 24 jam hingga kering. Pupa kering kemudian dihaluskan menggunakan blender untuk mendapatkan tepung pupa. Tepung pupa kemudian dijemur kembali di bawah sinar matahari selama satu hari.
2. Ekstraksi Tepung Pupa Ulat Sutera
Ekstraksi pupa mengacu pada metode ekstraksi maserasi menurut Liu dan Zhang (2006), yaitu menggunakan ethanol 95% sebagai pelarut (Lampiran 3). Tepung pupa, residu ekstrak tepung pupa dan pupa ulat sutera (Gambar 1), digunakan sebagai pakan tambahan pada puyuh dengan perlakuan dosis 0% (Kontrol), 1% dan 10%, berdasarkan pada bobot badan mengacu pada penelitian Ido et al. (2015). Pemberian perlakuan dilakukan dengan cara dicekok (force feeding) (Gambar 2).
(a) (b) (c)
Gambar 1 (a) Tepung pupa, (b) Ekstrak tepung pupa, (c) Residu ekstrak tepung pupa
Gambar 2 Pemberian perlakuan force feeding pada puyuh 3. Pemeliharaan
Puyuh dipelihara selama tujuh minggu. Tiga minggu pertama sebagai masa adaptasi dan empat minggu berikutnya masa pengamatan. Puyuh diberi ransum dan air minum ad libitum setiap hari. Pakan diberikan pada pagi dan sore hari pada pukul 06.00 dan 16.00 wib.
4. Pengambilan Sampel Darah Puyuh
4
ditunjukkan melalui peningkatan jumlah rata-rata sel darah putih pada waktu pengamatan 12, 24 dan 48 jam. Perlakuan cekok diberikan pada puyuh pada masa pemeliharaan minggu ke-3, sebanyak satu kali pada pagi hari pukul 06.00 wib. Setelah itu pada tahap pertama, sampel darah diambil secara berurutan pada 12, 24, dan 48 jam setelah pemberian perlakuan. Pengambilan sampel darah tahap dua dilakukan kembali pada minggu ke 4.
5. Pengamatan Profil Darah Puyuh
Jumlah Butir Darah Merah – Dengan menggunakan aspirator pada pipet eritrosit, darah sebanyak 1 ml pada tube dihisap sampai batas angka 0.5 pada pipet eritrosit. Larutan pengencer dihisap sampai tanda 101 yang tertera pada pipet. Tutup kedua ujung pipet dengan ibu jari dan jari telunjuk tangan kanan. Darah disuspensikan dalam larutan Hayem dengan cara membuat gerakan angka delapan. Suspensi kemudian diteteskan ke kamar hitung hemocytometer neubeur. Hasil perhitungan yang diperoleh dikalikan dengan faktor koreksi pengenceran 200x. Setelah jumlah eritrosit didapatkan maka jumlah darah dikalikan dengan 104 butir, untuk mengetahui jumlah eritrosit dalam 1 mm3 darah (Sastradipradja et al. 1989).
a. Kadar Hemoglobin
Kandungan hemoglobin darah diukur dengan menggunakan tabung Sahli. Darah dihisap menggunakan aspirator pipet Sahli sampai batas 0.02 ml, kemudian dimasukkan ke dalam tabung Sahli yang diisi larutan HCl 0.1 N sampai angka 10 (garis paling bawah pada tabung). Tabung Sahli diletakkan antara kedua bagian standar warna dalam alat hemoglobinometer. Suspensi didiamkan selama 3 menit sampai terbentuk asam hematin berwarna coklat, kemudian ditambahkan aquades setetes demi setetes sambil diaduk, sampai warna larutan sama dengan warna standar. Tinggi permukaan suspensi pada tabung Sahli dibaca dengan melihat skala jalur g%. Konsentrasi hemoglobin diukur dalam gram per 100 ml darah (Frandson 1992).
b. Nilai Hematokrit
Darah dalam pipa mikro-kapiler berheparin disentrifusi dengan kecepatan 3000 rpm selama 15 menit. Nilai hematokrit ditentukan dengan mengukur tinggi lapisan eritrosit yang berwarna merah dan dibandingkan terhadap tinggi total darah (Sastradipradja et al. 1989).
Jumlah Butir Darah Putih - Dengan menggunakan aspirator pada pipet leukosit, darah sebanyak 1 ml pada tube dihisap sampai batas angka 0.5 pada pipet lekosit. Larutan pengencer dihisap sampai tanda 11 yang tertera pada pipet. Tutup kedua ujung pipet dengan ibu jari dan jari telunjuk tangan kanan. Darah disuspensikan dalam larutan Ress dan Ecker dengan cara membuat gerakan angka delapan. Suspensi kemudian diteteskan ke kamar hitung hemocytometer neubeur. Hasil perhitungan yang diperoleh dikalikan dengan faktor koreksi pengenceran 20x.(Sastradipradja et al. 1989).
5
Rancangan Percobaan
Penelitian ini menggunakan Rancangan Acak Lengkap (RAL) dengan 7 perlakuan dan 5 ulangan dengan 1 ekor puyuh di setiap ulangannya. Penentuan dosis ekstrak 1% dan 10% yang diberikan pada ransum perlakuan puyuh, berdasarkan bobot badan mengacu pada hasil penelitian Ido et al. (2015) dengan modifikasi. Perlakuan yang diberikan adalah:
R1 : ransum tanpa ekstrak tepung pupa (kontrol) R1 : ransum + 1% ekstrak tepung pupa
R2 : ransum + 10% ekstrak tepung pupa R3 : ransum + 1% residu ekstrak tepung pupa R4 : ransum + 10% residu ekstrak tepung pupa R5 : ransum + 1% tepung pupa
R6 : ransum + 10% tepung pupa
Analisis Data
6
3 HASIL DAN PEMBAHASAN
Kinetika Rataan Leukosit Darah Puyuh Petelur Setelah Perlakuan Cekok (Penelitian Pendahuluan)
Peningkatan dan penurunan jumlah rata-rata leukosit darah puyuh petelur setelah dicekok, dengan waktu pengamatan berbeda pada studi pendahuluan disajikan pada Gambar 3.
Gambar 3 Kinetika rataan leukosit dalam darah puyuh setelah perlakuan cekok Pada studi pendahuluan, kinetika rataan leukosit puyuh petelur diamati pada lima waktu berbeda. Puyuh yang digunakan sebagai hewan percobaan sebanyak 21 ekor, dengan 3 ekor pada setiap perlakuan (R0, R1, R2, R3, R4, R5 dan R6). Pengamatan pada waktu berbeda (0, 6, 12, 24 dan 48 jam) dilakukan untuk mengetahui respon kekebalan tubuh puyuh petelur terhadap setiap perlakuan yang dimasukkan ke dalam tubuh secara oral dengan cekok. Status kekebalan (imun) diamati melalui peningkatan jumlah rata-rata sel darah putih pada masing-masing waktu pengamatan. Sel darah putih merupakan unit aktif dalam sistem pertahanan tubuh (Guyton dan Hall 1997). Perlakuan yang masuk ke dalam tubuh puyuh akan mendapatkan reaksi, karena perlakuan tersebut dianggap benda asing oleh tubuh. Reaksi tubuh berupa pembentukan imun diekspresikan melalui meningkatnya antibodi tubuh yang disebabkan kehadiran benda asing yang dapat berupa mikroba atau senyawa yang tidak dikenal lainnya (Bratawidjaja 2006).
7 perlakuan 10% ekstrak tepung pupa (R2). Jumlah leukosit pada R2, tidak mengalami peningkatan pada 0 dan 6 jam. Peningkatan sel darah putih dalam jumlah besar pada 12, 24 dan 48 jam dijadikan sebagai dasar dalam penentuan waktu optimal pengambilan darah serta pengamatan terhadap jumlah sel darah putih puyuh petelur pada tahapan penelitian selanjutnya. Puyuh dengan perlakuan R1 (ekstrak tepung pupa dosis 1%) mengalami peningkatan jumlah rata-rata sel darah putih lebih besar dibandingkan dengan perlakuan lainnya, yaitu 9.34 x103/mm3 pada jam ke 12 setelah cekok. Peningkatan jumlah sel darah putih terbesar pada penelitian pendahuluan ditunjukkan oleh perlakuan R2.
Kinetika Rataan Leukosit Darah Puyuh Petelur Setelah Perlakuan Cekok (Tahap 1)
Peningkatan dan penurunan jumlah rata-rata leukosit darah puyuh petelur setelah perlakuan cekok berdasarkan waktu pengamatan disajikan pada Gambar 4.
8
Pada R4 (10% residu ekstrak tepung pupa) jumlah sel darah putih meningkat sebesar 4.80 x103/mm3 pada jam pengamatan ke-48, R5 (1% tepung pupa) jumlah sel darah putih meningkat sebesar 8.13 x103/mm3 pada jam pengamatan ke-12. Pada R6 (10% tepung pupa) jumlah sel darah putih mengalami peningkatan sebesar 4.66 x103/mm3 pada jam pengamatan ke-24. Dari hasil pengamatan kinetika rataan sel darah putih (leukosit) berdasarkan waktu, menunjukkan bahwa peningkatan jumlah sel darah putih pada R2 lebih tinggi pada jam ke 24 dan 48, dibandingkan dengan perlakuan R0, R1, R3, R4, R5 dan R6. Hal ini menunjukkan bahwa pengaruh pemberian ekstrak tepung pupa dosis 10% (R2) pada puyuh petelur dapat meningkatkan jumlah sel darah putih pada 24 dan 48 jam. Ekstrak tepung pupa ulat sutera diasumsikan mengandung senyawa aktif polisakarida yang dapat menstimulasi sistem kekebalan tubuh. Sejalan dengan hasil penelitian Sun et al. (2007) yang menunjukkan bahwa polisakarida yang terkandung pada pupa ulat sutera secara signifikan dapat meningkatkan status leukosit sehingga mempunyai kemampuan pagositosis makrofage pada sel darah putih tikus. Ohta et al. (2014) menunjukkan bahwa ekstrak tepung pupa dari serangga Diptera dan Lepidoptera mengandung senyawa bioaktif polisakarida yang dinamakan Dipterosa dan Silkrosa, yang dapat mengaktifkan sistem kekebalan bawaan (Innate Immune System) pada sel makrofage tikus RAW264.
Profil Hematologi Darah Puyuh Petelur Setelah Perlakuan Cekok (Tahap 1)
Berdasarkan hasil analisis ragam, perlakuan berpengaruh (P<0.05) terhadap jumlah leukosit puyuh petelur. Hasil uji lanjut menunjukkan bahwa R0 (kontrol) tidak berbeda pengaruhnya terhadap kandungan leukosit puyuh petelur dengan perlakuan penambahan 1% ekstrak tepung pupa (R1), 1% residu ekstrak tepung pupa sampai taraf 10% (R3, R4) dan 1% tepung pupa sampai taraf 10% (R5, R6), tetapi pengaruhnya berbeda (P<0.05) dengan perlakuan penambahan 10% ekstrak tepung pupa (R2) terhadap kandungan leukosit darah (Tabel 1).
Jumlah Eritrosit
9 pucuk Indigofera zollingerana yang mengandung antinutrien saponin dalam ransum ayam petelur tidak mengganggu pembentukan eritrosit.
Tabel 1 Rataan eritrosit, hemoglobin, hematokrit dan leukosit dalam darah puyuh petelur setelah perlakuan cekok pada pengamatan 12, 24 dan 48 ja
* Berdasarkan Sturkie dan Griminger (1976)
Proses metabolisme dalam tubuh berlangsung normal dan nutrisi yang dibutuhkan dalam pembentukan sel darah merah, terutama protein dan vitamin sudah mencukupi kebutuhan puyuh, sehingga kesehatan tubuh puyuh optimal. Darah selalu mempertahankan kondisi yang stabil agar proses fisiologi dalam tubuh berfungsi normal. Fungsi utama darah adalah untuk mempertahankan homeostatis tubuh (Dellman dan Brown 1992). Saponin mempunyai kemampuan dalam mengikat protein dan menghambat proses penyerapan protein dalam saluran pencernaan puyuh. Protein sangat dibutuhkan dalam pembentukan eritrosit normal. Diasumsikan bahwa saponin yang terkandung pada senyawa aktif polisakarida silkrosa yang terdapat pada ekstrak tepung pupa ulat sutera, dalam penelitian ini di bawah batas normal sehingga tidak mengganggu jumlah eritrosit normal.
Kadar Hemoglobin
Rataan hemoglobin puyuh petelur setelah dicekok disajikan pada Tabel 1. Hasil analisis ragam menunjukkan bahwa perlakuan penambahan R1, R2, R3, R4, R5 dan R6 tidak berpengaruh terhadap kadar hemoglobin. Hemoglobin berkaitan erat dengan eritrosit dan hematokrit. Hemoglobin merupakan protein sederhana, pemberi warna merah pada eritrosit, dan berfungsi dalam mengikat oksigen. Kadar hemoglobin puyuh pada pengamatan 12 jam berkisar antara 7.77-12.45 g %, 24 jam 7.89-12.80 g % dan 48 jam 8.01-12.97 g %. Nilai hemoglobin ini masih berada pada kisaran normal. Menurut Sturkie dan Griminger (1976) bahwa kadar hemoglobin normal pada puyuh adalah 7-13 g %.
Penambahan ekstrak tepung pupa, residu tepung pupa dan tepung pupa 1% sampai taraf 10% pada ransum mampu mempertahankan kadar hemoglobin puyuh petelur dalam kondisi normal, sehingga status fisiologi puyuh petelur tidak mengalami gangguan. Hal ini disebabkan penambahan tepung pupa ulat sutera dalam bentuk tepung, residu dan ekstrak tidak menurunkan kualitas protein pada
10
ransum. Kandungan protein pada tepung pupa ulat sutera 47.4%, ekstrak tepung pupa ulat sutera 29.4% dan residu ekstrak tepung pupa ulat sutera 37.8% mencukupi kebutuhan protein puyuh petelur. Terpenuhinya kebutuhan protein pada ransum memperlancar pembentukan hemoglobin darah, karena protein pakan tersedia untuk bersenyawa dengan zat besi untuk membentuk hemoglobin. Hemoglobin merupakan suatu senyawa organik yang komplek terdiri dari empat pigmen porfirin merah (heme), masing-masing mengandung atom besi ditambah globin, yang merupakan protein globular Frandson (1992). Asam pantothenat berperan dalam mensintesis porphyrin untuk pembentukan hemoglobin (Piliang dan Djojosoebagio 2006).
Pembentukan hemoglobin dimulai dari succinyl-co A yang dibentuk dalam siklus Krebs yang berkaitan dengan asam amino glisin untuk membentuk molekul pirol. Empat pirol bergabung membentuk protoporfirin IX dan bergabung dengan besi membentuk molekul heme. Heme bergabung dengan protein globin besi membentuk rantai hemoglobin (Guyton dan Hall 1997). Diasumsikan bahwa komponen organik berupa saponin yang terkandung pada senyawa aktif polisakarida silkrosa yang terdapat pada ekstrak tepung pupa ulat sutera, dalam penelitian ini di bawah batas normal dan tidak menyebabkan gangguan penyerapan protein, sehingga protein untuk pembentuk hemoglobin terpenuhi dan tidak menurunkan jumlah ketersediaan Fe2+ untuk membentuk senyawa komplek.
Nilai Hematokrit
Rataan nilai hematokrit puyuh petelur setelah dicekok disajikan pada Tabel 1. Hasil analisis ragam menunjukkan bahwa perlakuan penambahan R1, R2, R3, R4, R5 dan R6 tidak berpengaruh terhadap nilai hematokrit puyuh petelur. Nilai hematokrit merupakan suatu istilah yang artinya persentase (berdasarkan volume) dari darah yang terdiri dari sel-sel darah merah setelah disentrifusi (Frandson 1992). Nilai hematokrit dipengaruhi oleh jumlah dan ukuran sel darah merah (Sturkie dan Griminger 1976). Nilai hematokrit pada pengamatan 12 jam berkisar antara 30.30-35.25%, 24 jam 29.99-35.33% dan 48 jam 30-31.12% (Tabel 1). Nilai hematokrit pada perlakuan penambahan R1, R2, R4, R5dan R6 berada pada kisaran normal. Nilai hematokrit pada perlakuan R3 pengamatan jam ke-24 berada sedikit di bawah kisaran normal yaitu sebesar 29.99%. Menurut Sturkie dan Griminger (1976) bahwa nilai hematokrit normal pada puyuh adalah 30-37 %.
Nilai hematokrit menggambarkan jumlah sel eritrosit terhadap total dalam darah, sehingga menjadi salah satu indikator penentuan kemampuan darah dalam mengangkut oksigen (O2) yang biasa dikenal dengan istilah Oxygen Carrying
Capacity. Pada saat bertelur, nilai hematokrit cenderung mengalami penurunan yang merupakan dampak tubuh puyuh dalam mempertahankan homeostasis. Nilai hematokrit yang rendah pada saat bertelur diakibatkan oleh peningkatan volume plasma darah yang disebut proses Haemodilusi. Namun, konsentrasi plasma akan kembali normal ketika folikel terakhir telah mengalami ovulasi (Vezina et al. 2003). Volume plasma yang meningkat akan berakibat menurunnya kapasitas pengangkutan oksigen (O2) dalam darah meskipun pada dasarnya jumlah eritrosit
tidak berkurang (Wagner et al. 2008).
11 merah (eritropoietic) (Wagner et al. 2008). Bertambahnya folikel yang sedang berkembang selama produksi telur akan meningkatkan kadar estrogen dalam darah, yang diiringi dengan meningkatnya jumlah komponen-komponen kuning telur dalam darah (Challenger et al. 2001). Walaupun rataan kandungan eritrosit pada perlakuan penambahan tepung pupa dosis 1% lebih rendah (2.58%) jika dibandingkan dengan perlakuan lainnya, tetapi jumlah eritrosit tersebut masih dalam batas normal.
Penurunan nilai hematokrit selama fase produksi juga disebabkan oleh beberapa faktor lain, yaitu tingkat stres oleh pengaruh nutrisi dan lingkungan, dehidrasi maupun parasit dalam darah (Challenger et al. 2001). Selama pemeliharaan puyuh petelur, suhu lingkungan cenderung tinggi, yaitu berkisar antara 31-33°C. Stres panas dapat terjadi ketika suhu lingkungan melebihi 32°C (Hemid et al. 2010). Kondisi tersebut menyebabkan puyuh petelur mengkonsumsi air minum lebih banyak. Tingginya konsumsi air minum menyebabkan konsentrasi air dalam darah meningkat, sehingga akan menurunkan persentase benda darah (hematokrit). Hal ini dapat juga disebabkan oleh tingginya level prekursor yolk (William et al. 2004), dan akibat meningkatnya konsentrasi hormon estrogen dalam darah (Wagner et al. 2008), merupakan asumsi yang menggambarkan penurunan nilai hematokrit pada puyuh dengan tingkat produksi telur yang lebih tinggi.
Jumlah Leukosit
Leukosit merupakan sel darah yang memiliki inti sel dan memiliki kemampuan gerak yang independen (Frandson 1992). Leukosit berperan dalam merespon kekebalan tubuh. Rataan jumlah leukosit puyuh petelur setelah dicekok disajikan pada Tabel 1. Berdasarkan hasil analisis ragam, perlakuan berpengaruh (P<0.05) terhadap jumlah leukosit puyuh petelur. Hasil uji lanjut menunjukkan bahwa R0 (kontrol) tidak berbeda pengaruhnya dengan perlakuan penambahan R1, R3, R4, R5 dan R6 terhadap kandungan leukosit puyuh petelur, tetapi pengaruhnya berbeda (P<0.05) dengan perlakuan penambahan R2 (10% ekstrak tepung pupa) terhadap kandungan leukosit darah (Tabel 1).
Rataan jumlah leukosit darah puyuh petelur perlakuan R0, R1, R2, R3, R4, R5 dan R6 pada jam pengamatan ke-12 berkisar antara 4.06-11.26 x103/mm3, jam ke-24 2.93-14.53 x103/mm3 dan jam ke-48 3.06-9.86 x103/mm3 (Tabel 1). Rataan jumlah leukosit ini lebih rendah dan masih berada dibawah kisaran normal. Menurut Sturkie dan Griminger (1976) bahwa jumlah leukosit normal pada puyuh berkisar antara 20-40 x 103/mm3.
12
Pengambilan darah pada penelitian ini, dilakukan saat umur puyuh 7 minggu dan sudah mulai bertelur. Puyuh betina mulai bertelur pada umur 6 minggu (Sujana et al. 2012). Muhammad (2013) menyatakan bahwa pada saat panas dapat menurunkan jumlah leukosit serta meningkatkan rasio heterofil/limfosit yang merupakan salah satu indikator stres yang penting pada puyuh petelur, terutama pada saat periode bertelur.
Leukosit merupakan unit yang aktif untuk menyediakan pertahanan yang cepat dan kuat terhadap setiap bahan penyebab infeksi (Guyton dan Hall 1997). Leukosit berperan dalam merespon kekebalan tubuh. Penggunaan ekstrak tepung pupa ulat sutera dosis 10%, mampu mempertahankan jumlah leukosit puyuh petelur untuk menjalankan fungsi dalam sistem kekebalan tubuh. Diasumsikan bahwa kemampuan ini dikarenakan ekstrak tepung pupa ulat sutera yang digunakan dalam penelitian, mengandung bahan aktif berupa polisakarida. Ohta et al. (2014) melaporkan bahwa ekstrak tepung pupa ulat sutera mengandung bahan aktif berupa polisakarida yang dinamakan silkrosa tersusun dari sembilan monosakarida dengan komposisi terbesar yaitu galaktosa (unsur pokok gula) sebesar 48.9 mol%. Silkrosa masuk ke dalam tubuh puyuh dan dianggap oleh tubuh sebagai benda asing. Benda asing ini mengandung senyawa kimiawi yang khas sehingga membuatnya berbeda dengan semua senyawa yang lain. Silkrosa merupakan senyawa polisakarida yang diperoleh melalui proses ekstraksi dan memiliki berat molekul 3.15x105 (Ohta et al. 2014). Polisakarida merupakan salah satu senyawa yang membentuk kekebalan didapat (acquired immunity) dan disebut sebagai antigen (Guyton dan Hall 1997). Antigen memulai terjadinya proses kekebalan pada tubuh puyuh petelur. Polisakarida silkrosa merupakan antigen yang dikenali sehingga tubuh menghasilkan antibodi. Antibodi dibentuk oleh limfosit. Limfosit diolah dan dipersiapkan untuk membuat antibodi pada bursa fabrisius, selama bagian akhir kehidupan janin pada unggas (Guyton dan Hall 1997). Persentase jumlah benda darah putih yang paling banyak ditemukan pada penelitian ini adalah limfosit. Diasumsikan bahwa polisakarida silkrosa yang terkandung dalam ekstrak pupa ulat sutera pada penelitian ini dapat meningkatkan jumlah limfosit. Sejalan dengan hasil penelitian Sun et al. (2007), bahwa pengunaan polisakarida yang terkandung pada ekstrak pupa ulat sutera yang diujikan pada tikus dapat meningkatkan status leukosit sehingga mempunyai kemampuan pagositosis sel makrofage, antibodi hemolisin dan transformasi limfosit. Hal ini mengindikasikan bahwa polisakarida pupa ulat sutera dapat menstimulasi imunitas spesifik dan nonspesifik (Sun et al. 2007).
Diferensiasi Leukosit
13 Tabel 2 Persentase diferensiasi leukosit dalam darah puyuh petelur setelah
perlakuan cekok pada pengamatan 12, 24 dan 48 jam
* Berdasarkan Sturkie dan Griminger (1976) ** Dihitung dari sejumlah 100 leukosit
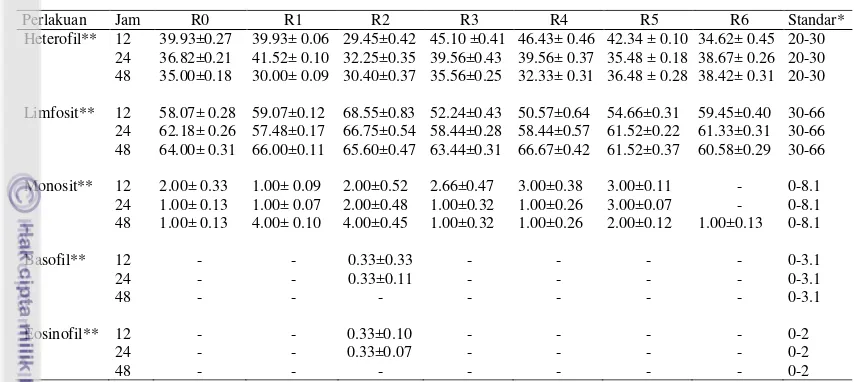
Heterofil merupakan leukosit granulosit yang berperan dalam respon terhadap infeksi. Leukosit heterofil dikenal sebagai pertahanan pertama tubuh (first line defense). Menurut Tizard (2000), fungsi utama heterofil adalah menghancurkan bahan asing melalui proses fagositosis. Untuk mempertahankan tubuh melawan infeksi, heterofil memperlihatkan aktifitas amuboid dan aktif dalam memfagosit mikroorganisme. Heterofil melawan infeksi dengan cara migrasi menuju daerah-daerah yang sedang mengalami infeksi dengan menembus dinding endotel dan menghancurkan agen. Jumlah heterofil yang meningkat menunjukan kejadian infeksi akut. Heterofil memiliki masa hidup yang singkat, dimana setelah melakukan tugasnya akan mati dan melepas faktor kemotaktik untuk menarik heterofil lainnya. Masa hidup normal dalam sirkulasi darah mencapai 4-8 jam, kemudian 4-5 jam berikutnya berada pada jaringan. Masa hidup heterofil mampu beredar dalam aliran darah hingga 12 jam (Tizard 1988).
Hasil analisis ragam menunjukkan bahwa perlakuan R1, R2, R3, R4, R5, dan R6 tidak berpengaruh terhadap persentase heterofil pada darah puyuh petelur (Tabel 2). Rataan persentase heterofil darah puyuh petelur pada pengamatan 12 jam berkisar antara 29.45-46.43%, 24 jam 32.25-41.52% dan 48 jam 30-38.42%. Sturkie dan Griminger (1976) menyatakan bahwa persentase heterofil puyuh normal berkisar antara 20-30%. Persentase heterofil pada penelitian ini merata cukup tinggi, kecuali pada R2 jam pengamatan ke-12 dengan nilai heterofil sebesar 29.45%. Nilai heterofil ini lebih rendah dibandingkan dengan perlakuan lainnya. Rendahnya persentase heterofil pada penambahan 10% ekstrak tepung pupa (R2) dapat dijadikan sebagai salah satu indikator bahwa ekstrak tepung pupa ulat sutera memiliki aktivitas imunomodulator. Di asumsikan ekstrak tepung pupa ulat sutera mengandung bahan aktif polisakarida silkrosa dengan kandungan saponin di dalamnya. Saponin merupakan salah satu komponen organik yang memiliki aktivitas antibakteri dan antibiotik (Chaitali dan Preeti, 2014). Pemberian perlakuan ekstrak tepung pupa ulat sutera pada puyuh petelur mengakibatkan persentase heterofil puyuh petelur tidak mengalami peningkatan secara berlebihan, sehingga puyuh memiliki tangkal kebal yang baik. Umumnya
14
pada kasus-kasus penyakit infeksi bakteri, persentase heterofil pada hewan akan mengalami peningkatan secara besar-besaran. Persentase heterofil pada semua perlakuan (R1, R2, R3, R4, R5, R6) menunjukkan peningkatan diatas standar normal. Hal ini kemungkinan disebabkan pupa dalam bentuk ekstrak tepung pupa, residu tepung pupa dan tepung pupa, yang masuk ke dalam tubuh puyuh dianggap benda asing. Tubuh akan memberikan reaksi terhadap kehadiran benda asing, dengan cara fagositosis yang dilakukan oleh heterofil. Hal ini berkaitan erat dengan fungsi terpenting dari heterofil adalah fagositosis. Guyton dan Hall (1997) menyatakan bahwa terjadinya proses fagositosis disebabkan karena tubuh mempunyai kemampuan khusus untuk mengenali bahan-bahan asing yang tertentu.
Limfosit sangat berperan dalam sistem kekebalan tubuh (Melvin et al. 1993). Fungsi utama limfosit adalah memproduksi antibodi sebagai sel efektor khusus dalam menanggapi antigen yang terikat dengan makrofag (Tizard 2000). Limfosit dapat dibagi menjadi dua bagian yaitu limfosit T yang berasal dari timus dan limfosit B yang berasal dari bursa fabrisius. Sebanyak 70-75% limfosit T menghasilkan tanggap kebal yang berperantara sel yaitu tanggap kebal seluler. Limfosit juga menghasilkan limfokin yang mencegah perpindahan makrofag dan merupakan media kekebalan. Limfosit B berperan dalam reaksi kekebalan humoral dan tumbuh menjadi sel plasma pembentuk antibodi (Tizard 2000). Limfosit memiliki fungsi kompleks dengan fungsi utama yaitu memproduksi antibodi (Limfosit B) atau sebagai sel efektor khusus dalam menanggapi antigen yang melekat pada makrofag (Limfosit T). Limfosit T akan mengikatkan diri pada benda asing serta merusaknya. Pada masa hidupnya limfosit sangat lama, berkisar antara 100-300 hari atau bahkan bertahun-tahun. Limfosit dilepaskan ke jaringan melalui proses diapedesis dan dapat kembali kedalam sirkulasi darah melalui kelenjar limfe dan dapat ikut bersirkulasi (Guyton dan Hall 1997). Limfosit ada dalam jumlah banyak di usus, uterus dan membran mukosa respirasi dengan cara migrasi. Limfosit ini motil dan menunjukan aktivitas amuboid tapi tidak fagositik (Melvin et al. 1993).
Hasil analisis ragam menunjukkan bahwa R0, R1, R2, R3, R4, R5 dan R6 tidak berpengaruh terhadap persentase limfosit darah puyuh petelur (Tabel 2). Kisaran limfosit pada pengamatan 12 jam berkisar antara 50.57-68.55%, 24 jam 57.48-66.75% dan 48 jam 60.58-66.67%. Persentase limfosit pada penelitian ini cukup tinggi, keadaan ini menandakan puyuh memiliki tanggap kebal seluler dan humoral yang normal. Sturkie dan Griminger (1976) menyatakan bahwa persentase limfosit puyuh normal berkisar antara 30-66%.
Monosit memiliki kemampuan fagositik, yaitu memakan benda asing seperti bakteri, yang sama fungsinya dengan heterofil. Apabila heterofil berperan dalam mengatasi infeksi akut, maka monosit bekerja dalam keadaan infeksi yang tidak terlalu akut. Monosit dibentuk di dalam sumsum tulang yang nantinya akan disebarkan dan beredar di dalam darah hingga 72 jam. Sel-sel monosit selanjutnya akan masuk ke dalam jaringan dan membentuk makrofag. Makrofag akan mampu berada di jaringan hingga berbulan-bulan bahkan bertahun-tahun hingga musnah akibat kemampuan fagositiknya (Guyton dan Hall 1997).
15 persentase monosit pada unggas berkisar antara 0-8.1%. Jumlah monosit pada semua perlakuan berada pada kisaran nilai normal. Hal ini menandakan bahwa tidak terjadi infeksi yang akut pada puyuh, walaupun diberikan perlakuan R1, R2, R3, R4, R5 dan R6. Keadaan ini menandakan status puyuh dalam keadaan sehat.
Basofil memiliki peranan yang sama dengan sel mast, yaitu melepaskan heparin ke dalam darah, yang merupakan suatu bahan yang dapat mencegah pembekuan darah (Guyton dan Hall 1997). Basofil dibentuk di sumsum tulang merah. Jumlah basofil sangat sedikit dalam peredaran darah dan terkadang hampir tidak memiliki aktivitas fagositosis (Sturkie dan Griminger 1976).
Hasil analisis ragam menunjukkan bahwa perlakuan R1, R2, R3, R4, R5 dan R6 tidak berpengaruh terhadap jumlah basofil pada darah puyuh petelur (Tabel 2). Rataan jumlah basofil puyuh pada pengamatan 12 jam adalah 0.33%, 24 jam 0.33% dan 48 jam belum ditemukan adanya basofil. Sturkie dan Griminger (1976) menyatakan bahwa persentase basofil pada unggas berkisar antara 0-3.1%. Jumlah basofil pada penelitian ini masih berada pada kisaran normal. Basofil ditemukan terdapat pada perlakuan penambahan ekstrak tepung pupa dosis 10% (R2). Basofil belum ditemukan dari sejumlah 100 leukosit yang dihitung dari R0, R1, R3, R4, R5, dan R6. Hal serupa ditemukan Angelica et al. (2012) yang melaporkan bahwa basofil tidak ditemukan dari sejumlah 200 leukosit yang dihitung pada sampel ikan Acipenser baeri umur 5 bulan dengan rataan bobot badan 135 g.
Eosinofil memiliki daya fagositosis lemah dan dapat menunjukkan kemotaksis, namun bila dibandingkan dengan heterofil, eosinofil ini diragukan dalam mempertahankan tubuh terhadap tipe infeksi yang umum (Guyton dan Hall 1997). Eosinofil akan diproduksi dalam jumlah besar jika terjadi infestasi parasit dalam jaringan. Eosinofil memiliki kecenderungan yang khusus untuk berkumpul dalam suatu jaringan yang mengalami reaksi alergi.
Hasil analisis ragam menunjukkan bahwa perlakuan R1, R2, R3, R4, R5 dan R6 tidak berpengaruh terhadap jumlah eosinofil pada darah puyuh petelur (Tabel 2). Rataan jumlah eosinofil pada pengamatan 12 dan 24 jam sebesar 0.33%. Eosinofil ditemukan terdapat pada perlakuan penambahan ekstrak tepung pupa 10% (R2), sedangkan pada perlakuan lainnya belum ditemukan dari sejumlah 100 leukosit. Sturkie dan Griminger (1976) menyatakan bahwa persentase eosinofil pada unggas berkisar antara 0-2%. Jumlah eosinofil pada penelitian ini masih berada pada kisaran normal.
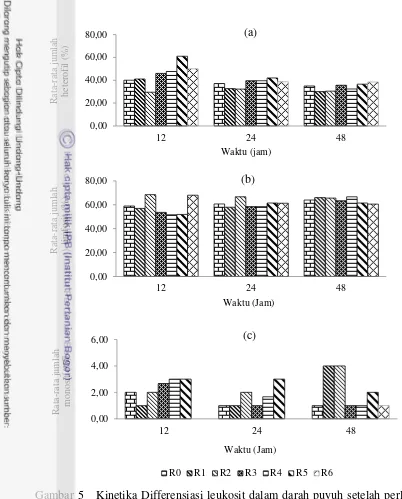
Kinetika Diferensiasi Leukosit Darah Puyuh Petelur Setelah Perlakuan Cekok (Tahap 1)
16
Gambar 5 Kinetika Differensiasi leukosit dalam darah puyuh setelah perlakuan cekok: (a) heterofil, (b) limfosit, (c) monosit
Pengambilan darah pada 12, 24 dan 48 jam setelah perlakuan cekok (Gambar 5) dilakukan untuk melihat perlakuan yang memberikan dampak pada persentase benda darah putih (heterofil, limfosit, monosit, basofil dan eosinofil). Pengambilan darah pada tiga waktu pengamatan yang berbeda tersebut, berdasarkan pada studi pendahuluan yang dilakukan di awal penelitian.
17 sebesar 32.25% dan mengalami penurunan kembali pada jam pengamatan ke-48 menjadi 30.40%.
Limfosit. pada penelitian ini persentasenya meningkat hampir secara merata mulai pada jam ke-12 hingga 48 jam pada R0, R3, R4, R5 dan R6, kecuali pada perlakuan R1 dan R2 peningkatan persentase limfosit terjadi pada jam ke-12 kemudian menurun pada 24 jam. Peningkatan persentase limfosit pada jam ke-12 hingga 48 jam setelah puyuh dicekok, menyebabkan terjadinya penurunan persentase heterofil pada jam ke-12 hingga 48 jam. Swenson (1984) menyatakan bahwa fluktuasi jumlah leukosit antara lain dapat disebabkan oleh stres, pakan, umur, jenis kelamin, penyakit, pemberian estrogen dan obat tertentu. Nilai persentase limfosit R2 lebih besar dibandingkan dengan kontrol (R0) dan perlakuan lainnya (R1, R3, R4, R5, R6). Hal ini diduga karena terjadi pembentukan imun pada tubuh puyuh petelur akibat kehadiran benda asing, dalam hal ini bahan aktif polisakarida silkrosa. Polisakarida silkrosa diperoleh melalui proses ekstraksi tepung pupa ulat sutera. Polisakarida silkrosa terususun dari 9 monosakrida, dengan Rhamnosa sebagai komponen penyusun terbesar. L-Rhamnosa mengandung komponen organik seperti saponin, terpenoid dan flavonoid (Ohta et al. 2014). Senyawa saponin yang masuk ke dalam tubuh puyuh dianggap sebagai benda asing (antigen) sehingga mengakibatkan tubuh membentuk antibodi. Limfosit memiliki peranan dalam pembentukan antibodi di dalam tubuh. Guyton dan Hall (1997) menyatakan bahwa limfosit merupakan benda darah putih yang terbagi dalam dua kelompok besar (limfosit B dan limfosit T). Limfosit B bertanggung jawab dalam pembentukan antibodi yang memberikan kekebalan humoral dan limfosit T bertanggung jawab dalam pembentukan sel-sel limfosit yang teraktivasi yang dapat membentuk kekebalan yang diperantarai sel (Guyton dan Hall 1997).
Monosit meningkat jumlah selnya pada jam ke-12 hingga 48 jam setelah puyuh dicekok, sebesar 1-4%. Jumlah monosit meningkat terutama pada perlakuan R2 (ekstrak tepung pupa 10%. Senyawa aktif polisakarida silkrose yang terkandung pada ekstrak tepung pupa, yang masuk ke dalam tubuh dianggap sebagai benda asing, sehingga sel monosit akan memfagositosit polisakarida silkrosa. Tizard (1988) menyatakan bahwa monosit bersifat motil, dapat berpindah dengan gerakan amuboid serta mempunya kemampuan memfagositosit mikro organisme, sel yang nekrotik dan runtuhan sel. Jumlah monosit dan limfosit pada perlakuan R2 dalam penelitian ini memiliki nilai terbesar dibandingkan jumlah pada perlakuan R0, R1, R3, R4, R5 dan R6. Selain berperan sebagai makrofag, monosit juga berperan dalam sistem imunologi, kontak yang dekat antara limfosit dan monosit diperlukan untuk respon imunologis yang maksimal. Monosit merupakan komponen esensial bagi sistem kekebalan bawaan (Parihar et al. 2010).
18
Kinetika Rataan Leukosit Darah Puyuh Petelur 31 Hari Setelah Perlakuan Cekok (Tahap 2)
Peningkatan dan penurunan jumlah rata-rata leukosit darah puyuh petelur 31 hari setelah di cekok, berdasarkan waktu pengamatan disajikan pada Gambar 6.
Gambar 6 Kinetika rataan leukosit dalam darah puyuh 31 hari setelah perlakuan cekok
Pengamatan kinetika rataan leukosit dilakukan kembali mulai pada hari ke-31 setelah puyuh diberikan perlakuan cekok (Gambar 6). Pengambilan darah dilakukan pada tiga waktu pengamatan yang berbeda, berdasarkan pada studi pendahuluan. Pengamatan ini dilakukan untuk melihat pengaruh masing-masing perlakuan terhadap jumlah sel darah putih puyuh petelur 31 hari setelah pemberian perlakuan cekok R1, R2, R3, R4, R5 dan R6. Ransum yang diberikan kepada puyuh petelur, hanya berupa ransum racikan. Puyuh masih berada pada kondisi masa bertelur dan dalam suhu lingkungan panas, yaitu pada kisaran 31-33˚C. Peningkatan jumlah sel darah putih tertinggi pada R2 sebesar 39.60 x103/mm3, jam pengamatan ke-48. Jumlah ini lebih tinggi bila dibandingkan dengan R0, R1, R3, R4, R5 dan R6. Kontrol (R0) mengalami peningkatan jumlah sel darah putih sebesar 11.60 x103/mm3 pada jam pengamatan ke-48. R1 meningkat pada jam pengamatan ke-48 sebesar 23.20 x103/mm3. R3 meningkat pada jam pengamatan ke-48 sebesar 21.80 x103/mm3. R4 meningkat pada jam pengamatan ke-48 sebesar 20 x103/mm3. R5 meningkat pada jam pengamatan ke-48 sebesar 9.60 x103/mm3 dan R6 meningkat pada jam pengamatan ke-48 sebesar 5.80 x103/mm3. Hasil kinetika rataan leukosit menunjukkan bahwa peningkatan sel darah putih pada R0, R1, R2, R3, R4, R5 dan R6, terjadi pada jam ke-48 (Gambar 6). Peningkatan rataan jumlah leukosit tidak merata pada setiap perlakuan. Pada R0, R5 dan R6 jumlah leukosit masih berada dibawah kisaran normal sel darah putih. R1, R3 dan R4 sudah berada pada kisaran normal sel darah putih pada puyuh, sedangkan jumlah leukosit pada R2 berada pada kisaran normal. Nilai normal sel darah putih pada puyuh sebesar 20-40 x103/mm3 (Sturkie dan Griminger 1976). Peningkatan jumlah leukosit R2 paling tinggi
19 dibandingkan dengan perlakuan lainnya. Jumlah ini mampu bertahan dalam kondisi nilai normal dalam rentang waktu hingga 48 jam dari periode 31 hari setelah puyuh diberikan perlakuan cekok. Kondisi puyuh petelur pada penelitian ini berada pada masa bertelur dan kondisi lingkungan panas, namun perlakuan R2 (10% ekstrak tepung pupa) masih menunjukan efek mampu meningkatkan sistem kekebalan tubuh pada puyuh. Ekstrak tepung pupa yang mengandung bahan aktif polisakarida silkrosa dosis 10% di asumsikan dapat meningkatkan jumlah leukosit puyuh petelur yang sedang berada pada masa produksi (bertelur) serta terpapar suhu lingkungan panas. Banyak faktor yang mempengaruhi kadar leukosit pada unggas, yaitu genetik (spesies dan strain), paparan stress (stress dapat berupa suhu, lingkungan kandang yang tidak nyaman, handling), sistem pemeliharaan, pakan, periode produksi (starter, grower, layer) dan program pencahayaan (Hrabcakova et al. 2014).
Profil Hematologi Darah Puyuh Petelur 31 Hari Setelah Perlakuan Cekok (Tahap 2)
Berdasarkan hasil analisis ragam, perlakuan tidak berpengaruh terhadap eritrosit, hemoglobin, nilai hematokrit dan jumlah leukosit puyuh petelur periode 31 hari setelah dicekok (Tabel 3).
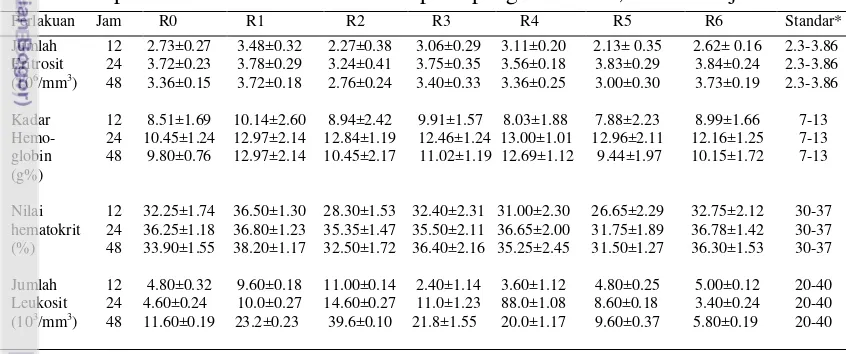
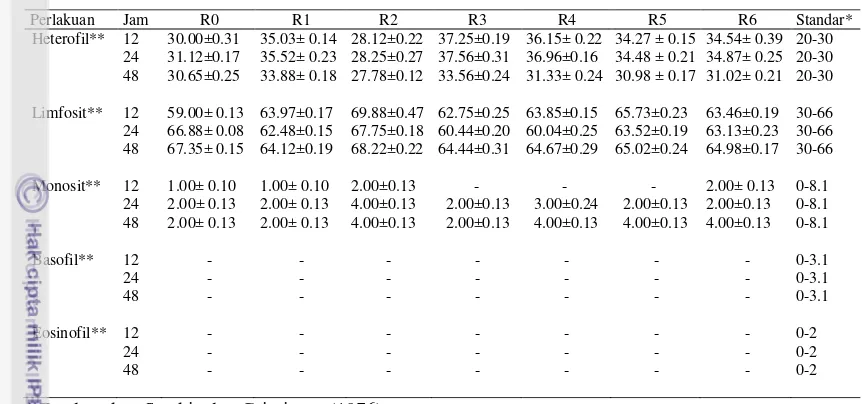
Tabel 3 Rataan eritrosit, hemoglobin, hematokrit dan leukosit dalam darah puyuh petelur 31 hari setelah di cekok pada pengamatan 12, 24 dan 48 jam
* Berdasarkan Sturkie dan Griminger (1976)
Jumlah Eritrosit
Hasil analisis ragam pada puyuh 31 hari setelah dicekok dengan perlakuan R1, R2, R3, R4, R5, dan R6, menunjukkan bahwa pemberian ransum racikan tidak berpengaruh terhadap jumlah eritrosit puyuh petelur (Tabel 3). Rataan jumlah eritrosit puyuh petelur pada pengamatan 12 jam berkisar antara 2.13-3.48 x 106/mm3, 24 jam 3.24-3.84 x 106/mm3 dan 48 jam 2.76-3.73 x 106/mm3. Nilai tersebut masih berada pada kisaran normal. Jumlah eritrosit normal 2.3-3.86 x 106/mm3 (Sturkie dan Griminger 1976). Rataan jumlah eritrosit puyuh petelur 31 hari setelah dicekok mengalami peningkatan, ke nilai kisaran normal puyuh. Penambahan R1, R2, R3, R4, R5 dan R6 dalam ransum pada tahap awal penelitian, tidak mengganggu pembentukan eritrosit, sehingga jumlah eritrosit
20
masih dalam keadaan normal dan puyuh petelur dalam keadaan sehat selama penelitian.
Kadar Hemoglobin
Hasil analisis ragam pada puyuh 31 hari setelah dicekok dengan perlakuan R1, R2, R3, R4, R5, dan R6, menunjukkan bahwa pemberian ransum racikan tidak berpengaruh terhadap kadar hemoglobin puyuh petelur (Tabel 3). Rataan kadar hemoglobin puyuh petelur pada pengamatan 12 jam berkisar antara 7.88-10.14 g%, 24 jam 10.45-13 g% dan 48 jam 9.80-12.97 g%. Nilai tersebut masih berada pada kisaran normal. Rataan kadar hemoglobin puyuh petelur 31 hari setelah dicekok mengalami peningkatan. Kadar hemoglobin normal puyuh 7-13 g% (Sturkie dan Griminger 1976). Penambahan R1, R2, R3, R4, R5 dan R6 dalam ransum di tahap awal penelitian mampu mempertahankan kadar hemoglobin puyuh petelur dalam kondisi normal, sehingga status fisiologi puyuh tidak mengalami gangguan.
Nilai Hematokrit
Hasil analisis ragam pada puyuh 31 hari setelah dicekok dengan perlakuan R1, R2, R3, R4, R5, dan R6, menunjukkan bahwa pemberian ransum racikan tidak berpengaruh terhadap nilai hematokrit puyuh petelur (Tabel 3). Rataan nilai hematokrit puyuh petelur pada pengamatan 12 jam berkisar antara 26.65-36.50%, 24 jam 31.75-36.80% dan 48 jam 31.50-38.20%. Terjadi sedikit peningkatan rataan nilai hematokrit pada pengamatan 48 jam sebesar 38.20%. Nilai tersebut masih berada pada kisaran normal. Rataan nilai hematokrit normal pada puyuh 30-37% (Sturkie dan Griminger 1976). Penambahan R1, R2, R3, R4, R5 dan R6 dalam ransum di tahap awal penelitian mampu mempertahankan nilai hematokrit puyuh petelur dalam kondisi normal.
Jumlah Leukosit
21 Tabel 4 Persentase diferensiasi leukosit puyuh petelur 31 hari setelah perlakuan
cekok pada pengamatan 12, 24 dan 48 jam
* Berdasarkan Sturkie dan Griminger (1976)
** Dihitung dari sejumlah 100 leukosit
Diferensiasi leukosit
Hasil analisis ragam heterofil pada puyuh 31 hari setelah dicekok dengan perlakuan R1, R2, R3, R4, R5, dan R6, menunjukkan bahwa pemberian ransum racikan tidak berpengaruh terhadap persentase heterofil puyuh petelur (Tabel 4). Rataan persentase heterofil puyuh petelur pada pengamatan 12 jam berkisar antara 28.12-37.25%, 24 jam 28.25-37.56% dan 48 jam 27.78-33.88%. Nilai persentase heterofil normal puyuh yaitu 20-30% (Sturkie dan Griminger 1976). Persentase jumlah heterofil pada penelitian ini cukup tinggi, menandakan puyuh yang diberi perlakuan R1, R2, R3, R4, R5 dan R6 memiliki tangkal kebal yang baik. Nilai rataan persentase heterofil puyuh petelur pada 31 hari setelah dicekok lebih rendah dibandingkan dengan persentase heterofil puyuh petelur yang di cekok pada hari pertama. Hal ini menunjukan bahwa perlakuan cekok yang diberikan pada hari pertama (hari ke-15 dari masa pemeliharaan), mampu merangsang heterofil bekerja lebih optimal, sehingga puyuh tetap berada dalam kondisi sehat selama penelitian.
Limfosit. Hasil analisis ragam pada puyuh 31 hari setelah dicekok dengan perlakuan R1, R2, R3, R4, R5, dan R6, menunjukkan bahwa pemberian ransum racikan tidak berpengaruh terhadap persentase limfosit puyuh petelur (Tabel 4). Kisaran limfosit pada penelitian ini berkisar antara 57.66-65.67%. Persentase limfosit puyuh petelur masih berada pada kisaran normal, yaitu 30-66% (Sturkie dan Griminger 1976).
Monosit. Hasil analisis ragam pada puyuh 31 hari setelah dicekok denganperlakuan R1, R2, R3, R4, R5, dan R6, menunjukkan bahwa pemberian ransum racikan tidak berpengaruh terhadap jumlah monosit puyuh petelur (Tabel 4). Rataan jumlah monosit pada pengamatan 12 jam berkisar antara 1-2%, pengamatan 24 jam dan 48 jam antara 2-4%. Jumlah ini masih berada pada kisaran normal. Sturkie dan Griminger (1976) menyatakan bahwa persentase monosit pada unggas berkisar antara 0-8.1%.
22
Belum ditemukan adanya basofil dan eosinofil yang dihitung dari sejumlah 100 leukosit pada puyuh 31 hari setelah dicekok dengan perlakuan R1, R2, R3, R4, R5, dan R6 (Tabel 4).
Kinetika Diferensiasi Leukosit Darah Puyuh Petelur 31 Hari Setelah Perlakuan Cekok (Tahap 2)
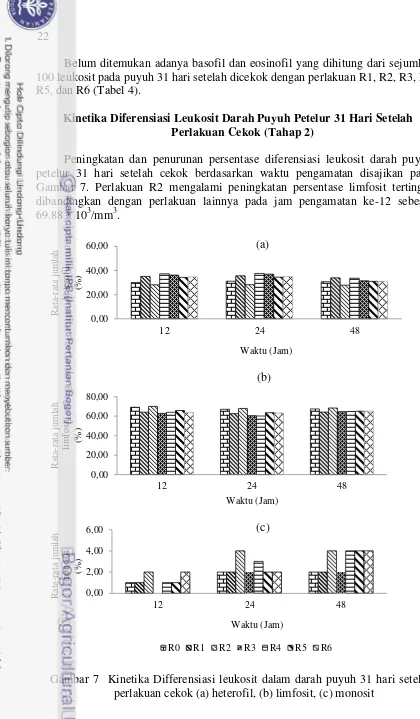
Peningkatan dan penurunan persentase diferensiasi leukosit darah puyuh petelur 31 hari setelah cekok berdasarkan waktu pengamatan disajikan pada Gambar 7. Perlakuan R2 mengalami peningkatan persentase limfosit tertinggi dibandingkan dengan perlakuan lainnya pada jam pengamatan ke-12 sebesar 69.88 x 103/mm3.
Gambar 7 Kinetika Differensiasi leukosit dalam darah puyuh 31 hari setelah perlakuan cekok (a) heterofil, (b) limfosit, (c) monosit
23
Diferensiasi Leukosit
Pengamatan kinetika rataan persentase heterofil dilakukan kembali pada 31 hari setelah puyuh dicekok, dimana puyuh hanya diberi ransum racikan (Gambar 7). Pengamatan ini dilakukan untuk melihat keberadaan dampak dari masing-masing perlakuan terhadap persentase benda sel darah putih (diferensiasi leukosit).
Heterofil. Pada pengamatan kinetika rataan persentase heterofil puyuh 31 hari setelah dicekok, terlihat bahwa kontrol (R0), R1, R2, R3, R4, R5 dan R6 mengalami peningkatan persentase heterofil mulai pada jam pengamatan ke-12 hingga jam pengamatan ke-24. Penurunan persentase heterofil pada semua perlakuan terjadi pada pengamatan 48 jam. Penurunan persentase heterofil di bawah kontrol (R0) terdapat pada puyuh R2 (ekstraksi tepung pupa dosis 10%) sebesar 27.78%. Namun penurunan persentase heterofil R2 ini masih berada pada standar kisaran normal puyuh petelur 20-30% (Sturkie dan Griminger, 1976). Seluruh perlakuan cekok yang diberikan di tahap awal penelitian, mampu mempertahankan persentase heterofil puyuh pada masa pemeliharaan 31 hari setelah dicekok.
Limfosit. Pada pengamatan kinetika rataan persentase limfosit puyuh 31 hari setelah dicekok, terlihat bahwa kontrol (R0), R1, R2, R3, R4, R5 dan R6 mengalami peningkatan persentase limfosit mulai pada jam pengamatan ke-12 hingga jam pengamatan ke-48. Kenaikan persentase limfosit di atas kontrol (R0) terdapat pada puyuh R2 (ekstraksi tepung pupa dosis 10%) dengan nilai persentase limfosit sebesar 68.22%.
Monosit. Pada pengamatan kinetika rataan jumlah monosit umur puyuh 31 hari setelah dicekok, terlihat bahwa kontrol (R0), R1, R2, R3, R4, R5 dan R6 mengalami peningkatan persentase monosit mulai pada jam pengamatan ke-12 hingga jam pengamatan ke-48. Kenaikan rataan jumlah monosit tertinggi terdapat pada R2, R4, R5 dan R6 sebesar 4%, terjadi pada jam pengamatan ke-48.
Pada pengamatan kinetika rataan jumlah basofil dan eosinofil pada puyuh 31 hari setelah dicekok, belum ditemukan adanya aktivitas basofil dan eosinofil pada jam pengamatan ke-12, ke-24 dan jam ke-48 pada kontrol (R0) dan semua perlakuan (R1, R2, R3, R4, R5 dan R6).
4 SIMPULAN DAN SARAN
Simpulan
24
Saran
Berdasarkan kinetika gambaran leukosit menunjukan peningkatan yang tinggi pada ekstrak tepung pupa ulat sutera dosis 10% maka disarankan untuk dilakukan penelitian lanjut tentang status imun pada perlakuan.
DAFTAR PUSTAKA
Angelica D, Lorena D, Cristea V. 2012. Effect of feeding with different dietary protein level on leukocytes population in juvenile Siberian Sturgeon, Acipenser baeri Brandt. Archiva Zootechnica. 15(4):59-67.
Astuti T, Kusharto CM. 2009. Tepung pupa-mulberry (pury) sebagai bahan pangan alternatif kaya gizi. J Giz Pangan. 4(1):29-32.
Astuti T, Kusharto CM, Mas’ud H. 2014. Pury, a fine powder made from Silkworm pupae as an alternate of nutritious food for human nutrition. Abstract. Conference “Insects to Feed The World”. Netherlands 14-17 May 2014. pp 36.
Bomford R. 1980. Saponin and other haemolysins (vitamin A, aliphatic amines, polyene antibiotics) as adjuvant for SRBC in the Mouse. Evidence for a role for cholesterol binding in saponin adjuvanticity. Intl Arch Alergy Appl Immunol. 63(2):170-7.
Bratawidjaja KG. 2006. Imunologi Dasar. Ed ke-3. Jakarta (ID): Indonesia. Fakultas Kedokteran Universitas.
Chaitali N, Preeti SM. 2014. Preliminary phytochemical screening of leaf extract of mulberry (Morus Indica) from Chahattisgarh. IJABPT. 5(3):131-136. Challenger WO, Williams TD, Christians JK, Vejina F. 2001. Follicular
development and plasma yolk precursors dynamics through the laying cycle in the European starling (Sturnus vulgaris). Physiol Biochem Zool. 74:356-365.
Chernysh S, Kim SI, Bekker G, Pleskach VA, Filatova NA. 2002. Antiviral and antitumor peptides from insects. Proc Natl Acad Sci USA. 99:12628-32. Dellman HD, EM Brown. 1992. Histologi Veteriner : R Hartono, penerjemah.
Jakarta (ID): UI Pr.
Frandson RD. 1992. Anatomi dan Fisiologi Ternak. Ed ke-4. Yogyakarta (ID): Gajahmada University Pr.
Guyton AC, Hall JE. 1997. Sel Darah Merah, Anemia, dan Polisitimia. Didalam Fisiologi Kedokteran. Irawati, Tengadi LMA, Santoso A, penerjemah. Jakarta (ID): E. G. C. hlm 93-130.
Hemid AEA, El-Gawad AHA, El-Wardany I, El-Daly FE, El-Azeem ANA. 2010. Alleviating effect of some environmental stress factors on productive performance in Japanese Quail 2. laying performance. World Journal of Agricultural Sciences. 6(5):517-524
25 Hrabcakova P, Voslarova E, Bedanova I, Pistekova V, Chloupek J. 2014. Changes in selected haematological and biochemical parameters in debeaked pheasant hens during the laying period. Ankara Univ Vet Fak Derg. 61:111-117.
Ido A, Iwai T, Ito K, Ohta T, Mizushige T, Kishida T, Miura C, Miura T. 2015. Dietary effects of housefly (Musca domestica) (Diptera : Muscidae) pupae on the growth performance and the resistance against bacterial pathogen in the red sea bream (Pagrus major) (Perciformes : Sparidae). Appl Entomol Zool. 50:213-221.
Kusnadi E. 2009. Pengaruh berbagai cekaman terhadap perubahan beberapa komponen dan biokimia darah unggas. Seminar Nasional Teknologi Peternakan dan Veteriner ; 2009. Balai Besar Veteriner. hlm 580-585. Leeson S, Summers JD. 2005. Commercial Poultry Nutrition. 3rd Ed. Canada
(US): Guelph Univ.
Liu GQ, Zhang KC. 2006. Effects of water and ethanol extracts of insects on polysaccharide production by submerged fermentation of Ganoderma lucidum. Mycosystema. 25(2):308-315.
Long S, Ying F, Zhao HE, Tao MA, Xin Z. 2007. Studies on alkaline solution extraction of polysaccharide from silkworm pupa and its immunomodulating activities. Forest Res. 20(6):782-786.
Mattjik AA, Sumertajaya M. 2002. Perancangan Percobaan dan Aplikasi SAS dan Minitab. Jilid I. Ed ke-2. Bogor (ID): IPB Pr.
Melvin JS, William OR. 1993. Duke’s Physiology of Domestic Animals. 11th ed. London (UK): Cornell University Pr.
Muhammad HK. 2013. Study the effect of age and sex on some haemotological parameters in Golden Local Quail. Bas J Vet Res. 12(1):135-141.
Ohta T, Ido A, Kusano K, Miura C, Miura T. 2014. A novel polysaccharide in insects activates the innate immune system in mouse macrophage RAW264 cells. PLoS ONE. 9:0114823.
Parihar A, Eubank TD, Doseff AI. 2010. Monocytes and machropages regulate immunity through dynamics networks of survival and cell death. J Innate Immun. 2:204-205.
Piliang GW, Djojosoebagio S. 2006. Fisiologi Nutrisi Volume ke-1. Bogor (ID): IPB Pr.
Rizki P. 2014. Substitusi protein bungkil kedelai dengan protein tepung pucuk
Indigofera zollingeriana untuk menghasilkan telur fungsional tinggi antioksidan [tesis]. Bogor (ID): Institut pertanian Bogor.
Rumpold BA, Schluter OK. 2013. Nutritional composition and safety aspects of edible insects. Mol Nutr Food Res. 57:802-23.
Sastradipradja D, Sikar SHS, Wijayakusuma R, Ungerer T, Maad A, Nasution H, Suriawinata R, Hamzah R. 1989. Penuntun Praktikum Fisiologi Veteriner. Pusat Antar University Ilmu Hayati. Institut pertanian Bogor, Bogor.
Singhal BK, Dhar A, Sharma A, Qadri SMH, Ahsan MM. 2001. Sericultural by-product for various valuable commercial by-product as emerging bio science industry. Sericologia. 41(3):369-391.
26
Sujana E, Tanwiriah W, Widjastuti T. 2012. Evaluation on Quails (Coturnix coturnix japonica) growth performance among the breeding centre of village communities in West Java. J Zootehnie. 58:70-72.
Sun L, Feng Y, HE Z, Ma T, Zhang X. 2007. Studies on alkaline solution extraction of polysaccharide from silkworm pupa and its immunomodulating activities. Forest Research. 20(6):782-786.
Swenson MJ. 1984. Duke’s Physiology of Dinamic. 10th ed. London (GB). Cornell Univ.
Swevers L, Smagghe G, Liu J. 2013. Transcriptional response of BmToll9-1 and RNAi machinery genes to exogenous dsRNA in the midgut of Bombyx mori. J Insect Physiology. 59:646-654.
Tamzil MH, Noor RR, Hardjosworo PS, Manalu W, Sumantri C. 2014. Hematological response of chickens with different heat shock protein 70 genotypes to acute heat stress. Int J Poult Sci. 13:14-20.
Tizard IR. 1988. Pengantar Imunologi Veteriner. Ed Ke-2. Partodirejo M, penerjemah. Surabaya (ID): Airlangga Unversity Pr.
Tizard IR. 2000. Veterinary Immunology an Introduction. 3th ed. USA (US). Saundres.
Vézina F, Salvante KG, Williams TD. 2003. The metabolic cost of avian egg formation: Possible impact of yolk precursor production. J Exp Biol. 206:4443-4451.
Wagner CE, Prevolsek JS, Wynne KE, Williams TD. 2008. Hematological changes associated with egg production: estrogen dependence and repeatibility. J Exp Biol. 2011:400-408
Williams TD, Challenger WO, Christians JK, Evanson M, Love O, Vezina F. 2004. What causes the decrease in hematokrit during egg production?. Func Eco. 18:330-336.
Yao H, Wu X, Gokulamma K. 2006. Antiviral activity in the mulberry silkworm, Bombyx mori L. J Zhejiang Univ SCIENCE A. 7:350-356.
Yeo Y, Cho M, Jeon B, Seo H, Kwon T, Ryu S. 2013. Changes of pupa powder ingestion on inflammatory cytokine in rats. J Exerc Nutr Biochem. 17(3):71-80.
27
LAMPIRAN
Lampiran 1 Gambar kandang puyuh Departemen Biologi, FMIPA-IPB