ISOLASI DAN IDENTIFIKASI BAKTERI PELARUT
FOSFAT DAN KALIUM DARI KAWASAN SEKITAR
TAMBANG BATU KAPUR CIREBON
ELIYA MURSYIDA
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA
Dengan ini saya menyatakan bahwa tesis berjudul Isolasi dan Identifikasi Bakteri Pelarut Fosfat dan Kalium dari Kawasan Sekitar Tambang Batu Kapur Cirebon adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Agustus 2015
Eliya Mursyida
RINGKASAN
ELIYA MURSYIDA. Isolasi dan Identifikasi Bakteri Pelarut Fosfat dan Kalium dari Kawasan Sekitar Tambang Batu Kapur Cirebon. Dibimbing oleh NISA RACHMANIA MUBARIK dan ARIS TJAHJOLEKSONO.
Fosfor (P) dan kalium (K) merupakan unsur utama makronutrien yang diperlukan untuk pertumbuhan dan perkembangan tanaman. Kebutuhan P dan K untuk tanaman umumnya dipenuhi melalui aplikasi pemupukan. Namun upaya tersebut menjadi tidak efisien karena P terikat menjadi Fe-P atau Al-P pada tanah masam atau Ca-P pada tanah basa, dan K mudah tercuci oleh air di dalam tanah, sehingga P dan K tidak tersedia bagi tanaman. Kurang efisiennya penggunaan pupuk P dan K dapat diatasi dengan memanfaatkan bakteri pelarut fosfat (BPF) dan bakteri pelarut kalium (BPK) sebagai pupuk hayati. Tujuan penelitian ini ialah untuk mengisolasi dan identifikasi bakteri pelarut fosfat dan kalium dari kawasan sekitar tambang batu kapur Cirebon dalam upaya reklamasi tambang batu kapur.
Penelitian ini diawali dengan pengambilan sampel tanah secara acak pada kedalaman tanah 0-15 cm. Bakteri tanah diisolasi menggunakan metode pengenceran serial dan disebar pada medium Pikovskaya dan Aleksandrov. Isolat yang membentuk zona bening dimurnikan dengan menggunakan metode gores kuadran. Isolat yang murni ditumbuhkan kembali pada medium Pikovskaya dan Aleksandrov untuk mengetahui pelarutan P dan K berdasarkan indeks pelarutannya. Isolat yang memiliki kemampuan pelarutan P dan K tertinggi, digunakan dalam pembuatan kurva pertumbuhan dan estimasi secara kuantitatif untuk mengetahui aktivitas pelarutan P dan K. Identifikasi secara morfologi dan fisiologi dilakukan dengan menggunakan API Kit 20 NE, sedangkan identifikasi secara molekuler dilakukan berdasarkan sekuen gen 16S rRNA.
Hasil penelitian menunjukkan bahwa 12 isolat dari 45 isolat bakteri pelarut P yang diisolasi dari sampel tanah sekitar kawasan tambang batu kapur Cirebon mampu melarutkan K. Berdasarkan nilai indeks pelarutan diperoleh tiga isolat terpilih yang mampu melarutkan P dan K tertinggi yaitu isolat QC3.a.1, QC3.a.2 dan QC3.d.5. Hasil estimasi kuantitatif menunjukkan bahwa isolat QC3.a.2 memiliki kemampuan pelarutan P tertinggi pada medium Pikovskaya cair, dan isolat QC3.a.1 memiliki kemampuan pelarutan K tertinggi pada medium Aleksandrov cair. Hasil identifikasi secara fisiologi menggunakan API Kit 20 NE menunjukkan bahwa isolat QC3.d.5 merupakan bakteri Pseudomonas sp. dengan tingkat kemiripan 99%. Hasil analisis sekuen gen 16S rRNA menunjukkan bahwa isolat QC3.a.1 berkerabat dekat dengan Burkholderia cepacia, QC3.a.2 berkerabat dekat dengan Serratia marcescens dan S. nematodiphila, dan QC3.d.5 berkerabat dekat dengan Pseudomonasputida.
SUMMARY
ELIYA MURSYIDA. Isolation and Identification of Phosphate and Potassium Solubilizing Bacteria from the Area Around the Limestone Mining in Cirebon Quarry. Supervised by NISA RACHMANIA MUBARIK and ARIS TJAHJOLEKSONO.
Phosphorus (P) and potassium (K) are important macronutrients that necessary for growth and development of plants. The needs of P and K in plants are usually obtained through fertilizer application. However, such effort became inefficient because P is bound to Fe-P or Al-P in acid soil or Ca-P in alkaline soil, and K is easily leached by water in the soil, so that P and K are unavailable for plants. The inefficiency problem of P and K fertilizer can be solved by using phosphate solubilizing bacteria (PSB) and potassium solubilizing bacteria (KSB) as biological fertilizer. This study aimed to isolate and identify the phosphate and potassium solubilizing bacteria from the area around limestone Cirebon Quarry in relation to the effort of limestone mining reclamation.
This study was conducted using soil samples taken randomly from 0-15 cm soil depth. The bacteria were isolated from soil samples using serial dilutions and plated on Pikovskaya and Aleksandrov solid medium. Isolates forming clear zone were purified using quadrant method. Pure isolates were regrown using dot method on Pikovskaya and Aleksandrov solid medium to determined the ability of bacteria to solubilize P and K. Isolates having highest ability to solubilize P and K were used to determine the growth curve and to estimate quantitatively the P and K solubilization activity. Morphological and physiological identification were conducted using API 20 NE Kit, while molecular identification was realized based on 16S rRNA gene sequence.
The result showed that 12 of 45 bacterial isolates obtained from soil sample area around the limestone mining in Cirebon were capable to solubilize K mineral. Based on the solubility index, three isolates having the highest ability to solubilize P and K were selected. The results of quantitative estimation of selected isolates to solubilize P and K showed that isolate QC3.a.2 has the highest ability to solubilizing of P in Pikovskaya liquid medium, and the isolate QC3.a.1 has the highest activity in solubilizing K in Aleksandrov liquid medium. Physiological identification using API 20 NE Kit showed that isolate QC3.d.5 is Pseudomonas
sp. with similarity level of 99%. Sequence analysis of 16S rRNA gene showed that the isolate QC3.a.1 was closely related to Burkholderia cepacia, QC3.a.2 was closely related to Serratia marcescens and S. nematodiphila, and QC3.d.5 was closely related to Pseudomonas putida.
© Hak Cipta Milik IPB, Tahun 2015
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
Program Studi Mikrobiologi
ISOLASI DAN IDENTIFIKASI BAKTERI PELARUT
FOSFAT DAN KALIUM DARI KAWASAN SEKITAR
TAMBANG BATU KAPUR CIREBON
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
BOGOR 2015
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah subhanahu wa ta’ala atas segala karunia-Nya sehingga karya ilmiah ini berhasil diselesaikan. Tema yang dipilih dalam penelitian yang dilaksanakan sejak bulan Mei sampai Desember 2014 ini ialah isolasi dan identifikasi bakteri pelarut fosfat dan kalium dari kawasan sekitar tambang batu kapur Cirebon.
Terima kasih penulis ucapkan kepada Ibu Dr Nisa Rachmania Mubarik, MSi sebagai ketua komisi pembimbing dan Bapak Dr Ir Aris Tjahjoleksono, DEA sebagai anggota komisi pembimbing, yang telah banyak memberikan nasehat, saran, motivasi, serta solusi dari setiap permasalahan yang dihadapi penulis selama melaksanakan penelitian dan penyusunan karya ilmiah ini. Selain itu penulis ucapkan terima kasih kepada penguji luar komisi Dr Rahayu Widyastuti, MScAgr dan Prof Dr Anja Meryandini, MS selaku Ketua Program Studi Mikrobiologi IPB yang telah memberikan nasehat dan saran saat ujian tesis. Di samping itu, penghargaan penulis sampaikan kepada Staf PT Indocement, Tbk yang telah memberikan kesempatannya dalam The Quarry Life Award 2014.
Penulis juga mengucapkan terima kasih kepada Ibu Heni dan Bapak Jaka selaku teknisi Laboratorium Mikrobiologi IPB, Mba Rike, Mba Eja, Mba Cesa, Mba Anja, Kak Sipri, Bang Risky, Erni, Dame, Meli, Zizah, Cico, Sukma, Eka, Mei serta seluruh teman-teman di Laboratorium IPB, atas dukungan, motivasi dan bantuannya selama penelitian ini. Ucapan terima kasih tak terhingga dan paling spesial penulis sampaikan kepada kedua orang tua tercinta Mama & Papa, Bang Edwin, Zeno, serta seluruh keluarga dan sahabat-sahabatku Ellarisya, atas segala do’a, dukungan, dan kasih sayangnya. Terima kasih untuk teman-teman seperjuangan di Pascasarjana Mikrobiologi IPB angkatan 2012 dan 2013 serta seluruh pihak yang telah memberikan do’a dan dukungannya.
Semoga karya ilmiah ini bermanfaat.
Bogor, Agustus 2015
DAFTAR ISI
DAFTAR TABEL vii
DAFTAR GAMBAR vii
DAFTAR LAMPIRAN vii
PENDAHULUAN 1
Latar Belakang 1
Perumusan Masalah 2
Tujuan Penelitian 2
Manfaat Penelitian 2
Ruang Lingkup Penelitian 2
TINJAUAN PUSTAKA 2
Pentingnya Nitrogen, Fosfor dan Kalium untuk Tanaman 2
Nitrogen 3
Fosfor 3
Kalium 3
Bakteri Pelarut Fosfat 4
Bakteri Pelarut Kalium 4
Mekanisme Pelarutan P dan K oleh Mikrob Tanah 5 Reklamasi Tambang serta Pemanfaatan Mikrob Tanah 5
METODE 6
Kerangka Penelitian 6
Waktu dan Tempat 6
Bahan 7
Pengambilan Sampel Tanah 7
Isolasi Bakteri Pelarut Fosfat dan Kalium dari Tanah 7 Pengujian Kemampuan Bakteri dalam Melarutkan P dan K 7
Penentuan Kurva Pertumbuhan Isolat Terpilih 8
Estimasi Kuantitatif Pelarutan P dan K 8
Identifikasi Bakteri secara Morfologi dan Fisiologi 8
Identifikasi Molekuler Isolat Terpilih 9
HASIL 10
Isolasi Bakteri Pelarut Fosfat dan Kalium dari Tanah 10 Pengujian Kemampuan Bakteri dalam Melarutkan P dan K 10
Kurva Pertumbuhan Isolat Terpilih 10
Estimasi Kuantitatif Pelarutan P dan K 11
Identifikasi Bakteri secara Morfologi dan Fisiologi 12
Identifikasi Molekuler Isolat Terpilih 13
DAFTAR ISI (Lanjutan)
SIMPULAN DAN SARAN 17
Simpulan 17
Saran 17
DAFTAR PUSTAKA 18
LAMPIRAN 22
DAFTAR TABEL
1 Hasil pengujian tiga isolat terpilih dalam melarutkan P dan K 11 2 Karakteristik tiga isolat terpilih berdasarkan pengamatan morfologi 13
DAFTAR GAMBAR
1 Diagram alur penelitian 6
2 Isolat bakteri QC3.a.1 pada medium Pikovskaya dan Aleksandrov 10 3 Pengujian kemampuan tiga isolat terpilih dalam melarutkan P dan K 11 4 Kurva pertumbuhan tiga isolat terpilih pada medium Nutrient Broth
selama 39 jam inkubasi 11
5 Jumlah sel dan konsentrasi pelarutan P dan K dari tiga isolat terpilih 12 6 Hasil pewarnaan Gram diamati pada perbesaran 1000x 13 7 Hasil amplifikasi gen 16S rRNA dari tiga isolat terpilih 14 8 Konstruksi pohon filogenetik dari tiga isolat terpilih berdasarkan
sekuen gen 16S rRNA 14
DAFTAR LAMPIRAN
1 Lokasi pengambilan sampel tanah pada kawasan sekitar tambang batu
kapur Cirebon 22
2 Kurva log jumlah sel terhadap turbiditas dari isolat bakteri QC3.a.1 22 3 Kurva log jumlah sel terhadap turbiditas dari isolat bakteri QC3.a.2 22 4 Kurva log jumlah sel terhadap turbiditas dari isolat bakteri QC3.d.5 23
5 Kurva standar estimasi KH2PO4 23
6 Tahapan isolasi DNA berdasarkan protokol PrestoTM gDNA Bakteria
Mini Kit (Geneaid) 23
7 Hasil pengujian 45 isolat bakteri dalam melarutkan P dan K 24 8 Identifikasi 45 isolat bakteri secara morfologi 25 9 Hasil identifikasi fisiologi isolat QC3.d.5 menggunakan API Kit 20 NE 26 10 Kualitas DNA hasil ekstraksi dari tiga isolat terpilih 26
11 Sekuen isolat bakteri QC3.a.1 27
12 Sekuen isolat bakteri QC3.a.2 28
13 Sekuen isolat bakteri QC3.d.5 29
14 Kesamaan sekuen tiga isolat terpilih dengan spesies pembanding pada
database NCBI 30
15 Hasil analisis kimia tanah kawasan sekitar tambang batu kapur Cirebon 30
PENDAHULUAN
Latar Belakang
Fosfor (P) dan kalium (K) merupakan unsur utama makronutrien yang diperlukan untuk pertumbuhan dan perkembangan tanaman. Kebutuhan P dan K untuk tanaman umumnya dipenuhi melalui aplikasi pemupukan. Namun upaya tersebut menjadi tidak efisien bagi tanaman karena P terikat menjadi Fe-P atau Al-P pada tanah masam atau Ca-Al-P pada tanah basa (Lindsay et al. 1989), sedangkan K mudah tercuci oleh air di dalam tanah. Kurang efisiennya penggunaan pupuk P dan K dapat diatasi dengan memanfaatkan mikrob pelarut fosfat dan kalium, salah satunya yaitu bakteri pelarut fosfat (BPF) dan bakteri pelarut kalium (BPK) sebagai pupuk hayati.
Fosfat dan kalium di dalam tanah terikat dalam bentuk batuan P, mineral K, atau deposit lainnya (Goldstein 1994) yang tidak dapat diserap oleh tanaman. Fosfat dan kalium dibuat tersedia bagi tanaman ketika P dan K dikonversi dalam bentuk terlarut (Bertsch dan Thomas 1985; Kpomblekou dan Tabatabai 1994). Tanaman menyerap P dalam bentuk ion H2PO4-, HPO42-, dan PO43- , sedangkan K dalam bentuk ion K+. Fosfat berperan penting dalam merangsang pembungaan, kematangan buah, dan pembentukan biji (Tucker 2001), sedangkan kalium berperan penting dalam pertumbuhan dan reproduksi tanaman (Badr 2006).
Bakteri pelarut P diketahui mampu melarutkan P dengan melepaskan senyawa P melalui mekanisme pembentukan khelat, reaksi pertukaran, dan produksi asam organik (Chen et al. 2006). Beberapa kelompok bakteri yang umumnya diketahui mampu melarutkan P antara lain Pseudomonas, Bacillus,
Azotobacter, Agrobacterium, Achromobacter, Rhizobium, Acinotebacter,
Paenibacillus, Serratia, Burkholderia, Flavobacterium,dan Micrococcus (Chen et al. 2006; Islam et al. 2007; Walpola dan Yoon 2013; Don dan Diep 2014).
Bakteri pelarut K mampu melarutkan mineral K seperti mika, illit, dan ortoklas yang terdapat di dalam tanah melalui produksi dan sekresi asam organik (Friedrich et al. 1991), serta produksi polisakarida kapsuler (Sheng dan He 2006) yang kemudian dapat diserap oleh tanaman. Beberapa kelompok bakteri pelarut K diketahui mampu melarutkan K seperti Pseudomonas, Burkholderia, Azotobacter,
Rhizobium, Bacillus, dan Paenibacillus (Hu et al. 2006; Singh et al. 2010; Don dan Diep 2014) dan dapat digunakan sebagai pupuk hayati.
2
Perumusan Masalah
Pertambangan yang dilakukan secara terbuka mengakibatkan terjadinya perubahan sifat fisik, kimia, dan biologi tanah. Revegetasi di daerah pertambangan biasanya tidak mencapai keberhasilan yang diinginkan karena tingginya angka kematian suatu spesies atau lambatnya pertumbuhan spesies yang ditanam. Hal ini disebabkan oleh kurangnya ketersediaan unsur-unsur hara bagi tanaman. Mikrob yang meliputi BPF dan BPK dinilai dapat digunakan sebagai salah satu alternatif untuk mengatasi ketersediaan unsur hara terutama P dan K di lahan reklamasi bekas tambang batu kapur.
Tujuan Penelitian
Tujuan penelitian ini ialah melakukan isolasi dan identifikasi bakteri pelarut fosfat dan kalium dari kawasan sekitar tambang batu kapur Cirebon, dan mempelajari kemampuan bakteri dalam melarutkan P dan K.
Manfaat Penelitian
Penelitian ini diharapkan dapat memberikan informasi mengenai spesies bakteri pelarut fosfat dan kalium yang potensial untuk dimanfaatkan dalam upaya reklamasi tambang batu kapur serta upaya peningkatan pertumbuhan dan produktivitas tanaman pada daerah lahan bekas tambang.
Ruang Lingkup Penelitian
Ruang lingkup dalam penelitian ini meliputi pengujian kemampuan bakteri dalam melarutkan P dan K berdasarkan indeks pelarutan, estimasi kuantitatif pelarutan P dan K, identifikasi bakteri secara morfologi, fisiologi, serta analisis gen 16S rRNA isolat terpilih.
TINJAUAN PUSTAKA
Pentingnya Nitrogen, Fosfor, dan Kalium untuk Tanaman
3 Menurut Wu et al. (2005), penggunaan pupuk hayati tidak hanya meningkatkan kadar unsur hara pada tanaman seperti N, P dan K, tetapi juga menjaga kandungan senyawa organik dan N-total dalam tanah. Hal lain yang menguntungkan ialah bahwa mikrob tanah dapat mendorong peningkatan pertumbuhan rambut-rambut akar sehingga penyerapan air dan hara menjadi lebih efisien.
Nitrogen
Nitrogen sangat penting dalam pembentukan protein dan senyawa lainnya. Pada dasarnya, nitrogen diambil oleh tanaman dalam bentuk nitrat (NO3-) atau amonium (NH4+). Amonium diproduksi oleh dekomposer dan bakteri nitrogen tanah melalui proses amonifikasi. Bakteri nitrifikasi akan mengubah amonium menjadi nitrit sebagai senyawa perantara melalui proses nitrifikasi sebelum diubah menjadi nitrat yang akan diambil oleh tanaman dalam proses asimilasi.
Pupuk N, bila diaplikasikan pada tanah, akan cepat meningkatkan konsentrasi ion amonium dalam larutan tanah, tetapi segera hilang melalui penyerapan oleh tanaman, imobilisasi oleh mikrob, pencucian, dan denitrifikasi (Houng 1976). Nitrogen yang hilang dapat dikembalikan ke dalam tanah melalui pelapukan sisa mahluk hidup (bahan organik) melalui bantuan mikrob tanah.
Fosfor
Fosfor merupakan unsur utama yang diperlukan tanaman setelah nitrogen. Fosfor yang diserap tanaman tidak direduksi, melainkan berada dalam bentuk teroksidasi seperti senyawa-senyawa organik dan anorganik. Peranan P bagi tanaman antara lain merupakan komponen membran sitoplasma dan kloroplas, proses metabolisme tanaman seperti ATP, ADP, dan AMP, pembentukan nukleotida dalam penyusunan DNA dan RNA (Salisbury dan Ross 1995).
4
untuk pembentukan protein dan selulosa. Unsur K dapat meningkatkan respon tanaman terhadap pemupukan dan meningkatkan efisiensi penggunaan pupuk N dan P. Kalium dalam jumlah yang cukup akan menjamin ketegaran tanaman dan merangsang pertumbuhan akar. Kalium memperkuat batang tanaman yang berarti mempertinggi ketahanan tanaman terhadap serangan cendawan patogen seperti
Pyricularia oryzae dan Helminthosporium.
Sebagian tanah di dunia, kandungan K tersedia sangat rendah untuk produksi hasil tanaman yang baik. Konsentrasi K tersedia berkisar antara 1-2% di dalam tanah yang dapat diserap langsung oleh tanaman (Goldstein 1994). Kelompok mikrob tertentu seperti bakteri, jamur, dan aktinomiset diketahui mampu melarutkan mineral K menjadi bentuk yang larut yang dapat dimanfaatkan oleh tanaman. Pemanfaatan mikrob pelarut K dapat memberikan alternatif potensial untuk membuat K tersedia dan dapat diserap oleh tanaman.
Bakteri Pelarut Fosfat
Bakteri pelarut fosfat (BPF) merupakan kelompok bakteri tanah yang memiliki kemampuan melarutkan P yang terfiksasi dalam tanah dan mengubahnya menjadi bentuk yang tersedia. Bakteri pelarut P ini dapat berupa bakteri
Pseudomonas, Rhodococcus, Bacillus, dan Streptomyces. Menurut Rodriguez dan Fraga (1999), dari beberapa kelompok bakteri, ternyata genus Pseudomonas dan
Bacillus mempunyai kemampuan yang tinggi dalam melarutkan P.
Keefektifan bakteri pelarut P yang hidup dalam permukaan akar seperti
Pseudomonas fluorescens, P. putida, dan P. striata tidak hanya disebabkan oleh kemampuannya dalam meningkatkan ketersediaan unsur P, tetapi juga kemampuannya dalam menghasilkan zat pengatur tumbuh. Mikrob-mikrob tersebut dapat menghasilkan zat pengatur tumbuh seperti asam indol asetat (IAA) dan asam giberellin (GA3) (Arshad dan Frankenberger 1993; Patten dan Glick 1996), serta memiliki kemampuan sebagai agens biokontrol dan menurunkan endosulfan seperti pestisida organoklorin (Kukreja et al. 2010).
Bakteri Pelarut Kalium
Bakteri pelarut kalium (BPK) merupakan kelompok bakteri tanah yang memiliki kemampuan melarutkan mineral K seperti mika, illit, dan ortoklas. Bakteri pelarut K dapat melarutkan mineral K menjadi bentuk terlarut melalui produksi dan sekresi asam organik. Bakteri pelarut K ini dapat berupa
Pseudomonas, Bacillus, Erwinia,dan Streptomyces. Menurut Raj (2004), ternyata genus Bacillus mempunyai kemampuan yang lebih efisien dalam melarutkan mineral K atau silikat pada kondisi in vitro.
Penggunaan bakteri pelarut K pada tanaman dilaporkan dapat memberikan efek yang menguntungkan pada pertumbuhan kapas dan lobak (Sheng 2005), merica dan mentimun (Han et al. 2006), tomat (Badr 2006), gandum (Sheng dan He 2006), dan rumput sudan (Basak dan Biswas 2008). Menurut Singh et al. (2010), inokulasi tanaman jagung dan gandum dengan Bacillus maciloginosus,
5 yang lebih tinggi dari limbah mika, sehingga dapat dimanfaatkan untuk pertumbuhan tanaman. Dengan demikian, penerapan bakteri pelarut K sebagai pupuk hayati untuk perbaikan pertanian dapat mengurangi penggunaan pupuk kimia dan mendukung produksi tanaman yang ramah lingkungan.
Mekanisme Pelarutan P dan K oleh Mikrob Tanah
Pelarutan senyawa P oleh mikrob pelarut P dapat berlangsung secara kimia dan biologi. Mekanisme pelarutan P secara kimia merupakan mekanisme pelarutan P utama yang dilakukan oleh mikrob pelarut P. Mikrob pelarut P mensekresikan sejumlah asam organik berbobot molekul rendah seperti oksalat, suksinat, tartat, sitrat, laktat, alfa ketoglutarat, asetat, formiat, propionat, glikolat, glutamat, glioksilat, malat, fumarat. Asam-asam organik ini dapat membentuk khelat(kompleks stabil) dengan kation Al, Fe atau Ca yang mengikat P, sehingga ion H2PO4- menjadi bebas dari ikatannya dan tersedia bagi tanaman untuk diserap (Illmer dan Schinner 1992; Hasanudin 2006).
Mekanisme pelarutan P secara biologi oleh mikrob pelarut P dilakukan dengan cara menghasilkan enzim antara lain enzim fosfatase. Fosfatase merupakan enzim yang akan dihasilkan apabila ketersediaan P rendah. Fosfatase disekresikan oleh akar tanaman dan lebih dominan oleh mikrob di dalam tanah (Joner et al. 2000). Dalam proses mineralisasi bahan organik, senyawa P organik diuraikan menjadi bentuk P anorganik yang tersedia bagi tanaman dengan bantuan enzim fosfatase. Enzim fosfatase dapat melepaskan P yang terikat pada senyawa-senyawa organik menjadi bentuk yang tersedia.
Mekanisme pelarutan K dari mineral K tidak larut seperti mika, illit dan ortoklas ialah dengan mensekresikan asam organik oleh bakteri pelarut K yang secara langsung melarutkan batuan K atau mengkhelat ion silikat untuk membawa K ke dalam bentuk terlarut (Aleksandrov et al. 1967; Bennett et al. 1998). Selain itu, Styriakova et al. (2003) mengatakan bahwa pelarutan K terjadi karena adanya pembentukan kompleks antara asam organik yang disekresikan bakteri dan ion logam yang berikatan dengan mineral K seperti Fe2+, Al3+, dan Ca2+.
Reklamasi Tambang serta Pemanfaatan Mikrob Tanah
Reklamasi adalah usaha untuk memperbaiki atau memulihkan kembali lahan yang rusak sebagai akibat kegiatan usaha pertambangan agar dapat berfungsi dan berdaya guna sesuai dengan kemampuannya. Reklamasi lahan bekas tambang merupakan upaya untuk memperbaiki kondisi lingkungan pasca tambang, juga untuk menghasilkan lingkungan ekosistem yang lebih baik dibandingkan rona awalnya. Proses reklamasi pada lahan bekas tambang dilakukan dengan mempertimbangkan potensi bahan galian yang masih tertinggal. Namun, upaya perbaikan dengan cara ini masih dirasakan kurang efektif, hal ini karena tanaman secara umum kurang dapat beradaptasi dengan lingkungan ekstrim, termasuk bekas lahan tambang.
6
saja terbatas pada penyediaan unsur hara, tetapi juga aktif dalam dekomposisi serasah dan bahkan dapat memperbaiki struktur tanah. Dengan demikian, untuk memperbaiki lahan bekas tambang perlu dilakukan pemanfaatan mikrob terutama bakteri pelarut P dan bakteri pelarut K yang diharapkan dapat menjadi biofertilizer yang mampu memberikan unsur P dan K yang tersedia bagi tanaman, sehingga tanaman dapat memanfaatkannya (Mursyidin 2009).
METODE
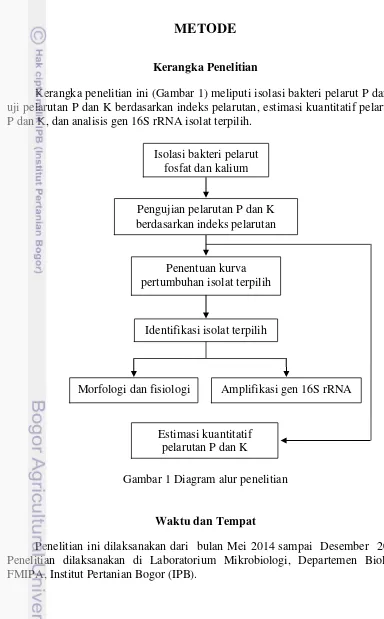
Kerangka Penelitian
Kerangka penelitian ini (Gambar 1) meliputi isolasi bakteri pelarut P dan K, uji pelarutan P dan K berdasarkan indeks pelarutan, estimasi kuantitatif pelarutan P dan K, dan analisis gen 16S rRNA isolat terpilih.
Gambar 1 Diagram alur penelitian
Waktu dan Tempat
Penelitian ini dilaksanakan dari bulan Mei 2014 sampai Desember 2014. Penelitian dilaksanakan di Laboratorium Mikrobiologi, Departemen Biologi, FMIPA, Institut Pertanian Bogor (IPB).
Isolasi bakteri pelarut fosfat dan kalium
Pengujian pelarutan P dan K berdasarkan indeks pelarutan
Penentuan kurva pertumbuhan isolat terpilih
Estimasi kuantitatif pelarutan P dan K Identifikasi isolat terpilih
7
Bahan
Bahan yang digunakan pada penelitian ini ialah sampel tanah yang berasal dari kawasan sekitar tambang batu kapur PT Indocement Tbk, Palimanan, Cirebon (Lampiran 1).
Pengambilan Sampel Tanah
Pengambilan sampel tanah dilakukan dengan menggunakan metode
purposive random sampling. Sampel tanah diambil secara acak dari 10 titik pada lapisan permukaan antara 0-15 cm.
Isolasi Bakteri Pelarut Fosfat dan Kalium dari Tanah
Sebanyak 3 gram sampel tanah dimasukkan ke dalam 27 ml larutan garam fisiologis 0.85%, dan diinkubasi dalam inkubator goyang pada kecepatan 120 rpm selama 4 jam pada suhu ruang, kemudian dibuat pengenceran serial sampai 10-4. Sebanyak 0.1 ml dari pengenceran 10-2 sampai 10-4 disebar di atas permukaan medium agar-agar Pikovskaya yang terdiri atas 10 g C6H12O6, 5 g Ca3(PO4)2, 0.5 g (NH4)2SO4, 0.2 g KCl, 0.1 g MgSO4.7H2O, 0.002 g MnSO4.7H2O, 0.002 g FeSO4.7H2O, 0.1 g NaCl, 0.5 g ekstrak khamir, 20 g agar-agar dalam 1000 ml dengan pH 7 (Nautiyal 1999), dan medium agar-agar Aleksandrov yang terdiri atas 5 g C6H12O6, 0.5 g MgSO4.7H2O, 0.1 g CaCO3, 0.006 g FeCl3, 2 g Ca3(PO4)2, 3 g KAlSi3O8 (feldspar), 20 g agar-agar dalam 1000 ml dengan pH 7 (Prajapati dan Modi 2012), dan diinkubasi selama 3 hari pada suhu ruang. Pertumbuhan koloni bakteri pelarut P dan K ditandai dengan pembentukan zona bening di sekitar koloni. Koloni-koloni yang diinginkan selanjutnya dimurnikan dengan metode gores kuadran pada medium Pikovskaya dan Aleksandrov untuk mendapatkan koloni tunggal. Isolat yang diperoleh disimpan sebagai stok untuk uji selanjutnya.
Pengujian Kemampuan Bakteri dalam Melarutkan P dan K
8
Penentuan Kurva Pertumbuhan Isolat Terpilih
Sebanyak 1 lup kultur isolat bakteri terpilih diinokulasikan ke dalam 50 ml medium Nutrient Broth (NB) dan diinkubasi dengan inkubator goyang hingga sel bakteri mencapai 107 CFU/ml. Sebanyak 1 ml kultur 107 CFU/ml diinokulasikan ke dalam 100 ml medium NB, lalu diinkubasi dengan inkubator goyang berkecepatan agitasi 100 rpm pada suhu 37 oC selama 24-48 jam. Setiap 3 jam dilakukan pengambilan kultur sel untuk pengukuran densitas selnya menggunakan spektrofotometer Genesys 20 pada panjang gelombang 620 nm. Jumlah sel dihitung dengan menggunakan kurva log jumlah sel terhadap turbiditas dari tiga isolat terpilih yang dibuat sebelumnya (Lampiran 2, 3 dan 4).
Estimasi Kuantitatif Pelarutan P dan K
Estimasi kuantitatif P yang dilarutkan oleh isolat bakteri terpilih dilakukan berdasarkan metode Lynn et al. (2013). Sebanyak 1 lup kultur bakteri diinokulasikan ke dalam 50 ml medium Pikovskaya cair, kemudian diinkubasi dalam inkubator goyang selama 48 jam. Setelah inkubasi, sebanyak 1 ml kultur diinokulasikan ke dalam 100 ml medium Pikovskaya cair, dan diinkubasi dalam inkubator goyang selama 7 hari pada suhu 37 oC. Setiap 24 jam, sebanyak 1.5 ml kultur bakteri disentrifugasi pada kecepatan 10.600 g selama 10 menit untuk memisahkan sel bakteri dari supernatan. Supernatan hasil sentrifugasi diambil sebanyak 1 ml dan direaksikan dengan pereaksi pembentuk warna (2.5 ml natrium molibdat 2.5% dan 1 ml hidrazin sulfat 0.3%), kemudian dipanaskan selama 10 menit dan didinginkan. Setelah terbentuk warna biru, aktivitas pelarutan P diukur dengan spektrofotometer Genesys 20 pada panjang gelombang 830 nm. Kurva standar dibuat dengan menggunakan konsentrasi KH2PO4 untuk standar 0, 20, 40, 60, 80, dan 100 ppm (Lampiran 5).
Estimasi kuantitatif K yang dilarutkan oleh isolat bakteri terpilih dilakukan berdasarkan metode Parmar dan Sindhu (2013). Sebanyak 1 lup kultur bakteri memisahkan koloni bakteri dari supernatan. Jumlah kalium terlarut dalam supernatan diukur dengan spektrofotometer serapan atom Shimadzu AA-7000 dengan flame air-C2H2 pada panjang gelombang 766.5 nm. Kurva standar dibuat dengan menggunakan konsentrasi KCl untuk standar 0, 0.5, 1, 1.5, dan 2 ppm.
Identifikasi Bakteri secara Morfologi dan Fisiologi
9 metode Analytical Profile Index (API) 20 NE biochemical test kit (bioMerieux, Inc. Durham, USA). Isolat ditumbuhkan pada medium NA dan diinkubasi pada suhu 37 oC selama 24 jam. Sebanyak 1 lup isolat dilarutkan dalam 2 ml garam fisiologi 0.85%, dan dihomogenkan. Selanjutnya, sebanyak 200 μl suspensi isolat bakteri diteteskan ke dalam sumur tanpa garis, dan 200 μl suspensi isolat bakteri ditambahkan ke medium API Kit lalu diteteskan ke dalam sumur bergaris. Pembacaan hasil test didasarkan pada tabel baca API 20 NE, kemudian digunakan program (software) API 20 NE untuk mengetahui spesies bakteri dari isolat yang diuji.
Identifikasi Molekuler Isolat Terpilih
Identifikasi molekuler terhadap isolat terpilih dari lokasi pengambilan sampel dilakukan dalam beberapa tahapan, yaitu isolasi DNA genom bakteri, amplifikasi gen 16S rRNA dan sekuening DNA hasil amplifikasi.
Isolasi DNA Genom Bakteri
Koloni bakteri tunggal dari isolat terpilih pada medium NA diinokulasikan ke dalam 50 ml medium Luria Broth (LB), dan diinkubasi pada inkubator goyang berkecepatan 150 rpm pada suhu 37 oC selama 24 jam. Setelah inkubasi, sel bakteri disentrifugasi pada kecepatan 10.600 g selama 10 menit. DNA genom bakteri diisolasi (diekstraksi) menggunakan protokol dari PrestoTM gDNA Bakteria Mini Kit (Geneaid) (Lampiran 6). Kualitas dan kuantitas DNA genom diukur menggunakan spektrofotometer NanoDrop 2000 (Thermo Scientific, Wilmington, DE, USA).
Amplifikasi Gen 16S rRNA
Reaksi PCR mix dibuat sebanyak 50 μl dengan komposisi yaitu:
masing-masing 3 μl primer 63f (5’-CAGGCCTAACACATGCAAGTC-3’) dan primer
1387r (5’-GGGCGGCGTGTACAAGGC-3’) (Marchesi et al. 1998) konsentrasi
10 pmol, 25 μl GoTaq Green Master Mix 2x (Promega, Madison, W1, USA), 12
µl ddH2O, dan 7 µl template DNA. PCR dilakukan dengan kondisi sebagai berikut: predenaturasi 95 oC selama 5 menit, 30 siklus yang terdiri dari denaturasi 95 oC selama 1 menit, annealing 55 oC selama 1 menit, dan elongasi 72 oC selama 1.5 menit. Setelah siklus terakhir, reaksi dilanjutkan dengan pasca elongasi pada suhu 72 oC selama 10 menit. Produk PCR dielektroforesis menggunakan gel agarosa 1% pada tegangan 75 volt selama 46 menit, kemudian diwarnai dengan etidium bromida dan didokumentasikan (dipotret) di bawah sinar UV.
Sekuening DNA dan Analisis Filogenetik
10
HASIL
Isolasi Bakteri Pelarut Fosfat dan Kalium dari Tanah
Isolasi dari 10 sampel tanah dari kawasan sekitar tambang batu kapur Cirebon menghasilkan 45 isolat yang mampu melarutkan P pada medium Pikovskaya, sedangkan isolasi dari 10 sampel tanah tidak menghasilkan isolat yang mampu melarutkan K pada medium Aleksandrov. Isolat dimurnikan pada cawan dengan metode gores kuadran (Gambar 2), kemudian disimpan pada agar-agar miring Pikovskaya sebagai stok.
Gambar 2 Isolat bakteri QC3.a.1 pada medium Pikovskaya (a) dan Aleksandrov (b)
Pengujian Kemampuan Bakteri dalam Melarutkan P dan K
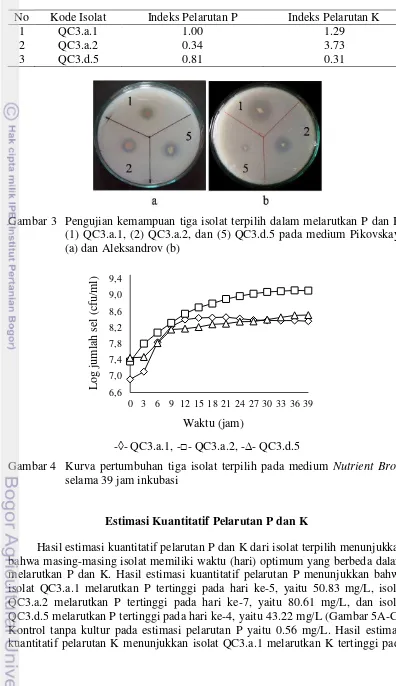
Isolat bakteri pelarut P yang telah murni, diuji kemampuannya dalam melarutkan P dan K secara kualitatif melalui pembentukan zona bening di sekitar koloni dengan cara menghitung indeks pelarutannya (IP). Di antara 45 isolat pelarut P yang diperoleh, terdapat 12 isolat yang mampu melarutkan K (Lampiran 7). Berdasarkan nilai indeks pelarutan, dipilih tiga isolat yang mampu melarutkan P dan K tertinggi (Tabel 1; Gambar 3) untuk analisis selanjutnya.
Kurva Pertumbuhan Isolat Terpilih
11 Tabel 1 Hasil pengujian tiga isolat terpilih dalam melarutkan P dan K
No Kode Isolat Indeks Pelarutan P Indeks Pelarutan K
1 QC3.a.1 1.00 1.29
2 QC3.a.2 0.34 3.73
3 QC3.d.5 0.81 0.31
Gambar 3 Pengujian kemampuan tiga isolat terpilih dalam melarutkan P dan K. (1) QC3.a.1, (2) QC3.a.2, dan (5) QC3.d.5 pada medium Pikovskaya (a) dan Aleksandrov (b)
-◊- QC3.a.1, -□- QC3.a.2, -∆- QC3.d.5
Gambar 4 Kurva pertumbuhan tiga isolat terpilih pada medium Nutrient Broth
selama 39 jam inkubasi
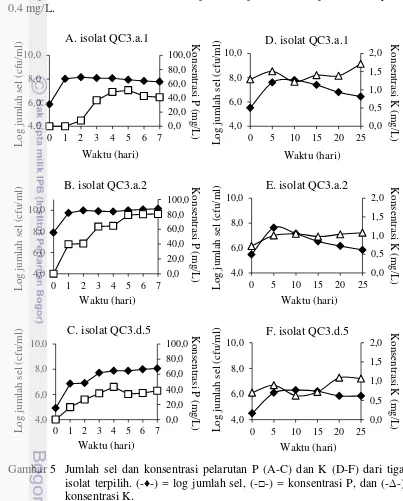
Estimasi Kuantitatif Pelarutan P dan K
Hasil estimasi kuantitatif pelarutan P dan K dari isolat terpilih menunjukkan bahwa masing-masing isolat memiliki waktu (hari) optimum yang berbeda dalam melarutkan P dan K. Hasil estimasi kuantitatif pelarutan P menunjukkan bahwa isolat QC3.a.1 melarutkan P tertinggi pada hari ke-5, yaitu 50.83 mg/L, isolat QC3.a.2 melarutkan P tertinggi pada hari ke-7, yaitu 80.61 mg/L, dan isolat QC3.d.5 melarutkan P tertinggi pada hari ke-4, yaitu 43.22 mg/L (Gambar 5A-C). Kontrol tanpa kultur pada estimasi pelarutan P yaitu 0.56 mg/L. Hasil estimasi kuantitatif pelarutan K menunjukkan isolat QC3.a.1 melarutkan K tertinggi pada
6,6 7,0 7,4 7,8 8,2 8,6 9,0 9,4
0 3 6 9 12 15 18 21 24 27 30 33 36 39
L
og
jum
lah se
l (c
fu/ml
)
12
hari ke-25, yaitu 1.7 mg/L, isolat QC3.a.2 melarutkan K tertinggi pada hari ke-25, yaitu 1.1 mg/L, dan isolat QC3.d.5 melarutkan K tertinggi pada hari ke-20, yaitu 1.1 mg/L (Gambar 5D-F). Kontrol tanpa kultur pada estimasi pelarutan K yaitu 0.4 mg/L.
Gambar 5 Jumlah sel dan konsentrasi pelarutan P (A-C) dan K (D-F) dari tiga isolat terpilih. (-♦-) = log jumlah sel, (-□-) = konsentrasi P, dan (-∆-) konsentrasi K.
Identifikasi Bakteri secara Morfologi dan Fisiologi
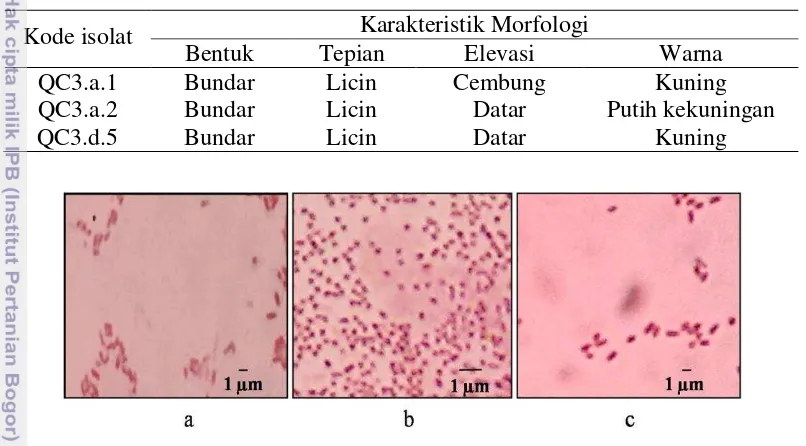
Identifikasi bakteri secara morfologi dari 45 isolat bakteri menunjukkan karakter yang berbeda (Lampiran 8). Tiga isolat terpilih memiliki perbedaan karakter elevasi dan warna koloni (Tabel 2). Berdasarkan hasil pewarnaan Gram, diketahui bahwa ketiga isolat merupakan bakteri Gram negatif. Isolat QC3.a.1 dan QC3.d.5 berbentuk basil, sedangkan isolat QC3.a.2 berbentuk kokus (Gambar 6).
13 Hasil identifikasi bakteri secara fisiologi menggunakan API Kit 20 NE (Lampiran 9) menunjukkan bahwa isolat QC3.d.5 merupakan bakteri Pseudomonas sp. dengan tingkat kemiripan 99% dengan hasil positif terhadap uji L-arginin, urea, gelatin, D-glukosa, D-mannosa, D-mannitol, N asetil glukosamin, kalium glukonat, asam kaprat, asam malat, trisodium sitrat dan asam fenilasetat. Isolat QC3.a.1 dan QC3.a.2 telah diidentifikasi sebelumnya menggunakan API Kit 20 NE/E dan masing-masing merupakan bakteri Burkholderia cepacia dan
Burkholderia sp. (Mubarik et al. 2014).
Tabel 2 Karakteristik tiga isolat terpilih berdasarkan pengamatan morfologi Kode isolat Karakteristik Morfologi
Bentuk Tepian Elevasi Warna
QC3.a.1 Bundar Licin Cembung Kuning
QC3.a.2 Bundar Licin Datar Putih kekuningan
QC3.d.5 Bundar Licin Datar Kuning
Gambar 6 Hasil pewarnaan Gram diamati pada perbesaran 1000x. (a) QC3.a.1, (b) QC3.a.2, dan (c) QC3.d.5.
Identifikasi Molekuler Isolat Terpilih
14
Gambar 7 Hasil amplifikasi gen 16S rRNA dari tiga isolat terpilih. M=1kb, Sumur 1-3=QC3.d.5, QC3.a.1, dan QC3.a.2
Gambar 8 Konstruksi pohon filogenetik dari tiga isolat terpilih berdasarkan sekuen gen 16S rRNA
PEMBAHASAN
Hasil analisis kimia tanah (Lampiran 15), menunjukkan bahwa kawasan sekitar tambang batu kapur Cirebon memiliki pH tanah bersifat basa (agak alkalis), C-organik tergolong rendah, P-Bray I atau tersedia tergolong sangat rendah, serta basa-basa kation seperti K, dan kapasitas tukar kation tergolong
Serratia marcescens galur By2Root2 Serratia marcescens galur S4
Serratia nematodiphila galur MUGA215 Isolat QC3.a.2
Pseudomonas putida galur GG65 Pseudomonas putida galur IBFC2012-17
Isolat QC3.d.5
Pseudomonas putida galur ACO-140 Isolat QC3.a.1
Burkholderia cepacia galur K1 Burkholderia cepacia galur SE-1 Burkholderia sp. TCP10
Pediococcus pentosaceus galur E24-160 Pediococcus pentosaceus galur V3-86 Bacillus subtilis galur L7
Bacillus amyloliquefaciens galur KAVK1
100
100 100
72
100 98 100
93
100 69
15 sedang. Berdasarkan kriteria (PPT 1983), tingkat kesuburan tanah pada kawasan sekitar tambang tersebut tergolong rendah. Tingkat kesuburan tanah ialah kemampuan tanah dalam menyediakan unsur-unsur hara dalam jumlah yang cukup dan seimbang bagi pertumbuhan suatu tanaman.
Sebanyak 45 isolat bakteri pelarut P berhasil diisolasi dari tanah sekitar tambang batu kapur Cirebon, dan 12 diantaranya mampu melarutkan K. Suliasih dan Rahmat (2007) mengatakan bahwa bakteri yang tumbuh pada medium Pikovskaya akan melarutkan P yang ditandai dengan zona bening di sekitar koloni akibat adanya pelarutan Ca3(PO4)2. Bashan et al. (2013) menegaskan bahwa pelarutan P terjadi karena adanya pelepasan proton seperti H+ dengan mekanisme pelarutan P sama dengan trikalsium fosfat Ca3(PO4)2, yang dideskripsikan sebagai berikut: Ca3(PO4)2 + 2H+ 2CaHPO4 + Ca2+. Isolasi dari tanah tidak didapatkan bakteri yang mampu melarutkan K, diduga populasi bakteri pelarut K pada tanah daerah sekitar tambang batu kapur rendah jika dibandingkan populasi bakteri pelarut P dan juga kemampuan bakteri itu sendiri dalam merebutkan sumber energi yang sama dihabitatnya.
Pengujian dalam melarutkan P dan K berdasarkan indeks pelarutan menghasilkan dua isolat yang berpotensi dalam melarutkan P tertinggi pada medium Pikovskaya padat yaitu QC3.a.1 dan QC3.d.5, serta dua isolat yang berpotensi dalam melarutkan K tertinggi pada medium Aleksandrov padat yaitu QC3.a.1 dan QC3.a.2 (Tabel 1). Variasi nilai indeks pelarutan tersebut karena adanya perbedaan kemampuan bakteri dalam mensekresikan asam organik ekstraselulernya atau jenis asam organik yang dihasilkan. Mekanisme utama pelarutan P dan K yang tidak larut ialah melalui produksi dan sekresi asam organik (Archana 2007; Song et al. 2008).
Zona bening yang terbentuk di sekitar koloni pada medium tidak selalu disebabkan oleh besar atau tidaknya ukuran suatu koloni. Hal ini ditunjukkan dari penelitian bahwa diameter koloni yang besar tidak selalu menghasilkan zona bening yang besar pula (Gambar 3). Selain itu, zona bening yang terbentuk pada medium Pikovskaya dan Aleksandrov padat tidak dapat menunjukkan jumlah (konsentrasi) P dan K yang dilarutkan oleh bakteri. Meskipun luas zona bening dapat menunjukkan kemampuan relatif bakteri dalam melarutkan P dan K, tetapi tidak dapat menunjukkan jumlah (konsentrasi) P dan K yang terlarut di dalam medium (Tatiek 1991; Lynn et al. 2013). Oleh karena itu, dilakukan pengujian pelarutan P dan K secara kuantitatif untuk mengetahui berapa jumlah (konsentrasi) P dan K yang dilarutkan oleh bakteri.
Pertumbuhan bakteri dapat diamati melalui peningkatan jumlah sel terhadap waktu. Isolat QC3.a.1 dan QC3.d.5 memiliki waktu untuk mencapai fase logaritmik yang sama, sedangkan isolat QC3.a.2 tidak terlihat jelas fase logaritmiknya (Gambar 4). Fase logaritmik ialah fase ketika bakteri mampu tumbuh lebih cepat sehingga mempunyai waktu penggandaan yang lebih singkat. Menurut Pelczar dan Chan (1986) perbedaan waktu ini dapat dipengaruhi oleh beberapa faktor, yaitu sumber energi, sumber karbon, pH, suhu lingkungan, O2 dan masa inkubasi atau sifat organisme tersebut.
16
medium bakteri, perubahan pH medium kultur, kehadiran galur bakteri pelarut P. Pelarutan P oleh bakteri berkisar antara 0.56 mg/L - 898 mg/L (Chen et al. 2006; Park et al. 2010; Aarab et al. 2013; Karpagam dan Nagalakshmi 2014). Song et al. (2008) melaporkan bahwa Burkholderia cepacia DA23 yang diisolasi dari tanah daerah Gimhae, Korea, mampu melarutkan P sebesar 345.9 mg/L. Perez et al. (2007) melaporkan bahwa Serratia marcescens yang diisolasi dari permukaan besi yang terletak dekat Ciudad Piar, Bolivar, Venezuela memiliki kemampuan melarutkan P antara 78.6 mg/L – 82.7 mg/L. Nautiyal (1999) melaporkan bahwa konsentrasi P sebesar 35 µg/ml dihasilkan oleh Pseudomonas sp. yang diisolasi dari tanah dan akar tanaman Banthra, Lucknow, India.
Pelarutan K seperti illit dan feldspar oleh mikrob karena adanya produksi asam organik seperti asam oksalat dan asam tartat, serta produksi polisakarida kapsuler yang membantu dalam pelarutan mineral K untuk melepaskan K (Sheng dan He 2006). Beberapa penelitian telah menunjukkan bahwa mikrob tanah dapat melepaskan K dari mineral K seperti K feldspar, mika, dan illit. Pelarutan K oleh bakteri berkisar antara 0.59 mg/L - 48 mg/L (Archana 2007; Sugumaran dan Janarthanam 2007; Parmar dan Sindhu 2013; Lynn et al. 2013; Zhang dan Kong 2014). Burkholderia cepacia GL13 yang diisolasi dari tanah rizosfer sekitar tanaman tembakau Provinsi Sichuan, Shandong dan Hubei menghasilkan K terlarut sebesar 0.59 mg/L (Zhang dan Kong 2014), sedangkan Pseudomonas sp. yang diisolasi dari tanah rhizosfer tanaman berbeda sekitar Dharwad, Belgaum menghasilkan K terlarut sekitar 8.72 µg/ml - 20.50 µg/ml (Archana 2007).
Penurunan konsentrasi P dan K terlarut (Gambar 5A-F) diduga disebabkan adanya pemakaian kembali P dan K terlarut oleh kultur sebagai sumber nutrisi untuk aktivitas metabolismenya dan adanya penurunan jumlah populasi sel bakteri yang akan mempengaruhi aktivitas bakteri dalam melarutkan P dan K. Krishnawamy et al. (2009) melaporkan bahwa fosfat diperlukan oleh mikrob untuk sintesis asam nukleat, membangun membran sel (seperti fosfolipid) dan transfer energi kimia ke dalam sel (seperti molekul ATP). Gries et al. (2013) melaporkan bahwa ion kalium (K+) berperan penting dalam fisiologi bakteri, termasuk regulasi pH sitoplasma, tekanan turgor, aktivitas enzim intraseluler, dan potensial listrik trans-membran.
Pada uji kualitatif (Gambar 3) menunjukkan isolat QC3.a.1 mampu melarutkan P tertinggi dan isolat QC3.a.2 mampu melarutkan K tertinggi, tetapi pada uji kuantitatif (Gambar 5) menunjukkan isolat QC3.a.2 mampu melarutkan P tertinggi dan isolat QC3.a.1 mampu melarutkan K tertinggi. Hal ini diduga disebabkan adanya variasi tingkat difusi dari asam organik yang berbeda yang dihasilkan oleh mikrob yang berbeda. Hasil serupa juga telah dilaporkan oleh Lynn et al. (2013) dan Nautiyal (1999), mikrob yang melarutkan P dan K pada medium padat belum tentu mampu melarutkan P dan K tertinggi pada medium cair. Oleh karena itu, pengukuran secara langsung menggunakan spektrofotometer lebih akurat dibanding metode cawan.
Ketiga isolat yang diidentifikasi pada penelitian ini (QC3.a.1, QC3.a.2, dan QC3.d.5), masing-masing berkerabat dekat dengan Burkholderia cepacia, Serratia marcescens dan S. nematodiphila, dan Pseudomonas putida. Burkholderia,
17
growth promoting rhizobacteria) yang mampu menghasilkan zat tumbuh seperti IAA (Patten dan Glick 2002). Burkholderia diketahui sebagai bakteri fiksasi N dan memiliki kemampuan sebagai antifungi (Stephen dan Jisha 2011; Mubarik et al. 2014). Selain itu, Burkholderia cepacia dapat digunakan sebagai agens fitoremediasi dan promotor tanaman toleran terhadap toluene (Barac et al. 2004).
Serratia diketahui berpotensi menghambat pertumbuhan Aspergillus parasitic dan produksi senyawa aflatoksin (Wang et al. 2013), serta produksi IAA dan metabolit sekunder yaitu siderofor (Gupta et al. 2012). Pseudomonas diketahui mampu mencegah tanaman dari patogen dan berpotensi sebagai agens biokontrol yang digunakan secara komersial di rumah kaca maupun di lapangan (Arshad dan Frankenberger 1993). Kumar et al. (2012) juga melaporkan bahwa Pseudomonas
sp. mampu menghasilkan hidrogen sianida (HCN) sebagai biokontrol patogen dan produksi IAA. Burkholderia, Serratia, dan Pseudomonas merupakan bakteri yang efisien digunakan sebagai pupuk hayati pada tanah pertanian (Rodriguez dan Fraga 1999; Ghaderi et al. 2008; Lavania dan Nautiyal 2013).
SIMPULAN DAN SARAN
Simpulan
Sebanyak 12 isolat dari 45 isolat bakteri pelarut P yang diisolasi dari sampel tanah sekitar kawasan tambang batu kapur Cirebon mampu melarutkan K. Isolat QC3.a.1, QC3.a.2 dan QC3.d.5 merupakan isolat yang mampu melarutkan P dan K tertinggi pada medium Pikovskaya dan Aleksandrov padat. Isolat QC3.a.2 mampu melarutkan P tertinggi pada medium Pikovskaya cair, isolat QC3.a.1 mampu melarutkan K tertinggi pada medium Aleksandrov cair. Isolat QC3.a.1, QC3.a.2 dan QC3.d.5 merupakan bakteri Gram negatif. Identifikasi berdasarkan gen 16S rRNA menunjukkan bahwa QC3.a.1 berkerabat dekat dengan
Burkholderia cepacia, QC3.a.2 berkerabat dekat dengan Serratia marcescens dan
S. nematodiphila, dan QC3.d.5 berkerabat dekat dengan Pseudomonas putida.
Saran
18
DAFTAR PUSTAKA
Aarab S, Ollero FJ, Megias M, Laglaoui A, Bakkali M, Arakrak A. 2013. Isolation and identification of potential phosphate solubilizing bacteria from the rhizosphere of Lupinus hirsutus L. in the north of Morocco. Moroccan J Biol. 10:7-13.
Aleksandrov VG, Blagodyr RN, Iiiev IP. 1967. Liberation of phosphoric acid from apatite by silicate bacteria. Microbiol Zh. (Kiev).29:111-114.
Archana DS. 2007. Studies on potassium solubilizing bacteria (tesis). Dharwad (IN): University of Agricultural Sciences.
Arshad M, Frankenberger WT. 1993. Microbial production of plant growth regulators. Di dalam: Mettind FB, editor. Soil Microbiol Ecol. New York (US): Marcel Dekker, Inc. hlm 307-347.
Badr MA. 2006 Efficiency of K-feldspar combined with organic materials and silicate dissolving bacteria on tomato yield. J Appl Sci Res. 2(12):1191-1198. Barac T, Taghavi S, Borremans B, Provoost A, Oeyen L, Colpaert JV. 2004.
Engineered endophytic bacteria improve phytoremediation of water-soluble, volatile,organic pollutants. Nat Biotechnol. 22:583–8.
Basak BB, Biswas DR. 2008. Influence of potassium solubilizing microorganism (Bacillus mucilaginous) and waste mica on potassium uptake dynamics by sudan grass (Sorghum vulgare Pers) grown under two Alfisols. Plant Soil. 317:235-255.
Bashan Y, Kamnev AA, de Bashan KE. 2013. Tricalcium phosphate is inappropriate as a universal selescton factor for isolating and testing phosphate-solubilizing bacteria that enhance plant growth: a proposal for an alternative procedure. Biol Fertil Soils. 49:465-479.
Bennett PC, Choi WJ, Rogers JR. 1998. Microbial destruction of feldspars. Miner. Mag. 8:149-150.
Bertsch PM, Thomas GW. 1985. Potassium status of temperate region soils. Di dalam: Munson RD, editor. Potassium in Agriculture. Madison (US): American Society of Agronomy. hlm 131-162.
Chen YP, Rekha PD, Arun AB, Shen FT, Lai WA, Young CC. 2006. Phosphate solubilizing bacteria from subtropical soil and their tricalcium phosphate solubilizing abilities. Appl Soil Ecol. 34:33-41.
Doman DC, Geiger DR. 1979. Effect of exogenously supplied foliar potassium on phloem loading in Beta vulgaris L. Plant Physiol. 64:528-533.
Don NT, Diep CN. 2014. Isolation, characterization and identification of phosphate and potassium solubilizing bacteria from weathered materials of granite rock mountain, That Son, an Giang province, Vietnam. Americ J Life Sci. 2(5):282-291.
Friedrich S, Platonova NP, Karavaiko GI, Stichel E, Glombitza F. 1991. Chemical and microbiological solubilization of silicates. Acta Biotechnol. 11(3):187-196. Ghaderi A, Aliasgharzad N, Oustan S, Olsson PA. 2008. Efficiency of three
Pseudomonas isolates in releasing phosphate from an artificial variable charge mineral (iron III hydroxide). Soil Environ. 27(1):71-76.
19 Di dalam: Torriani GA, Yagil E, Silver S, editor. Phosphate in Microorganisms, Cellular and Molecular Biology. Washington (US): ASM Press. ISBN 1555810802. hlm 197-203.
Gries CM, Bose JL, Nuxoll AS, Fey PD, Bayles KW. 2013. The Ktr potassium transport system in Staphylococcus aureus and its role in cell physiology, antimicrobial resistance and pathogenesis. Molec Microbiol. 89(4):760-773. Gupta M, Kiran S, Gulati A, Singh B, Tewari R. 2012. Isolation and identification
of phosphate solubilizing bacteria able to enhance the growth and aloin-A biosynthesis of Aloe barbadensis Miller. Microbiol Res. 167:358-363.
Hadioetomo RS. 1993. Mikrobiologi Dasar dalam Praktek. Jakarta (ID): PT. Gramedia.
Han HS, Supanjani, Lee KD. 2006. Effect of co-inoculation with phosphate and potassium solubilizing bacteria on mineral uptake and growth of pepper and cucumber. Plant Soil Environ.52(3):130-136.
Handayanto E, Hairiah K. 2007. Biologi Tanah Landasan Pengelolaan Tanah Sehat. Ed ke-3. Yogyakarta (ID): Pustaka Adipura.
Hasanudin. 2006. Pengaruh inokulasi mikrobia pelarut fosfat dan batuan fosfat terhadap perbaikan fosfor tersedia tanah, serapan fosfor dan hasil jagung pada ultisol Bengkulu. JIPI. 8(2):85-90.
Houng KH. 1976. The role of organic matter in rice production. Di dalam: The Fertility of Paddy Soils and Fertilizer Applications for Rice. Taipei (TW): FFTC for Asian and Pacific Region. hlm 49-59.
Hu X, Chen J, Guo J. 2006. Two phosphate and potassium solubilizing bacteria isolated from Tianmu Mountain, Zhejiang, China. World J Microbiol Biotechnol. 22:983-990.
Illmer P, Schinner F. 1992. Solubilization of inorganic phosphates by microorganisms isolated from forest soil. Soil Biol Biochem. 24:389-395. Islam MT, Deora A, Hashidoko Y, Rahman A, Ito T, Tahara. 2007. Isolation and
identification of potential phosphate solubilizing bacteria from the rhizoplane of Oryza sativa L. cv. BR29 of Bangladesh. Z Naturforsch. 62:103-110.
Joner EJ, Aarle IM, Vosatka M. 2000. Phosphatase activity of extraradical arbuscular mycorrhiza hyphae. Plant Soil. 226:199-210.
Karpagam T, Nagalakshmi PK. 2014. Isolation and characterization of Phosphate Solubilizing Microbes from Agricultural soil. Int J Curr Microbiol Appl Sci. 3(3):601-614.
Kpomblekou AK, Tabatabai MA. 1994. Effect of organic acids on release of phosphorus from phosphate rocks. Soil Sci. 158:442-453.
Krishnawamy U, Muthusamy M, Perumalsamy L. 2009. Studies of efficiency of the removal of phosphate using bacterial consortium for the biotreatment of phosphate wastewater. EuropJ Appl Sci. 1(1):06-15.
Kukreja GP, Bhute SS, Mangate SA, Dhawale MN. 2010. Exploring the potential of Pseudomonas species as phosphate solubilizer, plant growth promoter, biocontrol agent and pesticide degrader. Asian J Exp Biol SCI SPL. 10:40-44. Kumar A, Kumar A, Devi S, Patil S, Payal C, Negi S. 2012. Isolation, screening
20
Lavania M, Nautiyal CS. 2013. Solubilization of tricalcium phosphate by temperature and salt tolerant Serratia marcescens NBRI1213 isolated from alkaline soils. Afric J Microbiol Res. 7(34):4403-4413.
Lindsay WL, Vlek PLG, Chien SH. 1989. Phosphate minerals. Di dalam: Dixon JB, Weed SB, editor. Minerals in Soil Enviroment. Madison (US): Soil Science Society of America. hlm 1089.
Lynn TM, Win HS, Kyaw EP, Latt ZK, Yu SS. 2013. Characterization of phosphate solubilizing and potassium decomposing strains and study on their effets on tomato cultivation. Int J Innov Appl Stud. 3(4):959-966.
Marchesi JR, Sato T, Weightman AJ, Martin TA, Fry JC, Hiom SJ, Wade WG. 1998. Design and evaluation of useful bacterium-specific PCR primers that amplify genes coding for bacterial 16S rRNA. Appl Environ Microbiol. 64(2):795-799.
Marschner H. 1995. Functions of mineral nutrients: macronutirents. Di dalam: H. Marschner, editor. Mineral nutrition of higher plants 2nd Edition. New York (US): Academic Press. hlm 299-312.
Mubarik NR, Wibowo RH, Angraini E, Mursyida E, Wahdi E. 2014. Exploration of bacterial diversity at Cirebon quarry [final report]. Quarry Life Award Project. http://www.quarrylifeaward.com.
Mursyidin, D. 2009. Memperbaiki lahan bekas tambang dengan mikroorganisme [internet]. [diunduh 2014 September 23]. Tersedia pada: http://agrica.wordpress.com.
Nautiyal CS. 1999. An efficient microbiological growth medium for screening phosphate solubilizing microorganisms. FEMS Microbiol Lett. 170:265-270. Park J, Bolan N, Megharaj M, Naidu R. 2010. Isolation of phosphate solubilizing
bacteria and characterization of their effects on lead immobilization. Pedologist. 67-75.
Parmar P, Sindhu SS. 2013. Potassium solubilization by rhizosphere bacteria: influence of nutritional and environmental conditions. J Microbiol Res. 3(1):25-31.
Patten CL, Glick BR. 1996. Bacterial biosynthesis of indole-3-acetic acid. Can J Microbiol. 42:207-220.
Patten CL, Glick BR. 2002. Role of Pseudomonas putida indole acetic acid in development of the host plant root system. Appl Environ Microbiol. 68:3795-3801.
Pelczar MJ Jr, Chan ECS. 1986. Dasar-Dasar Mikrobiologi. Volume 1. Hadioetomo RS, Imas T, Tjitrosomo SS, Angka SL, penerjemah. Jakarta (ID): UI Pr. Terjemahan dari: Elements of Microbiology.
Perez E, Sulbaran M, Ball MM, Yarzabal LA. 2007. Isolation and characterization of mineral phosphate-solubilizing bacteria naturally colonizing a limonitic crust in the south-eastern venezuelan region. Soil Biol Biochem. 39(11): 2905-2914.
Prajapati KB, Modi HA. 2012. Isolation and characterization of potassium solubilizing bacteria from ceramic industry soil. CIBTech J Microbiol.1:8-14. PPT. 1983. Sistem klasifikasi tanah definisi dan kriteria, istilah serta
perubahan-perubahan terhadap TOR tipe A 1981. Bogor (ID): Pusat Penelitian Tanah. Raj SA. 2004. Biofertilizer Technology for Rice Based Cropping System. Jodhpur
21 Rodriguez H, Fraga R. 1999. Phosphate solubilizing bacteria and their role in
plant growth promotion. Biotech Adv Res.17:319-339.
Salisbury FB, Ross CW. 1995. Fisiologi Tumbuhan. Lukman DH, Sumaryono, editor. Bandung (ID): ITB Press.
Sheng XF. 2005. Growth promotion and increased potassium uptake of cotton and rape by a potassium releasing strain of Bacillus edaphicus. Soil Biol Biochem. 37(1):1918-1922.
Sheng XF, He LY. 2006. Solubilization of potassium bearing minerals by a wild type strain of Bacillus edaphicus and its mutants and increased potassium uptake by wheat. Can J Microbiol. 52(1):66-72.
Singh G, Biswas DR, Marwah TS. 2010. Mobilization of potassium from waste insoluble inorganic phosphate by Burkholderia cepacia DA23 isolated from cultivated soil. Braz J Microbiol. 39:151-156.
Stephen J, Jisha MS. 2011. Gluconic acid production as the principal mechanism of mineral phosphate solubilization by Burkholderia sp. (MTCC 8369). J Tropic Agric. 49(1-2):99-103.
Styriakova I, Styriak I, Galko I, Hradil D, Bezdicka P. 2003. The release of iron-bearing minerals and dissolution of feldspar by heterotrophic bacteria of
Bacillus species. Cer Silicat. 47:20-26.
Sugumaran P, Janarthanam B. 2007. Solubilization of potassium containing minerals by bacteria and their effect on plant growth. World J Agric Sci. 3(3):350-355.
Suliasih, Rahmat. 2007. Aktivitas fosfatase dan pelarutan kalsium fosfat oleh beberapa bakteri pelarut fosfat. Biodiversitas.8(1):23-26.
Tatiek H. 1991. Bakteri pelarut fosfat asal beberapa jenis tanah dan efeknya terhadap pertumbuhan dan hasil jagung (Zea mays L.) (disertasi). Bandung (ID): Universitas Padjadjaran.
Tucker MR. 2001. Essential Plant Nutrients: Di dalam: Their Presence in North Carolina Soils & Role in Plant Nutrition. North Caroline (US): NCDA & CS bulletin, Agronomic Division. hlm 45-61.
Walpola BC, Yoon MH. In vitro solubilization of inorganic phosphates by phosphate solubilizing microorganisms. Afr J Microbiol Res. 7(27):3534-3541. Wang K, Yan S, Cao LX, Ding QL, Shao C, Zhao TF. 2013. Potential of
chitinolytic Serratia marcescens strain JPP1 for biological control of
Aspergillus parasiticus and aflatoxin. Biomed Reser Int. 2013:1-7.
Wu SC, Cao ZH, Li ZG, Cheung KC, Wong MH. 2005. Effects of biofertilizer containing N-fixer, P and K solubilizers and AM fungi on maize growth: a greenhouse trial. Geoderma. 125:155-166.
22
LAMPIRAN
Lampiran 1 Lokasi pengambilan sampel tanah pada kawasan sekitar tambang batu kapur Cirebon
Lampiran 2 Kurva log jumlah sel terhadap turbiditas dari isolat bakteri QC3.a.1
23 Lampiran 4 Kurva log jumlah sel terhadap turbiditas dari isolat bakteri QC3.d.5
Lampiran 5 Kurva standar estimasi KH2PO4
Lampiran 6 Tahapan isolasi DNA berdasarkan protokol PrestoTM gDNA Bakteria Mini Kit (Geneaid) yang terdapat pada tabung koleksi dibuang, kemudian ditambahkan 600 µl wash buffer, dan disentrifugasi 10.600 g selama 1 menit. Cairan yang terdapat pada tabung koleksi dibuang dan disentrifugasi 10.600 g selama 5 menit. Kolom dipindahkan pada mikrotube baru, kemudian ditambahkan 100 µl TE ditengah-tengah kolom, lalu diinkubasi pada suhu 37 oC selama 10 menit, dan disentrifugasi 10.600 g selama 2 menit.
24
Lampiran 7 Hasil pengujian 45 isolat bakteri dalam melarutkan P dan K
No Kode
25 Lampiran 8 Identifikasi 45 isolat bakteri secara morfologi
No Kode
Isolat
Pengamatan Morfologi
Bentuk Tepian Elevasi Warna
26
Lampiran 9 Hasil identifikasi fisiologi isolat QC3.d.5 menggunakan API Kit 20 NE
No Uji Hasil
1 Kalium nitrat -
2 L-triptofan -
3 D-glukosa -
4 L-arginin +
5 Urea +
6 Eskulin ferik sitrat -
7 Gelatin +
8 4-nitrofenil-D-galaktopiranosid -
9 D-glukosa +
10 L-arabinosa -
11 D-manosa +
12 D-manitol +
13 N-asetil-glukosamin +
14 D-maltosa -
15 Kalium glukonat +
16 Asam kaprat +
17 Asam adipat -
18 Asam malat +
19 Trisodium sitrat +
20 Asam fenilasetat +
21 Oksidase -
Keterangan: (+) = reaksi positif dan (-) = reaksi negatif
Lampiran 10 Kualitas DNA hasil ekstraksi dari tiga isolat terpilih
No Kode Isolat A260/A280
1 QC3.a.1 1.9
2 QC3.a.2 1.9
27 Lampiran 11 Sekuen isolat bakteri QC3.a.1
28
Lampiran 12 Sekuen isolat bakteri QC3.a.2
29 Lampiran 13 Sekuen isolat bakteri QC3.d.5
30
Lampiran 14 Kesamaan sekuen tiga isolat terpilih dengan spesies pembanding pada database NCBI
Burkholderia cepacia galur K1 100 99 0.0 KM030037.1
Burkholderia cepacia galur
No Komponen Analisis Kimia
32
RIWAYAT HIDUP
Penulis dilahirkan di Pekanbaru pada tanggal 16 Oktober 1989 sebagai anak bungsu dari pasangan bapak H. Impun Agus, BA dan ibu Hj. Harmailis Ramli, S.Pd. Pendidikan sarjana (S1) ditempuh di Program Studi Biologi, Fakultas Matematika dan Ilmu Pengetahuan Alam Universitas Riau, lulus pada tahun 2012. Pada tahun 2013, penulis diterima di Program Studi Mikrobiologi pada Program Pascasarjana IPB.
Sebagai salah satu syarat untuk memperoleh gelar Magister Sains (MSi)
penulis melakukan penelitian dengan judul “Isolasi dan Identifikasi Bakteri
Pelarut Fosfat dan Kalium dari Kawasan Sekitar Tambang Batu Kapur Cirebon”. Penelitian ini dibimbing oleh Dr Nisa Rachmania Mubarik, MSi dan Dr Ir Aris Tjahjoleksono DEA. Penulis pernah menjadi anggota tim pada The Quarry Life Award 2014 di PT Indocement, Tbk, Palimanan – Cirebon dengan judul proyek “Exploration of Bacterial Diversity at Cirebon Quarry”. Penelitian tersebut mendapat penghargaan peringkat ke-2 The Quarry Life Award Indonesia pada bulan September 2014. Artikel penelitian ini telah dimuat di jurnal internasional