ADSORPSI UNSUR PENGOTOR LARUTAN NATRIUM
SILIKAT MENGGUNAKAN ZEOLIT ALAM
KARANGNUNGGAL
AFIT HENDRAWAN
PROGRAM STUDI KIMIA
FAKULTAS SAINS DAN TEKNOLOGI
UNIVERSITAS ISLAM NEGERI SYARIF HIDAYATULLAH
JAKARTA
ADSORPSI UNSUR PENGOTOR LARUTAN NATRIUM
SILIKAT MENGGUNAKAN ZEOLIT ALAM
KARANGNUNGGAL
Skripsi
Sebagai Salah Satu Syarat untuk Memperoleh Gelar Sarjana Sains Program Studi Kimia
Fakultas Sains dan Teknologi
Universitas Islam Negeri Syarif Hidayatullah Jakarta
Oleh :
AFIT HENDRAWAN
105096003152
PROGRAM STUDI KIMIA
FAKULTAS SAINS DAN TEKNOLOGI
UNIVERSITAS ISLAM NEGERI SYARIF HIDAYATULLAH
JAKARTA
ADSORPSI UNSUR PENGOTOR LARUTAN NATRIUM
SILIKAT MENGGUNAKAN ZEOLIT ALAM
KARANGNUNGGAL
Skripsi
Sebagai Salah Satu Syarat untuk Memperoleh Gelar Sarjana Sains Program Studi Kimia
Fakultas Sains dan Teknologi
Universitas Islam Negeri Syarif Hidayatullah Jakarta
Oleh :
AFIT HENDRAWAN
105096003152
Menyetujui,
Pembimbing I Pembimbing II
Dr. Florentinus Firdiyono Dr. Thamzil Las NIP.19560214 198202 1 001 NIP.19490516 197703 1 001
Mengetahui,
Ketua Program Studi Kimia
PENGESAHAN UJIAN
Skripsi yang berjudul “Adsorpsi Unsur Pengotor Larutan Natrium Silikat
Menggunakan Zeolit Alam Karangnunggal” yang ditulis oleh Afit Hendrawan NIM 105096003152 telah diuji dan dinyatakan LULUS
dalam Sidang Munaqosyah Fakultas Sains dan Teknologi Universitas Islam Negeri Syarif Hidayatullah Jakarta pada hari Senin tanggal 20 Desember 2010. Skripsi ini telah diterima sebagai salah satu syarat untuk memperoleh gelar Sarjana Strata Satu (S1) Program Studi Kimia.
Menyetujui,
Penguji I Penguji II
DR. Mirzan T Razzak, M.Eng., APU Yusraini DI Siregar, M.Si NIP.330 001 086 NIP.19770512 200112 2 002
Pembimbing I Pembimbing II
Dr. Florentinus Firdiyono Dr. Thamzil Las NIP.19560214 198202 1 001 NIP.19490516 197703 1 001
Mengetahui,
Dekan Fakultas Sains dan Teknologi Ketua Program Studi Kimia
PERNYATAAN
DENGAN INI SAYA MENYATAKAN BAHWA SKRIPSI INI ADALAH HASIL KARYA SAYA SENDIRI DAN BELUM PERNAH DIAJUKAN SEBAGAI SKRIPSI ATAU KARYA ILMIAH PADA PERGURUAN TINGGI ATAU LEMBAGA MANAPUN.
Jakarta, Desember 2010
KATA PENGANTAR
Bismillaahirrohmaanirrohiim,
Assalaamu’alaikum Warohmatullaahi Wabarokaatuh
Syukur Alhamdulillah penulis panjatkan ke hadirat Allah SWT yang telah menciptakan seluruh alam. Shalawat serta salam penulis panjatkan kepada Nabi Muhammad SAW, kepada keluarganya, para sahabatnya, dan kepada para pengikutnya.
Skripsi dengan judul “Adsorpsi Unsur Pengotor Larutan Natrium Silikat Menggunakan Zeolit Alam Karangnunggal” disusun berdasarkan hasil
penelitian di Pusat Penelitian Metalurgi – LIPI, Cisauk, Tanggerang, Banten. Skripsi ini disusun sebagai salah satu persyaratan untuk meraih gelar Strata 1 (S1) Kimia di Fakultas Sains dan Teknologi, Universitas Islam Negeri (UIN) Syarif Hidayatullah Jakarta.
Skripsi ini tidak mungkin selesai tanpa pihak-pihak yang terus memberikan bimbingan dan semangatnya, sehingga penulis ucapkan terima kasih setulus-tulusnya kepada :
1. Dr. Syopiansyah Jaya Putra, M.Sis sebagai Dekan Fakultas Sains dan Teknologi Universitas Islam Negeri Syarif Hidayatullah Jakarta.
3. Dr. Florentinus Firdiyono sebagai pembimbing pertama, yang telah membimbing dan banyak memberikan masukan, semangat dan penjelasan tentang semua yang berhubungan dengan skripsi ini.
4. Dr. Thamzil Las sebagai pembimbing kedua dan pembimbing akademik, yang telah membimbing dan memberikan penjelasan tentang semua materi yang berhubungan dengan skripsi ini.
5. DR. Mirzan T Razzak, M.Eng., APU dan Yusraini DI Siregar, M.Si sebagai penguji pertama dan kedua yang telah memberikan kririk dan saran sehingga skripsi ini menjadi lebih baik.
6. Pa’e (Bpk Supriyanto) dan Bu’e (Ibu Endang Sulasih) yang telah memberikan dukungan moril, materil, doa serta semua dukungan yang tak terbatas. I Love U Mom and Dad.
7. Seluruh dosen kimia FST UIN, terutama Nurhasni, M.Si terima kasih atas semua ilmu yang telah diberikan. Insya Allah penulis akan mengamalkannya sehingga dapat bermanfaat di dunia dan di akhirat.
8. Eko Sulistiyono, S.T sebagai pembimbing lapangan, yang telah banyak meluangkan waktunya dan memberikan penjelasan tentang skripsi ini. 9. Murni Handayani, S.Si sebagai koordinator penelitian, yang telah banyak
meluangkan waktunya untuk berdiskusi dengan penulis.
10. Pusat Penelitian Metalurgi – LIPI yang telah memberikan sarana dan prasarana berupa laboratorium dan alat-alatnya untuk penelitian ini.
12. My oldest sister (Mbak Liya Suryani, SE) dan Bang Iyung yang telah meluangkan rumah dan perangkat elektroniknya untuk penyelesaian skripsi ini.
13. My sister’s (Mbak Mirawati, SPd; Retno Wulandari, CSE; Ayu Julaiha) dan My Nephew’s (Zaidan, Syifa, Azmi) atas semangat dan senyumannya. 14. Lek Bambang dan Mufida yang telah ikhlas menerima keberadaan penulis
di rumahnya.
15. Qosyim dan Pipit, teman seperjuanganku yang telah menjadi teman suka dan duka selama penulis membuat skripsi ini.
16. Bu Rinta, Age dan Balqis, terima kasih atas semangat yang kalian berikan. 17. Adum, Teh Dede, Umi Icha, Hasbi, Ndo’ Susti, Mpok Ummu, Fajri, Ocim,
April, Nunu dan seluruh teman-teman Al – Chemist 2005 yang tidak bisa disebutkan satu persatu. Semoga kenangan itu masih ada sampai kita tua. 18. Al – Chemist 2002 – 2008 yang telah memberikan semangat, dukungan
serta senyuman selama penulis menyusun skripsi ini.
Penulis menyadari bahwa skripsi ini masih jauh dari kesempurnaan, untuk itu saran dan kritik yang membangun sangat diharapkan. Semoga skripsi ini bermanfaat bagi mahasiswa kimia pada khususnya dan masyarakat pada umumnya. Amiiin.
Wassalaamu’alaikum Warohmatullaahi Wabarokaatuh
Jakarta, Desember 2010
DAFTAR ISI
KATA PENGANTAR ... vi
DAFTAR ISI ... ix
DAFTAR TABEL ... xiii
DAFTAR GAMBAR ... xiv
DAFTAR LAMPIRAN ... xv
ABSTRAK ... xvi
ABSTRACT ... xvii
BAB I. PENDAHULUAN ... 1
1.1. Latar Belakang ... 1
1.2. Rumusan Masalah ... 3
1.3. Hipotesis ... 3
1.4. Tujuan Penelitian ... 4
1.5. Manfaat Penelitian ... 4
BAB II. TINJAUAN PUSTAKA ... 5
2.1. Adsorpsi ... 5
2.1.1. Isoterm Adsorpsi ... 8
2.2. Pasir Kuarsa ... 10
2.3. Logam Pengotor ... 12
2.3.1. Besi (Fe) ... 13
2.3.2. Magnesium (Mg) ... 14
2.4. Zeolit ... 16
2.4.1. Teori Zeolit ... 16
2.4.2. Struktur Zeolit ... 16
2.4.3. Sifat – sifat Zeolit ... 18
2.4.4. Jenis – jenis Zeolit ... 20
2.4.5. Mordenit ... 21
2.4.6. Aktivasi Zeolit ... 22
2.4.7. Zeolit Alam Karangnunggal ... 23
2.5. Scanning Electron Microscopy (SEM) ... 25
2.6. Spektroskopi Serapan Atom (Atomic Absorption Spectroscopy) ... 27
2.6.1. Prinsip Spektroskopi Serapan Atom ... 28
2.6.2. Instrumentasi Spektroskopi Serapan Atom ... 29
BAB III. METODOLOGI PENELITIAN ... 32
3.1. Tempat dan Waktu Penelitian ... 32
3.2. Bahan dan Alat ... 32
3.2.1. Bahan ... 32
3.2.2. Alat ... 32
3.3. Prosedur Kerja ... 33
3.3.1. Pemangangan Pasir Kuarsa ... 33
3.3.2. Preparasi Larutan Natrium Silikat 10% ... 33
3.3.3. Preparasi Zeolit ... 34
3.3.4. Aktivasi Zeolit ... 34
3.3.5. Analisa SEM ... 34
3.3.6.1. Analisa Fe3+ ... 35
3.3.6.1.1. Variasi Waktu Kontak ... 35
3.3.6.1.2. Variasi Massa Zeolit ... 35
3.3.6.1.3. Variasi pH ... 36
3.3.6.1.4. Variasi Temperatur ... 36
3.3.6.1.5 Isoterm Adsorpsi ... 36
3.3.6.2. Analisa Mg2+ dan Ca2+ ... 37
3.3.6.2.1. Variasi pH ... 37
3.3.6.2.2. Variasi Massa Zeolit ... 37
3.3.6.2.3. Variasi Waktu Kontak ... 37
BAB IV HASIL DAN PEMBAHASAN ... 38
4.1. Karakterisasi dan Identifikasi Pasir Kuarsa ... 38
4.2. Preparasi Larutan Natrium Silikat ... 39
4.3. Aktivasi Zeolit ... 41
4.4. Penentuan Kondisi Optimum ... 44
4.4.1. Analisa Ion Logam Fe3+ ... 44
4.4.1.1. Hubungan Waktu Kontak dengan Penyerapan Fe3+ ... 44
4.4.1.2. Hubungan Massa Zeolit dengan Penyerapan Fe3+ ... 45
4.4.1.3. Hubungan pH dengan Penyerapan Fe3+ ... 46
4.4.1.4. Hubungan Temperatur dengan Penyerapan Fe3+ ... 48
4.4.1.5 Isoterm Adsorpsi Fe3+ ... 49
4.4.2. Analisa Mg2+ dan Ca2+ ... 50
4.4.2.1. Hubungan pH dengan Penyerapan Mg2+ dan Ca2+ ... 50
4.4.2.3. Hubungan Waktu Kontak dengan Penyerapan
Mg2+ dan Ca2+ ... 52
BAB V KESIMPULAN DAN SARAN ... 54
5.1. Kesimpulan ... 54
5.2. Saran ... 55
DAFTAR PUSTAKA ... 56
DAFTAR TABEL
Tabel 1. Perbedaan Isoterm Adsorpsi Langmuir dan Freundlich ... 9
Tabel 2. Hasil Analisa XRF Komposisi Kimia Pasir Kuarsa Indonesia ... 10
Tabel 3. Parameter Fisika Pasir Kuarsa Indonesia ... 11
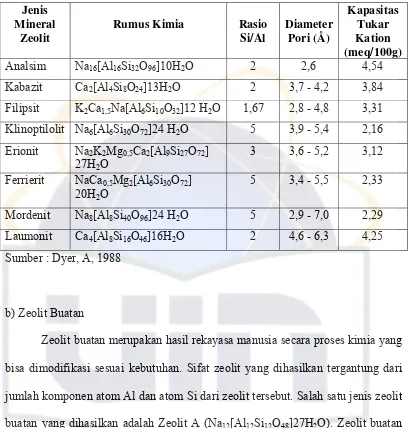
Tabel 4. Jenis Mineral Zeolit Alam dan Sifat Fisiknya ... 21
Tabel 5. Hasil Analisa XRF Zeolit Alam Karangnunggal ... 24
Tabel 6. Hasil Analisa XRF Pasir Kuarsa Samboja…...….. 39
Tabel 7. Hasil Analisa EDX Zeolit Alam Karangnunggal ... 43
Tabel 8. Hasil Analisa Penyerapan Mg2+ dan Ca2+ terhadap Pengaruh pH Larutan Natrium Silikat (massa zeolit 2,5 gr, temperatur 30°C, waktu kontak 60 menit, volume 50 ml, konsentrasi 0,1%) ... 50
Tabel 9. Hasil Analisa Penyerapan Mg2+ dan Ca2+ terhadap Pengaruh Massa Zeolit (pH = 10, temperatur 30°C, waktu kontak 60 menit, volume 50 ml, konsentrasi 0,1%) ... 51
DAFTAR GAMBAR
Gambar 1. Struktur Kerangka Penyusun Zeolit ... 16
Gambar 2. Struktur Stereotip Mordenit …... 22
Gambar 3. Skema Dasar Scanning Electron Microscopy (SEM) ... 26
Gambar 4. Sistem Instrumentasi AAS ... 29
Gambar 5. Morfologi Pasir Kuarsa Samboja ... 38
Gambar 6. Struktur Ikatan Natrium Silikat ... 40
Gambar 7. Morfologi Zeolit Alam Karangnunggal ... 42
Gambar 8. Persentase ion logam Fe3+ yang diserap dari larutan natrium silikat dengan waktu kontak yang berbeda (massa zeolit 1 gr, pH = 3, temperatur 30°C, volume 50 ml, konsentrasi 0,03%) ... 44
Gambar 9. Persentase ion logam Fe3+ yang diserap dari larutan natrium silikat dengan massa zeolit yang berbeda (pH = 3, temperatur 30°C, waktu kontak 60 menit, volume 50 ml, konsentrasi 0,03%) ... 45
Gambar 10. Persentase ion logam Fe3+ yang diserap dari larutan natrium silikat dengan pH larutan yang berbeda (massa zeolit 3 gr, temperatur 30°C, waktu kontak 60 menit, volume 50 ml, konsentrasi 0,03%) ... 46
Gambar 11. Persentase ion logam Fe3+ yang diserap dari larutan natrium silikat dengan temperatur larutan yang berbeda (massa zeolit 3 gr, pH = 3, waktu kontak 60 menit, volume 50 ml, konsentrasi 0,03%) ... 48
DAFTAR LAMPIRAN
Lampiran 1. Kurva Kalibrasi AAS ... 60
Lampiran 2. Perhitungan Efisiensi Penyerapan ... 63
Lampiran 3. Data Efisiensi Peyerapan Fe3+,Mg2+ dan Ca2+ oleh Zeolit ... 64
Lampiran 4. Data Isoterm Adsorpsi Fe3+ …....………..……. 68
Lampiran 5. Hasil Analisa XRF Pasir Kuarsa Samboja ... 70
Lampiran 6. Hasil Analisa SEM Pasir Kuarsa Samboja ... 71
Lampiran 7. Hasil Analisa SEM Zeolit Alam Karangnunggal Sebelum Diaktivasi ... 72
Lampiran 8. Hasil Analisa SEM Zeolit Alam Karangnunggal Setelah Diaktivasi ... 73
ABSTRAK
Afit Hendrawan. ADSORPSI UNSUR PENGOTOR LARUTAN NATRIUM SILIKAT MENGGUNAKAN ZEOLIT ALAM KARANGNUNGGAL. Dibawah Bimbingan Dr. Florentinus Firdiyono dan Dr. Thamzil Las.
Penelitian tentang kemampuan penyerapan zeolit alam Karangnunggal sebagai sorben dalam larutan natrium silikat telah dilakukan. Penelitian ini bertujuan untuk mengetahui efisiensi penyerapan zeolit terhadap unsur pengotor larutan natrium silikat serta mengetahui hubungan penyerapan zeolit dengan beberapa parameter adsorpsi. Untuk itu proses adsorpsi dilakukan dengan beberapa parameter, diantaranya waktu kontak, massa sorben, pH, temperatur. Hasil analisa menggunakan Spektroskopi Serapan Atom (SSA) menunjukkan bahwa zeolit alam Karangnunggal yang diaktivasi dengan H2SO4 dapat digunakan untuk menyerap Fe3+ dalam larutan natrium silikat. Kondisi optimum penyerapan Fe3+ dalam larutan natrium silikat dicapai dengan parameter waktu kontak selama 60 menit, massa zeolit yang digunakan sebanyak 3 gram, pH 3, dan pada temperatur ruang. Tetapi zeolit tersebut tidak efektif untuk menyerap Mg2+ dan Ca2+ dalam larutan natrium silikat.
ABSTRACT
Afit Hendrawan. ADSORPTION OF IMPURITIES ELEMENTS IN SODIUM SILICATE SOLUTION BY USING KARANGNUNGGAL NATURAL ZEOLITE. Under guidance of Dr. Florentinus Firdiyono and Dr. Thamzil Las.
Research studies on the adsorption capacity of Karangnunggal natural zeolite as a sorbent in solution of sodium silicate has been done. This study aims to determine the efficiency of adsorption of the zeolite to a solution of sodium silicate impurity elements and know the relationship between the adsorption of the zeolite with the adsorption parameters. For the adsorption process carried out by several parameters, such as contact time, sorbent mass, pH, temperature. Results of analysis using Atomic Absorption Spectroscopy (AAS) showed that Karangnunggal natural zeolite activated with H2SO4 can be used to adsorb Fe3+ in sodium silicate solution. The optimum condition of the adsorption of Fe3+ in sodium silicate solution is achieved with contact time parameters for 60 minutes, the mass of zeolite is used as much as 3 grams, pH 3, and at room temperature. However, these zeolites is not effective to adsorb Mg2+ and Ca2+ in a solution of sodium silicate.
BAB I PENDAHULUAN
1.1.Latar Belakang
Indonesia memiliki potensi sumber daya energi terbarukan yang melimpah antara lain energi surya, hal ini dikarenakan letak Indonesia yang berada di daerah tropis yang menerima sinar matahari sepanjang tahun. Energi ini dapat digunakan sebagai sumber energi alternatif. Akan tetapi pengembangan energi alternatif ini terbentur dengan mahalnya peralatan panel surya impor. Peralatan panel surya tidak dapat diproduksi di dalam negeri karena ketersediaan silikon murni untuk bahan pembuatan panel surya belum mampu dibuat di Indonesia.
Pemurnian silika biasanya dilakukan dengan penambahan asam klorida (HCl). Pemurnian ini hanya menghasilkan silika dengan kadar 99,99% (Aulich, et al, 1984) dan (Sulistiyono, et al, 2000). Hal ini dikarenakan HCl hanya mengikat unsur pengotor yang ada di permukaan silika. Untuk mendapatkan silika dengan kadar 99,999% maka dilakukan penyerapan unsur pengotor dengan zeolit. Zeolit adalah mineral dengan struktur kristal alumino silikat yang berbentuk framework
(struktur tiga dimensi), dan mempunyai rongga serta saluran yang diisi oleh kation logam alkali dan atau alkali tanah serta molekul air. Ion logam dan molekul air dapat digantikan oleh ion atau molekul lain secara reversibel tanpa merusak struktur zeolit, sehingga zeolit dapat digunakan untuk menyerap ion logam. Sampai saat ini telah ditemukan lebih dari 50 jenis zeolit alam (Suhala, 1997). Namun yang mempunyai nilai komersil diantaranya adalah jenis klinoptilolit, mordenit, filipsit, kabazit, erionit, ferrierit dan faujasit (Dyer, A.1988).
Jenis mineral zeolit yang sering ditemukan di Indonesia adalah klinoptilolit dan mordenit (Las, T. 2006). Zeolit merupakan salah satu mineral yang banyak terdapat di Kabupaten Tasikmalaya dengan penyebaran deposit di daerah Karangnunggal, Cipatujah dan Cikalong dengan deposit kurang lebih 39.435.125 ton. Zeolit alam Karangnunggal sudah dikarakterisasi dan merupakan jenis mordenit (Sulistiyono, et al, 2009). Zeolit ini dapat digunakan untuk menyerap kromium (Cr) (Handayani, et al, 2009) dan nikel (Ni) (Yuhelda, 2004) dalam air limbah.
pengotor dan dapat dijadikan bahan baku silikon murni untuk pembuatan panel surya. Untuk itu pada penelitian ini akan dilakukan proses peleburan pasir kuarsa dengan senyawa alkali natrium karbonat (Na2CO3). Pada proses ini diasumsikan terjadinya pemecahan ikatan di dalam pasir kuarsa tersebut. Hasil dari proses peleburan ini adalah natrium silikat (Na2SiO3) yang kemudian dilarutkan dan dilanjutkan dengan proses pemisahan unsur pengotor yang mungkin masih terkandung dalam larutan natrium silikat. Eliminasi unsur pengotor yang terdapat dalam larutan natrium silikat dalam penelitian ini dilakukan dengan menggunakan zeolit alam Karangnunggal. Eliminasi tersebut berlangsung melalui proses adsorpsi. Dengan proses ini diharapkan kadar unsur pengotor yang terdapat dalam larutan natrium silikat seperti besi (Fe), magnesium (Mg), dan kalsium (Ca) dapat dikurangi karena terserap oleh zeolit alam Karangnunggal.
1.2.Rumusan Masalah
a. Bagaimana proses penghilangan unsur pengotor dalam larutan natrium silikat?
b. Bagaimana proses aktivasi zeolit alam Karangnunggal harus dilakukan agar mampu menyerap unsur pengotor dalam larutan natrium silikat?
1.3.Hipotesis
a. Zeolit alam Karangnunggal dapat menyerap unsur pengotor yang ada dalam larutan natrium silikat.
1.4.Tujuan Penelitian
a. Untuk mengetahui kondisi optimum penyerapan zeolit alam Karangnunggal terhadap unsur pengotor dalam larutan natrium silikat. b. Untuk mengetahui hubungan kemampuan penyerapan unsur pengotor
oleh zeolit alam Karangnunggal dengan variasi waktu kontak, massa, pH dan temperatur.
1.5. Manfaat Penelitian
a. Memberikan informasi tentang pemanfaatan zeolit alam Karangnunggal sebagai penyerap unsur pengotor dalam larutan natrium silikat.
BAB II
TINJAUAN PUSTAKA
2.1. Adsorpsi
Adsorpsi merupakan suatu proses penyerapan oleh padatan tertentu
terhadap zat tertentu yang terjadi pada permukaan zat padat karena adanya gaya
tarik atom atau molekul pada permukaan zat padat tanpa meresap ke dalam
(Atkins, 1982). Apabila gaya tarik penyerap dengan zat terlarut lebih besar
daripada gaya tarik pelarut dengan zat terlarut, maka zat terlarut itu dapat diserap.
Adsorpsi adalah suatu proses dimana molekul-molekul dari senyawa yang
diserap oleh permukaan zat padat atau zat cair yang lain. Zat yang mengadsorpsi
disebut sorben sedangkan zat yang diadsorpsi disebut sorbat. Proses adsorpsi
terjadi pada batas permukaan dua fase, sebagai contohnya fase cair dengan fase
padat (adsorpsi zat warna dalam air dengan karbon sebagai sorben), fase cair
dengan fase gas (adsorpsi pada campuran gas klor dan air), fase cair dengan fase
cair (adsorpsi deterjen pada permukaan emulsi) dan lain-lain.
Metode adsorpsi telah dikembangkan untuk menangani masalah limbah di
perairan. Metode ini adalah salah satu metode yang potensial, karena prosesnya
yang sederhana, dapat bekerja pada konsentrasi rendah, dapat didaur-ulang, dan
biaya yang dibutuhkan relatif murah.
Proses adsorpsi dapat terjadi karena adanya gaya tarik atom atau molekul
pada permukaan padatan yang tidak seimbang. Karena adanya gaya ini, padatan
cenderung menarik molekul-molekul lain yang bersentuhan dengan permukaan
konsentrasi molekul pada permukaan menjadi lebih besar daripada dalam fasa gas
atau zat terlarut dalam larutan. Adsorpsi dapat terjadi pada antarfasa padat-cair,
padat-gas atau gas-cair. Pada adsorpsi, interaksi antara sorben dengan sorbat
hanya terjadi pada permukaan sorben. Adsorpsi adalah gejala pada permukaan,
sehingga makin besar luas permukaan, maka makin banyak zat yang teradsorpsi.
Walaupun demikian, adsorpsi masih bergantung pada sifat zat pengadsorpsi
(Fatmawati, 2006).
Berdasarkan besarnya interaksi antara sorben dan sorbat, adsorpsi
dibedakan menjadi dua macam yaitu adsorpsi kimia dan adsorpsi fisika. Pada
adsorpsi kimia, molekul-molekul yang teradsorpsi pada permukaan sorben
bereaksi secara kimia. Hal ini disebabkan pada adsorpsi kimia terjadi pemutusan
dan pembentukan ikatan. Ikatan antara sorben dengan sorbat dapat cukup kuat
sehingga spesies aslinya tidak dapat ditemukan kembali. Adsorpsi ini bersifat
irreversibel dan diperlukan energi yang besar untuk melepaskan sorbat kembali
(dalam proses adsorpsi). Pada umumnya, dalam adsorpsi kimia jumlah (kapasitas)
adsorpsi bertambah besar dengan naiknya temperatur. Zat yang teradsorpsi
membentuk satu lapisan monomolekuler dan relatif lambat, kesetimbangan
tercapai karena dalam adsorpsi kimia melibatkan energi aktivasi.
Jenis adsorpsi lainnya adalah adsorpsi fisika, dimana molekul-molekul
sorbat teradsorpsi pada permukaan sorben dengan ikatan yang lemah. Adsorpsi
terjadi karena adanya gaya Van der Waals antara sorbat dan sorben. Adsorpsi ini
bersifat reversibel, sehingga molekul-molekul yang teradsorpsi mudah dilepaskan
kembali dengan cara menurunkan tekanan gas atau konsentrasi zat terlarut.
yang teradsorpsi akan semakin kecil dengan naiknya suhu. Banyaknya zat yang
teradsorpsi dapat beberapa lapisan monomolekuler, demikian juga kondisi
kesetimbangan tercapai segera setelah sorben bersentuhan dengan sorbat. Hal ini
dikarenakan dalam adsorpsi fisika tidak melibatkan energi aktivasi.
Metode sorpsi dapat dilakukan dengan dua cara yaitu statis (batch) dan
dinamis (kolom). Cara statis dilakukan dengan memasukkan larutan yang
mengandung komponen yang diinginkan ke dalam wadah yang berisi sorben,
selanjutnya diaduk dalam waktu tertentu, kemudian dipisahkan dengan cara
penyaringan atau dekantasi. Komponen yang telah terikat pada sorben dilepaskan
kembali dengan melarutkan sorben dalam pelarut tertentu dan volumenya lebih
kecil dari volume larutan mula-mula. Cara dinamis (kolom) dilakukan dengan
melewatkan larutan yang mengandung komponen tertentu ke dalam kolom yang
telah diisi sorben, selanjutnya komponen yang telah diserap dilepaskan kembali
dengan mengalirkan pelarut (eluen) yang sesuai dan volumenya lebih kecil.
Karena selektivitasnya yang tinggi, proses adsorpsi sangat sesuai untuk
memisahkan bahan dengan konsentrasi yang kecil dari campuran yang
mengandung bahan lain yang berkonsentrasi tinggi. Bentuk lain dari adsorpsi
adalah pertukaran ion (ion exchange).
Kecepatan adsorpsi tidak hanya bergantung pada perbedaan konsentrasi
dan luas permukaan sorben, melainkan juga pada temperatur, pH larutan, tekanan
(untuk gas), ukuran partikel dan polaritas sorben tetapi juga bergantung pada
ukuran molekul bahan yang akan diadsorpsi dan viskositas campuran yang akan
2.1.1. Isoterm Adsorpsi
Isoterm adsorpsi merupakan fungsi konsentrasi zat terlarut yang terserap
oleh sorben terhadap konsentrasi larutan. Isoterm adsorpsi adalah hal yang
mendasar dalam menentukan kapasitas adsorpsi suatu sorbat pada permukaan
sorben (Sriyanti, 2005). Isoterm adsorpsi yang banyak digunakan adalah isoterm
adsorpsi Langmuir dan Freundlich. Langmuir dan Freundlich memberikan
gambaran tentang adsorpsi zat terlarut dari larutan oleh zat padat.
a) Isoterm Adsorpsi Langmuir
Langmuir mendefinisikan bahwa kapasitas adsorpsi maksimum terjadi
akibat adanya lapisan tunggal (monolayer) sorbat di permukaan sorben. Sorbat
yang diserap tidak akan melebihi jumlah situs aktif sorben. Persamaan isoterm
adsorpsi Langmuir dapat ditulis sebagai berikut (Azizah, Nur, et al, 2008):
x = 1 + 1 . C ……….………(1) m qm b b
Keterangan:
x/m = Jumlah sorbat yang diserap per unit berat sorben (mg/g)
C = Konsentrasi sorbat dalam larutan pada saat kesetimbangan (mol/L)
b = Konstanta
qm = Maksimum sorbat yang dapat diserap (mg/g)
Dengan eksperiman di laboratorium, kapasitas adsorpsi maksimum (qm) dan
konstanta Langmuir dapat diperoleh. Kapasitas adsorpsi dapat diperoleh dari
b) Isoterm Adsorpsi Freundlich
Freundlich mengasumsikan bahwa terdapat lebih dari satu lapisan
permukaan (multilayer), adsorpsi yang terjadi adalah adsorpsi fisika (Azizah, Nur,
et al, 2008). Persamaan isoterm adsorpsi Freundlich dapat ditulis :
... (2)
Keterangan :
x/m = jumlah sorbat yang diserap per unit berat sorben (mg/g)
C = konsentrasi sorbat dalam larutan pada saat kesetimbangan (mol/L)
K, n = konstanta empiris
Konstanta Freundlich diperoleh dengan eksperimen di laboratorium. Untuk
memudahkan perhitungan, maka persamaan 3 dirubah menjadi bentuk linier,
sehingga persamaannya menjadi:
...(3)
Konstanta Freundlich dapat diperoleh dari harga intersep dan slope linier kurva
log (x/m) vs log C.
Tabel 1. Perbedaan Isoterm Adsorpsi Langmuir dan Freundlich
Sifat Langmuir Freundlich
Jenis Ikatan Ikatan Kimia Ikatan Fisika
Energi Aktivasi Rendah – Sedang Tidak Ada
Reversibilitas Lambat Cepat
Pelapisan Lapisan Tunggal
(Monolayer)
Lapisa Majemuk
(Multilayer)
2.2. Pasir Kuarsa
Pasir kuarsa yang juga dikenal dengan nama pasir putih merupakan hasil
pelapukan batuan yang mengandung mineral utama, seperti kuarsa (SiO2) dan
felspar (MZ4O8). M adalah kation K+, Na+ atau Ca+. Z adalah kation-kation Al3+
dan Si4+. Hasil pelapukan kemudian tercuci dan terbawa oleh air atau angin yang
diendapkan di tepi-tepi sungai, danau, atau laut. Pasir kuarsa mengandung
senyawa pengotor yang terbawa selama proses pengendapan. Pada umumnya,
senyawa pengotor tersebut terdiri atas oksida besi, oksida kalsium, oksida alkali,
oksida magnesium, lempung, dan zat organik hasil pelapukan sisa-sisa hewan
serta tumbuhan.
Pasir kuarsa yang terdapat di alam ditemukan dengan kemurnian yang
bervariasi, tergantung pada proses terbentuknya dan juga material lain yang ikut
selama proses pengendapan. Material pengotor tersebut bersifat sebagai pemberi
warna pada pasir kuarsa. Secara umum, pasir kuarsa Indonesia mempunyai
komposisi kimia seperti yang dapat dilihat pada tabel 2. Sedangkan komposisi
fisika pasir kuarsa dapat dilihat pada tabel 3.
Tabel 2. Hasil Analisa XRF Komposisi Kimia Pasir Kuarsa Indonesia
Senyawa Jumlah (%)
SiO2 55,30 – 99,87
Fe2O3 0,01 – 9,14
Al2O3 0,01 – 18,00
TiO2 0,01 – 0,49
CaO 0,01 – 3,24
MgO 0,01 – 0,26
K2O 0,01 – 17,00
Tabel 3. Parameter Fisika Pasir Kuarsa Indonesia
Parameter Keterangan
Warna Putih bening atau warna lain tergantung
senyawa pengotornya. Misalnya, warna
kuning berarti mengandung oksida besi.
Kekerasan 7 (skala Mohs)
Berat Jenis 2,65 g/cm3
Titik Lebur 1715°C
Bentuk Kristal Hexagonal
Panas Spesifik 0,185
Konduktivitas Panas 12 – 100°C
Sumber : Suhala, et al, 1997
Pasir kuarsa banyak digunakan dalam kegiatan industri. Penggunaan pasir
kuarsa sudah berkembang baik langsung sebagai bahan baku utama maupun
bahan tambahan. Sebagai bahan baku utama, misalnya digunakan dalam industri
pembuatan chip, gelas kaca, semen, tegel, mosaik keramik, dan ampelas.
Sedangkan sebagai bahan tambahan, misalnya dalam industri pengecoran logam,
bata tahan api (refraktori), dan lain sebagainya.
Sekarang penggunaan pasir kuarsa sudah dikembangkan untuk pembuatan
panel surya. Faktor utama yang diperhatikan adalah pasir kuarsa yang dipakai
harus mencapai kemurnian dengan pembatasan pada oksida pengotornya. Kristal
silika merupakan bahan baku utama untuk pembuatan panel surya monokristal.
Kristal silika ditemukan di alam terutama sebagai pasir kuarsa. Proses ekstraksi
pasir kuarsa bervariasi berdasarkan lokasinya, tetapi biasanya dikombinasikan
mulai dari pengolah tanah, penghancuran, penggilingan, pencucian, dan
dan kotoran untuk mendapatkan ukuran butiran yang diinginkan. Produk akhirnya
disebut sebagai pasir silika atau kristal silika.
Pemanfaatan pasir kuarsa dari Indonesia sebagai bahan baku untuk panel
surya harus dimulai dari penguasaan teknologi pemurnian silika dari pasir kuarsa.
Syarat minimal penguasaan teknologi pemurnian silika dari pasir kuarsa untuk
panel surya jika hasil pemurnian SiO2 mencapai 99,999%. Karena pentingnya
penguasaan teknologi pemurnian silika dari pasir kuarsa Indonesia maka perlu
adanya penelitian pemurnian silika dari pasir kuarsa dengan terobosan proses.
Diharapkan dengan terobosan proses ini akan meningkatkan pertumbuhan industri
pembuatan modul panel surya dari pasir kuarsa Indonesia. Keuntungan dengan
penguasaan teknologi tersebut bagi Indonesia adalah swasembada energi
sekaligus meningkatkan nilai tambah pasir kuarsa Indonesia.
Potensi sumber daya pasir kuarsa di Indonesia cukup besar dengan
cadangan diperkirakan tidak kurang dari 4,48 milyar ton. Cadangan pasir kuarsa
tersebar di 16 provinsi, yang terbesar diantaranya terdapat di Sumatera Barat,
Sumatera Utara, Kalimantan Barat, Jawa Barat, Sumatera Selatan, Kalimantan
Selatan, dan Pulau Bangka dan Belitung (Suhala, et al, 1997).
2.3. Logam Pengotor
Keberadaan logam-logam dalam perairan dapat berasal dari
sumber-sumber alamiah dan dari aktivitas manusia. Sumber-sumber-sumber logam alamiah dapat
berupa pengikisan dari batu mineral yang banyak di sekitar perairan. Di samping
itu, partikel-partikel logam yang ada di udara, dikarenakan oleh hujan, juga dapat
aktivitas manusia dapat berupa buangan sisa dari industri ataupun buangan
rumah tangga.
Bentuk persenyawaan dari ion-ion logam dalam air laut umumnya berbeda
dengan bentuk persenyawaan yang terjadi di air tawar. Perbedaan itu dikarenakan
tingkat kompleksitas dari perairannya. Lautan merupakan perairan yang
kompleksitasnya sangat tinggi. Logam-logam di dalam perairan juga dipengaruhi
oleh interaksi yang terjadi antara air dengan sedimen (endapan).
2.3.1. Besi (Fe)
Besi (Fe) merupakan logam transisi dan memiliki nomor atom 26,
bilangan oksidasi Fe adalah +3 dan +2. Fe memiliki berat atom 55.845 g/mol, titik
leleh 1.538°C, dan titik didih 2.861°C. Fe menempati urutan sepuluh besar
sebagai unsur yang terbanyak di bumi. Fe menempati berbagai lapisan bumi.
Konsentrasi tertinggi terdapat pada lapisan dalam dari inti bumi dan sejumlah
kecil terdapat di lapisan terluar kerak bumi.
Logam Fe ditemukan dalam inti bumi berupa hematit (Fe2O3). Fe hampir
tidak dapat ditemukan sebagai unsur bebas. Fe diperoleh dalam bentuk tidak
murni sehingga harus melalui reaksi reduksi untuk mendapatkan Fe murni. Fe
ditemukan terutama sebagai mineral hematit (Fe2O3), magnetit (Fe3O4), pirit
(FeS2) dan siderit (FeCO3). Mineral lain yang merupakan sumber Fe adalah
limonit (FeO(OH).nH2O).
Mineral yang sering berada dalam perairan dengan jumlah besar adalah
kandungan Fe. Kandungan Fe dalam kerak bumi diperkirakan sebesar 5,63 x 104
dalam air tanah bisa berbentuk Fe (II) dan Fe (III) terlarut. Logam Fe sebagian
besar digunakan dalam pembuatan baja dan menghasilkan hampir 95% baja di
dunia dengan berbagai kombinasi kekuatan baja (Oxtoby, et al, 2003).
2.3.2 Magnesium (Mg)
Magnesium (Mg) adalah logam yang berwarna putih keabu-abuan dan
mempunyai permukaan pelindung lapisan tipis oksida. Mg melebur pada
temperatur 650°C. Mg adalah unsur keenam yang melimpah di kerak bumi. Mg
terutama dapat diperoleh dari batuan magnesit (MgCO3) dan dolomit
(CaMg(CaCO3)2). Sumber lain Mg adalah air laut yang mengandung sekitar 1,3
gram Mg per kilogram air laut. Mg membentuk ion positif paling melimpah
kedua di dalam laut (Chang, Raymond, 2005).
Mg dihasilkan dengan beberapa cara. Proses untuk memperoleh Mg dari
air laut menggunakan tiga jenis reaksi, diantaranya adalah reaksi pengendapan,
reaksi asam-basa, dan reaksi redoks. Pada reaksi pengendapan, air laut yang
mengandung MgCl2 direksikan dengan kalisum hidroksida (Ca(OH)2), sehingga
dihasilkan endapan yang mengandung magnesium hidroksida (Mg(OH)2).
Endapan ini disaring kemudian direaksikan dengan asam klorida (HCl), sehingga
dihasilkan larutan magnesium klorida (MgCl2). Larutan ini diuapkan kemudian
dimasukkan dalam sel elektrolisis. Larutan ini mengandung ion Mg2+ dan ion Cl-.
Dalam proses elektrolisis dialirkan arus listrik ke dalam sel, sehingga dapat
mereduksi ion Mg2+ dan mengoksidasi ion Cl-. Lelehan Mg yang dibebaskan pada
katode mengapung ke permukaan dan diambil secara berkala. Gas klorin yang
dihasilkan asam klorida yang dapat digunakan kembali untuk reaksi asam-basa
pada proses ini. Kerapatan magnesium lebih kecil daripada alumunium. Karena
sifat ini magnesium digunakan dalam alloy dengan alumunium untuk menurunkan
kerapatan alumunium dan memperbaiki ketahanannya terhadap korosi pada
kondisi basa.
2.3.3. Kalsium (Ca)
Kalsium adalah logam putih perak yang agak lunak. Kerak bumi
mengandung sekitar 3,4% massa kalsium. Kalsium terdapat pada batu kapur
(CaO), kalsit (CaCO3), gipsum (CaSO4.2H2O), dan dolomit (CaMg(CaCO3)2).
Kalsium melebur pada temperatur 845°C. Kalsium dapat bereaksi dengan
oksigen atmosfer dan udara lembab. Pada reaksi ini terbentuk kalsium oksida
dan/atau kalsium hidroksida. Kalsium menguraikan air dengan membentuk
kalsium hidroksida dan hidrogen. Kalsium membentuk kation Ca2+ dalam larutan
air. Garam-garamnya biasanya berupa bubuk putih dan membentuk larutan yang
tidak berwarna, kecuali bila anionnya berwarna.
Penggunaan logam kalsium masih terbatas. Sebagian besar kalsium
digunakan sebagai alloy logam alumunium dan tembaga. Kalsium digunakan
dalam pengolahan logam berilium dari senyawa-senyawanya. Kalsium klorida
padat bersifat higroskopis dan sering digunakan sebagai zat pengering dalam
2.4. Zeolit
2.4.1. Teori Zeolit
Kata zeolit berasal dari kata Yunani, zeinyang berarti membuih dan lithos
yang berarti batu. Nama ini sesuai dengan sifat zeolit yang akan membuih bila
dipanaskan pada suhu 100°C. Zeolit pertama kali ditemukan pada tahun 1756 oleh
Axel Cronstedt seorang ahli mineral dari Swedia. Jenis mineral yang ditemukan
adalah stilbit (Na2Ca4[Al10Si26O72].34H2O). Menurut penelitian yang dilakukan
Cronstedt, mineral ini akan mendidih apabila dipanaskan, hal ini disebabkan oleh
proses dehidrasi dari mineral tersebut. Di Indonesia zeolit ditemukan pada tahun
1985 oleh Pusat Pengembangan Teknologi Mineral (PPTM) Bandung dalam
jumlah besar. Penyebaran zeolit terdapat di beberapa daerah, terutama di pulau
Sumatera dan Jawa.
2.4.2. Struktur Zeolit
Si Al
-Atom O
Gambar 1. Struktur Kerangka Penyusun Zeolit
Kerangka dasar struktur zeolit terdiri dari unit-unit tetrahedral [AlO4]- dan
[SiO4] yang saling berhubungan melalui atom O (Barrer, 1987). Struktur kristal
zeolit membentuk suatu kerangka tetrahedron berantai dalam bentuk tiga dimensi.
Al, sedangkan atom-atom oksigen berada pada sudut-sudutnya. Rumus empiris
komposisi zeolit dapat dinyatakan sebagai berikut:
Mx/n[(AlO2)x(SiO2)y].wH2O
M = Kation alkali/alkali tanah
n = Valensi kation M (alkali/alkali tanah)
x, y = Jumlah tetrahedral per unit sel
w = Jumlah molekul air per unit sel
Kedudukan atom Al dalam posisi tetrahedra memerlukan tambahan
muatan positif sebagai penetral muatan listrik, seperti kation logam alkali atau
alkali tanah. Keadaan seperti ini yang menyebabkan zeolit dapat bersifat sebagai
penukar kation. Sedangkan pori-pori yang terdapat di dalam struktur kristal zeolit
diisi oleh molekul air. Pada umumnya pori-pori tersebut mencapai 20 – 30% dari
total volume kristalnya. Secara garis besar, struktur zeolit dibangun dalam tiga
bagian utama, yaitu:
a. Unit bangun primer (TO4), yaitu tetrahedron dari empat oksigen dengan atom
pusat tetrahedron (T) adalah Si4+ dan Al3+. Semua atom oksigen berada di
antara dua tetrahedron.
b. Unit bangun sekunder, yaitu susunan tetrahedron yang membentuk cincin,
seperti cincin tunggal berbentuk segi empat, segi enam, segi delapan, atau
kubus, prisma heksagonal, atau gabungan dari dua cincin segi empat.
2.4.3. Sifat – sifat Zeolit
a) Dehidrasi
Sifat dehidrasi zeolit berpengaruh terhadap sifat serapannya. Keunikan
zeolit terletak pada struktur porinya yang spesifik. Pada zeolit alam di dalam
pori-porinya terdapat kation-kation atau molekul air. Pori-pori zeolit akan semakin
terbuka bila zeolit dipanaskan. Keadaan seperti ini akan memungkinkan zeolit
dapat menyerap molekul-molekul yang mempunyai jari-jari lebih kecil dari
pori-pori zeolit tersebut. Kandungan air yang terperangkap di dalam rongga zeolit
biasanya berkisar antara 10 – 35% berat zeolit (Suhala, et al, 1997).
b) Penyerapan
Zeolit digunakan sebagai bahan penyerap karena sifatnya yang selektif dan
mempunyai kapasitas tukar kation yang cukup tinggi. Zeolit dapat memisahkan
molekul-molekul berdasarkan ukuran dan bentuk struktur kristal zeolit. Bila zeolit
dipanaskan maka air yang terkandung di dalamnya akan menguap. Zeolit yang
telah dipanaskan dapat berfungsi sebagai penyerap gas atau cairan (Khairinal,
2000). Jika beberapa molekul memasuki sistem pori zeolit, salah satu molekul
tersebut akan tertahan karena perbedaan kepolarannya. Mekanisme penyerapan
dengan zeolit dapat dilakukan dengan tiga cara, yaitu penyerapan fisik,
penyerapan kimia, atau gabungan dari keduanya (penyerapan fisik dan kimia).
Penyerapan tersebut bergantung kepada sifat unsur yang diserap, keasaman
c) Penukar Ion
Kation-kation yang terdapat pada rongga zeolit berguna untuk menjaga
kenetralan zeolit. Kation-kation ini dapat bergerak bebas sehingga pertukaran
kation yang terjadi tergantung dari ukuran dan muatan maupun jenis zeolitnya.
Sifat sebagai penukar ion dari zeolit antara lain tergantung dari sifat kation, suhu,
dan jenis anion (Bambang, 1998). Selain sebagai penukar kation, zeolit juga dapat
berfungsi sebagai penukar anion. Dalam hal ini, kedudukan dari gugus hidroksil
(OH-) pada zeolit memegang peranan penting. Gugus hidroksil pada zeolit dapat
dibentuk dengan metode deamonisasi melalui proses pertukaran ion NH4+ pada
zeolit.
d) Katalis
Zeolit sebagai katalis hanya mempengaruhi laju reaksi tanpa
mempengaruhi kesetimbangan reaksi. Katalis berpori dengan ukuran pori-pori
tertentu akan memuat molekul yang lebih kecil tetapi mencegah molekul yang
lebih besar masuk. Sebagai katalis, zeolit mempunyai keistimewaan, yaitu lama
pemakaian yang lebih panjang bila dibandingkan dengan bahan katalis lainnya.
e) Penyaring/pemisah
Zeolit sebagai penyaring molekul maupun pemisah didasarkan atas
perbedaan bentuk, ukuran, dan polaritas molekul yang disaring. Sifat ini
disebabkan karena zeolit mempunyai pori-pori yang cukup besar. Molekul yang
berukuran lebih kecil dari pori-pori zeolit dapat melintas sedangkan yang
ini disebut molecular sieve yang terdapat dalam substansi zeolit alam (Bambang,
1998). Diameter pori-pori zeolit bervariasi sesuai dengan jenis zeolit, seperti yang
dapat dilihat pada tabel 4.
2.4.4. Jenis-jenis Zeolit
a) Zeolit Alam
Zeolit alam merupakan senyawa alumino silikat terhidrasi, dengan unsur
yang terdiri dari kation alkali dan alkali tanah. Senyawa ini berstruktur tiga
dimensi dan mempunyai pori yang dapat diisi oleh molekul air. Zeolit alam
terbentuk karena adanya perubahan alam (zeolitisasi) dari bahan vulkanik dan
dapat digunakan secara langsung untuk berbagai keperluan, namun daya serap
maupun daya tukar ion zeolit ini belum maksimal. Untuk memperoleh zeolit
dengan daya guna tinggi diperlukan suatu perlakuan yaitu dengan aktivasi.
Beberapa penelitian yang telah dilakukan menunjukkan bahwa zeolit alam mampu
dimanfaatkan sebagai adsorben limbah pencemar dari beberapa industri. Zeolit
mampu menyerap berbagai macam logam, antara lain Ni, Np, Pb, U, Zn, Ba, Ca,
Mg, Sr, Cd, Cu dan Hg (Kosmulski, 2001).
Perbandingan antara atom Si dan atom Al yang bervariasi akan
menghasilkan banyak jenis zeolit yang terdapat di alam. Sampai saat ini telah
ditemukan lebih dari 50 jenis zeolit alam. Namun, mineral pembentuk zeolit
hanya ada 8 besar jenisnya, seperti yang dapat dilihat pada tabel 4. Di Indonesia,
Tabel 4. Jenis Mineral Zeolit Alam dan Sifat Fisiknya
Jenis Mineral
Zeolit
Rumus Kimia Rasio Si/Al
Zeolit buatan merupakan hasil rekayasa manusia secara proses kimia yang
bisa dimodifikasi sesuai kebutuhan. Sifat zeolit yang dihasilkan tergantung dari
jumlah komponen atom Al dan atom Si dari zeolit tersebut. Salah satu jenis zeolit
buatan yang dihasilkan adalah Zeolit A (Na12[Al12Si12O48]27H2O). Zeolit buatan
lebih murni dan mempunyai kemampuan lebih luas dibandingkan dengan zeolit
alam, terutama sebagai bahan katalis.
2.4.5. Mordenit
Zeolit alam jenis mordenit mempunyai struktur kristal berbentuk
ortorombik, yang terdiri dari cincin 8 dan cincin 12. Cincin 8 dan cincin 12
dengan ukuran masing-masing 2,6 x 5,7 Å dan 6,7 x 7,0 Å serta mempunyai total
volume rongga 28% (Parikesit, Eko, 2003). Pada umumnya mordernit
mengandung ion Na, Ca dan K. Sifat adsorpsi mordenit ditentukan oleh ukuran
rongga, sehingga hanya molekul-molekul yang berdiameter lebih kecil yang dapat
diserap oleh mordenit terhidrasi (Judawati, Janis, 1993).
Gambar 2. Struktur Stereotip Mordenit
2.4.6. Aktivasi Zeolit
a) Aktivasi dengan Pemanasan
Pemanasan bertujuan untuk menguapkan air yang terperangkap di dalam
pori-pori kristal zeolit, sehingga luas permukaannya bertambah (Khairinal, 2000).
Pemanasan dilakukan selama 2 – 3 jam, tergantung besarnya kandungan unsur
pengotor yang ada serta stabilitas zeolit terhadap panas. Stabilitas ini dipengaruhi
oleh jenis mineral zeolit yang terkandung. Proses pemanasan zeolit dikontrol,
karena pemanasan yang berlebihan kemungkinan akan menyebabkan zeolit
b) Aktivasi secara Kimia
Aktivasi zeolit secara kimia dilakukan dengan cara perendaman dan
pengadukan zeolit dalam larutan asam (H2SO4 atau HCl) ataupun dalam larutan
basa (NaOH). Aktivasi ini bertujuan untuk membersihkan permukaan pori,
membuang senyawa pengotor dan mengatur kembali letak atom yang dapat
dipertukarkan. Proses aktivasi dengan asam dapat meningkatkan kristalinitas,
keasaman dan luas permukaan zeolit (Hari, 2001). Perlakuan asam telah berhasil
melepaskan alumunium dari kerangka zeolit dan mampu meningkatkan keasaman
zeolit. Peningkatan keasaman zeolit mampu memperbesar kemampuan
penyerapan zeolit. Hal itu terjadi karena banyaknya pori-pori zeolit yang terbuka
dan permukaan padatannya menjadi bersih dan luas (Heraldy, et al, 2003). Zeolit
dapat dimodifikasi menggunakan NaCl untuk menjadi zeolit unikation (Na-zeolit).
Zeolit ini cenderung bersifat netral (pH 6,8). Kondisi yang cenderung netral ini
dapat meningkatkan penyerapan zeolit (Amsiri, 2010).
2.4.7. Zeolit Alam Karangnunggal
Zeolit merupakan salah satu mineral yang banyak terdapat di daerah
sepanjang pantai selatan Provinsi Jawa Barat dan Banten. Salah satu daerah yang
banyak terdapat bijih zeolit adalah Kecamatan Karangnunggal, Kabupaten
Tasikmalaya. Kabupaten Tasikmalaya memiliki penyebaran deposit zeolit di
Karangnunggal, Cipatujah dan Cikalong dengan deposit kurang lebih 39.435.125
ton. Sampai saat ini usaha penambangan zeolit masih didominasi oleh usaha
penambangan tradisional skala kecil, sebagian juga usaha pertambangan skala
luar Kabupaten Tasikmalaya sehingga nilai tambah zeolit masih rendah. Zeolit
dari Tasikmalaya pada umumnya digunakan untuk keperluan pertanian seperti
bahan pelengkap penyerap pupuk, perikanan udang untuk menetralisir amonia dan
untuk keperluan industri penjernihan air (Sulistiyono, et al, 2009).
Zeolit alam Tasikmalaya berwarna kehijauan dan mempunyai kapasitas
tukar kation 114,5 – 162,2 meq/100g. Hasil analisis kandungan senyawa oksida dan prosentase yang terkandung dalam mineral zeolit alam Karangnunggal
menggunakan XRF dapat dilihat pada tabel 5. Hasil analisis menunjukkan bahwa
zeolit hijau Karangnunggal merupakan zeolit dengan rasio Si/Al sebesar 5,05.
Hasil analisis lebih lajut menggunakan XRD untuk menentukan karakteristik
batuan zeolit menunjukkan bahwa zeolit hijau Karangnunggal merupakan jenis
mineral mordenit yang merupakan senyawa utama dari sampel ((Na2,Ca, K2) Al2
Si10 O24.7 H2O) (Sulistiyono, et al, 2009).
Tabel 5. Hasil Analisa XRF Zeolit Alam Karangnunggal
Sumber : Sulistiyono, Eko dan Murni Handayani, 2009
Senyawa Jumlah
CaO 1,65 %
Na2O 2,77 %
K2O 0,72 %
SiO2 78,92 %
Al2O3 15,62 %
MgO 0,05 %
2.5. Scanning Electron Microscopy (SEM)
Morfologi dari suatu material dapat diamati dengan menggunakan SEM.
Alat ini memiliki resolusi yang lebih tinggi jika dibandingkan dengan mikroskop
optik. SEM dan mikroskop optik metalurgi menggunakan prinsip refleksi, yaitu
permukaan spesimen memantulkan berkas media. Daya pisah atau resolusi
dibatasi oleh panjang gelombang media yang digunakan.
Sejak SEM dikembangkan, jauh lebih mudah untuk mempelajari struktur
permukaan secara langsung. Pada dasarnya teknik SEM merupakan pemeriksaan
dan analisis permukaan. Data atau tampilan yang diperoleh adalah data dari
permukaan atau dari lapisan yang tebalnya sekitar 20 μm dari permukaan. Gambar
permukaan yang diperoleh merupakan gambar topografi dengan segala tonjolan
dan lekukan permukaan. Gambar topografi permukaan diperoleh dari
penangkapan elektron sekunder yang dipancarkan oleh spesimen. Kata kunci dari
prinsip kerja SEM adalah scanning yang berarti bahwa berkas elektron
“memindai” permukaan spesimen, titik demi titik dengan pindaian membentuk
baris demi baris, mirip dengan gerakan mata yang membaca. Sinyal elektron
sekunder yang dihasilkannya pun adalah dari titik pada permukaan, yang
selanjutnya ditangkap oleh detektor SEM dan kemudian diolah dan ditampilkan
pada layar CRT (TV). Scanning coil yang mengarahkan berkas elektron
bersinkronisasi dengan pengarah berkas elektron pada tabung layar TV, sehingga
didapatkan gambar permukaan spesimen pada layar TV (Siswosuwarno, 1996).
SEM mempunyai resolusi tinggi bisa mencapai 150.000 kali dan dapat
digunakan untuk mengamati obyek benda berukuran nanometer. Meskipun
horizontal, sedangkan pemindaian secara vertikal (tinggi rendahnya struktur)
resolusinya rendah. Ini merupakan kelemahan SEM yang belum diketahui
pemecahannya.
Gambar 3. Skema Dasar Scanning Electron Microscopy (SEM)
Perkembangan mutakhir paling berarti adalah perolehan informasi
mengenai komposisi kimia. Mikroskopnya juga menggambarkan sebuah Energy
Dispersive X-ray spectrometer (EDX) yang dapat digunakan untuk menentukan
komposisi unsur dari sampel. Ketika sebuah sampel difoto oleh SEM, sinar
elektron juga diemisikan oleh sinar-X yang dibawa oleh EDX. Emisi sinar-X tiap
unsur khas dalam energi dan panjang gelombangnya, karena itu unit EDX mampu
menentukan tiap unsur yang merespon emisi tersebut. Data ini dapat ditambahkan
pada gambar SEM untuk menghasilkan sebuah peta unsur yang sebenarnya dari
2.6. Spektroskopi Serapan Atom (Atomic Absorption Spectroscopy/AAS)
Absorpsi atom telah dikenal bertahun-tahun yang lalu. Misalnya
garis-garis gelap pada frekuensi tertentu dalam spektrum matahari, kondisi ini pertama
kali diperhatikan oleh Wollaston dalam tahun 1802. Garis-garis ini ditemukan
ulang dan dipelajari lebih mendalam oleh Joseph van Fraunhover, dan diberi nama
garis-garis Fraunhover. Pentingnya garis-garis ini baru dipahami pada tahun 1859,
ketika Kirchhoff menerangkan asal-usulnya setelah mengamati gejala yang serupa
di laboratorium. Permukaan matahari yang tampak jauh lebih panas daripada
selimut gas yang mengitarinya, dan atom-atom dalam atmosfer itu menyerap
frekuensi-frekuensi yang khas dari dalam kontinum pancaran permukaan yang
lebih panas. Radiasi itu dipancarkan kembali, kalau tidak selimut itu akan menjadi
semakin panas, namun pancaran itu berlangsung ke segala arah. Kirchhoff dan
peneliti lainnya, terutama Bunsen (yang terkenal dengan pembakarnya),
mengidentifikasi sejumlah unsur dalam atmosfer matahari dengan
membandingkan frekuensi garis-garis Fraunhofer dengan frekuensi garis dari
unsur-unsur yang dikenal di laboratorium (Day, RA, 2002).
Sekarang ini AAS merupakan pilihan utama dalam analisis unsur,
terutama unsur logam dengan beberapa alasan, yaitu :
1) Dapat menetapkan kadar logam dari suatu campuran yang sangat kompleks
dengan cepat dan ketepatan tinggi.
2) Dapat menetapkan kadar logam tertentu dengan kepekatan yang sangat kecil
3) Dapat menetapkan kadar logam tertentu dengan kepekatan yang relatif kecil,
walaupun ada unsur lain yang kepekatannya relatif besar tanpa perlu
dilakukan pemisahan terlebih dahulu.
2.6.1. Prinsip Spektroskopi Serapan Atom
Teknik ini memanfaatkan penyerapan spektroskopi untuk menilai
konsentrasi suatu analit dalam sampel. Perhitungannya menggunakan hukum
Lambert Beer. Singkatnya, elektron suatu atom di dalam sistem atomisasi dapat
dipromosikan ke orbital yang lebih tinggi untuk waktu singkat dengan menyerap
sejumlah energi (cahaya dengan panjang gelombang tertentu). Jumlah energi (atau
panjang gelombang) spesifik untuk transisi elektron tertentu dalam unsur tertentu,
masing-masing mempunyai panjang gelombang sesuai hanya dengan satu unsur.
Teknik ini memberikan selektivitas yang mendasar.
Jumlah energi (daya) yang dimasukkan ke dalam pembakar diketahui, dan
kuantitas yang tersisa di sisi lain (di detektor) dapat diukur, dari hukum Lambert
Beer ada kemungkinan untuk menghitung berapa banyak transisi ini berlangsung,
dan dengan demikian mendapatkan sinyal yang sebanding dengan konsentrasi
unsur yang diukur. Energi yang diserap berbanding lurus dengan energi yang
diperlukan untuk eksitasi atom. Hubungan penyerapan sinar dengan konsentrasi
dinyatakan dalam hukum Lambert Beer, yaitu :
Keterangan :
A = Absorbansi
IO = Intensitas cahaya awal (c/s)
IC = Intensitas cahaya setelah diadsorb oleh sampel (c/s)
ε = Koefisien Ekstingsi molar (L/mol.cm) d = Tebal media (cm)
C = Konsentrasi atom analit dalam sampel (mol/L)
Hubungan antara serapan yang dialami oleh sinar dengan konsentrasi
analit dalam larutan standar biasa dipakai untuk menganalisa larutan sampel yang
tidak diketahui konsentrasinya. Yaitu dengan mengukur serapan yang diakibatkan
oleh larutan sampel tersebut terhadap sinar yang sama.
2.6.2. Instrumentasi Spektroskopi Serapan Atom
a) Sumber Cahaya
Terdiri dari lampu katoda berongga (hollow cathode lamp) yang di
dalamnya terdapat anoda Tungsen, katoda analit, dan unsur gas mulia seperti
argon atau neon. Sumber cahaya digunakan untuk memancarkan radiasi resonans
yang spesifik untuk setiap unsur dan menghasilkan cahaya monokromatik pada
panjang gelombang yang sesuai dengan elemen analit.
b) Sistem Atomisasi
Sistem pengatoman dengan nyala terdiri dari pengabut (nebulizer) yang
berfungsi untuk mengubah sampel larutan menjadi butir-butir halus (kabut),
pembakar (burner) yang berfungsi untuk mengubah kabut uap suatu unsur
menjadi atom-atom normal di dalam nyala, dan pengatur aliran gas serta kapiler.
c) Monokromator
Sistem pemilih panjang gelombang berfungsi untuk memisahkan radiasi
yang tidak diserap oleh populasi atom (yang berasal dari lampu katoda berongga)
dari radiasi-radiasi lain yang tidak diperlukan dan akan mengganggu pengukuran
intensitas radiasi yang diperlukan. Sistem monokromator terdiri dari gabungan
cermin, lensa, prisma atau kisi (grating), dan celah (slit). Hanya cahaya dengan
panjang gelombang tertentu yang diteruskan melalui celah (slit). Sistem
monokromator ini ada yang menggunakan saluran tunggal (single beam) dan
d) Detektor
Berfungsi untuk mendeteksi radiasi gelombang elektromagnetik yang akan
diukur dengan mengubah energi cahaya menjadi energi listrik di dalam
photomultifier untuk memudahkan pengukuran.
e) Sistem Pengolahan
Berfungsi untuk mengolah kuat arus yang dihasilkan oleh detektor
menjadi besaran daya serap atom transmisi yang selanjutnya diubah menjadi
besaran konsentrasi.
f) Pencatat (recorder)
Berfungsi untuk mencatat hasil yang dikeluarkan oleh sistem pengolahan.
BAB III
METODOLOGI PENELITIAN
3.1. Tempat dan Waktu Penelitian
Penelitian dilakukan di Pusat Penelitian Metalurgi – LIPI, Gedung 470 Kawasan PUSPIPTEK Serpong, Tangerang 15314. Penelitian dilakukan dari tanggal 8 Maret 2010 sampai dengan tanggal 9 Juli 2010.
3.2. Bahan dan Alat 3.2.1. Bahan
Pasir kuarsa dari daerah Samboja, Samarinda, Kalimantan Timur. Natrium karbonat (Na2CO3), zeolit hijau dari daerah Cidadap Karangnunggal, Tasikmalaya, Jawa Barat. Aquades, asam sulfat (H2SO4) 1 N, larutan standar logam Fe, larutan standar logam Mg, larutan standar logam Ca.
3.2.2. Alat
3.3. Prosedur Kerja
3.3.1. Pemanggangan Pasir Kuarsa
Pasir kuarsa yang digunakan adalah pasir yang berasal dari daerah Samboja, Kalimantan Timur. Pasir dicuci dengan menggunakan air bersih sampai hilang kotoran berupa humus maupun lumpur. Setelah bersih, ditandai dengan filtrat yang sudah jernih. Campuran dikeringkan dalam oven pada temperatur 110°C selama 1 jam. Pasir yang sudah kering ditimbang sebanyak 165 gram dan dicampur dengan 135 gram natrium karbonat (Na2CO3), kemudian dicampur sampai merata dalam mixer. Setelah merata, campuran dimasukkan ke dalam krusibel tanah liat dan tanur diatur pada temperatur 1200°C. Setelah tercapai temperatur 1200°C, campuran ditahan dalam tanur selama 2 jam. Setelah itu, campuran dikeluarkan dalam kondisi cair dan dituangkan di tempat yang telah disediakan. Lelehan (natrium silikat) didinginkan pada temperatur ruang. Setelah dingin, natrium silikat digrinding sehingga menjadi bubuk.
3.3.2. Preparasi Larutan Natrium Silikat 10%
3.3.3. Preparasi Zeolit
Zeolit alam yang digunakan pada penelitian ini berasal dari daerah Cidadap, Karangnunggal. Zeolit yang digunakan berwarna hijau. Zeolit diperkecil ukurannya kurang lebih 2-3 cm, kemudian digrinding sampai menjadi serbuk. Setelah itu disaring dengan penyaring ayakan berukuran lubang 50 mesh.
3.3.4. Aktivasi Zeolit
Menurut (Rustam, 2001) dan (Yuhelda, 2004), aktivasi zeolit dilakukan dengan pemanasan dan secara kimia. Pertama oven diatur pada temperatur 300°C. Setelah tercapai temperatur yang diinginkan, 50 gram zeolit berukuran –50 mesh dimasukkan dan ditahan dalam oven selama 1 jam, kemudian zeolit didinginkan dalam desikator. Tahap selanjutnya zeolit hasil pemanasan dicampur ke dalam 500 ml H2SO4 dengan konsentrasi 1 N, dan diaduk pada temperatur ruang selama 1 jam. Zeolit kemudian dicuci dengan aquades sampai pH filtrat sama dengan pH aquades. Tahap akhir zeolit disaring dengan kertas saring Whatman No 40 dan dikeringkan dalam oven pada temperatur 105°C selama 2 jam. Zeolit hasil pengeringan didinginkan dalam desikator dan siap untuk digunakan.
3.3.5. Analisa SEM
Sampel yang telah bersih dan kering ditempelkan pada sample holder
3.3.6. Percobaan Batch
Percobaan batch dilakukan untuk mengetahui adsorpsi Fe3+, Mg2+, dan Ca2+. Percobaan dilakukan dengan menambahkan zeolit (yang sudah diaktivasi) ke dalam larutan natrium silikat. Percobaan dilakukan dengan beberapa parameter untuk mengetahui kondisi optimum adsorpsi zeolit.
3.3.6.1. Analisa Fe3+
3.3.6.1.1. Variasi Waktu Kontak
Sebanyak 1 gram zeolit yang sudah diaktivasi dicampur ke dalam 50 ml larutan natrium silikat (Na2SiO3) 0,03% dengan pH = 3. Kemudian diaduk pada temperatur 30°C dengan waktu yang berbeda (15, 30, 60, 90, 120, 150 menit). Setelah itu campuran disaring dengan kertas saring Whatman No 40. Filtrat yang dihasilkan dianalisa menggunakan AAS Analytic Jena novAA 300 untuk mengetahui penyerapan zeolit.
3.3.6.1.2. Variasi Massa Zeolit
3.3.6.1.3. Variasi pH
Sebanyak 3 gram zeolit yang sudah diaktivasi dicampur ke dalam 50 ml larutan natrium silikat (Na2SiO3) 0,03% dengan pH yang berbeda (2, 3, 4, 5, 6, 7, 8). Kemudian diaduk pada temperatur 30°C selama 60 menit. Setelah itu campuran disaring dengan kertas saring Whatman No 40. Filtrat yang dihasilkan dianalisa menggunakan AAS Analytic Jena novAA 300 untuk mengetahui penyerapan zeolit.
3.3.6.1.4. Variasi Temperatur
Sebanyak 3 gram zeolit yang sudah diaktivasi dicampur ke dalam 50 ml larutan natrium silikat (Na2SiO3) 0,03% dengan pH = 3. Kemudian diaduk pada temperatur yang berbeda (30, 40, 50, 60, 70, 80°C) selama 60 menit. Setelah itu campuran disaring dengan kertas saring Whatman No 40. Filtrat yang dihasilkan dianalisa menggunakan AAS Analytic Jena novAA 300 untuk mengetahui penyerapan zeolit.
3.3.6.1.5 Isoterm Adsorpsi
3.3.6.2. Analisa Mg2+ dan Ca2+ 3.3.6.2.1. Variasi pH
Sebanyak 2,5 gram zeolit yang sudah diaktivasi dicampur ke dalam 50 ml larutan natrium silikat (Na2SiO3) 0,1% dengan pH yang berbeda (2, 3, 4, 6, 8, 10). Kemudian diaduk pada temperatur 30°C selama 60 menit. Setelah itu campuran disaring dengan kertas saring Whatman No 40. Filtrat yang dihasilkan dianalisa menggunakan AAS Analytic Jena novAA 300 untuk mengetahui pada pH berapa penyerapan optimum zeolit.
3.3.6.2.2. Variasi Massa Zeolit
Zeolit yang sudah diaktivasi dengan massa yang berbeda (1, 3, 5, 7 gram) dicampur ke dalam 50 ml larutan natrium silikat (Na2SiO3) 0,1% dengan pH = 10. Kemudian diaduk pada temperatur 30°C selama 60 menit. Setelah itu campuran disaring dengan kertas saring Whatman No 40. Filtrat yang dihasilkan dianalisa menggunakan AAS Analytic Jena novAA 300 untuk mengetahui penyerapan optimum zeolit.
3.3.6.2.3. Variasi Waktu Kontak
BAB IV
HASIL DAN PEMBAHASAN
Penelitian ini dilakukan untuk mengetahui efisiensi dan kapasitas penyerapan zeolit alam Karangnunggal terhadap unsur pengotor dalam larutan natrium silikat. Untuk mengetahuinya, maka peneliti mencari hubungan antara kemampuan penyerapan unsur pengotor oleh zeolit alam Karangnunggal dengan variasi waktu kontak, massa, pH dan temperatur.
4.1. Karakterisasi dan Identifikasi Pasir Kuarsa
Bahan baku yang digunakan adalah pasir kuarsa dari daerah Samboja, Samarinda, Kalimantan Timur. Pasir yang digunakan haruslah kuarsa yang hampir murni. Untuk itu dilakukan karakterisasi pasir kuarsa menggunakan SEM dan AAS. Hasil analisa menggunakan SEM dengan perbesaran 500 kali menunjukkan morfologi permukaan pasir kuarsa. Dari gambar 5 dapat dilihat bahwa hasil analisa ini identik dengan kuarsa komersil.
100 µm100 µm100 µm100 µm100 µm
Analisa menggunakan AAS juga dilakukan. Analisa ini dilakukan untuk mengetahui senyawa-senyawa pengotor apa saja yang terdapat di dalam pasir kuarsa. Hasil analisa AAS dapat dilihat pada tabel 6. Berdasarkan analisa AAS diketahui bahwa senyawa pengotor terbesar adalah Fe2O3 sebesar 0,19 %.
Tabel 6. Hasil Analisa XRF Pasir Kuarsa Samboja
Senyawa Jumlah (%)
SiO2 99,2
Fe2O3 0,19
Al2O3 0,063
TiO2 0,048
CaO 0,008 MgO 0,008
K2O 0,023
Na2O 0,020
LOI 0,39 Sumber : Laboratorium Pengujian tekMIRA, Bandung
4.2. Preparasi Larutan Natrium Silikat
Pasir kuarsa direaksikan dengan natrium karbonat (Na2CO3). Pasir kuarsa dan natrium karbonat (Na2CO3) akan melebur membentuk natrium silikat pada temperatur di atas 1200°C. Selanjutnya leburan didinginkan dengan cepat agar kristal yang diperoleh dapat larut dalam air dengan mudah, reaksi yang terjadi adalah :
Natrium karbonat (Na2CO3) ditambahkan ke dalam krusibel yang sebelumnya diisi dengan pasir silika, kedua bahan akan berdisosiasi menghasilkan natrium silikat dengan melepaskan karbon dioksida (CO2). Akhirnya, setelah proses peleburan dan degassing pada temperatur mencapai 1200°C, cairan didinginkan hingga temperatur kamar. Ion natrium terperangkap di dalam jaringan dan mengurangi jumlah jembatan/ikatan antar tetrahedra, seperti diperlihatkan pada gambar 6. Kation Na+ ini berpengaruh pada ukuran lubang/rongga dan diperkirakan terjadinya pembentukan klaster dan kation Na+ tidak terdistribusi secara acak dalam jaringan. Namun meskipun berfungsi sebagai fluks, natrium oksida sendiri menyebabkan gelas dapat larut dalam air (Smallman, et al, 2000).
Gambar 6. Struktur Ikatan Natrium Silikat
Titik leleh natrium silikat adalah sekitar 900°C, dan keadaan berkaca dihasilkan jika pendinginan melewati suhu tersebut dilakukan dengan cepat. Produknya, yang disebut “kaca-air” bersifat larut air. Natrium silikat yang dihasilkan kemudian dilarutkan dengan air mendidih. Hanya silikat logam-logam alkali larut dalam air. Zat-zat ini terhidrolisis dalam larutan air dan karenanya menghasilkan larutan basa, reaksi yang terjadi adalah :
Larutan natrium silikat ini kemudian direaksikan dengan zeolit untuk menghilangkan unsur pengotor yang terkandung di dalamnya. Proses adsorpsi dilakukan dengan metode batch.
4.3. Aktivasi Zeolit
Zeolit alam pada umumnya mempunyai ukuran pori-pori yang tidak sama. Aktivitas katalitik zeolit alam cenderung rendah dan banyak mengandung pengotor. Oleh karena itu, zeolit alam perlu diaktivasi dan dimodifikasi terlebih dahulu untuk meningkatkan manfaat dan kemampuannya (Pardoyo, et al, 2009).
Temperatur aktivasi zeolit mempengaruhi adsorpsi ion logam dalam larutan natrium silikat. Pemanasan zeolit bertujuan untuk menguapkan air yang terdapat pada permukaan zeolit sampai ke seluruh rongga atau pori-pori zeolit. Hal ini juga berfungsi untuk menguraikan senyawa-senyawa organik yang terdapat di dalam rongga atau pori-pori zeolit (Parikesit, 2003). Penguapan molekul-molekul air yang terperangkap di dalam pori-pori zeolit menghasilkan jumlah pori dan luas permukaan spesifik zeolit bertambah sehingga zeolit menjadi lebih efektif mengadsorpsi ion-ion logam (Susatyo, et al, 2009).
pori-pori zeolit yang terbuka dan permukaan padatannya menjadi bersih dan luas (Heraldy, et al, 2003).
Zeolit alam Karangnunggal yang sudah diaktivasi dan akan digunakan untuk proses selanjutnya dianalisa menggunakan SEM. Hasil analisa SEM dapat dilihat pada gambar 7. Hasil analisa menggunakan SEM dengan perbesaran 1000 kali menunjukkan morfologi permukaan zeolit. Dari gambar 7 dapat dilihat bahwa zeolit yang sudah diaktivasi permukaannya lebih bersih dari pengotor. Selain itu, zeolit yang sudah diaktivasi mempunyai ukuran partikel yang lebih kecil dan hampir sama. Semakin kecil ukuran partikel maka akan semakin efektif untuk menyerap unsur pengotor dalam larutan natrium silikat.
30 µm30 µm30 µm30 µm30 µm 30 µm30 µm30 µm30 µm30 µm
Zeolit Tanpa Aktivasi Zeolit yang Sudah Diaktivasi
Gambar 7. Morfologi Zeolit Alam Karangnunggal
Emisi sinar-X setiap unsur khas dalam energi dan panjang gelombangnya, karena itu unit EDX mampu menentukan setiap unsur yang merespon emisi tersebut. Data ini dapat ditambahkan pada gambar SEM untuk menghasilkan sebuah peta unsur yang sebenarnya dari permukaan sampel (Nuryadi, 2006).
Tabel 7. Hasil Analisa EDX Zeolit Alam Karangnunggal Unsur Zeolit Tanpa Aktivasi
(% massa)
Zeolit yang Sudah Diaktivasi (% massa)
C 33,54 31,42
O 42,91 41,70
Na 0,50 -
Al 2,92 3,35
Si 17,21 21,84
K 0,80 0,71
Ca 0,98 0,99
Cu 1,14 -
dealuminasi (lepasnya Al dari struktur zeolit). Zeolit yang diaktivasi dengan H2SO4 akan membentuk H-zeolit.
4.4. Penentuan Kondisi Optimum
4.4.1. Analisa Ion Logam Fe3+
4.4.1.1. Hubungan Waktu Kontak dengan Penyerapan Fe3+
0
Gambar 8. Persentase ion logam Fe3+ yang diserap dari larutan natrium silikat dengan waktu kontak yang berbeda (massa zeolit 1 gr, pH = 3, temperatur 30°C, volume 50 ml, konsentrasi 0,03%).
Waktu kontak mempengaruhi adsorpsi ion logam Fe3+ dalam larutan natrium silikat. Dari gambar 8 dapat dilihat bahwa adsorpsi optimum dihasilkan pada larutan natrium silikat yang direaksikan dengan zeolit selama 60 menit, yaitu sebesar 53,64 %.
adsorpsi sudah lewat jenuh sehingga terjadinya pelepasan kembali ion-ion logam Fe3+ yang sudah terikat pada zeolit. Kemungkinan lain adalah pada proses adsorpsi yang relatif lama menyebabkan pori-pori adsorben mengalami penyusutan kembali (Kadarwati dan Bagus Setyo, 2009). Berdasarkan perhitungan dengan menggunakan persamaan Isoterm Langmuir dan Freundlich dapat diketahui bahwa proses adsorpsi yang terjadi adalah adsorpsi fisika. Sehingga ikatan yang terjadi merupakan ikatan lemah.
4.4.1.2. Hubungan Massa Zeolit dengan Penyerapan Fe3+
70
Gambar 9. Persentase ion logam Fe3+ yang diserap dari larutan natrium silikat dengan massa zeolit yang berbeda (pH = 3, temperatur 30°C, waktu kontak 60 menit, volume 50 ml, konsentrasi 0,03%).
Gambar 9 menunjukkan bahwa adsorpsi optimum dihasilkan pada larutan yang direaksikan dengan 3 gram zeolit, yaitu sebesar 81,81 %. Larutan yang direaksikan dengan massa zeolit kurang dari 3 gram belum optimal. Hal ini dikarenakan kurangnya sisi aktif dan rongga-rongga zeolit untuk menyerap ion logam Fe3+. Larutan yang direaksikan dengan massa zeolit lebih dari 3 gram juga tidak optimal. Hal ini kemungkinan dikarenakan dengan semakin banyaknya jumlah zeolit yang digunakan, larutan natrium silikat menjadi semakin asam. Kondisi pH larutan yang semakin asam memungkinkan terjadinya reaksi pelepasan ion Fe3+ kembali. Massa yang digunakan harus seminimal mungkin agar aplikasinya ekonomis pada skala lapangan.
4.4.1.3. Hubungan pH dengan Penyerapan Fe3+
0
Kemampuan penyerapan suatu sorben dapat dipengaruhi oleh pH larutan. Hal ini berhubungan dengan protonasi atau deprotonasi permukaan sisi aktif dari sorben (Nurhasni, 2002). Keasaman dan kebasaan larutan natrium silikat mempengaruhi adsorpsi ion logam Fe3+. Dari gambar 10 dapat dilihat bahwa adsorpsi optimum dihasilkan pada larutan natrium silikat dengan pH 3, yaitu sebesar 76,05 %. Adsorpsi ion logam Fe pada larutan natrium silikat dengan pH kurang dari 3 tidak optimal. Hal ini dikarenakan konsentrasi H+ yang terlalu besar, sehingga terjadi kompetisi antara H+ dengan alkali dan alkali tanah yang terdapat di dalam kerangka zeolit. Kompetisi ini mengakibatkan terganggunya proses pertukaran ion dan penyerapan terhadap ion logam Fe3+.
Reaksi antara H+ dengan logam alkali dan alkali tanah pada kerangka zeolit ditunjukkan oleh reaksi di bawah ini :
(M+)z + (H+)l (M+)l + (H+)z M : alkali / alkali tanah
Z : padatan Zeolit l : Fase Larutan