INDUKSI KERAGAMAN GENETIK LILI UNTUK MERAKIT
VARIETAS RESISTEN TERHADAP
Fusarium oxysporum f.sp. lilii SECARA IN VITRO
RIDHO KURNIATI
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI DISERTASI DAN SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA*
Dengan ini saya menyatakan bahwa disertasi berjudul Induksi Keragaman Genetik Lili untuk Merakit Varietas Resisten terhadap Fusarium oxysporum f.sp. lilii secara In vitro adalah benar karya saya dengan arahan dari Komisi Pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir disertasi ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Februari 2014
Ridho Kurniati
NIM. A263090091
__________________________
RINGKASAN
RIDHO KURNIATI. Induksi Keragaman Genetik Lili untuk Merakit Varietas Resisten terhadap Fusarium oxysporum f.sp. lilii secara In vitro. Dibimbing oleh AGUS PURWITO sebagai ketua, GUSTAAF ADOLF WATTIMENA dan BUDI MARWOTO sebagai anggota komisi pembimbing.
Lili merupakan tanaman hias penting dalam industri florikultura. Saat ini, umbi lili untuk materi perbanyakan di Indonesia masih impor. Dengan demikian diperlukan metode perbanyakan lili secara massal. Metode perbanyakan yang dilakukan diantaranya pemanfaatan tangkai sari bunga sebagai eksplan. Perbanyakan lili juga dilakukan dengan optimalisasi kondisi kultur melalui modifikasi media yang mengandung gula, kondisi kultur dengan cahaya dan kondisi gelap.
Di sisi lain, induksi keragaman genetik juga penting dilakukan untuk menyediakan bunga lili tipe baru sesuai kebutuhan pasar. Peningkatan keragaman lili dilakukan melalui induksi mutasi dengan sinar Gamma dan mutagen kimia EMS. Seleksi in vitro planlet hasil induksi mutasi dilakukan dengan menggunakan media yang mengandung fusaric acid (FA). Optimalisasi konsentrasi FA digunakan untuk mendapatkan konsentrasi yang sesuai untuk mendapatkan planlet tahan FA. Analisis kandungan saponin pada akar dan umbi lili hasil induks i mutasi digunakan sebagai indikator ketahanan tanaman terhadap Fusarium oxysporum.
Tujuan penelitian ialah mendapatkan tanaman lili yang tahan terhadap Fusarium oxysporum f.sp. lilii melalui induksi mutasi. Seleksi awal dilakukan melalui seleksi in vitro menggunakan media yang mengandung fusaric acid.
Dalam penelitian ini digunakan dua tipe lili yaitu lili Asiatik dan lili Oriental. Planlet lili diperoleh dari eksplan tangkai sari bunga, melalui tahapan induksi kalus. Media induksi kalus yang mengandung zat pengatur tumbuh TDZ 0.1 mgl-1 dan Kinetin 0.1 mgl-1 merupakan media yang mampu menginduksi kalus dalam waktu 14 hari setelah kultur. Media yang mengandung TDZ (thidiazuron) 0.2 mgl-1 dan Kinetin 0.3 mgl-1 menghasilkan bobot kalus tertinggi. Pembentukan umbi optimum diperoleh pada media yang mengandung gula pasir 45 g/l dalam kondisi gelap. Media regenerasi yang mengandung NAA (Naphthalene acetic acid) mendorong pembentukan akar lili. Zat pengatur tumbuh NAA 2 mgl-1 menghasilkan rerata jumlah akar terbanyak.
Oriental cv. Frutty Pink lebih tahan terhadap FA dibandingkan lili Asiatik cv. Purple Maroon, pada konsentrasi fusaric acid yang sama.
Kandungan saponin lili dapat ditingkatkan melalui induksi mutasi, terjadi peningkatan kandungan saponin 0.02% pada lili Asiatik cv. Purple Maroon dan 0.22% pada lili Oriental cv. Frutty Pink. Kandungan saponin lili Oriental cv. Frutty Pink lebih tinggi dibandingkan lili Asiatik cv. Purple Maroon. Kandungan saponin ini dapat digunakan sebagai indikator ketahanan terhadap Fusarium oxysporum.
SUMMARY
RIDHO KURNIATI. Induce Genetic Variability of Lily for resistance of Fusarium oxysporum f.sp. lilii by in vitro culture. Supervised by AGUS PURWITO, GUSTAAF ADOLF WATTIMENA and BUDI MARWOTO.
Lily is an important flower for floriculture industries. Up till now planting materials of lily are obtained from import. Therefore, development of mass propagation method of lily is needed. Optimalization culture condition through modification of media containing sugar, light and darkness culture are also important.
In other side, inducing genetic variability is urgently done to provide new types of flower that are always needed by market. Induce variability through Gamma irradiation and EMS, in vitro selection using selection media containing fusaric acid (FA) and measure total of saponin contents were conducted in this study.
The objectives of the research were to develop in vitro propagation technology of lily and induce their variabilities through Gamma irradiation and EMS mutagen. One of lily variance that are expected to be appeared is the ones that resistant to Fusarium oxysporum. They will be obtained from in vitro selection of lily variance to fusaric acid and analysis of saponin contents. Two types of lily, Asiatic and Orientals lily were used in this study. Planlets lily could be produced using filaments. MS medium containing TDZ 0.1 mgl-1 and Kinetin 0.1 mgl-1 could induced callus on 14 days after culture. MS medium containing TDZ (thidiazuron) 0.2 mgl-1 and Kinetin 0.3 mgl-1 was produce the highest fresh weight of callus. The optimum bulbs formation were achieved on dark culture condition and media containing 45 gl-1 of sugar. MS medium using NAA 2 mgl-1 was induced the highest rooting in lily.
The variability of lily increased by application of Gamma irradiation and EMS mutagen. Radiosensitivity of Gamma irradiation depended on the type of lily. Asiatik lily cv. Purple Maroon was more sensitives than Oriental lily cv. Sorbon. Lethal dose (50%) of Asiatic lily cv. Purple Maroon was achieved on 33.49 Gy and 46.68 Gy for Oriental lily cv. Sorbon. The precentage of survival callus was decreased on higher dose of Gamma irradiation. Mutation induction using EMS was not caused lethal concentration yet, but it was influenced for shoots production. The highest concentration of EMS was decreased total number of shoots.
Resistance plantlets of fusaric acid (FA) were achieved on in vitro selection, about 36 clones were resistance to FA. In vitro selection was showed that Oriental lily cv. Frutty Pink was more resistant on selected media than Asiatic lily cv. Purple Maroon on the same concentration of FA.
Saponin contents of lily which induced by mutagen could be increased and it was could be as indicator for resistance to Fusarium oxysporum. Saponin contents of Asiatic lily cv. Purple Maroon was increased 0.02% and 0.22% for Oriental lily cv. Frutty Pink.
© Hak Cipta Milik IPB, Tahun 2014
Hak Cipta Dilindungi Undang- Undang
INDUKSI KERAGAMAN GENETIK LILI UNTUK MERAKIT
VARIETAS RESISTEN TERHADAP
Fusarium oxysporum f.sp. lilii SECARA IN VITRO
RIDHO KURNIATI
Disertasi
Sebagai salah satu syarat untuk memperoleh gelar Doktor
pada
Program Studi Pemuliaan dan Bioteknologi Tanaman
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
Penguji pada Ujian Tertutup : 1. Dr. Ir. Syarifah Iis Asyiah, MSc. 2. Dr. Dewi Sukma, SP. MSi
Judul Disertasi : Induksi Keragaman Genetik Lili untuk Merakit Varietas Resisten Fusarium oxysporum f.sp. lilii secara In vitro.
Nama : Ridho Kurniati NRP : A.263090091
Disetujui Komisi Pembimbing
Dr.Ir.Agus Purwito, MSc.Agr Ketua
Prof. Dr.Ir.G.A. Wattimena. MSc Anggota
Diketahui
Prof. Dr. Ir. Budi Marwoto, MS.APU Anggota
Ketua Program Studi Pemuliaan dan Bioteknologi Tanaman
Dr.Ir. Yudiwanti Wahyu EK, MS
Dekan Sekolah Pasca Sarjana
Dr. Ir. Dahrul Syah, MSc.Agr
PRAKATA
Alhamdulillah, segala puji bagi Allah yang telah memberikan hidayah dan karunia-Nya sehingga penulis dapat menyelesaikan disertasi yang berjudul
“Induksi Keragaman Genetik Lili untuk Merakit Varietas Resisten Fusarium oxysporum f.sp. lilii secara In vitro”.
Penulis menyampaikan terimakasih dan penghargaan setinggi - tingginya kepada Dr.Ir. Agus Purwito MSc.Agr, Prof.Dr. GA.Wattimena, Prof.Dr. Ir.Budi Marwoto,MS.APU sebagai komisi pembimbing yang telah memberikan bimbingan, saran dan masukan yang sangat berharga sejak awal penyusunan proposal, pelaksanaan penelitian hingga selesainya penulisan disertasi ini. Penulis juga menyampaikan terimakasih kepada Prof. Dr. Nurhayati Ansori Matjik, Dr. Dewi Sukma, SP. MSi, Dr. Ir. Trikoesoemaningtyas MSc, Dr. Ir. Syarifah Iis Asyiah, MSc, Dr. Ir. Muhammad Prama Yufdy MSc, Dr. Ir.Ni Made Armini Wiendi, MS yang telah bersedia menjadi penguji luar komisi pada ujian pra kualifikasi program Doktor, Ujian Tertutup dan Ujian Terbuka serta memberikan masukan dan saran perbaikan untuk kesempurnaan disertasi ini.
Terima kasih juga penulis sampaikan kepada Kepala Pusat Penelitian dan Pengembangan Tanaman Hortikultura, Kepala Balai Tanaman Hias Segunung dan Kepala Badan Penelitian dan Pengembangan Pertanian, Kementerian Pertanian atas kesempatan belajar dan beasiswa pendidikan program doktor yang telah diberikan kepada penulis.
Terimakasih juga penulis sampaikan kepada teman- teman di Laboratorium Kultur Jaringan Kebun Percobaan Cipanas dan teman- teman di Balai Penelitian Tanaman Hias yang banyak membantu dan memudahkan penggunaan fasilitas laboratorium dan rumah kaca untuk penelitian. Terimakasih kepada Dr. Suskandari Kartikaningrum, Dr. Sri Rianawati, Ir. Minangsari Dewanti MP, Ir. Dedeh Badriah MSi, Ir. Darliah MS, Dr. Lia Sanjaya dan Fitri Rachmawati, MSi atas bantuannya. Kepada Supenti, Yana Mulyana, Fauzi, Prayit (BATAN), Iwan (Lab. Histologi FKH IPB), Joko (Laboratorium Mikroteknik IPB) terimakasih atas bantuan dan kerjasamanya selama penelitian. Kepada teman- teman PBT tahun 2009, terimakasih atas kerjasama, persahabatan dan dukungannya selama belajar di IPB.
Disertasi ini juga tersusun dan terselesaikan atas bantuan dan dukungan orang tua, keluarga, suami dan kedua putri tercinta Fildza Maulida Fairuz dan Faiza Naufalia Ghaisani. Terimakasih atas perhatian, motivasi dan dorongan semangat yang telah diberikan. Akhir kata, semoga semua bantuan baik moril maupun material Bapak dan Ibu menjadi amalan yang tiada terputus dan sebagai amal jariyah yang bermanfaat dunia dan akhirat. Harapan penulis, semoga disertasi ini memberi banyak manfaat bagi semua pihak.
DAFTAR ISI
DAFTAR TABEL x DAFTAR GAMBAR x DAFTAR LAMPIRAN xii
1 PENDAHULUAN 1
1.1 Latar Belakang 1
1.2 Tujuan Penelitian 3
1.3 Hipotesis 3
1.4 Kerangka Pemikiran 3
1.5 Manfaat 4
1.6 Kebaruan 4
2 TINJAUAN PUSTAKA 7
Botani dan Morfologi Lili 7
Nilai Ekonomi Lili 8
Perbanyakan Lili secara In vitro 9
Pemuliaan Mutasi Lili 10
Fusarium oxysporum 11
Fusaric acid (FA) 12
Saponin 12
3 TEKNOLOGI PERBANYAKAN LILI SECARA IN VITRO 14 3.1 Produksi kalus lili dan regenerasi planlet lili pada beberapa jenis
media 14
Abstrak 14
Pendahuluan 14
Bahan dan Metode 15
Hasil dan Pembahasan 16
1. Induksi kalus lili dari tangkai sari bunga 16 2. Regenerasi kalus membentuk umbi dan daun lili 18
Simpulan 20
3.1 Optimasi media regenerasi kalus lili untuk menghasilkan tunas
dan umbi 21
Abstrak 21
Pendahuluan 21
Bahan dan Metode 22
Hasil dan Pembahasan 23
Simpulan 25
3.2 Pembesaran umbi pada beberapa media serta aklimatisasi lili 26
Abstrak 26
Pendahuluan 26
Bahan dan Metode 27
Hasil dan Pembahasan 27
4 PENINGKATAN KERAGAMAN IN VITRO LILI DENGAN
INDUKSI MUTASI 31
4.1 Peningkatan keragaman genetik in vitro lili dengan sinar Gamma 31
Abstrak 31
Pendahuluan 31
Bahan dan Metode 33
Prosedur Pelaksanaan 33
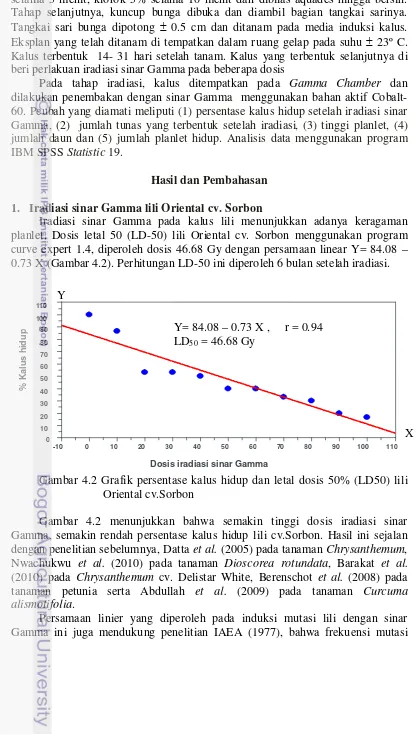
Hasil dan Pembahasan 34
1. Iradiasi sinar Gamma lili Oriental cv. Sorbon 34 2. Iradiasi sinar Gamma lili Asiatik cv. Purple Maroon 35 3. Analisis keragaman planlet lili hasil induksi mutasi berdasarkan
karakter morfologi 37
Simpulan 38
4.2 Peningkatan keragaman genetik in vitro lili dengan mutagen kimia
(Ethyl methanosulfonat/EMS) 39
1. Induksi mutagen EMS pada lili Asiatik cv. Purple Maroon (PM) 40 2. Induksi mutagen EMS pada lili Oriental cv. Frutty Pink (FP) 42 3. Analisis keragaman planlet lili hasil induksi mutasi berdasarkan
karakter morfologi 43
4. Pembentukan Populasi Planlet Hasil Induksi Mutasi 44
Simpulan 47
5 SELEKSI IN VITRO PLANLET LILI HASIL INDUKSI MUTASI
DENGAN FUSARIC ACID 48
Abstrak 48
Pendahuluan 48
Bahan dan Metode 50
Hasil dan Pembahasan 50
1. Seleksi in vitro planlet lili Asiatik cv. Purple Maroon (PM) 51 2. Seleksi in vitro planlet lili Oriental cv. Frutty Pink (FP) 52
Simpulan 54
6 KANDUNGAN SAPONIN LILI HASIL INDUKSI MUTASI 55
Abstrak 55
Pendahuluan 55
Bahan dan Metode 56
Simpulan 58
7 DETEKSI KERAGAMAN IN VITRO PLANLET LILI (Lilium, L)
HASIL MUTASI DENGAN ISOZIM 59
Abstrak 59
Pendahuluan 59
Bahan dan Metode 60
Hasil dan Pembahasan 60
8 PEMBAHASAN UMUM 67
9 SIMPULAN DAN SARAN 70
DAFTAR PUSTAKA 71
LAMPIRAN 77
DAFTAR TABEL
2.1 Klasifikasi spesies lili 7
2.2 Tingkat ketahanan species lili terhadap Fol 12
3.1 Rerata waktu inisiasi kalus dan bobot basah kalus 17 3.2 Rerata jumlah tunas, panjang tunas, jumlah daun dan jumlah akar lili
ada beberapa media 2 minggu setelah kultur. 23
3.3 Rerata jumlah umbi dan diameter umbi lili pada beberapa media 2
minggu setelah kultur. 24
3.4 Pengaruh jenis media dan kondisi kultur pada kalus lili 29 4.1 Persentase kalus hidup, jumlah tunas, jumlah daun, tinggi planlet dan
jumlah planlet hidup lili Oriental cv.Sorbon pada berbagai dosis
sinar Gamma 35
4.2 Persentase kalus hidup, jumlah tunas, tinggi planlet, jumlah daun dan
jumlah planlet lili Asiatik cvPM pada berbagai dosis sinar Gamma 36 4.3 Keragaman planlet lili hasil induksi mutasi sinar Gamma berdasarkan
karakter morfologi (8 bulan setelah kultur). 38 4.4 Persentase kalus hidup dan persentase kalus membentuk tunas planlet
lili Asiatik cv.PM hasil induksi mutasi kimia EMS (20 HSK) 41 4.5 Persentase kalus hidup dan persentase kalus membentuk tunas lili
Oriental cv.FP hasil induk si mutasi kimia EMS (20 HSK) 42 4.6 Keragaman planlet lili Asiatik cvPM dan lili Oriental cvFP hasil
induksi mutasi berdasarkan karakter morfologi 44 4.7 Tahapan pembentukan populasi planlet hasil mutasi. 46 5.1 Seleksi in vitro planlet lili Asiatik cv.PM hasil induksi mutasi dengan 51 5.2 Seleksi in vitro planlet lili Oriental cvFP hasil iradiasi sinar Gamma 52 5.3 Klon-klon lili tahan hasil seleksi in vitro pada media yang
mengandung FA. 53
DAFTAR GAMBAR
1.1 Bagan alur tahapan penelitian 6
2.1 Struktur bunga lili dan reproduksinya. 8
2.2 Penampilan umbi dan tanaman lili yang terinfeksi cendawan
3.1 Tahapan percobaan pembentukan kalus lili 16
3.2 Pembentukan kalus lili pada beberapa media 18
3.3 Jumlah umbi yang terbentuk pada beberapa media 4 bulan setelah
kultur 19
3.4 Jumlah daun yang terbentuk pada beberapa media 4 bulan setelah
kultur 19
3.5 Perkembangan kalus membentuk daun dan umbi lili 20 3.6 Perkembangan kalus lili pada media regenerasi (4 bulan setelah
kultur) 24
3.7 Respon kalus lili dan regenerasinya pada beberapa media (8 bulan
setelah kultur) 25
3.8 Jumlah umbi lili yang terbentuk pada beberapa konsentrasi gula 28 3.9 Pembentukan umbi pada beberapa media dalam kondisi gelap. 29
3.10 Aklimatisasi planlet lili 30
4.1 Tahapan induksi mutasi kalus lili dengan sinar Gamma dan
pembentukan populasi hasil mutasi. 33
4.2 Grafik persentase kalus hidup dan letal dosis 50% (LD50) lili
Oriental cv.Sorbon 34
4.3 Grafik persentase kalus hidup dan dosis letal dosis 50% (LD50) lili
Asiatik cv Purple Maroon. 36
4.4 Respon kalus 37
4.5 Perubahan morfologi planlet lili hasil iradiasi sinar Gamma. 38 4.6 Pengaruh konsentrasi EMS terhadap tinggi planlet lili Asiatik cv. PM
(20 HSK) 41
4.7 Pengaruh konsentrasi EMS terhadap jumlah daun lili Asiatik cv PM 41 4.8 Pengaruh konsentrasi EMS terhadap tinggi planlet lili Oriental cv. FP
(20 HSK) 42
4.9 Pengaruh konsentrasi EMS terhadap jumlah daun lili Oriental cv. FP 43 4.10 Keragaman morfologi planlet lili hasil induksi mutasi dengan EMS. 44 4.11 Tahapan pembentukan populasi planlet hasil induksi mutasi. 45 4.12 Perubahan morfologi planlet hasil mutasi selama pembentukan
populasi dari MV0 sampai dengan MV3. 46
5.1 Planlet lili hasil induksi mutasi pada media seleksi yang
mengandung FA 52
5.2 Planlet lili hasil induksi mutasi MV3 pada media seleksi in vitro. 53 6.1 Bahan tanaman yang digunakan dalam uji kandungan saponin lili. 57 6.2 Kandungan saponin lili Oriental cv FP dengan menggunakan TLC 57 6.3 Kadar saponin lili Asiatik cv.PM dengan menggunakan TLC 57 7.1 Profil pola pita planlet lili hasil induksi mutasi dengan analisis
isozim menggunakan enzim AAT. 62
7.2 Profil pola pita planlet lili hasil mutasi induksi dengan analisis isozim
7.3 Profil pola pita planlet lili hasil mutasi induksi dengan analisis isozim
menggunakan enzim EST . 64
7.4 Profil pola pita planlet lili hasil mutasi induksi dengan analisis isozim
menggunakan enzim PRX 65
7.5 Dendogram planlet lili hasil induksi mutasi. 66
DAFTAR LAMPIRAN
1.Morfologi bunga lili
Bunga lili cv.Frutty Pink 77
Eksplan lili cv.Purple Maroon 77
Lili Oriental cv. Sorbon 77
Lili Asiatik cv. Purple Maroon 77
2. Karakteristik lili Oriental cv. Sorbon 78
3. Komposisi Media MS (Murashige and Skoog) untuk induksi kalus
1
PENDAHULUAN
1.1Latar Belakang
Lili (Lilium L.) merupakan tanaman hias yang dibudidayakan untuk produksi umbi, bunga potong, tanaman pot dan taman (Straathof 1994). Tanaman ini memiliki nilai ekonomi tinggi dengan berbagai keunggulan, di antaranya aroma, warna maupun corak bunga. Corak dan warna bunga yang bervariasi serta aroma bunga yang wangi menjadikan bunga lili menjadi salah satu bunga yang banyak digemari masyarakat. Bunga lili putih digunakan sebagai lambang kesucian, keabadian serta kelimpahan rejeki, sehingga bunga ini banyak digunakan untuk acara keagamaan dan pernikahan. Di Cina, umbi lili (Lilium speciosum var. gloriosoides ) dimanfaatkan sebagai obat (Chang et al. 2000).
Kebutuhan bunga potong lili di Indonesia cukup tinggi, namun ketersediaan benih masih terbatas. Indonesia mengalami peningkatan impor lili dari tahun ke tahun. Direktorat Perbenihan dan Sarana Produksi Direktorat Jenderal Hortikultura tahun 2010 menyatakan bahwa impor benih lili pada tahun 2008 sebanyak 1.273.550 umbi, tahun 2009 sebanyak 2.201.500 umbi dan tahun 2010 sebanyak 2.992.390 umbi.
Benih lili secara keseluruhan masih impor dari negara lain. Di sisi lain, umbi impor ini memiliki beberapa kelemahan, diantaranya pembudidayaannya harus memiliki ijin dari negara pengekspor, tanaman lili kurang adaptif serta hambatan hama dan penyakit tanaman. Hambatan ini akan mempengaruhi biaya produksi yang akan berdampak pada nilai jual bunga. Harga jual bunga dan umbi menjadi lebih mahal sehingga kalah bersaing dalam industri florikultura di Indonesia. Hambatan lain dalam budidaya lili ialah penyakit layu dan busuk umbi yang disebabkan oleh cendawan Fusarium oxysporum f.sp. lilii (fol). Cendawan ini termasuk cendawan tular tanah dan berpengaruh terhadap produksi umbi serta bunga lili yang terserang (Lim et al. 2003). Usaha untuk mencegah kerusakan akibat patogen ini umumnya dilakukan dengan cara kimia melalui disinfektan pada umbi lili dan media tanam. Namun, cara ini kurang efektif dan kurang ramah lingkungan karena dapat menyebabkan polusi , kerusakan lingkungan dan peningkatan biaya produksi (Straathof 1994).
Peluang usaha florikultura yang cukup bagus, terutama tanaman lili di Indonesia menjadi alasan perlunya usaha untuk mengatasi hambatan dalam pembudidayaannya. Upaya yang dapat dilakukan antara lain perbaikan teknologi perbanyakan lili dan penggunaan varietas lili yang tahan terhadap penyakit. Pendekatan yang dilakukan yaitu melalui teknik kultur jaringan dan pemuliaan mutasi.
paling produktif diantara eksplan lain yang digunakan (Kumar et al. 2008). Namun hasil - hasil penelitian tersebut belum sepenuhnya mencapai produk yang maksimal, sehingga masih perlu dilakukan pengembangan metode yang efektif.
Keragaman tanaman lili umumnya diperoleh melalui hibridisasi interspesifik. Metode ini memerlukan waktu yang cukup lama, dari awal persilangan hingga seleksi. Kelemahan lain metode ini yaitu adanya hambatan sebelum dan sesudah fertilisasi (Lim et al.2003). Pendekatan yang telah dilakukan untuk mengatasi hambatan sebelum fertilisasi antara lain metode pemotongan putik (cut style technique), grafted style methode, perlakuan zat pengatur tumbuh, dan polinasi secara in vitro. Hambatan setelah fertilisasi dilakukan dengan embrio rescue, kultur embrio, kultur ovul dan ovary slice culture ( van Tuyl et al. 2002; Wang et al. 2009). Pengembangan poliploidisasi lili, kultur mikrospora, transformasi gen serta penggunaan colchisin dan oryzalin untuk mendapatkan tanaman lili tetraploid (van Tuyl et al. 1996). Namun demikian pendekatan yang dilakukan tersebut masih terbatas pada jenis lili tertentu. Dengan demikian perlu pendekatan dan pengembangan metode dalam pemuliaan lili, salah satunya melalui pemuliaan mutasi.
Pemuliaan mutasi dilakukan untuk memperbaiki salah satu karakter tanaman dan meningkatkan keragaman genetik tanaman lili, sehingga dapat memberikan manfaat dan hasil yang lebih baik. Pemuliaan mutasi juga memegang peranan penting dalam pengembangan tanaman hias, khususnya menghasilkan mutan dengan warna dan bentuk bunga yang baru serta mendapatkan tanaman tahan terhadap penyakit. Varietas yang telah dilepas melalui mutagenesis hingga tahun 2005 sebanyak 2.335 dan 552 diantaranya tanaman hias (Barakat et al. 2010). Hasil penelitian melalui induksi mutasi pada
tanaman hias antara lain perubahan morfologi dan warna bunga pada
Chrysanthemum morifolium (Lamseejan et al. 2000), (Datta et al. 2005, Barakat et al. 2010), mutan novelty pada petunia (Berenschot et al. 2008), bunga matahari tahan terhadap imidazolinone ( Sala et al. 2008), perubahan warna dan ukuran petal pada anyelir (Aisyah et al. 2009), perubahan morfologi bunga dan mutasi klorofil pada curcuma alismatifolia (Abdullah et al. 2009).
Upaya untuk mendapatkan kultivar tahan dapat diperoleh melalui pemuliaan mutasi dan seleksi in vitro planlet lili dengan menggunakan agen seleksi yang tepat. Agen seleksi untuk ketahanan lili terhadap Fusarium oxysporum f.sp lilii (Fol) adalah fusaric acid (FA). FA merupakan salah satu senyawa toksik yang dihasilkan oleh cendawan Fusarium oxysporum. FA ini memiliki peran dalam patogenesis, ketidak sensitifan tanaman terhadap toksin ini akan meningkatkan ketahanan terhadap patogen. Löffler dan Morris (1992) telah berhasil mengembangkan dan menghasilkan tanaman jagung tahan terhadap Helminthosporium, dan beberapa tanaman tahan Fusarium dengan menggunakan FA sebagai agen seleksi secara in vitro.
1.2Tujuan Penelitian
Mendapatkan tanaman lili yang tahan terhadap Fusarium oxysporum f.sp. lilii (Fol) melalui induksi mutasi secara in vitro.
Tujuan khusus penelitian ini adalah :
1. Mendapatkan teknologi perbanyakan lili secara in vitro melalui induksi kalus lili dari tangkai sari bunga dan regenerasinya.
2. Mendapatkan dosis iradiasi sinar Gamma dan konsentrasi mutagen kimia yang optimum serta putatif mutan.
3. Mendapatkan keragaman morfologi tanaman hasil iradiasi sinar Gamma dan induksi mutagen kimia serta mendapatkan populasi planlet hasil mutasi. 4. Mendapatkan planlet lili tahan fusaric acid hasil seleksi in vitro menggunakan
media seleksi yang mengandung fusaric acid.
5. Mendapatkan kandungan saponin umbi lili hasil induksi mutasi dengan TLC (Thin Layer Chromatography).
1.3Hipotesis
Hipotesis yang diajukan dalam penelitian ini adalah:
1. Teknologi perbanyakan lili secara in vitro melalui induksi kalus dari tangkai sari bunga dan regenerasinya dapat diperoleh pada media dasar MS dengan penambahan zat pengatur tumbuh 2,4-D, TDZ dan NAA.
2. Dosis iradiasi sinar Gamma dan konsentrasi mutagen kimia EMS yang optimum dapat diperoleh untuk menginduksi keragaman genetik lili.
3. Keragaman morfologi dapat diperoleh pada planlet lili hasil induksi mutasi. 4. Mutan lili hasil induksi mutasi dapat diperoleh dengan seleksi in vitro pada
media seleksi yang mengandung fusaric acid.
5. Kandungan saponin lili dapat diperoleh dengan menggunakan TLC scanner.
1.4Kerangka Pemikiran
Pembudidayaan lili di Indonesia masih mengalami kendala diantaranya ketergantungan benih lili dari negara lain serta adanya penyakit utama lili yang disebabkan oleh cendawan Fusarium oxysporum f.sp. lilii. Permasalahan tersebut berpengaruh terhadap tingginya biaya produksi terutama untuk penyediaan benih dan pengendalian penyakit tanaman. Penyakit tanaman akan berdampak terhadap produksi umbi dan kualitas bunga yang dihasilkan. Pengendalian penyakit secara kimia yang umum dilakukan pada tanaman lili juga berdampak buruk terhadap kesehatan dan lingkungan.
Pemuliaan mutasi yang dilakukan diharapkan dapat meningkatkan keragaman genetik lili serta dapat memperbaiki karakter ketahanan terhadap penyakit. Tanaman lili tahan terhadap cendawan Fusarium yang dihasilkan akan dapat menekan biaya produksi terutama untuk fungisida. Tanaman lili yang tahan penyakit juga akan meningkatkan produksi umbi dan kualitas bunga yang dihasilkan. Keragaman genetik lili hasil induksi mutasi dapat dimanfaatkan dalam program pemuliaan untuk menghasilkan lili yang berkualitas, unggul dan sesuai keinginan konsumen dan pasar.
1.5Manfaat
Manfaat dari penelitian ini ialah
1. Memperkaya khasanah ilmu pengetahuan dan teknologi.
2. Mendapatkan materi genetik yang dapat digunakan langsung untuk perakitan varietas unggul.
3. Mendapatkan teknologi perbanyakan lili terutama untuk pengadaan benih. 4. Mendapatkan teknologi mengendalikan Fusarium secara ramah lingkungan. 5. Memperkuat industri lili berbasis sumber daya nasional.
6. Mengurangi impor dan membuka peluang ekspor.
1.6Kebaruan
Penelitian tentang perbanyakan lili telah banyak dilakukan oleh beberapa peneliti secara intensif. Beberapa penelitian yang telah dilakukan sebelumnya yaitu perbanyakan lili secara konvensional dengan umbi, perbanyakan secara in vitro dengan menggunakan berbagai macam eksplan diantaranya jaringan reseptakel bunga (Tan Nhut et al. 2001), sisik umbi (Lian et al. 2002; Han et al. 2004; Chen et al. 2011, anter bunga lili (Tzeng et al. 2009), dan bulblet (Lian et al. 2003; Tan Nhut et al. 2006). Perbanyakan juga dilakukan melalui somatik embriogenesis menggunakan eksplan daun (Lan et al. 2009).
Penelitian - penelitian yang telah dilakukan sebelumnya, belum memanfaatkan tangkai sari bunga sebagai eksplan untuk perbanyakan lili. Pada penelitian ini dilakukan perbanyakan lili secara in vitro menggunakan tangkai sari bunga sebagai eksplan. Penelitian ini dilakukan untuk menambah kajian terutama pemanfaatan bagian- bagian tanaman lili yang memiliki potensi untuk dikembangkan sebagai materi perbanyakan guna mendukung penyediaan benih secara masal dan seragam.
Kebaruan lainnya dalam penelitian ini ialah peningkatan keragaman lili melalui pemuliaan mutasi. Penelitian pemuliaan lili yang umum dilakukan sebelumnya yaitu pemuliaan interspesifik (Lim et al. 2008; Gonzales et al. 2008; Zhou et al. 2008; van Tuyl 2009; Chung et al. 2009 ; van Tuyl dan Arens 2011; van Tuyl 2012), dan ploidisasi (Xie et al. 2010; Khan et al. 2010; Khan et al. 2009). Pemuliaan mutasi dengan sinar Gamma dan EMS ini dilakukan agar dapat memberikan alternatif cara untuk meningkatkan keragaman lili. Klon - klon lili hasil induksi mutasi diharapkan dapat menambah keragaman serta dapat digunakan sebagai tetua persilangan maupun plasma nutfah.
Induksi Keragaman Planlet lili dan Seleksi in vitro
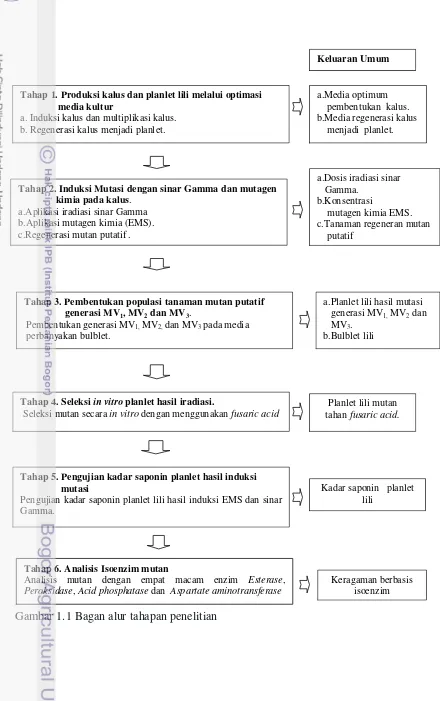
Gambar 1.1 Bagan alur tahapan penelitian
Keluaran Umum
a.Media optimum pembentukan kalus. b.Media regenerasi kalus menjadi planlet.
Tahap 1. Produksi kalusdan planlet lili melalui optimasi media kultur
a. Induksi kalus dan multiplikasi kalus. b. Regenerasi kalus menjadi planlet.
a.Dosis iradiasi sinar
Tahap 2. Induksi Mutasi dengan sinar Gamma dan mutagen kimia pada kalus.
a.Aplikasi iradiasi sinar Gamma b.Aplikasi mutagen kimia (EMS). c.Regenerasi mutan putatif .
Tahap 3. Pembentukan populasi tanaman mutan putatif generasi MV1, MV2 dan MV3.
Pembentukan generasi MV1, MV2, dan MV3 pada media
perbanyakan bulblet.
a.Planlet lili hasil mutasi generasi MV1, MV2 dan
MV3.
b.Bulblet lili
Tahap 4. Seleksi in vitro planlet hasil iradiasi.
Seleksi mutan secara in vitro dengan menggunakan fusaric acid
Planlet lili mutan tahan fusaric acid.
Tahap 5. Pengujian kadar saponin planlet hasil induksi mutasi
Pengujian kadar saponin planlet lili hasil induksi EMS dan sinar Gamma.
Kadar saponin planlet lili
Tahap 6. Analisis Isoenzim mutan
Analisis mutan dengan empat macam enzim Esterase, Peroksidase, Acid phosphatase dan Aspartate aminotransferase
2
TINJAUAN PUSTAKA
Botani dan Morfologi Lili
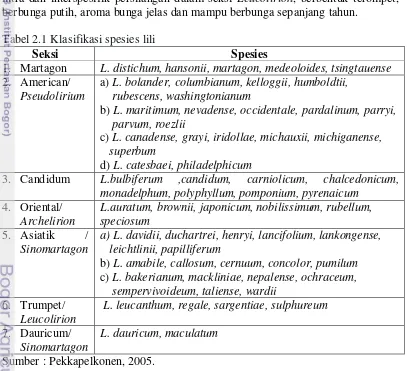
Lili (Lilium L) termasuk dalam kelompok tanaman monokotil, divisi Magnoliophyta, kelas Liliopsida, ordo Liliales, famili Liliaceae, dan genus Lilium. Genus lili terdiri atas 100 spesies. Spesies asli berasal dari Amerika utara, Eropa, dan Asia (Jepang, Korea dan Cina) (Timmermann 2004). Genus lili diklasifikasikan dalam 7 kelompok/seksi (Tabel 2.1) antara lain kelompok Martagon, Sinomartagon, Archelirion, Leucolirion, Pseudolirion, Lilium dan Oxypetalum (Nadeem Khan 2009, Wang et al. 2009). Lili dalam kelompok tersebut mudah disilangkan dan menghasilkan individu fertil, kecuali tiga kelompok yaitu Sinomartagon, Archelirion dan Leucolirion. Namun, Sinomartagon, Archelirion dan Leucolirion merupakan kelompok penting untuk dibudidayakan karena menghasilkan hibrid unggulan dan paling diminati yaitu hibrid Longiflorum, Asiatik dan Oriental. Hibrid Longiflorum merupakan hasil intra dan interspesifik persilangan dalam seksi Leucolirion, berbentuk terompet, berbunga putih, aroma bunga jelas dan mampu berbunga sepanjang tahun.
Tabel 2.1 Klasifikasi spesies lili
Seksi Spesies
1. Martagon L. distichum, hansonii, martagon, medeoloides, tsingtauense 2. American/
Pseudolirium
a) L. bolander, columbianum, kelloggii, humboldtii, rubescens, washingtonianum
b) L. maritimum, nevadense, occidentale, pardalinum, parryi, parvum, roezlii
c) L. canadense, grayi, iridollae, michauxii, michiganense, superbum
d) L. catesbaei, philadelphicum
3. Candidum L.bulbiferum ,candidum, carniolicum, chalcedonicum, monadelphum, polyphyllum, pomponium, pyrenaicum
4. Oriental/ Archelirion
L.auratum, brownii, japonicum, nobilissimum, rubellum, speciosum
5. Asiatik /
Sinomartagon
a) L. davidii, duchartrei, henryi, lancifolium, lankongense, leichtlinii, papilliferum
b) L. amabile, callosum, cernuum, concolor, pumilum c) L. bakerianum, mackliniae, nepalense, ochraceum, sempervivoideum, taliense, wardii
6. Trumpet/ Leucolirion
L. leucanthum, regale, sargentiae, sulphureum 7. Dauricum/
Sinomartagon
L. dauricum, maculatum
Sumber : Pekkapelkonen, 2005.
lambat, bunga berukuran besar dan harum serta tahan Botrytis elliptica (Nadeem Khan 2009). Lili Asiatik dan Oriental, memerlukan cahaya matahari sekitar lima sampai enam jam, namun lili Oriental lebih memerlukan lingkungan teduh.
Organ utama tanaman lili terdiri atas akar, umbi, daun dan bunga (Gambar 2.1) dengan ukuran serta bentuk organ bervariasi. Umbi lili memiliki tipe pertumbuhan simpodial.
Gambar 2.1 Struktur bunga lili dan reproduksinya.
(a) Bagian irisan melintang dan longitudinal polong buah yang mengandung biji. (b) Bagian bunga dan tangkai bunga lili, tunas adventif dan axilair/bulbil (tanda panah), (c). Perkecambahan biji epigeal, (d) Perkecambahan umbi hipogeal lili.
Sumber: Pekkapelkonen (2005).
Spesies lili berdasarkan tipe perkecambahannya dikelompokkan menjadi dua yaitu epigeal dan hipogeal. Biji epigeal berkecambah segera setelah di sebar tanpa melalui dormansi. Biji hipogeal, perkecambahannya dikendalikan oleh dormansi, yang hanya dapat dipatahkan dengan perlakuan dingin. Dormansi sering di induksi ulang setelah bulblet utama terbentuk dan periode dingin yang lain diperlukan untuk perkembangan tanaman selanjutnya (Pekkapelkonen 2005). Nilai Ekonomi Lili
Dalam industri farmasi, saponin yang terkandung dalam umbi lili memiliki potensi untuk dikembangkan dan dimanfaatkan sebagai obat kanker. Di Cina dan beberapa negara Eropa telah memanfaatkan umbi lili sebagai obat. Beberapa jenis lili yang dimanfaatkan dalam industri farmasi antara lain Lilium speciosum var. gloriosoides (Chang et al. 2000), Lilium brownii var.viridulum (Hong et al. 2012), Lilium speciosum x L. nobilissimum ‘Star Gazer” (Nakamura et al. 1994), Lilium longiflorum (Mimaki et al. 1994), candidum (Mimaki et al. 1998), Lilium regale dan L.henryi (Mimaki et al. 1993).
Perbanyakan Lili secara In vitro
Perbanyakan lili umumnya dilakukan secara vegetatif dengan menggunakan umbi. Metode lain yang dilakukan ialah perbanyakan secara in vitro. Beberapa keuntungan yang diperoleh dengan teknik ini antara lain tingkat multiplikasinya lebih banyak, mendapatkan tanaman seragam dan bebas virus (Chang et al. 2000).
Perbanyakan in vitro lili dipengaruhi beberapa faktor diantaranya jenis media, fotoperiode, zat pengatur tumbuh, jenis gula dan jenis eksplan (Rice et al. 2011; Tribulato et al. 1997; Lan et al. 2009; Chang et al. 2000; Tan Nhut et al. 2001). Media yang umum digunakan yaitu media MS yang dikombinasikan dengan beberapa jenis zat pengatur tumbuh. Diantaranya somatik embriogenesis Lilium longiflorum Thunb pada media MS yang mengandung zat pengatur tumbuh dicamba dan picloram (Tribulato et al. 1997) dan lili Drimiopsis kirkii Baker pada media MS yang mengandung kinetin dan 2,4-D (Lan et al. 2009). Perbanyakan lilium speciosum Thunb. var. gloriosoides Baker menggunakan media MS yang dikombinasikan dengan NAA, BA dan 2,4-D (Chang et al. 2000). Modifikasi media ½ MS dengan zat pengatur tumbuh NAA, IBA dan BAP digunakan pada induksi tunas Lilium longiflorum dari jaringan reseptakel (Tan Nhut et al. 2001). Beberapa species lili dengan eksplan biji, sisik umbi, dan daun diregenerasikan pada media MS yang mengandung picloram ( Mori et al. 2005).
Jenis eksplan juga berpengaruh dalam perbanyakan lili secara in vitro. Beberapa jenis eksplan yang digunakan dalam perbanyakan lili diantaranya jaringan reseptakel bunga (Tan Nhut et al. 2001), ovul (Obata et al. 2000), sisik umbi (Han et al. 2004; Chen et al. 2011), anter bunga lili (Tzeng et al. 2009), bulblet (Lian et al. 2003; Tan Nhut et al. 2006), dan umbi (Lian et al. 2002). Perbanyakan melalui somatik embriogenesis juga dilakukan dengan menggunakan eksplan daun (Mori et al. 2005; Lan et al. 2009; Lingfei. 2009).
Perbanyakan lili secara in vitro juga dipengaruhi oleh jenis gula. Kombinasi sukrosa dan manosa memacu pertumbuhan umbi lili (Pekkapelkonen 2005). Sukrosa merupakan gula yang sering digunakan dalam kultur in vitro lili (Tan Nhut et al. 2001; Tribulato et al. 1997; Lan et al. 2009; Chang et al. 2000; Obata et al. 2000). Konsentrasi sukrosa 30 gl-1 diperlukan dalam perbanyakan Lilium longiflorum (Tribulato et al. 1997; Tan Nhut et al. 2001) dan lili Drimiopsis kirkii Baker (Lan et al. 2009). Media yang mengandung sukrosa 50 gl-1 digunakan dalam kultur ovul Lilium nobilissimum dan L.regale (Obata et al. 2000).
kondisi gelap. Kultur in vitro lili pada umumnya memerlukan 16 jam cahaya (Pekkapelkonen 2005).
Pemuliaan Mutasi Lili
Beberapa metode pemuliaan lili yang dilakukan antara lain hibridisasi interspesifik, transformasi genetik melalui particle bombardment, pengembangan metode pemuliaan pada tingkat tetraploid dengan poliploidisasi, hibridisasi somatik serta pemuliaan mutasi. Tujuan pemuliaan lili diantaranya perbaikan sifat/ karakter lili seperti vase life bunga yang lebih lama, bunga dengan kualitas unggul, aroma wangi serta ketahanan terhadap Fusarium oxysporum, pythium dan virus (van Tyul and Holsteijn 1996).
Persilangan interspesifik lili masih memiliki beberapa hambatan diantaranya memerlukan waktu yang cukup lama sekitar 2- 3 tahun dari tebar benih hingga bunga pertama, perbanyakan vegetatif memerlukan waktu sekitar 3-5 tahun. Kelemahan lain ialah adanya hambatan sebelum dan sesudah fertilisasi ( pre and post fertilization barrier). Persilangan antara lili longiflorum x asiatik dan lili oriental x asiatik umumnya steril. Sterilitas ini disebabkan adanya perpasangan kromosom yang tidak teratur selama meiosis (Lim et al. 2000).
Pemuliaan lili untuk sifat ketahanan terhadap penyakit juga masih terbatas. Faktor pembatas tersebut antara lain fase juvenil yang panjang, perbanyakan klonal lambat dan masih kurangnya pengujian screening ketahanan pada fase ini (van Heusden et al. 2002). Pada umumnya screening dilakukan pada fase perkecambahan, namun adanya variasi lingkungan menyebabkan pengujian pada tingkat perkecambahan ini perlu pengujian ulang pada tingkat klonal (Straathof et al. 1994). Hambatan - hambatan dalam pemuliaan lili ini mendorong perlu adanya metode pemuliaan dan seleksi yang tepat untuk menghasilkan lili tahan penyakit dan berkualitas. Salah satu cara yang dapat dilakukan ialah dengan pemuliaan mutasi.
Pemuliaan mutasi dapat dilakukan dengan cara fisik maupun kimia. Induksi keragaman lili dengan mutasi fisik dapat dilakukan dengan iradiasi sinar Gamma, sinar X, Neutron, Proton dan partikel Alfa serta Beta. Induksi mutasi kimia menggunakan mutagen kimia seperti EMS (ethyl methanesulphonate) , dES (diethyl sulphate), EI (ethyleneimine), ENU (ethyl nitroso urethane), ENH (ethyl nitroso urea) dan MNH (methyl nitroso urea) (IAEA 1977).
morfologi bunga dan mutasi klorofil pada curcuma alismatifolia ( Abdullah et al. 2009) serta mutasi pada cabe ( Omar et al. 2008).
Iradiasi pada tanaman hias yang diperbanyak secara vegetatif, umumnya menghasilkan kimera. Pada jaringan kimera, sel mutan terdapat diantara sel normal. Selama pembelahan sel, sel mutan berkompetisi dengan sel normal untuk tetap hidup (diplontic selection). Sel mutan yang tetap hidup akan menjadi tanaman mutan dan bila sel mutan tidak mampu bertahan akan menjadi sel normal kembali. Penelitian Datta et al. (2005) berhasil mengembangkan metode isolasi kimera untuk mendapatkan mutan solid pada tanaman krisan. Metode isolasi tersebut menggunakan dua cara yaitu perlakuan mutagen in vivo dan regenerasi tanaman viabel dari bagian yang mengalami mutasi secara in vitro.
Fusarium oxysporum
Fusarium oxysporum (Schlecht.) merupakan patogen tanaman yang termasuk dalam kelompok cendawan Deuteromycetes. Berdasarkan specifik inang, species Fusarium oxysporum terdiri atas 120 formae speciales. Pada beberapa formae, untuk inang yang berbeda menunjukkan pengaruh yang berbeda (Straathof 1994). Patogen ini menyebabkan kerugian dan kehilangan hasil pada tanaman agronomi dan hortikultura diantaranya pisang, barley, tomat, tembakau, gandum, kentang, gladiol (Remotti 1996), crocus, narcisus, freesia, tulip dan lili (Straathof 1994). Pada tanaman berumbi yang termasuk dalam kelompok famili Amarillydaceae, Iridaceae dan Liliaceae, gejala serangan Fusarium berupa busuk pada umbi, akar, corm dan rhizoma. Infeksi patogen ini dapat mempengaruhi produksi umbi lili (Remotti 1996).
Fusarium merupakan patogen utama pada tanaman lili. Cendawan ini menyebabkan klorosis pada daun, nekrotik pada umbi dan akar lili (Prados Ligero et al. 2008), busuk umbi dan akar (Straathof et al. 1994) dan tanaman kerdil serta kematian tanaman lili (van Heusden et al. 2002).
Fusarium termasuk cendawan yang bersifat laten, pada umbi patogen mudah menyebar disekitar pertanaman meskipun telah dilakukan perlindungan dan pengendalian tanaman. Sifat laten ini yang menyebabkan tanaman menjadi sakit, meskipun ditanam pada tanah yang tidak terinfeksi. Penetrasi cendawan ini terbatas pada parenkim umbi seperti basal umbi dan luka pada mata tunas. Gejala ditandai dengan umbi berwarna kecoklatan pada jaringan yang membusuk (Gambar 2A), daun menguning pada tanaman dan umbi yang terinfeksi (Gambar 2B), ukuran tanaman lebih kecil dibandingkan dengan tanaman sehat, daun menggulung pada bagian yang terinfeksi (Remotti 1996).
Gambar 2.2. Penampilan umbi dan tanaman lili yang terinfeksi cendawan
Fusarium oxysporum. Umbi lili terinfeksi Fusarium (A), Tanaman lili yang terserang Fusarium (B).
Penelitian Lim et al. (2003) menyatakan bahwa beberapa tanaman lili memiliki tingkat ketahanan yang berbeda terhadap cendawan Fusarium oxysporum f.sp.lilii. Berdasarkan tingkat ketahanan terhadap Fusarium oxysporum terdapat tiga kelompok utama yaitu sangat tahan, rentan dan sangat rentan (Tabel 2.2).
Tabel 2.2. Tingkat ketahanan species lili terhadap Fol
No. Seksi Spesies Tingkat ketahanan
1 Sinomartagon L. dauricum Sangat tahan
2. Leucolirion L.regale Sangat tahan
3. Archelirion L.speciosum Rentan
4. Martagon L.hansonii Sangat rentan
5. Longiflorum L.longiflorum Rentan
L.henryi Rentan
Sumber : Lim et al. (2003).
Fusaric acid (FA)
Fusaric acid merupakan salah satu senyawa toksin yang dihasilkan cendawan Fusarium oxysporum. Toksin ini dapat menginduksi gejala phytotoksisitas yang bersifat racun pada tanaman lili dan menyebabkan penyakit busuk umbi pada lili. Fusaric acid mampu menghambat aktivitas PPO (plant polyphenol oxidase), enzim yang terlibat dalam pertahanan tanaman. Pada tanaman yang rentan, terjadi akumulasi FA dalam jaringan dengan jumlah FA lebih banyak dibanding pada tanaman tahan. Hal ini disebabkan FA pada tanaman tahan akan didekomposisi oleh jaringan tanaman lebih cepat. Fusaric acid pada dosis rendah menginduksi peningkatan aktivitas PPO pada tanaman rentan, yang merupakan respon pertahanan (Curir et al. 2000).
FA berperan dalam patogenisitas tanaman dengan menurunkan viabilitas sel tanaman. Toksin FA juga berpengaruh terhadap pertumbuhan sel, aktivitas mitokondria, serta permiabilitas membran. FA juga menghasilkan fusarii non patogenik yang berpotensi sebagai agen biokontrol. FA pada konsentrasi non toksik (dibawah 10-6 M) dapat menginduksi respon pertahanan, menginduksi sintesis phytoalexin, serta dapat berperan sebagai elicitor pada konsentrasi nanomolar (Bouizgarne et al. 2006). FA pada konsentrasi tinggi mengurangi pertumbuhan akar dan umbi. Aktivitas FA juga berperan sebagai enzym inhibitor, inhibitor pada sintesis asam nukleat (Bacon et al. 1996).
Saponin
Saponin merupakan salah satu metabolit sekunder yang dihasilkan beberapa jenis tumbuhan. Tanaman yang termasuk dalam famili Caryophyllaceae diketahui banyak mengandung saponin yang disebut dengan saponaria. Tanaman lain yang memiliki kandungan saponin yaitu bayam, alfalfa, ginseng, kacang- kacangan, bawang merah, bawang putih termasuk juga lili (Fenwick dan Oakenfull 1983).
menurunkan kolesterol darah serta antioksidan. Pada tanaman lili, steroidal saponin merupakan senyawa untuk pertahanan tanaman terhadap cendawan patogen, menghambat pertumbuhan Phytium dan Botrytis cinerea (Munafo dan Gianfagna 2011). Steroidal glycosides Lilium longiflorum berperan dalam proses penyembuhan luka (Esposito et al. 2013) dan glycoalkaloid berperan dalam respon pertahanan tanaman terhadap patogen (Munafo dan Gianfagna 2011).
Saponin terdiri atas sapogenin yaitu bagian yang bebas dari glikosida yang disebut aglycone dan bersifat ampifilik. Sapogenin bersifat lipofilik dan mengikat sakarida (hidrofilik) yang panjangnya dari monosakarida hingga 11 unit monosakarida. Yang paling sering ialah 2-5 unit monosakarida dan berupa D-galaktosa dan D-glukosa. Sapogenin/aglycone dapat berupa triterpenoid atau steroid. Sifat lipofilik sapogenin serta sifat hidrofilik sakarida dan saponin yang bersifat ampifilik menyebabkan saponin dapat membentuk busa dan merusak membran sel karena dapat membentuk ikatan lipida dari membran sel. Kandungan saponin lili dapat diperoleh melalui ekstraksi dengan spektrofotometer (Feng lian et al. 2005), ekstraksi dengan ultrasonik, hidrolisis dan RSM (Response Surface Methodology) (Chun Ling et al. 2009).
3
TEKNOLOGI PERBANYAKAN LILI SECARA IN VITRO
3.1 Produksi kalus lili dan regenerasi planlet lili pada beberapa jenis media
Abstrak
Perbanyakan lili umumnya dilakukan secara vegetatif menggunakan umbi. Kemampuan totipotensi tanaman memungkinkan setiap bagian tanaman dapat dimanfaatkan untuk perbanyakan tanaman, termasuk tangkai sari bunga. Tujuan penelitian ialah mendapatkan media induksi kalus lili menggunakan tangkai sari bunga. Eksplan tangkai sari bunga lili ditanam pada media MS yang mengandung zat pengatur tumbuh thidiazuron (TDZ), dan kinetin (Kin) pada beberapa konsentrasi. Kalus yang terbentuk selanjutnya diregenerasikan menjadi planlet. Hasil penelitian menunjukkan bahwa media M9 (MS + TDZ 0.1 mgl-1 + 2.4-D 0.05 mgl-1 + Kinetin 0.1mgl-1) merupakan media terbaik untuk mendapatkan waktu inisiasi kalus lebih awal dibanding media yang lain. Bobot basah kalus tertinggi diperoleh pada media M11 (MS + TDZ 0.2 mgl-1 + 2.4-D 0.05 mgl-1 + Kinetin 0.3 mgl-1).
Kata Kunci : MS, tangka i sari, TDZ, Kinetin, lili.
Abstract
Lilium is usually propagated vegetatively by using bulbs. Based on the totipotency ability of every parts of plant, it is possible to regenerate them into planlets. The objective of the experiments were to find out micropropagation medium of lily using filament as explant . The filaments were cut into 0.5 cm and then those cut filaments were placed on several in vitro media containing thidiazuron (TDZ) and Kinetin (Kin) to form callus. The callus were subsequently regenerated to be planlet. The results showed that the M9 medium (MS + TDZ 0.1 mgl-1 + 2.4-D 0.05 mgl-1 + Kinetin 0.1 mgl-1) was the best medium for callus initiation. The highest of fresh callus weight was achieved on M11 medium (MS + TDZ 0.2 mgl-1 + 2.4-D 0.05 mgl -1 +Kinetin 0.3 mgl-1).
Keywords : MS, filament, TDZ, Kinetin, lilium.
Pendahuluan
2004; Kumar et al. 2008; Chen et al. 2011), anter bunga lili (Tzeng et al. 2009), dan bulblet (Lian et al. 2003; Tan Nhut et al. 2006). Perbanyakan lili melalui somatik embriogenesis juga dilakukan dengan eksplan daun (Mori et al. 2005; Lan et al. 2009; Lingfei 2009). Somatik embriogenesis pada lilium ledebourii (Baker) Boiss (Bakshaie et al. 2010) dan Drimiopsis kirkii Baker (Lan et al. 2009) berhasil dikembangkan dengan daun sebagai eksplan. Hasil- hasil penelitian tersebut masih terbatas untuk varietas dan jenis lili tertentu. Sehingga perlu pengembangan teknik perbanyakan lili yang efektif untuk mendapatkan hasil maksimal.
Faktor- faktor yang mempengaruhi pembentukan kalus dan regenerasi lili secara in vitro antara lain media, fotoperiode, jenis eksplan, suhu, dan zat pengatur tumbuh (Rice et al. 2001).
Tujuan penelitian ialah mendapatkan media induksi kalus lili menggunakan tangkai sari bunga.
Bahan dan Metode
Penelitian dilakukan di laboratorium kultur jaringan Kebun Percobaan Balai Penelitian Tanaman Hias Cipanas, dari bulan Februari sampai dengan Oktober 2011. Bahan yang digunakan ialah tangkai sari/filamen bunga lili. Bahan sterilisasi yang digunakan yaitu detergen, streptomisin sulfat 20%, benomil 50%, klorok 5% dan alkohol 70%. Alat yang digunakan antara lain Laminer air flow, pH meter, autoclave, magnetic stirer, timbangan digital, botol kultur, pinset, petridish dan selotip.
Penelitian menggunakan rancangan acak lengkap satu faktor, yaitu perlakuan media dasar MS dengan penambahan zat pengatur tumbuh TDZ dan kinetin. Percobaan terdiri atas 12 perlakuan dan tiga ulangan. Tiap perlakuan 10 botol dan satuan pengamatan 10 botol, sehingga terdapat 360 satuan percobaan. Perlakuan media terdiri atas M1= MS tanpa zat pengatur tumbuh, M2 = MS + TDZ 0.1 mg l-1 + 2,4-D 0.05 mg l-1, M3 = MS + TDZ 0.2 mgl-1 + 2,4-D 0.05 mg
Gambar 3.1 merupakan tahapan percobaan pembentukan kalus lili menggunakan tangkai sari bunga sebagai eksplan.
Gambar 3.1 Tahapan percobaan pembentukan kalus lili. Kuncup bunga lili (A),
Daun bunga/mahkota bunga lili (B), Bagian- bagian putik dan benang sari (C), Kepala putik(1), Tangkai putik (2), Benangsari (3), Tangkai
sari (4), Potongan tangkai sari sebagai eksplan (D).
Peubah yang diamati meliputi (1) waktu inisiasi kalus, yaitu saat awal kalus lili terbentuk; pengamatan dilakukan satu minggu setelah tanam. Pengamatan berikutnya dilakukan setiap minggu. (2) bobot basah kalus, diamati dengan menimbang kalus yang terbentuk dengan timbangan digital, penimbangan dilakukan sebelum dan sesudah subkultur kalus. Subkultur dilakukan setiap satu bulan sekali, (3) jumlah umbi, diamati satu minggu setelah tanam, pengamatan selanjutnya dilakukan satu bulan sekali serta (4) jumlah daun yang terbentuk, diamati dengan menghitung jumlah daun yang terbentuk pada eksplan kalus. Jumlah daun diamati satu bulan setelah tanam. Pengamatan selanjutnya dilakukan satu bulan sekali. Analisis data menggunakan program IBM SPSS Statistics 19.
Hasil dan Pembahasan
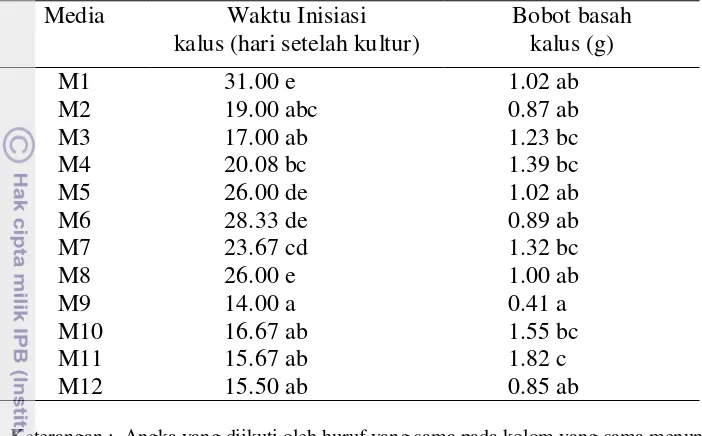
1. Induksi kalus lili dari tangkai sari bunga
Induksi kalus lili dari tangkai sari bunga terbentuk 14- 31 hari setelah kultur (Tabel 3.1). Waktu inisiasi kalus paling cepat diperoleh 14 hari setelah kultur pada media M9, yaitu media MS yang mengandung kinetin 0.1 mgl-1 dan TDZ 0.1 mgl
-1
. Waktu inisiasi kalus ini lebih cepat dibandingkan hasil penelitian Bakhshaie et al. (2010) pada Lilium ledebourii (Baker) Boiss, yaitu 3 bulan setelah kultur.
Penggunaan zat pengatur tumbuh kinetin dan TDZ ini mempercepat terbentuknya kalus, disebabkan peran kedua zat pengatur tumbuh tersebut dalam pembelahan sel dan pembentukan organ. Kinetin juga berperan memacu perbesaran sel, diantaranya pada tanaman lobak, labu dan tanaman dikotil lainnya (Arteca 1995). Sedangkan waktu inisiasi kalus paling lama diperoleh pada media M1 yaitu Media MS tanpa hormon 31 hari setelah tanam.
Keseimbangan antara konsentrasi auksin dan sitokinin yang tepat dapat menginduksi kalus. Zat pengatur tumbuh 2,4-D termasuk dalam kelompok auksin yang umum digunakan untuk menginduksi kalus dalam kondisi tanpa cahaya. Dalam keadaan demikian, auksin tidak mudah terdegradasi sehingga mempercepat waktu inisiasi kalus pada eksplan. Faktor lain yang mempengaruhi inisiasi kalus ialah pelukaan pada eksplan serta adanya zat pengatur tumbuh sitokinin (TDZ dan kinetin). Pada penelitian sebelumnya, kombinasi auksin (2,4-D) dan sitokinin (BA) terbukti efektif menginduksi kalus kalus Lilium speciosum Thunb var. gloriosoides Baker (Chang et al. 2000). Demikian juga kombinasi
D dan NAA mampu menginduksi kalus kotiledon kedelai ( Widoretno et al. 2003).
Tabel 3.1 Rerata waktu inisiasi kalus dan bobot basah kalus
Media Waktu Inisiasi
kalus (hari setelah kultur)
Keterangan : Angka yang diikuti oleh huruf yang sama pada kolom yang sama menunjukkan tidak berbeda nyata pada uji Duncan taraf 5% . M1= MS tanpa zat pengatur tumbuh, M2
Hasil penelitian sebelumnya juga menunjukkan bahwa 2,4-D merupakan auksin terbaik untuk menginduksi pembentukan kalus berbagai jenis lili dibandingkan dengan auksin yang lain (IAA, IBA dan NAA). Zat pengatur tumbuh 2,4-D memiliki sifat yang lebih baik dibandingkan jenis auksin lainnya, karena lebih mudah diserap sel tanaman, tidak mudah terurai dan berfungsi mendorong aktivitas morfogenetik (Shoemaker et al.1991, Widoretno et al. 2003). Zat pengatur tumbuh 2,4-D juga merupakan auksin yang tahan terhadap foto-oksidasi. Perbandingan auksin dan sitokinin menentukan bentuk dan struktur kalus. Kombinasi konsentrasi auksin dan sitokinin yang tepat akan menghasilkan kalus berstruktur remah (friable)(Wattimena 1988). Zat pengatur tumbuh 2,4-D juga berpengaruh terhadap pembentukan somatik embrio secara langsung (Lan et al. 2009).
Gambar 3.2 Pembentukan kalus lili pada beberapa media. Kalus lili pada media M1 (A), Kalus pada media M2 (B), Kalus pada media M3 (C), Kalus pada media M4 (D), Kalus pada media M5 (E), Kalus pada media M6 (F), Kalus pada media M7 (G), Kalus pada media M8 (H), Kalus pada media M9 (I), Kalus pada media M10 (J), Kalus pada media M11 (K), Kalus pada media M12 (L).
2. Regenerasi kalus membentuk umbi dan daun lili
Dalam perkembangannya, kalus membentuk daun dan umbi pada beberapa media yang diujikan 4 bulan setelah kultur. Gambar 3.3 menunjukkan bahwa jumlah umbi yang terbentuk tidak berbeda nyata pada beberapa media. Kalus dapat membentuk ± 1-3 umbi, baik pada media yang mengandung zat pengatur tumbuh maupun media tanpa zat pengatur tumbuh.
Rerata jumlah umbi tertinggi diperoleh pada media M3 yaitu media MS yang mengandung TDZ 0.2 mgl-1. Jumlah umbi terendah diperoleh pada media M2 (MS+ TDZ 0.1 mgl -1) dan M7 (1/2 MS + TDZ 0.3 mgl-1). Hasil ini menunjukkan bahwa pengurangan unsur makro dan mikro pada media MS (M2) menjadi ½ MS (M7) tidak mempengaruhi jumlah umbi yang terbentuk. Di duga, pembentukan umbi lebih dipengaruhi sukrosa atau gula yang digunakan dalam media. Proses pembentukan umbi disebabkan adanya surplus karbohidrat (Arteca 1995). Sukrosa juga dapat memacu pertumbuhan umbi lili, konsentrasi gula yang tinggi menyebabkan ukuran sisik umbi lili japonicum Thunb.meningkat dan menurunkan pembentukan tunas dan daun (Yamagishi 1995).
A B C D
F G
E
I J K L
Gambar 3.3 Jumlah umbi yang terbentuk pada beberapa media 4 bulan setelah
kultur. M1= MS tanpa zat pengatur tumbuh , M2 = MS + TDZ 0.1 mg l-1 +
2,4-Gambar 3.4 Jumlah daun yang terbentuk pada beberapa media 4 bulan setelah
kultur. M1= MS tanpa zat pengatur tumbuh, M2 = MS + TDZ 0.1 mg l-1 + 2,4-D
Media juga tidak berpengaruh terhadap jumlah daun yang terbentuk. Rerata jumlah daun terbanyak diperoleh pada media M2 (MS+ TDZ 0.1 mgl-1). Jumlah daun terendah diperoleh pada media M1 yaitu media tanpa zat pengatur
tumbuh dan M8 (Gambar 3.4). Hal ini disebabkan pada umumnya umbi yang tumbuh diikuti dengan tumbuhnya daun. Oleh karena jumlah umbi tidak berbeda nyata antar perlakuan, maka jumlah daun pun tidak berbeda nyata. Dengan demikian ada kemungkinan jumlah daun yang dihasilkan berkaitan dengan jumlah umbi yang terbentuk.
Gambar 3.5 menunjukkan respon kalus membentuk daun dan umbi pada beberapa media. Terbentuknya daun dan umbi secara langsung pada kalus merupakan awal perkembangan menjadi planlet. Gambar 3.3 dan 3.4 menunjukkan bahwa pada semua media yang diujikan, kalus dapat beregenerasi membentuk daun dan umbi.
Gambar 3.5. Perkembangan kalus membentuk daun dan umbi lili. Daun terbentuk
dari kalus setelah dipindah ke ruang cahaya (A, B dan C). Umbi terbentuk dari kalus diruang tanpa cahaya (D).
Simpulan
1. Kombinasi zat pengatur tumbuh auksin (2,4-D 0.05 mg l-1
) dan sitokinin (TDZ 0.1 mgl-1 dan Kinetin 0.1 mgl-1) dapat mempercepat induksi kalus lili.
2. Produksi kalus dapat diperoleh dengan menggunakan eksplan tangkai sari bunga lili, baik pada media yang mengandung zat pengatur tumbuh maupun yang tidak mengandung zat pengatur tumbuh. Media MS yang mengandung TDZ 0.2 mgl-1 dan Kinetin 0.3 mgl-1 merupakan media terbaik untuk produksi kalus.
3.1 Optimasi media regenerasi kalus lili untuk menghasilkan tunas dan umbi
Regenerasi lili dari kalus merupakan bagian penting dalam perbanyakan lili secara in vitro. Tahapan ini diperlukan untuk menyediakan benih secara masal baik berupa planlet maupun umbi lili. Untuk mendapatkan produksi planlet dan umbi lili yang maksimal diperlukan media yang sesuai. Media yang sesuai diperoleh dengan melakukan optimasi media regenerasi lili.
Abstrak
Regenerasi kalus menjadi planlet dan umbi penting dalam perbanyakan lili secara in vitro. Tujuan penelitian ialah mendapatkan media regenerasi lili yang terbaik secara in vitro.Bahan yang digunakan ialah kalus lili yang berasal dari tangkai sari bunga. Optimasi media dilakukan dengan menggunakan beberapa media yang mengandung sukrosa dan NAA. Hasil menunjukkan bahwa media B1 (MS+ sukrosa 10 gl-1) merupakan media terbaik untuk pembentukan umbi secara langsung dari kalus lili. Media perakaran planlet lili terbaik diperoleh pada media yang mengandung NAA 2 mgl -1. Media MS yang mengandung zat pengatur tumbuh NAA ataupun MS tanpa zat pengatur tumbuh NAA tidak berbeda nyata dalam menghasilkan tunas lili.
Kata kunci : NAA, perbanyakan in vitro, lili.
Abstract
Callus regeneration into plantlet and bulbs is an important process in in vitro propagation of lilium. The objective of this study was to find out the best medium for regeneration of lilium from callus. Callus from filaments were used as materials. Various media containing sucrose and NAA were used in this study. Media B1 (MS+ sucrose 10 gl -1 ) was the best medium for bulbs formation of lilium. The best rooting media was achieved on M6 (MS+ NAA 2 mgl-1 ). Both media with and without plant growth regulator were not significantly different for shoots formation.
Keywords : NAA, in vitro propagation, lilium.
Pendahuluan
Lilium longiflorum (Tan Nhut et al. 2001). Konsentrasi sukrosa yang rendah digunakan untuk regenerasi kalus membentuk tunas dan daun (Yamagishi 1995).
Faktor-faktor yang mempengaruhi regenerasi kalus lili menjadi planlet diantaranya jenis eksplan, genotipe (Mori et al. 2005), zat pengatur tumbuh dan faktor fisik seperti intensitas cahaya serta temperatur (Pekkapelkonen 2005; Lan et al. 2009). Jenis eksplan sisik umbi dan umbi merupakan sumber eksplan yang potensial dan menguntungkan untuk produksi dan pembentukan bulblet, meskipun resiko kontaminasinya tinggi (Tan Nhut et al. 2001). Eksplan daun mempunyai kemampuan regenerasi lebih rendah dibanding umbi (Pekkapelkonen 2005). Zat pengatur tumbuh berperan penting dalam diferensiasi dan pertumbuhan kalus lili. Interaksi antara auksin (NAA) dan sitokinin (kinetin) berperan dalam pembentukan bulblet dan akar. Beberapa zat pengatur tumbuh yang mempengaruhi regenerasi kalus antara lain BA, kinetin, zeatin, IAA dan 2,4-D. Perbanyakan lili secara in vitro dilakukan dalam kondisi gelap maupun adanya cahaya, tergantung tujuan kultur. Regenerasi kalus menjadi tunas dipacu oleh adanya cahaya, sedangkan kultur kalus untuk perbanyakan umbi memerlukan kondisi gelap. Kebutuhan cahaya dalam kultur in vitro lili kurang lebih 16 jam sehari (Pekkapelkonen 2005).
Tujuan penelitian ialah mendapatkan media regenerasi lili terbaik yang diinduksi dari kalus.
Bahan dan Metode
Penelitian ini dilaksanakan di laboratorium kultur jaringan Kebun Percobaan Balai Penelitian Tanaman Hias Cipanas, dari bulan Januari sampai dengan Oktober 2012. Bahan yang digunakan ialah kalus lili yang diinduksi dari tangkai sari bunga. Alat yang digunakan antara lain laminer air flow, pH meter, autoclave, botol kultur, timbangan, magnetic stirer, pinset dan petridish. Media yang digunakan ialah media MS yang mengandung beberapa konsentrasi sukrosa dan NAA.
Penelitian menggunakan rancangan acak lengkap satu faktor, yaitu perlakuan media dasar MS dengan penambahan zat pengatur tumbuh NAA (naftalene asetat acid) dan sukrosa. Percobaan terdiri atas 7 perlakuan dan tiga ulangan. Tiap perlakuan terdiri dari 5 botol kultur dan satuan pengamatan 5 botol, sehingga terdapat 105 satuan percobaan. Bahan yang digunakan ialah kalus yang diinduksi dari tangkai sari bunga lili. Perlakuan terdiri atas 7 macam media, yaitu B1= MS (Murashige Skoog) + 10 gl-1 sukrosa, B2= MS+ 20 gl-1 sukrosa, B3= MS+ 30 gl-1 sukrosa, B4= MS+ 40 gl-1 sukrosa, B5= MS+ 1 mgl-1 NAA+ 30 gl-1 sukrosa, B6= MS+ 2 mgl-1 NAA+ 30 gl-1 sukrosa dan B7= MS+ 3 mgl-1 NAA+ 30 gl-1 sukrosa.
menghitung banyaknya akar yang terbentuk. Data dianalisis menggunakan program IBM SPSS Statistics 19.
Hasil dan Pembahasan
Regenerasi kalus merupakan bagian penting dalam perbanyakan lili secara in vitro. Kalus berkembang membentuk tunas, daun, akar dan umbi. Salah satu faktor yang berperan penting dalam regenerasi kalus ialah zat pengatur tumbuh. Jenis dan konsentrasi zat pengatur tumbuh berperan dalam morfogenesis tanaman. Pada tanaman lili, interaksi auksin (NAA) dan sitokinin (kinetin) berperan dalam pembentukan umbi dan akar (Takayama dan Misawa 1979). Sejalan dengan hasil penelitian tersebut, pada Tabel 3.2 menunjukkan bahwa zat pengatur tumbuh NAA dapat mendorong pembentukan akar lili. Media B6 yaitu MS yang mengandung NAA 2 mgl-1 merupakan media yang menghasilkan jumlah akar terbanyak. Penelitian Tan Nhut et al. (2001) menyatakan bahwa NAA dan IBA efisien dalam menginduksi perakaran lili longiflorum dari kuncup bunga.
Jumlah akar pada media B6 dan B7 tidak berbeda nyata (Tabel 3.2), hal ini menunjukkan bahwa konsentrasi NAA 2 mgl -1 dengan 3 mgl -1 memberikan respon yang sama terhadap pembentukan akar. Namun, kedua media tersebut berbeda nyata dengan perlakuan B1, B2, B3, B4 dan B5. Pembentukan akar lebih dipengaruhi oleh NAA. Zat pengatur tumbuh NAA termasuk dalam kelompok auksin yang berperan dalam pembesaran sel, pembentukan dan pertumbuhan akar (Wattimena 1988). Hasil ini sejalan dengan penelitian Ming Chen et al. (2002) bahwa NAA merupakan auksin sintetik yang dapat mendorong pembentukan perakaran pada kedelai (Glycine max). Di samping itu NAA juga berfungsi menentukan regenerasi tunas bunga pada tembakau ( Smulders et al. 1990). NAA meningkatkan hasil biji per tanaman pada 20 ppm. NAA juga mampu menurunkan fatty acid pada kapas (Zakaria et al. 1989).
Tabel 3.2 Rerata jumlah tunas, panjang tunas, jumlah daun dan jumlah akar lili pada beberapa media 2 minggu setelah kultur.
Media Jumlah tunas Panjang tunas (cm) Jumlah daun Jumlah akar
B1 2.00 a 2.31 a 2.00 a 2.81 a
Keterangan : Angka yang diikuti oleh huruf yang sama pada lajur yang sama menunjukkan tidak berbeda nyata pada uji Duncan taraf 5%. B1= MS + 10 gl-1 sukrosa, B2= MS+ 20 gl-1 sukrosa, B3= MS+ 30 gl-1 sukrosa, B4= MS+ 40 gl-1 sukrosa, B5= MS+ 1 mgl-1 NAA+ 30 gl-1 sukrosa, B6= MS+ 2 mgl-1 NAA+ 30 gl-1 sukrosa, B7= MS+ 3 mgl-1 NAA+ 30 gl-1 sukrosa.
dipengaruhi zat pengatur tumbuh sitokinin dan tidak dipengaruhi oleh NAA (Arteca 1995).
Tabel 3.3 Rerata jumlah umbi dan diameter umbi lili pada beberapa media 2 minggu setelah kultur.
Media Jumlah umbi Diameter umbi (cm)
B1 4.25 a 0.80 a
B2 1.72 b 0.57 ab
B3 2.08 b 0.66 ab
B4 2.30 b 0.65 ab
B5 1.92 b 0.27 b
B6 1.94 b 0.67 ab
B7 2.33 b 0.42 ab
Keterangan : Angka yang diikuti oleh huruf yang sama pada lajur yang sama menunjukkan tidak berbeda nyata pada uji Duncan taraf 5%. B1= MS + 10 gl-1 sukrosa, B2= MS+ 20 gl-1 sukrosa, B3= MS+ 30 gl-1 sukrosa, B4= MS+ 40 gl-1 sukrosa, B5= MS+ 1 mgl-1 NAA+ 30 gl-1 sukrosa, B6= MS+ 2 mgl-1 NAA+ 30 gl-1 sukrosa, B7= MS+ 3 mgl-1 NAA+ 30 gl-1 sukrosa.
Regenerasi kalus lili pada beberapa media menunjukkan bahwa umbi lili dapat terbentuk secara langsung pada semua media yang diujikan. Kalus dapat berkembang langsung membentuk umbi 2 bulan setelah kultur (Tabel 3.3). Media MS yang mengandung sukrosa 10 gl-1 menghasilkan jumlah dan diameter umbi tertinggi.
Faktor yang mempengaruhi pembentukan umbi antara lain konsentrasi metabolit hasil fotosintesa, khususnya rasio karbohidrat dan nitrogen (Arteca 1995). Kombinasi sukrosa dan manosa juga dapat memacu pertumbuhan umbi (Yamagishi 1995). Kondisi lingkungan yang tidak mendukung seperti suhu tinggi, intensitas cahaya rendah, serta asimilat yang digunakan untuk pertumbuhan tunas dan akar dalam jumlah banyak menjadi penghambat dalam pembentukan umbi (Arteca 1995).
Gambar 3.6 merupakan perkembangan kalus pada media regenerasi, 4 bulan setelah kultur. Kalus mulai berkembang membentuk daun (Gambar 3.6A - D) dan umbi (3.6 E). Planlet secara sempurna terbentuk 8 bulan setelah kultur.
Gambar 3.6 Perkembangan kalus lili pada media regenerasi (4 bulan setelah
kultur). MediaB1= MS + 10 gl-1 sukrosa (A), Media B2= MS+ 20 gl-1 sukrosa (B), Media B3= MS+ 30 gl-1 sukrosa (C), Media B6= MS+ 2 mgl-1 NAA+ 30 gl-1 sukrosa (D) dan Media B7= MS+ 3 mgl-1
NAA+ 30 gl-1 sukrosa (E).
Gambar 3.7. Respon kalus lili dan regenerasinya pada beberapa media (8 bulan setelah kultur). Planlet pada media B1= MS + 10 gl-1 sukrosa (A), media B2= MS+ 20 gl-1 sukrosa (B), media B3= MS+ 30 gl-1 sukrosa(C), media B4= MS+ 40gl-1 sukrosa (D), media B5= MS+ 1 mgl-1 NAA+ 30 gl-1 sukrosa (E), media B6= MS+ 2 mgl-1 NAA+ 30 gl-1 sukrosa (F), media B7= MS+ 3 mgl-1 NAA+ 30 gl-1 sukrosa (G).
Gambar 3.7 menunjukkan respon pertumbuhan kalus lili pada beberapa media regenerasi, 8 bulan setelah kultur. Media yang mengandung NAA 2 mgl-1 dan 3 mgl-1 mendorong pembentukan akar, sedangkan media yang mengandung sukrosa tanpa NAA lebih memacu pembentukan umbi.
Simpulan
1. Media B1 yaitu media MS yang mengandung sukrosa 10 gl-1 merupakan media terbaik untuk pembentukan umbi lili secara langsung dari kalus.
2. Media B6 yaitu media MS yang mengandung NAA 2 mgl -1 merupakan media terbaik untuk induksi perakaran lili dari kalus.
A B C D
3.2 Pembesaran umbi pada beberapa media serta aklimatisasi lili
Tanaman lili dikembangkan untuk produksi bunga dan umbi. Untuk memaksimalkan produksi umbi lili secara in vitro diperlukan media yang sesuai. Perbesaran umbi pada media dengan beberapa konsentrasi gula merupakan bagian teknologi perbanyakan lili secara in vitro.
Abstrak
Umbi merupakan eksplan yang sering digunakan untuk perbanyakan vegetatif tanaman lili. Produksi umbi lili secara optimal dapat diperoleh pada media pengumbian yang sesuai. Tujuan penelitian ialah mendapatkan konsentrasi gula yang sesuai untuk produksi umbi terbaik serta kondisi kultur yang sesuai. Bahan yang digunakan yaitu kalus lili yang diinduksi dari tangkai sari bunga. Konsentrasi gula yang digunakan antara lain 0, 15, 30, 45, 60 dan 75 gl-1. Kondisi kultur dengan cahaya dan tanpa cahaya digunakan dalam menginduksi pengumbian lili dari kalus. Media MS dengan konsentrasi gula 45 gl -1 merupakan media terbaik untuk pengumbian lili dari kalus. Kondisi kultur tanpa cahaya menunjukkan kondisi kultur terbaik untuk pengumbian lili.
Kata kunci : umbi lili, gula, kalus, cahaya.
Abstract
Bulbs is usually for vegetatively propagation on lilium. This explants is more favorable than other explants in lilium. Bulbs were obtained on favorable media. The objectives of this study were to find out the best concentration of sugar and the best culture condition for bulbs formation in lilium. Callus from filaments were used as material. The sugar concentrations were 0, 15, 30, 45, 60 and 75 gl-1. The best concentration of sugar was 45 gl-1 and culture without light was the best culture condition for bulbs formation.
Keywords : lilium bulbs, sugar, callus, light. Pendahuluan
Perbanyakan lili umumnya menggunakan umbi. Umbi merupakan eksplan yang potensial dan menguntungkan untuk perbanyakan dibandingkan jenis eksplan lili yang lain seperti daun, akar, biji maupun anther (Tan Nhut et al. 2001;