POLISAKARIDA
Porpyridium
cruentum
SERTA AKTIVITAS
ANTIHIPERGLIKEMIK SECARA
IN VIVO
HIMAWAN PRASETIYO
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
Dengan ini saya menyatakan bahwa tesis yang berjudul Produksi Biomassa dan Ekstraseluler Polisakarida Porphyridium cruentum serta Aktivitas Antihiperglikemik secara in vivo adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apapun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, September 2016
Himawan Prasetiyo
HIMAWAN PRASETIYO. Produksi Biomasa dan Ekstraseluler Polisakarida
Porphyridium cruentum serta Aktivitas Antihiperglikemik secara In Vivo.
Dibimbing oleh IRIANI SETYANINGSIH dan DEWI RATIH
AGUNGPRIYONO.
Porphyridium cruentum merupakan mikroalga merah (Rhodophyta) yang dapat menghasilkan ekstraseluler polisakarida (EPs). Polisakarida diproduksi dalam sel kemudian dikeluarkan dan terakumulasi dalam media (ekstraseluler). Beberapa penelitian menunjukkan biomassa dan EPs P. cruentum memiliki aktivitas antihiperglikemik secara in vitro, sehingga perlu dikaji lebih lanjut mengenai aktivitas antihiperglikemik dan mekanismenya menggunakan hewan coba (in vivo).
Tujuan dari penelitian ini yaitu menentukan pertumbuhan dan produksi EPs tertinggi pada kultivasi P. cruentum dengan fotoperiode berbeda, menentukan metode presipitasi dan pengeringan berdasarkan karakteristik EPs, menganalisis pengaruh pemberian biomassa dan EPs dengan dosis yang berbeda pada hewan coba dan menentukan mekanisme antihiperglikemik.
Porphyridium cruentum dikultivasi menggunakan media Guilard pada fotoperiode 24:0, 18:6, 12:12 dan 06:18 jam (gelap:terang). Pertumbuhan diukur berdasarkan nilai densitas optik (OD) dan berat kering biomassa, sedangkan kurva produksi EPs ditentukan berdasarkan berat kering polisakarida hasil presipitasi etanol. Hasil pengamatan menunjukkan nilai OD dan berat kering biomassa tertinggi terdapat pada fotoperiode 24:0 jam dengan nilai masing-masing sebesar 0.876 dan 716.12 mg/L. Produksi EPs tertinggi diperoleh pada fotoperiode 12:12 jam dengan nilai sebesar 1.310 mg/L.
Ekstraseluler polisakarida (EPs) dari media kultivasi P. cruentum
dipresipitasi menggunakan etanol 96% atau KOH 5% dan dikeringkan
menggunakan oven suhu 50 ˚C atau freeze dryer. Karakteristik EPs ditentukan berdasarkan rendemen, viskositas dan kelarutan EPs. Metode presipitasi dan pengeringan memberikan pengaruh yang berbeda nyata (p<0.05) terhadap rendemen dan kelarutan EPs. Presipitasi etanol dan pengeringan oven dapat memperoleh EPs dengan karakteristik rendemen 1.31 g/L, viskositas 32.72 cP dan kelarutan 97.6%.
Pengujian aktivitas antihiperglikemik secara in vivo dilakukan pada tikus
Sprague-Dawley jantan yang diinduksi diabetes menggunakan streptozotocin
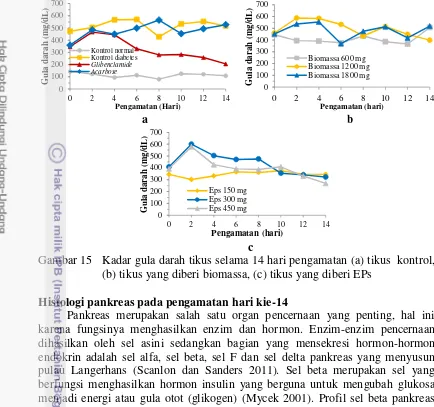
seiring dengan peningkatan dosis biomassa yang diberikan, namun stabil pada tikus yang diberi EPs. Konsumsi pakan tikus diabetes yang diberi biomassa 1800 mg lebih tinggi dibanding 1200 mg dan 600 mg, sedangkan yang diberi EPs 150 mg lebih tinggi dibanding EPs 300 dan 450 mg. Tikus diabetes yang diberi biomassa cenderung tidak mengalami penurunan kadar glukosa, sedangkan yang diberi EPs mengalami penurunan sebesar 26% pada dosis 150 mg, 52% pada dosis 300 mg dan 53.5% pada dosis 450 mg.
Dosis biomassa dan EPs memberikan pengaruh yang berbeda nyata (p<0.05) terhadap luasan pulau Langerhans dan tinggi vili usus, namun tidak memberikan pengaruh yang berbeda nyata (p>0.05) terhadap kadar gula darah, jumlah sel beta, tingkat kecerahan sel beta dan aktivitas enzim SOD. Pemberian biomassa dan EPs P. cruentum pada tikus diabetes dapat memperbaiki fungsi sel beta pankreas yang dilihat berdasarkan peningkatan luasan pulau Langerhans dan jumlah sel beta pankreas. Biomassa 1200 mg/kg bb dan EPs 450 mg/kg bb merupakan dosis terbaik pada aktivitas antihiperglikemik in vivo.
HIMAWAN PRASETIYO
.
Biomass and Extracellular Polysaccharides Production of Porphyridium cruentum and Antihyperglycemic Activity In Vivo. Supervised by IRIANI SETYANINGSIH and DEWI RATIH AGUNGPRIYONO.Porphyridium cruentum, known as red microalgae, able to produce extracellular polysaccharides (EPs). Polysaccharidesare producedinthecell, then be released and accumulated into cultivation medium (extracellular). Some researchs show that biomass and EPs of P. cruentum have antihyperglycemic activity in vitro, furthermore will be studied on antihyperglycemic activity and its mechanism by in vivo.
The purposes of this research were to determine the highest growth and EPs production of P. cruentum on cultivation with different photoperiods, to determine the precipitation and drying methods based on the characteristics of EPs, to analyze the effect of biomass and EPs with different doses in experimental animals and determine its antihyperglycemic mechanism.
Porphyridiumcruentum was cultivated in Guilard medium at 06:18, 12:12, 18:06 and 24:0 h (light:dark) photoperiods. The growth were measured by optical density (OD) and dried weight of biomass, whereas EPs productions are measured by dried weight of polysaccharides which resulted from ethanol precipitations. The results showed that the highest OD and weight of dried biomass were occured on 24:0 h photoperiod, with the value 0.876 and 716.12 mg/L respectively. The highest EPs production was obtained on the 12:12 h photoperiod with the value 1310 mg/L.
Extracellular polysaccharides (EPs) from P. cruentum culture medium are precipitated using 96% ethanol or 5% KOH and then dried using oven at 50 °C or freeze dryer. The characteristics of EPs are determined by yield, viscosity and solubility. Precipitation and drying methods are significantly different (P<0.05) to the yield and solubility of EPs. Ethanol precipitation and oven drying produced EPs with 1.31 g/L yield, 97.6% solubility and 32.72 cP viscosity.
Antihyperglycemic activities by in vivo assessment were performed in male Sprague-Dawley diabetic rats induced with streptozotocin (STZ). The doses of biomass were 600, 1200 and 1800 mg/kg rat body weight (bw) and the doses of EPs were 150, 300 and 450 mg/kg rat bw. The observations are performed for 14 days on rat’s body weight, feed intake, blood glucose and are analyzed descriptively. Blood glucose at 14th day, Langerhans islets areas, number of beta cells, brightness level of beta cells, villi height and superoxide dismutase (SOD) activity at 14th day are analyzed statistically.
beta cells, the brightness level of beta cells and the plasma SOD activity. The induction of biomass and EPs from P. cruentum were able to restore the functions of pancreatic beta cells based on the increasing of Langerhans islets areas and the number of beta cells in diabetic rats. The biomass with 1200 mg/kg bw dose and EPs with 450 mg/kg bw dose were the best doses on antihyperglycemic activity in vivo.
Keywords: antihyperglycemic, biomass, extracellular polysaccharide, in vivo
© Hak Cipta Milik IPB, Tahun 2016
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB.
POLISAKARIDA
Porpyridium
cruentum
SERTA AKTIVITAS
ANTIHIPERGLIKEMIK SECARA
IN VIVO
HIMAWAN PRASETIYO
Tesis
sebagai salah satu syarat untuk mendapatkan gelar Magister Sains
pada
Program Studi Teknologi Hasil Perairan
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
Puji dan syukur penulis panjatkan kehadirat Allah SWT atas rahmat dan karunia-Nya, sehingga penulis dapat menyeleselesaikan tesis yang berjudul Produksi Biomasa dan Ekstraseluler Polisakarida Porpyridium cruentum serta Aktivitas Antihiperglikemik secara In vivo. Tesis ini dibuat sebagai salah satu syarat kelulusan pada Program Pascasarjana Departemen Teknologi Hasil Perairan, Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor. Terima kasih penulis ucapkan kepada:
1 Dr Ir Iriani Setyaningsih, MS dan drh Dewi Ratih Agungpriyono, PhD selaku komisi pembimbing, atas bimbingan, arahan dan masukan sehingga tesis ini dapat diselesaikan dengan baik.
2 Dr Ir Wini Trilaksani, MSc selaku ketua Program Studi Pascasarjana Teknologi Hasil Perairan.
3 Prof Dr Ir Sri Purwaningsih, MSi yang telah bersedia menjadi dosen penguji dalam sidang akhir tesis ini dan Prof Dr Ir Nurjanah, MS selaku perwakilan komisi pendidikan yang bersedia memberikan masukan dalam penulisan tesis ini.
4 Direktorat Jenderal Pendidikan Tinggi (Ditjen Dikti) yang telah memberikan beasiswa studi di Pascasarjana IPB.
5 Direktorat Jenderal Pendidikan Tinggi (Ditjen Dikti), Kementrian Riset Teknologi dan Pendidikan Tinggi (Kemenristekdikti) yang telah membiayai sebagian dari tesis ini melalui Penelitian Institusi 2014-2015
yang berjudul “Pengembangan Produk Biomedis Antidiabetes” kontrak
nomor: 083/SP2H/PL/Dit.Litbamas/11/2015 tanggal 5 Februari 2015. 6 Seluruh staf pengajar, staf administrasi dan laboratorium yang telah
membantu kelancaran jalannya penelitian penulis.
7 Orang tua penulis Bapak Untung Budi Susilo, SPd dan Ibu Siti Rokhatun, adik Adi Hari Purnomo serta seluruh keluarga atas segala doa dan kasih sayang yang diberikan.
8 Teman pasca sarjana THP 2012 atas kebersamaan yang telah dilalui juga kepada teman-teman S1THP, seluruh Crew Bioteknologi Mikroalga, teman-teman pascasarjana IPB alumni UNSOED, Keluarga griya Artayasa dan semua pihak yang membantu kelancaran penelitian penulis.
Penulis menyadari bahwa masih terdapat kekurangan dalam penyusunan tesis ini. Kritik dan saran yang membangun sangat diharapkan oleh penulis. Semoga karya ilmiah ini dapat bermanfaat.
Bogor, September 2016
DAFTAR TABEL
SECARA IN VIVO PADA TIKUS DIABETES
1 Diagram alir penentuan fotoperiode pada kultivasi P.cruentum 9 2 Kurva pertumbuhan biomassa P. cruentum yang dikultivasi selama
40 hari
10
3 Kurva densitas optik P. cruentum yang dikultivasi selama 40 hari 11 4 Kurva produksi ekstraseluler polisakarida (EPs) P. cruentum selama
40 hari kultivasi
12
5 Diagram alir karakteristik biomassa dan ekstraseluler polisakarida 15
6 Kadar abu biomassa P. cruentum 17
7 Kadar garam biomassa P. cruentum 17
8 Rendemen ekstraseluler polisakarida (EPs) P. cruentum 18
9 Viskositas ekstraseluler polisakarida (EPs) P. cruentum 19
10 Kelarutan ekstraseluler polisakarida (EPs) P. cruentum 20
11 Spektra gugus fungsi ekstraseluler polisakarida P. cruentum 21
12 Diagram alir uji aktivitas antihiperglikemik secara invivo 25
13 Grafik berat badan tikus 14 hari pengamatan 29
14 Konsumsi pakan per hari 30
15 Kadar gula darah tikus selama 14 hari pengamatan 31
16 Pengamatan tingkat kecerahan warna sel beta pankreas 34
17 Vili usus tikus 35
DAFTAR TABEL
1 Gugus fungsi ekstraseluler polisakarida 21
2 Pembagian kelompok tikus 26
1 Komposisi medium kultivasi modifikasi Guilard F/2 47
2 Analisis data kadar garam dan kadar abu biomassa 47
3 Analisis data rendemen, viskositas dan kelarutan EPs 48
4 Surat Keputusan Komisi Etik Hewan 51
5 Data pengujian aktivitas antihiperglikemik 52
6 Analisis data kadar gula darah hari ke-14 53
7 Analisis data luasan pulau Langerhans 54
8 Analisis data jumlah sel beta 55
9 Analisis data tingkat kecerahan 56
10 Analisis data tinggi vili usus 57
11 Analisis data aktivitas SOD 58
12 Histologi pankreas pewarnaan imunohistokimia 60
1
PENDAHULUAN
Latar belakang
Porphyridium cruentum merupakan jenis mikroalga merah yang dapat tumbuh dan memproduksi polisakarida pada media air laut yang diperkaya mineral (media Guilard). Pertumbuhan dan produksi senyawa metabolit mikroalga dapat ditingkatkan melalui perlakuan fotoperiode atau durasi pencahayaan pada kultivasi (Bermudes et al. 2004; Sung et al. 2009; Krzeminska et al. 2014).
Porphyridium cruentum mengandung bahan aktif yaitu polisakarida, asam lemak majemuk (PUFA), karotenoid, zeaxanthin dan pigmen protein (fluorescent phycobilin) yang bermanfaat bagi kesehatan (Wang et al. 2007). Manfaat yang telah diteliti diantaranya antikolesterol (Hypocholesterolemic) (Dvir et al. 2009), antihiperglikemik (Setyaningsih et al. 2013), imunomodulation dan antitumor (Sun et al. 2012), antioksidan (Tannin-Spitz et al. 2005) dan merawat kesehatan kulit (Bayona et al. 2012).
Hiperglikemik adalah kondisi kadar gula darah dalam tubuh lebih tinggi dibanding kondisi normal. Kondisisi hiperglikemik yang berlangsung lama menyebabkan menurunnya produksi insulin dan resistensi insulin yang berujung pada penyakit diabetes mellitus (DM) (Touchette 2005). Menurut Harvey (2012) penyebab utama terjadinya hiperglikemik adalah menurunnya fungsi pankreas karena faktor usia, gaya hidup kurang sehat, stres, pola makan kurang seimbang dengan tingginya asupan kalori dan gula. Hiperglikemik dapat ditanggulangi dengan beberapa cara yaitu olahraga, diet atau pengendalian berat badan, namun membutuhkan waktu yang lama. Solusi yang dapat dilakukan adalah dengan terapi obat atau sediaan antihiperglikemik yang bersifat menurunkan gula darah.
Diabetes melitus (DM) merupakan salah satu penyakit degeneratif, yaitu penyakit akibat fungsi atau struktur jaringan atau organ tubuh yang secara progresif menurun karena usia atau pilihan gaya hidup. Penyakit diabetes disebabkan karena konsentrasi glukosa dalam darah secara kronis lebih tinggi dibanding kondisi normal (hiperglikemia), kekurangan insulin atau fungsi insulin yang dihasilkan kurang efektif (Subroto 2006). Penyakit ini sampai sekarang belum dapat disembuhkan dan menjadi berbahaya apabila sudah terjadi komplikasi. Solusi yang dapat dilakukan adalah dengan mengontrol gula darah melalui diet dan pola hidup yang sehat atau menggunakan terapi obat antihiperglikemik.
Mekanisme kerja obat antihiperglikemik di antaranya menstimulasi pankreas untuk mensekresi insulin, menurunkan kadar glukosa endogenus, menurunkan resistensi insulin, menurunkan penyerapan glukosa pada usus
Beberapa mikroalga yaitu Spirulina platensis (Layam dan Redi 2007) dan
Chlorella sp. (Amin et al. 2011) dilaporkan memiliki aktivitas antihiperglikemik serta mekanisme secara in vivo. Setyaningsih et al. (2013) melaporkan biomassa dan ekstraseluler polisakarida P. cruentum yang dikultivasi menggunakan media Becker memiliki aktivitas antihiperglikemik yang diuji secara in vitro. Biomassa dan ekstraseluler polisakarida mampu menghambat aktivitas enzim α-glukosidase dengan persentase hambatan masing-masing 33.82 dan 71.57%.
Produksi biomassa dan ekstraseluler polisakarida pada kultivasi P. cruentum
menggunakan media Guilard dengan fotoperiode berbeda serta karakteristik biomassa dan polisakarida yang dihasilkan belum diketahui. Pengujian aktivitas antihiperglikemik dapat dilakukan secara in vitro (di luar tubuh) dan in vivo
(dalam tubuh). Aktivitas antihiperglikemik in vivo biomassa dan ekstraseluler polisakarida P. cruentum hasil kultivasi menggunakan media Guilard juga belum diketahui. Penelitian mengenai kultivasi P. cruentum dengan fotoperiode berbeda serta karakterisasi biomassa dan ekstraseluler polisakarida yang dihasilkan perlu dilakukan untuk mengetahui karakteristik dan aktivitas antihiperglikemik pada hewan coba (in vivo).
Perumusan masalah
Porphyridium cruentum merupakan mikroalga merah yang dapat tumbuh dan memproduksi ekstraseluler polisakarida (EPs). Pertumbuhan dan produksi EPs dipengaruhi oleh fotoperiode (lama pencahayaan), intensitas pencahayaan, media pertumbuhan, metode kultivasi dan umur panen. Kultivasi P. cruentum
biasanya menggunakan media Becker yang terkendala pada kadar garam NaCl yang tinggi. Biomassa dan EPs P. cruentum diketahui memiliki aktivitas antihiperglikemik, namun belum diketahui mekanismenya. Berdasarkan permasalahan tersebut perlu diteliti lebih lanjut mengenai kultivasi P. cruentum
dalam media lain pada fotoperiode yang berbeda untuk mengetahui karakteristik dan aktivitas antihiperglikemik secara in vivo.
Tujuan Penelitian
Penelitian ini bertujuan untuk: 1) Menentukan pertumbuhan dan produksi ekstraseluler polisakarida terbaik pada kultivasi P. cruentum menggunakan media Guilard dengan fotoperiode yang berbeda. 2) Menentukan metode presipitasi dan pengeringan berdasarkan karakteristik ekstraseluler polisakarida. 3) Menganalisis pengaruh pemberian biomassa dan ekstraseluler polisakarida (EPs) P. cruentum
Hipotesis Penelitian
Hipotesis yang dapat diambil dari penelitian ini:
1 Fotoperiode yang berbeda memberikan pengaruh terhadap pertumbuhan dan produksi ekstraseluler polisakarida P. cruentum
2 Metode presipitasi dan pengeringan memengaruhi karakteristik ekstraseluler polisakarida.
3 Pemberian biomassa dan ekstraseluler polisakarida P. cruentum dengan dosis yang berbeda berpengaruh terhadap kadar gula darah, histologi pankreas dan usus serta aktivitas enzim SOD.
Manfaat Penelitian
1 Mendapatkan waktu pencahayaan terbaik untuk pertumbuhan dan produksi polisakarida pada kultivasi P. cruentum.
2 Mendapatkan metode presipitasi dan pengeringan dengan karakteristik ekstraseluler polisakarida terbaik
3 Memperoleh informasi mengenai kemampuan antihiperglikemik dari
biomassa dan ekstraseluler polisakarida P. cruentum pada tikus diabetes. 4 Memperoleh informasi tentang mekanisme antihiperglikemik dari biomassa
dan ekstraseluler polisakarida P. cruentum
Ruang Lingkup Penelitian
Penelitian ini merupakan penelitian lanjutan dari tahap pengujian in vitro
2
METODE PENELITIAN
Waktu dan Tempat Penelitian
Penelitian dilaksanakan dari Februari 2014 sampai dengan Juli 2015 di Laboratorium Bioteknologi Hasil Perairan II, Laboratorium Mikrobiologi Hasil PerairanTHP, Laboratorium Prolink MSP, Laboratorium Pusat Studi Penelitian BIOFARMAKA, Unit Pengelolaan Hewan Laboratorium (UPHL) FKH, Laboratorium Histopatologi FKH, Institut Pertanian Bogor.
Bahan dan Alat
Bahan yang digunakan dalam penelitian adalah bibit Porphyridium cruentum
medium Guilard F/2 dan bahan untuk kultivasi lainya. Bahan karakterisasi biomassa dan EPs dan bahan uji invivo. Alat yang digunakan adalah peralatan kultivasi, peralatan karakterisasi biomassa dan EPs serta peralatan uji in vivo.
Prosedur Penelitian
Penelitian ini dibagi menjadi tiga tahap yaitu 1) penentuan fotoperiode terbaik pada kultivasi P. cruentum, 2) karakterisasi biomassa dan ekstraseluler polisakarida serta 3) pengujian aktivitas antihiperglikemik secara in vivo.
1) Penentuan Fotoperiode Terbaik pada Kultivasi P. cruentum
Tahap ini dimulai dengan penyegaran bibit P. cruentum, kultivasi pada berbagai fotoperiode serta penentuan kurva pertumbuhan dan produksi ekstraseluler polisakarida. Fotoperiode yang digunakan adalah 06:18, 12:12, 18:06 dan 24:0 jam (terang:gelap). Kurva pertumbuhan ditentukan berdasarkan jumlah berat kering dan densitas optik, sedangkan kurva produksi polisakarida ditentukan berdasarkan berat kering polisakarida hasil presipitasi etanol yang mengacu Setyaningsih et al. (2013). Fotoperiode terpilih digunakan pada kultivasi massal untuk tahap selanjutnya.
2) Karakterisasi Biomassa dan Ekstraseluler Polisakarida
Tahap ini dimulai dengan kultivasi masal P. cruentum dengan fotoperiode terpilih hasil penelitian tahap 1. Biomassa yang diperoleh dicuci sebanyak 1, 2 dan 3 kali secara maserasi menggunakan air demineralisasi selanjutnya dianalisis kadar abu dan kadar garam. Jumlah pencucian biomassa terpilih digunakan pada tahap selanjutnya.
Ekstraseluler polisakarida dipresipitasi menggunakan 2 metode yakni etanol 96% mengacu pada Setyaningsih et al. (2013) dan larutan KOH 5%, kemudian dikeringkan menggunakan oven selama 12 jam suhu 50 oC dan freeze dryer
3) Pengujian Aktivitas Antihiperglikemik secara In vivo
Hewan coba yang digunakan pada tahap ini adalah tikus jantan galur
Sprague-Dawley. Tahap ini dimulai dengan adaptasi tikus pada kondisi laboratorium dan pemberian obat pretreatment (obat cacing, anti protozoa dan antibiotik). Tikus diinduksi diabetes menggunakan streptozotocin (STZ), selanjutnya diberikan biomassa dan EPs pada dosis yang telah ditentukan secara oral. Analisis yang dilakukan meliputi gula darah, berat badan dan konsumsi pakan, histologi usus dan pankreas serta aktivitas enzim SOD.
Analisis Data
Analisis secara deskriptif digunakan pada tahap penentuan fotoperiode pada kultivasi P. cruentum dan pengujian aktivitas antihiperglikemik secara in vivo.
Data yang dianalisis deskriptif meliputi berat biomasa kering, densitas optik, berat polisakarida, berat badan tikus, konsumsi pakan, kadar gula darah dan histologi pankreas. Data dianalisis deskriptif menggunakan grafik microsoftexcel 2007.
Rancangan Acak Lengkap (RAL) digunakan pada tahap karakterisasi biomassa P. cruentum dan pengujian aktivitas antihiperglikemik secara in vivo. Data yang dianalisis meliputi kadar abu dan garam biomassa, gula darah tikus pada hari ke-14, luasan pulau Langerhans, jumlah sel beta pankreas, tingkat kecerahan sel beta, tinggi vili usus dan aktivitas enzin SOD. Data dianalisis menggunakan bantuan program statistical product and service solutions (SPSS) seri 14. Model rancangan mengacu pada Walpole (1992), dengan persamaan sebagai berikut:
Yij = μ + βi + εij
Yij = Nilai pengamatan dari perlakuan ke-i dan ulangan ke-j
μ = Nilai rataan umum populasi
βi = Pengaruh perlakuan ke-i
εij = Galat perlakuan ke-i dan ulangan ke-j.
Apabila hasil analisis sidik ragam (ANOVA) menunjukkan berpengaruh nyata dengan selang kepercayaan 95% (α 0.05), maka dilanjutkan dengan uji
Duncan’s. Rumus uji Duncan’s sebagai berikut:
= ( bs s
Keterangan:
Rp = Nilai kritikal untuk perlakuan yang dibandingkan
p = Perlakuan
dbs = Derajat bebas
K\kts = Jumlah kuadrat tengah
r = Ulangan
faktor pengeringan yaitu oven suhu 50 oC dan freeze dryer, masing-masing taraf diulang sebanyak tiga kali. Data rendemen, kelarutan dan viskositas dinalisis menggunakan program statistical product and service solutions (SPSS) seri 14. Uji lanjut tidak dilakukan karena tidak memenuhi persyaratan yaitu minimal memiliki tiga taraf, sedangkan penelitian ini hanya 2 taraf. Model Rancangan mengacu pada Walpole (1992) sebagai berikut:
Xijk = μ + αi + βj + (αβ ij + εijk
Xijk = Nilai pengamatan dari perlakuan presipitasi ke-i, perlakuan pengeringan ke-j dan ulangan ke-k
μ = Nilai rataan umum populasi
αi = Pengaruh presipitasi ke-i
βj = Pengaruh pegeringan ke-j
(αβ ij = Pengaruh interaksi perlakuan presipitasi ke-i dengan pengeringan ke-j
3
PERTUMBUHAN DAN PRODUKSI EKSTRASELULER
POLISAKARIDA (EPs) DENGAN KONDISI FOTOPERIODE
BERBEDA
Pendahuluan
Porphyridium cruentum merupakan jenis mikroalga merah (Rhodophyta) yang memiliki kemampuan tumbuh dan memproduksi ekstraseluler polisakarida secara bersamaan. Polisakarida disekresikan dalam sel dan secara difusi terakumulasi pada media (ekstraseluler). Mikroalga ini dapat ditumbuhkan dalam media air laut yang diperkaya berbagai mineral. Pertumbuhan dan produksi senyawa metabolitnya dapat dioptimalkan dengan memanipulasi parameter fisik yaitu intensitas pencahayaan (You dan Barnett 2004) dan lama pencahayaan (fotoperiode) (Sung et al. 2009) serta nutrien (de Winter et al. 2013).
Pencahayaan merupakan faktor yang memengaruhi pertumbuhan mikroalga, hal ini dikarenakan pencahayaan memfasilitasi proses asimilasi nutrisi terutama gula (Richmond 2013). Fotoperiode atau siklus terang gelap berperan sebagai agen stressor yang memengaruhi pertumbuhan dan sintesis senyawa sekunder mikroalga (Krzeminska et al. 2014). Waktu pencahayaan yang terlalu pendek berpengaruh terhadap penyerapan nutrien nitrat dan fosfat (Messeck et al. 2005), namun mikroalga membutuhkan kondisi gelap untuk produktivitas selnya. Cahaya dibutuhkan pada fase fotokimia (photochemical) untuk menghasilkan adenosine triphosphate (ATP) dan nicotinamide adenine dinucleotide phosphate-oxidase
(NADPH), sedangkan kondisi gelap dibutuhkan pada fase biokimia (biochemical) untuk sintesis molekul-molekul penting yang berperan dalam proses pertumbuhan (Bouterfas et al. 2006).
Efisiensi pencahayaan dapat memaksimalkan pertumbuhan dan kemampuan mikroalga dalam mengonversi energi cahaya menjadi energi biokimia, yang tersimpan dalam bentuk karbohidrat, protein dan lemak (Richmond 2013). Mikroalga jenis sianobakteri yaitu Nostoc calcicola produksi polisakarida tertinggi pada fotoperiode 24:0 jam (terang:gelap) (Singh dan Das 2011), sedangkan Chroomonas sp. pada fotoperiode 12:12 jam (Bermudez et al. 2004). Sung et al.(2009) melaporkan konsentrasi biomassa P. cruentum serta akumulasi lipid tertinggi terdapat pada fotoperiode 18:06 jam dan 12:12 jam (terang:gelap). Fotoperiode yang tepat untuk pertumbuhan dan produksi polisakarida P. cruentum
belum diketahui, sehingga perlu dilakukan kajian mengenai fotoperiode pada kultivasinya.
Tujuan
1 Menentukan kurva pertumbuhan dan produksi ekstraseluler polisakarida pada
kultivasi P. cruentum pada berbagai kondisi fotoperiode
Metodologi
Waktu dan Tempat
Penelitian dilaksanakan dari Februari 2014 sampai dengan April 2014 di Laboratorium Bioteknologi Hasil Perairan II, Laboratorium Mikrobiologi Hasil Perairan THP, Fakultas Perikanan dan Ilmu Kelautan IPB.
Bahan dan Alat
Bahan yang digunakan adalah Porphyridium cruentum yang diperoleh dari koleksi kultur Pusat Penelitian dan Pengembangan Oseanografi (P3O) LIPI Ancol. Medium modifikasi Guilard F/2 yang terdiri atas NaNO3 (Bratachem), Na2HPO4 (Bratachem), FeCl2 (Bratachem), Na(II)-EDTA (Bratachem), CuSO4 (Bratachem), ZnSO4 (Bratachem), NaMoO4 (Merck), CoCl2 (Merck), MnCl2 (Merck) dan Vitamin B komplek Neurobion 5000 (Merck), masing-masing bahan dilarutkan pada 100mL akuades (Lampiran 1).
Alat yang digunakan dalam penelitian ini adalah tabung kaca volume 3L, lampu TL40 watt (Hannoch), timer (24 Hour Time Switch Intra), spektrofotometer (Spectro UV-VIS 2500), aerator (AP 500), mikroskop cahaya (Olimpus), oven (Yamato DV 41) dan neraca (Sartorius TE214S).
Prosedur Penelitian
Penyegaran bibit Porphyridium cruentum
Penyegaran bibit P. cruentum dilakukan menggunakan media modifikasi F/2 yang komposisinya dapat dilihat pada Lampiran 1. Pembuatan media dilakukan dengan cara menambahkan 1 mL tiap larutan ke dalam tiap liter kultivasi. Perbandingan volume bibit dan media pada penyegaran adalah 1:3 v/v (volume/volume). Kultivasi penyegaran stok mikroalga dilakukan pada tabung erlenmeyer 500 mL dalam keadaan aseptik di suhu ruang dengan penyinaran 2000-3000 lux dan aerasi non stop.
Kultivasi pada fotoperiode berbeda
Penentuan kurva pertumbuhan dan produksi polisakarida
Sampel sebanyak 10 mL dari tiap perlakuan diambil dan diukur OD menggunakan spektrofotometer pada panjang gelombang (λ) 760 nm. Sampel selanjutnya disimpan dan diendapkan pada suhu ± 10 oC untuk memisahkan biomassa basah dan filtrat yang mengandung polisakarida. Biomassa basah yang sudah terpisah kemudian dikeringkan menggunakan oven suhu 50 oC selama 5 jam dan diukur berat keringnya secara gravimetri.
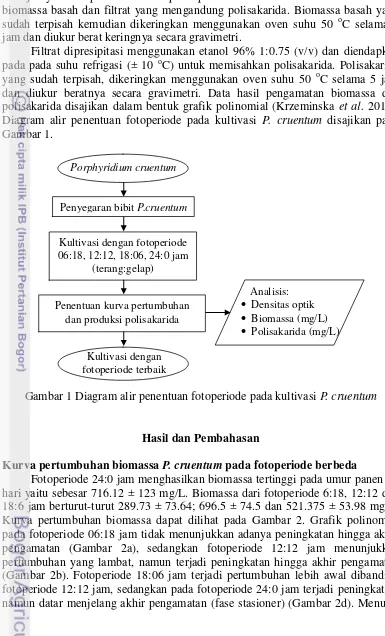
Filtrat dipresipitasi menggunakan etanol 96% 1:0.75 (v/v) dan diendapkan pada pada suhu refrigasi (± 10 oC) untuk memisahkan polisakarida. Polisakarida yang sudah terpisah, dikeringkan menggunakan oven suhu 50 oC selama 5 jam dan diukur beratnya secara gravimetri. Data hasil pengamatan biomassa dan polisakarida disajikan dalam bentuk grafik polinomial (Krzeminska et al. 2014). Diagram alir penentuan fotoperiode pada kultivasi P. cruentum disajikan pada Gambar 1.
Gambar 1 Diagram alir penentuan fotoperiode pada kultivasi P. cruentum
Hasil dan Pembahasan
Kurva pertumbuhan biomassa P. cruentum pada fotoperiode berbeda
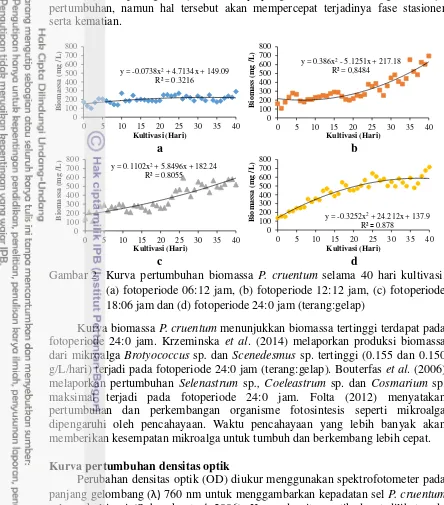
Fotoperiode 24:0 jam menghasilkan biomassa tertinggi pada umur panen 40 hari yaitu sebesar 716.12 ± 123 mg/L. Biomassa dari fotoperiode 6:18, 12:12 dan 18:6 jam berturut-turut 289.73 ± 73.64; 696.5 ± 74.5 dan 521.375 ± 53.98 mg/L. Kurva pertumbuhan biomassa dapat dilihat pada Gambar 2. Grafik polinomial pada fotoperiode 06:18 jam tidak menunjukkan adanya peningkatan hingga akhir pengamatan (Gambar 2a), sedangkan fotoperiode 12:12 jam menunjukkan pertumbuhan yang lambat, namun terjadi peningkatan hingga akhir pengamatan (Gambar 2b). Fotoperiode 18:06 jam terjadi pertumbuhan lebih awal dibanding fotoperiode 12:12 jam, sedangkan pada fotoperiode 24:0 jam terjadi peningkatan, namun datar menjelang akhir pengamatan (fase stasioner) (Gambar 2d). Menurut
Behrens (2005) peningkatan jumlah cahaya yang diterima akan meningkatkan laju pertumbuhan, namun hal tersebut akan mempercepat terjadinya fase stasioner serta kematian.
a b
c d
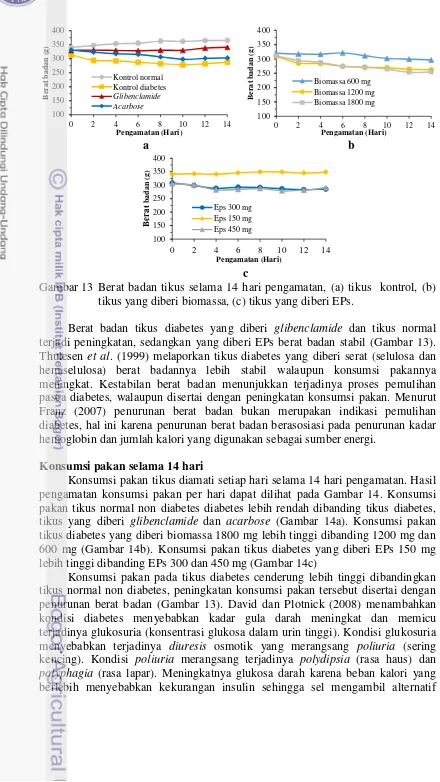
Gambar 2 Kurva pertumbuhan biomassa P. cruentum selama 40 hari kultivasi. (a) fotoperiode 06:12 jam, (b) fotoperiode 12:12 jam, (c) fotoperiode 18:06 jam dan (d) fotoperiode 24:0 jam (terang:gelap)
Kurva biomassa P. cruentum menunjukkan biomassa tertinggi terdapat pada fotoperiode 24:0 jam. Krzeminska et al. (2014) melaporkan produksi biomassa dari mikroalga Brotyococcus sp. dan Scenedesmus sp. tertinggi (0.155 dan 0.150 g/L/hari) terjadi pada fotoperiode 24:0 jam (terang:gelap). Bouterfas et al. (2006) melaporkan pertumbuhan Selenastrum sp., Coeleastrum sp. dan Cosmarium sp. maksimal terjadi pada fotoperiode 24:0 jam. Folta (2012) menyatakan pertumbuhan dan perkembangan organisme fotosintesis seperti mikroalga dipengaruhi oleh pencahayaan. Waktu pencahayaan yang lebih banyak akan memberikan kesempatan mikroalga untuk tumbuh dan berkembang lebih cepat.
Kurva pertumbuhan densitas optik
Perubahan densitas optik (OD) diukur menggunakan spektrofotometer pada panjang gelombang (λ) 760 nm untuk menggambarkan kepadatan sel P. cruentum
selama kultivasi (Sobczuk et al. 2006). Kurva densitas optik dapat dilihat pada Gambar 3. Kurva densitas optik perlakuan fotoperiode 24:0 jam memiliki nilai densitas optik tertinggi yaitu sebesar 0.876, sedangkan fotoperiode 18:6, 12:12 dan 6:18 jam berturut-turut 0.692; 0.619 dan 0.416 (Gambar 3).
Gambar 3 Kurva densitas optik P. cruentum selama 40 hari kultivasi, ( ) fotoperiode 06:18 jam, ( ) fotoperiode 12:12 jam, ( ) fotoperiode 18:06 jam dan ( ) fotoperiode 24:0 jam (terang:gelap).
Fotoperiode 24:0 jam memiliki nilai OD lebih tinggi dibanding fotoperiode lain. Hasil yang sama diperoleh Endrawati et al. (2012) yang melaporkan kultivasi
Spirulina platensis pada fotoperiode 24:0 jam memiliki nilai densitas optik lebih tinggi dibanding fotoperiode lain. Djemai-Zoghlache et al. (2011) melaporkan kepadatan sel Porphyridium purpureum yang dikultivasi dengan fotoperiode 12:12 jam mencapai nilai OD hingga 1 pada umur 40 hari. Nilai densitas optik dipengaruhi oleh laju pertumbuhan dan siklus sel. de Winter et al. (2013) melaporkan lama pencahayaan pada fotoperiode berbanding lurus dengan penyerapan nutrien terutama nitrogen dan siklus sel mikroalga. Fotoperiode 24:0 jam dapat digunakan untuk kultivasi P. cruentum dengan tujuan memperoleh biomassa tertinggi.
Kurva produksi ekstraseluler polisakarida
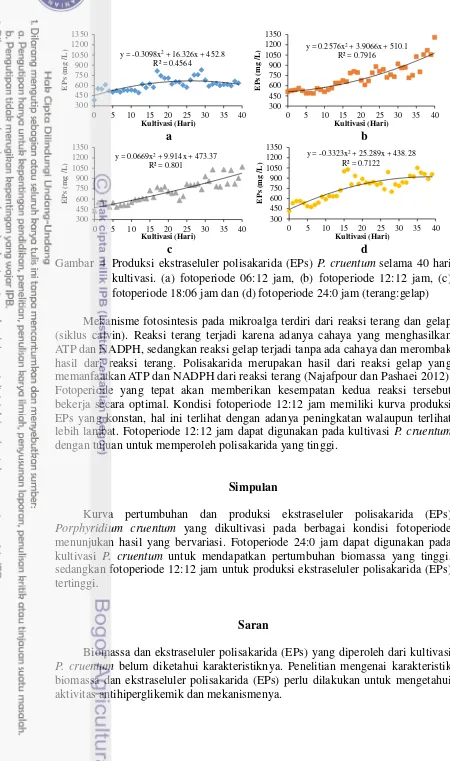
Produksi ekstraseluler polisakarida (EPs) tertinggi terdapat pada fotoperiode 12:12 jam yaitu sebesar 1310 ± 130.26 mg/L pada umur kultivasi 40 hari, sedangkan pada fotoperiode 18:06, 24:0 dan 06:18 jam masing-masing nilainya 1065.5 ± 92.88; 1051 ± 72.93 dan 829.7 ± 282.03 mg/L. Kurva produksi polisakarida dapat dilihat pada Gambar 4. Kurva produksi ekstraseluler polisakarida (EPs) menunjukkan produksi EPs pada fotoperiode 06:18 jam tidak terjadi peningkatan (Gambar 4a), sedangkan pada fotoperiode 12:12 terjadi peningkatan lebih lambat, namun tinggi hingga akhir pengamatan (Gambar 4b). Produksi EPs fotoperiode 18:06 jam (Gambar 4c) dan 24:0 jam (Gambar 4d) terjadi peningkatan, namun tidak setinggi pada fotoperiode 12:12 jam.
Sun et al. (2010) melaporkan produksi EPs P. cruentum pada fotoperiode 24:0 jam sebesar 1108 ± 13.2 mg/L selama 37 hari. Singh dan Das (2011) melaporkan Nostoc calcicola produksi EPs terdapat pada fotoperiode 24:0 jam selama 44 hari sebesar 105 mg/L. Hasil pengamatan menunjukkan P. cruentum
yang dikultivasi 12:12 jam selama 40 hari produksi EPsnya lebih tinggi.
Bermudez et al. (2004) melaporkan Chroomonas sp. menghasilkan
a b
c d
Gambar 4 Produksi ekstraseluler polisakarida (EPs) P. cruentum selama 40 hari kultivasi. (a) fotoperiode 06:12 jam, (b) fotoperiode 12:12 jam, (c) fotoperiode 18:06 jam dan (d) fotoperiode 24:0 jam (terang:gelap)
Mekanisme fotosintesis pada mikroalga terdiri dari reaksi terang dan gelap (siklus calvin). Reaksi terang terjadi karena adanya cahaya yang menghasilkan ATP dan NADPH, sedangkan reaksi gelap terjadi tanpa ada cahaya dan merombak hasil dari reaksi terang. Polisakarida merupakan hasil dari reaksi gelap yang memanfaatkan ATP dan NADPH dari reaksi terang (Najafpour dan Pashaei 2012). Fotoperiode yang tepat akan memberikan kesempatan kedua reaksi tersebut bekerja secara optimal. Kondisi fotoperiode 12:12 jam memiliki kurva produksi EPs yang konstan, hal ini terlihat dengan adanya peningkatan walaupun terlihat lebih lambat. Fotoperiode 12:12 jam dapat digunakan pada kultivasi P. cruentum
dengan tujuan untuk memperoleh polisakarida yang tinggi.
Simpulan
Kurva pertumbuhan dan produksi ekstraseluler polisakarida (EPs)
Porphyridium cruentum yang dikultivasi pada berbagai kondisi fotoperiode menunjukan hasil yang bervariasi. Fotoperiode 24:0 jam dapat digunakan pada kultivasi P. cruentum untuk mendapatkan pertumbuhan biomassa yang tinggi, sedangkan fotoperiode 12:12 jam untuk produksi ekstraseluler polisakarida (EPs) tertinggi.
Saran
Biomassa dan ekstraseluler polisakarida (EPs) yang diperoleh dari kultivasi
4
KARAKTERISASI BIOMASSA DAN EKSTRASELULER
POLISAKARIDA
Porphyridium cruentum
Pendahuluan
Porphyridium cruentum tumbuh pada media kultivasi dengan salinitas 3.5 hingga 4.5%. Salinitas media yang tinggi memengaruhi komposisi kimia biomassa terutama kadar abu dan garam. Setyaningsih et al. (2013) melaporkan kadar abu pada biomassa P. cruentum yang dikultivasi menggunakan media Becker sebesar 38%, sedangkan Fuentes (2000) melaporkan P. cruentum yang dikultivasi dengan medium Hemerick memiliki kadar abu berkisar antara 16.8 hingga 23.6%. Kadar abu P. cruentum yang tergolong tinggi dikhawatirkan dapat menganggu pemanfaatan serta aplikasinya, sehingga perlu dicari cara untuk mengurangi kadar abu dan garam.
Dvir et al. (2009) menyatakan bahwa penggunaan metode pencucian biomassa menggunakan air demineralisasi dapat mengurangi kadar abu dan garam. Beck (2002) menambahkan air demineralisasi merupakan air yang telah mengalami tahap penyulingan dan penghilangan kandungan mineral. Penggunaan air demineralisasi dapat menarik garam atau mineral yang terdapat pada biomassa
P. cruentum. Optimasi pencucian dengan intensitas pengulangan diduga dapat memengaruhi kadar abu dan garam pada biomassa P. cruentum.
Hasil penelitian sebelumnya menunjukkan P. cruentum yang dikultivasi menggunakan fotoperiode 12:12 jam (terang:gelap) menghasilkan produksi ekstraseluler polisakarida tertinggi. Menurut Arad dan Levy-Ontman (2010) polisakarida akan terkonsentrasi pada media (ekstrasel) selama masa kultivasi P. cruentum, sehingga untuk memperoleh polisakarida dari media dibutuhkan metode seperti filtrasi dan presipitasi. Kalium hidroksida (KOH) merupakan senyawa alkali yang dapat digunakan untuk presipitasi sama seperti NaOH. Metode presipitasi menggunakan KOH memiliki keunggulan diantaranya ekonomis serta mudah diaplikasikan pada skala besar. Informasi mengenai penggunaan KOH pada presipitasi EPs belum ada, sehingga perlu dilakukan kajian lebih lanjut mengenai karakteristik EPs yang dihasilkan.
Tujuan
1 Menentukan pengaruh pencucian terhadap kadar garam dan kadar abu
biomassa P. cruentum.
2 Menentukan pengaruh metode presipitasi dan pengeringan yang berbeda terhadap karakteristik ekstraseluler polisakarida P. cruentum.
Metodologi
Waktu dan Tempat
Penelitian dilaksanakan dari Desember 2014 sampai dengan Juni 2015 di Laboratorium Bioteknologi Hasil Perairan II, Laboratorium Mikrobiologi hasil perairan THP IPB, Laboratorium Prolink MSP IPB, Laboratorium Pusat Studi Penelitian BIOFARMAKA dan Balai Penelitian Peternakan (BALITNAK) Ciawi.
Alat dan Bahan
Alat yang digunakan adalah akuarium 60 L, Lampu TL 40 watt (Hannoch), aerator (AP200), timer (24 Hours Switch Intra), sentrifuse (Himac CR21G), lampu UV, oven (Yamato DV 41), spektrofotometer UV-Vis (Hitachi U-2800), neraca (Sartorius TE214S), dan nylon mess (u u n 45 μm), corong pisah, spektrofotometer IR (Bruker) dan viskometer (Toki Sangyo TV-10). Bahan yang digunakan adalah bibit Porphyridium cruentum, medium Guilard (Lampiran 1) etanol 90% (Bratachem) dan KOH (Bratachem).
Prosedur Penelitian
Penelitian karakterisasi biomassa dan ekstraseluler polisakarida P.cruentum
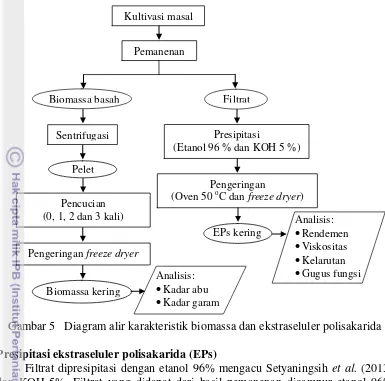
terdiri dari empat tahap. Tahap pertama kultivasi dan pemanenan, tahap kedua pencucian biomassa, tahap ketiga presipitasi ekstraseluler polisakarida dan tahap keempat pengeringan ekstraseluler polisakarida. Diagram alir karakterisasi biomassa dan ekstraseluler polisakarida dapat dilihat pada Gambar 5.
Kultivasi dan pemanenan
Porphyridium cruentum dikultivasi menggunakan 2 akuarium volume 60 L dengan media Guilard (F/2) modifikasi (Lampiran 1). Metode kultivasi dan pemanenan yang digunakan sama dengan yang digunakan pada tahap kultivasi penentuan fotoperiode.
Pencucian biomassa
Gambar 5 Diagram alir karakteristik biomassa dan ekstraseluler polisakarida
Presipitasi ekstraseluler polisakarida (EPs)
Filtrat dipresipitasi dengan etanol 96% mengacu Setyaningsih et al. (2013) dan KOH 5%. Filtrat yang didapat dari hasil pemanenan dicampur etanol 96% dengan perbandingan 1:0.75 v/v, sedangkan KOH 5% dengan perbandingan 1:1.5 v/v. Campuran filtrat tersebut, disimpan semalam dalam suhu 10 oC, sedangkan untuk presipitasi KOH dicuci dengan akuades hingga pH netral. Endapan polisakarida dipisahkan menggunakan corong pemisah kemudian dikeringkan.
Pengeringan ekstraseluler polisakarida (EPs)
Pengeringan dilakukan menggunakan freeze dryer selama 24 jam pada suhu -20 oC dan oven selama 12 jam suhu 50 oC mengacu Ginzberg et al. (2008). Ekstraseluler polisakarida (EPs) kering kemudian ditentukan gugus fungsi
menggunakan spektrofotometer inframerah (fourier transform infrared-
spectrofotometer) dan karakteristik fisik yaitu rendemen, kelarutan dan viskositas.
Prosedur Analisis
Pengukuran kadar abu (BSN 1992)
Cawan porselen dikeringkan menggunakan oven suhu 105 oC selama 1 jam, setelah itu didinginkan 15 menit dalam desikator dan ditimbang. Sampel sebanyak 3 g dimasukkan cawan dan dipanaskan hingga tidak berasap. Sampel dimasukkan
tanur dengan suhu 600 oC selama 6 jam, kemudian diletakan dalam desikator selama 15 menit dan ditimbang. Kadar abu ditentukan menggunakan rumus:
Berat Abu (g) = Berat Cawan Akhir (g) – Berat Cawan Kosong (g)
bu = bu (
m (
Pengukuran kadar garam metode perak nitrat (Apriyantono et al. 1989)
Biomassa P. cruentum kering sebanyak 3 g diekstrak dalam 100 mL akuades panas (100 oC) dibiarkan 15 menit. Sampel disaring menggunakan kertas saring dan diambil cairan hasil ektraksi sebanyak 10 mL dan ditambahkan 3 mL kalium khromat 5% kedalam wadah. Campuran selanjutnya dititrasi AgNO3 0.1 N hingga warnanya menjadi merah bata. Kadar garam dihitung menggunakan persamaan:
Garam (%) = [(mL AgNO3 x N AgNO3 x 58.46) / (gram bahan x 1000) x 100%]
Analisis gugus fungsi menggunakan spektrofotometer FTIR (ASTM 2013)
Sampel uji terlebih dahulu dibentuk pelet dengan campuran KBr. Serbuk KBr sebanyak 200 mg dan 2 mg sampel polisakarida dicampurkan, kemudian ditumbuk sampai halus dan tercampur rata dalam mortar agate. Pengukuran sampel uji dilakukan pada bilangan gelombang antara 400-4000 cm-1. Gugus fungsi ditentukan berdasarkan puncak serapan bilangan gelombang yang terdeteksi pada wilayah serapan gugus fungsi polisakarida.
Pengukuran kelarutan metode TSS (Total Suspended Solid) (APHA 2012)
Sampel ekstraseluler polisakarida 100 mg dilarutkan dalam akuades 40 mL, kemudian diaduk menggunakan magnetic stirrer plus heater dengan suhu 50 oC selama 60 menit. Larutan kemudian disaring pada kertas saring membram selulosa (Whatman 934-AH) serta vacuum air pump kemudian dikeringkan suhu 105 oC selama 60 menit dan dihitung kelarutanya menggunakan rumus:
u n = s m – i s s in
Pengukuran viskositas (modifikasi Geresh et al. 2002)
Polisakarida dilarutkan dalam akuades dengan konsentrasi 0.25% (b/v), kemudian diaduk menggunakan magnetic stirrer plus heater dengan suhu 50 oC selama 30 menit hingga larutan homogen. Viskositas diukur menggunakan viskometer Toki Sangyo TV-10 dengan spindle M2 no 18 pada kecepatan 30 rpm. Nilai viskositas yang terukur dinyatakan dalam satuan cP (Centipoise).
Hasil dan Pembahasan
Kadar abu biomassa
suatu bahan. Hasil pengamatan menunjukkan kadar abu biomassa P. cruentum
tanpa pencucian sebesar 26.34%, sedangkan pencucian 1, 2 dan 3 kali masing-masing sebesar 25.33%, 22.97% dan 24.32%, hasil pengamatan dapat dilihat pada Gambar 6.
Gambar 6 Kadar abu biomassa P. cruentum, huruf yang berbeda menunjukkan berbeda nyata (p<0.05)
Hasil analisis statistik menunjukkan pencucian tidak memberikan pengaruh yang berbeda nyata (p>0.05) terhadap kadar abu biomassa, hasil analisis dapat dilihat pada Lampiran 2. Pencucian menggunakan air demineralisasi belum mampu menurunkan kadar abu biomassa P. cruentum. Kadar abu menunjukan jumlah mineral suatu bahan yang terdiri atas mineral larut air dan tidak larut air (larut asam) (Apriyantono et al. 1989). Menurut Achyadi dan Maulidah (2004) pencucian menggunakan air hanya mengurangi kandungan mineral larut air. Biomassa P. cruentum diduga mengandung mineral tidak larut air lebih tinggi sehingga kadar abu totalnya tetap tinggi. Kadar abu total yang dianjurkan oleh Depkes RI (2012) untuk sediaan jamu atau obat herbal tidak lebih dari 10%.
Biomassa P. cruentum belum dapat dijadikan sebagai sediaan herbal
antihiperglikemik karena nilai kadar abunya lebih tinggi.
Kadar garam biomassa
Prinsip pengukuran kadar garam yaitu dengan reaksi antara ion Ag+ (AgNO3) dan ion Cl- (garam) yang menghasilkan warna merah bata dengan penambahan K2CrO4 (Belcher et al. 1957). Hasil pengamatan menunjukkan kadar
garam biomassa P. cruentum tanpa pencucian sebesar 4.53%, sedangkan
pencucian 1, 2 dan 3 kali masing-masing; 4.05, 4.13 dan 4.15% (Gambar 7).
Hasil analisis statistik menunjukkan pencucian memberikan pengaruh yang berbeda nyata (p<0.05) terhadap kadar garam biomassa (Lampiran 3). Hasil uji lanjut Duncan menunjukkan kadar garam biomassa yang dicuci sebanyak 1 kali berbeda nyata dengan perlakuan tanpa pencucian, namun tidak berbeda nyata dengan pencucian 2 kali dan 3 kali. Berdasarkan hasil tersebut pencucian 1 kali dapat digunakan untuk mengurangi kadar garam pada biomassa P. cruentum
Menurut Achyadi dan Maulidah (2004) berkurangnya kadar garam selama proses pencucian terjadi melalui pengikatan molekul-molekul garam oleh ikatan hidrogen yang terdapat pada air.
Rendemen ekstraseluler polisakarida (EPs)
Rendemen berkaitan dengan jumlah komponen yang dapat dimanfaatkan. Rendemen EPs yang diperoleh dipengaruhi umur panen, efektivitas presipitan dan pengeringan. Hasil penenelitian sebelumnya menunjukkan umur panen 40 hari dengan fotoperiode 12:12 jam (terang:gelap) menghasilkan rendemen EPs lebih tinggi. Hasil pengamatan rendemen polisakarida dapat dilihat pada Gambar 8.
Gambar 8 Rendemen ekstraseluler polisakarida P. cruentum, presipitasi etanol, presipitasi KOH. Huruf berbeda di belakang angka menunjukkan berbeda nyata (p<0.05).
Hasil analisis statistik menunjukkan perlakuan presipitasi, pengeringan serta interaksi antara perlakuan presipitasi dan pengeringan memberikan pengaruh yang berbeda nyata (p<0.05) terhadap rendemen EPs yang dihasilkan (Lampiran 3). Metode presipitasi KOH dan pengeringan menggunakan oven menghasilkan rendemen EPs tertinggi, sehingga tahap karakterisasi selanjutnya ditentukan berdasarkan analisis viskositas dan kelarutan.
Kalium hidroksida (KOH) dapat digunakan pada presipitasi polisakarida. Herliany et al. (2013) dalam penelitianya juga menggunakan KOH 0.5% pada presipitasi karaginan yang menghasilkan rendemen tertinggi yaitu sebesar 45.64%. Menurut Arad dan Levi-Otman (2010) karaginan merupakan polisakarida yang memiliki kesamaan karakteristik dengan polisakarida dari mikroalga. Menurut Uy et al. (2005) menambahkan tingginya rendemen polisakarida presipitasi KOH terjadi karena kemampuan gugus H+ dari alkali yang bereaksi dengan gugus OH- polisakarida dalam membentuk polimer anhydrous galaktosa, sehingga polisakarida yang diperoleh menjadi lebih banyak.
Pengeringan menggunakan oven dapat menghasilkan rendemen lebih tinggi dibanding pengeringan menggunakan freeze dryer. Perbedaan rendemen pada metode pengeringan diduga dipengaruhi kadar air. Goldshall dan Solms (1992) menyatakan pati dapat membentuk komponen inklusi dengan berbagai molekul
seperti hidrokarbon dan air melalui fraksi amilosa yang berperan dalam proses tersebut. Asgar dan Musaddad (2006) menambahkan suhu berperan pada peningkatan elastisitas yang memengaruhi volume jaringan. Peningkatan suhu pada pengeringan diduga mendukung proses inklusi dan elastisitas polisakarida yang menyebabkan tingginya rendemen.
Viskositas ekstraseluler polisakarida (EPs)
Viskositas merupakan ketahanan internal suatu cairan untuk mengalir pada medianya. Pengukuran viskositas polisakarida dilakukan untuk mengetahui tingkat kekentalan polisakarida sebagai larutan setelah mengalami proses pengeringan. Hasil pengamatan viskositas EPs dapat dilihat pada Gambar 9.
Gambar 9 Viskositas ekstraseluler polisakarida (EPs) P. cruentum, presipitasi
etanol, presipitasi KOH. Huruf berbeda di belakang angka
menunjukkan berbeda nyata (p<0.05).
Hasil analisis menunjukkan perlakuan pengeringan dan presiptasi memberikan pengaruh yang berbeda nyata (p<0.05) terhadap viskositas EPs, sedangkan interaksi antara perlakuan presipitasi dan pengeringan tidak berbeda nyata (p>0.05). Hasil analisis dapat dilihat pada Lampiran 3.
Metode presipitasi etanol dan pengeringan menggunakan freeze dryer
menghasilkan viskositas EPs yang lebih tinggi dibanding perlakuan lainnya. Jading et al. (2011) menyatakan bahwa nilai viskositas pati dipengaruhi oleh beberapa faktor yaitu daya serap air, suhu dan pH. Tingginya suhu pada pengeringan menggunakan oven dan perubahan pH pada presipitasi KOH diduga memengaruhi viskositas EPs yang dihasilkan.
Geresh et al. (2002) melaporkan viskositas EPs P. cruentum komersial pada konsentrasi 0.25% berkisar antara 23.5-27.5 cP. Ginzberg et al. (2008) juga melaporkan viskositas EPs P. cruentum konsentrasi 0.5% yang diperoleh dari metode mikrofiltrasi mencapai 1000 cp. Metode presipitasi dan pemanenan yang berbeda diduga berpengaruh terhadap viskositas EPs. Isobe et al. (1992) melaporkan nilai viskositas gum guar pada konsentrasi 0.4% dan gum tamarin konsentrasi 0.9% masing-masing 94.8 dan 100.3 cP.
Nilai viskositas EPs P. cruentum pada konsentrasi 0.25% yaitu sebesar 31.57-45.83 cP. Polisakarida hasil presipitasi dan pengeringan sesuai dengan ketentuan food chemicals codex (FCC) (2001) yaitu bahan pengental dan
stabilizer makanan dan obat-obatan minimal memiliki nilai viskositas 25 cP pada konsentrasi maksimal hingga 2%. Metode presipitasi etanol dan pengeringan menggunakan oven merupakan metode terpilih karena lebih ekonomis dengan nilai viskositas yang telah memenuhi telah kriteria FCC (2001).
Kelarutan ekstraseluler polisakarida (EPs)
Ekstraseluler polisakarida P. cruentum tergolong polisakarida larut air (Geresh 2009). Menurut Yuliasih etal. (2007) kelarutan pati dipengaruhi oleh pH, suhu serta berat molekul pati. Whistler et al. (2012) menambahkan derajat polimerisasi atau kemampuan partikel untuk bergabung juga berpengaruh terhadap kelarutan pati. Hasil pengamatan kelarutan EPs dapat dilihat pada Gambar 10.
Hasil analisis menunjukkan perlakuan presipitasi dan interaksi antara perlakuan presipitasi dan pengeringan memberikan pengaruh yang berbeda nyata (p<0.05) terhadap kelarutan EPs, sedangkan perlakuan pengeringan tidak berbeda nyata. Hasil analisis kelarutan dapat dilihat pada Lampiran 3.
Gambar 10 Kelarutan ekstraseluler polisakarida (EPs) P. cruentum, presipitasi etanol, presipitasi KOH, huruf yang berbeda di belakang angka menunjukkan berbeda nyata (p<0.05).
Perlakuan presipitasi menggunakan etanol memiliki nilai kelarutan yang lebih tinggi dibanding presipitasi KOH (Gambar 10). Mizukami et al. (1999) menyatakan reaksi antara senyawa kompleks polisakarida pati dengan alkohol mengakibatkan terjadinya pemisahan fraksi terlarut (amilosa) dengan fraksi tak larut (amilopektin) yang menyebabkan tingginya kelarutan. Patel et al. (2013) menambahkan presipitasi ekstraseluler polisakarida menggunakan etanol memengaruhi karakteristik kelarutan dengan merubah sifat polaritas polisakarida yang dihasilkan. Sifat polaritas menyebabkan kelarutan yang tinggi pada pelarut polar seperti air. Metode presipitasi etanol dan pengeringan menggunakan oven merupakan metode terpilih untuk mendapatkan polisakarida yang digunakan untuk tahap selanjutnya.
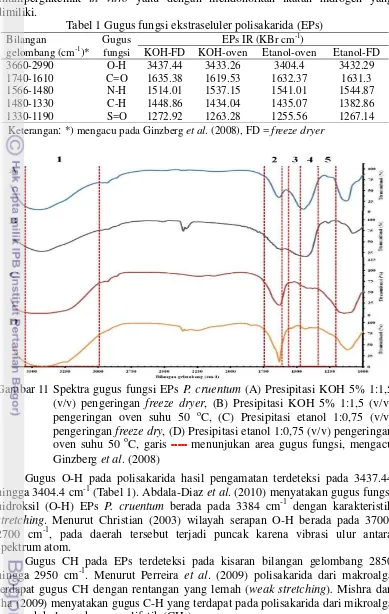
Gugus fungsi ekstraseluler polisakarida (EPs)
Wilayah serapan gugus fungsi EPs terdeteksi pada bilangan gelombang 3660-2990; 1740-1610; 1566-1480; 1480-1330 dan 1330-1190 cm-1 (Tabel 1). Menurut Ginzberg et al. (2008) area tersebut termasuk pada golongan gugus fungsi O-H (hidroksil), C=O (karboksil), C-C (alkena), N-H (amina) dan S=O (sulfat ester) (Tabel 1). Menurut Wu et al. (2012) gugus fungsi O-H, C=O, S dan O memiliki peran penting pada aktivitas antioksidan polisakarida Cordyceps militaris melalui mekanisme pengikatan radikal bebas Fe2+. Hasil tersebut didukung oleh Tannin-Spitz et al. (2005) yang melaporkan EPs P. cruentum
memiliki aktivitas antioksidan yang melindungi sel dari radikal oksigen reaktif. Saqib dan Siddiqi (2008) menambahkan gugus karboksil yang dimiliki acarbose
antihiperglikemik in vitro yaitu dengan mendonorkan ikatan hidrogen yang dimiliki.
Tabel 1 Gugus fungsi ekstraseluler polisakarida (EPs)
Bilangan
gelombang (cm-1)*
Gugus fungsi
EPs IR (KBr cm-1)
KOH-FD KOH-oven Etanol-oven Etanol-FD
3660-2990 O-H 3437.44 3433.26 3404.4 3432.29
1740-1610 C=O 1635.38 1619.53 1632.37 1631.3
1566-1480 N-H 1514.01 1537.15 1541.01 1544.87 1480-1330 C-H 1448.86 1434.04 1435.07 1382.86 1330-1190 S=O 1272.92 1263.28 1255.56 1267.14
Keterangan: *) mengacu pada Ginzberg et al. (2008), FD = freezedryer
Gambar 11 Spektra gugus fungsi EPs P. cruentum (A) Presipitasi KOH 5% 1:1,5 (v/v) pengeringan freeze dryer, (B) Presipitasi KOH 5% 1:1,5 (v/v) pengeringan oven suhu 50 oC, (C) Presipitasi etanol 1:0,75 (v/v) pengeringan freeze dry, (D) Presipitasi etanol 1:0,75 (v/v) pengeringan oven suhu 50 oC, garis ---menunjukan area gugus fungsi, mengacu Ginzberget al. (2008)
Gugus O-H pada polisakarida hasil pengamatan terdeteksi pada 3437.44 hingga 3404.4 cm-1 (Tabel 1). Abdala-Diaz et al. (2010) menyatakan gugus fungsi hidroksil (O-H) EPs P. cruentum berada pada 3384 cm-1 dengan karakteristik
stretching. Menurut Christian (2003) wilayah serapan O-H berada pada 3700-2700 cm-1, pada daerah tersebut terjadi puncak karena vibrasi ulur antara spektrum atom.
Gugus CH pada EPs terdeteksi pada kisaran bilangan gelombang 2850 hingga 2950 cm-1. Menurut Perreira et al. (2009) polisakarida dari makroalga terdapat gugus CH dengan rentangan yang lemah (weak stretching). Mishra dan Jha (2009) menyatakan gugus C-H yang terdapat pada polisakarida dari mikroalga termasuk kelompok gugus alifatik (CH2).
pada 2 bilangan gelombang yang pertama pada 1642 cm-1 dan yang kedua pada 1013-1053 cm-1. Zhang et al. (2010) menambahkan adanya gugus C=O yang kedua dengan vibrasi bending mengindikasikan adanya ikatan C-O-S dengan posisi axial.
Gugus fungsi N-H (amina) terdeteksi pada 1514-1544 cm-1 (Tabel 1) dengan karakteristik vibrasi bending (Gambar 11). Menurut Mishra dan Jha (2009) adanya gugus amina, menandakan adanya ikatan alkil halida atau ikatan N=C=O yang ditandai dengan adanya gugus C=O. Bramhachari dan Dubey (2006) menambahkan adanya gugus alifatik CH, alkil halida dan gugus C-O-C atau C-O
pada panjang gelombang 1000-1200 cm-1 merupakan penanda senyawa
karbohidrat atau turunannya.
Gugus sulfida (S) berada pada bentuk sulfat eter (S=O) yang terdeteksi pada 1263.28-1272.92 cm-1 (Tabel 1) dengan karakteristik bending dan intensitas lemah (Gambar 11). Menurut Zhang et al. (2010) intensitas puncak yang lemah disebabkan karena adanya kandungan 3,6-anhidrogalactose. Gugus sulfat S=O dan C-O dengan vibrasi bending pada posisi axial C-O-S merupakan penanda monosakarida dari golongan uronicacid atau glucuronic acid.
Simpulan
Pencucian biomassa menggunakan air demineralisasi memengaruhi kadar garam, namun tidak memengaruhi kadar abu biomassa P. cruentum. Pencucian sekali dapat digunakan untuk menurunkan kadar garam biomassa P. cruentum. Metode presipitasi dan pengeringan memengaruhi rendemen dan kelarutan EPs, namun tidak memengaruhi viskositas. Presipitasi etanol dan pengeringan oven merupakan metode terpilih yang dapat digunakan untuk memperoleh polisakarida.
Saran
Metode lain perlu dilakukan untuk menurunkan kadar garam dan kadar abu biomassa serta metode untuk meningkatkan kelarutan polisakarida yang dipresipitasi dengan KOH agar pemanfaatannya lebih optimal. Biomassa dan EPs
5
AKTIVITAS ANTIHIPERGLIKEMIK BIOMASSA DAN
EKSTRASELULER POLISAKARIDA
Porphyridium cruentum
SECARA
In vivo
PADA TIKUS DIABETES
Pendahuluan
Porphyridium cruentum merupakan mikroalga laut dari golongan mikroalga merah yang memiliki banyak manfaat bagi kesehatan. Mikroalga ini memiliki komponen aktif yang disinyalir berperan sebagai antidiabetes. Komponen aktif tersebut diantaranya asam lemak tak jenuh, polisakarida, karotenoid, phycobilin
protein (Becker 1994; Fuentes 2001; Schubert dan Garcia-Mendoza 2006). Manfaat yang dimiliki P. cruentum tidak hanya pada biomassanya saja tetapi juga pada ekstraseluler polisakarida (EPs) yang dihasilkan. Hasil penelitian sebelumnya melaporkan EPs yang diperoleh dengan presipitasi etanol dan pengeringan oven memiliki nilai rendemen sebesar 1.31 g/L, kelarutan sebesar 97.6% dan viskositas sebesar 32.72 cP. Menurut Lunn dan Burrtiss (2007) sifat viskositas polisakarida yang larut air berperan sebagai antihiperglikemik dengan memperlambat laju pengosongan lambung, mempercepat waktu transit di usus halus serta mengendalikan penyerapan makronutrien seperti glukosa.
Diabetes mellitus (DM) merupakan penyakit heterogenous syndrome yang disebabkan peningkatan kadar gula darah (hiperglikemik) dan penurunan jumlah sekresi insulin (Harvey 2012). Penyakit ini belum dapat disembuhkan dan terapi antihiperglikemik umumnya menggunakan obat sintesis. Liu et al. (2005) menyatakan resiko yang sering dihadapi dari penggunaan berberapa jenis obat antihiperglikemik sintesis adalah gangguan usus atau hilangnya cairan usus berlebih, sakit perut, perut kembung dan kerusakan hati.
Beberapa mikroalga diketahui memiliki aktivitas antihiperglikemik serta mekanisme secara in vivo yaitu Chlorella sp. dan Spirulina platensis. Mekanisme antihiperglikemik Chlorella sp. adalah dengan memperbaiki fungsi pankreas (Amin et al. 2013), sedangkan pada Spirulina platensis dengan aktivitas antioksidan yang menghambat kerusakan pankreas (Layam dan Redi 2007; Agustin et al. 2014). Setyaningsih et al. (2013) melaporkan biomassa dan EPs P. cruentum memiliki aktivitas antihiperglikemik yang diuji in vitro mampu menghambat aktivitas enzim α-glukosidase sebesar 33.82 dan 71.57%. Aktivitas antihiperglikemik serta mekanisme in vivo biomassa dan EPs dari P. cruentum
hasil kultivasi media Guilard belum diketahui. Kajian lebih lanjut perlu dilakukan untuk mendapatkan informasi mengenai aktivitas dan mekanismenya pada hewan percobaan.
Tujuan
2 Menentukan mekanisme antihiperglikemik biomassa dan ekstraseluler polisakarida P. cruentum berdasarkan histologi pankreas dan usus serta aktivitas enzim antioksidan.
Metodologi
Waktu dan Tempat
Penelitian dilaksanakan dari Febuari sampai September 2015 di Unit Pengelolaan Hewan Laboratorium (UPHL), Laboratorium Histopatologi FKH dan Laboratorium Fisiologi FKH IPB.
Alat dan Bahan
Alat yang digunakan yaitu kandang tikus, sonde, alat bedah, syiringe (OneMed) dan glukometer (GlucoDr), tissue cassette, mikrotom (Mikrom), Object glass, micropipet (Eppendof), waterbath (Stuart 6L), neraca (Sartorius TE214S) dan lemari pendingin (Sharp). pH meter (Thermo), sentrifuse (Hitachi), mikroskop cahaya (Olympus) dan kamera (Digital eye piece camera).
Bahan-bahan yang digunakan biomassa dan ekstraseluler polisakarida (EPs)
Porphyridium cruentum kering hasil kultivasi, tikus jantan galur Spraque dawley
dengan berat rata-rata 300-350 g yang diperoleh dari hasil breeding Bandan
Pengawasan Obat dan Makanan (BPOM), pakan standar, streptozotocin
(Santacruz), antibiotik (Clavamox), obat cacing (Albendazole 5%), anti-protozoa pencernaan (Metronidazole), glibenclamide (Generik), acarbose (Generik), ketamin (Ketamil) dan xylazine (Dormixil), Na2HPO4 (Merck), H3PO4 (Merck), buffer formalin (BrataChem), xylol (BrataChem), parafin (BrataChem), poli-L -lisin (Sigma), Bovine Serum Albumin (Merck), Trichloracetic acid (Merck), hematoxyllin (Merck) dan kit imunohistokimia (Biocare).
Prosedur Penelitian
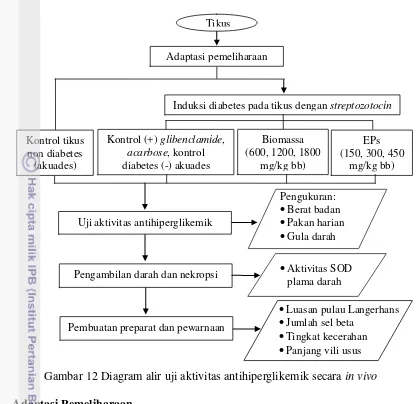
Gambar 12 Diagram alir uji aktivitas antihiperglikemik secara in vivo
Adaptasi Pemeliharaan
Hewan uji yang digunakan adalah tikus putih jantan Sprague-Dawley dengan berat 300-350 g sebanyak 30 ekor. Pemeliharaan dilakukan pada kondisi temperatur ruangan, kelembaban 30-70% dan bedding serpihan kayu. Ruangan diberi pencahayaan selama12 jam dan suplai air minum yang tidak dibatasi. Tikus secara berurutan diberi antibiotik Clavamox (amoxicillin dan asam clavulanat) 250 mg/kg bb selama 3 hari, obat cacing (albendazole 5%) 10 mg/kg bb selama 2 hari dan anti protozoa saluran cerna flagyl (metronidazole) 30 mg/kg bb selama 5 hari, untuk mengurangi galat yang disebabkan patogen dan parasit. Tikus diadaptasikan selama 14 hari untuk menghilangkan residu obat, kemudian dilakukan induksi diabetes.
Induksi Diabetes (Hwang dan Yun 2010)
Tikus diinduksi diabetes menggunakan streptozotocin (STZ) 40 mg/kg berat badan tikus (bb) secara intraperitoneal yang dilarutkan pada buffer sitrat (50 mM dan pH 4.5) hingga volume 0.5 mL. Kondisi hiperglikemik selanjutnya dibuat dengan cara tikus diberikan minum larutan sukrosa 5% selama 3 hari, kemudian diamati kadar glukosa darahnya setelah 24 dan 72 jam. Pemberian larutan sukrosa 5% dihentikan setelah kadar gula darah mencapai 200 mg/dL. Pembagian perlakuan dapat dilihat pada Tabel 2.
Tikus
Adaptasi pemeliharaan
Induksi diabetes pada tikus dengan streptozotocin
Tabel 2 Pembagian perlakuan tikus
Perlakuan Kondisi tikus Dosis perlakuan Kode perlakuan Kontrol normal diberi akuades Non diabetes 1 mL Normal Kontrol diabetes diberi akuades Diabetes 1 mL Diabetes Kontrol positif glibenclamide Diabetes 0,6 mg/kg1) Glibenclamide
Kontrol positif acarbose Diabetes 1 mg/kg2) Acarbose Keterangan: Dosis diberikan per kg berat badan, mengacu pada 1) Layam dan Redi (2007)
2)
Sugiwati (2005),3) Li Ping et al.(2005) dan 4) Jian et al. (2006)
Uji aktivitas antihiperglikemik in vivo
Biomassa, ekstraseluler polisakarida (EPs), glibenclamide dan acarbose
diberikan dengan dilarutkan akuades hingga 1 mL kemudian dicekokkan pada tikus. Tikus normal non diabetes dan kontrol negatif diabetes tetap dicekok dengan akuades saja (placebo). Tikus dipuasakan selama 6 jam dan tetap diberi minum, kemudian diukur kadar glukosa darah. Pengamatan dilakukan selama 14 hari dan setiap 2 hari sekali diukur glukosa darah dan berat badan, jumlah pakan yang dikonsumsi dihitung tiap hari mengacu pada Hwang dan Yun (2010).
Pengambilan darah dan nekropsi (Ettarh dan Carr 1997)
Tikus dianestesi menggunakan 0.1 mL ketamin 20 mg dan 0.4 mL xylazine
30 mg, setelah pingsan darah diambil melalui mata dan ditampung dalam tabung yang berisi NaEDTA 0.01%. Sampel darah selanjutnya dianalisis aktivitas enzim
superoxide dismutase (SOD). Tikus kemudian dimatikan (euthanasia) dengan cara dislokasi cervical dan dilakukan pembedahan rongga perut. Organ pankreas dan usus halus diambil dan bersihkan dengan larutan NaCl fisiologis, kemudian disimpan dalam wadah yang berisi larutan bufferneutralformalin 10%.
Pembuatan preparat histologi (modifikasi Besley 1995)
Sampel pankreas dan usus halus (duodenum) dicuci larutan PBS (phospate buffered saline pH 7.4). Sampel dipotong dengan ketebalan ± 0.5 cm dan diletakkan dalam tissue cassette, kemudian direndam dalam alkohol konsentrasi bertingkat (70, 80 dan 95%), direndam dalam larutan xylol dan dicetak dalam parafin. Blok parafin yang telah mengeras dipotong serial dengan ketebalan ± 4 µm menggunakan mikrotom dan sayatan diletakan diatas gelas objek, khusus untuk pewarnaan imunohistokimia gelas objek dilapisi terlebih dahulu dengan perekat poli-L-lisin 0.01%. Preparat selanjutnya direndam dalam xylol, alkohol absolut, alkohol konsentrasi bertingkat dan dibilas akuades masing-masing selama 5 menit. Preparat kemudian siap untuk dilakukan pewarnaan hematoxilin-eosin
(HE) dan imunohistokimia.
Pewarnaan Hematoxilin-Eosin (HE) (Fischer et al. 2008)