POTENSI PELEPAH TEMULAWAK
(
Curcuma xanthorriza
)
SEBAGAI ANTIKANKER DAN ANTIOKSIDAN
CAHYA SEPTYANTI
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
ABSTRAK
CAHYA SEPTYANTI. Potensi Pelepah Temulawak (
Curcuma xanthorriza
)
sebagai Antikanker dan Antioksidan. Dibimbing oleh IRMANIDA BATUBARA
dan GUSTINI SYAHBIRIN.
Potensi pelepah temulawak diketahui melalui penentuan ekstrak teraktif
dengan uji antikanker
brine shrimp lethality test
(BSLT) dan uji antioksidan
2,2-difenil
-
1
-
pikrilhidrazil (DPPH). Pelepah temulawak dari Bogor diekstraksi dengan
n
-heksana, kloroform, etil asetat, metanol, dan air, serta minyak atsiri yang
diperoleh dari distilasi air. Ekstrak kloroform (LC
50: 370.69 ± 22.69 µg mL
-1) dan
minyak atsiri (LC
50: 23.05 ± 3.49 µg mL
-1) toksik terhadap
Artemia salina
yang
menunjukkan potensi antikanker. Ekstrak etil asetat dan kloroform memiliki
aktivitas antioksidan (IC
50: 46.41 ± 15.49 µg mL
-1dan 52.72 ± 3.46 µg mL
-1,
berturut-turut) namun tidak sekuat asam askorbat sebagai kontrol positifnya (IC
50:
1.80 ± 0.33 µg mL
-1). Ekstrak kloroform selanjutnya difraksionasi menggunakan
kromatografi kolom dengan fase diam
Silica Gel G
60F
254-
Merck
serta elusi secara
gradien dengan
n
-heksana, kloroform, dan metanol. Fraksi yang positif memiliki
aktivitas antioksidan secara kualitatif selanjutnya diuji aktivitas antioksidan dan
antikankernya. Fraksi teraktif antioksidan (F9) berpotensi antikanker (LC
50:
522.95 ± 43.35 µg mL
-1) dan antioksidan (IC
50: 79.57 ± 8.96 µg mL
-1). Oleh
karena itu, F9 berpotensi sebagai antikanker dan antioksidan.
ABSTRACT
CAHYA SEPTYANTI. Potency of Temulawak Stem (
Curcuma xanthorriza
) as
Anticancer and Antioxidant. Supervised by IRMANIDA BATUBARA and
GUSTINI SYAHBIRIN.
The study aimed to evaluate the potency of temulawak (
Curcuma
xanthorrhiza
) stem as anticancer by brine shrimp lethality test (BSLT) and
antioxidant by 2,2-diphenyl-1-picrylhydrazyl (DPPH) assays. The stem of
temulawak midrib obtained from Bogor, was extracted by
n
-hexane, chloroform,
ethyl acetate, methanol, and water, and the volatile oil was obtained by water
distillation. The chloroform extract and volatile oil showed anticancer potency
towards
Artemia salina
(LC
50: 370.69 ± 22.69 µg mL
-1; 123.05 ± 3.49 µg mL
-1,
respectively). Ethyl acetate and chloroform extracts had antioxidant activities
(IC
50: 46.41 ± 15.49 µg mL
-1and 52.72 ± 3.46 µg mL
-1) but the activity did not as
strong as ascorbic acid (control positive, IC
501.80 ± 0.33 µg mL
-1). The
chloroform extract was further fractionated by column chromatography with
Silica Gel G
60F
254-Merck as stationary phase and gradient of
n
-hexane,
chloroform, and methanol as mobile phase. Antioxidant and anticancer potency of
fraction which had antioxidant activity qualitatively were tested. The most
antioxidant active fraction (F9) had anticancer potency (LC
50: 522.95 ± 43.35 µg
mL
-1) and antioxidant activity (IC
50: 79.57 ± 8.96 µg mL
-1). In conclusion, F9 is
POTENSI PELEPAH TEMULAWAK
(
Curcuma xanthorriza
)
SEBAGAI ANTIKANKER DAN ANTIOKSIDAN
CAHYA SEPTYANTI
Skripsi
sebagai salah satu syarat untuk memperoleh gelar
Sarjana Sains pada
Departemen Kimia
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
Judul Skripsi : Potensi Pelepah Temulawak (
Curcuma xanthorriza
) sebagai
Antikanker dan Antioksidan
Nama `
: Cahya Septyanti
NIM
: G44080051
Disetujui
Pembimbing I
Pembimbing II
Dr Irmanida Batubara SSi MSi
Dr Gustini Syahbirin MS
NIP 19750807 200501 2 001 NIP 19600819 198903 2 002
Diketahui
Ketua Departemen Kimia
Prof Dr Ir Tun Tedja Irawadi MS
NIP 19501227 197603 2 002
PRAKATA
Puji dan syukur kehadirat Allah SWT yang telah melimpahkan rahmat dan
karunia-
Nya sehingga penulis dapat menyelesaikan skripsi yang berjudul ―Potensi
Pelepah
Temulawak
(
Curcuma
xanthorriza
)
sebagai
Antikanker
dan
Antioksidan‖. Penelitian ini dilaks
anakan pada bulan Februari 2012 sampai Juli
2012 yang bertempatkan di Laboratorium Kimia Analitik, Fakultas Matematika
dan Ilmu Pengetahuan Alam (FMIPA), Institut Pertanian Bogor (IPB) serta
Laboratorium Pusat Studi Biofarmaka Institut Pertanian Bogor (PSB IPB). Skripsi
ini disusun sebagai salah satu syarat kelulusan Program Sarjana di Departemen
Kimia FMIPA IPB.
Penulis mengucapkan terima kasih kepada Dr Irmanida Batubara SSi MSi
selaku pembimbing satu dan Dr Gustini Syahbirin MS sebagai pembimbing kedua
yang selalu memberikan motivasi, kritik, dan saran untuk kelancaran penelitian
dan penulisan. Terima kasih kepada Laboratorium Pusat Studi Biofarmaka Institut
Pertanian Bogor (PSB IPB) yang telah memberikan kesempatan kepada penulis
untuk melaksanakan penelitiannya. Penulis juga mengucapkan terima kasih
kepada Bapak Eman, Ibu Nunung, Bapak Engkos, dan Bapak Dede yang telah
menyediakan alat dan bahan selama penelitian. Terima kasih kepada staf PSB IPB
yang telah membantu penulis dalam melakukan penelitian. Ungkapan terima kasih
juga dihaturkan untuk kedua orang tua serta adik penulis yang selalu memberikan
dukungan dan kasih sayangnya. Ucapan terima kasih kepada rekan-rekan kimia 45
dan ekstensi analitik yang senantiasa menyemangati dan berjuang bersama dalam
penelitian. Semoga tulisan ini dapat memberikan manfaat dalam perkembangan
ilmu pengetahuan.
Bogor, Juli 2012
RIWAYAT HIDUP
Penulis dilahirkan di Jakarta, pada tanggal 08 September 1990 dari
pasangan Muji Waluyo dan Rachmawati. Penulis merupakan anak pertama dari
dua bersaudara. Penulis menyelesaikan pendidikannya di Sekolah Dasar Negeri
(SDN) Sukatani IV tahun 1995
–
2001, Sekolah Lanjutan Tingkat Pertama Negeri
(SLTPN) 11 Depok tahun 2001
–
2004, Sekolah Menengah Analis Kimia Bogor
(SMAKBo) tahun 2004
–
2008. Kemudian penulis melanjutkan pendidikan pada
tahun 2008
–
2012 di Program Sarjana Departemen Kimia IPB.
Selama kuliah, penulis mengikuti berbagai kepanitiaan dalam lingkup
kimia, FMIPA, maupun kampus. Penulis berpartisipasi sebagai staf kementrian
pendidikan Badan Eksekutif Mahasiswa Keluarga Mahasiswa Institut Pertanian
Bogor tahun 2010/2011. Penulis melakukan Praktik Lapang di PT Bayer Health
Care
Cimanggis Plant
dengan judul laporan ―Analisis Vitamin B
9(Asam Folat)
dalam Produk Sediaan
Effervescent
‖
pada tahun 2011. Penulis juga pernah
menjadi asisten praktikum kimia Tingkat Persiapan Bersama IPB tahun 2009
–
2012, asisten praktikum Kimia Analitik ekstensi Departemen Kimia IPB tahun
ajaran 2010/2011, asisten praktikum Kimia Analitik 2 mayor kimia Departemen
Kimia IPB tahun ajaran 2010/2011, asisten praktikum Elektroanalitik dan Teknik
Pemisahan ekstensi Departemen Kimia IPB tahun ajaran 2010/2011, asisten
praktikum Elektroanalitik dan Teknik Pemisahan mayor kimia Departemen Kimia
IPB tahun ajaran 2011/2012, asisten praktikum Spektrofotometri dan Analisis
Kemometrik mayor kimia Departemen Kimia IPB tahun ajaran 2011/2012, serta
asisten praktikum Kimia Bahan Alam ekstensi Departemen Kimia IPB tahun
ajaran 2011/2012. Selain aktif di kampus, penulis juga menjadi tentor Kimia TPB
tahun 2009
–
2011 serta tentor Kimia Analitik Layanan mayor ITP tahun 2012 di
bimbingan belajar
―Katalis‖.
Penulis juga pernah berkesempatan mewakili
departemen kimia dalam ajang Mahasiswa Berprestasi tingkat Fakultas
Matematika dan Ilmu Pengetahuan IPB tahun 2011. Selain itu juga, penulis
pernah menjadi pemakalah poster pada Seminar Nasional Tanaman Obat
―
POKJANAS TOI XLII
‖ di Universitas Jenderal Achmad Yani (UNJANI) di
Cimahi Bandung dengan judul makalah ―Potensi Pelepah
Temulawak (
Curcuma
DAFTAR ISI
Halaman
DAFTAR ISI ... vi
DAFTAR TABEL ... vii
DAFTAR GAMBAR ... vii
DAFTAR LAMPIRAN ... viii
PENDAHULUAN ... 1
METODE ... 2
Bahan dan Alat ... 2
Lingkup Kerja ... 2
HASIL DAN PEMBAHASAN ... 4
Penentuan Kadar Air dan Abu ... 4
Ekstraksi ... 5
Kandungan Fitokimia ... 5
Potensi Antikanker dan Antioksidan Ekstrak ... 6
Identifikasi Komponen dalam Minyak Atsiri ... 7
Penentuan Eluen Terbaik dengan KLT ... 8
Fraksionasi Kromatografi Kolom (KK) ... 8
Potensi Antikanker dan Antioksidan Fraksi ... 9
Identifikasi Senyawa ... 11
SIMPULAN DAN SARAN ... 12
Simpulan ... 12
Saran ... 12
DAFTAR TABEL
Halaman
1 Data rendemen ekstrak pelepah temulawak dengan berbagai kepolaran ... 5
2 Uji fitokimia ekstrak kasar pelepah temulawak ... 5
3 Potensi antikanker dan antioksidan ekstrak kasar pelepah temulawak ... 6
4 Komponen minyak atsiri dari pelepah temulawak ... 7
5 Potensi antikanker dan antioksidan hasil fraksionasi dan ekstrak kasar
kloroform pelepah temulawak ... 9
6 Kandungan senyawa metabolit sekunder dan aktivitas antioksidan hasil
fraksionasi ekstrak kloroform pelepah temulawak ... 11
7 Bilangan gelombang spektrum inframerah Fraksi 9 hasil fraksionasi ekstrak
kloroform pelepah temulawak ... 11
DAFTAR GAMBAR
Halaman
1 Tanaman dan pelepah temulawak. ... 1
2 Prinsip penangkapan H oleh DPPH ... 6
3 Senyawa xantorizol. ... 7
4 Kromatogram ekstrak kloroform pelepah temulawak dengan eluen tunggal .... 8
5 Kromatogram ekstrak kloroform pelepah temulawak dengan eluen campuran
kloroform:
n
-heksana. ... 8
6 Kromatogram hasil fraksionasi dan ekstrak kasar kloroform pelepah
temulawak ... 9
DAFTAR LAMPIRAN
Halaman
1 Bagan alir penelitian ... 15
2 Isolasi minyak atsiri pelepah temulawak ... 16
3 Kadar air serbuk pelepah temulawak ... 17
4 Kadar abu serbuk pelepah temulawak ... 17
5 Rendemen ekstrak kasar pelepah temulawak ... 18
6 Potensi antikanker oleh ekstrak kloroform pelepah temulawak ... 19
7 Aktivitas antioksidan oleh ekstrak kloroform pelepah temulawak ... 20
8 Larutan sampel ekstrak pelepah temulawak setelah diinkubasi 37
oC selama 30
menit ... 20
9 Uji Duncan nilai LC
50hasil fraksionasi ekstrak kloroform pelepah temulawak21
10 Kromatogram minyak atsiri pelepah temulawak dengan GC-MS ... 21
11 Rendemen hasil fraksionasi kolom ekstrak kloroform pelepah temulawak ... 22
12 Uji fitokimia lanjutan flavonoid hasil fraksionasi ekstrak kloroform pelepah
temulawak ... 23
13 Uji fitokimia lanjutan alkaloid hasil fraksionasi ekstrak kloroform pelepah
temulawak ... 23
14 Uji fitokimia lanjutan steroid dan triterpenoid hasil fraksionasi ekstrak
kloroform pelepah temulawak ... 24
15 Spektrum FTIR F9 hasil fraksionasi ekstrak kloroform pelepah temulawak ... 25
PENDAHULUAN
Gencarnya gerakan kembali ke alam (back to nature) telah mendorong semakin banyak dilakukan penelitian yang berkaitan dengan pemakaian bahan alam sebagai obat herbal. Obat ini banyak digunakan sebagai obat alternatif maupun untuk pemeliharaan kesehatan. Ilmu kedokteran pun mendukung dengan adanya bidang baru yang dikenal dengan naturopathic medicine. Bidang ini berdasarkan pengobatan yang bersistem, terintegrasi, tidak merusak, serta mengutamakan penggunaan bahan alam sebagai obat (natural medicine dan natural care), bukan bahan-bahan sintetik (Kumulawati 2005).
Temulawak (Curcuma xanthorriza) merupakan salah satu jenis tanaman unggulan yang memiliki banyak manfaat sebagai tanaman obat (Hadipoentyanti & Syahid 2007). Tanaman ini termasuk tanaman tahunan yang tumbuh merumpun. Tiap rumpun tanaman terdiri atas beberapa tanaman anakan dan tiap tanaman memiliki 2–9 helai daun (Gambar 1). Warna daging rimpangnya kuning dengan cita rasa pahit serta berbau tajam (Rukmana 1995).
Gambar 1 Tanaman (a) dan pelepah (b) temulawak.
Khasiat temulawak sebagai bahan alam untuk obat terutama disebabkan kandungan senyawa kurkuminoid di dalamnya. Kurkuminoid pada temulawak terdiri atas kurkumin, demetoksikurkumin, dan bis-demetoksikurkumin. Khasiat kurkuminoid di antaranya ialah sebagai antioksidan, antiradang, antibakteri, antihepatotoksik, antikolesterol, dan antikanker (Sidik 2006).
Selain senyawa kurkuminoid, terdapat senyawa lain di dalam rimpang temulawak. Senyawa tersebut antara lain kelompok difenilheptanoid seperti (1E,3E )-1,7-difenil-1,3-heptadien-5-ol, (1E,3E )-1,7-difenil-1,3-heptadien-5-on, (E)-1,7-difenil-1-hepten-5-ol, (E )-7-(3,4-dihidroksifenil)-5-hidroksi-1-fenil-1-heptena, dan 7-hidroksi-1,7-bis-(4-hidroksi-3-metoksifenil)-1-heptena-3,5-dion; kelompok terpenoid jenis monoterpena seperti kamfor, borneol, isoborneol, α-felandrena, -felandrena (Ravindran et al. β007), α-pinena, α-longipinena, dan kamfena (Sukrasno et al. 2011); serta jenis seskuiterpena seperti kurzerenon, ar-turmeron, zingiberena (Ravindran et al. 2007), α-kurkumena, furanodiena, xantorizol, -elemena, -elemena, -farnesena, dan trans-kariofilena (Sukrasno et al. 2012).
Ravindran et al. (2007) menyatakan bahwa xantorizol, ar-turmeron, serta senyawa golongan difenilheptanoid juga berperan dalam bioaktivitas temulawak selain kurkuminoid. Xantorizol berfungsi sebagai antimikrob dan antikanker. Ar-turmeron berfungsi sebagai antikanker dan antinyamuk. Difenilheptanoid seperti (1E,3E )-1,7-difenil-1,3-heptadien-5-on, (E )-1,7-difenil-1-hepten-5-ol, dan (1E,3E )-1,7-difenil-1,3-heptadien-5-ol penting sebagai antiradang.
Penelitian bahan aktif selama ini baru terfokus pada rimpang temulawak. Hal ini dikarenakan tradisi masyarakat yang hanya menggunakan rimpang sebagai obat tradisional, sedangkan pelepah dan daunnya belum umum dipergunakan. Belum adanya peneliti dengan fokus pada pelepah dan dekatnya jarak antara rimpang dan pelepah membuat pelepah temulawak menjadi bagian yang menarik untuk diteliti lebih lanjut potensinya sebagai antikanker dan antioksidan. Kedua bioaktivitas ini diteliti pada pelepah karena telah terbukti bahwa rimpang temulawak memiliki bioaktivitas antikanker (Cheah et al. 2009) dan antioksidan (Qader et al. 2011).
METODE
Bahan dan Alat
Bahan-bahan yang digunakan antara lain sampel pelepah temulawak dari kebun UKBB Pusat Studi Biofarmaka Bogor, n-heksana, kloroform, etil asetat, metanol, air, air laut, larva udang Artemia salina, pereaksi uji fitokimia, asam askorbat, dan pereaksi DPPH. Alat-alat yang digunakan antara lain oven, eksikator, neraca analitik, lampu ultraviolet (UV), pelat kromatografi lapis tipis (KLT), penguap putar, kolom, kromatografi gas-spektrometer massa (GC-MS), dan spektrofotometer inframerah transformasi Fourier (FTIR).
Lingkup Kerja
Penelitian yang dilakukan meliputi preparasi sampel, penentuan kadar air dan abu, ekstraksi pelepah temulawak kering dengan maserasi dalam pelarut dengan berbagai kepolaran, isolasi minyak atsiri pelepah temulawak dengan distilasi air, penentuan ekstrak kasar atau minyak atsiri teraktif dengan uji BSLT dan DPPH, penentuan eluen terbaik untuk ekstrak teraktif dengan KLT, fraksionasi ekstrak teraktif dengan kromatografi kolom menggunakan eluen sistem gradien. Pada tahap terakhir dilakukan identifikasi fraksi teraktif menggunakan spektrofotometer (FTIR) serta identifikasi komponen penyusun minyak atsiri dengan GC-MS.
Diagram alir penelitian secara umum diberikan pada Lampiran 1 dan tahapan isolasi minyak atsiri ditunjukkan pada Lampiran 2.
Preparasi Pelepah Temulawak
Pelepah segar dicuci dengan air bersih, ditiriskan, dipotong kecil-kecil, dan dikeringkan dalam oven 50oC. Setelah itu, pelepah kering digiling dan diayak menggunakan pengayak 40 mesh agar diperoleh bentuk serbuk.
Analisis Kadar Air (AOAC 2007)
Cawan porselen dikeringkan pada suhu 105°C selama 30 menit kemudian didinginkan dalam eksikator dan ditimbang. Sebanyak 2 g pelepah temulawak kering dimasukkan ke dalam cawan dan dikeringkan pada suhu 105°C selama 5 jam kemudian didinginkan dalam eksikator dan ditimbang. Prosedur ini dilakukan hingga diperoleh bobot yang tetap. Kadar air contoh ditentukan dengan persamaan:
Kadar air (%) = Keterangan:
A = bobot contoh awal (g)
B = bobot contoh kering (g)
Analisis Kadar Abu (AOAC 2007)
Penentuan kadar abu pelepah temulawak menggunakan metode gravimetri. Cawan porselen yang bersih dan kering dimasukkan ke dalam tanur untuk menghilangkan sisa-sisa kotoran yang menempel di cawan. Setelah didinginkan dalam eksikator, cawan ditimbang. Sebanyak 2 g pelepah temulawak kering dimasukkan ke dalam cawan tersebut dan dipanaskan sampai tidak berasap kemudian dibakar dalam tanur pada suhu 600°C selama 2 jam sampai diperoleh abu. Cawan berisi abu didinginkan dalam eksikator dan ditimbang. Kadar abu contoh dihitung dengan persamaan
Kadar abu (%) =
Keterangan:
A = bobot contoh awal (g)
B = bobot abu (g)
Isolasi Minyak Atsiri Pelepah Temulawak (Muchtaridi et al. 2003)
Sebanyak 5 kg pelepah temulawak yang telah dipotong kecil-kecil dimasukkan ke dalam distilator Dean-Stark, lalu ditambahkan akuades dengan nisbah sampel dan akuades adalah 1:2. Setelah itu, dilakukan proses distilasi air selama 6 jam dengan suhu berkisar 100–105°C. Distilat yang diperoleh dipartisi dengan etil asetat. Fase etil asetat diuapkan dengan penguap putar pada suhu kamar. Selanjutnya, minyak dimasukkan ke dalam botol berwarna gelap dan disimpan di dalam kulkas untuk dianalisis pada tahap selanjutnya.
Ekstraksi Pelepah dengan Berbagai Kepolaran Pelarut
3
ulangan. Semua maserat dikumpulkan dan dipekatkan dengan penguap putar. Bobot ekstrak kering yang diperoleh ditimbang. Residu kemudian diekstraksi berturut-turut dengan kloroform, etil asetat, metanol, dan air berdasarkan metode yang sama dengan n -heksana. Rendemen setiap ekstrak dihitung dengan membandingkan bobot ekstrak yang diperoleh dengan bobot sampel awal. Kadar air sampel digunakan sebagai faktor koreksi. Rendemen (%) =
Keterangan:
A = bobot contoh awal (g)
B = bobot ekstrak (g)
C = kadar air
Pemilihan Pelarut sebagai Fase Gerak
Ekstrak pelepah temulawak dilarutkan secukupnya dengan pelarutnya. Ekstrak lalu ditotolkan pada pelat KLT hingga cukup pekat.
Pemilihan fase gerak diawali dengan menggunakan 10 pelarut tunggal, yaitu n -heksana, dietil eter, n-butanol, metanol, asam asetat, diklorometana, etil asetat, aseton, toluena, dan kloroform. Sebanyak 5 mL pelarut dimasukkan ke dalam bejana dan dijenuhkan selama 20 menit. Pelat KLT yang telah berisi sampel dimasukkan ke dalam bejana dan dipisahkan hingga fase gerak mencapai jarak ±1 cm dari tepi atas pelat. Pelat KLT diangkat, dikeringkan, dan dideteksi dengan lampu UV pada panjang gelombang 254 dan 365 nm. Eluen yang menghasilkan noda terbanyak dan terpisah baik dipilih sebagai eluen terbaik. Jika eluen tunggal belum dapat memberikan keterpisahan yang baik, maka dilakukan pencampuran antara eluen yang hampir memberikan keterpisahan yang baik dan eluen yang menahan seluruh komponen di garis awal.
Fraksionasi dengan Kromatografi Kolom (Rouessac & Rouessac 1994)
Sebanyak 10 g silika gel untuk pemisahan 0.5 gram ekstrak dengan diameter 1 cm dan tinggi 20 cm. Ekstrak kloroform pelepah temulawak dilarutkan dalam eluen terbaik, kemudian dipisahkan menggunakan elusi step gradient (peningkatan kepolaran). Eluat ditampung setiap 3 mL dalam tabung reaksi dan diuji dengan KLT. Noda pemisahan dideteksi di bawah lampu UV 254 dan 365 nm. Eluat yang memiliki Rf yang sama
digabungkan sebagai 1 fraksi. Selanjutnya,
fraksi-fraksi diuji aktivitas antioksidan, antikanker, dan fitokimia.
Uji Fitokimia (Harborne 1987)
Uji Alkaloid. Ekstrak dengan bobot tertentu dilarutkan dengan 10 mL kloroform dan beberapa tetes NH4OH kemudian disaring ke dalam tabung reaksi tertutup. Ekstrak kloroform dalam tabung reaksi dikocok dengan 10 tetes H2SO4 2 M dan lapisan asamnya dipisahkan ke dalam tabung reaksi lain. Lapisan asam ini diteteskan ke lempeng tetes dan ditambahkan pereaksi Mayer, Wagner, dan Dragendorf yang akan menimbulkan endapan dengan warna berturut-turut putih, cokelat, dan merah jingga jika ekstrak mengandung alkaloid.
Uji Saponin dan Flavonoid. Ekstrak dengan bobot tertentu dimasukkan ke dalam gelas piala besar kemudian ditambahkan 100 mL air panas dan dididihkan selama 5 menit. Setelah itu, disaring dan filtratnya digunakan untuk pengujian. Uji saponin dilakukan dengan mengocok 10 mL filtrat di dalam tabung reaksi tertutup selama 10 detik kemudian dibiarkan selama 10 menit. Adanya saponin ditunjukkan dengan terbentuknya buih stabil. Sebanyak 10 mL filtrat yang lain ditambahkan 0.5 g serbuk Mg, 2 mL alkohol klorhidrat (campuran HCl 37% dan etanol 95% dengan volume yang sama), dan 20 mL amil alkohol kemudian dikocok kuat-kuat. Terbentuknya warna merah, kuning, atau jingga pada lapisan amil alkohol menunjukkan adanya flavonoid.
Uji Steroid dan Triterpenoid. Ekstrak dilarutkan dengan 25 mL etanol panas (50oC) kemudian disaring ke dalam pinggan porselen dan diuapkan sampel kering. Residu ditambahkan eter, dipindahkan ke lempeng tetes lalu ditambahkan 3 tetes anhidrida asam asetat dan 1 tetes H2SO4 pekat (uji Lieberman-Buchard). Warna merah atau ungu menunjukkan adanya triterpenoid sedangkan hijau atau biru steroid.
Uji Tanin. Ekstrak ditambahkan 100 mL air panas, dididihkan selama 5 menit, dan disaring. Filtrat ditambahkan larutan FeCl3 1%. Warna hitam kehijauan menunjukkan adanya tanin.
untuk uji BSLT setelah berumur 48 jam (Nurhayati et al. 2006).
Uji Toksisitas Ekstrak. Larutan stok ekstrak pelepah dan minyak atsiri pelepah disiapkan dengan konsentrasi 2000 ppm. Ekstrak pelepah diencerkan pada konsentrasi tertentu dan kontrol disiapkan tanpa penambahan sampel. Pengujian dilakukan dengan memasukkan 10 ekor larva A. salina
berumur 48 jam ke dalam sumur (multiwell) yang telah berisi air laut, kemudian ditambahkan larutan ekstrak dengan total volume sumur 2 mL. Setelah 24 jam, jumlah larva yang mati dihitung dengan bantuan kaca pembesar (Khurniasari 2004).
Parameter yang digunakan adalah jumlah larva yang mati 50% dari total larva uji. Nilai LC50 diperoleh dengan memasukkan angka probit (50% kematian larva uji). Efek toksisitas dianalisis dari persen kematian
kematian jumlah larva matijumlah larva uji 100
yang kemudian dibuat persamaan garis
y=a+bx , dengan y = konsentrasi larutan, dan x
= persen kematian larva. LC50 merupakan nilai
y yang diperoleh dengan memasukkan nilai x
= 50%. Apabila pada kontrol ada larva yang mati, maka persen kematian ditentukan dengan rumus Abbot:,
kematian
-10 100 ,
dengan T = jumlah larva uji yang mati, K = jumlah larva kontrol yang mati, dan 10 = jumlah larva uji.
Uji Aktivitas Antioksidan dengan Metode DPPH (Salazar et al. 2011)
Larutan stok ekstrak pelepah dibuat dengan konsentrasi (1 mg/mL) kemudian diencerkan menjadi beberapa konsentrasi. Kontrol positif yang digunakan ialah asam askorbat, sedangkan kontrol negatifnya ialah DPPH. Larutan stok asam askorbat disiapkan dengan konsentrasi 100 ppm dalam pelarut etanol, lalu diencerkan menjadi beberapa konsentrasi dengan etanol. Larutan diambil masing-masing 100 µL kemudian ditambahkan 100 µL larutan DPPH 125 µM dalam etanol, dan diinkubasi pada suhu 37oC selama 30 menit. Setelah itu, nilai absorbans diukur pada panjang gelombang 517 nm (ungu). Aktivitas inhibisi ditentukan berdasarkan persamaan berikut:,
inhibisi [1-( sampel- kontrol)
( blangko- kontrol)] 100 ,
Keterangan:
A sampel = absorbans bahan aktif
A kontrol = absorbans asam askorbat dengan inhibisi 100%
A blangko = absorbans DPPH
Uji Antioksidan dengan Metode KLT Bioautografi (Marston 2011)
Pelat KLT fraksi yang telah dielusi dengan eluen serta kontrol positif asam askorbat dikeringkan dan selanjutnya disemprot dengan larutan DPPH 125 µM dalam etanol. Pelat kemudian diamati dengan kasatmata setelah didiamkan selama 30 menit. Ekstrak metabolit sekunder yang berpotensi sebagai antioksidan akan memudarkan warna DPPH.
Identifikasi Senyawa
Identifikasi senyawa dilakukan dengan spektrofotometer FTIR untuk fraksi yang berasal dari ekstrak kasar. Kira-kira 1 mg fraksi teraktif dicampurkan dengan KBr murni, ditempatkan dalam cetakan, lalu ditekan dengan alat tekan mekanik, kemudian pelet yang terbentuk ditempatkan dalam tempat contoh untuk dianalisis.
Identifikasi senyawa dalam minyak atsiri dilakukan dengan GC-MS. Distilat kasar minyak atsiri diinjeksikan ke dalam injektor GC-MS (Shimadzu-QP-5050A) dengan kolom DB-5 MS (dimensi 0.25 mm 30 m) dan gas pembawa helium dengan laju alir 42 mL/menit. Suhu injektor dan detektor sama, yaitu 250 °C, sedangkan suhu kolom terprogram diawali dengan 80°C ditahan selama 2 menit, kemudian diubah perlahan-lahan dengan laju kenaikan suhu 5°C/menit hingga mencapai 250°C dan ditahan selama 8 menit. Kondisi spektrometer massanya adalah energi ionisasi 70 eV, mode ionisasi tumbukan elektron, split ratio: 25.0, dan area deteksi adalah 40—500 m/z. Setiap puncak yang muncul dalam kromatogram. Identifikasi dengan membandingkan m/z dengan data yang yang terdapat pada library index MS.
Analisis Statistika
Data aktivitas antikanker dan antioksidan ditampilkan sebagai rerata ± SD. Beda nyata antarkelompok diuji dengan uji Duncan.
HASIL DAN PEMBAHASAN
Penentuan Kadar Air dan Abu
5
dan kadar abu 8.80 ± 0.09% (Lampiran 4). Menurut Rahardjo dan Ajijah (2007), kadar air rimpang temulawak dari Balitro sebesar 11.27% dan kadar abu sebesar 3.13%. Serbuk pelepah temulawak memiliki kadar air tidak jauh berbeda dengan rimpangnya, sedangkan kadar abunya lebih tinggi. Hal ini berarti jumlah air yang terikat secara fisik pada pelepah tidak jauh berbeda dengan rimpangnya, tetapi jumlah mineral yang terkandung dalam pelepah lebih banyak.
Dalam analisis bahan, kadar air berguna sebagai koreksi dalam menghitung rendemen ekstraksi dan untuk menduga ketahanan dalam penyimpanan, sedangkan kadar abu menunjukkan banyaknya mineral dalam suatu bahan. Winarno (1992) menyatakan bahwa kadar air minimum agar bakteri tidak tumbuh ialah kurang dari 10% sehingga pada kadar air ini bahan dapat disimpan dalam jangka waktu yang lama dan risiko terkena jamur kecil.
Ekstraksi
Hasil maserasi dari 25 g serbuk pelepah temulawak dengan pelarut berbeda kepolaran yang dilakukan 3 kali ulangan terangkum pada Tabel 1 dan data lengkapnya pada Lampiran 5. Perbedaan polaritas dimaksudkan agar seluruh kandungan senyawa metabolit sekunder dalam sampel, terekstraksi.
Tabel 1
Data rendemen ekstrak pelepah temulawak dengan berbagai kepolaran
Ekstrak Rendemen (%)*
n-heksana 1.48 ± 0.03 Kloroform 1.53 ± 0.03 Etil asetat 0.57 ± 0.07 Metanol 16.47 ± 0.39
Air 7.97 ± 0.25 Minyak atsiri 0.07 Keterangan: * = berdasarkan bobot kering
Ekstrak metanol memiliki persentase rendemen tertinggi, sedangkan persentase rendemen terendah dimiliki oleh minyak atsiri. Menurut Hong dan Sirat (2004), minyak atsiri dalam rimpang temulawak segar sebesar 0.91%. Minyak atsiri pelepah lebih sedikit karena bagian ini didominasi oleh air. Perbedaan rendemen ekstrak dikarenakan perbedaan jumlah senyawa yang dapat larut pada pelarut berbeda polaritas. Prinsip ekstraksi ialah ―like dissolve like‖, maka senyawa nonpolar akan terkelompokkan dalam ekstrak n-heksana, senyawa semipolar yang dominan nonpolar dalam ekstrak kloroform, senyawa semipolar yang dominan
polar pada ekstrak etil asetat, dan senyawa polar pada ekstrak air. Senyawa bioaktif yang terlarut dalam setiap pelarut tersebut dan minyak atsiri akan diuji aktivitas antioksidan dan potensi antikankernya pada tahap selanjutnya.
Kandungan Fitokimia
Ekstrak n-heksana mengandung steroid, triterpenoid, dan alkaloid. Hampir semua steroid dan triterpenoid bersifat nonpolar sehingga intensitas warna uji steroid/ triterpenoid pada ekstrak ini paling dominan dibandingkan dengan ekstrak lainnya. Alkaloid yang terdeteksi pada ekstrak tersebut merupakan alkaloid nonpolar. Ekstrak kloroform pelepah temulawak mengandung steroid, triterpenoid, flavonoid, dan alkaloid semipolar. Ekstrak etil asetat mengandung flavonoid, alkaloid, dan triterpenoid semipolar. Kepolaran etil asetat yang tidak jauh berbeda dengan kloroform mengakibatkan senyawa yang terkandung pun tidak jauh berbeda. Intensitas warna yang lebih rendah kemungkinan diakibatkan hampir seluruh senyawa semipolar telah terekstraksi dengan kloroform. Metanol mengandung flavonoid, alkaloid, dan triterpenoid. Intensitas warna flavonoid dan alkaloid ekstrak ini lebih tinggi dibandingkan dengan ekstrak etil asetat, artinya flavonoid dan alkaloid yang bersifat polar terekstraksi lebih banyak oleh metanol. Sebaliknya, intensitas warna triterpenoid menurun dengan bertambahnya kepolaran pelarut. Ekstrak air yang memiliki tingkat kepolaran paling tinggi hanya mengandung flavonoid polar.
Tabel 2
Uji fitokimia ekstrak kasar pelepah temulawak
Komponen fitokimia
Ekstrak kasar pelepah temulawak
H K EA M A
Flavonoid - ++ + +++ +++
Saponin - - - - -
Tanin - - - - -
Alkaloid a) - - - - -
Alkaloid b) ++ + + ++ -
Alkaloid c) ++ + + ++ -
Steroid ++++ +++ - - -
Triterpenoid ++++ +++ ++ + -
6
Potensi Antikanker dan Antioksidan Ekstrak
Potensi antikanker dalam penelitian ini diuji menggunakan metode BSLT. Melalui uji BSLT dapat diketahui nilai konsentrasi mematikan 50%(LC50) senyawa bioaktif pada sampel terhadap larva udang. Nilai LC50 adalah konsentrasi yang dibutuhkan untuk mematikan 50% populasi larva udang total (Frank 1995). Nilai LC50 dari suatu populasi dipengaruhi oleh beberapa faktor, antara lain umur, suhu, jumlah hewan uji, dan jenis galur (Finney 1971). Metode ini sering digunakan untuk mendeteksi senyawa bioaktif yang memiliki efek farmakologis. Metode BSLT memiliki beberapa keunggulan, di antaranya waktu pelaksanaan cepat, biaya relatif murah, sederhana, tidak memerlukan teknik aseptik, tidak memerlukan peralatan khusus, dan hanya membutuhkan sedikit sampel uji (Meyer et al.1982).
Tabel 3 Potensi antikanker dan antioksidan ekstrak kasar pelepah temulawak
Ekstrak LC50
(µg/mL) IC50 (µg/mL)
n-heksana >1000 >400 Kloroform 370.69 ±
22.69b
46.41 ± 15.49b Etil asetat >1000 52.72 ± 3.46b
Metanol >1000 >400 Air >1000 >400 Minyak
atsiri
23.05 ±
3.49a >400 Asam
askorbat - 1.80 ± 0.33 a
Keterangan: Asam askorbat = kontrol positif antioksidan. Sampel dengan abjad yang sama tidak berbeda nyata berdasarkan uji Duncan pada P = 0.05
Nilai LC50 tiap ekstrak dan minyak atsiri ditunjukkan pada Tabel 3. Menurut Meyer et al. (1982), ekstrak dari bahan alam bersifat toksik apabila memiliki nilai LC50 < 1.0 mg/mL. Hal ini berarti ekstrak kloroform dan minyak atsiri berpotensi sebagai antikanker. Contoh perhitungan LC50 ekstrak kloroform diberikan pada Lampiran 6. Berdasarkan uji fitokimia (Tabel 2), ekstrak kloroform mengandung triterpenoid, steroid, alkaloid, dan flavonoid. Senyawa metabolit sekunder yang diduga berperan dalam uji BSLT ialah steroid, triterpenoid, flavonoid, dan alkaloid semipolar.
Antioksidan merupakan senyawa yang memiliki kemampuan salah satunya untuk menetralisasi radikal bebas. Salah satu
caranya ialah menyumbangkan radikal hidrogen pada molekul radikal bebas (Badarinath et al. 2010). Pemilihan metode DPPH untuk penentuan aktivitas antioksidan didasarkan pada beberapa keunggulannya, di antaranya mudah, sederhana, cepat, dapat-ulang, sensitif, dan hanya membutuhkan sedikit sampel (Koleva et al. 2002).
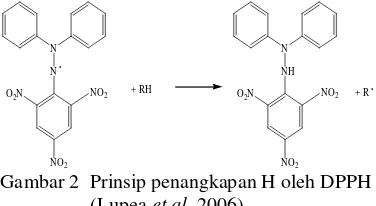
Metode uji antioksidan DPPH didasarkan pada reaksi penangkapan atom hidrogen dari senyawa antioksidan oleh DPPH (reduksi DPPH) (Gambar 2). Reagen DPPH berperan sebagai radikal bebas yang diredam oleh senyawa antioksidan yang terkandung dalam sampel. Selanjutnya, DPPH akan tereduksi menjadi senyawa 2,2-difenil-1-pikrilhidrazina (DPPH-H). Reduksi DPPH menjadi DPPH-H menyebabkan perubahan warna dari ungu menjadi kuning (Lupea et al. 2006). Perubahan warna uji sebanding dengan jumlah hidrogen radikal yang diambil oleh radikal bebas.
N
N .
NO2
O2N NO2 + RH
N
NH
NO2
O2N NO2 + R .
Gambar 2 Prinsip penangkapan H oleh DPPH (Lupea et al. 2006).
Daya inhibisi (IC50) dihitung berdasarkan pengurangan absorbans DPPH terhadap absorbans sampel uji (Lampiran 7). Nilai IC50 sebagai parameter aktivitas antioksidan, merupakan konsentrasi yang dibutuhkan untuk menghambat aktivitas radikal bebas (serapan radikal bebas) sebanyak 50% (Molyneux 2004). Nilai IC50 dari masing-masing sampel diperoleh berdasarkan persamaan garis yang dihasilkan dari hubungan antara persen inhibisi dan konsentrasi.
7
IC50 > 400 µg/mL. Secara visual pun dapat dilihat pada Lampiran 8 bahwa keempat sampel tersebut tidak mengalami perubahan warna larutan yang signifikan. Aktivitas antioksidan tertinggi dimiliki ekstrak kloroform (data lengkap di Lampiran 7) karena memiliki nilai IC50 sebesar 46.41 ± 15.49 ppm. Ekstrak etil asetat juga aktif antioksidan dengan IC50 sebesar 52.72 ± 3.46 ppm. Data nilai IC50 ini diuji beda nyata dengan uji Duncan (Lampiran 9). Nilai IC50 kedua ekstrak tersebut tidak berbeda nyata menurut uji Duncan, artinya diperlukan jumlah ekstrak yang hampir sama untuk mencapai inhibisi 50%. Bila dibandingkan dengan kontrol positif (asam askorbat), kedua ekstrak tersebut tidak seaktif asam askorbat dan nilai IC50-nya berbeda nyata.
Ekstrak kloroform mengandung triterpenoid, steroid, alkaloid, dan flavonoid, sedangkan ekstrak etil asetat mengandung triterpenoid, alkaloid, dan flavonoid (Tabel 2). Metabolit sekunder yang diduga berperan dalam aktivitas antioksidan ialah triterpenoid, steroid, alkaloid, dan flavonoid semipolar.
Aktivitas antioksidan pelepah temulawak belum pernah dilakukan sebelumnya, nilai IC50 pelepah lebih baik dibandingkan rimpangnya yang telah dilaporkan oleh Ruslay
et al. (2007), IC50 = 62.7 ± 0.014 ppm dan menurut Batubara et al. (2010) 80.72 ± 0.21 ppm. Hal ini berarti bagian pelepah juga dapat dimanfaatkan sebagai obat.
Berdasarkan hasil uji, hanya ekstrak kloroform yang memiliki aktivitas baik sebagai antikanker dan antioksidan. Oleh
karena itu, ekstrak kasar kloroform digunakan sebagai sampel uji lanjutan. Minyak atsiri yang merupakan sampel teraktif potensi antikanker tidak dilakukan uji lanjutan, tetapi diidentifikasi komponen penyusunnya dengan GC-MS.
Identifikasi Komponen dalam Minyak Atsiri
Minyak atsiri dalam pelepah temulawak sangat berpotensi sebagai antikanker karena memiliki nilai LC50 23.05 ± 3.49 µg/mL. Komponen penyusun minyak atsiri tersebut, dianalisis dengan GC-MS. Hasilnya terangkum dalam Tabel 4 dengan kromato-gram pada Lampiran 10.
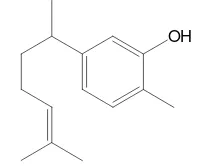
Senyawa penyusun minyak atsiri pelepah temulawak hampir sama dengan penyusun rimpangnya, tetapi dengan kadar yang sangat berbeda. Senyawa yang dominan pada pelepah ialah xantorizol (Gambar 3), sedangkan senyawa yang dominan dalam rimpang ialah diepi-α-sedrena dan α -kurkumena. Perbedaan komposisi senyawa diduga karena adanya perbedaan fungsional dari bagian tumbuhan tersebut.
OH
Gambar 3 Senyawa xantorizol.
Tabel 4 Komponen minyak atsiri dari pelepah temulawak Waktu retensi
(menit) Nama senyawa
Kadar (%) dalam pelepah
Kadar (%) dalam rimpang segar (Sukrasno 2012)*
4.65 Kamfor 0.44 5.61
4.87 Isoborneol 0.05 0.67
11.16 -Elemena 0.62 1.06
11.92 α-Bergamotena 0.04 3.61
12.10 trans-Kariofilena 1.17 1.10
12.55 -Elemena 0.28 1.48
13.36 -Farnesena 0.33 3.70
14.48 α-Kurkumena 9.61 19.43
15.47 Diepi-α-sedrena 3.97 29.95
17.02 Germakrena B 1.47 4.42
22.28 Germakron 8.69 3.51
24.64 Xantorizol 29.87 7.10
8
Xantorizol dikenal memiliki aktivitas antikanker in vitro dan in vivo. Hong dan Sirat (2003) menyatakan bahwa xantorizol memiliki toksisitas terhadap A. salina (LC50 = 25.91 ppm) dan sitotoksisitas terhadap sel lestari leukimia HL-60 (IC50 = 0.4 ppm). Oleh karena itu, aktivitas yang sangat besar dari minyak atsiri pelepah temulawak sebagai antikanker diduga tidak terlepas dari peranan senyawa xantorizol yang merupakan komponen dominan dalam minyak tersebut (Tabel 3). Selain xantorizol, senyawa yang memiliki peran sebagai antikanker yaitu kamfor, -elemena, dan α-kurkumena (Duke 2012). Namun, nilai LC50 masing-masing senyawa tersebut belum diketahui.
Penentuan Eluen Terbaik dengan KLT
Kromatografi lapis tipis (KLT) digunakan untuk pemisahan ekstrak pekat kloroform. Fase diam yang digunakan adalah silika gel G60F254, sedangkan eluen tunggal yang digunakan ialah eter, etil asetat, aseton, butanol, asam asetat, metanol, diklorometana, n-heksana, toluena, dan kloroform. Berdasarkan hasil kromatogram pada pelat KLT (Gambar 4), eluen n-heksana dan toluena tidak memberikan noda karena eluen tidak cukup besar kepolarannya sehingga sampel bersifat lebih polar dari eluen. Aseton, butanol, asam asetat, dan metanol menghasilkan noda berekor namun noda masih dapat terelusi pada akhir elusi (noda berada di atas) menunjukkan bahwa sampel kurang bersifat polar terhadap eluen-eluen tersebut. Eluen eter, etil asetat, diklorometana, dan kloroform bersifat semipolar sehingga dapat memberikan lebih banyak noda dari eluen sebelumnya. Eluen eter memberikan 5 noda dengan nilai Rf sedang sampai besar. Hal ini berarti sampel masih bersifat kurang polar terhadap eter. Diklorometana memberikan 5 noda dengan keterpisahan noda yang kurang baik. Etil asetat memberikan 6 noda dengan nilai Rf kecil sampai besar. Oleh karena itu, kepolaran sampel sudah mirip dengan eluen, namun masih belum memberikan jumlah noda yang banyak.
Eluen yang memberikan pemisahan terbaik adalah eluen kloroform. Eluen ini dapat memisahkan 12 noda dari ekstrak serta adanya noda pada awal dan akhir elusi menunjukkan bahwa sampel bersifat semipolar dan cocok terelusi oleh eluen kloroform. Namun, untuk noda dengan Rf kecil (senyawaan polar) masih terdapat beberapa noda yang belum terpisahkan dengan baik. Oleh karena itu, dibuat
komposisi campuran eluen antara kloroform dengan eluen yang tidak memberikan pemisahan yaitu n-heksana (Gambar 4).
Gambar 4 Kromatogram ekstrak kloroform pelepah temulawak dengan eluen tunggal: eter (a), etil asetat (b), aseton (c), butanol (d), asam asetat (e), metanol (f), diklorometana (g), n-heksana (h), toluena (i), dan kloroform (j).
Komposisi campuran eluen yang dibuat ialah kloroform:n-heksana 6:3; 3:2; 8:1; 4:1; 9:1; 9:2; dan 10:1. Eluen campuran yang memberikan pemisahan yang baik ialah kloroform:n-heksana 9:2 (Gambar 5). Eluen ini memisahkan 12 noda dari ekstrak dengan keterpisahan senyawaan polar yang baik.
Gambar 5 Kromatogram ekstrak kloroform pelepah temulawak dengan eluen campuran kloroform:n -heksana 6:3 (a); 6:4(b); 8:1 (c); 8:2 (d); 9:2 (e); 9:1 (f); dan 10:1 (g).
Fraksionasi Kromatografi Kolom (KK)
9
100%, (n-heksana:kloroform 9:1, 8:2, 7:3, 6:4, 5:5, 4:6, 3:7, 2:9, 1:9), dan kloroform 100%. Setelah dielusi dengan eluen kloroform 100%, masih ada pita yang belum keluar dari kolom. Oleh karena itu, elusi gradien dilanjutkan dengan campuran kloroform-metanol dengan komposisi sebagai berikut: kloroform 100%, (kloroform:metanol 9:1, 8:2, 7:3, 6:4, 5:5, 4:6, 3:7, 2:8, 1:9), dan metanol 100%. Diperoleh 187 eluat yang kemudian digabung berdasarkan pola KLT menjadi fraksi-fraksi KK. Penggabungan fraksi ini didasarkan pada kesamaan jumlah noda dan nilai Rf yang sama.
Diperoleh 11 fraksi (F1–F11) (Lampiran 11). Selanjutnya, 11 fraksi tersebut dielusi dengan eluen terbaik kloroform:n-heksana 9:2 untuk melihat bentuk nodanya (Gambar 6).
Gambar 6 Kromatogram hasil fraksionasi dan ekstrak kasar kloroform pelepah temulawak.
Potensi Antikanker dan Antioksidan Fraksi
Uji pendahuluan aktivitas antioksidan fraksi F1–F11 dilakukan dengan metode KLT bioautografi. Noda disemprot dengan larutan DPPH 125 µM.
Gambar 7 Kromatogram hasil fraksionasi, ekstrak kasar kloroform pelepah temulawak, dan asam askorbat (kontrol positif) yang disemprot larutan DPPH.
Nilai IC50 fraksi dapat ditentukan dengan menggunakan spektrofotometer UV-Vis
96-well plate. Fraksi 1 tidak diujikan karena tidak memiliki aktivitas antioksidan berdasarkan metode KLT bioautografi. Deret konsentrasi yang digunakan ialah 13.3; 16.7; 33.3; 66.7; dan 100 µg/mL. Berdasarkan nilai IC50, fraksi yang aktif antioksidan ialah fraksi 2, 8, dan 9 (Tabel 5). Fraksi teraktif yang memiliki nilai IC50 terendah ialah F9. Berdasarkan uji Duncan, aktivitas ketiga fraksi tersebut tidak berbeda nyata dalam menghambat 50% radikal bebas. Bila dibandingkan dengan kontrol positif (asam askorbat), ketiga fraksi tersebut tidak seaktif asam askorbat dan nilai IC50-nya berbeda nyata.
Tabel 5 Potensi antikanker dan antioksidan hasil fraksionasi dan ekstrak kasar kloroform pelepah temulawak Fraksi LC50 (µg/mL) IC50 (µg/mL)
F1 553.23 ± 20.27e *)
F2 549.25 ± 22.24e 100.77 ± 27.43b F3 316.97 ± 15.86c >100 F4 457.28 ± 11.61d >100 F5 253.33 ± 10.84ab >100 F6 219.37 ± 7.61a >100 F7 > 1000 >100
F8 571.19 ± 65.52ef 118.41 ± 29.03b F9 522.95 ± 43.35e 79.57 ± 8.96b F10 606.40 ± 29.17f >100 F11 292.17 ± 7.58bc >100 Asam
askorbat - 2.01 ± 0.12 a
Ekstrak
kloroform 370.69 ± 22.69 46.41 ± 15.49 Keterangan: * = tidak diuji; asam askorbat = kontrol positif antioksidan. Sampel dengan abjad yang sama tidak berbeda nyata berdasarkan uji Duncan pada P = 0.05
Nilai LC50 fraksi ditentukan berdasarkan metode BSLT. Hampir seluruh fraksi (F1– F11) berpotensi sebagai antikanker karena memiliki nilai LC50 < 1000 µg/mL (Tabel 5). Hanya fraksi 7 yang tidak berpotensi sebagai antikanker. Nilai LC50 F3, F5, F6, dan F11 lebih besar daripada ekstrak kasarnya. Hal ini berarti pemurnian ekstrak kasar cocok untuk aktivitas antikanker. Sebaliknya, aktivitas antioksidan fraksi teraktif (F9) lebih kecil dibandingkan dengan ekstrak kasarnya. Hal ini diduga erat kaitannya dengan peran penting efek sinergis fraksi-fraksi tersebut dalam sampel pelepah temulawak.
F1 F2 F3 F4 F5 F6 F7 F8 F9 F10 F11 E
10
Berdasarkan Tabel 2, ekstrak kasar kloroform mengandung flavonoid, alkaloid, steroid, dan triterpenoid yang diduga berperan dalam potensi aktivitas antikanker dan antioksidan. Oleh karena itu, seluruh fraksi diuji fitokimia kembali untuk keempat metabolit sekunder tersebut.
Uji flavonoid dilakukan dengan mengamati warna noda pada KLT yang dipaparkan uap amonia. Perubahan warna noda terjadi pada ekstrak kasar, F2, F4–F10 (Lampiran 12). Noda yang berwarna kuning berubah menjadi kuning kecokelatan setelah dipaparkan uap amonia untuk F4, F5, F6, F7, F9, dan F10. Noda takberwarna dari F2 dan F8 berubah menjadi kuning setelah dipaparkan uap amonia. Menurut Harborne (1987), noda yang berwarna berubah warna jika dipaparkan uap amonia dari kuning murup menjadi kuning kecokelatan merupakan golongan flavonol, sedangkan noda takberwarna yang berubah menjadi kuning merupakan golongan flavanon dan dihidroflavonol-7-glikosida. Oleh karena itu, secara umum F2, F4–F10 merupakan golongan flavonoid.
Uji alkaloid dilakukan dengan mengamati warna noda pada KLT yang disemprotkan pereaksi Dragendorf. Berdasarkan Lampiran 13, dihasilkan noda berwarna cokelat jingga berlatar belakang coklat pada ekstrak kasar, F8–F10. Menurut Harborne (1987), bercak cokelat jingga berlatar belakang kuning positif mengandung alkaloid. Oleh karena itu, ekstrak kasar, F8–F10 diduga mengandung alkaloid.
Steroid dan triterpenoid diuji berdasarkan pengamatan warna noda pada KLT yang disemprotkan pereaksi Lieberman Buchard. Dihasilkan noda berwarna merah pada F2, F3, F4, F5, dan F6, serta noda hijau pada F5, F6, dan F10 (Lampiran 14). Menurut Harborne (1987), bercak hijau positif mengandung steroid, sedangkan merah positif triterpenoid. Oleh karena itu, triterpenoid terkandung dalam F2–F6 serta steroid dalam F5, F6, dan F10. Ekstrak kasar tidak menunjukkan steroid dan triterpenoid. Hal ini diduga karena jumlah steroid dan triterpenoid yang terkandung dalam ekstrak yang ditotolkan lebih kecil dari limit deteksi uji ini.
Berdasarkan data nilai IC50 (Tabel 5), F2, F8, dan F9 aktif antioksidan, sedangkan berdasarkan nilai LC50 (Tabel 5), F3, F5, F6, dan F11 memiliki potensi antikanker yang baik dibandingkan dengan ekstrak kasarnya.
Fraksi yang aktif antioksidan diduga mengandung flavonoid, alkaloid, dan saponin/tanin. Hal ini berdasarkan letak noda yang mengalami pemudaran warna ungu (Gambar 8) jika dibandingkan dengan uji fitokimia lanjutan (Tabel 6) flavonoid, alkaloid, serta steroid dan triterpenoid. Flavonoid (pada ekstrak kloroform, F2, F4, F5, F7—F9), dan alkaloid (pada F8—F10) aktif antioksidan. Semua steroid yang teridentifikasi pada F5, F6, dan F10 tidak aktif antioksidan. Walaupun noda triterpenoid pada F4—F6 memudar, triterpenoid diduga tidak berperan sebagai antioksidan karena noda pada F2 dan F3 tidak memudar pada uji KLT bioautografi. Aktivitas ini diduga karena noda pada F4—F6 teridentifikasi juga sebagai flavonoid. Terdapat noda yang mengalami pemudaran warna tetapi bukan flavonoid, alkaloid, triterpenoid, atau steroid. Diduga noda tersebut mengandung saponin/tanin.
11
Tabel 6 Kandungan senyawa metabolit sekunder dan aktivitas antioksidan hasil fraksionasi ekstrak kloroform pelepah temulawak
Sampel Kandungan senyawa metabolit sekunder Rf
Anti-oksidan Sampel
Kandungan senyawa metabolit sekunder Rf Anti-oksidan E
Flavonoid 0.08, 0.03 + F5 Steroid 0.71 -
Alkaloid 0.03 +
F6
Flavonoid 0.08, 0.12 +
Saponin/tanin
0.11, 0.14, 0.17, 0.21, 0.24, 0.27,
0.30, 0.37
+ Saponin/tanin
0.29, 0.35, 0.45,0.58,
0.82
-
Saponin/tanin 0.44, 0.54, 0.89 - Triterpenoid 0.08, 0.12 +
F1 Saponin/tanin 0.12, 0.93 - Flavonoid 0.15, 0.18 -
F2
Flavonoid 0.88 + Steroid 0.70 -
Saponin/tanin 0.58 +
F7 Flavonoid 0.07 +
Triterpenoid 0.23 - Flavonoid 0.14 -
Saponin/tanin 0.73 -
F8
Alkaloid 0.05, 0.06,
0.09 +
F3 Saponin/tanin
0.05, 0.08, 0.11, 0.15, 0.18, 0.23, 0.53, 0.61, 0.65
+ Flavonoid 0.13 +
Triterpenoid 0.30, 0.77 -
F9
Alkaloid 0.03 +
F4
Flavonoid 0.10, 0.14, 0.17,
0.20 + Flavonoid 0.13 +
Triterpenoid 0.29 - Saponin/tanin 0.19 +
Saponin/tanin 0.23 + Saponin/tanin 0.92 -
Saponin/tanin 0.33, 0.41, 0.47,
0.55, 0.59, 0.89 -
F10
Alkaloid 0.00 +
F5
Flavonoid 0.08, 0.12, 0.15,
0.18 + Flavonoid 0.03, 0.06 -
Triterpenoid 0.08, 0.12, 0.15 + Saponin/tanin 0.75 -
Saponin/tanin 0.21, 0.26 + Saponin 0.90 -
Triterpenoid 0.33 - F11 *) 0.00 +
Keterangan: * = tidak diuji karena jumlah sampel tidak mencukupi, E = ekstrak kloroform
Identifikasi Senyawa
Fraksi teraktif antioksidan dan masih berpotensi antikanker (F9) merupakan fraksi yang diidentifikasi serapannya dengan FTIR. Senyawa dalam fraksi 9 diduga merupakan golongan flavonol, yakni adanya gugus –OH, –CH, –OCH3, C=O, C–O dan C=C aril terkonjugasi (Tabel 7) sebagai penyusun utama kerangka flavonol. Dugaan didukung oleh hasil uji fitokimia lanjutan yang telah dipaparkan sebelumnya. Daerah sidik jari tidak dianalisis karena sulit untuk diinterpretasikan. Intensitas puncak bergantung pada kandungan gugus tersebut dalam senyawa tersebut. Bentuk pita yang melebar diakibatkan oleh adanya interaksi ikatan hidrogen. Meskipun dalam F9 teridentifikasi golongan flavonoid dan alkaloid, hanya teridentifikasi golongan flavonoid pada spektrum IR (Lampiran 15).
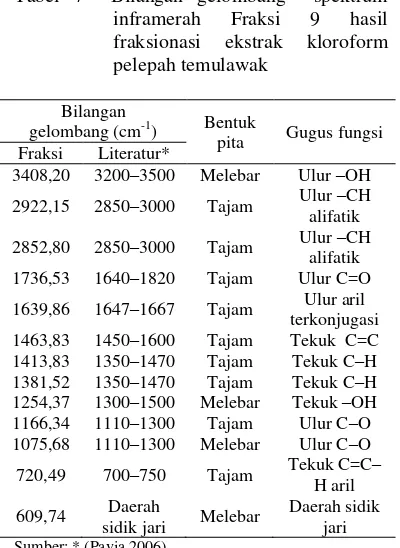
Tabel 7 Bilangan gelombang spektrum inframerah Fraksi 9 hasil fraksionasi ekstrak kloroform pelepah temulawak
Bilangan
gelombang (cm-1) Bentuk
pita Gugus fungsi
Fraksi Literatur*
3408,20 3200–3500 Melebar Ulur –OH
2922,15 2850–3000 Tajam Ulur –CH
alifatik
2852,80 2850–3000 Tajam Ulur –CH
alifatik
1736,53 1640–1820 Tajam Ulur C=O
1639,86 1647–1667 Tajam Ulur aril
terkonjugasi
1463,83 1450–1600 Tajam Tekuk C=C
1413,83 1350–1470 Tajam Tekuk C–H
1381,52 1350–1470 Tajam Tekuk C–H
1254,37 1300–1500 Melebar Tekuk –OH
1166,34 1110–1300 Tajam Ulur C–O
1075,68 1110–1300 Melebar Ulur C–O
720,49 700–750 Tajam Tekuk C=C–
H aril
609,74 Daerah
sidik jari Melebar
Daerah sidik jari
SIMPULAN DAN SARAN
Simpulan
Ekstrak kloroform menunjukkan potensi antikanker terhadap A. salina (LC50: 370.69 ± 22.69 µg mL-1) dan minyak atsiri (LC50: 23.05 ± 3.49 µg mL-1). Ekstrak etil asetat dan kloroform memiliki aktivitas antioksidan (IC50: 46.41 ± 15.49 µg mL-1 dan 52.72 ± 3.46 µg mL-1) namun tidak sekuat asam askorbat sebagai kontrol positifnya (IC50: 1.80 ± 0.33 µg mL-1). Fraksionasi ekstrak kloroform diperoleh 11 fraksi (F1–F11) dengan F9 sebagai fraksi teraktif. Nilai LC50 F9 sebesar 522.95 ± 43.35 µg mL-1 dan IC50 sebesar 79.57 ± 8.96 µg mL-1. Berdasarkan uji identifikasi FTIR terhadap F9, diduga fraksi tersebut golongan flavonoid dan berpotensi sebagai antikanker dan antioksidan.
Saran
Dibutuhkan pengujian lanjutan F5, F6, dan F11 untuk mengetahui aktivitas antikanker-nya. Pengujian fitokimia lanjutan F1, F7, dan F11 diperlukan untuk mengetahui peranan metabolit sekunder terhadap bioaktivitasnya. Penentuan kembali eluen terbaik F9 serta pemisahan dengan KCKT preparatif dibutuhkan untuk pemurnian fraksi yang aktif antioksidan dan antikanker. Senyawa murni yang diperoleh perlu diidentifikasi dengan NMR agar diketahui senyawa yang berperan terhadap kedua bioaktivitas tersebut.
DAFTAR PUSTAKA
[AOAC] Association of Official Analytical Chemist. 2007. Official Methods of AOAC International. Revisi ke-2. Volume ke-1. Maryland: AOAC International.
Badarinath AV, Mallikarjuna RK, Chetty CMS, Ramkanth S, Rajan TVS, Gnanaprakash K. 2010. A review on in-vitro antioxidant methods: comparisons, correlations and considerations.
International Journal of PharmTech Research 2(2): 1276-1285.
Batubara I, darusman LK, Mitsunaga T, Rahminiwati M, Djauhari E. 2010. Potency of Indonesian Medicinal Plants as Tyrosinase Inhibitor and antioxidant agent.
Journal of Biological Science 10 (2): 138-144.
[BPOM] Badan Pengawas Obat dan Makanan. 2004. Monografi Ekstrak Tumbuhan Obat Indonesia. Jakarta: BPOM RI.
Cheah YH, Nordin FJ, Sarip R, Tee TT, Azimahtol HLP, Sirat HM, Rashid BSS, Abdullah NR, Ismail Z. 2009. Combined xanthorrhizol-curcumin exhibits syner-gistic growth inhibitory activity via apoptosis induction in human breast cancer cells MDA-MB-231. Cancer Cell International 9(1): 1-12.
Duke. 2012. Phytochemical and ethnobotanical databases [terhubung berkala]. http://www.google.co.id/url?sa= t&rct=j&q=alphacurcumene+substance+as +anticancer+antitumor&source=web&cd= 14&ved=0CE0QFjADOAo&url=http%3A %2F%2Fhuilesutiles.eu%2Fdocs%2Fging er.pdf. [01 Jul 2012].
Finney DJ. 1971. Probit Analysis. Ed. ke-3. England: Cambridge University Press.
Frank CL. 1995. Toksikologi Dasar. Edi, penerjemah. Jakarta: UI Press. Terjemahan dari: Basic of Toxicology.
Hadipoentyanti E, Syahid Sf. 2007. Respon temulawak (Curcuma xanthorrhiza Roxb.) hasil rimpang kultur jaringan generasi kedua terhadap pemupukan. Littri
13(3):106-110.
Harborne JB. 1987. Metode Fitokimia: Penuntun Cara Modern Menganalisis Tumbuhan. Ed ke-2. Bandung: ITB.
Hong NM, Sirat H. 2004. Synthesis of several bisabolane sesquiterpenoids from xanthorrhizol isolated from C. xanthorrhiza and their bioactivities. The 4th Annual Seminar of National Science Fellowship. 181-186.
Khurniasari DW. 2004. Potensi antikanker senyawa bioaktif ekstrak kloroform dan metanol makroalga Sargassum duplicatum
J. Agardh [skripsi]. Yogyakarta: Fakultas Biologi, Universitas Gadjah Mada.
13
Kumulawati E. 2005. Peningkatan daya guna tanaman obat. [terhubung berkala] http://www.kompas.com/kompas/rubrik/il mu_pengetahuan [01 Nov 2011].
Lupea AX, Chambire D, Iditoiou C, Szabro MR. 2006. Short communication improved DPPH determination for antioxidant activity spectrophotometric assay. Chem Pap 3: 214-216.
Marston A. 2011. Thin-layer chromatography with biological detection in phytochemistry. Journal of Chromatography A 1218: 2676-2683.
Meyer BN, Ferrigni NR, Putnam JE, Jacobsen LB, Nichols DE, McLaughlin JL.1982. Brine Shrimps: A convenient general bioassay for active plant constituent.
Planta Medica 45: 31-34.
Molyneux P. 2004. The use of stable free radical dyphenilpicryl-hydrazil (DPPH) for estimating antioxidant activity. J.Sci. Technol: 211-219.
Muchtaridi, Apriyantono A, Subarnas A, Budijanto S. 2003. Analysis of volatile active compounds of essential oils of some aromatical plants possessing inhibitory properties on mice locomotor activity.
Proceeding in International Symposium on Biomedicine. Bogor: Biopharmaca Centre IPB, 18-19 September 2003.
Nurhayati APD, Nurlita A, Rachmat F. 2006. Uji toksisitas ekstrak Euchema alvarezil
terhadap Artemia sallina sebagai studi pendahuluan potensi antikanker. Surabaya: Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Teknologi Sepuluh November.
Pavia, Donal L, Lampman GM, George RK, Randall GE. 2006. Introduction to Organic Laboratory Techniques. USA: Thomson Brooks-Cole.
Qader SW, Abdulla MA, Chua LS, Najim N, Zain MM, Hamdan S. 2011. Antioxidant, total phenolic content and cytotoxicity evaluation of selected Malaysian plants.
Molecules 16: 3433-3443.
Rahardjo M, Ajijah N. 2007. Pengaruh pemupukan organik terhadap produksi dan mutu tiga nomor harapan temulawak (Curcuma xanthorriza) di Cibinong Bogor. Bul. Littro XVIII (1): 29-38.
Ravindran PN, Babu KN, Sivaraman K. 2007.
Turmeric: The Genus Curcuma. New York: CRC press.
Rouessac F, Rouessac A. 1994. Chemical Analysis Modern Instrumentation Methods and Techniques 2nd. USA: John Wiley & Sons, Ltd.
Rukmana R. 1995. Temulawak Tanaman Rempah dan Obat. Yogyakarta: Kanisius.
Ruslay S, Abas F, Shaari K, Zainal Z, Maulidiani, Sirat H, Israf DA, Lajis NH. 2007. Characterization of the components present in the active fractions of health ginger (Curcuma xanthorrhiza and
Zingiber zerumbet) by HPLC-DAD-ESIMS. Food chemistry 104: 1183-1191.
Salazar AR, Alejandro RLL, Lopez AJ, Alicia AGB, Waksman TN. 2011. Antimicrobial and antioxidant activities of plants from northeast of Mexico. Evidence-Based Complementary and Alternative Medicine
2011: 1-6.
Sidik. 2006. Temulawak cegah kanker payudara. [terhubung berkala]
http://www.pikiran-rakyat.com/rubrik/bandung-raya [01 Nov 2011].
Sukrasno, Kartika, Fidrianny I, Elfahmi, Anam K. 2012. Influence of storage on the volatile oil content of Curcuma rhizome.
Research Journal of Medicinal Plant : 1-7.
Winarno FG. 1992. Kimia Pangan dan Gizi. Jakarta:Gramedia.
15
Lampiran 1 Bagan alir penelitian
Pelepah temulawak
Dipotong kecil-kecil, dikeringkan dalam oven 50
oC, digiling,
diayak 40 mesh
Serbuk pelepah temulawak
Penentuan kadar air dan kadar abu
% air, % abu
Distilasi air
Maserasi bertingkat (pelarut:
n
-heksana, kloroform, etil
astetat, metanol, dan air)
Minyak atsiri Ekstrak kasar
n
-heksana, kloroform, etil astetat, metanol, dan air
Uji fitokimia, BSLT, DPPH
Ekstrak teraktif
KLT dengan berbagai eluen
Kromatografi kolom dengan eluen
terbaik
Fraksi I
Fraksi II
Fraksi III
Fraksi ke-n
Uji BSLT, bioautografi, DPPH
Fraksi teraktif
Uji fitokimia,
Identifikasi senyawa:
ekstrak: FTIR, atau
minyak atsiri: GC-MS
16
Lampiran 2 Isolasi minyak atsiri pelepah temulawak
Irisan halus pelepah temulawak
Distilasi air dengan
akuades 1:2 (6 jam)
Distilat
Dipartisi dengan etil asetat
Minyak atsiri temulawak dalam fase etil asetat
Diuapkan dengan penguap putar
17
Lampiran 3 Kadar air serbuk pelepah temulawak
Ulangan
Bobot sampel awal
(g)
Bobot kosong cawan (g)
Bobot akhir (g)
Bobot akhir sampel (g)
Kadar air (%)
1 2.0003 3.7517 5.5188 1.7671 11.66 2 2.0004 3.8257 5.5941 1.7684 11.60 3 2.0002 3.8639 5.6324 1.7685 11.58
Rerata 11.61 ± 0.04
Contoh perhitungan :
Ulangan 1
Kadar air (%) =
BobotBobotsampelsampelawalawalakhir100
Kadar air (%) =
Rerata (%) =
SD =
√∑
| ̅|
=
√
Lampiran 4 Kadar abu serbuk pelepah temulawak
Ulangan
Bobot sampel awal
(g)
Bobot kosong cawan (g)
Bobot akhir (g)
Bobot akhir sampel (g)
Kadar abu (%)
1 2.0025 28.1597 28.3355 0.1758 8.78 2 2.0025 25.2103 25.3850 0.1747 8.72 3 2.0022 20.1698 20.3479 0.1781 8.90
Rerata 8.80 ± 0.09
Contoh perhitungan :
Ulangan 1
Kadar abu (%) =
BobotsampelakhirBobotsampelawal
100
Kadar abu (%) =
Rerata (%) =
SD =
√∑
| ̅|18
Lampiran 5 Rendemen ekstrak kasar pelepah temulawak
Ekstrak Ulangan
Bobot sampel awal g)
Kadar air (%)
Bobot
ekstrak (g) Rendemen
(%) Rerata (%)
n-heksana
1 24.9999 11.61 0.3340 1.51
1.48 ± 0.03 2 25.0142 11.61 0.3231 1.47
3 25.0033 11.61 0.3246 1.46
Kloroform
1 24.9999 11.61 0.3443 1.56
1.53 ± 0.03 2 25.0142 11.61 0.3378 1.51
3 25.0033 11.61 0.3338 1.53
Etil asetat
1 24.9999 11.61 0.1205 0.55
0.57 ± 0.07 2 25.0142 11.61 0.1439 0.52
3 25.0033 11.61 0.1150 0.65
Metanol
1 24.9999 11.61 3.7135 16.81
16.47 ± 0.39 2 25.0142 11.61 3.5468 16.56
3 25.0033 11.61 3.6610 16.05
Air
1 24.9999 11.61 1.6943 8.24
7.97 ± 0.25 2 25.0142 11.61 1.7471 7.90
3 25.0033 11.61 1.8890 7.67
Contoh perhitungan
Ulangan 1
Rendemen (%) =
BobotsampelBobotawalsampelakhir1 kadarair
100
=
= 1.51%
Rerata (%)
=
SD
=
√∑
| ̅|
19
Lampiran 6 Potensi antikanker oleh ekstrak kloroform pelepah temulawak
Konsentrasi (µg/mL)
Jumlah larva mati % kematian Ulangan
1
Ulangan 2
Ulangan 3
Ulangan 1
Ulangan 2
Ulangan 3
0 0 0 0 0 0 0
200 2 1 1 20 10 10
250 1 2 2 10 20 20
300 2 5 2 20 50 20
350 5 5 5 50 50 50
400 6 6 5 60 60 50
LC50 375 346.15 390.91
Rerata LC50 370 ± 22.69
Contoh perhitungan
Ulangan 1
Konsentrasi ekstrak 200 µg/mL
% Kematian =
jumlahjumlahlarvalarvamatiuji100
=
Persamaan regresi linear: y = 0,24 x
–
40
LC
50diperoleh saat y = 50, oleh karena itu:
50 = 0.24 x
–
40
x = (50+40)/0.24 = 375 µg/mL
Rerata LC
50=
= 370.69 µg/mL
SD =
√∑
| ̅|
=
√
20
Lampiran 7 Aktivitas antioksidan oleh ekstrak kloroform pelepah temulawak
Konsentrasi (µg/mL)
Absorbans % inhibisi Ulangan 1 Ulangan 2 Ulangan 1 Ulangan 2
Blangko 0.342 0.342 - -
10 0.318 0.229 10.17 47.88
50 0.239 0.243 43.64 41.95
100 0.139 0.152 86.02 80.51 200 0.133 0.162 88.56 76.27 300 0.149 0.150 81.78 81.36 400 0.188 0.174 65.25 71.19
IC50 57.36 35.45
Rerata IC50 46.41 ± 15.49
Contoh perhitungan
Ulangan 1
Konsentrasi ekstrak 10 µg/mL
% inhibisi =
=
(
)
= 10.17%
Persamaan regresi linear: y = 0.8429 x + 1.6531
LC
50diperoleh saat y = 50, oleh karena itu:
50 = 0.8429 x + 1.6531
x = (50-1.6531)/0.8429 =57.36 µg/mL
Rerata IC
50=
= 46.41 µg/mL
SD =
√∑
| ̅|
=
√
= 15.49 µg/mL
Lampiran 8 Larutan sampel ekstrak pelepah temulawak setelah diinkubasi 37
oC
selama 30 menit
Keterangan:
Sampel ekstrak
n
-heksana (a); kloroform (b); etil asetat (c); metanol (d); air (e);
minyak atsiri (f); kontrol positif asam askorbat (g); dan blangko (h).
a b
c d e
f g
21
Lampiran 9 Uji Duncan nilai LC
50hasil fraksionasi ekstrak kloroform pelepah
temulawak
Variabel N
Subset for alpha = 0.05
a b c d e F
F6 3 2.1937E2
F5 3 2.5333E2 2.5333E2
F11 3 2.9216E2 2.9216E2
F3 3 3.1697E2
F4 3 4.5728E2
F9 3 5.2295E2
F2 3 5.4925E2
F1 3 5.5322E2
F8 3 5.7119E2 5.7119E2
F10 3 6.0640E2
Sig. .170 .119 .311 1.000 .077 .156
Lampiran 10 Kromatogram minyak atsiri pelepah temulawak dengan GC-MS
Kelimpahan (Y)
22
Lampiran 11 Rendemen hasil fraksionasi kolom ekstrak kloroform pelepah
temulawak
Fraksi Eluen Warna Bobot fraksi (g) Rendemen fraksi (%)
1 H Kuning ++++ 0.1126 13.25
2
H H:K (9:1) H:K (8:2) H:K (7:3) H:K (6:4) H:K (5:5) H:K (4:6)
Takberwarna 0.0389 4.58
3 H:K (4:6) Kuning kehitaman +++ 0.0609 7.16
4 H:K (4:6) Kuning + 0.0615 7.24
5 H:K (3:7) Kuning ++ 0.0373 4.39
6
H:K (2:9) H:K (1:9)
K
Kuning + 0.0327 3.85
7 K:M (9:1) Kuning keemasan ++ 0.0859 10.11 8 K:M (9:1) Kuning kehitaman ++++ 0.2514 29.58
9 K:M (9:1)
K:M (8:2) Kuning keemasan +++ 0.0574 6.75
10 K:M (8:2)
K:M (7:3) Kuning ++ 0.0502 5.91
11
K:M (4:6) K:M (3:7) K:M (2:8) K:M (1:9)
M
Kuning + 0.0357 4.20
Jumlah (%) 97.00
23
Lampiran 12 Uji fitokimia lanjutan flavonoid hasil fraksionasi ekstrak kloroform
pelepah temulawak
Keterangan: (dari kiri ke kanan: Ekstrak kasar, F1, F2, F3, F4, F5, F6, F7, F8, F9,
F10, dan ekstrak kasar).
Lampiran 13 Uji fitokimia lanjutan alkaloid hasil fraksionasi ekstrak kloroform
pelepah temulawak
Keterangan: (dari kiri ke kanan: Ekstrak kasar, F1, F2, F3, F4, F5, F6, F7, F8, F9,
F10, dan ekstrak kasar).
E F1 F2 F3 F4 F5 F6 F7 F8 F9 F10 E
24
Lampiran 14 Uji fitokimia lanjutan steroid dan triterpenoid hasil fraksionasi
ekstrak kloroform pelepah temulawak
Keterangan: (dari kiri ke kanan: Ekstrak kasar, F1, F2, F3, F4, F5, F6, F8, F9,
F10, dan ekstrak kasar).
25