ABSTRAK
UJI PATOGENISITAS JAMURAspergillussp.TERHADAP HAMA PENGISAP POLONG KEDELAI (Riptortus linearis) DI LABORATORIUM
Oleh:
FRANSISKA DINA MARLINAWATI
Salah satu penyebab produktivitas kedelai masih rendah adalah masih tingginya
serangan hama di pertanaman kedelai, seperti hama pengisap polong kedelai
(Riptortus linearis). Jamur entomopatogen adalah salah satu agensia hayati yang
mempunyai prospek yang cukup baik untuk mengendalikan OPT. Jamur dari
genusAspergillusbanyak dilaporkan berperan sebagai patogen pada beberapa serangga hama. Penelitian ini bertujuan menguji patogenisitasAspergillussp. terhadapR. linearisdi laboratorium. Perlakuan disusun dalam Rancangan
Kelompok (RK). Pengelompokan dilakukan berdasarkan waktu aplikasi suspensi
Aspergillussp. ke serangga uji. Perlakuan yang diuji adalah kerapatan spora: 105, 106, 107, 108spora/ml dan kontrol. Hasil penelitian menunjukkan bahwa jamur
Aspergillussp. dapat menginfeksi dan menimbulkan kematianR. linearis. MortalitasR. linearistertinggi terjadi pada perlakuan kerapatan spora 108 spora/ml sebesar 46,7%.
UJI PATOGENISITAS JAMURAspergillussp.TERHADAP HAMA PENGISAP POLONG KEDELAI (Riptortus linearis) DI LABORATORIUM
Oleh
Fransiska Dina Marlinawati
Skripsi
Sebagai Salah Satu Syarat untuk Mencapai Gelar SARJANA PERTANIAN
Pada
Jurusan Agroteknologi
Fakultas Pertanian Universitas Lampung
FAKULTAS PERTANIAN UNIVERSITAS LAMPUNG
UJI PATOGENISITAS JAMURAspergillussp.TERHADAP HAMA PENGISAP POLONG KEDELAI (Riptortus linearis) DI LABORATORIUM
(Skripsi)
Oleh
FRANSISKA DINA MARLINAWATI
FAKULTAS PERTANIAN UNIVERSITAS LAMPUNG
v
DAFTAR GAMBAR
1. Struktur jamurAspergillusmirip dengan aspergillum. ... 11 2. Struktur jamurAspergillus. ... 12 3. Perbedaan bentuk koloni jamur umur 3 minggu di media PDA
dalam cawan Petri berdiameter 9 cm. ... 14
4. Perbedaan spora jamur isolat Tegineneng dan Trimurjo secara
mikroskopik. ... 15
5. Perbandingan hasil pengamatan stuktur jamur isolat Trimurjo
dengan literatur. ... 16
6. Hasil pengamatan jamur padacadaver R. linearispada uji
pendahuluan. ... 18
7. Perkecambahan spora jamurAspergillussp. 48 jam setelah inkubasi dalam akuades pada pengamatan di mikroskop dengan perbesaran 1.000×. ...
25
8 Grafik mortalitas harianR. linearissetelah aplikasiAspergillussp.
sampai 14 HSA. ... 27
9 Perbandingancadaver R. linearissebelum dan sesudah inkubasi
dalam cawan Petri berisi tisu yang dilembabkan. ... 30
10. Perkembangan kulturAspergillussp. di media PDA. ... 32 11 Struktur jamurAspergillussp. hasil reisolasi daricadaver R.
linearis. ... 33 12 Struktur jamurAspergillussp. dalam pengamatan di bawah
vi
13 Spora jamurAspergillussp. berbentuk bulat dan tersusun seperti
rantai. ... 45
14 SporaAspergillussp. dalam bidang penghitungan di
haemocytometer. ... 46 15. Bidang pengamatan pada kotak kecil haemocytometerdengan pola
pengamatan berbentuk silang (X) dan arah pengamatan diagonal. .. 46
16 SporaAspergillussp. yang berkecambah selama 48 jam pada
inkubasi dalam air dengan perbesaran 400×. ... 47
17. Tanaman kacang panjang dan kedelai untukrearing R. linearis. .... 47 18. NimfaR. linearisinstar 2 dalam stoples pemeliharaan. ... 48 19. Pelembabancadaver R. linearisdi dalam cawan Petri. ... 48 20. Cadaver R. linearisyang bergejala terinfeksiAspergillussp. dalam
i
DAFTAR ISI
DAFTAR TABEL ………... iii
DAFTAR GAMBAR ………...………….. v
I. PENDAHULUAN ………..……... 1
1.1 Latar Belakang dan Masalah ... 1
1.2 Tujuan Penelitian ... 4
1.3 Kerangka Pemikiran ... 5
1.4 Hipotesis ... 7
II. TINJAUAN PUSTAKA ………...………….... 8
2.1 Penghisap Polong Kedelai (Riptortus linearis) ... 8
2.2 Jamur Entomopatogen ... 9
2.3 JamurAspergillus ... 10
III. BAHAN DAN METODE ... 13
3.1 Tempat dan Waktu Penelitian ... 13
3.2 Bahan dan Alat ... 13
3.3 Uji Pendahuluan ... 13
3.4 Metode Penelitian ... 18
3.5 Persiapan Penelitian ... 19
3.5.1 Perbanyakan serangga uji (R. linearis) ... 19
3.5.2 Pembutan mediaPotato Dextrose Agar(PDA) ... 20
ii
3.5.4 Pembuatan suspensiAspergillussp. ... 21
3.5.5 Perhitungan kerapatan sporaAspergillussp. ... 21
3.6 Pelaksanaan Penelitian ... 22
3.6.1 Uji viabilitasAspergillussp. ... 22
3.6.2 Uji patogenisitasAspergillussp. ... 23
3.6.2.1 Pengamatan gejala infeksi Aspergillus sp.pada R. linearis dan waktu kemunculan koloni jamur pada cadaver ... 3.6.2.2 Reisolasi Aspergillussp.dari cadaver ... 3.6.2.3 Persentase mortalitas R. linearis ... 23 23 24 3.7 Analisis Data ... 24
IV. HASIL DAN PEMBAHASAN ………...…………... 25
4.1 Viabilitas SporaAspergillussp. ... 25
4.2 MortalitasR. linearisSetelah AplikasiAspergillussp. ... 27
4.3 Gejala InfeksiAspergillussp. padaR. linearis ... 30
V. KESIMPULAN DAN SARAN …...………... 34
5.1 Kesimpulan ... 34
5.2 Saran ... 34
PUSTAKA ACUAN ... 35
iii
DAFTAR TABEL
1. MortalitasR. linearissetelah aplikasi isolat jamur Tegineneng
dan Trimurjo. ... 17
2. Waktu munculnya jamur padacadaver R. linearis setelah aplikasi
isolat jamur Tegineneng danTrimurjo. ... 17
3. Persentase perkecambahan sporaR. linearissetelah 48 jam
inkubasi dalam akuades. ... 26
4. MortalitasR. linearissetelah aplikasi suspensiAspergillussp. ... 28 5. Data mortalitasR. linearissetelah aplikasiAspergillussp. pada
kelompok 1. ... 40
6. Data mortalitasR. linearissetelah aplikasiAspergillussp. pada
kelompok 2. ... 40
7. Data mortalitasR. linearissetelah aplikasiAspergillussp. pada
kelompok 3. ... 40
8 Persentase mortalitasR. linearissetelah aplikasiAspergillussp.
pada kelompok 1. ... 41
9 Persentase mortalitasR. linearissetelah aplikasiAspergillussp.
pada kelompok 2. ... 41
10. Persentase mortalitasR. linearissetelah aplikasiAspergillussp.
pada kelompok 3. ... 41
iv
13. Analisis ragam persentase mortalitas totalR. linearis. ... 42 14. Waktu kemunculan jamur padacadaver R. linearissetelah proses
pelembaban. ... 43
15. Data perkecambahan sporaAspergillussp. pada kelompok I
(inkubasi 16–18 Juni 2015). ... 43
16. Data perkecambahan sporaAspergillussp. pada kelompok II
(inkubasi 23–25 Juni 2015). ... 43
17. Data perkecambahan sporaAspergillussp. pada kelompok III
(inkubasi 24–26 Juni 2015). ... 44
Percayalah kepada Tuhan dengan segenap hatimu, dan janganlah bersandar pada pengertianmu sendiri.
Akuilah Dia dalam segala lakumu, maka Ia akan meluruskan jalanmu.
(Amsal 2:4-5)
Tak perlu berlari jika tujuanmu belum pasti. Berjalan pelan saja sampai menemukan arah tujuanmu
dan berlarilah untuk meraihnya. Rejeki takkan kemana.
Setiap orang punya baju nya sendiri-sendiri. Jangan memaksakan diri untuk memakai baju orang lain
atau memaksa orang lain untuk memakai baju kita. (Ibu Indriyati)
Hidup terlalu singkat untuk mengeluhkan kegagalan, menangisi kehilangan, menyesali kesalahan,
dan mengkhawatirkan masa depan.
Belajarlah mengalah
sampai tak seorangpun yang bisa mengalahkanmu. Belajarlah merendah
✁ ✂✄☎ ✂ ✆✁ ✂ ✝✞ ✟☎✠☎ ✠✡✝☛ ✝✟☞ ☛☎✟✡☎ ✌✍✎✌☎ ✞ ✌✂ ✌ ✏✌ ✏✁ ✏✌ ☛☎ ✠✌ ☛☎ ✂
✝✂✑ ✝☛✒
Keluargaku Tercinta,
Bapak Markus Lukito dan Ibu Yustina Sugeng Marwati,
Kakak tercinta Theresia Pujilestari dan Frederikus Yowanto,
Adik tersayang Christina Natalia Setyawati
Seluruh Insan Akademis dan
RIWAYAT HIDUP
Penulis dilahirkan di Kalirejo, Lampung Tengah pada 31 Maret 1993. Penulis
merupakan anak kedua dari tiga bersaudara, dari pasangan Bapak Markus Lukito
dan Ibu Yustina Sugeng Marwati.
Penulis telah menyelesaikan pendidikan di TK Fransiskus Kalirejo pada 1999, SD
Fransiskus Kalirejo pada 2005, SMP Xaverius Pringsewu pada 2008, dan SMA
Xaverius Pringsewu pada 2011. Pada tahun 2011, penulis diterima sebagai
mahasiswa Fakultas Pertanian Universitas Lampung Jurusan Agroteknologi
melalui Seleksi Nasional Masuk Perguruan Tinggi Negeri (SNMPTN) jalur
undangan.
Penulis telah melaksanakan Kuliah Kerja Nyata (KKN) pada 2014 di Desa Padan,
Penengahan, Lampung Selatan dan pada tahun yang sama juga melaksanakan
Praktik Umum di PT Great Giant Pineapple, Lampung Tengah. Selama menjadi
mahasiswa, penulis pernah aktif dalam organisasi Persatuan Mahasiswa
Agroteknologi (PERMA-AGT) sebagai anggota Bidang Minat dan Bakat. Selain
itu, penulis juga pernah menjadi asisten praktikum mata kuliah Dasar-dasar Ilmu
tanah, Bioekologi Hama Tanaman, Pengendalian Hama Tanaman, dan
SANWACANA
Puji syukur penulis panjatkan kepada Tuhan Yang Maha Esa, atas berkat dan
karunia-Nya sehingga skripsi ini dapat diselesaikan. Skripsi berjudul “Uji
Patogenisitas JamurAspergillussp. Terhadap Hama Pengisap Polong Kedelai (Riptortus linearis)di Laboratorium” ini dapat terselesaikan oleh bantuan
berbagai pihak. Oleh karena itu, pada kesempatan ini penulis ingin mengucapkan
terima kasih kepada:
1. Ibu Prof. Dr. Ir. Rosma Hasibuan, M.Sc., selaku pembimbing utama atas
bimbingan, saran, motivasi, serta kesabaran yang diberikan selama penelitian
dan penyusunan skripsi ini.
2. Ibu Ir. Indriyati, selaku pembimbing kedua atas bimbingan, saran, motivasi,
serta kesabaran yang diberikan selama penelitian dan penyusunan skripsi ini.
3. Ibu Dr. Yuyun Fitriana, S.P., M.P., selaku pembahas atas bimbingan, saran,
motivasi, serta kesabaran yang diberikan selama penelitian dan penyusunan
skripsi ini.
4. Ibu Prof. Dr. Ir. Nanik Sriyani, M.Sc., selaku dosen pembimbing akademik
atas bimbingan, saran, nasihat, dan dukungan yang selalu diberikan kepada
penulis selama masa kuliah.
5. Kedua orang tua tercinta yang selalu memberikan doa, kepercayaan, motivasi,
6. Saudara-saudaraku tercinta, Theresia Puji Lestari, Christina Natalia Setyawati,
dan Frederikus Yowanto atas nasihat, dukungan,dan doa yang selalu diberikan.
7. Bapak Prof. Dr. Ir. Purnomo, M.S., selaku ketua bidang proteksi tanaman yang
selalu memberikan saran terbaik.
8. Bapak Radix Suharjo, S.P., M.Agr., Ph.D. yang selalu memberikan motivasi,
kepercayaan, nasihat, serta dukungan bagi penulis selama penelitian dan
penyusunan skripsi ini.
9. Rekan debatku paling setia, Eko Andrianto, S. P. yang selalu memberi inspirasi
dan membantu mencari pemecahan masalah.
10. Teman-teman seperjuanganku di HPT 2011, Eka Rizki, Ika, Icha, Septy, Sasha,
Desnidasari, Idha, Maya Gustina, Dwi Asih, Irma, Rani, Thoriq, Ismuaji, Aris,
Fajar, Himawan, Eko Saputro, Suhendra, Fransiskus, Akbar, Ali, Yohan, Agung
Susilo, dan Agung Prastiyo.
11. Kakak dan adik yang selalu membantuku, Wasis Sugiyem, Aldi Indra P., Astri
Ambun S., Agustinus Haryadi, Ahmad Aziz A.H., dan Wahyu Wijayanto.
12. Penyemangatku, Dionisius Handoko Wijaya.
13. Teman-teman di kelas B dan seluruh AGT 2011, serta semua pihak yang tidak
dapat penulis sebutkan satu-persatu.
Bandar Lampung, Desember 2015
1
I. PENDAHULUAN
1.1 Latar Belakang dan Masalah
Kedelai adalah salah satu bahan pangan yang sangat penting bagi masyarakat
Indonesia. Selain memiliki kandungan protein yang tinggi, kedelai juga dapat
diolah menjadi berbagai produk olahan yang digemari oleh masyarakat.
Sayangnya kebutuhan kedelai di Indonesia tidak dapat terpenuhi oleh produksi
kedelai dalam negeri yang hanya berkisar 700–800 ribu ton/tahun (BPSa, 2014).
Bahkan data dari Badan Pusat Statistik (BPSb, 2014) menunjukkan bahwa rerata
produksi kedelai pada tahun 2013 sebesar 779,99 ribu ton biji kering mengalami
penurunan sebesar 63,16 ribu ton (7,49%) dibandingkan tahun 2012. Setiap
tahunnya Indonesia membutuhkan sebanyak 2 juta ton kedelai untuk memenuhi
kebutuhan dalam negeri (Kemenperin, 2014). Akibatnya Indonesia harus
mengimpor kedelai dari negara lain untuk memenuhi kebutuhan akan komoditas
pangan ini.
Salah satu penyebab produktivitas kedelai masih rendah adalah masih tingginya
serangan hama di pertanaman kedelai. Hama pengisap polong tergolong hama
utama kedelai. Ada tiga spesies hama pengisap polong yang sering menyerang
2
Piezodorus rubrofasciatus. Di antara ketiga jenis hama tersebut,R. linearis mempunyai daerah penyebaran dan serangan yang paling luas (Asadi, 2009).
Serangan hama pengisap polongR. linearisdapat mengakibatkan kehilangan hasil kedelai hingga 80% bahkan puso apabila tidak dikendalikan (Marwoto, 2012).
Pengendalian hama di lapang selama ini lebih mengandalkan penggunaan
pestisida kimia. Hal ini tidak terlepas dari adanya salah persepsi oleh petani yang
menganggap pestisida, khususnya insektisida kimia sebagai obat dan
penggunaannya dilakukan secara teratur. Padahal, penggunaan pestisida secara
terus menerus menimbulkan masalah baru seperti resistensi dan resurjensi hama,
peledakan hama sekunder, bahaya keracunan pada operator dan konsumen,
pencemaran lingkungan, peningkatan biaya produksi, serta menurunnya
pendapatan petani (Hasibuan, 2003).
Saat ini mulai dikembangkan teknik pengendalian yang didasarkan pada konsep
PHT (Pengendalian Hama Terpadu) akibat dampak negatif yang ditimbulkan oleh
penggunaan insektisida kimia dalam pengendalianR. linearis. Salah satu teknik
pengendalian yang dianjurkan dalam pelaksanaan program PHT adalah
pemanfaatan musuh alami seperti predator, patogen, dan parasitoid (Hasibuan,
2003). Pengendalian dengan musuh alami ini diharapkan dapat mengurangi
penggunaan insektisida dalam pengendalianR. linearis.
Jamur entomopatogen adalah salah satu agensia hayati yang mempunyai prospek
yang cukup baik untuk mengendalikan OPT (Organisme Pengganggu Tanaman)
(Rosmini & Lasmini, 2010). Penggunaan jamur entomopatogen dalam
3
hidupnya pendek, bersifat selektif, kompatibel dengan pengendalian lainnya,
relatif murah diproduksi dan kemungkinan menimbulkan resistensi amat kecil
atau lambat, serta dapat membentuk spora yang dapat bertahan lama, bahkan
dalam kondisi yang tidak menguntungkan sekalipun (Rosmini & Lasmini, 2010).
Jamur dari genusAspergillustelah banyak dilaporkan berperan sebagai patogen pada beberapa serangga. Jamur entomopatogen dari genusAspergillusmerupakan jamur saprofit yang dapat menginfeksi serangga pada rentangan jenis yang luas,
terdiri atas banyak spesies sepertiA. flavus, A. parasiticus, A. tamari, A.
ochraceus, A. fumigatus, A. repensdanA. vesicolor(Tanada & Kaya, 1993 dalam Indriaet al., 2013). Indriaet al.(2013) melaporkan bahwa 2 spesies jamur dari genusAspergillusberhasil diisolasi dari usus rayap pekerjaCoptotermes
curvignathus(Isoptera:Rhinotermitidae),yaituA. fumigatusdanA. niger. Selain itu,A. fumigatusjuga dilaporkan bersifat patogen terhadapDysdercus similis (Heteroptera: Pyrrhocoridae) (Singh & Pathak, 2010).
Di Indonesia,Aspergillussp. telah berhasil diisolasi dari tanah sekitar perakaran kacang tanah di Sumatera Barat dan dapat menginfeksiTribolium molitor
(Coleoptera:Tenebrionidae) (Reflinaldonet al., 2014). Aspergillusjuga berhasil diisolasi dariDolycoris baccarumL. (Hemiptera: Pentatomidae),Eurygoster integricepsPut. (Hemiptera: Scutelleridae),Acrotylus insubricusScop.
(Orthoptera: Acrididae), danAelia acuminataL. (Hemiptera: Pentatomidae) di Duhok, Iraq dan bersifat entomopatogen (Assafet al., 2011). Hal ini
4
Pemanfaatan jamurAspergillussebagai jamur entomopatogen telah banyak dilakukan, bahkan dapat dikombinasikan dengan pengendalian lainnya. Hasil
penelitian Bhanet al.(2013), menunjukkan bahwaA. flavus,salah satu spesies Aspergillusyang sudah banyak diteliti, dapat dikombinasikan dengan insektisida kimia untuk mengendalikan larva nyamukAnopheles stephensiyang merupakan vektor penyakit malaria. Kombinasi toksinA. flavusdan Temephos (larvasida kimia) dengan perbandingan 1:1 ternyata meningkatkan mortalitas larvaA. stephensisekaligus menurunkan nilai LC50Temephos danA. flavusjika digunakan tanpa kombinasi. Hal ini berarti penggunaanA. flavusdapat mengurangi kebutuhan larvasida kimia untuk mengendalikan larva nyamukA. stephensi.
JamurAspergillustelah ditemukan hidup pada nimfaR. linearis. Namun, sebelum dimanfaatkan secara luas, suatu jamur entomopatogen harus diuji untuk
mengetahui daya infeksinya terhadap hama sasaran. Pengujian daya infeksi jamur
entomopatogen dapat diketahui dengan uji patogenisitas. Oleh karena itu
penelitian ini perlu dilakukan untuk mengetahui patogenisitas jamurAspergillus sp. terhadapR. linearisdi laboratorium.
1.2 Tujuan Penelitian
5
1.3 Kerangka Pemikiran
Saat ini, pengendalian hama tanaman lebih mengarah kepada teknik pengendalian
yang ramah lingkungan. Salah satu teknik pengendalian yang terus menerus
dikembangkan adalah pengendalian dengan pemanfaatan patogen sebagai agensia
hayati. Patogen yang dimanfaatkan sebagai agens pengendali hama antara lain
jamur, bakteri, virus, dan nematoda (Oka, 2005). Dari keempat patogen serangga
tersebut, jamur adalah patogen yang dapat menginfeksi serangga setelah terjadi
kontak, sedangkan bakteri, virus, dan nematoda harus masuk ke dalam perut
serangga untuk dapat melakukan infeksi (Sembel, 2010). Hal ini
mengindikasikan bahwa jamur patogen serangga relatif lebih mudah menginfeksi
serangga, meskipun infeksinya dipengaruhi oleh kelembaban lingkungan. Selain
itu, jamur patogen serangga juga dapat mengendalikan berbagai tingkat
perkembangan serangga mulai dari telur, larva, pupa dan imago (Trizeliaet al., 2010).
Pasaruet al.(2014) melaporkan bahwaAspergillussp.,A. flavus, danVerticillium lecaniiberhasil diisolasi dariHelopeltisspp. (Hemiptera: Miridae) yang mati di lapang. Uji patogenisitas di laboratorium menunjukkan bahwa mortalitas
6
yang lebih dikenal. Seyeet al.(2014) melaporkan bahwalethal concentrations (LC50dan LC90) untuk membunuhA. pisumolehA. flavussebesar 1,23×103dan 1,34×107spora/ml, sedangkanA. clavatussebesar 4,92×102dan 5,65×107 spora/ml. Nilai ini lebih rendah dibandingkan dengan LC50dan LC90M. anisopiaeyaitu sebesar 3,65×103dan 9,71×107spora/ml. Hasil-hasil penelitian tersebut menunjukkan bahwaAspergillusadalah jamur entomopatogen yang potensial untuk diteliti dan dikembangkan lebih lanjut.
Seperti jamur entomopatogen lainnya,Aspergillussp. menginfeksi inangnya secara langsung dengan menghasilkan enzim kitinolitik (chitinolytic enzymes)
untuk dapat memenetrasi kutikula inang (Burns & Dick, 2002). Konidia akan
masuk ke dalam hemolimfa dan mengeluarkan toksin yang mengganggu
metabolisme serangga inang (Sandhuet al.,2011). Beberapa spesiesAspergillus menghasilkan toksin berupa aflatoksin yang dapat menyebabkan penyakit pada
tumbuhan, hewan, dan manusia (Foleyet al.,2014). Meskipun demikian, tidak semua spesiesAspergillusmerugikan dan dimanfaatkan dalam industri, sepertiA. niger, A. sojae, A. kawacchii,danA. oryzaeyang digunakan dalam industri makanan (Gibbons & Rokas, 2013).
Dalam penelitian ini, koloni jamurAspergillussp. ditemukan hidup pada serangga R. linearisyang telah mati. Oleh sebab itu dilakukan uji patogenisitas Aspergillus sp. terhadapR. linearisuntuk mengetahui kemampuanAspergillusdalam
7
1.4 Hipotesis
8
II. TINJAUAN PUSTAKA
2.1 Pengisap Polong Kedelai (Riptortus linearis)
Berikut adalah taksonomi pengisap polong kedelai (EOL, 2014):
Kingdom : Animalia Phylum : Arthropoda
Class : Insecta
Ordo : Hemiptera
Super family : Coreoidea
Family : Alydidae
Genus :Riptortus
Species :Riptortus linearis(Fabricius, 1775)
ImagoR. linearisdatangkepertanaman kedelai saat tanaman mulai berbunga.
Selanjutnya, imago betina akan meletakkan telur satu per satu pada permukaan
atas dan bawah daun. Seekor imago betina mampu bertelur hingga 70 butir
selama 4–47 hari (Prayogo & Sudarsono, 2005).
MetamorfosisR. linearisadalah paurometabola, yaitu terdiri dari telur, nimfa, dan imago. TelurR. linearisberbentuk bulat dan berwarna coklat. Stadium nimfa terdiri dari 6 instar. Nimfa instar I dan II berbentuk mirip semut gramang,
berwarna kekuning-kuningan, aktif bergerak dan mencari makan. Nimfa instar III
dan IV berbentuk seperti semut rangrang, berwarna coklat, aktif bergerak tapi
tidak seaktif instar I dan II. Instar V dan VI berwarna hitam agak abu-abu, mirip
9
panjang dan berwarna kuning kecoklatan dengan garis putih kekuningan di
sepanjang sisi tubuhnya. Imago jantan dan betina dapat dibedakan dari bentuk
abdomennya, yaitu imago jantan ramping dengan panjang 11–13 mm dan betina
agak gemuk dengan panjang 13–14 mm (Prayogo & Sudarsono, 2005).
Riptortus linearismemiliki tipe mulut menusuk dan mengisap. Nimfa maupun imago mampu menyebabkan kerusakan pada polong kedelai dengan cara
mengisap cairan biji di dalam polong dengan menusukkan stiletnya (Prayogo &
Sudarsono, 2005). Tanda serangan dapat dilihat dari bekas tusukan mulut pada
kulit polong dan biji. Jika serangan terjadi pada saat polong masih dalam proses
pengisian penuh, maka polong menjadi kempes dan mengering (Asadi, 2009).
Suhu lingkungan sangat berpengaruh terhadap lamanya masa inkubasi telur dan
lamanya periode nimfa. Peningkatan suhu lingkungan dari 20°C menjadi 35°C
menyebabkan penurunan masa inkubasi telur dari 12,75 menjadi 4,13 hari dan
total lamanya periode nimfa dari 35,47 menjadi 11,52 hari (Talekaret al., 1995). Hal ini tentunya menyebabkanR. linearismenjadi hama penting di daerah-daerah bersuhu tinggi, termasuk Indonesia sebagai negara tropis karena perkembangan
serangga yang begitu cepat.
2.2 Jamur Entomopatogen
Jamur yang berasosiasi dengan serangga dikenal denganentomogenous fungiatau jamur serangga (entomopatogen). Jamur entomopatogen dapat menginfeksi
serangga dan hidup di dalam serangga inang. Mekanisme infeksi oleh jamur
entomopatogen pada serangga, diawali dengan menempelnya propagul jamur
10
melakukan penetrasi ke tubuh inang (misalnya tabung kecambah, appresorium,
atau lapisan ekstraseluler). Sebelum mampu mencapai hemosol, jamur
menghasilkan toksin untuk melawan mekanisme pertahanan tubuh serangga.
Setelah mencapai hemosol, jamur membentuk blastospora dan memperluas
infeksi ke seluruh bagian tubuh serangga. Serangga yang terinfeksi akan mati
akibat kekurangan nutrisi, gangguan fisik atau invasi jamur pada organ, dan toksin
yang dihasilkan jamur (Ingliset al., 2001).
Gejala infeksi jamur tampak dari adanya pertumbuhan miselium pada kutikula
serangga dewasa atau larva. Miselium akan terus bertumbuh, kemudian
membungkus seluruh permukaan tubuh serangga dan masuk ke bagian internal
tubuh serangga serta mengolonisasi hemosol. Selanjutnya, pertumbuhan
miselium akan diikuti oleh perkembangan spora atau konidia jamur yang dapat
menginfeksi serangga lain (Sembel, 2010).
2.3 JamurAspergillus
Jamur dari genusAspergillusumumnya adalah jamur-jamur saprofit yang sering dijumpai pada tanah dan substrat organik atau anorganik. Konidianya yang
merupakan spora aseksual bersifat hidrofobik dan biasanya dapat terbawa di
udara. Konidia ini mudah berkecambah dalam berbagai kondisi karena
termotoleran dan dapat berkecambah pada suhu berkisar 12–50°C (Bhabhra &
Askew, 2005).
Publikasi pertama jamurAspergillussekitar 300 tahun yang lalu oleh seorang pendeta dan ahli botani bernama Antonio Micheli. Jamur ini selanjutnya disebut
11
digunakan untuk memercikkan air suci dalam liturgi umat Kristiani (Gibbons &
Rokas, 2013) (Gambar 1).
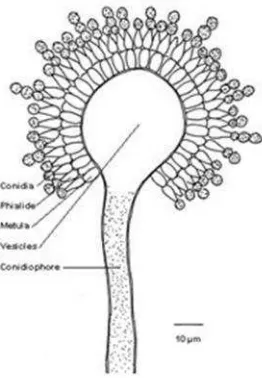
Gambar 1. Struktur jamurAspergillusmirip dengan aspergillum (Sphenothalami, 2013).
Ciri utama jamur dari genusAspergillusadalah bentuk struktur bantalan spora yang mirip dengan aspergillum. Stuktur ini merupakan karakter mikroskopik
Aspergilluspaling penting dalam taksonomi jamur ini. Pada saat tertentu,
miselium sel-sel terdiferensiasi menjadi struktur menggembung berbentuk huruf T
atau L dan membentukfoot cells(sel kaki) yang menghasilkan konidiofor tunggal yang tegak lurus. Sel kaki ini sering sulit untuk ditemukan, namun struktur ini
memperkuat bukti bahwa isolat yang ditemukan merupakan spesiesAspergillus (Machida & Gomi, 2010).
Aspergillusbiasa dijumpai di tanah-tanah daerah beriklim tropis, kompos, bagian tanaman yang membusuk, tempat penyimpanan biji, dll. GenusAspergillus dicirikan dengan adanya konidiofor tegak yang pada ujungnya terdapat vesikel.
12
dan metula ini bertumbuh serempak, lalu menghasilkan rangkaian konidia
(Gambar 2) (Domschet al., 1993).
13
III. BAHAN DAN METODE
3.1 Tempat dan Waktu Penelitian
Penelitian ini dilaksanakan di Laboratorium Hama dan Penyakit Bidang Proteksi
Tanaman, serta Laboratorium Lapang Terpadu, Fakultas Pertanian, Universitas
Lampung pada bulan Maret sampai dengan September 2015.
3.2 Bahan dan Alat
Bahan-bahan yang digunakan pada penelitian ini yaitu serangga ujiR. linearis, kacang panjang sebagai pakan,media PDA (Potato Dextrose Agar), isolat
Aspergillussp., akuades steril, tisu, dan alkohol 70%.
Alat-alat yang digunakan pada penelitian ini yaitu stoples plastik untuk
pemeliharaan serangga uji,sprayer, kain kasa, kain strimin, cawan Petri, plastik tahan panas, karet gelang, jarum ose, bor gabus, mikropipet, tabung reaksi,
bunsen, erlenmeyer,haemocytometer, autoklaf,laminar air flow, mikroskop majemuk, mikroskop stereo, neraca, kamera, dan alat tulis.
3.3 Uji Pendahuluan
Penelitian pendahuluan sebelumnya akan menggunakan 2 isolat lokal jamur
14
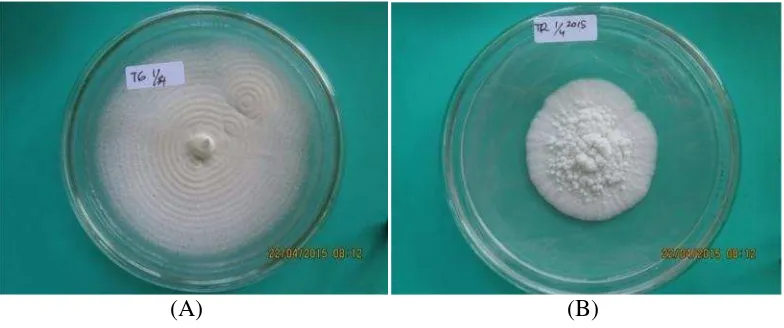
sangat berbeda. Isolat dari Tegineneng berwarna putih kekuningan dengan pola
koloni berbentuk lingkaran-lingkaran teratur, sedangkan isolat Trimurjo berwarna
putih dengan bentuk koloni seperti kapas dan ada pola berbentuk bunga. Selain
itu, pertumbuhan isolat Trimurjo sangat lambat jika dibandingkan dengan isolat
Tegineneng (Gambar 3).
(A) (B)
Gambar 3. Perbedaan bentuk koloni jamur umur 3 minggu di media PDA dalam cawan Petri berdiameter 9 cm (A) Isolat Tegineneng (B) Isolat
Trimurjo.
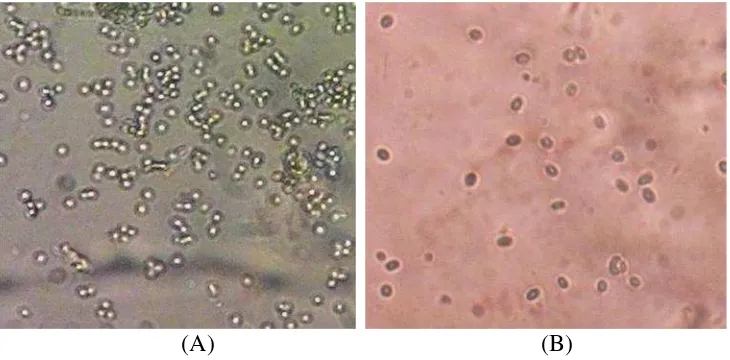
Setelah diamati dengan mikroskop menggunakan perbesaran 400 kali pada 12
Maret 2015, tampak bahwa spora jamur tersebut juga berbeda. Spora isolat
Tegineneng berbentuk bulat, sedangkan spora isolat Trimurjo berbentuk lonjong
(oval) (Gambar 4). Namun, terjadi kesulitan untuk mengamati struktur jamur
15
(A) (B)
Gambar 4. Perbedaan spora jamur isolat Tegineneng dan Trimurjo secara mikroskopik (A) Spora isolat Tegineneng (B) Spora isolat Trimurjo.
Perbedaan kedua isolat ini menyebabkan dilakukannya identifikasi ulang terhadap
kedua isolat yang dimiliki dan pengujian daya infeksi jamur tersebut terhadap
R. linearis. Identifikasi jamur dilakukan di Balai Veteriner Lampung pada 17 Maret–13 April 2015 dan pengujian daya infeksi jamur dilakukan di Laboratorium
Hama dan Penyakit Fakultas Pertanian UNILA pada 7–14 April 2015.
Identifikasi 2 isolat jamur di Balai Veteriner Lampung dilakukan untuk
menyatakan isolat yang merupakan jamurBeauveriasp. Penguji menyatakan bahwa isolat Trimurjo merupakan jamurBeauveriasp., sedangkan isolat Tegineneng bukanBeauveriasp. Namun, dokumentasi hasil uji yang
16
(A) (B)
Gambar 5. Perbandingan hasil pengamatan stuktur jamur isolat Trimurjo dengan literatur (A) Struktur jamur isolat Trimurjo (Balai Veteriner, 2015) (B) Struktur jamurB. bassiana(Ellis, 2015).
Pengujian daya infeksi jamur terhadapR. linearismenggunakan 10 ekor
R. linearis,sehingga setiap isolat diujikan pada 5 ekor serangga uji. Serangga uji yang digunakan tidak berumur sama untuk mengetahui tingkat kerentanan
serangga uji, yaitu 2 ekor larva instar II, 1 ekor larva instar V, dan 2 ekor imago.
Suspensi jamur yang diaplikasikan adalah suspensi pekat dari biakan jamur yang
telah diinkubasi selama 1 bulan dan diaplikasikan pada serangga uji serta
makanannya. Suspensi dibuat dengan memanen spora jamur dan melarutkannya
pada 10 ml akuades serta dihomogenkan denganrotamixer. Pengamatan setelah aplikasi dilakukan setiap hari sampai 7 HSA (Hari Setelah Aplikasi). Hasil
17
Tabel 1. MortalitasR. linearissetelah aplikasi isolat jamur Tegineneng dan Trimurjo.
No. Waktu Pengamatan Perlakuan Jamur Keterangan
Tegineneng
Serangga mati (cadaver) dikumpulkan dan diletakkan di dalam cawan Petri untuk
membuktikan bahwa serangga mati akibat infeksi jamur. Pada tutup cawan diberi
kertas tisu yang ditetesi akuades agar lembab dan mendukung pertumbuhan
jamur. Jika kematian disebabkan oleh jamur, biasanya jamur terlihat pada
serangga mati beberapa waktu kemudian. Pada uji pendahuluan ini, jamur
didapati tumbuh di serangga mati. Waktu munculnya jamur dapat dilihat pada
Tabel 2.
Tabel 2. Waktu munculnya jamur padacadaver R. linearissetelah aplikasi isolat jamur Tegineneng danTrimurjo.
Perlakuan Waktu Muncul Jamur Keterangan
Tegineneng 4 HSA
(11 April 2015)
• Jamur tampak tumbuh pada semua nimfa yang mati, koloni kekuningan
Trimurjo 5 HSA
(12 April 2015)
• Hanya nimfa instar II yang tampak ditumbuhi jamur, koloni jamur putih kekuningan
18
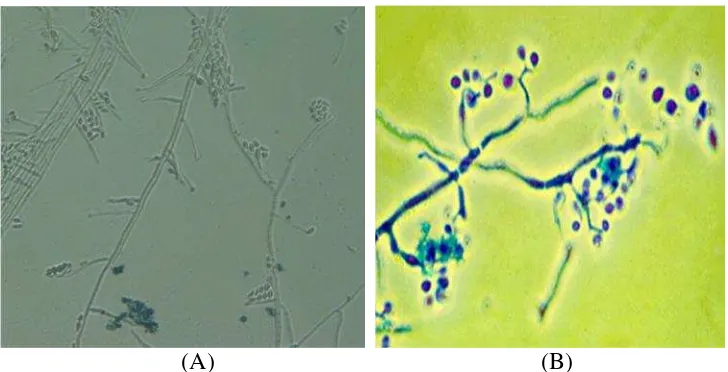
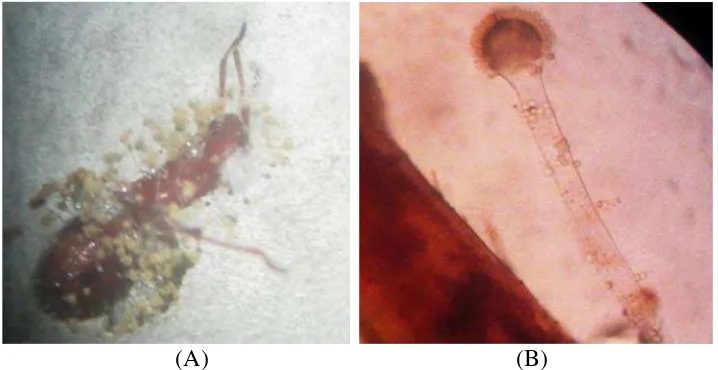
Hasil pengamatan di mikroskop menunjukkan bahwa koloni jamur yang hidup
padacadaversangat berbeda dengan koloniB. bassiana. Jamur yang tumbuh tampak memiliki konidiofor dan vesikel yang merupakan ciri khas jamur genus
Aspergillus(Gambar 6).
(A) (B)
Gambar 6. Hasil pengamatan jamur padacadaver R. linearispada uji
pendahuluan (A) Koloni jamur tumbuh padacadaver(B) Struktur jamur dengan konidiofor dan vesikel.
Berdasarkan hasil uji pendahuluan ini, maka jamur entomopatogen yang
menyerang hama pengisap polong kedelai adalahAspergillus. Dengan demikian jamur entomopatogen yang akan diteliti lebih lanjut adalahAspergillussp.
3.4 Metode Penelitian
Penelitian ini terdiri atas beberapa kegiatan yaitu pembiakan jamurAspergillus sp., pengujian kerapatan dan viabilitas spora jamur, aplikasi jamur, serta
pengamatan dan perhitungan peubah patogenisitas. Rancangan percobaan yang
digunakan adalah Rancangan Kelompok (RK). Pengelompokan dilakukan
19
Perlakuan yang diuji terdiri atas isolatAspergillussp. dengan kerapatan 105, 106, 107, dan 108spora/ml yang dibandingkan dengan kontrol. Setiap satuan
percobaan terdapat 10 ekor serangga uji.
3.5 Persiapan Penelitian
Persiapan penelitian terdiri atas perbanyakan serangga uji (R. linearis), pembuatan
media PDA, penyiapan isolatAspergillussp., pembuatan suspensiAspergillus sp., dan penghitungan kerapatan sporaAspergillussp.
3.5.1 Perbanyakan serangga uji (R.linearis)
Untuk memperoleh serangga uji, dilakukan penanaman tanaman kedelai yang
menjadi inang hamaR. linearisdan kacang panjang sebagai pakan hama pada lahan Laboratorium Lapang Terpadu Universitas Lampung. Pemeliharaan
tanaman dilakukan tanpa penggunaan insektisida kimia.
Tanaman kedelai yang memasuki masa pembungaan dan pembentukan polong
akan mengundang datangnya seranggaR. linearisdan dilakukan penangkapan serangga menggunakan alatsweep net. Serangga yang tertangkap kemudian dipelihara untuk memperbanyak stok serangga uji.
Serangga yang tertangkap dipelihara di laboratorium berdasarkan metode yang
digunakan Mawan & Amalia (2011) dengan sedikit modifikasi. Imago betinaR. linearissiap bertelur yang diperoleh dari lahan kacang panjang disimpan dalam stoples berdiameter 16 cm dan tinggi 17 cm yang ditutup dengan kain strimin.
Imago diberi pakan berupa kacang panjang dan diletakkan juga serabut kain kasa
20
dan pakannya diganti setiap 2 hari sekali. Telur-telur diambil saat penggantian
makanan, kemudian dipindahkan ke wadah lain sampai menetas. Nimfa akan
dipelihara sebagai stok serangga uji.
3.5.2 Pembuatan mediaPotato Dextrose Agar(PDA)
Media PDA dibuat dengan pencampuran ekstrak kentang dengan dekstrosa dan
agar. Satu liter media PDA membutuhkan 200 g kentang, 20 g dekstrosa, dan 20
g agar. Sebanyak 200 g kentang dipotong kecil sampai ukurannya ± 1 mm dan
kemudian direbus dalam 1 L akuades selama 20 menit. Ekstrak hasil perebusan
kemudian disaring dan dimasukkan ke dalam erlenmeyer 1.000 ml yang telah
berisi dekstrosa dan agar, lalu ditambahkan akuades sampai volumenya 1.000 ml.
Tabung erlenmeyer kemudian ditutup dengan aluminium foil dan karet gelang.
Selanjutnya, erlenmeyer berisi bahan media dimasukkan ke dalam plastik tahan
panas dan diautoklaf selama 15 menit dalam suhu 121°C dan tekanan 1 atm.
Selanjutnya, media diangkat dan didiamkan sampai media bersuhu ± 50°C lalu
dituang ke dalam cawan Petri secara aseptik dilaminar air flow.
3.5.3 Penyiapan isolatAspergillussp.
IsolatAspergillussp. yang digunakan dalam penelitian ini merupakan hasil isolasi daricadaver R. linearisdi Laboratorium Hama dan Penyakit Fakultas Pertanian Universitas Lampung, Lampung. Isolasi dilakukan dengan cara mengambil
miselium atau spora jamur dan menumbuhkannya pada media PDA, kemudian
dimurnikan kembali. Isolat murni ini kemudian diinkubasi selama 15 hari dan
21
yang sama, isolat diremajakan pada setiap kelompok aplikasi sehingga dalam
penelitian ini digunakan subkultur ke-2, ke-3, dan ke-4.
3.5.4 Pembuatan suspensiAspergillussp.
Suspensi jamur dibuat dengan menambahkan 10 ml akuades ke dalam biakan
jamur. Spora jamur kemudian dilepaskan dari biakan dengan menyapukan kuas
halus di permukaan biakan. Larutan yang didapatkan dimasukkan ke dalam
tabung reaksi dan dihomogenkan denganrotamixer, sehingga didapatkan larutan dasar. Larutan dasar ini harus diencerkan lagi dengan pengenceran berseri.
Pengenceran berseri dilakukan dengan mengambil 1 ml larutan dasar yang
dimasukkan ke dalam tabung reaksi dan ditambahkan 9 ml akuades. Larutan ini
dihomogenkan kembali selama 1 menit, sehingga didapatkan pengenceran tingkat
satu. Pengenceran ini dilanjutkan sampai pengenceran tingkat empat.
3.5.5 Perhitungan kerapatan sporaAspergillussp.
Kerapatan spora dalam penelitian ini digunakan sebagai perlakuan yang diuji.
Kerapatan spora dalam larutan dihitung denganhaemocytometerdi bawah mikroskop dengan perbesaran 400 kali. Spora dalam bidang pengamatan
haemocytometerdihitung secara langsung dengan bantuancounter. Terdapat tiga ukuran bidang pengamatan dalamhaemocytometer,yaitu kotak besar, sedang, dan kecil. Dalam penelitian ini, bidang pengamatan yang digunakan adalah kotak
22
Perhitungan kerapatan menggunakan rumus (Hadioetomo, 1993 dalam Budiet al., 2013) sebagai berikut:
K = ×
× ,
× 10
Keterangan:
K = kerapatan spora (spora/ml) t = jumlah spora dalam kotak sampel d = faktor pengenceran
n = jumlah kotak sampel yang diamati 0,25 = faktor koreksi
3.6 Pelaksanaan Penelitian
Pelaksanaan penelitian terdiri atas uji viabilitasAspergillussp. dan uji patogenisitasAspergillussp.
3.6.1 Uji viabilitasAspergillussp.
Daya berkecambah (viabilitas) spora jamurAspergillussp.diuji dengan inkubasi spora yang disuspensikan dengan akuades pada kaca preparat selama 48 jam.
Inkubasi selama 48 jam bertujuan untuk melihat jumlah spora berkecambah yang
paling maksimal. Selain itu inkubasi selama 48 jam masih termasuk waktu
standard dalam pengujian viabilitas spora jamur (Neill & Tang, 2007), dengan
catatan bahwa jumlah spora berkecambah dan tidak berkecambah masih mudah
untuk dihitung.
Sebanyak 1 tetes suspensi jamur diambil dengan pipet tetes dan diteteskan pada
preparat, kemudian ditutup dengan kaca penutup. Preparat ini selanjutnya
23
kelembaban. Empat puluh delapan jam kemudian diamati jumlah spora yang
berkecambah dengan bantuan mikroskop. Perhitungan diulang sebanyak 3 kali.
3.6.2 Uji patogenisitasAspergillussp.
Serangga uji yang digunakan adalah nimfaR. linearisinstar ke-2. Volume semprot suspensiAspergillussp. untuk aplikasi ke serangga uji sebanyak 2 ml/10 ekor serangga. Selain itu, suspensi juga disemprotkan ke polong kacang panjang
sebanyak 8 ml/5 potong polong kacang panjang berukuran 15 cm. Polong yang
telah disemprot suspensi jamur dikeringanginkan dan dimasukkan ke dalam toples
berisi serangga uji yang telah disemprot suspensi jamur. Makanan ini diganti
setiap 2 hari sekali tanpa pengulangan penyemprotan suspensi jamur. Perlakuan
kontrol hanya disemprot dengan akuades steril, dengan volume semprot yang
sama. Setelah dilakukan aplikasi suspensiAspergillussp.,maka dilakukan pengamatan dan pengumpulan data.
3.6.2.1 Pengamatan gejala infeksi Aspergillussp.pada R. linearis dan waktu kemunculan koloni jamur pada cadaver.
Gejala infeksi jamurAspergillussp. pada serangga uji diamati dengan melihat warna koloni jamur yang tumbuh pada tubuhR. linearisyang mati akibat infeksi jamur entomopatogen. Waktu kemunculan koloni jamur dicadaverjuga dicatat.
3.6.2.2 Reisolasi Aspergillussp.dari cadaver
Koloni jamur yang tumbuh pada serangga mati diisolasi kembali untuk
membuktikan bahwa patogen yang menyerang dan menimbulkan kematian adalah
24
3.6.2.3 Persentase mortalitas R. linearis
Pengamatan terhadap mortalitasR. linearisdilakukan setiap hari sampai 14 hari setelah aplikasi. Persentase mortalitas nimfa dihitung dengan rumus sebagai
berikut (Budiet al., 2013):
P = X
Y× 100%
Keterangan:
P = persentase kematianR. linearis X = jumlahR. linearisyang mati Y = jumlahR. linearisyang diuji
3.7 Analisis Data
Data persentase kematianR. linearisdianalisis dengan sidik ragam. Apabila sidik ragam menunjukkan pengaruh nyata pada perlakuan, maka dilakukan uji lanjutan
V. KESIMPULAN DAN SARAN
5.1 Kesimpulan
Kesimpulan dari penelitian ini adalah
1. JamurAspergillussp. dapat menginfeksi dan menimbulkan kematianR. linearis.
2. MortalitasR. linearistertinggi terjadi pada perlakuan kerapatan spora 108 spora/ml sebesar 46,67%.
5.2 Saran
Saran yang diajukan peneliti untuk penelitian selanjutnya adalah
1. Pengukuran suhu dan kelembaban ruang uji untuk menyediakan kondisi
optimum bagi proses infeksi jamur.
2. Penambahan bahan perekat dan pembawa pada suspensi jamur sebelum
diaplikasikan, untuk meningkatkan efisiensi aplikasi.
3. Pengujian hipovirulensi untuk mengetahui tingkat patogenisitas isolat
35
PUSTAKA ACUAN
Asadi. 2009. Identifikasi ketahanan sumber daya genetik kedelai terhadap hama pengisap polong.Buletin Plasma Nutfah15(1): 27–31.
Assaf, L. H., R. A. Haleem, & S. K. Abdullah. 2011. Association of
entomopathogenic and other opportunistic fungi with insects in dormant locations.Jordan Journal of Biological Sciences4(2): 87–92.
Bhabhra, R. & D. S. Askew. 2005. Thermotolerance and virulence ofAspergillus fumigatus: role of the fungal nucleolus.Medical Mycology43(1): 87–93. Bhan, S., Shrankhla, L. Mohan, & C.N. Srivastava. 2013. Larvicidal toxicity of
Temephos and entomopathogenic fungus,Aspergillus flavusand their synergistic activity against malaria vector,Anopheles stephensi. Journal of Entomology and Zoology Studies1(6): 55–60.
Bordoloi, M., M. Madhab, P. Dutta, T. Borah, S. C. Nair, Ivy Phukan, S. Debnath & B. K Barthakur. 2012. Potential of entomopathogenic fungi for the management ofHelopeltis theivora(Waterhouse).Two and a Bud59: 21– 23.
[BPS]aBadan Pusat Statistik. 2014. Tanaman Pangan. Dalam
<http://www.bps.go.id/tnmn_pgn.php>. Diakses 14 November 2014.
[BPS]bBadan Pusat Statistik. 2014. Produksi Padi, Jagung, dan Kedelai (Angka Ramalan I Tahun 2014). Berita Resmi Statistik No. 50/07/Th. XVII, 1 Juli 2014.
Budi, A. S., A. Afandhi, & R. D. Puspitarini. 2013. Patogenisitas jamur
entomopatogenBeauveria bassianaBalsamo (Deuteromycetes: Moniliales) pada larvaSpodoptera lituraFabricius (Lepidoptera: Noctuidae).Jurnal HPT1(1): 57–65.
Bunemann & Williams. 2008. Morphological description.
36
Burns, R. G. & R. P. Dick. 2002.Enzymes in the Environment: Activity, Ecology,
and Applications.Marcel Dekker Inc. United States of America.
Domsch, K. H., W. Gams, & T. H. Anderson. 1993.Compendium of Soil Fungi. Federal Republic of Germany. IHW Verlag.
Dwiastuti, M. E., W. Nawir, & S. Wuryantini. 2007. Uji patogenisitas jamur entomopatogenHirsutella citriformis, Beauveria bassiana,dan
Metarhizium anisopliaesecara eka dan dwiinfeksi untuk mengendalikan Diaphorina citriKuw. Jurnal Hortikultura17(1):75–80.
Ellis, D. 2015.Beauveriasp.
<http://www.mycology.adelaide.edu.au/Fungal_Descriptions/Hyphomycete s_%28hyaline%29/Beauveria/>. Diakses 22 April 2015.
[EOL] Encyclopedia of Life. 2014.Hierarchy entries.
<http://eol.org/pages/12036879/hierarchy_entries/52025790/overview>. Diakses 5 Desember 2014.
Foley, K., G. Fazio, A. B. Jensen, & W. O. H. Hughes. 2014. The distribution of Aspergillusspp. opportunistic parasites in hives and their pathogenicity to honey bees.Veterinary Microbiology169: 203–210.
Gibbons, J. G. & A. Rokas. 2013. The function and evolution of theAspergillus genome.Trends in Microbiology21(1): 14–22.
Hasibuan, R. 2003.Pengendalian Hama Terpadu.Penerbit Universitas Lampung. Bandar Lampung.
Herlinda, S., M. D. Utama, Y. Pujiastuti, & Suwandi. 2006. Kerapatan dan
viabilitas sporaBeauveria Bassiana(Bals.) akibat subkultur dan pengayaan media, serta virulensinya terhadap larvaPlutella xylostella(Linn.).Jurnal HPT Tropika6(2): 70–78.
Indria, S. P., S. Khotimah, & Rizalinda. 2013. Jenis-jenis jamur entomopatogen dalam usus rayap pekerjaCoptotermes curvignathusHolmgren.Protobiont 2(3): 141–145.
Inglis, G.D., M.S. Goettel, T.M. Butt, & H. Strasser. 2001. Use of Hypomycetous fungi for managing insect pest.in Fungi as Biocontrol Agents: Progress, Problems, and Potential.Edited by T.M. Butt, C.W. Jackson, & N. Magan. CAB International. United Kingdom.
[Kemenperin] Kementrian Perindustrian. 2014. Ironi Kedelai Impor di Negeri Tempe. Berita Industri. Dalam
37
Machida, M. & K. Gomi. 2010.Aspergillus:Molecular Biology and Genomics.in An overview of the genus Aspergillusby J. W. Bennet. <http://open-access-biology.com/aspergillus/aspergillusch1.pdf>. Diakses 20 April 2015.
Marwoto. 2012. Waspadai Pengisap Polong Riptortus pada Kedelai di Musim Kemarau. <http://balitkabi.litbang.pertanian.go.id/kilas-litbang/1644-waspada-pengisap-polong-riptortus-pada-kedelai-di-musim-kemarau.pdf>. Diakses 30 September 2015.
Mawan, A. & H. Amalia. 2011. Statistika demografiRiptortus linearisF. (Hemiptera: Alydidae) pada kacang panjang (Vigna sinensisL.).Jurnal Entomologi Indonesia8(1): 8–16.
Neill, H. & W. Tang. 2007. Rapid 48-Hour Viable and Culturable Fungi Analysis for Indoor Environment Samples.
<https://www.aiha.org/aihce07/handouts/po113neill.pdf.>. Diakses 9 November 2015.
Oka, I. N. 2005.Pengendalian Hama Terpadu dan Implementasinya di Indonesia. Gadjah Mada University Press. Yogyakarta.
Pasaru, F., A. Anshary, T. Kuswinanti, Mahfudz, & Shahabuddin. 2014. Prospective of entomopathogenic fungi associated withHelopeltisspp. (Hemipter: Miridae) on cacao plantation.International Journal of Current Research and Academic Review2(11): 227–234.
Prayogo, Y. & Suharsono. 2005. Optimalisasi pengendalian hama pengisap
polong kedelai (Riptortus linearis) dengan cendawan entomopatogen
Verticillium lecanii.Jurnal Litbang Pertanian24(4): 123–130.
Prayogo, Y. 2006. Upaya mempertahankan keefektifan cendawan entomopatogen
untuk mengendalikan hama tanaman pangan.Jurnal Litbang Pertanian
25(2): 47–54.
Reflinaldon, Trizelia, Hasmiandy, & J. Ganeshi. 2014.Pod borer of peanut and
potential entomopathogenic fungi for its control in West Sumatera. International Journal on Advanced Science Engineering information Technology4(4): 59–63.
Rosanti, K. T., I. R. Sastrahidayat, & A. L. Abadi. 2014. Pengaruh jenis air terhadap perkecambahan spora jamurColletotrichum capsicipada cabai danFusarium oxysporumF. sp.lycopersiciipada tomat.Jurnal HPT2(3): 109–120.
38
Salbiah, D., J. H. Laoh, & Nurmayani. 2013. Uji beberapa dosisBeauveria bassiana vuilleminterhadap larva hama kumbang tandukOryctes rhinoceros(Coleoptera; Scarabaeidae) pada kelapa sawit.Jurnal Teknobiologi4(2): 137–142.
Sandhu, S. S., A. K. Sharma, V. Beniwal, G. Goel, P. Batra, A. Kumar, S. Jaglan, A. K. Sharma, & S. Malhotra. 2011. Myco-biocontrol of insect pests: factors involved, mechanism, and regulation.Journal of Pathogens2012: 1–10.
Saputra, D. D., G. Mudjiono, & A. Afandhi. 2013. Penambahan asam cuka untuk meningkatkan produksi konidia, daya kecambah dan patogenisitas jamur Beauveria bassianaBalsamo (Deuteromycetes: Moniliales).Jurnal HPT 1(3): 60–68.
Sembel, D. T. 2010.Pengendalian Hayati. Penerbit ANDI. Yogyakarta. Seye, F., T. Bawin, S. Boukraa, J-Y. Zimmer, M. Ndiaye, F. Delvigne, & F.
Francis. 2014. Effect of entomopathogenicAspergillusstrains against the pea aphid,Acyrthosiphon pisum(Hemiptera: Aphididae).Applied
Entomology and Zoology49(3): 453–458.
Singh, K. & S. C. Pathak. 2010.Effect ofAspergillus fumigatusinfection on
cellular and humoral immune responses in red cotton stainer,Dysdercus
similis(Heteroptera: Pyrrhocoridae).Biological Forum—An International Journal2(1): 9–11.
Sphenothalami. 2013. Aspergillum &Aspergillus.
<http://www.englishbaby.com/findfriends/view_photo/766206>. Diakses pada 20 Maret 2015.
Sultana, R., Y. S. Wagan, M. Naeem, M. S. Wagan & I. Khatri. 2013.
Susceptibility of threeHieroglyphusspecies (Hemiacridinae: Acrididae: Orthoptera) to some strains of the entomopathogenic fungi from Pakistan. Canadian Journal of Pure and Applied Sciences7(2): 2325–2332.
Talekar, N. S., L-Y. Huang, H-H. Chou, & J-J. Ku.1995. Oviposition, feeding and developmental characteristics ofRiptortus Iinearis (Hemiptera: Alydidae), a Pest of Soybean.Zoological Studies34(2): 111–116.
Trizelia, U. Syam, & Y. Herawaty. 2010.Virulensi isolatMetarhiziumsp. yang
berasal dari beberapa rizosfer tanaman terhadapCrocidolomia pavonana
Fabricius (Lepidoptera: Pyralidae).Manggaro.10(2): 51–56.