= 0,249x + 0,053
Kurva standar glukosa untuk penentuan total gula
Kurva standar glukosa untuk penentuan gula reduksi dan kadar pati
83
Lampiran 2. Format uji organoleptik tepung ubi jalar ungu
FORMAT UJI ORGANOLEPTIK TEPUNG UBI JALAR UNGU
Nama Panelis : ………..
Tanggal : ………..
No. HP : ………..
Petunjuk :
Lampiran 3. Data pengamatan, daftar sidik ragam dan uji LSR pengaruh perlakuan awal (pre-ttreament) terhadap warna (nilai oHue) tepung ubi jalar ungu
Data pengamatan warna (nilai oHue) tepung ubi jalar ungu
Kombinasi perlakuan Ulangan Total Rataan
1 2 3
Daftar sidik ragam warna (nilai oHue) tepung ubi jalar ungu
85
Lampiran 4. Data pengamatan dan daftar sidik ragam pengaruh perlakuan awal (pre-treatment) terhadap nilai L* tepung ubi jalar ungu
Data pengamatan nilai L* tepung ubi jalar ungu
Kombinasi perlakuan Ulangan Total Rataan
1 2 3
Daftar sidik ragam warna nilai L* tepung ubi jalar ungu
Lampiran 5. Data pengamatan, daftar sidik ragam dan uji LSR pengaruh perlakuan awal (pre-treatment) terhadap nilai a* tepung ubi jalar ungu
Data pengamatan nilai a* tepung ubi jalar ungu
Kombinasi perlakuan Ulangan Total Rataan
1 2 3
Daftar sidik ragam warna nilai a* tepung ubi jalar ungu
87
Lampiran 6. Data pengamatan dan daftar sidik ragam pengaruh perlakuan awal (pre-treatment) terhadap nilai b* tepung ubi jalar ungu
Data pengamatan nilai a* tepung ubi jalar ungu
Kombinasi perlakuan Ulangan Total Rataan
1 2 3
Daftar sidik ragam warna nilai b* tepung ubi jalar ungu
Lampiran 7. Data pengamatan, daftar sidik ragam dan uji LSR pengaruh lama perendaman terhadap densitas kamba tepung ubi jalar ungu
Data pengamatan densitas kamba tepung ubi jalar ungu Kombinasi
Daftar sidik ragam densitas kamba tepung ubi jalar ungu
89
Lampiran 8. Data pengamatan dan daftar sidik ragam organoleptik warna tepung ubi jalar ungu
Data pengamatan organoleptik warna tepung ubi jalar ungu
Kombinasi perlakuan Ulangan Total Rataan
1 2 3
Daftar sidik ragam organoleptik warna tepung ubi jalar ungu
Lampiran 9. Data pengamatan dan daftar sidik ragam organoleptik aroma tepung ubi jalar ungu
Data pengamatan organoleptik aroma tepung ubi jalar ungu
Kombinasi perlakuan Ulangan Total Rataan
1 2 3
P1L1 7,93 7,07 7,73 22,73 7,58
P1L2 7,00 7,20 7,27 21,47 7,16
P1L3 7,07 7,67 7,13 21,87 7,29
P2L1 8,13 7,73 6,60 22,47 7,49
P2L2 7,27 6,87 6,60 20,73 6,91
P2L3 7,20 7,07 6,93 21,20 7,07
P3L1 8,07 7,33 6,87 22,27 7,42
P3L2 7,80 7,20 6,87 21,87 7,29
P3L3 7,00 6,93 6,20 20,13 6,71
Total 194,73
Rataan 7,21
Daftar sidik ragam organoleptik aroma tepung ubi jalar ungu
SK db JK KT F.Hitung F0,5 F0,1
Perlakuan 8 1,896626 0,237078 1,13 tn 2,51 3,71
P 2 0,223539 0,11177 0,53 tn 3,55 6,01
L 2 1,130206 0,565103 2,70 tn 3,55 6,01
L linier 1 1,011358 1,011358 4,83 * 4,41 8,29
L kuadratik 1 0,118848 0,118848 0,56 tn 4,41 8,29
P x L 4 0,542881 0,13572 0,64 tn 2,93 4,58
Galat 18 3,765926 0,209218
Total 26 5,662551
91
Lampiran 10. Data pengamatan dan daftar sidik ragam perlakuan awal (pre-treatment) dan lama perendaman terhadap indeks pencoklatan tepung ubi jalar ungu
Data pengamatan indeks pencoklatan tepung ubi jalar ungu
Kombinasi perlakuan Ulangan Total Rataan
1 2 3
Daftar sidik ragam indeks pencoklatan tepung ubi jalar ungu
Lampiran 11. Uji LSR pengaruh perlakuan awal (pre-treatment) dan lama perendaman serta interaksi antara perlakuan awal (pre-treatment) dan lama perendaman terhadap indeks
pencoklatan tepung ubi jalar ungu
Uji LSR pengaruh perlakuan awal (pre-treatment) terhadap indeks pencoklatan tepung ubi jalar ungu
Uji LSR pengaruh lama perendaman terhadap indeks pencoklatan tepung ubi jalar ungu
Uji LSR interaksi perlakuan awal (pre-treatment) dan lama perendaman terhadap indeks pencoklatan tepung ubi jalar ungu
93
Lampiran 12. Data pengamatan, daftar sidik ragam dan uji LSR pengaruh lama perendaman terhadap kadar air tepung ubi jalar ungu
Data pengamatan kadar air tepung ubi jalar ungu
Kombinasi perlakuan Ulangan Total Rataan
1 2 3
Daftar sidik ragam kadar air tepung ubi jalar ungu
SK db JK KT F.Hitung F0,5 F0,1
Uji LSR pengaruh lama perendaman terhadap kadar air tepung ubi jalar ungu
Lampiran 13. Data pengamatan, daftar sidik ragam, dan uji LSR pengaruh perlakuan awal (pre-treatment) terhadap derajat asam tepung ubi jalar ungu
Data pengamatan derajat asam tepung ubi jalar ungu
Kombinasi perlakuan Ulangan Total Rataan
1 2 3
Daftar sidik ragam derajat asam tepung ubi jalar ungu
SK db JK KT F.Hitung F0,5 F0,1
Uji LSR pengaruh perlakuan awal terhadap derajat asam tepung ubi jalar ungu
Jarak LSR Perlakuan Rataan Notasi
0,05 0,01 0,05 0,01
- - - P1 2,34 c C
2 0,0213 0,0292 P2 2,38 b B
95
Lampiran 14. Data pengamatan dan daftar sidik ragam antosianin tepung ubi jalar ungu
Data pengamatan antosianin tepung ubi jalar ungu
Kombinasi perlakuan Ulangan Total Rataan
1 2 3
Daftar sidik ragam daya serap air tepung ubi jalar ungu
Lampiran 15. Data pengamatan dan daftar sidik ragam daya serap air tepung ubi jalar ungu
Data pengamatan daya serap air tepung ubi jalar ungu
Kombinasi perlakuan Ulangan Total Rataan
1 2 3
P1L1 1,63 1,51 1,38 4,52 1,51
P1L2 1,64 1,58 1,47 4,69 1,56
P1L3 1,79 1,45 1,50 4,75 1,58
P2L1 1,64 1,63 1,54 4,80 1,60
P2L2 1,66 1,57 1,55 4,78 1,59
P2L3 1,67 1,73 1,35 4,76 1,59
P3L1 1,71 1,75 1,66 5,13 1,71
P3L2 1,85 1,75 1,36 4,96 1,65
P3L3 1,72 1,49 1,54 4,74 1,58
Total 43,12
Rataan 1,60
Daftar sidik ragam daya serap air tepung ubi jalar ungu
SK db JK KT F.Hitung F0,5 F0,1
Perlakuan 8 0,077414 0,009677 0,46 tn 2,51 3,71
P 2 0,04283 0,021415 1,02 tn 3,55 6,01
L 2 0,002853 0,001427 0,06 tn 3,55 6,01
L linier 1 0,002294 0,002294 0,10 tn 4,41 8,29 L kuadratik 1 0,000559 0,000559 0,02 tn 4,41 8,29 P x L 4 0,03173 0,007933 0,37 tn 2,93 4,58
Galat 18 0,376093 0,020894
Total 26 0,453507
97
Lampiran 16. Data pengamatan dan daftar sidik ragam daya serap minyak tepung ubi jalar ungu
Data pengamatan daya serap minyak tepung ubi jalar ungu
Kombinasi perlakuan Ulangan Total Rataan
1 2 3
Daftar sidik ragam daya serap minyak tepung ubi jalar ungu
Lampiran 17. Data pengamatan dan daftar sidik ragam swelling power tepung ubi jalar ungu
Data pengamatan swelling power tepung ubi jalar ungu
Kombinasi perlakuan Ulangan Total Rataan
1 2 3
P1L1 7,07 6,58 6,56 20,21 6,74
P1L2 7,40 7,09 6,74 21,23 7,08
P1L3 7,05 6,21 5,92 19,18 6,39
P2L1 6,45 6,38 6,44 19,27 6,42
P2L2 6,51 6,59 6,86 19,96 6,65
P2L3 6,61 6,89 6,98 20,48 6,83
P3L1 7,09 6,97 6,61 20,67 6,89
P3L2 7,10 6,45 6,48 20,03 6,68
P3L3 7,02 6,24 6,75 20,01 6,67
Total 181,03
Rataan 6,70
Daftar sidik ragam swelling power tepung ubi jalar ungu
SK db JK KT F.Hitung F0,5 F0,1
Perlakuan 8 1,110868 0,138859 1,30 tn 2,51 3,71
P 2 0,068569 0,034284 0,32 tn 3,55 6,01
L 2 0,140837 0,070419 0,66 tn 3,55 6,01
L linier 1 0,012602 0,012602 0,11 tn 4,41 8,29 L kuadratik 1 0,128235 0,128235 1,20 tn 4,41 8,29 P x L 4 0,901462 0,225366 2,11 tn 2,93 4,58 Galat 18 1,918706 0,106595
Total 26 3,029575
99
Lampiran 18. Data pengamatan dan daftar sidik ragam kelarutan (solubility) tepung ubi jalar ungu
Data pengamatan kelarutan (solubility) tepung ubi jalar ungu
Kombinasi perlakuan Ulangan Total Rataan
1 2 3
Daftar sidik ragam kelarutan (solubility) tepung ubi jalar ungu
Lampiran 19. Data pengamatan dan daftar sidik ragam baking expansion tepung ubi jalar ungu
Data pengamatan baking expansion tepung ubi jalar ungu
Kombinasi perlakuan Ulangan Total Rataan
1 2 3
P1L1 0,84 0,98 0,75 2,57 0,86
P1L2 1,13 1,14 0,86 3,13 1,04
P1L3 0,83 1,06 1,03 2,92 0,97
P2L1 1,15 0,98 1,01 3,14 1,05
P2L2 1,19 1,06 0,93 3,18 1,06
P2L3 1,16 0,87 0,94 2,97 0,99
P3L1 1,12 0,91 0,96 3,00 1,00
P3L2 0,97 0,88 0,88 2,72 0,91
P3L3 0,88 1,03 1,01 2,92 0,97
Total 26,54
Rataan 0,98
Daftar sidik ragam baking expansion tepung ubi jalar ungu
SK db JK KT F.Hitung F0,5 F0,1
Perlakuan 8 0,106393 0,013299 0,95 tn 2,51 3,71
P 2 0,032082 0,016041 1,15 tn 3,55 6,01
L 2 0,005768 0,002884 0,20 tn 3,55 6,01
L linier 1 0,000425 0,000425 0,03 tn 4,41 8,29 L kuadratik 1 0,005343 0,005343 0,38 tn 4,41 8,29 P x L 4 0,068544 0,017136 1,23 tn 2,93 4,58 Galat 18 0,250265 0,013904
Total 26 0,356658
101
Lampiran 20. Penentuan perlakuan terbaik metode deGarmo
103
Lampiran 20. Penentuan perlakuan terbaik metode deGarmo
Lampiran 21. Data uji t dua sampel varian berbeda perlakuan kontrol dan perlakuan terbaik.
Data uji t dua sampel varian berbeda perlakuan kontrol dan perlakuan terbaik.
Parameter Rataan t hitung t tabel P (T ≤ t) Keterangan
105
Lampiran 22. Foto produk tepung ubi jalar ungu Lama perendaman Perlakuan
awal ( Pre-treatment)
10 menit 20 menit 30 menit
Natrium metabisulfit
Natrium
klorida
Asam askorbat
Lampiran 23. Foto produk tepung ubi jalar ungu dari metode perlakuan awal natrium metabisulfit dengan lama perendaman 20 menit perlakuan terbaik
Perlakuan Foto produk
P1L2U1 = Natrium metabisulfit 20 menit
Ulangan 1
P1L2U2 = Natrium metabisulfit 20 menit
Ulangan 2
P1L2U3 = Natrium metabisulfit 20 menit
74
DAFTAR PUSTAKA
Ambarsari, I., Sarjana, dan A. Choliq, 2009. Rekomendasi dalam penetapan standar mutu tepung ubi jalar. Jurnal Standarisasi, 11 (3) : 212-219.
Anderson, R. A. 1982. Water absorption and solubility and amylograph characteristics on rool-cooked small gain products. Cereal Chemistry. 59: 265-269.
Antarlina, S. S. 1993. Kandungan Gizi, Mutu Tepung Ubi Jalar serta Produk Olahannya. Laporan Bulanan. Balai Penelitian Tanaman Pangan, Malang. Antarlina, S. S. 1998. Teknologi Pengolahan Tepung Komposit Terigu-Ubi Jalar
Sebagai bahan baku industri pangan. Kumpulan Hasil Penelitian Terbaik Bogasari Nugraha. 105-118.
AOAC, 1995. Official Methods of Analysis of Assocition of Official Analitycal Chemists. Associattion of Official Analitycal hemist, Inc. Arlington, VA. Apandi, M. 1984. Teknologi Buah dan Sayur. Alumni, Bandung.
Apriliyanti, T. 2010. Kajian Sifat Fisikokimia dan Sensori Tepung Ubi Jalar Ungu (Ipomoea batatas balckie) Dengan Variasi Proses Pengeringan. Skripsi. Universitas Sebelas Maret, Surakarta.
Apriyantono, D., Fardiaz, D. Puspitasari, N. L. Sedarnawati dan Budiyanto, S. 1989. Petunjuk Laboratorium Analisis Pangan. Institut Pertanian Bogor, Bogor.
Aryani, 2002. Kajian pengolahan permen rumput laut (Glacilaria Sp) dengan konsentrasi gula yang berbeda terhadap tingkat penerimaan konsumen. Program Studi Teknologi Hasil Perikanan Jurusan Perikanan Faperta Universitas Palangka Raya.
Bangun, M. K. 2001. Perancangan Percobaan. Fakultas Pertanian USU, Medan. Bauernfeind, J. C, dan Pinkert, D. M. 1970. Food processing with Added Ascorbic
Acid.Adv. Food Res. No. 18.
Bengtsston, G., Rahman, M. S., Stanley, R., dan Perera, C. O. 1998. Effect of specific pre treatment on the drying behavior of apple rings. In proceedings of the New Zealand Institute of Food Science and Technology and The Nutrition Society of New Zealand Conference, Nelson, New Zealand.
BPS Provinsi Sumatera Utara. 2015. Produksi Padi dan Palawija Sumatera Utara (Angka Ramalan II 2015). Berita Resmi Statistik No. 68/11/12/Thn. XVIII, 2 November 2015.
Braverman, J. B. S. 1963. Introduction to the Biochemistry of Foods. VI u. Amsterdam Elsevier Publishing comp, Belanda.
Burhanuddin. 2001. Strategi Pengembangan Industri Garam di Indonesia. Kanisius, Yogyakarta.
Cahyadi, W. 2006. Bahan Tambahan Pangan. Bumi Aksara, Jakarta.
Chichester, C. E. dan Tanner F. W. 1975. Anti Microbial and Food Additives. Chemical Rubber, Amsterdam.
Danilewicz, J. C., Seccombe, J. T., dan Whelan, J. 2008. Mechanism of interactionof polyphenols, oxygen, and sulfur dioxide in model wine and wine. American Journal of Enology and Viticultur. 59 (2).
deGarmo, E. D., Sullivan. W. G., dan Canada, J. R. 1984. Engineering Economics. Mc Millan Publishing Company, New York.
deMan, J. M., 1997. Kimia Makanan. Edisi Kedua. Penerjemah K. Padmawinata. ITB-Press, Bandung.
Demiate, I. M., Dupuy, N., Huvenne, J. P., Cereda, M. P., dan Wosiacki, G. 2000. Relationship between baking behavior of modified cassava starches and starch chemical structure determinded by FTIR spectroscopy. Carbohydrate Polymer. 42 : 149-158.
Desrosier, N. W. 1988. Teknologi Pengawetan Pangan. Edisi Ketiga. Penerjemah : Muchji Muljohardjo. UI-Press, Jakarta.
Dewan Standarisasi Nasional. 1994. Tapioka. SNI-01-3451-1994.
Direktorat Gizi Departemen Kesehatan RI. 1981. Daftar Komposisi Bahan Makanan. Penerbit Bhatara Karya Aksara, Jakarta.
Djauhari, A.B. 1998. Ubi Jalar (I. batatas) Sebagai Bahan Baku Tepung Terfermentasi, Kajian dari Pengaruh Lama Fermentasi pada Beberapa Klon dan Pengaruh Konsentrasi Asam Askorbat terhadap Lama Fermentasi. Tesis. PTP, Univ.Brawijaya. Malang.
76
Fardiaz, Dedi, Andarwulan, N., Wijaya, H., dan Puspitasari, N. L. 1992. Petunjuk Praktikum Teknik Analisis Sifat Kimia dan Fungsional Komponen Pangan. IPB-Press, Bogor.
Fatimah, D. dan Jannah, A. 2008. Efektivitas penggunaan asam sitrat dalam pembuatan gelatin tulang ikan bandeng (chanos-chanos forskal). Jurusan Kimia, Fakultas Sains dan Teknologi, Universitas Islam Negeri Maulana Malik Ibrahim, Malang.
Fennema, O.W., 1996. Principle of Food Science, Food Chemistry 2nd (ed). Marcel Dekker Inc, New York.
Ginting, E., Utomo, J. S., Yulifianti, R., dan Jusuf, M. 2011. Potensi ubi jalar ungu sebagai pangan fungsional. Iptek Tanaman Pangan. 6 (1) : 116-138. Ginting, E., Widodo, Y. Rahayuningsih, S. A., dan Jusuf. M. 2005. Karakteristik
pati beberapa varietas ubi jalar. Penelitian Pertanian Tanaman Pangan. 24 (1) : 8-18.
Giusti, M. M., dan Wrolstad, R. E. 2001. Characterization and Measurement of Anthocyanin by UV-Visible Spectroscopy. John Wiley and Sons Inc.http://Ipi.oregonstate.edu/ss01/anthocyanin.html. (01 Agustus, 2016). Hardoko., Hendarto, L., dan Siregar, T. M. 2010. Pemanfaatan ubi jalar ungu
(Ipomoea batatas L. Poir) sebagai pengganti sebagian tepung terigu dan sumber antioksidan pada roti tawar. Jurnal Teknologi dan Industri Pangan. 21 (1) : 25-32.
Harzau, H. dan Estiasih, T. 2013. Karakteristik cookies umbi inferior uwi putih (kajian proporsi tepung uwi:pati jagung dan penambahan margarin. Jurnal Pangan dan Agroindustri. 1(1) : 138-147.
Hildayati, R. 2005. Pengaruh lama perendaman natrium metabisulfit (Na2S2O5)
dan lama pengeringan terhadap mutu tepung sukun (Artocarpus communis). Skripsi. Universitas Sumatera Utara, Medan.
Husna, N. E., Novita, M., dan Rohaya, S. 2013. Kandungan antosianin dan aktivitas antioksidan ubi jalar ungu segar dan produk olahannya. Agritech. 33 (3) : 296-302.
Hutchings, J. B. 1999. Food Color and Appearance. Aspen Publisher Inc Gaithersburg, Maryland.
Isnaharani, Y. 2009. Pembuatan Tepung Jerami Nangka Dalam Pembuatan Cookies Serat. Skripsi. Fakultas Ekologi Manusia, Institut Pertanian Bogor, Bogor.
Iyengar R. J. A. dan Evily, Mc. 1992. Anti browning agents : Alternatives to the use of sulfite in foods Trends in food Technology. Elsevier trends. Journal. United Kingdom. 3. 60-63.
Juanda, D. dan Cahyono, B. 2000. Ubi Jalar, Budi Daya dan Analisis Usaha Tani. Kanisius, Yogyakarta.
Kadarisman, D. dan Sulaeman, A. 1993. Teknologi Pengolahan Ubi Kayu dan Ubi Jalar. IPB, Bogor.
Koeswara S. 1991. Kontrol Terhadap Reaksi Browning dalam Pengolahan Pangan. PAU Pangan dan Gizi, Institut Pertanian Bogor, Bogor.
Koswara, S. 2009a. Ubijalar dan Hasil Olahannya (Teori dan Praktek). Produk Patiseri. Proyek Akhir. Universitas Negeri Yogyakarta, Yogyakarta.
Kumalaningsih, S., Harijono, dan Amir, Y. F. 2011. Pencegahan pencokelatan umbi ubi jalar (Ipomoea batatas (L). Lam.) untuk pembuatan tepung : pengaruh kombinasi konsentrasi asam askorbat dan sodium acid pyrophosphate. Jurnal Teknologi Pertanian. 5 (11) : 11-19.
Kusumawati, D. D., Amanto, B. S., dan Muhammad, D. R. A. 2012. Pengaruh perlakuan pendahuluan dan suhu pengeringan terhadap sifat fisik, kimia dan sensori tepung biji nangka (Artocarpus heterophyllus). Jurnal Teknologi Pangan. 1 (1) : 41-48.
Laminkara O. 2002. Fresh-Cut Fruits and Vegetables Science, Technology, and Market. CRC Press, New York.
Lauria E, Kervinen R, dan Ahvenainen R. 2001. The inhibition of enzymatic browning in minimally processed vegetables and fruits. Phostharvest News and Information. 9 (4) : 53-66.
78
Lisinska, G. dan Leszcynski, W. 1989. Potato Science and Technology. Elsevier Science Publishers, New York. 391.
Mazza, G. dan Qi, H. 1991. Control of After Cooking Darkening in Potatoes with Edible Film-forming Products and CaCl2. Journal Agriculture Food
Chemistry. 39 (12) : 2163 - 2166.
Moehyi, S. 1992. Penyelenggaraan Makanan Institusi dan Jasa Boga. Bhratara, Jakarta.
Morsy, E. M. 1991. The Final Technical Report on: Aloe Vera Stabilization and Processing fot the Cosmetic, Beverage and Food Industries (5rd ed). CITA International, USA.
Murtiningsih dan Suyanti, 2011. Membuat Tepung Umbi dan Variasi Olahannya. Jurnal Litbang Pertanian 24 (3) : 56 - 65.
Nollet, L. M. L. 1996 Handbook of Food Analysis.Vol. 1. Marcel Dekker, Inc. NY, Basel.
Okaka, J. C. dan Potter, N. N. 1977. Functional and storage properties of cowpea-wheat flour blends in bread making. J. Food Science. 42: 828-833.
Park, E. Y, dan Luh, B. S. 1985. Polyphenol Oxidase of Kiwi fruit. J. Food Sci.
Pudjihastuti, I dan Sumardiono, S. 2010. Pengembangan Proses Inovatif Kombinasi Reaksi Hidrolisis Asam dan Reaksi Photokimia UV untuk Produksi Pati Termodifikasi dari Tapioka. Prosiding Seminar Nasional Teknik Kimia. ISSN 1693 – 4393.
Purwanto, C. C., Ishartani, D dan Rahadian, D. 2013. Kajian sifat kimia dan fisik tepung labu kuning (Cucurbita moschata) dengan perlakuan blanching dan perendaman dalam natrium metabisulfit (Na2S2O3). Jurnal Teknosains
Pangan. 2 (2) : 93-102.
Rahmat, R. 1997. Ubi Jalar. Kanisius, Yogyakarta.
Richana N., Budiyanto, A., dan Mulyawati, I. 2010. Pembuatan Tepung Jagung Termodifikasi dan Pemanfaatannya untuk Roti. Prosiding Pekan Serealia Nasional Balai Besar Litbang Pascapanen.
Richana, N. 2012. Ubi Kayu & Ubi Jalar. Nuansa, Bandung.
Rindasmara, Y.S., 2008. Penghilangan Rasa Gatal Pada Talas. http://www.ebookpangan.com (23 Maret 2016).
Rohmah, M. 2012. Karakterisasi sifat fisikokimia tepung dan pati pisang kapas (Musa comiculata). Jurnal Teknologi Pertanian. 8 (1) : 20-24.
Sarwono, B. 2005. Ubi Jalar: Cara Budi Daya yang Tepat, Efisien dan Ekonomis. Penebar Swadaya, Jakarta.
Sathe, S. K. dan Salunte, D. K. 1981. Isolation, partial characterization and modification of the great northern bean (Phaseolus vulgaricus L.). Journal of Food Science. 46 : 617-612.
Schuler, P. 1990. Natural Antioxidant Exploited Commercially. Dalam Food Antioksxidant. Elsevier Science Publishing, Canada.
Shahidi, F dan Nackz, M. 1995. Phenolic compounds in cereals and legumes. In: Food Phenolics: Sources, Chemistry, Effects, Applications. Technomic Publ. Co. Inc. Lancaster PA: 13–18.
Siddiq, M., Sinha, N. K., dan Cash, J. N. 1992. Characterization of polyphenoloxidase from Stanley Plums. Journal of Food. Science. 57 (5) : 1177-1179.
Slamet, A. 2010. Pengaruh perlakuan pendahuluan pada pembuatan tepung ganyong (Canna edulis) terhadap sifat fisik dan amilografi tepung yang dihasilkan. Agrointek. 4:(2). 70-78.
Soekarto, E., 1985. Penilaian Organoleptik untuk Pangan dan Hasil Pertanian. Bharatara Karya Aksara, Jakarta.
Suardi, D. 2005. Potensi Beras Merah untuk Peningkatan Mutu Pangan. Jurnal Teknologi dan Industri Pangan.
Suarni, I. U., Firmansyah, dan Aqil, M. 2013. Keragaman mutu pati beberapa varietas jagung. Penelitian Pertanian Tanaman Pangan. 32 (1) : 50-56. Suda, I., Oki, T., Masuda, M., Kobayashi, M., Nishiba, Y., dan Furuta, S. 2003.
80
Sudarmadji, S., Haryanto, B., dan Suhardi, 1997. Prosedur Analisa untuk Bahan Makanan dan Pertanian. Liberty, Yogyakarta.
Sulistiyo, C. N. 2006. Pengembangan brownies kukus tepung ubi jalar (Ipomoea Batatas L.) di PT. Fits Mandiri Bogor. Skripsi. Fakultas Teknologi Pertanian, IPB, Bogor.
Suprapto, H. 2006. Pengaruh perendaman pisang kepok (Musa acuminax balbisiana calla) dalam larutan garam terhadap mutu tepung yang dihasilkan. Jurnal Teknologi Pertanian 1 (2) : 74 - 80.
Suprapto. 2004. Pengaruh Lama Blanching Terhadap Kualitas Stik Ubi Jalar (Ipomoea batatas L.) dari tiga varietas. Prosiding Temu Teknis Nasional Tenaga Fungsional Pertanian. Pusat Penelitian dan Pengembangan Peternakan. 220-228.
Susanto, T. dan Saneto, B. 1994. Teknologi Pengolahan Hasil Pertanian. Bina Ilmu, Surabaya.
Syafii, I. 1981. Percobaan Pembuatan Tepung Mannan dari Umbi Iles-Iles (Amorphophallus variabilis BI). Fakultas Teknologi Pertanian, ITB- Bogor.
Syarief, R. dan Irawati, A. 1988. Pengetahuan Bahan Untuk Industri Pertanian. Mediyatama Sarana Perkasa, Jakarta.
Uritani, I. 1982. Postharvest Physiology and Pathology of Sweet Potato from The Biochemical View Point. In Sweet Potato : Proc. of The First International Simposium. Villareal, R.L. and T.D. Griggs (Eds.), 421- 428. AVRDC, Shanhua, Tainan, Taiwan, China.
Widhaswari, V. A. dan Putri, W. D. R. 2014. Pengaruh modifikasi kimia dengan STTP terhadap karakteristik tepung ubi jalar ungu. Jurnal Pangan dan Agroindustri. 2 (3) : 121-128.
Widiyowati, I. I. 2007. pengaruh lama perendaman dan kadar natrium metabisulfit dalam larutan perendaman pada potongan ubi jalar kuning (Ipomoea batatas (L.) Lamb) terhadap kualitas tepung yang dihasilkan. Jurnal Teknologi Pertanian 2 (2) : 55-58.
Widowati, S. 2009. Tepung aneka umbi sebuah solusi ketahanan pangan. Balai Besar Penelitian dan Pengembangan Pascapanen Pertanian.
Widowati, S., Suismono, Suarni, Sutrisno, dan Komalasari, O. 2002. Petunjuk teknis proses pembuatan aneka tepung dari bahan pangan sumber karbohidrat lokal. Balai Penelitian Pascapanen Pertanian, Jakarta.
Wikipedia, 2010. http://www.wikipedia.com (26 Januari 2016).
Winarno, F. G. 1993. Pangan Gizi, Teknologi, dan Konsumen. Gramedia Pustaka Utama, Jakarta.
Winarno, F. G. 2002. Kimia Pangan dan Gizi. Gramedia Pustaka Utama, Jakarta. Youn, K. S., dan Choi, Y. H. 1996. Drying characteristics of osmotically
pre-treatedcarrot. Korean Journal of Food Science and Technology, 28, 11-28.
Yuwono, S. S., Febrianto, K., dan Dewi, N. S. 2013. Pembuatan beras tiruan berbasis modified cassava flour (mocaf) :kajian proporsi mocaf: tepung beras dan penambahan tepung porang. Jurnal Teknologi Pertanian.14 (3) :175-182.
Zawitowski, J., Biliaderis, C. G., dan. Eskin, N. A. M. 1991. Poliphenol Oxidase dalam Robinson dan N. A. Eskin (Eds), Oxydative Enzym in Food. Elsevier, New York.
30
BAHAN DAN METODA
Waktu dan Tempat Penelitian
Penelitian ini dilaksanakan pada bulan April–Oktober 2016 di Laboratorium Analisa Kimia Bahan Pangan dan Laboratorium Teknologi
Pangan, Program Studi Ilmu dan Teknologi Pangan, Fakultas Pertanian, Universitas Sumatera Utara, Medan.
Bahan Penelitian
Bahan penelitian yang digunakan adalah ubi jalar ungu varietas Ayamurasaki dengan tingkat kematangan yang optimal dengan ciri ubi jalar berwarna ungu cerah. Bahan kimia yang digunakan dalam penelitian ini adalah larutan natrium metabisulfit 2000 ppm, larutan natrium klorida 2000 ppm, larutan asam askorbat 2000 ppm, larutan asam trikloroasetat 10 %, larutan NaOH 45 %, larutan NaOH 1,25 N, larutan NaOH 1 N, larutan NaOH 0,05 N, larutan indikator
fenolftalein 1 %, larutan HCl 25 %, larutan HCl 1 %, HCl 0,1 N, larutan HCl 0,02 N, larutan buffer HCl-KCl pH 1, larutan buffer asetat pH 4,5,
larutan H2SO4 0,325 N, larutan etanol 95 %, larutan alkohol 80 %, larutan
alkohol 10 %, larutan asam asetat 1 N, larutan iodin 0,1 N, larutan fenol 5 %, larutan pereaksi asam 3,5-dinitrosalisilat (DNS).
Alat Penelitian
Alat yang digunakan untuk pembuatan tepung ubi jalar yaitu slicer
elektrik, oven pengering, disc mill, dan sieve shaker ayakan 60 mesh. Peralatan yang digunakan untuk analisa karakteristik fisikokimia dan fungsional tepung ubi
jalar ungu meliputi timbangan analitik, gelas ukur, corong, buret, pipet tetes, pipet volume, erlenmeyer, beaker glass, corong buchner, stirer, magnetik stirer, labu ukur, spatula kaca, spatula alumunium, gelas aluminium, tabung sentrifuse, sentrifuse, tabung reaksi, rak tabung, pipet skala, cawan porselen, cawan aluminium, labu kjeldhal, alat destilasi, kertas saring, soxhlet, kondensor, kertas whatman no.1, no. 2, dan no. 41, vortex, desikator, waterbath, pemanas listrik, oven (tipe BMV 30), oven pemanggang listrik, kromameter (tipe CR-400, Jepang), tanur (tipe EML 11/2) dan spektrofotometer UV (Genesys 20).
Metode Penelitian
Penelitian ini dilakukan dengan menggunakan rancangan acak lengkap (RAL), yang terdiri dari dua faktor, yaitu:
Faktor I : Perlakuan Awal (P)
P1 = Perendaman dalam larutan natrium metabisulfit 2000 ppm
P2 = Perendaman dalam larutan natrium klorida 2000 ppm
P3 = Perendaman dalam larutan asam askorbat 2000 ppm
Faktor II : Lama Perendaman Dalam Larutan Pencegah Pencoklatan (L) L1 = 10 menit
L2 = 20 menit
L3 = 30 menit
32
Model Rancangan
Penelitian ini dilakukan dengan model rancangan acak lengkap (RAL) dua faktorial dengan model sebagai berikut:
ijk = µ + αi + βj + (αβ)ij + εijk
dimana:
ijk : Hasil pengamatan dari faktor P pada taraf ke-i dan faktor L pada taraf
ke-j dalam ulangan ke-k µ : Efek nilai tengah
αi : Efek faktor P pada taraf ke-i
βj : Efek faktor L pada taraf ke-j
(αβ)ij : Efek interaksi faktor P pada taraf ke-i dan faktor L pada taraf ke-j
εijk : Efek galat dari faktor P pada taraf ke-i dan faktor L pada taraf ke-j dalam
ulangan ke-k
Apabila diperoleh hasil yang berbeda nyata dan sangat nyata maka uji dilanjutkan dengan uji beda rataan, menggunakan uji Least Significant Range
(LSR).
Pelaksanaan Penelitian
Pembuatan tepung ubi jalar ungu dilakukan dengan cara memilih ubi jalar ungu dengan bentuk umbi yang bulat lonjong, kulit umbi berwarna ungu dan tidak terkelupas, serta daging umbi berwarna ungu. Ubi jalar ungu kemudian disortasi, dikupas, dicuci, dan diiris dengan ketebalan 2 mm dengan menggunakan slicer. Irisan umbi dibagi menjadi 30 kelompokyang masing-masing diberikan perlakuan pendahuluan (pre-treatment) yang berbeda-beda berupa perendaman dengan jenis bahan perendam dan waktu perendaman yang berbeda-beda sesuai dengan
perlakuan yakni perendaman dalam larutan natrium metabisulfit, larutan garam natrium klorida dan larutan asam askorbat masing-masing dengan konsentrasi 2000 ppm selama 10 menit, 20 menit, dan 30 menit, dan kontrol hasil irisan umbi yang tidak diberi perlakuan. Masing-masing dibuat dalam 3 ulangan.
Setelah perendaman irisan umbi ditiriskan, kemudian disusun pada loyang untuk dikeringkan dalam oven pengeringan pada suhu 50 oC selama 20 jam, lalu
didinginkan. Irisan umbi yang sudah kering kemudian digiling dengan mesin penggiling dan diayak dengan ayakan 60 mesh hingga diperoleh tepung ubi jalar, dan selanjutnya dikemas dengan kemasan plastik polietilen yang kedap udara sebelum dianalisis. Masing-masing perlakuan dilakukan ulangan sebanyak 3 kali.
Pengamatan mutu tepung ubi jalar meliputi karakteristik fisik, kimia, dan fungsional. Karakteristik fisik tepung ubi jalar ungu yang diamati yaitu pengujian
warna (Metode Hunter), densitas kamba (Okaka dan Potter, 1977), uji organoleptik warna dan aroma (Soekarto, 1985) dan indeks pencoklatan
(Youn dan Choi 1966). Karakteristik kimia tepung ubi jalar ungu yang diamati yaitu kadar air (AOAC, 1995), derajat asam (Dewan Standarisasi Nasional, 1994), dan penentuan antosianin (Giusti dan Wrolstad, 2001). Pengujian sifat fungsional tepung meliputi daya serap air dan minyak (Sathe dan Salunkhe, 1981), swelling power (Leach, dkk., 1959), kelarutan atau solubility (Anderson, 1982), dan uji
baking expansion (Demiate, dkk.,2000).
Pengamatan dan Metode Pengukuran Data
34
Perlakuan yang memberikan pengaruh berbeda nyata atau sangat nyata dilanjutkan dengan uji LSR. Pemilihan perlakuan terbaik didapatkan dengan mempertimbangkan nilai organoleptik warna, aroma, antosianin, swelling power,
baking expansion, daya serap air, dan indeks pencoklatan dengan menggunakan indeks efektivitas metode deGarmo (1984). Metode deGarmo sudah digunakan untuk menentukan perlakuan terbaik dalam penelitian Harzau dan Estiasih (2013), Aryani (2002) dan Fatimah dan Jannah (2008).
Masing-masing parameter diberikan bobot variabel (BV) dengan angka 0 – 1. Besar bobot ditentukan berdasarkan tingkat kepentingan parameter.
Semakin tinggi tingkat kepentingan maka semakin tinggi nilai bobot variabel yang diberikan. Bobot normal (BN) setiap parameter ditentukan dengan cara membagi BV dengan jumlah semua bobot variabel. Nilai efektivitas (Ne) diperoleh dengan rumus:
Ne = Nilai Terbaik (NBk) - Nilai Terburuk (NBr)Nilai Perlakuan (NP) - Nilai Terburuk (NBr)
Nilai hasil dari masing-masing parameter ditentukan dari hasil perkalian antara nilai efektivitas (Ne) dengan bobot normal (BN). Nilai hasil dari tiap parameter dijumlahkan untuk mengetahui total nilai hasil. Total Nh yang tertinggi menunjukkan hasil perlakuan terbaik.
Tepung ubi jalar dengan mutu terbaik selanjutnya dianalisis kadar abu (Sudarmadji, dkk., 1997), kadar protein (metode Kjeldahl, AOAC, 2005), kadar lemak (AOAC, 1995), kadar serat kasar (AOAC, 1995), kadar pati dengan metode hidrolisis asam (Apriyantono, dkk., 1989), amilosa dan amilopektin (Apriyantono, dkk., 1989), gula reduksi (Apriyantono, dkk., 1989), dan total gula (Apriyantono, dkk., 1989).
Karakteristik Fisik
Warna (metode Hunter)
Penentuan warna dengan metode hunter mengacu pada prosedur Hutching (1999). Warna diukur menggunakan alat kromameter Minolta (tipe CR 200, Jepang). Sampel diletakkan pada wadah yang telah tersedia, kemudian ditekan tombol start dan akan diperoleh nilai L, a, dan b dari sampel dengan kisaran 0 (hitam) sampai ± 100 (putih). Notasi “a “ menyatakan warna kromatik campuran merah-hijau dengan nilai “+a” (positif) dari 0 sampai + 100 untuk warna merah dan nilai “–a “ (negatif) dari 0 sampai – 80 untuk warna hijau.
Notasi “b” menyatakan warna kromatik campuran biru-kuning dengan nilai nilai “+b” (positif) dari 0 sampai + 70 untuk warna kuning dan nilai “–b “ (negatif) dari
0 sampai – 80 untuk warna biru. Sedangkan L menyatakan ketajaman warna. Semakin tinggi ketajaman warna, semakin tinggi nilai L. Selanjutnya dari nilai a dan b dapat dihitung oHue dengan rumus :
oHue = tan-1 . Jika hasil yang diperoleh:
18o– 54o maka produk berwarna red (R)
54o– 90o maka produk berwarna yellow red (YR)
90o – 126o maka produk berwarna yellow (Y)
126o– 162o maka produk berwarna yellow green (YG) 162o – 198o maka produk berwarna green (G)
198o– 234o maka produk berwarna blue green (BG) 234o– 270o maka produk berwarna blue (B)
36
342o– 18o maka produk berwarna red purple (RP)
Densitas kamba
Penentuan densitas kamba mengacu pada prosedur Okaka dan Potter (1977). Sampel sebanyak 20 g dimasukkan ke dalam gelas ukur
100 ml sambil ditepuk-tepuk 20-30 kali dengan menggunakan jari agar memadat, kemudian volume sampel dicatat. Densitas kamba dihitung sebagai berikut :
Densitas Kamba (g/ml) = Volume sampel (ml)Berat sampel (g)
Uji organoleptik warna
Penentuan uji organoleptik warna mengacu pada prosedur Soekarto (1985). Analisis sensoris terhadap sampel tepung ubi jalar ungu
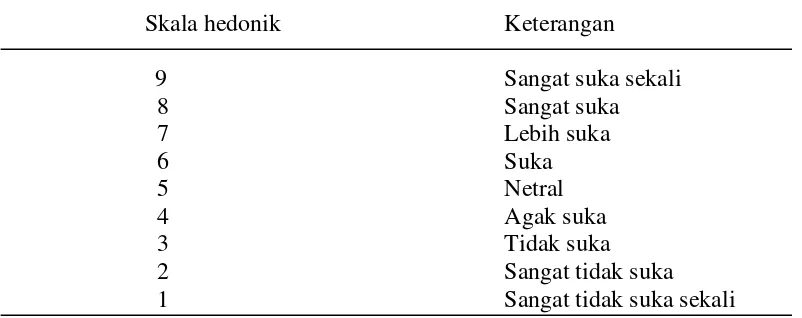
dilakukan dengan menentukan nilai organoleptik warna dan aroma. Sampel tepung ubi jalar yang telah diberi kode secara acak, diuji oleh 20 panelis. Pengujian dilakukan secara inderawi (organoleptik) yang ditentukan berdasarkan skala hedonik. Untuk skala hedonik disajikan pada Tabel 4.
Tabel 4. Skala nilai hedonik warna
Skala hedonik Keterangan
9 Sangat suka sekali
8 Sangat suka
7 Lebih suka
6 Suka
5 Netral
4 Agak suka
3 Tidak suka
2 Sangat tidak suka
1 Sangat tidak suka sekali
Uji organoleptik aroma
Penentuan uji organoleptik aroma mengacu pada prosedur Soekarto (1985). Analisis sensoris terhadap sampel tepung ubi jalar ungu
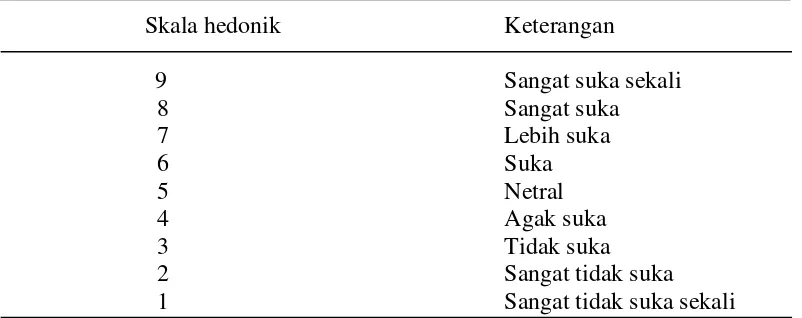
dilakukan dengan menentukan nilai organoleptik aroma. Sampel tepung ubi jalar yang telah diberi kode secara acak, diuji oleh 20 panelis. Pengujian dilakukan secara inderawi (organoleptik) yang ditentukan berdasarkan skala hedonik. Untuk skala hedonik disajikan pada Tabel 5.
Tabel 5. Skala nilai hedonik aroma
Skala hedonik Keterangan
9 Sangat suka sekali
8 Sangat suka
7 Lebih suka
6 Suka
5 Netral
4 Agak suka
3 Tidak suka
2 Sangat tidak suka
1 Sangat tidak suka sekali
Indeks pencoklatan
Penentuan indeks pencoklatan mengacu pada prosedur Youn dan Choi (1966). Sampel sebanyak 1 g tepung ubi jalar diekstraksi dengan
40 ml air destilata dan 10 ml larutan asam trikloroasetat 10 % dalam sebuah
38
Karakteristik Kimia
Kadar air
Penentuan kadar air mengacu pada prosedur AOAC (1995). Sampel sebanyak 5 g dimasukkan ke dalam cawan alumunium yang telah dikeringkan selama satu jam pada suhu 105 oC dan telah diketahui beratnya. Sampel tersebut dipanaskan pada suhu 105 oC selama tiga jam, kemudian didinginkan dalam
desikator sampai dingin kemudian ditimbang. Pemanasan dan pendinginan dilakukan berulang sampai diperoleh berat sampel konstan.
Berat sampel awal (g) – berat sampel akhir (g)
Kadar air (%) = x 100% Berat sampel awal (g)
Derajat asam
Penentuan derajat asam mengacu pada prosedur Dewan Standarisasi Nasional (1992). Sampel ditimbang sebanyak 1 g dimasukkan ke dalam labu ukur 100 ml dan ditambahkan alkohol yang telah dinetralkan dengan fenolftalein hingga batas tera. Sampel selanjutnya ditutup dengan aluminium foil dan dikocok menggunakan penggosok mekanik selama 1 jam. Setelah itu sampel disaring dengan menggunakan kertas saring Whatman No. 1, hasil saringan diambil 50 ml dan diberikan 3 tetes indikator fenolftalein dan dititrasi dengan NaOH 0,05 N. Derajat asam adalah banyaknya ml NaOH 0,05 N yang diperlukan untuk meniter 1 g contoh. Derajat asam dihitung dengan rumus:
Kadar antosianin
Penentuan antosianin mengacu pada prosedur Giusti dan Wrolstad (2001). Sampel ditimbang sebanyak 10 g dan dimasukkan kedalam erlenmeyer 100 ml. Kemudian diencerkan dengan larutan HCl 1% dalam metanol (untuk mengekstrak antosianin yang terkandung dalam sampel) sampai volume tertentu misalnya 50 ml, jika terdapat kandungan antosianin maka akan membentuk warna ungu kemerah-merahan. Setelah itu, didiamkan selama 16 jam, dan larutan di centrifuge
lalu diambil 1ml filtrat jernih ke dalam tabung reaksi kemudian ditambahkan 9 ml buffer HCl-KCl pH 1, dihomogenkan dengan vortex. Kemudian diambil 1 ml filtrat jernih ke dalam tabung reaksi dan ditambahkan 9 ml buffer asetat pH 4,5 dan di vortex. Absorbansinya dibaca dengan menggunakan spektrofotometer pada panjang gelombang 700 nm dan panjang gelombang maksimal sampel (520 nm). Data yang diperoleh dicatat.
Kadar antosianin ppm = A x FP x BM x 1000 Ʃ x berat sampel
Keterangan :
A = pH 1 (Panjang gelombang 520 nm – panjang gelombang 700 nm) – pH 4,5 (Panjang gelombang 520 nm – panjang gelombang 700 nm) BM = berat molekul antosianin yg di nyatakan dalam siaanidin 3 glukosida (449,2 gr/mol).
∑ = koefisien absorbsivitas ( 26900 L/mol ) yang di nyatakan sebagai sianidin 3 glukosida
Panjang gelombang maks = serapan warna paling tinggi pada sampel (520 nm) Panjang gelombang 700 nm = serapan warna antosianin yg di nyatakan sebagai
40
Karakteristik Fungsional
Daya serap air/minyak
Penentuan daya serap air/minyak mengacu pada prosedur Sathe dan Salunkhe (1981). Sampel ditimbang 1 g pati ditempatkan pada tabung
sentrifugasi yang telah diketahui beratnya kemudian ditambahkan 10 ml air atau minyak dan dikocok hingga homogen. Setelah itu dilakukan sentrifugasi pada 4000 RPM selama 40 menit. Air atau minyak dituang dan ditimbang berat tabung dan pastanya.
DSA/DSM (g/g) = berat akhir - berat tabung)Beratbahan kering - berat bahan kering
Keterangan : DSA : daya serap air DSM : daya serap minyak
Swelling power
Penentuan swelling power mengacu pada prosedur Leach, dkk., (1959). Pengujian swelling power dilakukan dengan melarutkan tepung ubi jalar sebanyak 1 g dalam aquadest 10 ml kemudian dipanaskan dalam waterbath pada suhu 90 °C selama 30 menit. Campuran disentrifugasi selama 30 menit dengan kecepatan 2200 rpm untuk memisahkan antara pasta dengan cairannya. Selanjutnya dibuang airnya lalu ditimbang berat supernatan. Swelling power
dihitung dengan menggunakan rumus:
Swelling power (%) =
(g) kering sampel Berat
(g) pasta Berat
x 100 %
Kelarutan (solubility)
Penentuan kelarutan (solubility) mengacu pada prosedur Anderson (1982). Sampel sebanyak 1 g tepung ubi jalar dimasukkan ke dalam tabung sentrifus dan ditambahkan 10 ml akuades, kemudian dikocok hingga tercampur merata. Campuran dipanaskan dalam waterbath suhu 90 °C selama 30 menit dan disentrifus dengan kecepatan 2200 rpm selama 30 menit. Supernatan dikumpulkan dan dimasukkan ke dalam cawan alumunium yang telah diketahui beratnya, kemudian dikeringkan pada oven suhu 105 °C hingga beratnya konstan. Berat padatan supernatan kering ditimbang. Kelarutan air dinyatakan dengan rumus:
Kelarutan air(%) = Berat padatan supernatan keringBerat sampel kering x 100%
Baking expansion
Penentuan baking expansion mengacu pada prosedur Demiate, dkk., (2000). Sebanyak 8 g pati ditambah 13,3 ml akuades, lalu
digelatinisasikan pada suhu 60 oC. Adonan lalu dioven pada suhu 200 °C selama 25 menit. Hasil panggangan kemudian didinginkan, ditimbang, kemudian dilapisi permukaannya dengan pencelupan dalam parafin. Volume hasil panggangan ditentukan dengan mencelupkan sampel dalam gelas ukur berisi air, hingga seluruh bagian terendam dan peningkatan volume dicatat.
42
Pengujian Perlakuan Terbaik
Kadar abu
Penentuan kadar abu mengacu pada prosedur Sudarmadji, dkk., (1997). Sampel yang telah dikeringkan dari hasil pengukuran kadar air ditimbang sebanyak 5 g. Sampel dimasukkan ke dalam cawan porselen yang telah diketahui berat awalnya dan dibakar selama 1 jam dalam tanur dengan suhu 100 oC, 2 jam
dengan suhu 300 oC kemudian dengan suhu 500 oC selama 2 jam. Cawan porselen didinginkan kemudian dikeluarkan dari tanur dan dimasukkan kedalam desikator selama 15 menit kemudian ditimbang. Kadar abu diperoleh rumus:
Kadar abu (%) = Bobot sampel awal (g) x 100%Bobot abu (g)
Kadar protein (metode Kjeldahl)
Penentuan kadar protein mengacu pada prosedur AOAC (1995). Sampel sebanyak 0,1 – 0,5 g yang telah dihaluskan dimasukkan ke dalam labu kjeldhal
selanjutnya ditambahkan dengan 2 ml H2SO4 pekat, 40 mg HgO, dan
1,9 mg K2SO4. Sampel dididihkan selama 1 – 1,5 jam atau sampai cairan
berwarna jernih. Labu beserta isinya didinginkan dan diencerkan dengan 20 ml aquades secara perlahan kemudian isinya dipindahkan ke dalam alat destilasi dan ditambahkan 10 ml larutan NaOH-Na2S2O3 (natrium tiosulfat). Labu erlenmeyer
berisi HBO3 diletakkan di bawah kondensor, sebelumnya ditambahkan ke
dalamnya 2 – 4 tetes indikator (campuran metil merah 0,02 % dalam alkohol dan metil biru 0,02 % dalam alkohol dengan perbandingan 2:1). Ujung tabung kondensor harus terendam dalam labu larutan HBO3, kemudian dilakukan
destilasi hingga sekitar 125 ml destilat dalam labu erlenmeyer. Ujung kondensor
kemudian dibilas dengan sedikit air destilat dan ditampung dalam erlenmeyer lalu dititrasi dengan HCl 0,02 N sampai terjadi perubahan warna. Penetapan blanko dilakukan dengan cara yang sama. Kadar protein dihitung dengan rumus:
Kadar protein (%) = (A - B) x N HCl x 14 x 6,25Berat sampel x 100%
Keterangan:
A = ml titrasi sampel B = ml titrasi blanko 14 = berat atom nitrogen 6,25 = faktor konversi
Kadar lemak
Penentuan kadar lemak mengacu pada prosedur AOAC (1995). Analisa lemak dilakukan dengan metode Soxhlet. Sampel sebanyak 5 g dibungkus dengan kertas saring, kemudian diletakan dalam alat ekstraksi Soxhlet. Alat kondensor dipasang diatasnya dan labu lemak di bawahnya. Pelarut lemak heksan dimasukkan ke dalam labu lemak, kemudian dilakukan reflux selama ± 6 jam sampai pelarut turun kembali ke labu lemak dan berwarna jernih. Pelarut yang ada dalam labu lemak didestilasi dan ditampung kembali. Kemudian labu lemak yang berisi lemak hasil ekstraksi dipanaskan dalam oven pada suhu 105 oC hingga
mencapai berat yang tetap, kemudian didinginkan dalam desikator. Labu beserta lemaknya ditimbang.
Kadar lemak (%)
(g) sampel Bobot
(g) lemak Bobot
44
Kadar serat kasar
Penentuan kadar serat kasar mengacu pada prosedur AOAC (1995). Sampel sebanyak 2 g dimasukan ke dalam labu erlenmeyer 300 ml kemudian ditambahkan 50 ml H2SO4 0,325 N, dihidrolisis selama 30 menit pada suhu
100 oC. Setelah itu didinginkan dan ditambahkan kembali NaOH 1,25 N sebanyak 50 ml dan dihidrolisis kembali selama 30 menit. Sampel disaring menggunakan kertas saring Whatman No. 41 yang telah dikeringkan dan diketahui beratnya. Kertas saring tersebut dicuci berturut-turut dengan akuades mendidih, 25 ml H2SO4 0,325 N, kemudian akuades mendidih dan yang terakhir dicuci dengan
etanol 95 %. Kertas saring yang telah dicuci selanjutnya dikeringkan dalam oven bersuhu 105 oC selama satu jam, pengeringan dilakukan hingga berat konstan. Kadar serat kasar dihitung dengan rumus:
Kadar serat kasar (%) = Berat kertas akhir (g) – berat kertas awal (g)
Bobot sampel awal (g) x 100%
Kadar pati (hidrolisis asam)
Penentuan kadar pati dengan metode hidrolisis asam mengacu pada prosedur Apriyantono, dkk., (1989). Terlebih dahulu pereaksi DNS dibuat dengan cara melarutkan 10,6 g asam 3,5-dinitrosalisilat dan 19,8 g NaOH ke dalam 1416 ml air, kemudian ke dalam larutan tersebut ditambahkan 306 g NaK-tartarat, 7,6 ml fenol yang telah dicairkan pada suhu 50 °C dan 8,3 g Na-metabisulfit,
dicampur merata. Pereaksi DNS distandarisasi dengan cara menitrasi 3 ml pereaksi DNS dengan HCl 0,1 N dengan indikator fenolftalein. HCl 0,1 N yang dibutuhkan 5-6 ml, jika kurang dari itu ditambahkan 2 g NaOH untuk setiap kekurangan 0,1 ml HCl 0,1 N.
Setelah itu dilakukan persiapan sampel dengan cara ditimbang pati sebanyak 2 g yang telah dihaluskan dimasukkan ke dalam beaker glass 250 ml, selanjutnya ditambahkan 50 ml alkohol 80 % dan diaduk selama 1 jam. Suspensi tersebut disaring dengan kertas saring dan dicuci dengan air sampai volume filtrat 250 ml. Filtrat ini mengandung karbohidrat yang terlarut dan dibuang.
Residu pati yang terdapat pada kertas saring dicuci sebanyak 5 kali dengan 10 ml eter. Eter dibiarkan menguap dari residu, kemudian cuci kembali dengan 150 ml alkohol 10 % untuk membebaskan lebih lanjut karbohidrat yang terlarut. Residu dipindahkan secara kuantitatif dari kertas saring ke dalam erlenmeyer dengan cara pencucian dengan 200 ml air dan ditambahkan 20 ml HCl 25 %. Kemudian erlenmeyer ditutup dengan penangas balik dan dipanaskan di atas penangas air sampai mendidih selama 2,5 jam pada suhu 100 °C. Residu dibiarkan dingin dan dinetralkan dengan larutan NaOH 45 % hingga ± pH 7 dan diencerkan sampai volume 500 ml. Campuran disaring kembali dengan kertas saring.
Setelah persiapan sampel selesai diukur gula reduksi dengan cara diambil 1 ml sampel dan dimasukkan ke dalam tabung reaksi bertutup, ditambahkan 3 ml pereaksi DNS. Sampel ditempatkan dalam air mendidih selama 5 menit dan dibiarkan dingin sampai suhu ruang. Sampel dibaca menggunakan spektrofotometer pada panjang gelombang 550 nm.
46
ke dalam tabung reaksi dan masing-masing ditambahkan akuades 9, 8, 6, dan 2 ml.
Setelah itu campuran tersebut dikocok atau dihomogenkan. Masing-masing dari campuran tersebut diambil 1 ml dan ditambahkan 3 ml DNS kemudian dikocok dan dipanaskan selama 5 menit dan didiamkan selama 30 menit. Selanjutnya intensitas warna yang terbentuk diukur absorbansinya menggunakan spektrofotometer pada panjang gelombang 550 nm. Kurva standar dibuat dengan memplot konsentrasi glukosa terhadap absorbansinya. (Lampiran 1)
Kadar pati (%) = Konsentrasi sampel (mg/ml) x FP x 100% Berat sampel (g) x 1000 x 0,9
Kadar amilosa dan amilopektin
Penentuan kadar amilosa dan amilopektin mengacu pada prosedur Apriyantono, dkk., (1989). Sampel sebanyak 0,1 g lalu dimasukkan ke dalam tabung reaksi. Selanjutnya ditambahkan 1 ml etanol 95 % dan 9 ml NaOH 1 N. Campuran tersebut dipanaskan dalam air mendidih selama 10 menit hingga semua terlarut kemudian didinginkan. Selanjutnya campuran tersebut dipindahkan ke dalam labu takar 100 ml dan ditambahkan akuades sampai tanda tera. Kemudian 5 ml larutan dipipet ke dalam labu takar 100 ml dan tambahkan 1 ml asam asetat 1 N, 2 ml larutan iod dan akuades hingga tanda tera. Lalu dikocok dan didiamkan selama 20 menit. Kemudian absorbansinya diukur dengan menggunakan panjang gelombang 620 nm.
Penetapan kurva standar amilosa dilakukan dengan cara menimbang 40 mg amilosa murni (amilosa kentang), kemudian dimasukkan ke dalam tabung reaksi lalu ditambahkan 1 ml etanol 95 % dan 9 ml NaOH 1 N. Campuran tersebut
dipanaskan ke dalam air mendidih selama 10 menit sampai semua bahan terlarut, kemudian didinginkan. Campuran tersebut dipindahkan ke dalam labu takar 100 ml dan ditambahkan akuades hingga tanda tera. Larutan campuran dipipet ke dalam labu takar 100 ml masing-masing 1 ml, 2 ml, 3 ml, 4 ml, dan 5 ml. Lalu ke dalam labu takar tersebut ditambahkan asam asetat 1 N berturut-turut 0,2 ml, 0,4 ml, 0,6 ml, 0,8 ml, 1 ml serta masing-masing 2 ml larutan iod. Kemudian ditambahkan akuades sampai tanda tera. Larutan dihomogenkan dengan menggunakan magnetik stirer lalu dibiarkan selama 20 menit, diukur absorbansinya dengan spektrofotometer pada panjang gelombang 620 nm yaitu hubungan panjang gelombang yang memberikan absorbansi maksimum untuk warna biru. Kurva standar amilosa dibuat dengan memplot konsentrasi amilosa dan absorbansinya. Konsentrasi kandungan amilosa ditentukan dengan menggunakan kurva standar, melalui persamaan linier yang diperoleh. Kadar amilosa dihitung dengan persamaan sebagai berikut:
Kadar amilosa (%) = Konsentrasi amilosa (mg/ml) x FP x 0,001 Berat sampel (g) x 100%
Total gula
48
Pengenceran sampel dilakukan dengan mengambil 1 ml sampel dan ditambahkan 19 ml akuades kemuaidan diaduk. Setelah persiapan sampel selesai, diukur total gula dengan cara diambil 1 ml sampel, ditambahkan 0,5 ml larutan fenol 5 %, ditambahkan dengan cepat 2,5 ml larutan asam sulfat pekat dengan cara menuangkan secara tegak lurus ke permukaan larutan. Dibiarkan selama 10 menit, dikocok. Diukur absorbansinya pada 490 nm. Kemudian ditentukan total gula sampel. Penetapan kurva standar menggunakan larutan glukosa standart dengan konsentrasi 0,005 g/ml dilakukan dengan cara menimbang 0,005 g glukosa, kemudian dimasukkan ke dalam labu ukur 100 ml. Ditambahkan akuades sampai tanda tera dan diaduk dengan menggunakan magnetik stirer. Selanjutnya masing-masing dipipet sebanyak 1, 2, 3, 4 dan 5 ml dimasukkan ke dalam tabung reaksi dan masing-masing ditambahkan ditambahkan 0,5 ml larutan fenol 5 %, ditambahkan dengan cepat 2,5 ml larutan asam sulfat pekat dengan cara menuangkan secara tegak lurus ke permukaan larutan. Larutan dibiarkan selama 10 menit, dikocok. Selanjutnya diukur absorbansinya menggunakan spektrofotometer pada panjang gelombang 490 nm. Kurva standar dibuat dengan memplot konsentrasi glukosa terhadap absorbansinya (Lampiran 1).
Total gula (%) = Konsentrasi sampel x FP Berat sampel (g) x 1000 x 100%
Gula reduksi
Penentuan gula reduksi mengacu pada prosedur Apriyantono, dkk., (1989).
Terlebih dahulu pereaksi DNS dibuat dengan cara melarutkan 10,6 g asam 3,5-dinitrosalisilat dan 19,8 g NaOH ke dalam 1416 ml air. Selanjutnya ke
dalam larutan tersebut ditambahkan 306 g NaK-tartarat, 7,6 ml fenol (cairkan
pada suhu 50 °C) dan 8,3 g Na-metabisulfit, dicampur merata. Larutan distandarisasi dengan cara dititrasi 3 ml pereaksi DNS dengan HCl 0,1 N dan indikator fenolftalein. Dibutuhkan 5-6 ml HCL 0,1 N, jika kurang dari itu ditambahkan 2 g NaOH untuk setiap kekurangan 0,1 ml HCl 0,1 N.
Setelah itu dilakukan persiapan sampel dengan cara ditimbang sampel sebanyak 5 g, ditambahkan 40 ml alkohol 80 % dan diaduk 1 jam. Sampel disaring dengan kertas saring dan dicuci dengan akuades sampai volume filtrat 100 ml. Sampel dipanaskan di waterbath hingga tidak berbau alkohol lagi (volume air berkurang ± 50 ml). Setelah itu sampel dimasukkan ke dalam labu ukur 50 ml dan ditambahkan akuades hingga tanda tera.
Setelah persiapan sampel selesai diukur gula reduksi dengan cara diambil 1 ml sampel dan dimasukkan ke dalam tabung reaksi tertutup, ditambahkan 3 ml pereaksi DNS. Sampel ditempatkan dalam air mendidih selama 5 menit dan dibiarkan dingin sampai suhu ruang. Sampel diencerkan bila perlu sampai dapat terukur pada kisaran 20-80 % T pada panjang gelombang 550 nm. Digunakan akuades sebagai blanko. Dibuat kurva standar.
50
Masing-masing dari campuran tersebut diambil 1 ml dan ditambahkan 3 ml DNS kemudian dikocok dan dipanaskan selama 5 menit. Didiamkan selama 30 menit. Selanjutnya diukur absorbansinya menggunakan spektrofotometer pada panjang gelombang 550 nm. Kurva standar dibuat dengan memplot konsentrasi glukosa terhadap absorbansinya (Lampiran 1)
Gula reduksi (%) = Konsentrasi sampel x FP Berat sampel (g) x 1000 x %
Gambar 8. Skema pembuatan tepung ubi jalar ungu
Didinginkan pada suhu ruang
Dihaluskan dengan menggunakan mesin penggiling Dikeringkan di oven dengan suhu 50 oC selama 20 jam
Diletakkan irisan diatas loyang
Direndam irisan dalam larutan perendam dan waktu perendaman yang berbeda
Diiris tipis-tipis 2-3 mm dengan slicer
Diayak dengan menggunakan ayakan 60 mesh dan dikemas dalam plastik polietilen
Analisa mutu kimia:
Tepung ubi jalar ungu mutu terbaik
52
HASIL DAN PEMBAHASAN
Pengaruh Perlakuan Awal (Pre-Treatment) dan Lama Perendaman Terhadap Karakteristik Fisik Tepung Ubi Jalar Ungu
Karakteristik fisik tepung ubi jalar ungu yang dihasilkan dari hasil penelitian meliputi warna (oHue) dengan kromameter, densitas kamba, uji organoleptik warna, organoleptik aroma dan indeks pencoklatan. Pengaruh metode perlakuan awal (pre-treatment) dan lama perendaman terhadap karakteristik fisik dari tepung ubi jalar ungu dapat dilihat pada Tabel 6 dan
Densitas kamba (g/ml) 0,58±0,03 0,57±0,03 0,58±0,05
Nilai organoleptik warna 7,61±0,96 6,73±0,75 6,51±0,94
Nilai organoleptik aroma 7,34±0,34 7,15±0,50 7,14±0,55
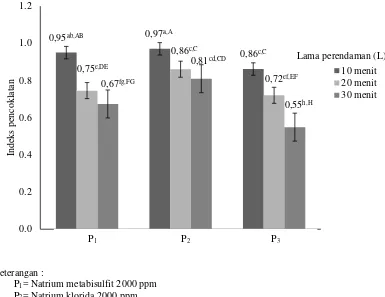
Indeks pencoklatan 0,78±0,12b,B 0,88±0,07a,A 0,71±0,13c,C
Keterangan: Angka dalam tabel merupakan rataan dari 3 ulangan, ± standard deviasi. Angka yang diikuti dengan huruf yang berbeda dalam satu baris menunjukkan berbeda nyata (P<0,05) (huruf kecil) dan berbeda sangat nyata (P<0,01) (huruf besar) dengan uji LSR.
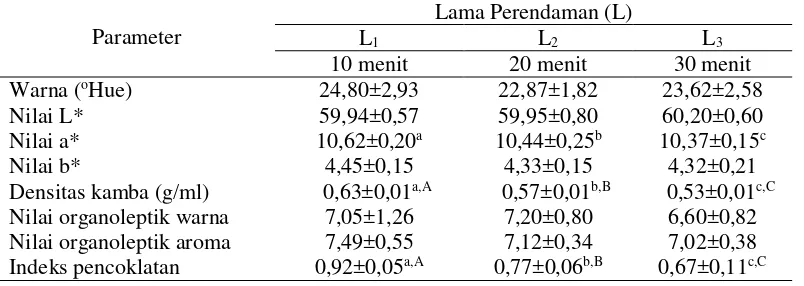
Tabel 7. Pengaruh lama perendaman terhadap karakteristik fisik yang diamati
Parameter
Lama Perendaman (L)
L1 L2 L3
10 menit 20 menit 30 menit
Warna (oHue) 24,80±2,93 22,87±1,82 23,62±2,58
Nilai L* 59,94±0,57 59,95±0,80 60,20±0,60
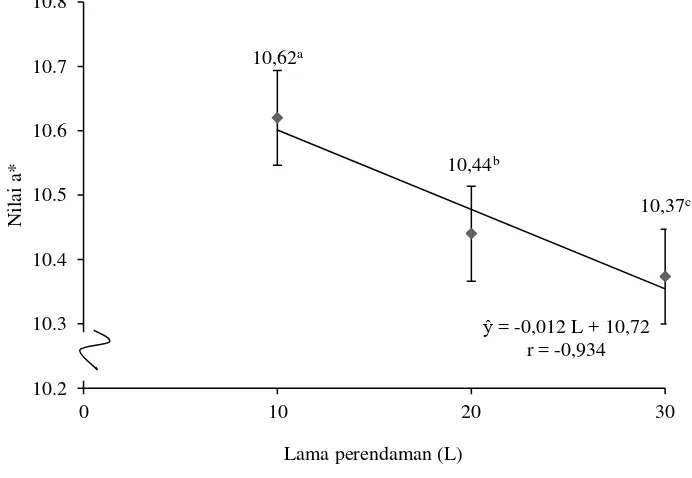
Nilai a* 10,62±0,20a 10,44±0,25b 10,37±0,15c
Nilai b* 4,45±0,15 4,33±0,15 4,32±0,21
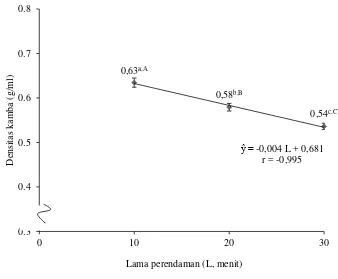
Densitas kamba (g/ml) 0,63±0,01a,A 0,57±0,01b,B 0,53±0,01c,C
Nilai organoleptik warna 7,05±1,26 7,20±0,80 6,60±0,82
Nilai organoleptik aroma 7,49±0,55 7,12±0,34 7,02±0,38
Indeks pencoklatan 0,92±0,05a,A 0,77±0,06b,B 0,67±0,11c,C
Keterangan: Angka dalam tabel merupakan rataan dari 3 ulangan, ± standard deviasi. Angka yang diikuti dengan huruf yang berbeda dalam satu baris menunjukkan berbeda nyata (P<0,05) (huruf kecil) dan berbeda sangat nyata (P<0,01) (huruf besar) dengan uji LSR.
52
Warna
Nilai warna tepung dilihat dari tingkat nilai kecerahan (L*), tingkat kemerahan (a*) dan tingkat kekuningan (b*) dari nilai °Hue. Lampiran 3 menunjukkan bahwa perlakuan awal memberikan pengaruh berbeda sangat nyata (P<0,01) terhadap nilai oHue tepung. Lama perendaman dan interaksi perlakuan awal (pre-treatment) memberikan pengaruh berbeda tidak nyata (P>0,05) terhadap nilai oHue tepung. Lampiran 4 menunjukkan bahwa menunjukkan perlakuan awal, lama perendaman dan interaksi perlakuan awal dan lama perendaman memberikan pengaruh berbeda tidak nyata (P>0,05) terhadap nilai L* tepung.
Lampiran 5 menunjukkan bahwa perlakuan awal (pre-treatment) memberikan pengaruh berbeda tidak nyata (P>0,05) terhadap nilai a* tepung. Lama perendaman memberikan pengaruh berbeda nyata (P<0,05) terhadap nilai a* tepung. Lama perendaman dan interaksi perlakuan awal (pre-treatment) memberikan pengaruh berbeda tidak nyata (P>0,05) terhadap nilai a* tepung.
Lampiran 6 menunjukkan bahwa perlakuan awal, lama perendaman dan interaksi perlakuan awal dan lama perendaman memberikan pengaruh berbeda tidak nyata (P>0,05) terhadap nilai b* tepung. Hubungan perlakuan awal (pre-treatment) dengan nilai oHue tepung dapat dilihat pada Gambar 9 dan hubungan lama perendaman dengan nilai a* tepung dapat dilihat pada Gambar 10.
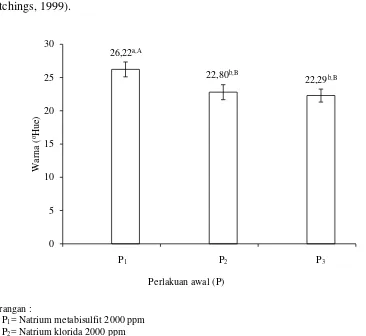
Gambar 9 menunjukkan bahwa perlakuan awal dengan menggunakan perlakuan perendaman natrium metabisulfit memberikan nilai oHue paling tinggi
54
coklat (Fennema, 1996). Sehingga semakin lama perendaman dalam natrium metabisulfit maka akan semakin efektif untuk menghambat reaksi pencoklatan pada tepung ubi jalar. Nilai oHue 18-54 menunjukkan warna merah
(Hutchings, 1999).
Keterangan :
P1= Natrium metabisulfit 2000 ppm
P2= Natrium klorida 2000 ppm
P3= Asam askorbat 2000 ppm
Gambar 9. Hubungan perlakuan awal (pre-treatment) dengan nilai oHue tepung (Error bar ± standar deviasi)
Nilai warna asam askorbat 22,29 oHue. Perubahan warna yang tidak
diinginkan akibat pencoklatan dapat diatasi dengan perlakuan perendaman dalam asam askorbat. Menurut Winarno (2002), asam askorbat merupakan reduktor yang kuat dan mampu bertindak sebagai oksigen scavenger, sehingga akan mencegah terjadinya oksidasi enzimatis senyawa-senyawa fenol yang terkandung dalam umbi-umbian. Penggunaan asam mampu menginaktivasi enzim, karena pH bahan akan diturunkan hingga dibawah pH 5 (Eskin, dkk., 1971).
Gambar 10. Hubungan lama perendaman dengan nilai a* tepung (Error bar ± standar deviasi)
Gambar 10 menunjukkan bahwa semakin lama waktu perendaman maka terjadi penurunan pada nilai a* tepung ubi jalar ungu. Nilai a* menunjukkan tingkat kemerahan suatu bahan. Penurunan tingkat kemerahan warna tepung ubi jalar ungu terjadi karena pigmen antosianin pada irisan ubi jalar ungu terlarut di dalam air perendaman. Sehingga semakin lama waktu perendaman semakin banyak pigmen antosianin yang terlarut di dalam air.
10,62a
10,44b
10,37c
= -0,012 L + 10,72 r = -0,934 10.2
10.3 10.4 10.5 10.6 10.7 10.8
0 10 20 30
Nilai
a*
56
Densitas kamba
Lampiran 7 menunjukkan bahwa perlakuan awal memberikan pengaruh berbeda tidak nyata (P>0,05) terhadap densitas kamba tepung. Lama perendaman memberikan pengaruh berbeda sangat nyata (P<0,01) terhadap densitas kamba tepung. Interaksi perlakuan awal dan lama perendaman memberikan pengaruh berbeda tidak nyata (P>0,05) terhadap densitas kamba tepung. Hubungan lama perendaman dengan densitas kamba dapat dilihat pada Gambar 11.
Gambar 11. Hubungan lama perendaman dengan densitas kamba tepung (Error bar ± standar deviasi)
Gambar 11 menunjukkan bahwa peningkatan lama perendaman akan menurunkan densitas kamba tepung. Densitas kamba adalah suatu massa dari partikel yang dapat menempati suatu volume tertentu. Jika semakin tinggi densitas kamba, hal ini menunjukkan bahwa produk tersebut akan semakin padat. Produk dapat dikatakan kamba jika mempunyai densitas kamba kecil yang artinya
memiliki volume besar namun berat produk ringan. Penentuan densitas kamba ini berhubungan dengan penentuan ruang penyimpanan dan juga kemasan suatu produk (Rohmah, 2012).
Amilosa dapat menyerap air yang lebih besar daripada amilopektin namun dapat dengan mudah pula melepaskan air kembali (Yuwono, dkk., 2013). Saat mengalami proses pengeringan, maka ukuran granula pati dengan ukuran yang lebih besar akan mudah mengalami proses penguapan dan tersisa ukuran granula pati yang lebih besar karena mengalami proses pembengkakan. Granula pati yang mengalami pembengkakan ini pula yang akan menyebabkan tekstur bahan yang lebih berpori sehingga perendaman yang semakin lama menghasilkan volume yang lebih besar dengan berat bahan yang sama pula. Volume bahan yang semakin besar dapat menurunkan densitas kamba bahan sehingga semakin lamanya waktu perendaman dapat menurunkan nilai densitas kamba tepung ubi jalar ungu yang dihasilkan.
Nilai organoleptik warna dan aroma
Lampiran 8 dan lampiran 9 menunjukkan perlakuan awal, lama perendaman dan interaksi perlakuan awal dan lama perendaman memberikan pengaruh berbeda tidak nyata (P>0,05) terhadap nilai organoleptik warna dan aroma tepung.
Indeks pencoklatan
58
awal (pre-treatment) dan lama perendaman terhadap indeks pencoklatan dapat dilihat pada Gambar 12.
Keterangan :
P1= Natrium metabisulfit 2000 ppm
P2= Natrium klorida 2000 ppm
P3= Asam askorbat 2000 ppm
Gambar 12. Hubungan interaksi perlakuan awal (pre-treatment) dan lama perendaman dengan indeks pencoklatan tepung (Error bar ± standar deviasi)
Gambar 12 menunjukkan bahwa peningkatan lama perendaman pada perlakuan awal memberikan pengaruh terhadap nilai indeks pencoklatan tepung, tetapi pada metode pemberian dengan asam askorbat lebih cenderung menurunkan nilai indeks pencoklatan tepung. Semakin lamanya waktu perendaman maka semakin menurunkan indeks pencoklatan pada tepung. Perendaman dengan menggunakan asam askorbat memiliki indeks pencoklatan yang lebih rendah. Hal ini disebabkan adanya pemberian asam askorbat yang dapat menurunkan pH pada saat proses perendaman sehingga dapat mendenaturasi protein enzim dan
menginaktivasi enzim fenolase dan polifenol oksidase yang menyebabkan terjadinya pencoklatan.
Sementara indeks pencoklatan P1 (perendaman dalam larutan natriun
metabisulfit 2000 ppm) dan P2 (perendaman dalam larutan natrium klorida
2000 ppm) memiliki nilai yang lebih tinggi. Faktor penting yang menentukan kecepatan reaksi pencoklatan adalah konsentrasi enzim dan substrat, pH, temperatur serta kesediaan oksigen dalam jaringan (Laurila, dkk., 2001). Pencegahan proses pencoklatan enzimatis dapat dilakukan dengan berbagai cara antara lain penggunaan panas, pencegahan kontak dengan oksigen, pemberian inhibitor dan penggunaan asam (Susanto dan Saneto,1994).
Menurut Siddiq dkk. (1992), aktifitas fenolase mencapai optimum pada pH 4-7, dan aktifitasnya sangat kecil pada pH 3. Oleh sebab itu penggunaan asam-asam organik sebagai penghambat dapat digunakan untuk menghambat reaksi pencoklatan dengan menurunkan pH di bawah 3. Asam organik yang dapat digunakan untuk menghambat reaksi pencoklatan enzimatik diantaranya adalah asam sitrat, asam malat dan asam tartarat (Iyengar dan Evily, 1992).
Pengaruh Perlakuan Awal (Pre-Treatment) dan Lama Perendaman Terhadap Karakteristik Kimia Tepung Ubi Jalar Ungu
60
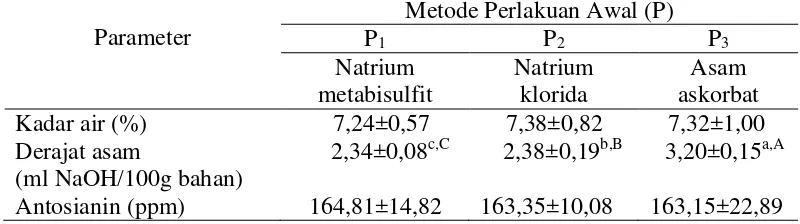
Tabel 8. Pengaruh perlakuan awal (pre-treatment) terhadap karakteristik kimia tepung ubi jalar ungu Antosianin (ppm) 164,81±14,82 163,35±10,08 163,15±22,89
Keterangan: Angka dalam tabel merupakan rataan dari 3 ulangan, ± standard deviasi. Angka yang diikuti dengan huruf yang berbeda dalam satu baris menunjukkan berbeda nyata (P<0,05) (huruf kecil) dan berbeda sangat nyata (P<0,01) (huruf besar) dengan uji LSR.
Tabel 9. Pengaruh lama perendaman terhadap karakteristik kimia tepung ubi jalar ungu Antosianin (ppm) 160,06±16,20 172,14±16,94 159,11±13,37
Keterangan: Angka dalam tabel merupakan rataan dari 3 ulangan, ± standard deviasi. Angka yang diikuti dengan huruf yang berbeda dalam satu baris menunjukkan berbeda nyata (P<0,05) (huruf kecil) dan berbeda sangat nyata (P<0,01) (huruf besar) dengan uji LSR.
Kadar air
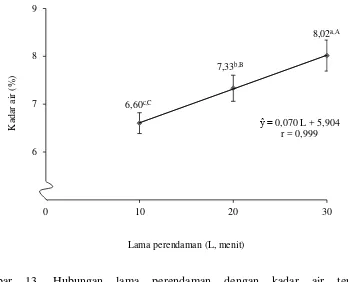
Lampiran 12 menunjukkan perlakuan awal memberikan pengaruh berbeda tidak nyata (P>0,05) terhadap kadar air tepung. Lama perendaman memberikan pengaruh yang berbeda sangat nyata (P<0,01) terhadap kadar air tepung. Interaksi perlakuan awal dan lama perendaman memberikan pengaruh berbeda tidak nyata (P>0,05) terhadap kadar air tepung. Hubungan perlakuan awal dengan kadar air tepung dapat dilihat pada Gambar 13.
Gambar 13 menunjukkan bahwa semakin lama waktu perendaman maka semakin meningkat kadar air pada tepung ubi jalar ungu. Hal ini disebabkan oleh semakin lama waktu perendaman yang menyebabkan air masuk ke dalam bahan
sehingga kadar airnya semakin tinggi. Tepung ubi jalar ungu yang direndam selama 10 menit mempunyai kadar air paling rendah. Artinya tepung tersebut lebih tahan terhadap pertumbuhan mikroba yang dapat merusak tepung jika dibandingkan dengan perendaman selama 30 menit yang memiliki kadar air paling tinggi.
Gambar 13. Hubungan lama perendaman dengan kadar air tepung (Error bar ± Standar deviasi)
62
menyebabkan terjadinya pembengkakan granula pati. Ukuran granula pati akan meningkat sampai batas tertentu sebelum akhirnya granula pati pecah (Winarno, 2002).
Derajat asam
Lampiran 13 menunjukkan perlakuan awal memberikan pengaruh berbeda sangat nyata (P<0,01) terhadap derajat asam tepung. Lama perendaman dan interaksi perlakuan awal dan lama perendaman memberikan pengaruh berbeda tidak nyata (P>0,05) terhadap derajat asam tepung. Hubungan perlakuan awal dengan derajat asam tepung dapat dilihat pada Gambar 14.
Keterangan:
P1= Natrium metabisulfit 2000 ppm
P2= Natrium klorida 2000 ppm
P3= Asam askorbat 2000 ppm
Gambar 14. Hubungan perlakuan awal (pre treatment) dengan derajat asam tepung (Error bar ± standar deviasi)
Gambar 14 menunjukkan bahwa perlakuan awal P1 memiliki nilai derajat