PENGARUH KONSENTRASI
CRUDE GLISEROL (LIMBAH BIODIESEL)
TERHADAP PERTUMBUHAN Lysinibacillus sphaericus strain HytAP-B60 DAN INDEKS EMULSIFIKASI BIOSURFAKTAN
YANG DIHASILKANNYA
FATHIN HAMIDA
PROGRAM STUDI BIOLOGI
FAKULTAS SAINS DAN TEKNOLOGI
UNIVERSITAS ISLAM NEGERI
SYARIF HIDAYATULLAH
PENGARUH KONSENTRASI
CRUDE GLISEROL (LIMBAH BIODIESEL)
TERHADAP PERTUMBUHAN Lysinibacillus sphaericus strain HytAP-B60 DAN INDEKS EMULSIFIKASI BIOSURFAKTAN
YANG DIHASILKANNYA
Skripsi
Sebagai Salah Satu Syarat untuk Memperoleh Gelar Sarjana Sains Pada Program Studi Biologi
Fakultas Sains dan Teknologi
Universitas Islam Negeri Syarif Hidayatullah Jakarta
FATHIN HAMIDA 105095003125
PROGRAM STUDI BIOLOGI
FAKULTAS SAINS DAN TEKNOLOGI
UNIVERSITAS ISLAM NEGERI
SYARIF HIDAYATULLAH
Pengesahan Ujian
Skripsi ini berjudul “PENGARUH KONSENTRASI CRUDE GLISEROL (LIMBAH BIODIESEL) TERHADAP PERTUMBUHAN Lysinibacillus
sphaericus strain HytAP-B60 DAN INDEKS EMULSIFIKASI
BIOSURFAKTAN YANG DIHASILKANNYA” telah diuji dan dinyatakan lulus dalam ujian sidang munaqasyah pada tanggal 1 Maret 2010. Skripsi ini telah diterima sebagai salah satu syarat untuk memperoleh gelar Sarjana Strata Satu (S1) Program Studi Biologi.
1 Maret 2010
Menyetujui,
Penguji 1,
DR. Lily Surayya Eka Putri, M.Env.Stud. NIP. 150 375 182
DR. Syopiansyah Jaya Putra, M. Sis. NIP. 196801172001121001
Ketua Program Studi Biologi
PERNYATAAN
DENGAN INI SAYA MENYATAKAN KEASLIAN SKRIPSI INI BENAR-BENAR HASIL KARYA SENDIRI YANG BELUM PERNAH DIAJUKAN SEBAGAI SKRIPSI ATAU KARYA ILMIAH PADA PERGURUAN TINGGI ATAU LEMBAGA MANAPUN
Jakarta, 1 Maret 2010
ABSTRAK
Fathin Hamida. Pengaruh Konsentrasi Crude Gliserol (Limbah Biodiesel) terhadap Pertumbuhan Lysinibacillus sphaericus strain HytAp-B60 dan Indeks Emulsifikasi Biosurfaktan yang Dihasilkannya. Skripsi. Program Studi Biologi. Fakultas Sains dan Teknologi. Universitas Islam Negeri Syarif Hidayatullah Jakarta.
Biosurfaktan, merupakan senyawa produk metabolit mikroba yang dapat mengemulsi minyak dalam air dan dapat dijadikan sebagai pengganti surfaktan sintetik untuk meningkatkan degradasi hidrokarbon dalam proses bioremediasi. Penelitian dilakukan untuk mengetahui pengaruh konsentrasi “crude gliserol biodiesel” terhadap pertumbuhan sel dan indeks emulsi yang dihasilkan oleh isolat bakteri L. sphaericus dari Cepu. Variasi konsentrasi “crude gliserol biodiesel” yang digunakan adalah 2%, 4%, dan 6% v/v. Penelitian dilakukan dalam kultur kocok yang berisi medium Bushnell-Haas pada pH 7, jumlah inokulum 5% v/v, suhu inkubasi 28oC dengan agitasi 120 rpm. Analisis data menggunakan analisis varian yang dilanjutkan dengan uji Duncan. Hasil menunjukkan bahwa tidak terdapat perbedaan nyata diantara konsentrasi 2%, 4%, dan 6% crude gliserol terhadap pertumbuhan L. sphaericus dan indeks emulsifikasi biosurfaktan yang dihasilkannya. Konsentrasi crude gliserol 2% merupakan konsentrasi optimal untuk pertumbuhan L. sphaericus dan indeks emulsifikasi. Dimana dihasilkan crude biosurfaktan sebanyak 6,7 g/l yang diekstraksi menggunakan kombinasi pelarut kloroform dan methanol (2:1 v/v).
ABSTRACT
Fathin Hamida. Effect of Crude Gycerol (Biodiesel waste) Concentration of
Lysinibacillus sphaericus Strain HytAp-B60 Growth and Biosurfactant
Production on Index of Emulsification. Minithesis. Departemen of Biology. Faculty of Science and Technology. Islamic State University. Jakarta
Biosurfactant, microbial metabolite whose properties like surfactant, can emulsify oil phase in water, suggested to replace chemically synthesized surfactant to increase degradation of hydrocarbon in order to enhance bioremediation. This research was done to the examine effect of crude biodiesel glycerol concentrations on growth of L. sphaericus and on emulsification index of the produced biosurfactant. Concentration of “crude glycerol biodiesel” were 2%, 4%, and 6% v/v. Experiment was carried out in Bushnell-Haas medium on pH 7, inoculum concentration 5% v/v, temp 28oC and agitation 120 rpm. Data obtained were analyzed by analysis of variance then continued with Duncan analysis. Results showed that glycerol concentration of 2%, 4%, and 6% were not significantly different for growth of L. sphaericus and index of emulsification. Glycerol concentration of 2% was optimal for growth of L. sphaericus and index of emulsification. Crude biosurfactant obtained was 6.7 g/l which extracted by mixed solvents of chloroform and methanol (2:1 v/v).
KATA PENGANTAR
Segala puji hanya milik Allah SWT, Rabb kehidupan yang telah
memberikan nikmat yang tiada ternilai, atas rahmat, hidayah dan kekuatan-Nya
yang diberikan kepada Penulis sehingga dapat menyelesaikan penelitian ini
dengan lancar. Juga tak lupa shalawat beserta salam semoga selalu tercurah-
limpahkan kepada suri tauladan umat manusia di jagad raya Rasulullah
Muhammad SAW.
Alhamdullilah banyak ilmu dan pengalaman berharga yang telah Penulis
peroleh selama proses penelitian yang berjudul “PENGARUH KONSENTRASI
CRUDE GLISEROL (LIMBAH BIODIESEL) TERHADAP PERTUMBUHAN
Lysinibacillus sphaericus strain HytAP-B60 DAN INDEKS EMULSIFIKASI
BIOSURFAKTAN YANG DIHASILKANNYA”. Tak lupa Penulis sampaikan
banyak terimakasih kepada semua pihak yang telah membantu dalam penelitian
ini. Penulis ucapkan terimakasih yang setinggi – tingginya kepada:
1. Mamah dan Papah, uni Izah, Uni Ami, ke-3 adikku dan seluruh keluargaku
tercinta yang selalu memberi dukungan moril maupun materiil yang tiada
ternilai serta menjadi motivator utama bagi penulis.
2. Dr.-Ing. M. Abdul Khaliq, M.Sc. sebagai pembimbing 1, dan Megga
Ratnasari Pikoli, M.Si. selaku pembimbing 2. Penulis haturkan banyak
terimakasih atas segala bentuk dukungan moril, ilmu, bimbingan, dan
3. Dr. Lily Surayya Eka Putri, M. Env. Stud. selaku ketua Program Studi
Biologi, sebagai pembimbing akademik, dan sebagai dosen penguji dalam
sidang skripsi Penulis.
4. Dr. Syopiansyah Jaya Putra, M.Sis. selaku Dekan Fakultas Sains dan
Teknologi UIN Syarif Hidayatullah Jakarta
5. DR. Ir. Ikbal, M.Eng. selaku Kepala Balai Teknologi Lingkungan
BPPT-Serpong, yang telah memberikan perizinan kepada Penulis untuk
penelitian.
6. Seluruh staff Balai Teknologi & Lingkungan BPPT-Serpong terutama staff
Laboratorium Mikrobiologi, Staff Kultur Jaringan (Lab. Flora) dan staff
Laboratorium Kimia Analitik yang telah memberikan dukungan baik moril
maupun materil.
7. Irawan Sugoro, M.Si. dan Hermanto, M.Si. selaku dosen penguji dalam
seminar proposal dan seminar hasil penelitian. Priyanti, M.Si. selaku
dosen penguji dalam sidang skripsi, terimakasih Penulis haturkan atas
segala saran dan masukannya.
8. Dosen-dosen Prodi Biologi yang selalu memberikan ilmu, arahan, dan
nasehatnya tanpa pamrih kepada Penulis agar menjadi saintis sejati.
9. Fahri Fahrudin yang selalu memberi dukungan moril kepada penulis.
10.Diah Suprapti, S.Si, Dwi Sandri, M.Si., Ibu Fuji Astuti Febria, M.Si. yang
selalu hadir dalam suka dan duka selama penelitian dengan segala
11.Keluarga besar di Ciputat Bpk. Azmir dan keluarga atas dukungan moril
dan materil kepada Penulis.
12.Keluarga besar BIOMA (Biologi 2005) yang selalu hadir memberi nuansa
hangat.
13.Dan semua pihak yang telah terlibat dalam proses penelitian ini.
Akhir kata, Penulis sangat menyadari bahwa tak ada gading yang tak
retak, begitu pula dengan skripsi ini. Oleh karena itu usul serta saran yang bersifat
konstruktif sangat diharapkan demi penyempurnaan skripsi ini.
Jakarta, Maret 2010
2.6.2. Biosintesis Biosurfaktan... 13
2.6.3. Produksi Biosurfaktan ... 14
2.6.3. Tipe Produksi Biosurfaktan ... 14
2.6.4. Faktor – Faktor yang Mempengaruhi Produksi Biosurfaktan... 15
BAB IV HASIL DAN PEMBAHASAN 4.1. Pertumbuhan Bakteri Lysinibacillus spaerichus... 30
4.2. Aktifitas Emulsifikasi ... 34
4.3. Hubungan Produksi Biosurfaktan dengan Pertumbuhan Sel ... 37
4.4. Ekstraksi Biosurfaktan... 38
5.2. Saran ... 41
DAFTAR PUSTAKA ... 42 LAMPIRAN ... 47
DAFTAR GAMBAR
Halaman Gambar 1. Pertumbuhan Bakteri L. sphaericus pada Medium Perlakuan
Crude Gliserol 2%, 4%, 6%, dan Kontrol... 30 Gambar 2. Kondisi pH Kultur Medium Perlakuan Selama Masa Inkubasi ... 34 Gambar 3. Indeks Emulsifikasi (IE24%) L. spaerichus pada Medium
Perlakuan Crude Gliserol 2%, 4%, 6%, dan Kontrol... 35 Gambar 4. Pola Pertumbuhan Sel dan IE24% pada Medium Crude Gliserol ... 37 Gambar 5. Kurva Korelasi Hubungan antara Pertumbuhan L. sphaericus
DAFTAR TABEL
Halaman
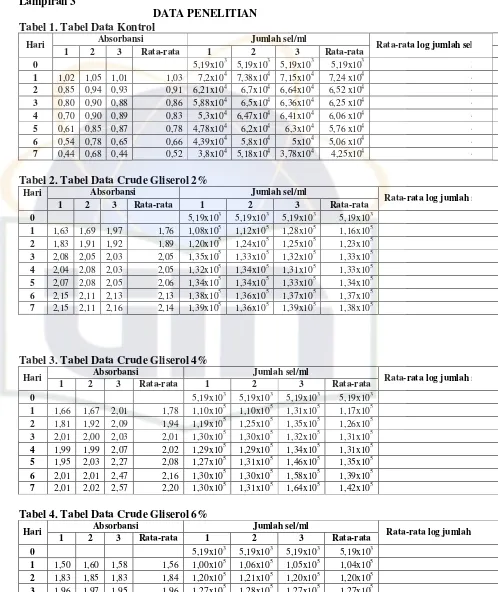
Tabel 1. Data Kontrol ... 49
Tabel 2. Data Crude Gliserol 2% ... 49
Tabel 3. Data Crude Gliserol 4% ... 50
Tabel 4. Data Crude Gliserol 6% ... 50
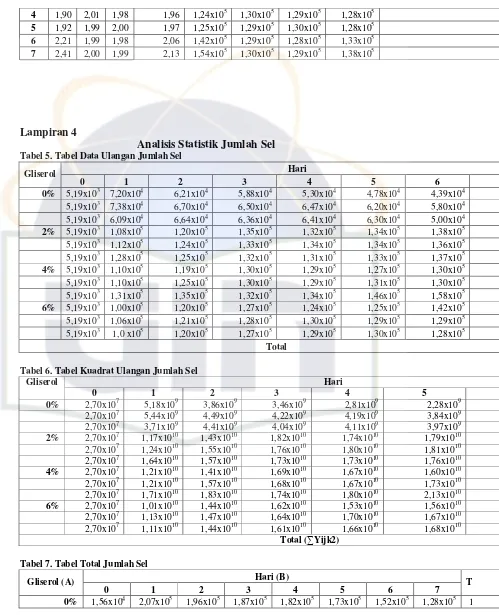
Tabel 5. Data Ulangan Jumlah Sel ... 51
Tabel 6. Kuadrat Ulangan Jumlah Sel ... 51
Tabel 7. Total Jumlah Sel ... 52
Tabel 8. Kuadrat Total Jumlah Sel ... 52
Tabel 9. Analisis Sidik Ragam Jumlah Sel ... 52
Tabel 10. Jarak Duncan Jumlah Sel... 53
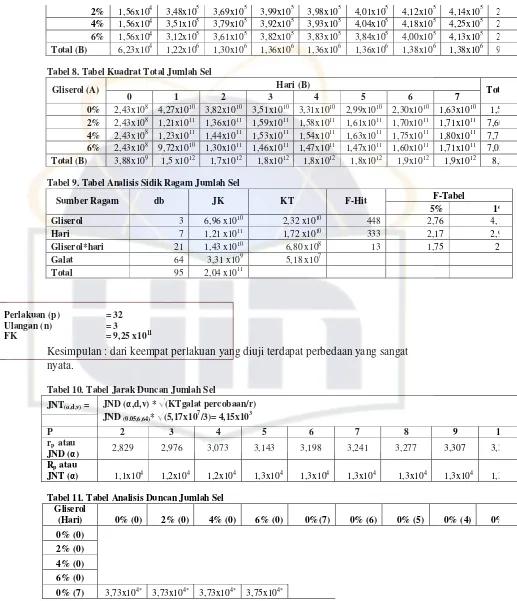
Tabel 11. Analisis Duncan Jumlah Sel ... 53
Tabel 12. Jarak Duncan Jumlah Sel... 55
Tabel 13.Analisis Duncan Jumlah Sel ... 55
Tabel 14. Notasi Interaksi Jumlah Sel ... 56
Tabel 15. Ringkasan Interaksi Jumlah Sel ... 56
Tabel 16. Tabel Ulangan Indeks Emulsi... 57
Tabel 17. Total Indeks Emulsi ... 57
Tabel 18. Analisis Sidik Ragam Indeks Emulsifikasi ... 58
Tabel 19. Jarak Duncan Indeks Emulsi ... 58
Tabel 20. Analisis Duncan Indeks Emulsi ... 58
Tabel 21. Jarak Duncan Indeks Emulsi... 60
DAFTAR LAMPIRAN
Halaman
Lampiran 1. Bagan Alir Penelitian ... 47
Lampiran 2. Kurva Standar ... 48
Lampiran 3. Tabel Data Hasil Penelitian ... 49
Lampiran 4. Tabel Analisis Statisitk Jumlah Sel dan Indeks Emulsi ... 51
BAB I PENDAHULUAN
1.1. Latar Belakang
Limbah hidrokarbon merupakan polutan terbesar dalam pencemaran
lingkungan baik di darat maupun di perairan, hal ini menjadi masalah cukup
serius bagi lingkungan. Penanganan limbah hidrokarbon di lingkungan selama ini
telah dilakukan baik secara fisika maupun kimiawi. Penanganan secara fisika
misalnya dengan menggunakan adsorben dan secara kimiawi dengan
menggunakan bahan kimia tambahan, namun cara tersebut seringkali tidak
sempurna dan sering menimbulkan permasalahan baru, terutama oleh
penambahan bahan kimia. Oleh karena itu, untuk mengatasi permasalahan
tersebut kini sedang dikembangkan penanganan limbah atau cemaran hidrokarbon
secara biologis yang diharapkan dapat menjadikan hidrokarbon terdegradasi dan
aman bagi lingkungan yaitu dengan menggunakan biosurfaktan (Aditiawati, et
al., 2001).
Biosurfaktan merupakan senyawa produk metabolit mikroba yang
mengemulsi minyak dalam air dan dapat mengurangi tegangan permukaan,
sehingga dapat dijadikan sebagai pengganti surfaktan dalam meningkatkan
degradasi hidrokarbon dalam proses bioremediasi. Keunggulan biosurfaktan
dibandingkan dengan surfaktan sintetik yaitu sebagai emulsifier yang sifatnya
cenderung lebih stabil daripada surfaktan sintetik sehingga lebih optimal dalam
Hasil eksplorasi bakteri dari tanah tercemar minyak bumi di Cepu, Jawa
Tengah yang telah dilakukan oleh Balai Teknologi Lingkungan-BPPT Serpong
berhasil diisolasi 23 isolat bakteri hidrokarbonoklastik. Berdasarkan hasil skrining
dari 23 isolat tersebut berhasil diperoleh satu isolat bakteri (Lysinibacillus
spaerichus) yang paling berpotensi menghasilkan biosurfaktan. Dari penelitian
sebelumnya (Sandri, 2009) diketahui bahwa L. sphaericus mampu tumbuh dengan
IE24% terbaik ketika ditumbuhkan pada medium dengan penambahan 2% crude
gliserol (limbah produksi biodiesel) dibandingkan dengan sumber karbon lainnya.
Oleh karena itu dalam hal ini perlu dilakukan penelitian mengenai pengaruh
konsentrasi crude gliserol terhadap pertumbuhan L. sphaericus dan IE24% yang
dihasilkannya. Variasi konsentrasi yang digunakan dalam penelitian ini yaitu
konsentrasi 2%, 4%, dan 6%.
Crude gliserol yang akan digunakan dalam penelitian ini adalah crude
gliserol yang merupakan produk samping dari produksi biodiesel. Pemanfaatan
crude gliserol dari limbah biodiesel merupakan salah satu alternatif dalam
penanganan limbah untuk menghindari timbulnya masalah lingkungan akibat
buangan gliserol, disamping itu juga dapat meningkatkan efisiensi industri
biodiesel.
1.2. Perumusan Masalah
1. Apakah terdapat perbedaan pertumbuhan sel L. sphaericus diantara
2. Apakah terdapat perbedaan indeks emulsifikasi biosurfaktan dari L.
sphaericus diantara ketiga konsentrasi crude gliserol 2%, 4%, 6%
dengan kontrol.
1.3. Hipotesis
1. Terdapat perbedaan pertumbuhan sel L. sphaericus diantara ketiga
konsentrasi crude gliserol 2%, 4%, 6% dengan kontrol.
2. Terdapat perbedaan indeks emulsifikasi biosurfaktan dari L.
sphaericus diantara ketiga konsentrasi crude gliserol 2%, 4%, 6%
dengan kontrol.
1.4. Tujuan
Tujuan dari penelitian ini yaitu untuk mengetahui pengaruh konsentrasi
gliserol sebagai sumber karbon terhadap pertumbuhan isolat bakteri L. sphaericus
dan indeks emulsifikasi biosurfaktan yang dihasilkannya.
1.5. Manfaat
Penelitian ini diharapkan dapat memproduksi biosurfaktan yang nantinya
dapat diaplikasikan untuk bioremediasi, disamping itu juga diharapkan menjadi
alternatif dalam pemanfaatan limbah biodiesel sehingga menjadi produk yang
BAB II
TINJAUAN PUSTAKA
2.1. Komposisi Minyak Bumi
Minyak bumi adalah senyawa kompleks yang terdiri dari komponen
hidrokarbon dan non-hidrokarbon. Hidrokarbon merupakan senyawa dominan
yang terkandung dalam minyak bumi terdiri dari unsur karbon (C) dan hidrogen
(H). Secara umum hidrokarbon dalam minyak bumi terdiri dari 3 komponen
besar, yaitu: alkana (paraffin), sikloalkana (naphten), dan aromatik. Alkana atau
parafin (CnH2n+2) merupakan hidrokarbon jenuh yang memiliki rantai lurus dan
bercabang. Sikloalkana atau naphten (CnH2n) merupakan hidrokarbon jenuh
dengan satu atau lebih struktur cincin. Aromatik (CnH2n-6)merupakanhidrokarbon
yang mengandung satu atau lebih struktur cincin aromatik dengan beberapa ikatan
rangkap pada rantai karbonnya (Akbar, 2004). Aromatik hanya terdapat dalam
jumlah kecil, tetapi sangat diperlukan dalam bensin. Proporsi dari ketiga tipe
hidrokarbon sangat tergantung pada sumber minyak bumi (Zuhra, 2003).
Kandungan senyawa non-hidrokarbon dalam minyak bumi relatif kecil,
terdiri dari sulfur, oksigen, nitrogen, dan logam. Sulfur merupakan komponen
non-hidrokarbon terbesar di dalam minyak bumi. Oksigen dan nitrogen terdapat
dalam konsentrasi rendah dan sangat sedikit di dalam minyak bumi. Logam yang
terkandung dalam minyak bumi umumnya berupa unsur vanadil (Va) Nikel (Ni),
besi (Fe), dan kobalt (Co) membentuk garam anorganik dan senyawa kompleks
2.2. Bakteri Hidrokarbonoklastik
Bakteri dalam aktivitas hidupnya memerlukan molekul karbon sebagai
salah satu sumber nutrisi dan energi untuk melakukan metabolisme dan
pertumbuhannya. Bakteri yang memiliki kemampuan mendegradasi senyawa
hidrokarbon untuk kebutuhan metabolisme dan pertumbuhannya
disebut bakteri hidrokarbonoklastik (Atlas & Bartha, 1985 dalam Nugroho,
2006a). Mikroorganisme hidrokarbonoklastik secara alami memiliki potensi
genetik untuk mengikat, mengemulsi, mentranspor, dan mendegradasi
hidrokarbon, yaitu dengan menghasilkan enzim oksigenase yang terikat membran
sitoplasma dan memiliki mekanisme untuk mengoptimumkan kontak antara
permukaan sel mikroorganisme dengan hidrokarbon yang tidak larut dalam air
(Rosenberg et al., 1992). Sintesis enzim tersebut dikode dalam kromosom atau
plasmid, tergantung pada jenis bakterinya (Ashok et al., 1995).
Berdasarkan penelitian sebelumnya telah banyak diketahui bakteri
hidrokarbonoklastik yang mempunyai kemampuan mendegradasi hidrokarbon,
diantaranya yaitu Pseudomonas aeoroginosa, Pseudomonas sp., P. fluorescens,
Bacillus licheniformis, Serratia marcessens, Azotobacter chroococcum,
Mycobacterium sp., Rhodococcus erithropolis, Bacillus subtilis, Thiobacillus,
Bravibacterium, Corynebacterium kutscheri (Desai & Banat, 1997; Al-Araji et
al., 2007; Zhang et al., 2005; Samadi et al., 2007; Rismani et al., 2006; Sandri,
2.3. Lysinibacillus spaerichus
Golongan Lysinibacillus dapat tumbuh pada kisaran suhu 16 – 45 oC dan
pada kisaran nlai pH 6,0 – 9,5 (Ahmed et al., 2007). Lysinibacillus spaerichus
merupakan bakteri basil gram negatif. Sandri (2009) dalam penelitiannya
menyebutkan bahwa .L. sphaericus dapat tumbuh optimum dalam medium
Bushnell–Haas dengan urea sebagai sumber nitrogen dan crude gliserol sebagai
sumber karbon pada pH 6. Supernatant L sphaericus yang mengandung
biosurfaktan memiliki kemampuan yang hampir sama dengan LAS. Biosurfaktan
yang dihasilkan bersifat termostabil dari suhu 28 sampai dengan suhu 121oC,
tetap stabil pada kisaran pH 1 – 11. Biosurfaktan yang dihasilkannya dapat
mengemulsi jenis hidrokarbon crude oil dan oli motor bekas.
Lysinibacillus spaerichus didalam database Kyoto Encyclopedia of Genes
and Genomes Pathway diketahui dapat melakukan metabolisme dalam
pertumbuhannya yaitu diantaranya glikolisis, siklus asam sitrat, biosintesis asam
lemak, metabolisme asam lemak, metabolisme gliserolipid, metabolism
gliseropospolipid, biosintesis peptidoglikan, dan sebagainya
(http://www.genome.jp/kegg/.).
2.4. Biodegradasi Hidrokarbon
Secara umum biodegradasi merupakan penguraian suatu senyawa organik
kompleks menjadi senyawa sederhana dengan bantuan mikroorganisme (Udiharto,
1999). Dalam proses biodegradasi senyawa organik diubah menjadi CO2,
berlangsung secara aerob. Oleh karena itu proses biodegradasi sangat tergantung
pada oksigen yang tersedia. Dua hal penting bagi mikroba sebagai syarat awal
dalam mengoksidasi hidrokarbon, yaitu sintesis enzim oksidase dan kontak antara
mikroba dengan air dan hidrokarbon yang tidak larut air dengan bantuan
biosurfaktan yang dihasilkan oleh mikroba tersebut (Rosenberg et al., 1993 dalam
Akbar, 2004).
Tahap pertama degradasi hidrokarbon oleh mikroba adalah reaksi antara
molekul oksigen dan hidrokarbon dengan bantuan enzim oksigenase. Tahap
berikutnya yaitu dengan dua mekanisme pengambilan substrat oleh bakteri.
Pertama, pengambilan substrat dilakukan pada saat hidrokarbon telah mengalami
emulsifikasi oleh biosurfaktan yang dihasilkannya; kedua, pengambilan substrat
dilakukan setelah sel mengalami kontak langsung dengan hidrokarbon melalui
mekanisme adhesi fisik. Kontak ini terjadi ketika mikroba mengeksresi
biosurfaktan akibat respon dari keberadaan hidrokarbon (Rosenberg et al., 1993
dalam Akbar, 2004; Kinbal, 1994 dalam Zam, 2006).
Biosurfaktan yang dihasilkan oleh mikroba dapat menurunkan tegangan
permukaan dan meningkatkan luas daerah kontak antara hidrokarbon dan
mikroorganisme melalui pembentukan misel, pelarutan dan emulsifikasi
hidrokarbon serta pembebasan tetesan minyak. Misel yang terbentuk berfungsi
sebagai paket transport hidrokarbon dan mempermudah mikroba dalam
memperoleh nutrisi bagi pertumbuhannya sehingga pertumbuhan sel menjadi
lebih baik. Misel adalah agregat molekul aktif permukaan yang membentuk fase
1994 dalam Zam, 2006; Barnet et al 1974 dalam Noviana 1998). Mikroorganisme
yang memiliki afinitas tinggi terhadap hidrokarbon dapat menggunakan minyak
baik dalam bentuk tetesan besar (droplet) maupun dalam bentuk tetesan sangat
kecil (submikron). Sedangkan mikroorganisme yang memiliki afinitas rendah
terhadap hidrokarbon lebih efektif mendegradasi hidrokarbon dalam bentuk
submikron daripada bentuk droplet (Buhler & Schindler, 1984 dalam Pikoli,
2000).
Proses biodegradasi pada setiap hidrokarbon tidak sama, karena setiap
hidrokarbon memiliki tingkat kesulitan yang berbeda untuk dapat didegradasi oleh
mikroba (Udiharto dan Sudaryono, 1999). Senyawa hidrokarbon alifatik lebih
mudah didegradasi dibandingkan senyawa hidrokarbon aromatik dan naftalen.
Hidrokarbon jenuh lebih mudah didegradasi dibandingkan hidrokarbon tidak
jenuh, dan hidrokarbon alifatik rantai lurus lebih mudah didegradasi
dibandingkan hidrokarbon alifatik rantai bercabang (Akbar, 2004; Udiharto,1999).
2.5. Crude Gliserol (Limbah Biodiesel)
Biodiesel (ester metil) merupakan bahan bakar alternatif yang dibuat dari
minyak nabati. Dalam proses pembuatan biodiesel menghasilkan biodiesel juga
menghasilkan produk samping (air limbah). Kandungan dalam air limbah
biodiesel merupakan campuran dari metanol, asam lemak, minyak dan ester metil
yang terlarut. Air limbah yang dihasilkan memiliki kandungan organik yang
cukup tinggi. Proses pembuatan biodiesel yang lazim dilakukan adalah melalui
menghasilkan ester metil dan gliserol. Dalam proses transesterifikasi dihasilkan
80% ester metal dan 20% crude gliserol sebagai produk samping. Crude Gliserol
terdiri dari gliserol, air, methanol, residu katalis dan sabun (Syafilla et al., 2007;
Syah, 2006).
Gliserol termasuk dalam golongan derivat lipid. Derivat lipid yaitu
senyawa lipid yang dihasilkan dari proses hidrolisis lipid. Gliserol merupakan
suatu trihidroksi alkohol yang terdiri atas tiga atom karbon. Jadi, tiap atom karbon
mempunyai gugus –OH. Satu molekul gliserol dapat mengikat satu, dua atau tiga
molekul asam lemak dalam bentuk ester, yang disebut monogliserid, digliserid
atau trigliserid. Gliserol larut baik dalam air dan tidak larut dalam eter. Gliserol
merupakan senyawa yang tidak berwarna, tidak berbau dan berbentuk cairan
kental yang terasa manis. Rumus kimia gliserol yaitu: C3H8O3. Gliserol
merupakan derivat lipid yang dapat larut dalam air (water-soluble) (Poedjiadi,
1994).
Biosurfaktan tipe rhamnolipid oleh genus Pseudomonas dapat diproduksi
dengan substrat gliserol, glukosa, manitol, dan etanol sebagai sumber karbon
(Desai & Banat, 1997). Sebagian besar penelitian diketahui bahwa sintesis
biosurfaktan oleh mikroorganisme selain dapat ditumbuhkan pada hidrokarbon
tidak larut air, tetapi beberapa juga dapat diproduksi dalam substrat larut air
seperti glukosa, gliserol dan etanol (Abu-Ruwaida et al., 1991). Berdasarkan
hasil penelitian Rismani et al (2006) diketahui bahwa pada konsentrasi 0,5%
terbaik bagi pertumbuhan Bacillus licheniformis dan produksi biosurfaktan
dengan penurunan tegangan permukaan (surface tension) yang terbaik.
Zhang et al (2005) menyebutkan bahwa P. aeroginosa mampu
memproduksi rhamnolipid lebih banyak ketika ditumbuhkan pada substrat gliserol
dengan konsentrasi 3% sebagai sumber karbon dibandingkan dengan substrat
yang lain (glukosa, minyak nabati, dan paraffin cair). Samadi et al (2007) dalam
penelitiannya menyebutkan bahwa Bravibacterium mampu tumbuh maksimum
dan memproduksi glikolipid dengan penurunan tegangan permukaan terbaik
ketika ditumbuhkan pada susbtrat gliserol dengan konsentrasi 5%.
2.6. Biosurfaktan
2.6.1. Definisi, Sifat, dan Klasifikasi
Biosurfaktan adalah produk metabolit yang diproduksi oleh bakteri, ragi,
dan jamur sebagai produksi ekstraseluler atau bagian dari dinding sel.
Biosurfaktan meruapakan senyawa aktif permukaan dalam bentuk senyawa
amphipatik terdiri dari bagian hidrofilik dan hidrofobik. Bagian hidrofilik
merupakan molekul polar dapat berupa karbohidrat, asam amino, atau kelompok
fosfat. Bagian hidrofobik umumnya merupakan karbon rantai panjang atau rantai
hidrokarbon dari asam lemak. Oleh karena itu biosurfaktan mampu mengikat
molekul hidrokarbon, menurunkan tegangan permukaan pada ruang antar air dan
minyak dan membentuk mikroemulsi sehingga membantu degradasi hidrokarbon.
(Al-Araji, et al., 2007; Van dyke, 1991 dalam Budiarti, 2001; Vater, et al., 2002
Biosurfaktan mempunyai kapasitas sebagai enzim seluler yang dapat
melarutkan, sebagai reseptor, dan protein (Kitamoto, 1993). Biosurfaktan
memiliki beberapa perbedaan dibandingkan dengan surfaktan sintetik seperti
toksisitas rendah, kemampuan biodegradasi yang tinggi, memiliki sifat emulsifier
yang lebih stabil dibandingkan dengan surfaktan sintetik sehingga proses
degradasi lebih optimal, lebih ramah lingkungan, buih yang banyak, mempunyai
gugus molekul yang spesifik terhadap suatu reaksi dan aktifitas yang spesifik pada
kondisi lingkungan yang ekstrim (temperatur, pH, dan salinitas) (Desai & Banat,
1997; Rahman & Gakpe, 2008).
Biosurfaktan dapat diproduksi dari bahan baku yang murah yang
dihasilkan dalam jumlah besar, dapat menggunkan sumber karbon yang berasal
dari hidrokarbon, karbohidrat, dan atau lipid yang digunakan terpisah atau
dikombinasikan dengan yang lain, bernilai ekonomis karena biosurfaktan juga
dapat diproduksi dari limbah industri, dapat berfungsi sebagai pengontrol
lingkungan – digunakan untuk menangani emulsi industri, kontrol tumpahan
minyak, dan bioremediasi pada tanah tercemar (Kosaric, 2001; Makkar &
Cameotra, 1999).
Desai & Banat (1997) mengklasifikasikan biosurfaktan menjadi 5
kelompok berdasarkan komponen kimianya yaitu: glikolipid, lipopeptida dan
lipoprotein (lipid biosurfaktan yang mengandung asam amino), fosfolipid dan
asam lemak, surfaktan polimerik, dan surfaktan partikulat. Glikolipid merupakan
karbohidrat dengan rantai alifatik panjang atau asam hidroksialifatik. Diantara
dan sophorolipid. Rhamnolipid merupakan satu atau dua molekul rhamnose
dihubungkan pada satu atau dua molekul asam -hidroxidekanoik. Trehalolipid
kebanyakan diperoleh dari genus Mycobacterium disebabkan ester trehalolipid
berada pada permukaan sel. Trehalolipid mengandung disakarida trehalose yang
dihubungkan pada C-6 dan C-6’ pada asam mikolik. Asam mikolik merupakan
rantai panjang asam lemak - -hidroksi. Sophorolipid terdiri dari sebuah gula
sophorose dan sebuah asam lemak hidroksil yang dihubungkan dengan sebuah
ikatan -glikosidik. (Asselineau & Asselineau, 1978 dalam Rahman & Gakpe,
2008; Desai & Banat, 1997; Rahman & Gakpe, 2008; Karanth et al, 2005; ).
Lipopeptida disebut juga surfaktin, terdiri dari tujuh asam amino yang
diikat pada sebuah gugus karboksil dan hidroksil pada 14 asam karbon.
Biosurfaktan asam lemak terdiri dari gugus OH dan cabang alkil. Emulsan,
liposan, mannoprotein, dan komplek polisakarida-protein merupakan
biosurfaktan polimerik. Emulsan yaitu bioemulsifier polianionik amphipatik
heteropolisakarida. Liposan merupakan emulsifier ekstraseluler yang larut dalam
air. Liposan terdiri dari 83% karbohidrat dan 17 % protein dengan bagian
karbohidrat merupakan heteropolisakarida yang terdiri dari glukosa, galaktosa,
galaktosamin, dan asam galaktoronik. Jenis polimerik lainnya antara lain
biodispersan, bioemulsifier makanan, komplek protein, dan insektida emulsifier.
Biosurfaktan polimerik disusun oleh protein, phospolipid, dan lipopolisakarida
(Desai & Banat, 1997; Rahman & Gakpe, 2008). Disamping itu Ron dan
Rosenberg (2001) juga mengelompokkan biosurfaktan menjadi 2 kelompok
1. Biosurfaktan dengan berat molekul (BM) rendah, yaitu glikolipid, seperti
soforolipid, trehalosa lipida, fosfolipid, dan asam lemak, yang semuanya
memiliki bagian hidrofilik dan hidrofobik. Berfungsi dalam menurunkan
tegangan permukaan dan antar muka.
2. Biosurfaktan dengan berat molekul (BM) tinggi, yaitu lipoprotein,
lipopolisakarida dan polisakarida amphipatik, tidak memiliki bagian
hidrofilik dan hidrofobik serta lebih efektif pada stabilisasi minyak dalam
emulsi air.
2.6.2. Biosintesis Biosurfaktan
Hidrokarbon masuk melalui membran dengan mekanisme difusi pada sisi
pelekatan selnya dengan minyak dan terjadi oksidasi hidrokarbon untuk
membentuk asam lemak dalam sitoplasma. Pelekatan minyak pada sel yang
terjadi karena adanya struktur tertentu pada dinding sel seperti saluran, pori-pori,
vesikel membran, dan kompleks membran yang melipat ke dalam. Struktur ini
diketahui terdapat pada berbagai mikroorganisme yang tumbuh pada substrat
hidrokarbon (Buhler & Schindler, 1984 dalam Pikoli, 2000; Homel & Ratledge,
1993 dalam Akbar, 2004).
Pada tahap degradasi, volume hidrokarbon dalam medium sangat banyak
dibandingkan jumlah sel bakteri pendegradasi, hal ini menyebabkan
terakumulasinya asam lemak dalam sitoplasma. Sel melakukan dua mekanisme
untuk menjaga keseimbangan konsentrasi asam lemak didalam sel, yaitu sebagian
– asam lemak berlebih yang terdapat di dalam sel akan disintesis untuk
pembentukan glukosa. Keduanya merupakan komponen surfaktan yang potensial
(Homel & Ratledge, 1993 dalam Akbar, 2004).
2.6.3. Tipe Produksi Biosurfaktan
Produksi biosurfaktan dikelompokkan menjadi beberapa tipe, yaitu (Desai
& Banat, 1997) :
1. Produksi pertumbuhan gabungan (Growth-Associated Production), yaitu
terjadi hubungan yang paralel antara pertumbuhan, pemanfaatan substrat,
dan produksi biosurfaktan. Produksi biosurfaktan meningkat dengan
meningkatnya pertumbuhan sel.
2. Produksi di bawah kondisi pertumbuhan terbatas (production under
growth-limiting conditions), yaitu kenaikan biosurfaktan merupakan hasil
dari keterbatasan satu atau lebih komponen medium.
3. Produksi dengan resting atau immobilized sel, yaitu produksi biosurfaktan
terjadi tanpa diikuti dengan pembelahan sel.
4. Produksi dengan memberi suplemen prekursor, yaitu produksi
biosurfaktan dilakukan dengan penambahan prekursor biosurfaktan pada
medium pertumbuhan dengan tujuan pada perubahan kualitatif dan
2.6.4. Faktor – Faktor yang Mempengaruhi Produksi Biosurfaktan
Secara umum faktor – faktor yang mempengaruhi komposisi dan
terakumulasinya biosurfaktan di dalam suatu media pertumbuhan antara lain
substrat pertumbuhan, umur kultur, dan kondisi lingkungan (pH dan salinitas,
temperatur, agitasi, dan ketersediaan oksigen) (Akbar, 2004; Budiarti, 2000).
1. Substrat Pertumbuhan a. Sumber Karbon
Pemilihan sumber karbon mempunyai peran penting terhadap hasil dan
struktur biosurfaktan. Sumber karbon yang telah diketahui dapat digunakan untuk
produksi biosurfaktan yaitu karbohidrat, hidrokarbon, dan minyak nabati.
Beberapa mikroorganisme memproduksi biosurfaktan hanya pada substrat
karbohidrat, beberapa hanya pada substrat hidrokarbon, dan beberapa
mikroorganisme ada yang mampu memproduksi biosurfaktan pada substrat
dengan beberapa sumber karbon yang digabungkan atau terpisah. Tipe, kualitas,
dan kuantitas biosurfaktan yang dihasilkan juga dipengaruhi oleh sifat sumber
karbon (Desai & Banat, 1997).
Perbedaan sumber karbon dapat mempengaruhi komposisi dan bagaimana
biosurfaktan itu diproduksi. Arthrobacter hanya memproduksi 75% biosurfaktan
ekstraseluler ketika ditumbuhkan pada asetat atau etanol, namun dapat mencapai
100% biosurfaktan ekstraseluler ketika ditumbuhkan pada substrat hidrokarbon
(Mulligan & Gibbs, 1993). Panjang rantai substrat hidokarbon sering berakibat
Kemampuan bakteri menggunakan karbon dari substrat pertumbuhannya
akan menentukan kualitas dan kuantitas biosurfaktan yang dihasilkan sehingga
memberikan aktivitas emulsifikasi yang berlainan, serta perbedaan kemampuan
dalam menurunkan tegangan permukaan kultur (Desai & Desai, 1993 dalam
Fathimah, 2007). Sumber karbon seperti mannitol, gliserol, dan ethanol mampu
digunakan oleh Pseudomonas sp. untuk memproduksi rhamnolipid, namun
produksinya masih lebih rendah dari substrat tidak larut air seperti n-alkana dan
olive oil (Desai & Banat, 1997).
Bravibacterium mampu tumbuh pada sumber karbon glukosa, gliserol,
molasse, gasolin, Canola oil, dan limbah minyak, akan tetapi biosurfaktan tipe
gllikolipid hanya dapat diproduksi pada substrat dengan sumber karbon glukosa,
gliserol, dan Canola oil. Penurunan tegangan permukaan terbaik didapat pada
substrat gliserol (Samadi et al., 2007). Sandri (2009) dalam penelitiannya
menyebutkan bahwa Lysinibacillus sphaericus mampu tumbuh pada sumber
karbon yang berbeda dan memproduksi biosurfaktan dengan indeks emulsifikasi
biosurfaktan yang berbeda pula.
Crude gliserol, oli bekas, dan crude oil merupakan sumber karbon yang dapat
digunakan oleh L. spaerichus dalam pertumbuhannya dan produksi biosurfaktan.
Oli bekas dan crude oil mengandung senyawa yang heterogen, hal ini
menyebabkan lambatnya pertumbuhan sel bakteri dan mempengaruhi
biosurfaktan yang dihasilkan (Sandri, 2009). Gliserol mudah dimanfaatkan oleh
bakteri karena bersifat larut air dan asam lemak bebas yang terkandung dapat
Moussa et al (2006) dalam penelitiannya diketahui bahwa pada produksi
biosurfaktan oleh Nocardia amarae dengan peningkatan konsentrasi olive oil
hingga mencapai konsentrasi 3%(v/v) menyebabkan kenaikan jumlah
biosurfaktan namun pada konsentrasi >3%(v/v) jumlah biosurfaktan menurun.
Rashedi et al., (2005b) menyebutkan dalam penelitiannya bahwa gliserol
menunjukkan merupakan substrat yang paling baik untuk produksi rhamnolipid
oleh strain P. aeruginosa CFTR-6 dibandingkan dengan substrat gasolin, paraffin
oil, dan whey. Pada konsentrasi 5% gliserol diperoleh biomassa tertinggi dan
produksi rhamnolipid terbanyak. Namun, pada gliserol dengan konsentrasi lebih
dari 5% gliserol terjadi penghambatan pada pertumbuhan bakteri dan produksi
biosurfaktan. Penghambatan ini diduga berkaitan dengan solubilitas gliserol dan
kesulitan bakteri untuk memperoleh nutrisi dalam medium kultur.
Nugroho (2006b) dalam penelitiannya telah memperoleh penurunan
tegangan permukaan yang cenderung meningkat secara teratur sesuai dengan
peningkatan konsentrasi paraffin dalam media kultur. Semakin tinggi konsentrasi
parafin dalam media maka semakin tinggi pula penurunan tegangan permukaan
yang dihasilkan. Suryatmana (2006) dalam penelitiannya menyebutkan bahwa
semakin tinggi konsentrasi glukosa yang digunakan dalam pertumbuhan
Azotobacter chroococcum untuk produksi biosurfaktan maka semakin tinggi pula
produksi biosurfaktan yang dihasilkan.
Begitu pula dengan Rashedi et al (2005a) dalam penelitiannya diketahui
bahwa produksi biosurfaktan oleh Pseudomonas aeruginosa meningkat seiring
Sedangkan Ruzniza (2005) pada penelitiannya menyebutkan bahwa terjadi
perbedaan signifikan pada biomassa sel isolat ETL-CR1 antara penambahan 1
mM glukosa dengan 3 mM – 10mM glukosa. Dan tidak terjadi perbedaan
signifikan biomassa sel pada medium dengan penambahan 3 mM – 10 mM
glukosa.
b.Sumber Nitrogen
Nitrogen merupakan unsur lain yang dibutuhkan dalam medium
pertumbuhan yang dibutuhkan mikroba untuk produksi biosurfaktan. Sumber
nitrogen dalam medium juga memberikan hasil yang baik dalam produksi
biosurfaktan. Sumber nitrogen juga berperan sebagai pengontrol pH dalam
medium. Garam ammonium dan urea memberikan hasil yang lebih baik untuk
produksi biosurfaktan oleh A. paraffineus. Disamping itu nitrat mendukung
produksi biosurfaktan lebih banyak oleh P. aeroginosa (Desai & Banat, 1997).
Sandri (2009) dalam penelitiannya menyebutkan bahwa pertumbuhan L.
spaerichus lebih tinggi ketika ditumbuhkan dalam medium dengan ammonium
nitrat dibandingkan dengan urea sebagai sumber nitrogen, namun produksi
biosurfaktan pada medium dengan ammonium nitrat lebih rendah dibandingkan
dengan urea. Makkar & Cameotra (2002) menyebutkan bahwa sodium nitrat,
potassium nitrat, dan urea merupakan sumber nitrogen yang paling baik untuk
pertumbuhan Bacillus subtilis dibandingkan dengan sumber nitrogen lain yang
dicobakan (peptone, yeast ekstrak, beef ekstrak, tripton, ammonium nitrat, dan
Syldatk (1985) dalam Desai & Banat (1997) menyebutkan bahwa
ketersediaan nitrogen yang terbatas tidak hanya menyebabkan produksi
biosurfaktan yang berlebih namun juga mengubah komposisi dan biosurfaktan
yang dihasilkan. Budiarti (2001) menyebutkan bahwa pertumbuhan bakteri B4
pada medium urea sebagai sumber nitrogen lebih baik dibandingkan dengan
media yeast ekstrak. Konsentrasi nitrogen yang terlalu tinggi dalam suatu medium
pertumbuhan dengan hidrokarbon sebagai satu-satunya sumber karbon dapat
menyebabkan keracunan pada bakteri.
2. Umur Kultur
Umur kultur merupakan faktor yang penting untuk memproduksi
biosurfaktan dalam kultur batch. Semakin tua umur kultur, maka semakin banyak
nutrisi yang digunakan oleh mikroorganisme, sehingga nutrien dalam medium
kultur batch semakin terbatas. Hal tersebut dapat mengakibatkan akumulasi
produk sisa metaboilisme yang menyebabkan perubahan pada metabolisme sel
dan produksi biosurfaktan. Bertambahnya umur kultur dapat berhubungan pula
dengan pembentukan permukaan sel mikroba yang hidrofobik untuk digunakan
dalam deemulsifikasi emulsi minyak dalam air ( Kosaric, 1987 dalam Budiarti,
2000). Produksi biosurfaktan secara signifikan meningkat pada saat memasuki
fase stasioner sampai fase kematian bakteri (Mulligan & Gibs, 1993).
3. Kondisi Lingkungan
Faktor – faktor lingkungan yang berpengaruh dalam produksi biosurfaktan
adalah pH dan salinitas, temperatur, agitasi, dan ketersediaan oksigen. Faktor –
pertumbuhan dan aktifitas sel. Sebagian besar biodegradasi oleh bakteri terjadi
pada pH netral. Sandri (2009) dalam penelitiannya menyebutkan bahwa
pertumbuhan L. spaerichus dan aktivitas emulsi yang baik diperoleh pada pH 6.
Salinitas dapat berfungsi dalam membantu keseimbangan konsentrasi mineral
dalam sel. Apabila salinitas terganggu, maka akan mempengaruhi pertumbuhan
sel dalam produksi biosurfaktan (Budiarti, 2000). Abu Ruwaida et al (1991)
dalam Al-Araji et al (2007) menyebutkan bahwa pengaruh salinitas terhadap
produksi biosurfaktan tergantung pada efek aktivitas seluler.
Kenaikan dan penurunan temperatur kemungkinan berperan dalam
mengubah metabolisme mikroba. Pada kultur batch isolat AB-Cr1 dan ETL-Cr1
dengan variasi suhu 30ºC sampai 55º, diperoleh temperatur yang optimum pada
suhu 37ºC untuk produksi biosurfaktan terbanyak (Ruzniza, 2005). Kenaikan
kecepatan agitasi menghasilkan penurunan produksi biosurfaktan oleh Nocardia
erythropolis (Desai & Banat, 1997). Pada penelitian yang lain, produksi
biosurfaktan meningkat ketika agitasi dan aerasi ditingkatkan (Desai & Banat,
1997).
2.6.5. Ekstraksi Biosurfaktan
Biosurfaktan adalah lipid yang mengandung molekul amphipatik dan
dapat diekstraksi dengan menggunakan pelarut organik. Ekstraksi (recovery)
biosurfaktan bergantung pada pertukaran ion, kelarutan terhadap air, dan lokasi
produk biosurfaktannya (intraseluler, ekstraseluler, atau berikatan dengan sel).
metode ekstraksi dengan pelarut kloroform-metanol, diklorometan-metanol,
butanol, etil asetat, pentana, hexana, asam asetat, eter, dan lain-lain. Sebagian
besar biosurfaktan dikeluarkan dalam medium dan diisolasi dari kultur filtrat atau
supernatan (Desai & Banat, 1997; Gautam dan Tyagi, 2006).
Glikolipid dari P. aeroginosa dan U. zeae diekstraksi dengan presipitasi
asam pada suhu rendah. Glikolipid yang lain berasal dari populasi mikroba dan
rhamnolipid berasal dari kedua bakteri P. aeroginosa dan C. lipolitica berhasil
diekstraksi dengan pelarut kloroform-metanol (Desai & Banat, 1997). Diantara ketiga pelarut (kloroform-metanol, etil asetat pada kondisi asam (pH 2), dan
diklorometan dengan ultrasonik, pelarut kloroform-metanol (1:1 v/v) merupakan
pelarut yang efisien dalam ekstraksi bioemulsi yang melekat pada sel dari
suspensi sel Myroides sp (Maneerat & Dikit, 2007).
Biosurfaktan merupakan molekul amphipatik yang bisa diekstraksi
menggunakan pelarut organik. Variasi tiap pelarut organik bisa digunakan baik
secara tunggal maupun kombinasi. Daud et al (2007) dalam penelitiannya
menyebutkan bahwa dengan menggunakan pelarut kombinasi kloroform:methanol
(2:1) diperoleh crude biosurfaktan sebanyak 7 g/l dan hasil ini memberikan hasil
yang lebih banyak dibandingkan dengan crude biosirfaktan yang diperoleh
menggunakan pelarut MTBE:kloroform.
2.7. Indeks Emulsifikasi (IE24%)
Indeks Emulsifikasi (IE24%) merupakan aktifitas emulsifikasi yang terjadi
(mm) dibagi dengan total tinggi dari cairan kolom (Kumar et al., 2008).
Emulsifikasi minyak oleh biosurfaktan terjadi karena adanya ikatan antara gugus
hidrofobik dari tetes minyak dengan gugus hidrofilik dari biosurfaktan dengan
membentuk struktur misel yang berukuran mikron sehingga menyebabkan minyak
terdispersi dalam larutan dan terjadi emulsifikasi antara minyak-biosurfaktan dan
air (Suryatmana et al., 2006). Menurut Barnet et al (1974) dalam Noviana (1998)
misel adalah agregat molekul aktif permukaan yang membentuk fase non-polar
dalam larutan air yang akan mengikat konsentrasi molekul hidrokarbon yang lebih
besar daripada fase air itu sendiri, sehingga misel dapat dikatakan bekerja sebagai
paket transport bagi hidrokarbon.
Fathimah (2007) dalam penelitiannya menyebutkan bahwa biosurfaktan
yang dihasilkan oleh Pseudomonas sp. dalam kultur dengan substrat glukosa
memiliki aktivitas emulsifikasi yang lebih baik dibandingkan dengan biosurfaktan
yang dihasilkan dengan substrat yang lain. Biosurfaktan yang dihasilkan memiliki
kemampuan dalam mengemulsi beberapa jenis hidrokarbon uji yaitu solar,
minyak pelumas, dan heksadekan. Besarnya kemampuan biosurfaktan dalam
mengemulsi hidrokarbon bergantung pada jenis biosurfaktan dan minyak uji yang
BAB III
METODOLOGI PENELITIAN
3.1. Waktu dan Tempat Penelitian
Penelitian ini telah dilakukan pada bulan Juni – November 2009 di
Laboratorium Mikrobiologi Balai Teknologi Lingkungan – BPPT, Serpong.
3.2. Alat dan Bahan
Alat – alat yang digunakan dalam penelitian ini adalah laminar air flow
cabinet (Panasonic), rotary shaker (Multi Shaker PSU 20 Boeco), inkubator
(Memmert), sentrifuge (Sorvall®RMC 14), spektrofotometer UV-Vis (V-530
Jasco), pH meter (WTW 82362 Weilheim), Vortex (Yellow Line), timbangan
analitik (Sartorius – CP224 S), autoklaf (All American Model No. 25 X), hot plate
(Cimarec®2), rotary evaporator (Heidolph), labu distilasi (Iwaki Pyrex), corong
pisah (Iwaki Pyrex), oven (Memmert), Microwave (Panasonic), Mikropipet,
erlenmeyer (Iwaki Pyrex) 500 ml dan 250 ml, cawan petri (Iwaki Pyrex), tabung
reaksi (Iwaki Pyrex), botol Schott Duran, glass beker (Iwaki Pyrex), mikrotip,
mikrotube, ose lup, bunsen, penggaris (cm), dan kamera digital.
Bahan – bahan yang digunakan dalam penelitian ini adalah isolat bakteri
Lysinibacillus spaerichus, medium Bushnell-Haas (per liter akuades) (Atlas,
1994): 0,2 gram MgSO4.7H2O; 1 gram K2HPO4; 1 gram KH2PO4; 0,05 gram
FeCl3; 1 gram NH4NO3; 0,02 gram CaCl2.2H2O; dan ditambahkan 1,2 gram yeast
karbon, akuades, NaCl fisiologis 0,85%, kloroform:metanol, HCl, dan
hidrokarbon uji (bensin).
3.3. Cara Kerja
3.3.1. Penguapan Gliserol
Gliserol sebelum disterilisasi diuapkan terlebih dahulu diatas hot plate
dengan suhu 80 – 100 0C selama ±1 jam, hal ini dilakukan dengan tujuan untuk
memurnikan gliserol dengan memisahkan metanol.
3.3.2. Pembuatan Medium Bushnell-Haas
Sebanyak 0,2 gram MgSO4.7H2O; 1 gram K2HPO4; 1 gram KH2PO4; 0,05
gram FeCl3; 1 gram NH4NO3; 0,02 gram CaCl2.2H2O; dan 1,2 gram yeast ekstrak
dimasukkan ke dalam erlenmeyer ukuran 1L, ditambahkan crude gliserol (limbah
biodiesel) sebagai sumber karbon sebanyak 2%, 4%, da 6% v/v, seluruh
komponen dilarutkan dengan akuades hingga mencapai 1L dan diaduk hingga
larut. pH medium diatur pada pH 7 selanjutnya disterilisasi dalam autoklaf pada
suhu 121 0C selama 15 menit. Untuk pembuatan Bushnell-Haas Agar,
dimasukkan semua komponen diatas (tanpa crude gliserol) dan ditambahkan 15
3.3.3. Peremajaan Kultur Stok
Satu ose isolat dari kultur stok diinokulasikan ke dalam agar miring
Bushnell-Haas dengan cara gores. Kemudian diinkubasi selama 24 – 48 jam pada
suhu 28 0C.
3.3.4. Pembuatan Kurva Standar
Kultur stok ditambahkan sebanyak 10 ml medium cair Bushnell-Haas, lalu
dikocok menggunakan vortex dengan kecepatan maksimum. Dilakukan
pengenceran dengan akuades menggunakan rasio perbandingan konsentrasi
pengenceran 0,5%, 1%, 1,5%, 2%, dan 2,5%, dan dari tiap pengenceran dilakukan
pengukuran kekeruhan dengan menggunakan spektrofotometri pada panjang
gelombang 600nm dan jumlah sel dengan total plate count (TPC). Data dari TPC
dan kekeruhan diplotkan dalam bentuk kurva sebagai kurva standar. Data yang
diperoleh dijadikan sebagai acuan untuk pengukuran jumlah sel pada tahap
selanjutnya.
Total plate count (TPC) dilakukan dengan menggunakan medium
Bushnell-Haas Agar dan pengenceran berseri. Pengenceran berseri dilakukan
dengan cara sebagai berikut: 1 ml kultur dimasukkan ke dalam tabung reaksi dan
ditambahkan 9 ml larutan NaCl fisiologis 0,85% steril ke dalamnya, lalu kocok
dengan vortex; suspensi yang terbentuk disebut pengenceran 1:10 atau 10-1.
Kemudian diambil 1 ml suspensi dari pengenceran 10-1 dan dimasukkan ke dalam
tabung reaksi berisi 9 ml larutan NaCl fisiologis 0,85% steril, lalu kocok dengan
lakukan cara yang serupa untuk pengenceran 10-3 10-4 10-5 sampai dengan
pengenceran 10-10 (jumlah pengenceran dalam satu seri tergantung pada
kekeruhan kultur).
Dari tiga pengenceran terakhir (10-8 10-9 dan 10-10 ) masing-masing diambil
0,1 ml dengan menggunakan pipet steril yang berbeda, kemudian dilakukan
inokulasi pada tiga plat agar berbeda yang telah berisi medium Bushnell-Haas
Agar. Suspensi disebarkan pada permukaan plate agar dengan menggunakan
batang glass drygalski hingga merata secara aseptis. Selanjutnya Plat agar
diinkubasi pada suhu 280C selama 24 - 48 jam. Kemudian dilakukan
penghitungan jumlah koloni yang tumbuh pada setiap plate agar. Jumlah yang
dapat dihitung adalah 30-300 koloni. Jumlah sel dinyatakan dengan rumus:
3.3.5. Pembuatan Prekultur
Sebanyak tiga ose isolat dari slant agar diinokulasi ke dalam erlenmeyer
ukuran 250 ml yang berisi 80 ml medium Bushnell-Haas+crude gliserol 2%
(sebagai sumber karbon), kemudian diinkubasi dalam rotary shaker dengan
kecepatan agitasi 120 rpm pada suhu ruang selama 24 jam. Selanjutnya dilakukan
pengukuran kekeruhan dari kultur dengan menggunakan spektrofotometri pada koloni x n + koloni x n + koloni x n
10-1 10-1 10-1
3
Ket:
panjang gelombang 600nm. Inokulum prekultur digunakan sebagai inokulum
untuk pembuatan kultur kurva pertumbuhan dan optimasi produksi biosurfaktan.
3.3.6. Pembuatan Kurva Pertumbuhan dan Optimasi Produksi Biosufaktan Inokulumdibuat dalam erlenmeyer 250 ml berisi 80 ml medium
Bushnell-Haas+crude gliserol 2%, 4%, dan 6% (v/v) yang ditambahkan 5% (v/v) inokulum
yang berasal dari prekultur, kemudian diinkubasi pada rotary shaker dengan
agitasi 120 rpm pada suhu ruang. Pada jam ke-0 dan tiap 24 jam berikutnya
dilakukan pengukuran kekeruhan dengan menggunakan spektrofotometri pada
panjang gelombang 600nm dan indeks emulsi (IE24%) sebagai uji aktifitas
emulsifikasi biosurfaktan.
3.3.7. Uji Aktifitas Emulsifikasi
Uji aktifitas emulsifikasi dilakukan menggunakan metode Cooper dan
Goldenberg (1987). Sebanyak 5 ml kultur (3.3.6) disentrifugasi dengan agitasi
5000 rpm selama 30 menit pada suhu 40C dengan tujuan untuk melisiskan sel.
Supernatan yang didapat selanjutnya diambil sebanyak 2 ml ditambahkan dengan
3 ml hidrokarbon uji (bensin) dan divortex dengan kecepatan maksimum selama 2
menit. Campuran tersebut kemudian didiamkan selama 24 jam yang selanjutnya
diukur dengan perhitungan sebagai berikut :
tinggi lapisan emulsi
3.3.8. Ekstraksi Biosurfaktan
Ekstraksi biosurfaktan dilakukan terhadap kultur dengan nilai IE24%
terbaik. Dalam penelitian ini dilakukan ekstraksi dengan menggunakan pelarut
kloroform:methanol. Hal ini dilakukan berdasarkan penelitian yang dilakukan
sebelumnya (Maneerat & Phetrong, 2007).
Tiga puluh ml kultur (3.3.6) disentrifugasi (5000 rpm selama 30 menit
pada suhu 40C) dengan tujuan untuk melisiskan sel. Supernatan yang didapat
kemudian diasamkan dengan HCl sampai pH 2. Selanjutnya didiamkan satu
malam pada suhu 40C. Setelah itu, supernatan diekstraksi dengan
kloroform:methanol (2:1) selama 10 menit dan dipekatkan dengan menggunakan
rotary evaporator. Pelet yang diperoleh dari hasil ekstraksi berwarna kekuning –
kuningan kemudian dikeringkan pada suhu 600C, selanjutnya ditimbang sampai
diperoleh berat konstan. Berat ekstrak tersebut merupakan crude biosurfaktan.
3.4. Analisis Data
Untuk memilih konsentrasi gliserol yang memberikan pertumbuhan
optimum bagi L. sphaericus digunakan analisis sidik ragam dengan rancang acak
lengkap pada taraf uji 0,05%. Variabel yang dianalisis adalah jumlah sel dan
Indeks Emulsi (IE24%) sebagai parameter yang diuji. Pengambilan keputusan
dilakukan berdasarkan nilai hitung dan tabel, yaitu jika jika hitung <
F-tabel maka Ho diterima, dan jika nilai F-hitung > F-F-tabel maka Ho ditolak. Jika
hasil berbeda nyata atau sangat nyata pada taraf signifikansi 95%, maka dilakukan
antara jumlah sel dengan Indeks Emulsi (IE24%) digunakan uji Korelasi Pearson
dengan menggunakan SPSS 12. Penentuan keeratan hubungan yang ditunjukkan
oleh nilai koefisien korelasi mengikuti kriteria berikut ini (Nugroho, 2005):
1. 0,00 – 0,2 : Hubungan sangat lemah
2. 0,21 – 0,4 : Hubungan lemah
3. 0,41 – 0,7 : Hubungan kuat
4. 0,7 – 0,9 : hubungan sangat kuat
5. 0,91 – 0,99 : Hubungan sangat kuat sekali
BAB IV
HASIL DAN PEMBAHASAN
4.1. Pertumbuhan Bakteri L. sphaericus
Pola pertumbuhan bakteri L. sphaericus pada medium perlakuan crude
gliserol 2%, 4%, 6%, dan kontrol menunjukkan pola yang hampir sama (Gambar
1), yaitu tidak menunjukkan adanya fase adaptasi atau pertumbuhan langsung
memasuki fase eksponensial. Hal ini terjadi karena bakteri L. sphaericus
ditumbuhkan dalam medium utama pertumbuhan yang sama dengan medium
perlakuan, yaitu pada medium Bushnell-Haas+yeast ekstrak dengan penambahan
crude gliserol 2%, sehingga sel sudah siap tumbuh dalam medium yang baru
tanpa melalui fase adaptasi. Seperti yang dijelaskan oleh Purwoko (2007) bahwa
sel tidak memerlukan fase adaptasi ketika ditumbuhkan dalam medium dan
Gambar 1. Pertumbuhan Bakteri L. sphaericus pada Medium Perlakuan Crude Gliserol 2%, 4%, 6%, Dan Kontrol.
Berdasarkan hasil analisis sidik ragam (tabel 9 dalam lampiran 4)
diketahui bahwa pertumbuhan sel dalam medium dengan penambahan crude
gliserol lebih besar secara nyata dibandingkan dengan pertumbuhan sel dalam
medium kontrol. Hal ini artinya pertumbuhan sel dalam medium dengan
penambahan crude gliserol lebih tinggi dibandingkan dengan pertumbuhan sel
dalam medium kontrol. Dengan demikian hal ini menunjukkan bahwa crude
gliserol sebagai sumber karbon dapat memacu pertumbuhan L. sphaericus.
Samadi et al (2007) menyebutkan bahwa gliserol merupakan hidrokarbon larut air
yang mudah diurai. Oleh karena itu crude gliserol dapat dengan mudah digunakan
oleh L. sphaericus sebagai sumber karbon dan pembentukan energi bagi
pertumbuhannya sehingga pertumbuhan sel dalam medium dengan penambahan
crude gliserol lebih tinggi dibandingkan dengan pertumbuhan sel dalam medium
kontrol.
Pertumbuhan L. sphaericus dalam medium kontrol tampak mengalami
kenaikan pada hari ke-1 kultivasi. Dalam hal ini sel memanfaatkan yeast ekstrak
yang terkandung dalam medium kontrol sebagai sumber karbon bagi
pertumbuhannya dan pembentukan energi. Budiarti (2001) menyebutkan bahwa
yeast ekstrak selain berperan sebagai sumber nitrogen juga dapat digunakan
sebagai sumber karbon dalam pembentukan energi bagi pertumbuhan bakteri.
Populasi sel pada medium kontrol sesudah hari ke-1 kultivasi mulai terjadi
disebabkan oleh berkurangnya sumber karbon atau sumber nutrisi lain yang
terkandung dalam medium.
Namun, hal ini tidak terjadi pada pertumbuhan L. sphaericus dalam
medium yang ditambahkan dengan crude gliserol. Pertumbuhan L. sphaericus
pada medium perlakuan yang ditambahkan dengan crude gliserol sesudah hari
ke-1 kultivasi masih menunjukkan kenaikan hingga mencapai puncaknya. Dalam hal
ini L. sphaericus menggunakan crude gliserol sebagai sumber karbon bagi
pertumbuhannya secara langsung setelah suplai yeast ekstrak dalam medium
sudah habis tanpa melalui fase adaptasi. Hal ini ditandai dengan terjadinya
penurunan populasi sel dalam medium kontrol sesudah hari ke-1 kultivasi
sedangkan populasi sel dalam medium dengan penambahan crude gliserol masih
naik.
Pertumbuhan L. sphaericus dalam medium yang ditambahkan dengan
crude gliserol tampak berada pada fase eksponensial sesudah hari ke-0 sampai
hari ke-3 kultivasi. Pada fase eksponensial sel melakukan konsumsi nutrien dan
proses fisiologis lainnya. Pertumbuhan L. sphaericus dalam medium dengan
penambahan crude gliserol tampak memasuki fase stasioner sesudah hari ke-3
hingga hari ke-7 kultivasi, hal ini ditandai dengan jumlah populasi sel yang tetap.
Hal ini terjadi dapat disebabkan oleh suplai nutrisi dalam medium sudah habis.
Berdasarkan penelitian yang telah dilakukan sebelumnya terhadap
metabolisme L. sphaericus diketahui bahwa L. sphaericus dapat melakukan
metabolisme diantaranya yaitu glikolisis, siklus krebs, biosintesis asam lemak,
gliseropospolipid (http://www.genome.jp/kegg/.). Dalam hal ini gliserol
dimanfaatkan oleh L. sphaericus sebagaisumber karbon dan energi dalam proses
metabolismenya, antara lain sintesis biomassa, sintesis produk ekstraseluler, dan
energi pertumbuhan. L. sphaericus memanfaatkan gliserol sebagai sumber energi
dalam proses metabolismenya dan memproduksi berbagai jenis biosurfaktan yang
kemungkinan dapat dihasilkannya.
Disamping faktor nutrisi, pertumbuhan sel juga dipengaruhi oleh kondisi
lingkungan seperti pH, suhu dan ketersediaan oksigen yang mendukung
pertumbuhan (Purwoko, 2007). pH medium pertumbuhan pada awal inkubasi
berada pada pH 7, suhu medium pertumbuhan berada pada suhu kamar, dan suplai
oksigen dalam medium diperoleh dari pengocokan (rotary shaker) kultur selama
inkubasi dengan kecepatan konstan. Sandri (2009) dalam penelitiannya
menyebutkan bahwa L. sphaerichus mampu tumbuh pada kisaran pH 8 sampai 6
dan tumbuh optimum pada pH 6. Menurut Ahmed et al (2007) golongan
Lysinibacillus tumbuh pada kisaran nilai pH 9,5 – 5,5.
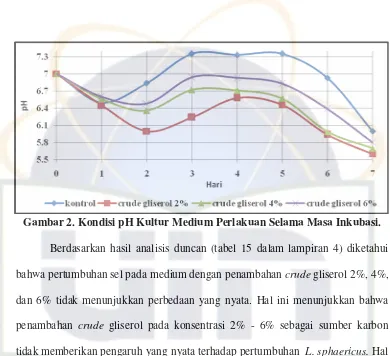
Kondisi pH kultur medium kontrol dan medium yang ditambahkan crude
gliserol selama inkubasi memiliki pola yang hampir sama (Gambar 2). pH
medium selama inkubasi berada pada kisaran pH 7,3 - 5,6. Penurunan pH yang
terjadi selama proses degradasi disebabkan sumber karbon yang terkandung
dalam medium merupakan sumber karbon yang sederhana. Seperti yang
dijelaskan oleh Nugroho (2006b) bahwa sumber karbon sederhana yang
terkandung dalam medium kultur dapat langsung digunakan oleh bakteri untuk
sisa dari metabolismenya dan hal ini cenderung menyebabkan pH medium
menurun.
Gambar 2. Kondisi pH Kultur Medium Perlakuan Selama Masa Inkubasi. Berdasarkan hasil analisis duncan (tabel 15 dalam lampiran 4) diketahui
bahwa pertumbuhan sel pada medium dengan penambahan crude gliserol 2%, 4%,
dan 6% tidak menunjukkan perbedaan yang nyata. Hal ini menunjukkan bahwa
penambahan crude gliserol pada konsentrasi 2% - 6% sebagai sumber karbon
tidak memberikan pengaruh yang nyata terhadap pertumbuhan L. sphaericus. Hal
ini terjadi karena sebagian crude gliserol pada konsentrasi 4% dan 6% dalam
medium kultur tidak terpakai untuk pertumbuhan sel. Dalam hal ini dapat
diketahui bahwa konsentrasi crude gliserol yang optimal bagi pertumbuhan L.
sphaericus yaitu pada konsentrasi 2%. Dengan demikian dapat disarankan untuk
penelitian mendatang perlu dilakukan pengujian dengan menurunkan konsentrasi
crude gliserol dibawah 2% guna mengetahui sejak konsentrasi berapa
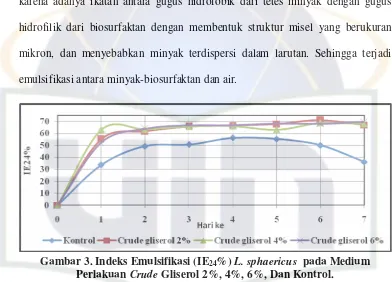
4.2. Aktifitas Emulsifikasi
Aktifitas emulsifikasi mulai tampak sejak hari pertama pertumbuhan sel
(Gambar 3). Dalam hal ini aktifitas emulsifikasi yang terjadi menunjukkan bahwa
biosurfaktan yang diproduksi oleh isolat bakteri L. sphaericus mampu
mengemulsi bensin. Emulsifikasi minyak bensin oleh biosurfaktan tersebut terjadi
karena adanya ikatan antara gugus hidrofobik dari tetes minyak dengan gugus
hidrofilik dari biosurfaktan dengan membentuk struktur misel yang berukuran
mikron, dan menyebabkan minyak terdispersi dalam larutan. Sehingga terjadi
emulsifikasi antara minyak-biosurfaktan dan air.
Gambar 3. Indeks Emulsifikasi (IE24%) L. sphaericus pada Medium
Perlakuan Crude Gliserol 2%, 4%, 6%, Dan Kontrol.
Berdasarkan hasil analisis sidik ragam (tabel 18 dalam lampiran 4)
diketahui bahwa IE24% dari biosurfaktan medium yang ditambahkan dengan
crude gliserol tampak lebih besar secara nyata dengan IE24% biosurfaktan
medium kontrol. Artinya bahwa IE24% biosurfaktan dari medium yang
ditambahkan crude gliserol lebih tinggi dibandingkan dengan IE24% biosurfaktan
sebagai sumber karbon mampu meningkatkan produksi biosurfaktan. Seperti yang
disebutkan oleh Bidlan et al (2007) bahwa gliserol mudah dimanfaatkan oleh
bakteri karena asam lemak bebas yang terkandung dapat merangsang bakteri
untuk memproduksi biosurfaktan dengan cepat.
Dalam penelitian ini sumber karbon pada medium kontrol hanya diperoleh
dari yeast ekstrak. Apabila dibandingkan IE24% dari biosurfaktan medium kontrol
pada hari ke-4 kultivasi (IE24% tertinggi) dengan IE24% dari biosurfaktan medium
crude gliserol 6% pada hari yang sama terdapat 18% perbedaannya. Artinya
dengan penambahan crude gliserol 6% sebagai sumber karbon dihasilkan
biosurfaktan 18% lebih banyak dari biosurfaktan yang dihasilkan dalam medium
kontrol.
Berdasarkan hasil analisis duncan (tabel 24 dalam lampiran 4) diketahui
bahwa IE24% yang berasal dari biosurfaktan kultur medium dengan penambahan
crude gliserol 2%, 4%, dan 6% tidak menunjukkan perbedaan yang nyata. Hal ini
menunjukkan bahwa penambahan crude gliserol pada konsentrasi 2% sampai
dengan 6% tidak memberikan pengaruh yang nyata terhadap indeks emulsifikasi
biosurfaktan yang dihasilkan oleh L. sphaericus. Hal ini terjadi karena sebagian
crude gliserol pada konsentrasi 4% dan 6% dalam medium kultur tidak terpakai
untuk pertumbuhan sel dan uji emulsifikasi. Dalam hal ini dapat diketahui bahwa
konsentrasi crude gliserol yang optimal untuk indeks emulsi biosurfaktan yang
dihasilkan oleh L. spaerichus yaitu pada konsentrasi 2%. Dengan demikian dapat
disarankan untuk penelitian mendatang perlu dilakukan pengujian dengan
konsentrasi berapa indeks emulsifikasi biosurfaktan yang dihasilkan oleh L.
spaerichus mulai mengalami kenaikan.
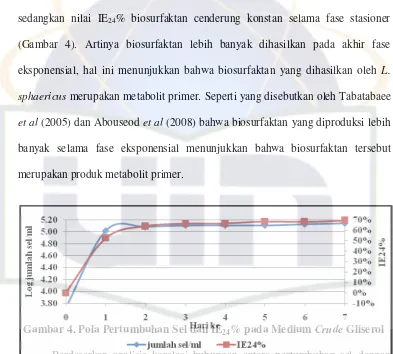
4.3. Hubungan Produksi Biosurfaktan dengan Pertumbuhan Sel
Nilai IE24% biosurfaktan tertinggi dari medium dengan penambahan crude
gliserol diperoleh pada akhir fase eksponensial yaitu pada hari ke-3 kultivasi,
sedangkan nilai IE24% biosurfaktan cenderung konstan selama fase stasioner
(Gambar 4). Artinya biosurfaktan lebih banyak dihasilkan pada akhir fase
eksponensial, hal ini menunjukkan bahwa biosurfaktan yang dihasilkan oleh L.
sphaericus merupakan metabolit primer. Seperti yang disebutkan oleh Tabatabaee
et al (2005) dan Abouseod et al (2008) bahwa biosurfaktan yang diproduksi lebih
banyak selama fase eksponensial menunjukkan bahwa biosurfaktan tersebut
merupakan produk metabolit primer.
Gambar 4. Pola Pertumbuhan Sel dan IE24% pada Medium Crude Gliserol Berdasarkan analisis korelasi hubungan antara pertumbuhan sel dengan
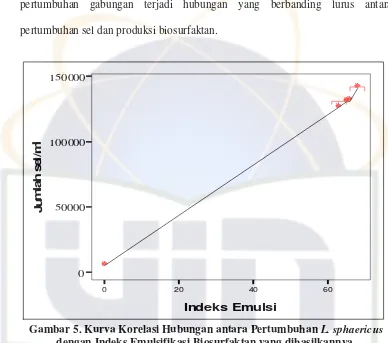
produksi biosurfaktan menunjukkan hubungan yang kuat (r = 0,993) (Gambar 5).
Hal ini menunjukkan bahwa produksi biosurfaktan sejalan dengan pertumbuhan
sel. Dalam hal ini pola produksi biosurfaktan dari L sphaericus termasuk dalam
produksi biosurfaktan meningkat sejalan dengan kenaikan pertumbuhan sel.
Seperti yang disebutkan oleh Desai & Banat (1997) bahwa pada produksi
pertumbuhan gabungan terjadi hubungan yang berbanding lurus antara
pertumbuhan sel dan produksi biosurfaktan.
Gambar 5. Kurva Korelasi Hubungan antara Pertumbuhan L. sphaericus dengan Indeks Emulsifikasi Biosurfaktan yang dihasilkannya.
4.4. Ekstraksi Biosurfaktan
Biosurfaktan merupakan molekul amphipatik yang terdiri dari bagian
hidrofilik yang bersifat polar dan bagian hidrofobik yang bersifat non-polar
(Al-Araji et al., 2007). Biosurfaktan dapat diekstraksi menggunakan sistem pelarut
organik baik dengan pelarut tunggal maupun kombinasi pelarut (mix solvent).
Kombinasi pelarut (mix solvent) umumnya digunakan untuk memudahkan