SIFAT ANTIBAKTERI DARI EKSTRAK DAUN KEMANGI
(Ocimum basilicum L.) DAN DAUN TESPONG
(Onanthe javanica D.C.)
SHINTA DWI SETIANI
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI SKRIPSI DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA*
Dengan ini saya menyatakan bahwa skripsi berjudul Sifat Antibakteri Dari Ekstrak Daun Kemangi (Ocimum basilicum L.) Dan Daun Tespong (Onanthe javanica D.C.) adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Januari 2014
Shinta Dwi Setiani
ABSTRAK
SHINTA DWI SETIANI. Sifat AntibakteriDari Ekstrak Daun Kemangi (Ocimum basilicum L.) Dan Daun Tespong (Onanthe javanica D.C.). Dibimbing oleh DYAH ISWANTINI P dan SRI BUDIARTI.
Pengujian antimikrob pada daun kemangi dan daun tespong dilakukan untuk mengetahui potensi antibakteri pada tanaman sebagai acuan dalam pemanfaatan tanaman herbal. Tanaman herbal digunakan sebagai bahan baku obat tradisional maupun modern. Pengujian antibakteri pada penelitian ini menggunakan metode Kirby-Bauer. Berdasarkan hasil penelitian, ekstrak daun kemangi, ekstrak daun tespong, antibiotik ampisilin, dan kloramfenikol tidak dapat menghambat pertumbuhan dari bakteri E.coli dan B.cereus. Hal ini disebabkan karena bakteri yang digunakan resisten terhadap antibiotik sintesis dan alami.
kata kunci: daun kemangi, daun tespong, antimikrob, resistensi antibiotik
ABSTRACT
SHINTA DWI SETIANI. Characterization of ExtractsOcimum basilicum L And
Onanthe javanica D.C. As Antibacterial Substance. Superviced by DYAH ISWANTINI P dan SRI BUDIARTI.
Antimicrobial test in the Ocimum basilicumL and Onanthe javanica D.C. done to find out teh potential of antibacterial at the plant as a herbs plant utilization. Herb plants used as raw material for traditional medicine and modern. Antibacterial test was carried using Kirby-Bauer method.Based on the results of the study, extracts of Ocimum basilicum L , Onanthe javanica D.C, ampicillin and chloramphenicol can’t inhibit the growth of E.coli and B.cereus. This is caused due to bacteris that are resistant to the antibiotics used in the synthesis and natural.
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Sains
pada
Departemen Kimia
SIFAT ANTIBAKTERI DARI EKSTRAK DAUN KEMANGI
( Ocimum basilicum L.) DAN DAUN TESPONG
(Onanthe javanica D.C.)
SHINTA DWI SETIANI
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM INSTITUT PERTANIAN BOGOR
Judul Skripsi : Sifat Antibakteri Dari Ekstrak Daun Kemangi (Ocimum basilicum
L.) Dan Daun Tespong (Onanthe javanica D.C.) Nama : Shinta Dwi Setiani
NIM : G44070063
Disetujui oleh
Prof. Dr. Dyah Iswantini P, M.sc, Agr Pembimbing I
Dr.dr.Sri Budiarti Pembimbing II
Diketahui oleh
Prof. Dr. Purwatiningsih, MS Ketua Departemen
PRAKATA
Puji dan syukur penulis panjatkan kehadirat Allah SWT, karena berkat rahmat dan hidayah-Nya penulis dapat menyelesaikan skripsi yang berjudul Sifat Antibakteri Dari Ekstrak Daun Kemangi (Ocimum basilicum L.) Dan Daun Tespong (Onanthe javanica D.C.). Salawat serta salam semoga tercurah kapada nabi besar Muhammad SAW. Skripsi ini disusun sebagai salah satu syarat kelulusan Program Sarjana di Departemen Kimia Fakultas Matematika dan Ilmu Pengetahuan Alam (FMIPA), Institut Pertanian Bogor (IPB).
Penulis mengucapkan terima kasih kepada Ibu Prof. Dr. Dyah Iswantini P, M.Sc.Agr selaku pembimbing pertama dan Ibu Dr.dr. Sri Budiarti selaku pembimbing kedua, yang telah memberikan arahan, bimbingan, waktu, motivasi, dan doa selama penelitian dan penyusunan skripsi. Terima kasih juga kepada staf dan laboran di laboratorium Kimia Fisik dan Laboratorium Mikrobilogi FMIPA IPB.
Penulis juga mengucapkan terima kasih kepada kedua orangtua dan kakak-kakak saya (Dyane Rismawanty, S.Pd dan Ruslan Heri Nugraha) yang selalu memberikan semangat, doa, dukungan moril maupun materi. Penulis juga mengucapkan terima kasih kepada Nuridin Zainal Adhiyana yang telah memberikan motivasi, doa, dan semangat pada penulis. Serta rekan-rekan seperjuangan Kimia Angkatan 44 dan adik-adik Angkatan 45 yang telah memberikan bantuan dalam menyelesaikan skripsi ini.
Bogor, Januari 2014
DAFTAR ISI
DAFTAR TABEL vi
DAFTAR GAMBAR vi
DAFTAR LAMPIRAN vi
PENDAHULUAN 1
Latar Belakang 1
Perumusan Masalah 1
Tujuan Penelitian 2
Manfaat Penelitian 2
METODE 2
Bahan 2
Alat 2
Prosedur 2
HASIL DAN PEMBAHASAN 5
SIMPULAN DAN SARAN 11
Simpulan 11
Saran 11
DAFTAR PUSTAKA 11
LAMPIRAN 14
DAFTAR TABEL
1 Hasil uji fitokimia ekstrak kasar daun kemangi dan daun tespong 7 2 Hasil Perhitungan Jumlah Sel E.coli ATCC 8739 7 3 Hasil Perhitungan Jumlah Sel B.cereus ATCC 10876 8 4 Hasil uji aktivitas ekstrak tunggal daun kemangi dan daun tespong pada
berbagai konsentrasi terhadap bakteri E.coli ATCC 8739 9 5 Hasil uji aktivitas ekstrak tunggal daun kemangi dan daun tespong pada
berbagai konsentrasi terhadap bakteri B.cereus ATCC 10876 10
6 Hasil Uji Kadar Air Daun Kemangi 15
7 Hasil Uji Kadar Abu Daun Kemangi 16
DAFTAR GAMBAR
1 Kurva Standar Pertumbuhan Bakteri E.coli ATCC 8739 8 2 Kurva Standar Pertumbuhan BakteriB.cereus ATCC 10876 9 3 Hasil uji aktivitas ekstrak daun tespong pada bakteri B.cereus ATCC
10876 9
4 Contoh hasil uji antibakteri ekstrak daun kemangi terhadap bakteri
E.coli ATCC 8739 dan B.cereus ATCC 10876 17
5 Contoh hasil uji antibakteri ekstrak daun tespong terhadap bakteri
E.coli ATCC 8739 dan B.cereus ATCC 10876 17
DAFTAR LAMPIRAN
1 Bagan alir lingkup kerja penelitian 13
2 Contoh perhitungan kadar air daun kemangi 14
3 Contoh perhitungan kadar abu daun kemangi 15
4 Contoh hasil uji antimikrob ekstrak daun kemangi terhadap bakteri
E.coli ATCC 8739dan B.cereus ATCC 10876 17
5 Contoh hasil uji antimikrob ekstrak daun tespong terhadap bakteri
1
PENDAHULUAN
Latar Belakang
Indonesia merupakan negara yang memiliki keanekargaman hayati yang berlimpah. Pemanfaatan keanekaragaman hayati ini telah banyak dikembangkan dalam berbagai bidang teknologi dan ilmu pengetahuan. Salah satu bidang teknologi yang sedang dikembangkan yaitu pemanfaatan tanaman herbal sebagai sediaan obat. Tanaman herbal atau tanaman obat yaitu tanaman yang berupa daun, batang, buah, dan akarnya yang memiliki khasiat sebagai obat dan digunakan sebagai bahan mentah dalam pembuatan obat modern maupun obat-obat tradisional. Pemanfaatan tanaman obat sebagai bahan baku, terutama obat tradisional mencapai seribu jenis, dimana 74% diantaranya merupakan tumbuhan liar yang hidup di hutan (Amzu&Haryanto 1990). Jagtap et al (2010),dalam penelitiannya menggunakan ekstrak kasar dari akar, daun, dan batang beberapa tanaman. Hasil menunjukan bahwa zat antimikrob terdapat dalam semua bagian tanaman, antimikrob terbesar dihasilkan pada tanaman Diospyros melanoxylon
yang mampu menghambat bakteri E.coli dengan diameter hambat 39 mm. Kandungan kimia dan formulasi di dalam tanamanlah yang mempengaruhi kegunaannya sebagai bahan baku obat.
Kemangi dan tespong merupakan dua jenis tanaman herbal yang dapat tumbuh di Indonesia. Penelitian ini dilakukan untuk mengetahui sifat antibakteri pada kedua jenis tanaman tersebut. Zat antibakteri merupakan senyawa baik alami maupun sintetik mempunyai efek menekan atau menghentikan suatu proses biokimia dalam organisme khususnya dalam proses infeksi bakteri (Tenover 2006). Berdasarkan hasil penelitian Anand et al (2011), daun kemangi dapat menghambat pertumbuhan bakteri Stapylococus aereus ATCC29213, MRSA15187, VRE (Clinical Isolate), Escherchia coli ATCC29212. Hasil penelitian Rostinawati pada tahun 2010, daun tespong dapat menghambat aktivitas bakteri Escherchia coli dengan diameter hambat 8 mm pada konsentrasi 0,2 g/ml. Berdasarkan informasi di atas, pada penelitian ini akan dilakukan pengujian antibakteri pada masing-masing ekstrak.
Penelitian yang dilakukan menggunakan bakteri uji Escherchia coli dan
Bacillus cereus. Escherchia coli merupakan bakteri gram negatif yang dapat hidup di dalam usus manusia dan penyebab penyakit diare. Penelitian Prabhu et al
(2010), E.coli dapat dihambat aktivitasnya oleh ekstrak nanopartikel perak pada daun Ocimum sanctum. Bacillus cereus merupakan bakteri patogen yang menyebabkan keracunan makanan dengan gejala muntah dan diare. Bakteri ini dapat tumbuh pada usus kecil manusia dan hewan. Penelitian Meilisa (2009) menggunakan bakteri Bacillus cereus sebagai bakteri gram positif dalam uji antibakteri rimpang temulawak. Hasil dari penelitian ini, diharapkan dapat digunakan sebagai acuan dalam teknologi nano herbal sebagai zat antibakteri.
Perumusan Masalah
2
lalapan. Kurangnya pengetahuan akan manfaat tanaman ini menjadi acuan dalam penelitian ini. Zat Antimikrob diharapkan terdapat dalam dua jenis tanaman tersebut. Tanaman kemangi dan tespong berasal dari desa Cihanjuang Cimahi. Tanaman ini akan di ekstraksi menggunakan metode maserasi sehingga dihasilkan ekstrak kasarnya. Ekstrak kasar kemudian di uji antibakterinya.
Tujuan Penelitian
Penelitian ini bertujuan untuk mengetahui sifat antibakteri pada daun kemangi (Ocimum basilicum L.) dan daun tespong (Onanthe javanica D.C.).
Manfaat Penelitian
Penelitian ini diharapkan mampu memberi informasi ilmiah tentang sifat antibakteri dari dua ekstrak tanaman.
METODE
Bahan
Bahan yang digunakan adalah daun kemangi dan daun tespong dari kebun di daerah Kampung Babakan, Desa Cihanjuang,-Cimahi, bakteri standar Bacillus cereus ATCC10876, bakteri standar Escherchia coli ATCC8739, etanol 30%, media TSA (Tryptic Soy Agar), media TSB (Tryptic Soy Broth), serbuk NaCl, pereaksi Dragendrof, pereaksi Meyer, pereaksi Wagner, kloroform, NH4OH, H2SO4 2M, serbuk Mg, HCl 3M, Amil Alkohol, FeCl3 1%, Eter, CH3COOH anhidrat, Etil asetat, Metanol, n-heksana, Butanol,dan AgNO3.
Alat
Alat-alat yang digunakan adalah peralatan gelas, peralatan pemanas, timbangan analitik, cawan petri, cawan porselen, kertas saring Whatman No. 1,
water bath, shaker,vortex, hot plate, oven, autoklaf, spektofotometer, pelat tetes, dan petri dish.
Prosedur
3
Persiapan sampel
Sampel basah daun kemangi dan daun tespong masing-masing diambil 1 kg.Sampel dikeringkan di bawah sinar matahari selama 2 s.d 3 hari.Kemudian simplisia kasar digiling dan ditimbang.
Analisis Kadar Air (AOAC 2007)
Cawan porselen dikeringkan pada suhu 105⁰C selama 15 menit lalu didinginkan dalam deksikator selama 15 menit dan ditimbang (A).Sebanyak 2 gram sampel(baik serbuk daun kemangi maupundaun tespong) dimasukkan ke dalam cawan yangtelah dikeringkan (B) dan dipanaskan pada suhu 105⁰C selama 5 jam, kemudian didinginkan dalam deksikator selama 15 menit dan ditimbang sampai diperoleh bobot konstan (C). Penetapan kadar air dilakukanberdasarkan penentuan jumlah bobot kering contoh. Penentuan kadar air dilakukan sebanyak 3 kali ulangan (triplo).
Kadar air (%) = B-Cx 100% B-A
Keterangan:
A = Bobot cawan kosong (gram)
B = Bobot cawan + sampel sebelum dikeringkan (gram) C = Bobot cawan + sampel setelah dikeringkan (gram)
Kadar Abu (AOAC 2007)
Cawan porselen dikeringkan terlebih dahulu di dalam oven selama 30 menit kemudian cawan didinginkan dalam deksikator selama 15 menit dan ditimbang. Sebanyak 2 gram sampel (baik serbuk daun kemangi maupun daun tespong) dimasukkan ke dalam cawan dan dipanaskan dengan nyala api bunsen sampai tidak berasap selama ± 10 menit dan dilanjutkan dengan pengabuan di dalam tanur pada suhu 600 ⁰C sampai pengabuan sempurna. Sampel yang telah diabukan didinginkan dalam deksikator dan ditimbang. Kadar abu dihitung dengan persamaan
Kadar abu (%) = C-A x 100% B-A
Keterangan:
A = bobot cawan kosong (gram)
B = bobot cawan + sampel (terkoreksi kadar air) (gram) C = bobot cawan + abu (gram)
Pembuatan Ekstrak Daun Kemangi dan Daun Tespong
4
Analisis Kualitatif Fitokimia (Harborne 1987)
Uji Flavonoid. Sebanyak 0.1 g ekstrak ditambahkan 10 ml air panas dan dididihkan selama 5 menit.Setelah itu, disaring dan filtratnya digunakan untuk pengujian. Filtrat dimasukkan kedalam tabung reaksi lalu ditambahkan 0.5 g serbuk Mg, 1 mL HCl, dan 1 mL amil alkohol, kemudian dikocok kuat. Uji positif flavonoid menghasilkan warna kuning atau jingga pada lapisan amil alkohol.
Uji Alkoloid. Sebanyak 0.1 g ekstrak dilarutkan dalam 10 mL CHCl3 dan 4 tetes NH4OH. Larutan disaring dan filtratnya dimasukkan ke dalam tabung reaksi tertutup. Ekstrak CHCl3 dalam tabung reaksi dikocok dengan 10 tetes H2SO4 2 M dan lapisan asamnya dipisahkan kedalam tabung reaksi lainnya. Lapisan asam ini diteteskan pada plat tetes dan ditambahkan pereaksi Mayer, Wagner, Dragendrof yang akan membentuk endapan berturut-turut berwarna putih, coklat, dan merah jingga jika terdapat alkaloid.
Uji Saponin. Sebanyak 0.1 g ekstrak ditambahkan 10 mL air panas dan dididihkan selama 5 menit.Setelah itu disaring dan filtratnya digunakan untuk pengujian. Filtrat dimasukkan kedalam tabung reaksi tertutup kemudian dikocok selama 10 menit. Adanya saponin ditunjukkan dengan terbentuknya buis yang stabil.
Uji Triterpenoid dan steroid.Sebanyak 0.1 g ekstrak dilarutkan dengan 25 ml etanol panas (50⁰C). Larutan disaring dalam pinggan porselin dan diuapkan sampai kering. Residu ditambahkan eter dipindahkan kedalam plat tetes. Sebanyak 3 tetes CH3COOH anhidrat dan 1 tetes H2SO4 (Uji Liebermann-Buchrad). Warna merah atau ungu menunjukkan triterpenoid, sedangkan warna hijau atau biru menunjukkan kandungan steroid.
Uji Tanin. Sebanyak 0.1 g ekstrak ditambahkan 10 mL air panas, dididihkan selama 5 menit,dan disaring. Sebagian filtra yang diperoleh ditambahkan larutan FeCl3 1%.Hasil positif ditunjukkan oleh warna hijau kehitaman.
Pembuatan Media Uji
Media Tryptic Soy Broth (TSB). Sebanyak 30 g TSB dilarutkan dalam 1 L air suling. Kemudian direbus sampai cairan menjadi bening.Setelah itu disterilkan di dalam autoklaf pada suhu 121 ⁰C, 1 atm selama 15 menit.Larutan dituangkan kedalam petri dish.
Media Tryptic Soy Agar (TSA). Sebanyak 40 g TSA dilarutkan dalam 1 L air suling. Kemudian direbus sampai cairan menjadi bening.Setelah itu disterilkan di dalam autoklaf pada suhu 121 ⁰C, 1 atm selama 15 menit. Larutan dituangkan kedalam petri dish.
Persiapan Bakteri Standar
5
Perhitungan Mikrob
Hitungan Cawan. Siapakan delapan buah botol berisi akudes steril 9 ml (diberikan label pada masing-masing botol (A= 10-1; B= 10-2; C= 10-3 dan seterusnya).Kemudian diambil bakteri standar dipipet sebanyak 0,1 ml kedalam tabung A dikocok. Setelah itu, dari tabung A di pipet 0,1 ml kedalam tabung B dan seterusnya. Pada pengenceran 10-5 dipipet 0,1 ml kedalam cawan yang telah berisi media agar. Penuangan ke dalam cawan dilakukan hingga pengenceran 10-7 . Setelah itu cawan yang telah berisikan bakteri di inkubasi selama 18-24 jam pada suhu 35⁰C.
Perhitungan Massa Sel (Metode Turbidimetri). Siapakan enam tabung reaksi. Satu tabung dibiarkan kosong (diberikan label A= 1:1) dan lima tabung di isi media TSB sebanyak 3 ml (diberikan label pada masing-masing botol (B=1:2; C= 1:4; D= 1:8; E= 1;16; F= blanko). Kemudian bakteri standar di pipet sebanyak 3 ml kedalam tabung B dan di kocok menggunakan vorteks. Setelah itu dari tabung B di pipet sebanyak 3 ml dimasukkan kedalam tabung C dan seterusnya sampai pengenceran 1:16). Kemudian kekeruhan bakteri di ukur menggunakan spektrofotometri dengan panjang gelombang 620nm
Uji Antibakteri (Kirby-Bauer)
Uji Ekstrak Tunggal Dengan Antibiotik Kloramfenikol. Suspensi bakteri uji dipipet sebanyak 0,1 mL pada permukaan media TSA padat. Sebagai kontrol positif digunakan kertas cakram berisi antibiotik kloramfenikol 0,03 mg/ml dan 0,10 mg/ml. Ekstrak, kontrol positif serta kontrol negatif dipipet sebanyak 100 µ L, diteteskan di atas kertas cakram pada permukaan media yang telah mengandung bakteri uji. Ekstrak diuji menggunakan bakteri gram negatif
Escherchia coli ATCC8739 dan bakteri gram positif Bacillus cereus pada suhu 35⁰C diinkubasi selama 18-24 jam.Aktivitas antimikrob diekspresikan dengan zona bening sebagai daerah hambat pada bakteri.
Uji Ekstrak Tunggal Dengan Antibiotik Ampisilin. Suspensi bakteri uji dipipet sebanyak 0,1 mL pada permukaan media TSA padat. Sebagai kontrol positif digunakan kertas cakram berisi antibiotik ampisilin 0,10 mg/ml. Ekstrak, kontrol positif serta kontrol negatif dipipet sebanyak 100 µ L, diteteskan di atas kertas cakram pada permukaan media yang telah mengandung bakteri uji. Ekstrak diuji menggunakan bakteri gram negatif Escherchia coli8739 dan bakteri gram positif Bacillus cereus ATCC10876 pada suhu 35⁰C diinkubasi selama 18-24 jam. Aktivitas antibakteri diekspresikan dengan zona bening sebagai daerah hambat pada bakteri.
HASIL DAN PEMBAHASAN
Kadar Air dan Abu
6
hasil penelitian, rerata kadar air pada daun kemangi sebesar 19,46% dan kadar air pada daun tespong sebesar 12,91%. Menurut Winarno (1997), bila kadar air yang terkandung dalam suatu bahan kurang dari 10%, maka kestabilan optimum akan tercapai dan pertumbuhan mikroba dapat dikurangi. Berdasarkan literatur di atas, daun kemangi dan daun tespong kurang baik apabila dilakukan penyimpanan dalam waktu lama.
Penentuan kadar abu bertujuan menentukan kandungan mineral sisa hasil pembakaran bahan organik. Mineral sebagai senyawaan anorganik akan tertinggal dalam bentuk abu yang dapat digunakan untuk analisis kualitatif dan kuantitatif. Berdasarkan hasil penelitian, kadar abu pada daun kemangi dan daun tespong berturut-turut sebesar 13,78% dan 12,10%.Besarnya presentasi kadar abu dalam suatu sampel dipengaruhi oleh banyaknya kandungan mineral dalam sampel tersebut. Data hasil perhitungan kadar air dan kadar abu dapat dilihat pada Lampiran 2 dan 3.
Ekstraksi
Ekstraksi merupakan salah satu cara pemisahan satu atau lebih komponen dari suatu bahan atau jaringan tanaman. Metode ekstraksi yang digunakan yaitu metode maserasi. Metode maserasi adalah pemisahan zat aktif yang dilakukan dengan cara merendam serbuk simplisia dalam pelarut yang sesuai selama beberapa hari pada suhu kamar. Kelebihan metode ini yaitu sederhana, efektif, dan aman.Metode maserasi biasanya digunakan untuk mengekstrak senyawa yang kurang tahan panas dan digunakan untuk sampel yang belum diketahui karakteristiknya.Rendemen ekstrak merupakan perbandingan antara berat ekstrak dengan berat contoh dikalikan seratus persen. Besarnya rendemen ekstrak dipengaruhi oleh kehalusan bahan, jenis pelarut dan lama ekstraksi (Bagem 2006). Berdasarkan penelitian Amalia F (2012), rendemen ekstrak kasar terbesar dihasilkan dari perendaman simplisia dengan pelarut etanol 30%. Oleh karena itu, penelitian ini menggunakan pelarut etanol 30% dalam tiap simplisia. Sebanyak 50 gram simplisia yang di maserasi dihasilkan rendemen ekstrak daun kemangi sebesar 12,93% dan rendemen ekstrak daun tespong sebesar 17,93%.
Analisis kualitatif Fitokimia
7 Tabel 1Hasil uji fitokimia ekstrak kasar daun kemangi dan daun tespong
Komponen Kemangi Tespong
Flavonoid + +
Keterangan: (+) : terdeteksi; (-) : tidak terdeteksi
Berdasarkan uji analisis kualitatif fitokimia dari kedua jenis ekstrak positif memiliki senyawa tanin dan flavonoid yang telah diketahui mempunyai khasiat sebagai zat antibakteri. Keberadaan tanin dalam ekstrak dapat menyebabkan terganggunya sintesis peptidoglikan sehingga pembentukan dinding sel bakteri menjadi tidak sempurna. Selain itu, tanin dapat menyebabkan terjadinya denaturasi protein apabila pada pH mendekati isoelektrik terjadi ikatan hidrogen antara tanin dengan protein. Protein akan terendapkan, enzim menjadi inaktif, metabolisme terganggu yang menyebabkan kerusakan pada sel bakteri. Tanin dan flavonoid bekerja sama untuk menyerang gugus polar di dalam membran sel bakteri yang menyebabkan fospolipid akan terurai menjadi gliserol, asam karboksilat, dan asam fosfat. Hal ini mengakibatkan fospolipid tidak mampu mempertahankan bentuk membran sel, akibatnya membran sel mengalami kebocoran dan bakteri akan mengalami kematian (Gilman et al 1991).
Kurva standar pertumbuhan bakteri
Bakteri standar yang akan digunakan terlebih dahulu dihitung jumlah koloni menggunakan metode hitung cawan. Berdasarkan hasil penelitian, jumlah koloni pada bakteri E.coli ATCC 8739 yaitu 4,90 x 107dan bakteri B.cereus
ATCC 10876 yaitu 3,20 x 107. Jumlah koloni bakteri E.coli ATCC8739 pada media Triptic Soy Broth (TSB) lebih banyak tumbuh bila dibandingkan dengan bakteri E.cereus ATCC10876. Hasil pengukuran nilai absorbansi dan perhitungan jumlah koloni bakteri dapat dilihat pada Tabel 2 dan 3.
Tabel 2 Hasil Perhitungan Jumlah Sel Bakteri E.coli ATCC8739 No Pengenceran Absorbansi
Absorbansi
terkoreksi jumlah sel/ml (107) log jumlah sel
1 P1/1 0.846 0,836 4,90 7,690
2 P1/2 0.513 0,505 2,45 7,389
3 P1/4 0.278 0,270 1,23 7,090
4 P1/8 0.148 0,140 0,62 6,792
8
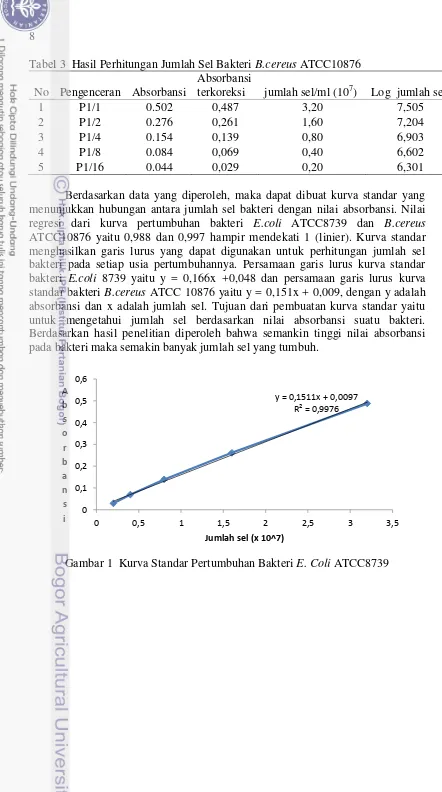
Tabel 3 Hasil Perhitungan Jumlah Sel Bakteri B.cereus ATCC10876 No Pengenceran Absorbansi
Absorbansi menunjukkan hubungan antara jumlah sel bakteri dengan nilai absorbansi. Nilai regresi dari kurva pertumbuhan bakteri E.coli ATCC8739 dan B.cereus
ATCC10876 yaitu 0,988 dan 0,997 hampir mendekati 1 (linier). Kurva standar menghasilkan garis lurus yang dapat digunakan untuk perhitungan jumlah sel bakteri pada setiap usia pertumbuhannya. Persamaan garis lurus kurva standar bakteri E.coli 8739 yaitu y = 0,166x +0,048 dan persamaan garis lurus kurva standar bakteri B.cereus ATCC 10876 yaitu y = 0,151x + 0,009, dengan y adalah absorbansi dan x adalah jumlah sel. Tujuan dari pembuatan kurva standar yaitu untuk mengetahui jumlah sel berdasarkan nilai absorbansi suatu bakteri. Berdasarkan hasil penelitian diperoleh bahwa semankin tinggi nilai absorbansi pada bakteri maka semakin banyak jumlah sel yang tumbuh.
Gambar 1 Kurva Standar Pertumbuhan Bakteri E. Coli ATCC8739
9
Gambar 2 Kurva Standar Pertumbuhan Bakteri B.cereus ATCC10876
Pengujian aktivitas antibakteri
Pengujian antibakteri pada penelitian ini menggunakan metode Kirby-Bauer. Metode ini merupakan salah satu metode difusi agar dalam uji antimikrob. Prinsip kerja metode ini yaitu pengukuran sensitifitas antibiotik dengan metode
paper disk yang berisi agen antimikroba pada media yang telah ditanami bakteri dan akan berdifusi kedalam media agar. Hasil dari uji dapat diamati dengan adanya zona bening disekitar antibiotik. Metode ini paling efektif digunakan dalam metode uji antimikrob karena hasil uji dapat diketahui dengan cepat. Selain itu kelebihan dari metode ini yaitu lebih sederhana dan murah.
Gambar 3 Hasil uji aktivitas ekstrak daun tespong pada bakteri Bacillus cereus
ATCC10876
Tabel 4 Hasil uji aktivitas ekstrak tunggal daun kemangi dan daun tespong pada berbagai konsentrasi terhadap bakteri E.coli ATCC8739
10
Tabel 5 Hasil uji aktivitas ekstrak tunggal daun kemangi dan daun tespong pada berbagai konsentrasi terhadap bakteri B.cereus ATCC10876
Nama
Berdasarkan hasil penelitian, diketahui bahwa tidak adanya zona bening yang dihasilkan dari kedua ekstrak dan antibiotik yang digunakan. Hal ini dikarenakan kedua jenis bakteri resisten terhadap antibiotik alami dan sintesis. Resistensi bakteri adalah kemampuan dari bakteri atau mikroorganisme lain untuk menahan efek antibiotik. Resistensi antibiotik terjadi ketika bakteri mampu mengeluarkan gen resisten sehingga dapat mengurangi efektifitas dari suatu ekstrak dan bahan kimia yang memiliki aktivitas untuk menghambat bakteri. Bakteri di dalam hidupnya mampu berevolusi untuk mempertahankan diri dari hal yang dapat menggangu kelangsungan hidupnya. Bakteri yang resisten akan tumbuh dan bereproduksi meski adanya antibiotik.
Penggunaan antibiotik kloramfenikol dan ampicilin tidak mampu menghambat pertumbuhan bakteri E.coli dan B.cereus. Kloramfenikol diketahui sebagai antibiotik yang memiliki spektrum yang luas dalam menghambat pertumbuhan bakteri gram negatif dan gram positif. Menurut Nogrady et al
(2011), bakteri S. thypimurium dari animal tidak dapat dihambat pertumbuhannya oleh antibiotik kloramfenikol. Hal ini terjadi karena adanya plasmid yang menghasilkan enzim Chloramphenicol Acetyltransferase (CAT) yang mampu mengaktivasi kloramfenikol (Balbi 2004). Adanya enzim CAT menyebabkan hilangnya kemampuan kloramfenikol sebagai antibiotik. Berdasarkan penelitian Sri B (2011), bakteri E.coli resisten terhadap antibiotik ampicilin dan kloramfenikol dengan presentasi berturut-turut 73,75% dan 51,25%. Hal ini terjadi karena terhadap antibiotik karena adanya perubahan struktur genetik pada bakteri. Menurut Katzung (1982), resistensi E.coli terhadap ampicilin dapat disebabkan oleh kemampuan bakteri menghasilkan enzim b-lactamase yang disandi olen gen dalam plasmid faktor R.
11 Resistensi plasmid terjadi apabila plasmid tidak dipengaruhi oleh kromosom mampu mengendalikan gen resisten pada antibakteri yang disebut dengan plasmid faktor R. Di dalam plasmid faktor R bakteri mampu menghasilkan enzim yang dapat mengaktivasi antibiotik. Resistensi kromosom terjadi karena adanya mutasi susunan asam nukleat dalam kromosom bakteri. Mutasi tersebut mengakibatkan terjadinya sintesis protein atau makromolekul lain yang berbeda sehingga menggangu aktivitas antimikroba terhadap sel inang. Beberapa penelitian melaporkan bahwa gen resistensi antimikrob yang terdapat dalam plasmid lebih mudah berpindah daripada yang terdapat dalam kromosom, karena plasmid dapat dipindahkan antar sel baik sel bakteri baik maupun yang berbeda spesiesnya (Courvalin 1994; Davies 1997). Berbeda dengan mekanisme resistensi terhadap ampicilin, permeabilitas membran yang menyebabkan mutasi membran terluar yang disandi secara kromosal lebih stabil dibandingkan dengan gen yang disandi oleh plasmid (Katzung 1982).
SIMPULAN DAN SARAN
Simpulan
Berdasarkan penelitian, pada kedua jenis ekstrak diketahui tidak adanya sifat antibakteri. Hal ini terlihat dari tidak adanya zona bening yang dihasilkan. Selain oleh ekstrak kasar dari daun kemangi dan daun tespong, bakteri yang digunakan tidak dapat dihambat pertumbuhannya oleh antibiotik kloramfenikol dan ampisilin. Kekebalan bakteri terhadap ekstrak dan antibiotik disebabkan adanya gen resisten pada bakteri.
Saran
Perlu dilakukan uji antibakteri ekstrak daun Kemangi dan daun Tespong terhadap bakteri selain E.coli dan B. cereus. Pemilihan antibiotik terhadap bakteri dilakukan sebagai perlakuan awal untuk mengetahui keresistensian bakteri.
DAFTAR PUSTAKA
Amalia F. 2012. Formulasi Ekstrak Kulit Buah Delima dan Duan Dewandaru Sebagai Sediaan Antibakteri Dan Penggunaan Zeolit Untuk Menjaga Stabilitas Formula [tesis]. Bogor: Fakultas Matematika dan Ilmu Pengetahuan Alam Institut Pertanian Bogor.
Amzu, Haryanto. 1990. Pemanfaatan Tumbuhan Obat di Indonesia. Bogor: Seminar Nasional Pelestarian Pemanfaatan Tanaman Obat.
Anand, Mohan M, Zafar S, Sharma A. 2011. Essential Oil Composistion And Antimicrobial Activity of Three Ocimum Spesies From Uttarakhand (India).
Int J Pharm Sci (3): 223-225.
12
Bagem BS, Ma’mun, Edi IG. 2006. Pengaruh Kehalusan Bahan dan Lama Ekstraksi terhadap Mutu Ekstrak Temulawak (Curcuma xanthorriza Roxb). Bul. Litro. Vol. XVII No. 2.53-58.
Budiarti Sri. 2011. Antibiotic Resistance Escherichia coli isolated from Faecal Healthy Human. J.Int. Environmetal Application&Science (6): 359-364. Courvalin P. 1994. Transfer of Antibiotic Resistance Genes Between
Gram-positive and Gram-negative Bacteria. Antimicrob. Agents Chemof 37: 855-869.
Davies JE. 1997. Origins, Acquasition,and Dissemination of Antibiotics Resistance Determinants. Ciba Found. Symp. 207: 15-35.
Harborne JB. 1987. Metode Fitokimia: Penuntun Cara Modern Menganalisis Tumbuhan. Ed ke-2. Kosasih P, Iwang S, penerjemah; Bandung: ITB. Terjemahan dari: Phytochemical Methods.
Hermani& Nurdjanah. 2009. Aspek Pengeringan dalam Mempertahankan Kandungan Metabolit Sekunder pada Tanaman Obat. Perkembangan Teknologi TRO 21(2): 33-39.
Jagtap, Deokule S, Pawar PK, Kuvalekar AA, Halsulkar AM. 2010.Antimicrobial Activity of Some Crude Herbal Drugs Used for Skin Diseases by Pawra
Tribes of Nandurbar District. . Indian Journal of Natural Product and Resources(2): 216-220.
Katzung BG. 1982. Basic and Clinical Pharmacology. California: Lange Medical Publications
Kusumaningrum GS, Suranto, Setyaningsih Ratna. 2003. Aktivitas Penghambatan Minyak Atsiri dan Ekstrak Kasar Biji Pala (Myristica fragrans Houtt dan Myristica fattua Houtt) terhadap Pertumbuhan Bakteri Xanthomonas campestris Oammel asal Tanaman Brokoli (Brassica oleracea var. Italica). Biofarmasi 1: 20-24.
Kusumaningsih A. 2007. Profil Dan Gen Resistensi Antimikrob Salmonella Eteritidis Asal Ayam, Telur, Dan Manusia [disertasi]. Bogor: Institut Pertanian Bogor
Meilisa. 2009. Aktivitas Antibakteri dan Formulasi dalam Sediaan Kapsul dari Ekstrak Etanol Rimpang Tumbuhan Temulawak (Curcumin xanthorriza.Roxb) terhadap beberapa bakteri [skripsi]. Medan: Fakultas Farmasi Universitas Sumatera Utara.
Nogrady N, Gado I, Fekete PZ, Paszti J. 2011. Chloramphenicol resistance genes in Salmonella enterica subsp. Serovar Thphimurium isolated from human and animal sources in Hungary. Vet. Med- Czech 4: 164-170.
Pelczar MJ& ESC Chan.1979. Dasar-dasar Mikrobiologi. Hoediotomo RS dkk, penerjemah; Jakarta: Universitas Indonesia. Terjemahan dari: Elements of microbiology.
Prabhu N, Raj DT, Gowri Y, Siddiqua A, Innocent DP. 2010. Synthesis of Silver Phyto Nanoparticels and Their Antibacterial Efficacy. Digest Journal Of Nanomaterial Biostructure 5: 185-189.
Rostinawati T. 2010. Aktivitas Antimikroba Ekstrak Herba Tespong (Oenanthe javanica D.C) terhadap Escherchia coli, Stapylococcus Aereus, dan Candida albicans. Jatinangor: Fakultas Farmasi Universitas Padjadjaran.
14
Lampiran 1 Bagan alir lingkup kerja penelitian
1.Penentuan Kadar Air 2.Penentuan Kadar Abu Preparasi sampel
Ekstraksi
Uji Fitokimia
15 Lampiran 2 Contoh Perhitungan kadar air daun kemangi
Tabel 6 Hasil uji kadar air daun kemangi
Ulangan Bobot sampel (g) Bobot setelah pengeringan (g)
Kadar Air (%)
1 2,0177 1,6282 19,30
2 2,0148 1,6224 19,48
3 2,0198 1,6241 19,59
Rerata 19,46
Ulangan 1:
Kadar air (%)= e − e e e e
e x 100%
= , − ,
, x 100%
= 19,30%
16
Lampiran 3 Contoh perhitungan kadar abu daun kemangi Tabel 7 Hasil uji kadar abu daun kemangi
Ulangan Bobot sampel (g)
Bobot sampel terkoreksi kadar air (g)
Bobot Abu (g)
Kadar Abu (%)
1 2,0034 1,6167 0,2184 13,51
2 2,0048 1,6143 0,2258 13,99
3 2,0012 1,6092 0,2229 13,85
Rerata 13,78
Ulangan 1: Kadar Abu (%)=
e e e x 100%
= ,
, x 100%
= 13,51%
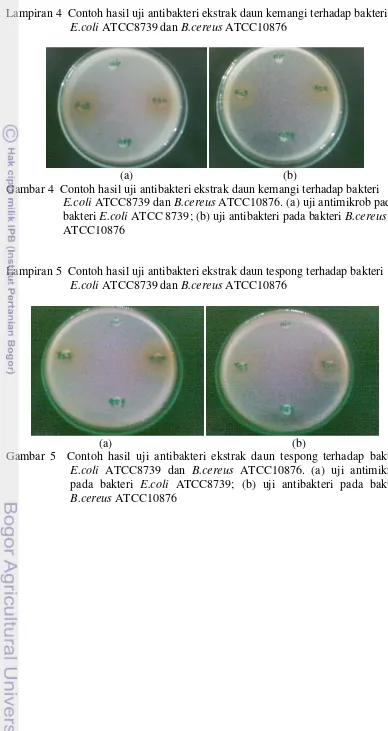
17 Lampiran 4 Contoh hasil uji antibakteri ekstrak daun kemangi terhadap bakteri
E.coli ATCC8739 dan B.cereus ATCC10876
(a) (b)
Gambar 4 Contoh hasil uji antibakteri ekstrak daun kemangi terhadap bakteri
E.coli ATCC8739 dan B.cereus ATCC10876. (a) uji antimikrob pada bakteri E.coli ATCC 8739; (b) uji antibakteri pada bakteri B.cereus
ATCC10876
Lampiran 5 Contoh hasil uji antibakteri ekstrak daun tespong terhadap bakteri
E.coli ATCC8739 dan B.cereus ATCC10876
(a) (b)
Gambar 5 Contoh hasil uji antibakteri ekstrak daun tespong terhadap bakteri
E.coli ATCC8739 dan B.cereus ATCC10876. (a) uji antimikrob pada bakteri E.coli ATCC8739; (b) uji antibakteri pada bakteri
19
RIWAYAT HIDUP
Penulis dilahirkan di Bandung pada tanggal 19 Juni 1989 sebagai putri kedua dari Bapak Sopandi dan Ibu N. Komariah. Penulis lulus dari Sekolah Menengah Atas Negeri 6 Cimahi pada tahun 2007. Penulis dinyatakan lulus seleksi masuk Institut Pertanian Bogor (IPB) melalui jalur Ujian Seleksi Masuk IPB(USMI).