Dengan ini saya menyatakan bahwa tesis berjudul Kandungan Gizi dan Senyawa antioksidan Keong Mata Lembu (Turbo setosus Gmelin 1791) adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, September 2013
Dewi Merdekawati
DEWI MERDEKAWATI. Nutrition Content and Antioxidant Compound of the Rough Turban Snails (Turbo setosus Gmelin 1791). Supervised by TATI NURHAYATI and AGOES M. JACOEB.
One of the commodities produced from the sea that has bioactive compounds is the rough turban snails (Turbo setosus). Empirically, it is believed to have efficacy as a drug to increase stamina and vitality. This organism has an economic potential that requires research to find out the existence of its bioactive compounds. The aims of this study were to determine the physical and chemical characteristics of the rough turban snail, to perform the extraction and purification of antioxidant compounds, and to characterize and identify the antioxidant compounds selected in the rough turban snail. The experiment was conducted with several stages: sample preparation, extraction antioxidant compounds, fractionation by TLC and identification of antioxidant compound by LC-MS. The meat of the rough turban snails were potential as a source of protein, carbohydrate, minerals, and had a low fat content. It had sixteen kinds of amino acids and twenty one kinds of fatty acids, where arginine (1,57 %) was the highest and had an important role to the male reproductive health. Saturated fatty acids is dominated by fatty acids palmitic (C16:0) is 5,76 %. Unsaturated fatty acids are dominated by fatty acids arachidonic (C20:4, n-6) is 3,70 %. Phytochemical of ethyl acetate extract of the rough turban snails meat were flavonoid and triterpenoid. The bioactive compounds in the meat of the rough turban snails with ethyl acetate solvent was kahalalide F and had an IC50 best antioxidant activity in fraction 7 at 2078.43 ppm.
DEWI MERDEKAWATI. Kandungan Gizi dan Senyawa Antioksidan Keong Mata Lembu (Turbo setosus Gmelin 1791). Dibimbing oleh TATI NURHAYATI dan AGOES M. JACOEB.
Salah satu komoditi laut yang mempunyai senyawa bioaktif adalah keong mata lembu (Turbo setosus). Keong mata lembu termasuk klas Gastropoda dari ordo Archaeogastropoda yang banyak ditemukan di Perairan Ujung Genteng Kabupaten Sukabumi, Jawa Barat. Hewan ini secara empiris dipercaya memiliki khasiat untuk meningkatkan stamina dan vitalitas pria. Pemanfaatan keong mata lembu oleh masyarakat setempat umumnya dilakukan dengan cara direbus. Organisme ini mempunyai potensi ekonomis dan perlu diteliti diantaranya tentang keberadaan kandungan senyawa bioaktif yang terdapat di dalamnya.
Tujuan penelitian ini adalah menentukan karakteristik fisik dan kimia, ekstraksi dan purifikasi senyawa antioksidan, serta mengkarakterisasi dan mengidentifikasi senyawa antioksidan terpilih keong mata lembu. Penelitian ini terdiri dari tiga tahap. Tahap pertama adalah preparasi dan analisis komponen kimia meliputi komposisi proksimat, mineral, vitamin, asam amino, taurin, asam lemak, dan kolesterol. Tahap kedua adalah ekstraksi bahan aktif keong mata lembu. Tahap ketiga adalah identifikasi bahan aktif keong mata lembu.
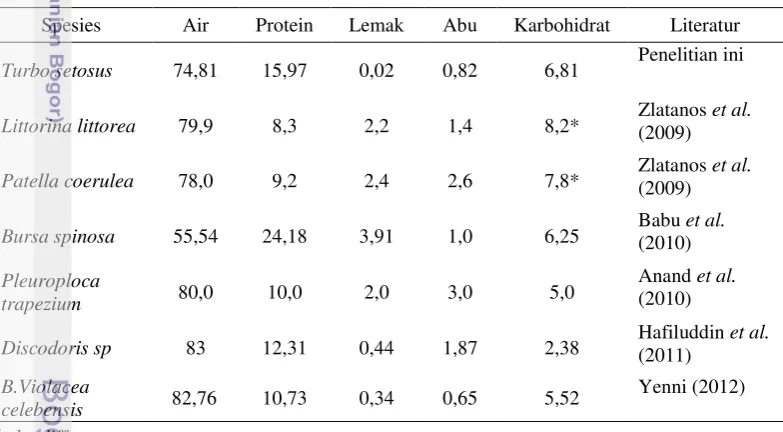
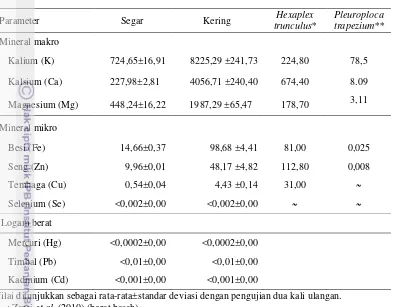
Keong mata lembu segar (Turbo setosus) yang berasal dari Perairan Ujung Genteng memiliki kadar air 74,81 %, protein 15,97 %, lemak 0,02 %, abu 0,82 %, dan karbohidrat 6,81 %. Keong mata lembu kering memiliki kadar air 10,15 %, protein 70,34 %, lemak 2,20 %, abu 6,87 %, dan karbohidrat 10,06 %. Hasil analisis mineral makro dan mikro pada daging segar adalah kalium 724,65 ppm; kalsium 227,98 ppm; magnesium 448,24 ppm; besi 14,66 ppm; seng 9,96 ppm; tembaga 0,54 ppm; dan selenium <0,002 ppm dan daging kering adalah kalium 8.225,29 ppm; kalsium 4.056,71 ppm; magnesium 1.987,29 ppm, besi 98,68 ppm; seng 48,17 ppm; tembaga 4,43 ppm; dan selenium <0,002 ppm. Hasil analisis kandungan beberapa jenis vitamin pada daging segar adalah vitamin A 90,07
mcg/100 g; vitamin B12 2,72 mcg/100 g; vitamin D tidak terdeteksi; vitamin E
2,37 mcg/100 g dan daging kering adalah vitamin A 70,27 mcg/100 g; vitamin B12
0,48 mcg/100 g; vitamin D tidak terdeteksi; vitamin E 9,72 mcg/100 g).
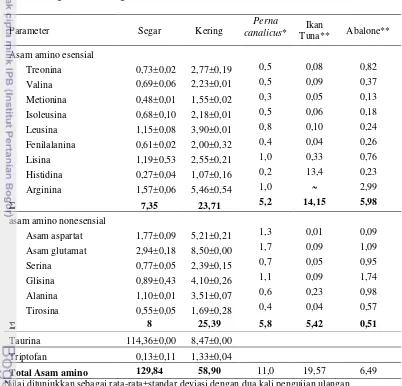
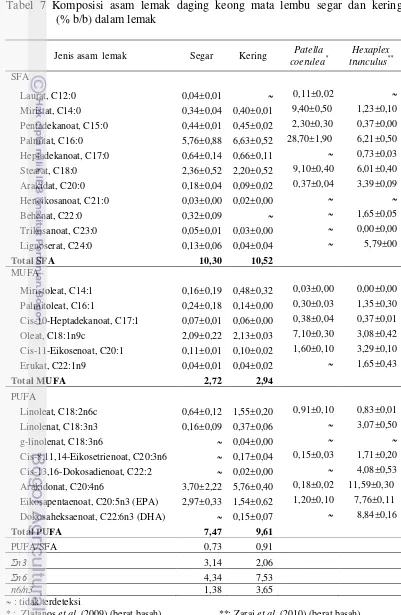
Daging keong mata lembu mengandung 16 jenis asam amino. Asam amino esensial sebesar 7,35 % didominasi oleh arginin sebesar 1,57 %. Asam amino non esensial sebesar 8 % didominasi oleh asam glutamat sebesar 2,94 %. Daging keong mata lembu mengandung 21 jenis asam lemak. Asam lemak jenuh didominasi oleh asam lemak palmitat (C16:0) yaitu 5,76 %. Asam lemak tidak jenuh didominasi oleh asam lemak arakidonat (C20:4n6) yaitu 3,70 %. Kandungan EPA dan DHA keong mata lembu segar (2970 mg/100 g; tidak terdeteksi). Kandungan kolesterol pada daging segar yaitu 96,22 mg/100 g) dan kering (60,33 mg/100 g).
terkandung pada fraksi 7 adalah Kahalalide F.
© Hak Cipta Milik IPB, Tahun 2013
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB.
DEWI MERDEKAWATI
Tesis
Sebagai salah satu syarat untuk mendapatkan gelar master pada Program Studi Teknologi Hasil Perairan
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
NIM : C351100131
Disetujui oleh Komisi Pembimbing
Dr. Tati Nurhayati, S.Pi, M.Si Dr. Ir. Agoes M. Jacoeb Dipl.-Biol. Ketua Anggota
Diketahui oleh
Ketua Program Studi Dekan Sekolah Pasca Sarjana,
Teknologi Hasil Perairan Institut Pertanian Bogor
Dr. Tati Nurhayati, S.Pi, M.Si. Dr. Ir. Dahrul Syah, MScAgr
Puji syukur penulis ucapkan kehadirat Allah SWT yang telah melimpahkan rahmat dan karunia-Nya, sehingga penulis dapat menyelesaikan tesis ini. Tema yang dipilih pada penelitian ini berjudul “Kandungan Gizi dan Senyawa Antioksidan Keong Mata Lembu (Turbo setosus Gmelin 1791)”. Tesis ini merupakan salah satu syarat untuk mendapatkan gelar master di Program Pascasarjana Teknologi Hasil Perairan.
Pada kesempatan ini, penulis mengucapkan terima kasih kepada pihak-pihak yang telah bersedia membantu dan memberi dukungan, khususnya kepada Ibu Dr. Tati Nurhayati, S.Pi, M.Si selaku ketua komisi pembimbing dan Bapak Agoes M. Jacoeb Dipl.-Biol. sebagai anggota komisi pembimbing yang telah memberikan arahan, saran dan motivasi kepada penulis. Penulis mengucapkan terima kasih kepada Ibu Dr. Ir. Nurjanah MS selaku penguji sidang tesis yang telah memberikan banyak masukan demi perbaikan tesis ini. Ungkapan terima kasih juga disampaikan kepada kedua orang tua, kakak, sanak keluarga dan teman-teman yang tidak dapat disebutkan satu per satu, atas doa dan semangat yang diberikan.
Kesempurnaan tesis ini tidak terlepas dari segala kritik dan saran yang membangun dari semua pihak. Semoga tesis ini dapat bermanfaat bagi pihak-pihak yang memerlukan.
Bogor, September 2013
Penulis dilahirkan di Padang, pada tanggal 16 Agustus 1987. Penulis adalah anak kedua dari dua bersaudara dari Bapak Patman Yahya dan Ibu Triyani Sari Nasution. Penulis memulai pendidikan formal di TK Kemala Bhayangkari 1 lulus tahun 1993, Sekolah Dasar di SDN 004 Pekanbaru lulus pada tahun 1999, Sekolah Menengah Pertama di SMP Negeri 8 Pekanbaru lulus tahun 2002 dan Sekolah Menengah Atas di SMA Negeri 4 Pekanbaru lulus pada tahun 2005.
Penulis diterima Universitas Riau melalui jalur PBUD pada tahun 2005 dan memilih Jurusan Teknologi Hasil Perikanan dan tamat pada tahun 2009. Selama di UNRI penulis aktif di organisasi Himpunan Mahasiswa Teknologi Hasil Perikanan (2007-2008). Pada tahun 2010, penulis meneruskan pendidikan pascarsajana di Institut Pertanian Bogor (IPB) dengan Program Studi Teknologi Hasil Perairan. Penulis melakukan penelitian dengan judul “Kandungan Gizi dan Senyawa Antioksidan Keong Mata Lembu (Turbo setosus Gmelin 1791)”.
Sebagian tesis sudah di kirim ke jurnal Teknologi dan Industri Pangan dengan
judul “Kandungan Mineral dan Proksimat Keong Mata Lembu (Turbo setosus
DAFTAR TABEL xii
3.3.1 Pengambilan dan preparasi sampel 14
3.3.2 Ekstraksi bahan aktif 14
3.4.10 Analisis aktivitas antioksidan 36
3.4.11 Analisis toksisitas metode Brine Shrimp Lethality Test 37
1) Identifikasi keong mata lembu 39
2) Morfologi keong mata lembu 39
3) Rendemen daging keong mata lembu 41
4.1.2 Karakteristik kimia 41
1) Kandungan proksimat 41
2) Vitamin 45
3) Mineral dan logam berat 46
4) Asam amino dan taurin 50
5) Asam lemak 53
6) Kolesterol 56
4.2 Hasil Ekstraksi Senyawa Aktif Keong Mata Lembu 57
4.2.1 Rendemen ekstrak keong mata lembu 57
4.2.2 Kandungan fitokimia ekstrak keong mata lembu 58 4.2.3 Aktivitas antioksidan ekstrak kasar keong mata lembu 60 4.2.4 Toksisitas ekstrak kasar keong mata lembu 61
4.3 Pemurnian Ekstra Terpilih 63
4.3.1 Fraksi ekstrak terpilih 63
4.3.2 Aktivitas antioksidan fraksi keong mata lembu 64 4.3.3 Identifikasi senyawa fraksi teraktif 66
5 SIMPULAN DAN SARAN 68
DAFTAR PUSTAKA 69
1 Kondisi dan spesifikasi operasi alat LC-MS 18
2 Kandungan proksimat daging keong mata lembu 41
3 Kandungan gizi dari beberapa jenis moluska bernilai
ekonomis penting 42
4 Kandungan vitamin A, B12, D dan E pada daging keong mata lembu 46
5 Hasil analisis kandungan mineral dan logam berat (ppm) daging
keong mata lembu segar dan kering 48
6 Kandungan asam amino dan taurin (%b/b) daging keong mata lembu
segar dan kering 51
7 Komposisi asam lemak daging keong mata lembu segar dan
kering (%b/b) dalam lemak 54
8 Hasil uji fitokimia ekstrak kasar daging keong mata lembu 59 9 Hasil uji aktivitas antioksidan ekstrak kasar keong mata lembu dengan
jenis pelarut berbeda 60
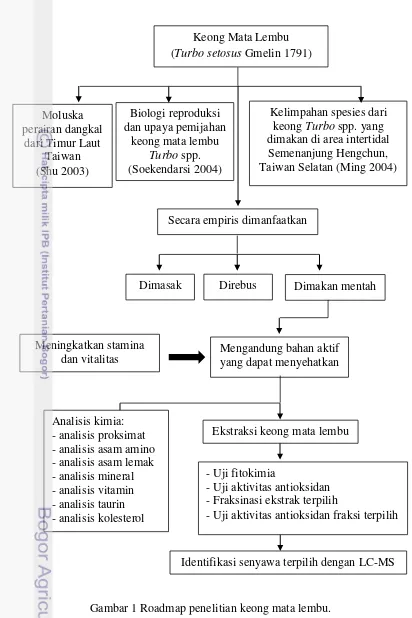
1 Roadmap penelitian keong mata lembu 4
2 Keong mata lembu 5
3 Struktur DPPH dan DPPH tereduksi hasil reaksi dengan antioksidan 10
4 Diagram alir penelitian 13
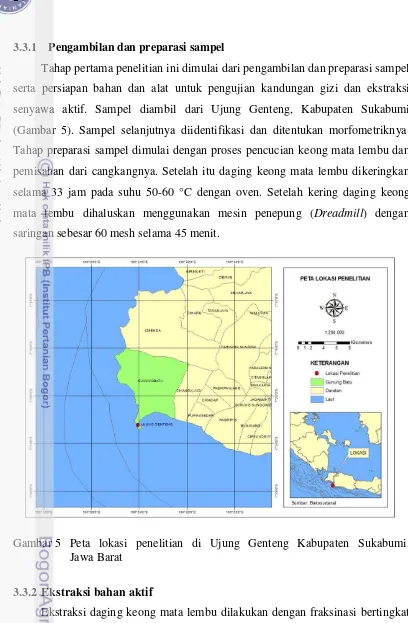
5 Peta lokasi penelitian 14
6 Bagan kerja ekstraksi daging keong mata lembu (T. setosus) 16
7 Pengukuran morfometrik keong mata lembu 39
8 Keong mata lembu: (a) utuh; (b) setelah preparasi; (c) daging segar
(d) setelah dikeringkan 40
9 Pemisahan menggunakan KLT dengan eluen terbaik
(kloroform:etil asetat:asam format 3:7:0,5) 64 10 Aktivitas antioksidan ekstrak dan fraksi-fraksi keong mata lembu 65 11 Dugaan struktur senyawa bioaktif pada fraksi 7 dari ekstrak etil asetat
keong mata lembu 66
1 Nilai rata-rata hasil analisis proksimat daging keong mata lembu 80 2 Kromatogram vitamin A,B12,D dan E daging keong mata lembu 80
3 Kromatogram standar asam amino keong mata lembu 84 4 Kromatogram asam amino daging keong mata lembu segar 86 5 Kromatogram asam amino daging keong mata lembu kering 90 6 Kromatogram standar taurin daging keong mata lembu 92 7 Kromatogram taurin daging keong mata lembu kering 94 8 Kromatogram taurin daging keong mata lembu segar 95
9 Kromatogram standar asam lemak 96
10 Kromatogram asam lemak daging keong mata lembu segar 98 11 Kromatogram asam lemak daging keong mata lembu kering 100 12 Kromatogram standar kolesterol keong mata lembu 102 13 Kromatogram kolesterol daging keong mata lembu kering 104 14 Kromatogram kolesterol daging keong mata lembu segar 105 15 Hasil rendemen ekstrak kasar keong mata lembu dari berbagai pelarut 106
16 Kurva standar spektrum absorbansi 106
17 Perhitungan persen inhibisi dan IC50 pada BHT dan ekstrak kasar
keong mata lembu 107
18 Kurva hubungan antara log konsentrasi dan mortalitas ekstrak kasar
metanol keong mata lembu 109
19 Hasil fraksinasi dengan kromatografi lapis tipis preparatif dari
ekstrak etil asetat keong mata lembu 109
20 Perhitungan persen inhibisi (IC50) hasil fraksinasi keong mata lembu 110
21 Kromatogram hasil LC-MS fraksi 7 dari ekstrak etil asetat
1 PENDAHULUAN
1.1 Latar Belakang
Lingkungan lautan dikenal kaya akan keanekaragaman sumberdaya hayati yang mempunyai potensi yang besar untuk aplikasi bioteknologi, obat-obatan dan pangan (Fahmi et al. 2012). Sekitar 55.000 jenis gastropoda menempati habitat laut yang tersebar dari pantai hingga ke laut dalam. Keong sudah dikonsumsi oleh manusia sebagai makanan selama ribuan tahun dan di banyak negara Eropa terutama Prancis, keong dikonsumsi dalam jumlah besar (Milinsk et al. 2003). Negara-negara Asia yaitu Korea dan Jepang juga menangkap keong untuk dikonsumsi dan dagingnya dianggap lezat (Qun et al. 2004; Xie et al. 2007).
Keong mata lembu (Turbo setosus Gmelin 1791) salah satu anggota ordo Archaeogastropoda yang banyak ditemukan di sepanjang pantai selatan Pulau Jawa. Habitat keong mata lembu adalah pecahan batu karang, dataran karang mati yang ditumbuhi oleh beberapa jenis tumbuhan laut, dan pasir kasar pada dataran terumbu karang yang terbawa oleh hempasan gelombang air laut (Soekendarsi 2004).
Keong mata lembu mempunyai nilai ekonomis bagi masyarakat di sekitar Perairan Ujung Genteng, keberadaannya cukup melimpah, harga relatif murah dan dimanfaatkan sebagai bahan pangan. Keong mata lembu diperdagangkan dalam bentuk segar, rebus, dan sate. Sejenis keong dari genus yang sama yaitu keong batulaga mempunyai nilai ekonomis yang cukup tinggi karena cangkangnya, namun keong batulaga pada masa ini sudah sulit didapat sehingga keong tersebut dalam daftar hewan yang dilindungi (S.K. Menteri Kehutanan No. 12 Tahun 1987).
Keong mata lembu secara empiris dipercaya memiliki khasiat untuk meningkatkan stamina dan vitalitas (aprodisiaka). Menurut Adeyeye dan Afolabi (2003) keong laut merupakan makanan yang bergizi tinggi karena mengandung mineral dan protein tinggi, serta kaya akan asam amino lisin dan rendah kolesterol.
mineral, asam amino, dan asam lemak serta keberadaan kandungan senyawa bioaktif. Pemahaman komposisi kimia sangat penting untuk memberikan informasi mengenai kandungan gizi dan memastikan kualitas keong mata lembu sebagai bahan pangan. Khasiat dan manfaatnya secara empiris yang mampu memberikan efek menyehatkan bila dikonsumsi memberikan dugaan bahwa di dalam daging keong mata lembu terdapat suatu komponen yang bersifat antioksidan.
Antioksidan adalah zat yang dapat menunda, memperlambat dan mencegah terjadinya proses oksidasi (Swasono et al. 2007). Antioksidan berfungsi mengatasi atau menetralisir radikal bebas sehingga diharapkan dengan pemberian antioksidan tersebut proses tua dihambat atau paling tidak “tidak dipercepat” serta dapat mencegah terjadinya kerusakan tubuh dari timbulnya penyakit degeneratif (Kosasih et al. 2006).
Beberapa penelitian tentang gastropoda telah dilakukan, yaitu Kamil (1998) melaporkan bahwa ekstrak keong mas mengandung komponen alkaloid, flavonoid, steroid dan/triterpenoid. Keong mas juga mengandung komponen-komponen lainnya yaitu asam amino bebas dan karbohidrat. Hasil penelitian Prabowo (2009) menunjukkan bahwa uji fitokimia terhadap ekstrak keong matah merah (Cerithidea obtusa) yang mempunyai aktivitas antioksidan menunjukkan bahwa keong matah merah mengandung senyawa bioaktif golongan alkaloid dan flavonoid.
Oleh karena itu diperlukan penelitian yang lebih lengkap untuk menentukan komposisi gizi, komponen kimia, ekstraksi, aktivitas antioksidan, dan identifikasi senyawa bioaktif dari keong mata lembu. Roadmap penelitian ini disajikan pada Gambar 1.
1.2Perumusan Masalah
hasil penyinaran ultraviolet, zat pemicu radikal dalam makanan, dan polutan lain. Penyakit yang disebabkan oleh radikal bebas bersifat kronis, yaitu dibutuhkan waktu bertahun-tahun untuk penyakit tersebut menjadi nyata. Contoh penyakit yang sering dihubungkan dengan radikal bebas adalah jantung koroner, hipertensi, kanker, katarak dan menurunnya fungsi ginjal. Untuk mencegah atau mengurangi penyakit kronis karena radikal bebas diperlukan antioksidan. Kerusakan akibat radikal bebas dan senyawa oksigen reaktif dalam tubuh dapat diatasi dengan konsumsi antioksidan secara optimal. Komposisi kimia dan senyawa bioaktif dari keong mata lembu belum banyak diketahui, sehingga perlu dilakukan penelitian senyawa bioaktif dari keong mata lembu (T. setosus).
1.3 Tujuan Penelitian
Tujuan penelitian adalah
1) Menentukan karakteristik fisik dan kimia keong mata lembu; 2) Ekstraksi dan purifikasi senyawa antioksidan keong mata lembu;
3) Mengkarakterisasi dan mengidentifikasi senyawa antioksidan terpilih keong mata lembu.
1.4Manfaat Penelitian
Manfaat penelitian diharapkan:
1) Memperoleh informasi tentang kandungan gizi dari keong mata lembu. 2) Mendapatkan analisis antioksidan terbaik untuk ekstrak keong mata lembu. 3) Membuka peluang tentang pemanfaatan keong mata lembu sebagai sumber
senyawa bioaktif yang berperan sebagai bahan dasar obat-obatan dan sebagai sumber bahan pangan.
1.5 Hipotesis
Hipotesis pada penelitian adalah:
1) Kandungan nilai gizi mempengaruhi karakteristik fisik dan kimia keong mata lembu sebagai sumber bahan pangan.
2 TINJAUAN PUSTAKA
2.1 Keong Mata Lembu (Turbo setosus Gmelin 1791)
Keong mata lembu (Turbo setosus Gmelin 1791) merupakan salah satu anggota ordo Archaeogastropoda primitif dari subkelas Gastropoda, filum Mollusca. Ciri-ciri umum keong mata lembu menurut Kilburn (2000) adalah sebagai berikut: cangkangnya cukup tebal, mempunyai ukuran kecil sampai sedang, operkulumnya tebal dan mengalami pengapuran yang cukup tebal dan sebagian dari operkulumnya muncul ke permukaan dari mulut cangkang. Bentuk keong mata lembu dapat dilihat pada Gambar 2.
Gambar 2 Keong mata lembu (www.marinespecies.org).
Anatomi umum keong ordo Archaeogastropoda yaitu di kepala terdapat sepasang tentakel, sepasang peduncula ocular, sepasang bintik mata yang terdapat pada bagian kepala dan sebuah mulut yang kecil, pendek dan tidak aktif digerakkan. Pada bagian ujung dan bagian bawah mulutnya terdapat celah, memberikan penampakan adanya dua bibir lateral. Diantara rongga mulutnya terdapat banyak gigi-gigi radula, merupakan salah satu ciri dari semua Gastropoda yang mempunyai kemampuan makan memarut (scraping) seperti pada keong lola (Yonge 1928).
Menurut Soekendarsi (2004) keong mata lembu memiliki satu jenis sistem reproduksi sehingga dapat dibedakan antara sistem reproduksi jantan dan sistem reproduksi betina. Dengan demikian kelamin keong mata lembu (Turbo setosus
air laut adalah 32 ppt hingga 33 ppt. Substrat keong mata lembu adalah pecahan batu karang, dataran karang mati yang ditumbuhi oleh beberapa jenis tumbuhan laut, dan pasir kasar pada daerah dataran terumbu karang yang terbawa oleh hempasan gelombang air laut. Pada substrat habitat keong mata lembu, didapat beberapa jenis hewan air lain yang hidup bersama dengan keong mata lembu yaitu hewan-hewan kelas Nematoda; Oligochaeta; Polichaeta; Diptera; Crustacea; dan Gastropoda lainnya.
2.2 Komponen Bioaktif
Senyawa bioaktif dapat diperoleh dengan cara isolasi, identifikasi, struktur ilusidasi dan mempelajari karakteristik produk kimia yang dihasilkan dari organisme hidup. Metabolit sekunder diproduksi oleh organisme hidup yang didefinisikan sebagai senyawa produk alami yang tidak termasuk dalam pertumbuhan, perkembangan, dan reproduksi yang normal pada organisme dan tidak begitu penting dalam hidup. Senyawa yang dihasilkan dari metabolit sekunder tergolong dalam biokimia yang tidak mengalami perubahan sampai fungsinya diperlukan. Senyawa metabolit sekunder digunakan sebagai alat interaksi antar organisme, dan sering juga digunakan sebagai pertahanan, sistem imun, antifungi, antibakteri, dan sitotoksik alami (Wojnar 2008).
Beberapa senyawa metabolit khususnya struktur dan aktivitas biologisnya telah berhasil diisolasi dari hewan-hewan laut. Senyawa metabolit tersebut mempunyai potensi sebagai obat. Senyawa bioaktif yang menarik diteliti umumnya diisolasi dari spons laut, ubur-ubur, terumbu karang, moluska, echinodermata, dan krustasean. Senyawa bioaktif yang telah diisolasi dari hewan laut yaitu steroid, terpenoid, isoprenoid, nonisoprenoid, quinon, dan nitrogen heterosiklik (Bhakuni dan Rawat 2005).
Beberapa senyawa yang memiliki aktivitas farmakologi sudah berhasil diisolasi dari spons. Didemnin B merupakan senyawa hasil isolasi dari
yang dapat dimanfaatkan sebagai bahan obat (Satari 1999). Isolat dari spons ini
dilaporkan memiliki aktivitas antikanker, antimikroba, dan antiparasit (Amir dan Budiyanto 1996). Hanani et al. (2005) melaporkan uji aktivitas
antioksidan menggunakan metode DPPH menunjukkan bahwa ekstrak
Callyspongia sp. mempunyai IC50 sebesar 41,21 µg/mL. Ekstrak Callyspongia sp.
mempunyai aktivitas antioksidan, dan senyawa yang berkhasiat sebagai antioksidantermasuk golongan alkaloid.
Chandran (2009) melaporkan hasil uji ekstrak insang Perna viridis terhadap
S. aureus dan S. paratyphi. Data tersebut menunjukkan adanya aktivitas antibakteri yaitu memperlihatkan zona hambatan maksimum 19 mm pada uji terhadap S. aureus serta aktivitas minimum 11 mm pada S. paratyphi. Ekstrak insang Perna viridis memiliki aktivitas antijamur dan menunjukkan zona hambat maksimum 13 mm terhadap A. flavus serta memiliki aktivitas minimum terhadap
Mucor sp. dengan zona hambat 11 mm.
Hafiluddin (2011) melaporkan lintah laut mengandung senyawa alkaloid, steroid, saponin, fenol, karbohidrat dan senyawa gula pereduksi. Nilai aktivitas antioksidan tertinggi diperoleh dari ekstrak kasar daging lintah laut dengan rendemen sebesar yaitu 5,08 %, menghasilkan IC50 sebesar 441,12 ppm. Senyawa
yang berperan sebagai antioksidan dalam lintah laut diduga termasuk golongan skualen.
Salamah et al. (2008) melaporkan bahwa dari hasil uji fitokimia terhadap ekstrak kijing taiwan menunjukkan hasil positif pada uji alkaloid dan flavonoid, tetapi negatif pada uji steroid. Hal ini menunjukkan bahwa senyawa antioksidan berupa alkaloid dan flavonoid dari ekstrak kijing taiwan bersifat polar karena terekstrak dari pelarut metanol. Hasil uji efek antioksidan yang paling tinggi diperoleh dari maserasi selama 72 jam dengan nilai IC50 sebesar 166,64 ppm.
Daluningrum (2009) melaporkan bahwa kerang darah memiliki senyawa aktif alkaloid dan steroid yang diekstrak dengan etil asetat. Kerang darah memiliki aktivitas antibakteri terhadap bakteri S. aureus dengan zona hambat sebesar 7 mm dan bakteri E. coli dengan zona hambat 4 mm.
Kamil (1998) melaporkan bahwa ekstrak keong mas mengandung komponen alkaloid, flavonoid, steroid /triterpenoid. Keong mas juga mengandung komponen-komponen lain misalnya asam amino bebas dan karbohidrat. Prabowo (2009) melaporkan bahwa uji ekstrak keong matah merah (Cerithidea obtusa) mempunyai aktivitas antioksidan dan berdasar uji fitokimia menunjukkan bahwa keong matah merah mengandung senyawa bioaktif golongan alkaloid dan flavonoid. Anand et al. (2010) melaporkan bahwa keong kuda (Pleuroploca trapezium) memiliki kandungan protein sekitar 8-10%, karbohidrat sekitar 4-5 %, mineral 2-3 % dan lemak 1-2 %. Keong ini juga kaya akan sumber mineral yaitu sodium sebesar 120 mg dan mengandung asam lemak omega 3 yaitu asam
eicosapentaenoic acid (EPA). Keong ini juga memiliki aktivitas antioksidan ekstrak metanol yang baik dengan nilai IC50 sebesar 4.021 μg/mL.
2.3 Radikal Bebas
berubah menjadi radikal bebas. Misalnya hidrogen peroksida (H2O2), ozon, dan
lain-lain. Kedua kelompok senyawa tersebut sering diistilahkan sebagai senyawa oksigen reaktif (SOR) atau reactive oxygen species (ROS) (Winarsi 2007).
Radikal bebas (free radical) adalah suatu senyawa atau molekul yang mengandung satu atau lebih elektron tidak berpasangan pada orbital luarnya. Adanya elektron yang tidak berpasangan menyebabkan senyawa tersebut sangat reaktif mencari pasangan dengan cara menyerang dan mengikat elektron molekul yang berada disekitarnya (Soeatmaji 1998).
Serangan radikal bebas terhadap molekul sekelilingnya akan menyebabkan terjadinya reaksi berantai yang kemudian menghasilkan senyawa radikal baru (Sadikin 2001). Dampak reaktivitas senyawa radikal bebas bermacam-macam, mulai dari kerusakan sel atau jaringan, penyakit autoimun, penyakit degeneratif, hingga kanker. Tingginya kadar radikal bebas dalam tubuh dapat ditunjukkan oleh rendahnya aktivitas enzim antioksidan dan tingginya kadar malondialdehid (MDA) dalam plasma (Zakaria et al. 2000; Winarsi et al. 2003).
2.4 Antioksidan
Antioksidan merupakan senyawa pemberi elektron (electron donor) atau reduktan. Senyawa ini memiliki berat molekul kecil, tetapi mampu menginaktivasi berkembangnya reaksi oksidasi, dengan cara mencegah terbentuknya radikal. Antioksidan juga merupakan senyawa yang dapat menghambat reaksi oksidasi dengan mengikat radikal bebas dan molekul yang sangat reaktif. Akibatnya kerusakan sel akan dihambat (Winarsi 2007). Menurut Anand et al. (2010) antioksidan merupakan zat kimia yang dapat mengikat radikal bebas dan terlibat dalam pencegahan penyakit jantung, kanker dan lain-lain.
asam urat, protein pengikat logam, dan protein pengikat heme. Senyawa-senyawa ini berfungsi menangkap senyawa oksidan serta mencegah terjadinya reaksi berantai (Winarsi 2007).
Stres oksidatif dapat dihambat oleh kerja enzim-enzim antioksidan dalam tubuh dan antioksidan non-enzimatik. Menurut Belleville-Nabet (1996) secara fisiologis terdapat dua sistem pertahanan tubuh:
(a) Sistem pertahanan preventif dilakukan oleh kelompok antioksidan sekunder. Pembentukan senyawa oksigen reaktif dihambat dengan cara pengkelatan metal, atau jika sudah terbentuk senyawa itu dirusak.
(b) Sistem pertahanan melalui pemutusan reaksi radikal berantai dilakukan oleh kelompok antioksidan primer.
Menurut Mega (2010) pengujian anti radikal bebas senyawa-senyawa bahan alam/sintesis dapat dilakukan secara reaksi kimia menggunakan DPPH (difenil pikril hidrazil) sebagai senyawa radikal bebas yang stabil dengan melihat proses peredaman panjang gelombang maksimumnya pada spektrofotometer UV-Vis. Peredaman warna ungu merah (absorbansi pada 517±20 nm) dikaitkan dengan kemampuan sebagai anti radikal bebas (free radical scavanger). Struktur DPPH dan DPPH tereduksi hasil reaksi dengan antioksidan dapat dilihat pada Gambar 3.
Pengukuran kapasitas antioksidan dengan metode DPPH menggunakan spektrofotometer dengan panjang gelombang 517 nm. Larutan DPPH berwarna ungu gelap, ketika ditambah senyawa antioksidan maka warna larutan akan berubah menjadi kuning cerah. Penurunan absorbansi akan menunjukkan adanya aktivitas scavenging dengan berkurangnya warna ungu. Parameter untuk menginterpretasikan hasil pengujian dengan metode DPPH adalah IC50 (inhibition
concentration). Nilai IC50 merupakan konsentrasi larutan substrat atau sampel
yang akan menyebabkan reduksi terhadap aktivitas DPPH sebesar 50 % (Molyneux 2004).
Gambar 3 Struktur DPPH dan DPPH tereduksi hasil reaksi dengan antioksidan.
2.5 Ekstraksi
Ekstraksi adalah pemisahan satu atau beberapa bahan suatu padatan atau cairan. Proses ekstraksi mula-mula menimbulkan penggumpalan ekstrak dalam pelarut kemudian terjadi kontak antar muka bahan dan pelarut sehingga pada bidang muka terjadi pengendapan massa dengan cara difusi. Bahan ekstraksi yang telah bercampur dengan pelarut menembus kapiler dalam suatu bahan padat dan melarutkan ekstrak larutan dengan konsentrasi lebih tinggi yang terbentuk di bagian dalam bahan ekstraksi. Difusi akan menimbulkan keseimbangan konsentrasi larutan dengan larutan di luar bahan (Bernasconi et al. 1995).
Berdasarkan wujud bahannya, ekstraksi dapat dibedakan menjadi dua cara yaitu (1) ekstraksi padat cair, digunakan untuk melarutkan zat yang dapat larut dari campurannya dengan zat padat yang tidak dapat larut; (2) ekstraksi cair-cair, digunakan untuk memisahkan dua zat cair yang saling bercampur, dengan menggunakan pelarut dapat melarutkan salah satu zat (McCabe et al. 1999).
Pemilihan metode ekstraksi bergantung pada sumber bahan alam dan senyawa yang ingin diisolasi. Beberapa tujuan dari ekstraksi adalah untuk mengetahui senyawa bioaktif, mengetahui keberadaan senyawa dalam organisme, hubungan struktur senyawa dalam organisme, identifikasi seluruh senyawa bioaktif yang ada pada organisme (Sarker et al. 2006).
3 METODE
3.1 Waktu dan Tempat
Penelitian ini dilaksanakan pada bulan November 2011 - November 2012. Sampel diambil dari Perairan Ujung Genteng, Kabupaten Sukabumi, Provinsi Jawa Barat. Identifikasi keong mata lembu dilakukan di Lembaga Ilmu Pengetahuan Indonesia (LIPI) Cibinong; preparasi, ekstraksi dan uji antioksidan di Laboratorium Bahan Baku Hasil Perairan, Departemen Teknologi Hasil Perairan (THP); uji fitokimia dan BSLT di Laboratorium Kimia Analitik Institut Pertanian Bogor (IPB). Analisis asam amino, taurin, kolesterol, dan vitamin dilakukan di Laboratorium Saraswanti Indo Genetech; analisis proksimat, mineral, asam lemak, EPA, DHA, dan triptofan di Laboratorium Terpadu Institut Pertanian Bogor; KLT Preparatif di Laboratorium Biofarmaka Institut Pertanian Bogor (IPB) serta identifikasi senyawa antioksidan dilakukan di Balai Pengkajian Bioteknologi (Biotech Center-BPPT) Serpong.
3.2 Alat dan Bahan
Alat yang digunakan pada penelitian ini adalah mesin penepung (Dreadmill), TLC alumunium sheets silica gel 60 Fe254, rotary evaporator merek Heidolph
WB2000, spektrofotometer UV-VIS merek Hitachi U-2800, AAS model varian AA-30, HPLC merek Waters Coorporation USA, Camag Linomat 5 dan GC merekShimadzu 2010 plus.
Bahan yang digunakan pada penelitian ini berupa keong mata lembu (Turbo
setosus). Bahan-bahan kimia yang digunakan untuk analisis kimia yaitu: n-heksana (p.a), etil asetat (p.a) dan metanol (p.a), kloroform (p.a), asam format
glacial, dan DPPH (1,1-difenil-2-pikrilhidrazil).
3.3Prosedur Penelitian
Pelepasan cangkang
Analisis proksimat, mineral (K, Ca, Mg, Fe, Zn, dan Se), asam amino,taurin, asam lemak, kolesterol, dan vitamin
Pemisahan cangkang, jeroan dan daging
Ekstraksi bertingkat (Gambar 6)
Analisis rendemen, fitokimia, uji antioksidan,
dan toksisitas
Identifikasi LC-MS
Fraksinasi: KLT
KLT preparatif
Gambar 4 Diagram alir penelitian. Keong Mata Lembu
Daging
Kering Segar
Ekstrak kasar
Antioksidan terbaik Antioksidan
fraksi terbaik
3.3.1 Pengambilan dan preparasi sampel
Tahap pertama penelitian ini dimulai dari pengambilan dan preparasi sampel serta persiapan bahan dan alat untuk pengujian kandungan gizi dan ekstraksi senyawa aktif. Sampel diambil dari Ujung Genteng, Kabupaten Sukabumi (Gambar 5). Sampel selanjutnya diidentifikasi dan ditentukan morfometriknya. Tahap preparasi sampel dimulai dengan proses pencucian keong mata lembu dan pemisahan dari cangkangnya. Setelah itu daging keong mata lembu dikeringkan selama 33 jam pada suhu 50-60 °C dengan oven. Setelah kering daging keong mata lembu dihaluskan menggunakan mesin penepung (Dreadmill) dengan saringan sebesar 60 mesh selama 45 menit.
Gambar 5 Peta lokasi penelitian di Ujung Genteng Kabupaten Sukabumi, Jawa Barat
3.3.2 Ekstraksi bahan aktif
satu pelarut yang digunakan. Bubuk keong mata lembu yang dihasilkan ditimbang sebanyak 50 gram, kemudian dimasukkan ke dalam labu takar dan ditambah dengan 150 mL n-heksana p.a. Campuran dikocok dengan bantuan shaker selama 24 jam kemudian disaring. Fraksinasi menggunakan pelarut n-heksana p.a dilakukan sampai larutan berwarna jernih. Hasil penyaringan ditampung dalam labu dan dievaporasi sampai pekat. Fraksi ini merupakan fraksi dengan tingkat kepolaran rendah.
Residu dari fraksinasi heksana p.a kemudian dilarutkan dengan pelarut etil asetat p.a. Residu hasil fraksinasi dengan heksana p.a ditambah dengan 150 mL pelarut etil asetat p.a. Selanjutnya campuran dikocok dengan shaker selama 24 jam dan kemudian disaring. Fraksinasi dengan pelarut etil asetat p.a dilakukan hingga larutan menjadi jernih. Hasil penyaringan ditampung dalam labu dan dievaporasi sampai pekat. Fraksi ini merupakan fraksi dengan tingkat kepolaran sedang.
Fraksinasi terakhir menggunakan pelarut metanol p.a. Residu hasil fraksinasi dengan etil asetat p.a ditambah dengan pelarut metanol p.a sebanyak 150 mL. Campuran dikocok dengan shaker selama 24 jam, kemudian disaring. Fraksinasi dengan pelarut methanol p.a dilakukan hingga larutan menjadi jernih. Prosedur lengkap dari proses ekstraksi dapat dilihat pada Gambar 6.
Filtrat yang terkumpul dipisahkan antara pelarut dan ekstraknya menggunakan
vacum rotary evaporator pada suhu 40-50 oC hingga diperolah ekstrak kasar berbentuk pasta. Ekstrak kasar tersebut diuji aktivitas antioksidannya sehingga diperoleh informasi mengenai jenis pelarut yang dapat memperoleh senyawa bioaktif dari daging keong mata lembu. Ekstrak kasar keong mata lembu yang memiliki aktivitas antioksidan terbaik dianalisis secara fitokimia untuk mengetahui golongan senyawa bioaktif pada ekstrak tesebut serta uji Brine Shrimp Lethality Bioassay
(BSLT) untuk mengetahui toksisitasnya. Serbuk daging keong mata lembu ditimbang untuk mengetahui rendemen yang didapatkan dengan rumus:
endemen (b/v) berat ekstrak kering
Gambar 6 Bagan kerja ekstraksi daging keong mata lembu (Quinn 1988 diacu dalam Darusman et al. 1995).
3.3.3 Fraksinasi lanjutan
Fraksi yang memiliki aktivitas antioksidan terbaik kemudian dipisahkan dengan kromatografi lapis tipis. Fase diam yang digunakan adalah silika gel 60 F254. Eluen yang digunakan yaitu berdasarkan tingkat kepolarannya dari polaritas
n-heksana, kloroform, dikhlorometan, etil asetat, etanol dan metanol. Pencarian eluen terbaik dimulai dengan menggunakan eluen tunggal sampai dengan eluen campuran atau perbandingan. Sebanyak 10 mL eluen dimasukkan ke dalam
chamber dan ditutup, kemudian dibiarkan beberapa menit sampai larutan menjadi jenuh. Ekstrak kasar yang terpilih sebanyak 0,02 g dilarutkan dalam 0,5 mL pelarutnya, kemudian ditotolkan pada garis bagian bawah yang ditandai pada plat kromatografi lapis tipis sepanjang 10 cm menggunakan pipa kapiler dan dikeringkan beberapa menit plat dimasukkan ke dalam chamber dengan posisi agak tegak, sampel yang ditotolkan berada pada bagian bawah dan diusahakan tidak terendam oleh eluen. Chamber ditutup dan ditunggu sampai sampel terbawa eluen pada batas atas. Plat kromatografi lapis tipis dikeluarkan dan dikeringkan. Selanjutnya plat dilihat hasilnya dengan menggunakan sinar UV 254 nm dan 366 nm.
Setelah ditemukan eluen terbaik, dilanjutkan dengan kromatografi preparatif. Prosedur yang dilakukan hampir sama dengan KLT namun dengan ukuran yang lebih besar. Pembuatan preparat dengan menggunakan silika gel 60 F254 yang dipasang pada lempeng kaca dengan ukuran 20x20 cm. Eluen terbaik
yang diperoleh disiapkan sebanyak 20 mL dan dimasukkan ke dalam chamber. Larutan sampel ditotolkan pada plat KLT dan dimasukkan ke dalam chamber, setelah dilihat hasilnya dengan sinar UV 254 nm, kemudian setiap fraksi atau masing-masing Rf (Retardation factor) yang dihasilkan dikerok dan dikumpulkan. Hasil pengerokan dilarutkan dengan pelarut yang sama dengan sampel terpilih. Hasil dari masing-masing fraksi diuji aktivitas antioksidannya untuk memilih fraksi terbaik.
3.3.4 Identifikasi senyawa aktif
Tabel 1 Kondisi dan spesifikasi operasi alat LC-MS Kondisi LC Spesifikasi dan program pengaturan
Alat UPLC- qToF-MS/MS System (Waters)
HPLC UPLC Acquity SDS (Waters)
Column Acquity UPLC BEH C18 1.7um, 2.1x50 mm
Flow rate 0.3 mL/min
Injection 5 uL
Suhu 40 °C
Eluent (fase gerak)
A: H2O+0.1 % formic acid, B: Acetonitrile + 0.1 % formic acid
Cara kerja LC adalah sama dengan HPLC, mula-mula eluen diambil melalui pompa. Eluen ini kemudian dimasukkan ke dalam katup injeksi berputar. Sampel dimasukkan ke dalam katup injeksi dengan bantuan mikrosiring yang kemudian bersama-sama dengan eluen masuk ke dalam kolom. Hasil pemisahan dideteksi oleh detektor kemudian direkam. Tekanan eluen diatur dengan pengatur dan pengukur tekanan. Pompa pemasuk eluen pada tekanan konstan hingga tekanan kurang lebih 4500 psi dengan laju alir rendah. Analit bersama dengan eluen dari
terganggu oleh pengaruh gas oksigen. Droplet yang masuk ke dalam cappilary transfer akan dianalisis melalui mass spectrofotometer.
3.4 Analisis
Analisis yang dilakukan pada tahap ini meliputi analisis rendemen, analisis proksimat (kadar air, kadar abu, kadar protein, kadar lemak dan karbohidrat), vitamin (A, B12, D, dan E), analisis asam amino, taurin, asam lemak, dan
kolesterol (AOAC 2005), analisis mineral (SNI 01-2891-1992), fitokimia (Harborne 1987), analisis antioksidan (Molyneux 2004), dan toksisitas (Carballo 2002).
3.4.1 Analisis rendemen daging keong mata lembu (Hustiany 2005)
Rendemen adalah persentase bagian tubuh yang dapat dimanfaatkan. Daging keong mata lembu utuh ditimbang beratnya baik sebelum maupun sesudah diambil cangkang dan jeroannya kemudian dikeringkan menggunakan oven. Daging keong mata lembu yang telah kering ditimbang kembali untuk mengetahui penurunan berat setelah dikeringkan. Rendemen merupakan persentase perbandingan antara bagian yang digunakan dengan berat utuh daging keong mata lembu segar.
endemen berat bagian yang digunakan (gram)
berat keong mata lembu (gram)
3.4.2 Analisis proksimat (AOAC 2005)
Daging keong mata lembu segar dan kering diuji komposisi kimianya yang terdiri atas kadar air, abu, protein, lemak, karbohidrat dan serat kasar.
1) Analisis kadar air (AOAC 950.46)
dicapai bobot yang konstan. Kadar air dihitung dengan rumus:
Kadar ir ( )
2) Analisis kadar abu (AOAC 920.153)
Analisis kadar abu dilakukan menggunakan metode oven. Prinsipnya adalah pembakaran atau pengabuan bahan-bahan organik yang diuraikan menjadi air (H2O) dan karbondioksida (CO2) tetapi zat anorganik tidak terbakar. Zat
anorganik ini disebut abu.
Prosedur analisis kadar abu sebagai berikut: cawan yang akan digunakan dipanaskan di dalam tanur selama 1 jam pada suhu 100 oC, kemudian didinginkan dalam desikator untuk menghilangkan uap air dan ditimbang (A). Contoh ditimbang sebanyak 0,1 g dalam cawan yang sudah dikeringkan dan dibakar sampai timbul asap. Cawan beserta isinya dipanaskan di dalam tanur pada suhu 550 oC selama 2 jam, kemudian didinginkan di dalam desikator dan ditimbang bobot cawan dan sampel (B). Cawan dan sampel dipanaskan lagi selama 2 jam pada suhu 550 oC lalu didinginkan di dalam desikator dan bobot cawan dan sampel ditimbang. Tahap pemanasan dan penimbangan diulangi sampai didapat bobot yang konstan. Kadar abu dihitung dengan rumus:
Kadar bu ( )
3) Analisis kadar lemak (AOAC 960.39)
yang turun ke labu lemak berwarna jernih. Pelarut lemak yang telah digunakan, disuling dan ditampung setelah itu ekstrak lemak yang ada dalam labu lemak dikeringkan dalam oven bersuhu 100-105 °C selama 1 jam, lalu labu lemak didinginkan dalam desikator dan ditimbang (C). Tahap pengeringan labu lemak diulangi sampai diperoleh bobot yang konstan. Kadar lemak dihitung dengan rumus:
Kadar lemak ( )
4) Analisis kadar protein (AOAC 954.01)
Analisis kadar protein dilakukan dengan metode kjeldahl. Prinsipnya adalah senyawa nitrogen dalam protein diubah menjadi amonium sulfat oleh H2SO4
pekat. Amonium sulfat yang terbentuk diuraikan dengan larutan NaOH pekat (sekitar 30 % b/v). Amoniak yang dibebaskan diikkat dengan asam borat berlebih, kemudian dititrasi dengan larutan HCl.
Prosedur analisis kadar protein sebagai berikut: contoh ditimbang sebanyak 0,51 g cuplikan, dimasukkan ke dalam labu Kjeldahl 100 mL, ditambahkan dengan 2 g campuran selenium dan 25 mL H2SO4 pekat, kemudian dipanaskan di
atas pemanas listrik atau pembakar bunsen sampai mendidih lalu larutan menjadi jernih kehijau-hijauan (sekitar 2 jam). Larutan dibiarkan dingin, kemudian diencerkan dan dimasukkan ke dalam labu ukur 100 mL, ditepatkan sampai tanda tera. Sebanyak 5 mL larutan dimasukkan ke dalam alat penyuling, lalu ditambahkan 5 mL NaOH 30 % dan segera tutup labu destilasinya, selanjutnya disuling selama lebih kurang 10 menit, sebagai penampung digunakan 10 mL larutan asam borat 2 %. Ujung pipa dibilas dengan air suling, lalu dititrasi dengan larutan HCl 0,01 N dan dilakukan penetapan blanko. Kadar protein dihitung dengan rumus:
Keterangan :
Wcontoh = bobot cuplikan (g)
V1 = volume HCl 0,01 N yang digunakan pada penitrasan contoh (mL)
V1 = volume HCl 0,01 N yang digunakan pada penitrasan blanko
NHCl = normalitas HCl
fk = faktor konversi untuk protein (6,25 untuk produk perikanan) fb = faktor pengenceran
5) Analisis kadar karbohidrat
Karbohidrat dalam sampel dihidrolisis dengan HCl menjadi gula monomernya. Gula monomer bereaksi dengan fenol membentuk kompleks fenol-gula monomer yang berwarna merah dan diukur dengan spektrofotometer sinar tampak pada panjang gelombang 490 nm. Analisis sampel dilakukan dengan cara menimbang 0,05-0,1 g cuplikan ke dalam tabung reaksi, ditambahkan 10 mL H2SO4 pekat lalu didiamkan. Larutan ditera ke labu 100 mL kemudian disaring.
Larutan sampel dipipet 1 mL, kemudian ditambahkan 1 mL air akuades, 1 mL larutan fenol 5 %, lalu divortex. Selanjutnya 5 mL asam sulfat pekat ditambahkan kedalamnya dengan cepat (dispenser) dan didiamkan selama 10 menit, kemudian diukur absorbansinya pada panjang gelombang 490 nm.
karbohidrat konsentrasi (ppm) Pmg sampel
3.4.3 Analisis Vitamin (AOAC 2005)
Kandungan vitamin yang dianalisis pada daging keong mata lembu segar dan kering meliputi vitamin A, B12, D dan E.
1) Vitamin A, D, dan E (AOAC 985.27)
Sebanyak 2 g contoh dimasukkan ke dalam tabung sentrifuse 50 mL, kemudian ditambah 5 mL larutan ethanol-ascorbic acid 0,1 % dan 2 mL KOH 50 %. Selanjutnya dipanaskan pada suhu 70 oC selama 30 menit, dan divortex tiap 10 menit setelah itu didinginkan dengan air mengalir. Setelah larutan dingin, ditambah dengan 7 mL dd H2O, 5 mL n-heksana lalu dikocok selama 5 menitdan
sentrifuse dan dikocok selama 5 menit. Lapisan n-heksana dipisahkan lagi dan digabungkan ke gelas kimia. Larutan yang telah terpisahkan, kemudian diuapkan sampai kering dalam lemari asam gelap. Setelah kering, dilarutkan dengan metanol HPLC grade dan dipindahkan ke labu ukur 50 mL, dihimpitkan dengan metanol HPLC grade sampai tanda tera, disaring dengan penyaring 0 45 μm lalu dimasukkan ke vial autosampler dan siap untuk diinjeksi ke HPLC.
Penyiapan larutan fase gerak dilakukan dengan menyiapkan metanol gradien grade, larutan disaring dengan penyaring 0,45 µm lalu dilakukan ultrasonik selama 15 menit dan siap dipakai untuk HPLC.
Perhitungan kadar vitamin A, D, dan E:
Keterangan:
Csp = konsentrasi contoh, dinyatakan dalam µg/g (ppm) Asp = area contoh
Ast = area standar
Cst = konsentrasi standar, dinyatakan dalam µg/mL (ppm) Vsp = volume pelarutan sampel, dinyatakan dalam mL Wsp = bobot contoh, dinyatakan dalam g
Kondisi alat HPLC saat berlangsungnya analisis vitamin A, D, dan E: Merek : waters coorporation, USA
Kolom : Oktadesilsilana (RP-18) Fase gerak : Metanol:dapar fosfat (4:96) Laju alir : 0,7 mL/menit
Panjang gelombang : vitamin A 325 nm, vitamin D 264 nm, dan vitamin E 292 nm
Nama standar : vitamin A Retinyl palmitate produksi Supelco; vitamin D
Ergocalcipherol produksi Sigma; vitamin E = Tocopherol
2) Vitamin B12 (AOAC 2011.10)
Sebanyak 1 g contoh dimasukkan ke dalam tabung ulir 25 mL (A), ditambah 5 mL H2SO4 0,1 M lalu dikocok. Selanjutnya campuran dipanaskan dalam
penangas air pada suhu 100 oC selama 30 menit, divortex setiap 10 menit dan didinginkan. Larutan yang telah dingin, dimasukkan dalam labu ukur 10 mL (B). Pada tabung A ditambah 1,4 mL CH3COONa 2 M, lalu divortex dan dimasukkan
ke dalam labu B kemudian ditambah 2 mL papain 0,1 % (untuk contoh berprotein tinggi) lalu divortex. Campuran dimasukkan ke dalam labu B ditambahkan dengan akuades hingga tanda tera kemudian disaring dengan Whatman No 42 dan membran 0,45 µm, setelah itu disuntikkan ke HPLC.
Perhitungan vitamin B12:
Keterangan:
Csp = konsentrasi contoh, dinyatakan dalam mg/kg Asp = luas area contoh
Ast = luas area standar
Cst = konsentrasi larutan standar dalam mg/L
Vsp = volume pelarutan sampel, dinyatakan dalam mL Wsp = bobot contoh, dinyatakan dalam g
Fp = faktor pengenceran
Kondisi alat HPLC saat berlangsungnya analisis vitamin B12:
Merek : waters coorporation, USA Kolom : oktadesilsilana (C18) Laju alir : 0,7 mL/menit
Fase gerak : air : acetonitril : TFA 0,025% (gradient) Panjang gelombang : 361 nm
3.4.4 Analisis mineral dan logam berat (SNI 01-2891-1992)
Mineral yang dianalisis pada sampel keong mata lembu (Turbo setosus) meliputi: kalsium, kalium, magnesium, besi, selenium, seng, kadmium, merkuri dan timbal yang dianalisis dengan metode spektrofotometer serapan atom.
1) Analisis mineral kalsium, magnesium, kalium, dan seng
Prosedur analisis kadar mineral kalsium adalah sebagai berikut: sampel yang telah kering ditimbang sebanyak 1-2 g, kemudian dihancurkan dan dimasukkan ke dalam gelas beaker 100 mL yang telah dibilas dengan HCl 1 N. Sampel ditambahkan dengan 25 mL HCl 1 N dan disimpan selama 24 jam.
Setelah penyimpanan, sampel dikocok dengan shaker dan disaring dengan kertas whatman no 1. Ekstrak sampel dipipet sebanyak 1 mL, ditambahkan 2 mL larutan lantanium oksida dan ditambahkan HCl 1 N sampai volume menjadi 10 mL, kemudian ditera dengan penambahan akuades sampai volume menjadi 50 mL. Larutan diukur absorbansinya dengan AAS masing-masing pada panjang gelombang 422,7 nm untuk kalsium; 285,2 untuk magnesium; 766,5 nm untuk kalium dan 213,9 nm untuk seng.
2) Analisis mineral besi
Prosedur analisis mineral besi adalah sebagai berikut: sampel yang telah kering ditimbang sebanyak 1-2 g, kemudian dihancurkan. Larutan asam campuran disiapkan yang dibuat dari HNO3, H2SO4, dan HClO4 dengan perbandingan 5:1:2.
Sampel yang telah hancur ditambah 10 mL larutan asam campuran, kemudian dipanaskan di dalam ruang asam menggunakan api kecil selama 2 jam. Kemudian api dibesarkan sampai larutan menjadi jernih dan didinginkan. Larutan ditambahkan akuades sampai volume 50 mL dan disaring dengan kertas saring pencucian asam whatman no 1.
3) Analisis mineral tembaga
Prosedur analisisnya sebagai berikut: sampel ditimbang sebanyak 25 g dalam gelas piala 250 mL yang terlebih dahulu dicuci dengan HNO3 6 N. Sampel
dikeringkan di dalam oven pada suhu 110-125 oC selama 8-24 jam. Selanjutnya sampel dipindahkan ke dalam tungku pada suhu 350 oC selama 1-2 jam untuk mencegah terjadinya proses pembakaran cepat yang menyebabkan sampel dapat terhambur ke luar. Suhu dinaikkan hingga 450 oC selama 12-24 jam. Apabila sampel abu belum putih sempurna, maka ditambah 0,25-1 mL HNO3 pekat,
kemudian diuapkan di atas hot plate. Sampel dipanaskan kembali pada suhu 450 oC di dalam tungku selama 30-60 menit sampai abu benar-benar putih.
Abu dilarutkan dalam 2 mL HNO3 pekat, kemudian diencerkan dengan
akuades hingga 25 mL dan dididihkan di atas hot plate. Larutan disaring dengan kertas saring No. 42 yang terlebih dahulu dicuci dengan HNO3 10 % dan akuades,
filtratnya ditampung dan diencerkan dengan akuades hingga 50 mL. Absorbansinya diukur dengan AAS pada panjang gelombang 324,7 nm.
4) Analisis logam berat
Prosedur analisisnya sebagai berikut: sampel yang telah dihomogenkan ditimbang sebanyak 5 g dan dimasukkan ke dalam labu. Leher labu dibilas dengan 5 mL akuades sebanyak 20 buah batu didih, 10-20 mg V2O5, dan 20 mL H2SO4
dengan HNO3 dengan perbandingan 1:1. Labu dihubungkan dengan kondensor
dan digoyang-goyang hingga tercampur. Air dingin dialirkan melalui kondensor selama pencampuran dilakukan, kemudian dipanaskan dengan api kecil sampai mendidih (sekitar 6 menit) dan diakhiri dengan pemanasan kuat (api besar) selama 10 menit. Selama reaksi berlangsung, labu terus digoyang-goyang. Alat pemanas dimatikan dan kondensor dicuci dengan 15 mL akuades. Dua tetes ditambah H2O2
Larutan blanko dan kurva standar disiapkan lalu ditambahkan 100 mL larutan pengencer ke dalam masing-masing labu. Larutan pengencer dibuat dengan cara sebanyak 50 mL HNO3 dan 67 mL H2SO4 dipipet ke dalam labu ukur
1000 mL yang berisi 300-500 mL akuades kemudian ditera sampai volume 1000 mL. Output pompa diatur sampai mencapai kira-kira 2 L udara/menit dengan mengatur kecepatan pompa lalu ditambahkan 20 mL larutan pereduksi ke dalam masing-masing labu. Larutan pereduksi dibuat dengan cara 50 mL H2SO4
dipipet dan ditambah 300 mL akuades kemudian didinginkan pada suhu kamar. Sebanyak 15 g NaCl, 25 g SnCl2, dan 15 g hidroksil aminasulfat ditimbang,
kemudian semua bahan dilarutkan dalam larutan H2SO4 sampai volume 500 mL.
Gas inlet adapter dihubungkan dan dilakukan aerasi selama 1 menit. Absorpsi larutan blanko dan larutan standar dicatat lalu diplotkan dalam kurva.
Larutan sampel dipipet 25 mL dari labu, kemudian ditambahkan dengan 75 mL larutan pengencer. Output pompa diatur sampai mencapai kira-kira 2 liter udara/menit dengan mengatur kecepatan pompa lalu ditambahkan 20 mL larutan pereduksi yang telah dibuat ke dalam larutan yang akan diperiksa. Gas inlet adapter dihubungkan dan dilakukan aerasi selama 1 menit. Absorpsi larutan sampel dicatat. Konsentrasi merkuri pada sampel yang diperiksa dapat ditentukan berdasarkan kurva tersebut. Bila didapat konsentrasi merkuri dalam sampel yang diperiksa menyimpang dari kurva, maka dilakukan penentuan kembali dengan memakai volume larutan standar yang lebih kecil. Kadar masing-masing mineral dalam bahan dihitung dengan rumus:
Kadar mineral (ppm)
Keterangan :
Abs = absorbansi yang terbaca pada AAS V = volume pengenceran
3.4.5 Analisis asam amino (AOAC 975.44)
Komposisi asam amino ditentukan dengan High Performance Liquid Chromatography (HPLC). Sebelum digunakan, perangkat HPLC harus dibilas dulu dengan eluen yang akan digunakan selama 2-3 jam. Begitu pula dengan
syringe yang akan digunakan juga harus dibilas dengan akuades. Analisis asam amino menggunakan HPLC terdiri atas 4 tahap yaitu (1) tahap pembuatan hidrolisat protein; (2) tahap pengeringan; (3) tahap derivatisasi; dan (4) tahap injeksi serta analisis asam amino.
1) Tahap pembuatan hidrolisat protein
Tahap preparasi sampel adalah pembuatan hidrolisat protein. Prosedurnya sebagai berikut: sampel ditimbang sebanyak 0,2 g dan dihancurkan. Hancuran sampel ditambah dengan HCl 6 N sebanyak 5-10 mL, kemudian dipanaskan dalam oven pada suhu 100 oC selama 24 jam. Tujuannya untuk menghilangkan gas atau udara yang ada pada sampel agar tidak mengganggu kromatogram yang dihasilkan, juga untuk mempercepat reaksi hidrolisis. Hidrolisat protein yang telah dipanaskan kemudian disaring dengan milipore berukuran 45 µ.
2) Tahap pengeringan
Larutan pengering dibuat dari campuran antara metanol, natrium asetat, dan trimetilamim dengan perbandingan 2:2:1. Pengeringan dilakukan dengan gas nitrogen untuk mempercepat pengeringan dan mencegah oksidasi.
3) Tahap derivatisasi
Larutan derivatisasi sebanyak 30 μL ditambahkan pada hasil pengeringan. Larutan derivatisasi dibuat dari campuran antara larutan metanol, pikoiotisianat, dan trietilamin dengan perbandingan 3:3:4. Proses derivatisasi dilakukan agar detektor mudah untuk mendeteksi senyawa yang ada pada sampel, selanjutnya dilakukan pegenceran dengan cara menambahkan 10 mL asetonitil 60 % atau buffer fosfat 0,1 M lalu dibiarkan selama 20 menit. Hasil pengenceran disaring kembali menggunakan milipore berukuran 0,45 µ.
4) Injeksi ke HPLC
kromatogram sampel dengan standar, pembuatan kromatogram standar menggunakan asam amino yang mengalami perlakuan yang sama dengan sampel.
Kandungan masing-masing asam amino pada bahan dapat dihitung dengan rumus:
Konsentrasi asam amino Luas areal sampelLuas areal standar obot sampel
Keterangan :
C konsentrasi standar asam amino (5 μg)
FP = faktor pengenceran (10 mL)
BM = bobot molekul dari masing-masing asam amino (g/mol) Kondisi alat HPLC saat berlangsungnya analisis asam amino: Merek : waters coorporation, USA
Kolom : accQtag column (3,9 x 150 mm) Temperatur : 37 oC
Fase gerak : acetonitril 60 % - AccqTag Eluent A, sistem gradien komposisi
Laju alir : 1,0 mL per menit
Detektor : fluorescense, Eksitasi = 250 nm, emisi = 395 nm Volume penyuntikan : 5 uL
Nama standar : Amino acid standar produksi Thermo Scientific
3.4.6 Analisis taurin (AOAC 997.05)
Kandungan taurin dapat dianalisis menggunakan alat HPLC dengan beberapa tahapan sebagai berikut: sampel ditimbang sebanyak 1 g dan dimasukkan ke labu ukur 100 mL, kemudian ditambah 80 mL air suling dan 1 mL pereaksi Carrez 1 lalu kocok hingga homogen. Sampel yang telah homogen kemudian ditambah 1 mL pereaksi Carrez 2, kemudian kocok hingga homogen. Sampel yang telah ditambah pereaksi Carrez 1 dan 2 kemudian diencerkan dengan cara menambahkan air suling sampai tanda tera labu ukur dan kocok hingga homogen. Sampel disaring menggunakan kertas saring Whatman. Filtrat ditampung dengan erlenmeyer dan disimpan ditempat gelap.
buffer natrium karbonat dan 1 mL larutan dansil klorida. Sampel didiamkan selama 2 jam lalu dikocok dan ditambahkan 0,5 mL larutan metilamin hidroklorida dan air suling sampai tanda tera (10 mL), kemudian dikocok kembali hingga homogen. Hasil derivatisasi diambil sebanyak 20 μL kemudian diinjeksikan ke HPLC untuk mengetahui kandungan taurin pada sampel. Kandungan taurin dalam100 gram bahan dapat dihitung dengan rumus :
Csp = konsentrasi contoh, dinyatakan dalam mg/100 g Asp = luas area contoh
Astd = luas area standar
Cstd = konsentrasi larutan standar dalam mg/L
Vsp = volume pelarutan sampel, dinyatakan dalam mL Wsp = bobot contoh, dinyatakan dalam g
10 = konversi dalam 100 g sampel
Kondisi alat HPLC saat berlangsungnya analisis taurin: Merek : waters coorporation, USA
Kolom : oktadesilsilana (C18) Laju alir : 1 mL/menit
Fase gerak : Bufer Natrium Asetat 0,01 M pH 4,2 : Asetonitril (84:16) Detektor : Flourescence : eksitasi 330 nm, emisi 530 nm
Nama standar : Amino acid standar produksi Thermo Scientific
3.4.7 Analisis asam lemak (AOAC 963.22)
dari suhu kamar dan biasanya dilakukan derivatisasi untuk contoh yang sulit menguap.
Dalam hal analisis asam lemak, maka mula-mula lemak/minyak dihidrolisis menjadi asam lemak, kemudian ditransformasi menjadi bentuk esternya yang bersifat lebih mudah menguap. Dalam metode ini, transformasi dilakukan dengan cara metilasi sehingga diperoleh metil ester asam lemak (FAME). Metil ester asam lemak (FAME) ini dianalisis dengan alat kromatografi gas. Identifikasi tiap komponen dilakukan dengan membandingkan waktu retensinya dengan standar pada kondisi analisis yang sama. Waktu retensi dihitung pada kertas rekorder sebagai jarak dari garis pada saat muncul puncak pelarut sampai ke tengah puncak komponen yang dipertimbangkan.
Penentuan kandungan komponen dalam contoh dapat dilakukan dengan teknik standar eksternal atau internal standar. Luas puncak dari masing-masing komponen adalah berbanding lurus dengan jumlah komponen tersebut dalam contoh, untuk meminimalkan kesalahan akibat volume injeksi, preparasi sampel, pengenceran dan sebagainya, lebih baik digunakan teknik standar internal, disamping itu koreksi terhadap respon detektor dan interaksi antar komponen dalam matrik contoh selama melewati kolom juga harus dilakukan.
(a) Preparasi contoh (hidrolisis dan esterifikasi)
Contoh lemak ditimbang sebanyak 20-30 mg atau minyak dalam tabung tertutup teflon, ditambah 1 mL NaOH 0,5 N ke dalam metanol dan dipanaskan dalam penangas air selama 20 menit. Sebanyak 2 mL BF3 16 % dan 5 mg/mL
standar internal ditambahkan. Larutan tersebut lalu dipanaskan lagi selama 20 menit, Sampel yang telah dingin ditambah 2 mL NaCl jenuh dan 1 mL n-heksana, lalu dikocok dengan baik. Lapisan n-heksana dipindahkan dengan bantuan pipet tetes ke dalam tabung yang berisi 0,1 g Na2SO4 anhidrat, dibiarkan 15 menit. Fase
cair dipisahkan dan selanjutnya diinjeksikan ke kromatografi gas. (b) Analisis komponen asam lemak sebagai FAME
sampel yang telah dipreparasi (A) diinjeksikan. Waktu retensi dan puncak masing-masing komponen diukur, jika rekorder dilengkapi dengan integrator, waktu retensi dan luas puncak langsung diperoleh dari integrator dan membandingkan waktu retensinya dengan standar untuk mendapatkan informasi mengenai jenis dari komponen-komponen dalam contoh. Metode internal standar, jumlah dari masing-masing komponen dalam sampel dapat dihitung dengan cara sebagai berikut :
Keterangan :
Cx = kosentrasi komponen x
Cs = kosentrasi standar internal
Ax = luas puncak komponen x
As = luas puncak standar internal
R = respon detektor terhadap komponen x relatif terhadap standar
Pada metode standar, dilakukan preparasi yang sama, hanya contoh dan standar dilakukan secara terpisah, tidak ada penambahan larutan standar ke dalam contoh. Jumlah kandungan komponen dalam contoh dihitung sebagai berikut:
x
s standar contoh
Gram contoh
Kondisi alat kromatografi gas pada saat dilakukan analisis :
Merek : shimadzu 2010 plus
Kolom : cyanopropil methylsil (capilary column)
Dimensi kolom : p=60m,ø dalam = 0,25 mm, 25 µm Film Tickness Laju alir N2 : 20 mL/menit
Laju alir H2 : 30 mL/menit
Laju alir udara : 200 – 250 mL/menit Suhu injektor : 200 oC
Suhu oven : awal 125 oC diam 5 menit akhir 225 oC diam 7 menit rata-rata 3 oC/menit
Ratio : 1 : 80
Volume injeksi : 1 µ L Linier velocity : 20 cm/sec
Nama standar : FAME Mix 37 components produksi Supelco
3.4.8 Analisis kolesterol (AOAC 994.10)
Analisis kolesterol menggunakan metode kromatografi gas. Analisis ini terdiri dari beberapa tahap yaitu penyabunan, ekstraksi, dan tahap derivatisasi. Analisis kolesterol dimulai dari tahap penyabunan yaitu dengan cara menimbang 2-3 g sampel kemudian dimasukkan ke erlenmeyer dan ditambah 40 mL etanol 95 % dan 8 mL KOH 50 %, kemudian sampel distirrer dan direfluks dengan suhu 70 °C selama kurang lebih 10 detik. Sampel selanjutnya ditambahkan 60 mL etanol 95% melalui atas kondensor dan didiamkan sampai suhu ruangan.
Tahap ekstraksi yaitu dimulai dengan hasil dari penyabunan ditambah 100 mL toluene, distirrer selama 30-60 detik. Hasil saringan ditambah 110 mL KOH 1 M lalu dikocok, fase air dibuang dan ditambah 40 mL KOH 0,5M dikocok lagi, fase air dibuang dan diulangi pencucian dengan air 3 kali. Lapisan toluene disaring melalui glass wool dan dimasukkan ke erlenmeyer yang berisi 20 g Na2SO4 anhidrat kemudian dikocok dan didiamkan selama 15 menit. Ekstrak
dipipet sebanyak 25 mL kemudian dilarutkan residu dalam 3 mL DMF.
Tahap derivatisasi yaitu dimulai dengan memipet sebanyak 1 mL larutan standar dan sampel, masing-masing ditambahkan 0,2 mL HMDS+0,1 mL TMCS dikocok selama 30 menit, didiamkan selama 15 menit sampai tidak keruh kemudian ditambah 1 mL 5α-cholestane internal standar + 10 mL H2O dikocok
selama 30 detik. Lapisan heptanes (lapisan atas) diambil kemudian diinjeksikan ke GC. Perhitungan banyaknya kolesterol dalam sampel sebagai berikut:
mg kolesterol/100 g sampel
( spl/ I spl)
Kondisi kromatografi pada saat analisis kolesterol : Fase diam (kolom) : kolom 5 % phenyl-methyl silicone Gas pembawa : hidrogen-helium
Detektor : FID (Flame Ionizazion Detector) Suhu injektor : 250 °C
Suhu detektor : 300 °C
Suhu kolom : 190 °C, ditahan 2 menit, dinaikkan 20 °C/menit sampai 230 °C, ditahan 3 menit dinaikkan 40 °C/menit sampai 25 °C, ditahan 25 menit.
Nama standar : Cholesterol produksi Sigma
3.4.9 Analisis fitokimia (Harborne 1987)
Analisis fitokimia dilakukan untuk menentukan komponen bioaktif yang terdapat pada ekstrak kasar keong mata lembu. Analisis fitokimia yang dilakukan terdiri dari alkaloid, steroid/triterpenoid, saponin, flavonoid, fenol hidrokuinon,
molisch, benedict, biuret, ninhidrin.
1) Alkaloid
Sejumlah sampel dilarutkan dalam beberapa tetes asam sulfat 2 N kemudian diuji dengan tiga pereaksi alkaloid, yaitu pereaksi dragendorf, meyer, dan wagner. Hasil uji dinyatakan positif bila dengan pereaksi meyer terbentuk endapan putih kekuningan, dengan pereaksi wagner membentuk endapan coklat dan dengan pereaksi dragendorf membentuk endapan merah sampai jingga. Pereaksi meyer dibuat dengan cara menambahkan 1,36 HgCl2 dengan 0,5 g kalium iodida lalu
dilarutkan dan diencerkan dengan akuades menjadi 100 mL dalam labu takar. Pereaksi ini tidak berwarna. Pereaksi wagner dibuat dengan cara 10 mL akuades dipipet kemudian ditambah 2,5 g iodin dan 2 g kalium iodida, selanjutnya dilarutkan dan diencerkan dengan akuades menjadi 200 mL dalam labu takar. Pereaksi ini berwarna coklat.
Pereaksi dragendorf dibuat dengan cara 0,8 g bismut subnitrat ditambah dengan 10 mL asam asetat dan 40 mL air. Larutan ini dicampur dengan larutan
yang dibuat dari 8 g kalium iodida dalam 20 mL air. Sebelum digunakan, 1 volume campuran ini diencerkan dengan 2,3 volume campuran 20 mL asam
2) Steroid/triterpenoid
Sejumlah sampel dilarutkan dalam 2 mL kloroform dalam tabung reaksi. Anhidrida asetat sebanyak 10 tetes dan asam sulfat pekat sebanyak 3 tetes ditambahkan ke dalam campuran tersebut. Hasil uji positif sampel mengandung steroid dan triterpenoid yaitu terbentuknya larutan berwarna merah untuk pertama kali kemudian berubah menjadi biru dan hijau.
3) Saponin
Saponin dapat dideteksi dengan uji busa dalam air panas. Busa yang stabil selama 30 menit dan tidak hilang pada penambahan 1 tetes HCl 2 N menunjukkan sampel mengandung saponin.
4) Flavonoid
Sejumlah sampel ditambah serbuk magnesium 0,1 mg dan 0,4 mL amil alkohol (campuran asam klorida 37 % dan etanol 95 % dengan volume sama) dan 4 mL alkohol, kemudian campuran dikocok. Hasil uji positif menunjukkan bahwa sampel mengandung flavonoid, yaitu terbentuknya warna merah, kuning atau jingga pada lapisan amil alkohol.
5) Fenol hidrokuinon
Sebanyak 1 g sampel diekstrak dengan 20 mL etanol 70 %. Larutan yang dihasilkan diambil sebanyak 1 mL kemudian ditambah 2 tetes larutan FeCl3 5 %. Hasil uji positif sampel mengandung senyawa fenol, yaitu terbentukya larutan berwarna hijau atau hijau biru.
6) Molisch
Sebanyak 1 mL larutan sampel ditambah 2 tetes pereaksi molisch dan 1 mL asam sulfat pekat melalui dinding tabung. Hasil uji positif menunjukkan sampel mengandung karbohidrat dan ditandai oleh terbentuknya kompleks berwarna ungu diantara 2 lapisan cairan.
7) Benedict
8) Biuret
Larutan sampel sebanyak 1 mL ditambah pereaksi biuret sebanyak 4 mL. Campuran dikocok dengan seksama. Hasil uji positif menunjukkan sampel mengandung senyawa peptida yaitu terbentuknya larutan berwarna ungu.
9) Ninhidrin
Larutan sampel sebanyak 2 mL ditambah beberapa tetes larutan ninhidrin 0,1 %. Campuran dipanaskan dalam penangas air selama 10 menit. Hasil uji positif menunjukkan sampel mengandung asam amino, yaitu terbentuknya larutan berwarna biru.
3.4.10 Analisis aktivitas antioksidan (Molyneux 2004)
Ekstrak keong mata lembu dari hasil ekstraksi bertingkat dan hasil pemurnian dilarutkan dalam metanol dengan konsentrasi 200, 400, 600 dan 800 ppm. Antioksidan sintetik BHT digunakan sebagai pembanding dan kontrol positif, dibuat dengan cara dilarutkan dalam pelarut metanol p.a. dengan konsentrasi 2, 4, 6 dan 8 ppm. Larutan DPPH yang akan digunakan dibuat dengan melarutkan kristal DPPH dalam pelarut metanol dengan konsentrasi 1 mM. Masing-masing sampel uji dan pembanding diambil 4,50 mL dan direaksikan
dengan 500 μL larutan DPPH 1 mM dalam tabung reaksi yang berbeda dan telah
diberi label. Campuran tersebut kemudian diinkubasi pada suhu 37 °C selama 30 menit dan diukur absorbansinya menggunakan spektrofotometer UV-VIS
Hitachi U-2800 pada panjang gelombang 516 nm. Absorbansi dari larutan blanko juga diukur untuk melakukan perhitungan persen inhibisi. Larutan blanko dibuat dengan mereaksikan 4,50 mL pelarut metanol dengan 500 μL larutan DPPH 1 mM dalam tabung reaksi. Nilai persentase aktivitas antioksidan dihitung dengan rumus:
inhibisi( ) bsorbansi blanko bsorbansi blanko bsorbansi sampel