KARAKTERISTIK DAN STATUS AKROSOM
SPERMATOZOA DOMBA (
Ovis aries
) YANG DIBEKUKAN
DALAM PENGENCER TRIS KUNING TELUR ATAU TRIS
SUSU SKIM DENGAN METODE
ONE
ATAU
TWO STEP
DEVI ANIANTI
FAKULTAS KEDOKTERAN HEWAN INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI SKRIPSI DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA
Dengan ini saya menyatakan bahwa skripsi berjudul Karakteristik dan Status Akrosom Spermatozoa Domba (Ovis aries) yang Dibekukan dalam Pengencer Tris Kuning Telur atau Tris Susu Skim dengan Metode One atau Two Step adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
ABSTRAK
DEVI ANIANTI. Karakteristik dan Status Akrosom Spermatozoa Domba (Ovis aries) yang Dibekukan dalam Pengencer Tris Kuning Telur atau Tris Susu Skim dengan Metode One atau Two Step. Dibimbing oleh NI WAYAN KURNIANI KARJA dan I KETUT MUDITE ADNYANE.
Penelitian bertujuan untuk mengetahui karakteristik (motilitas, viabilitas, membran plasma utuh) dan status akrosom utuh spermatozoa domba (Ovis aries) yang dibekukan dalam pengencer tris kuning telur atau tris susu skim dengan metode one atau two step. Semen dikoleksi dari domba kemudian dibagi dua dan diencerkan dalam pengencer tris kuning telur atau tris susu skim dengan metode one step (OS-KT dan OS-SK) dan two step (TS-KT dan TS-SK). Penelitian menunjukkan bahwa setelah ekuilibrasi kualitas spermatozoa sama antar semua kelompok (P>0.05). Persentase motilitas spermatozoa post thawing pada kelompok OS-SK lebih rendah daripada spermatozoa pada kelompok OS-KT (P<0.05). Viabilitas, integritas membran plasma dan status akrosom utuh spermatozoa pada kelompok OS-KT, OS-SK, TS-KT maupun TS-SK tidak menunjukkan perbedaan yang nyata (P>0.05). Berdasarkan hasil penelitian dapat disimpulkan bahwa pengencer tris kuning telur lebih baik dalam mempertahankan motilitas spermatozoa dibandingkan dengan pengencer tris susu skim. Metode pemberian gliserol (one step dan two step) tidak berpengaruh nyata terhadap kualitas spermatozoa post thawing.
Kata kunci: one step, two step, susu skim, kuning telur
ABSTRACT
DEVI ANIANTI. Characteristics and Acrosome Status of Ram’s Spermatozoa Cryopreserved in Tris-Egg Yolk or Tris-Skim Milk Extenders by Using One or Two Step Methods. Supervised by NI WAYAN KURNIANI KARJA and I KETUT MUDITE ADNYANE.
This research was conducted to study characteristics (motility, viability, plasma membrane integrity) and intact acrosome status of ram’s spermatozoa cryopreserved in tris-egg yolk or tris-skim milk extenders with one or two step method. Semen was collected from local ram, devided and extended in tris-egg yolk or tris-skim milk by using one step method (OS-KT and OS-SK) and two step method (TS-KT and TS-SK). The results showed that equilibrated spermatozoa had similar quality in all groups (P>0.05). Percentage of post-tahwed motility spermatozoa in OS-SK group was lower than OS-KT group (P<0.05). Percentage of spermatozoa viability, plasma membrane integrity and intact acrosome status were not significantly different among groups (P>0.05). In conclusion, tris-egg yolk extender was better than tris-skim milk extender to prevented the motility of spermatozoa after cryopreservation. Futhermore, one or two step methods were not significantly effected to the quality of post-thawing spermatozoa.
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Kedokteran Hewan
pada
Fakultas Kedokteran Hewan
KARAKTERISTIK DAN STATUS AKROSOM
SPERMATOZOA DOMBA (
Ovis aries
) YANG DIBEKUKAN
DALAM PENGENCER TRIS KUNING TELUR ATAU TRIS
SUSU SKIM DENGAN METODE
ONE
ATAU
TWO STEP
DEVI ANIANTI
FAKULTAS KEDOKTERAN HEWAN INSTITUT PERTANIAN BOGOR
PRAKATA
Puji dan syukur penulis panjatkan kehadirat Allah SWT atas segala karunia-Nya sehingga penulis dapat menyelesaikan penelitian dan penulisan skripsi yang berjudul Karakteristik dan Status Akrosom Spermatozoa Domba (Ovis aries) yang Dibekukan dalam Pengencer Tris Kuning Telur atau Tris Susu Skim dengan Metode One atau Two Step.
Penulis ingin mengucapkan terima kasih yang sebesar-besarnya kepada: 1. Drh Ni Wayan Kurniani Karja, MP, PhD dan Drh I Ketut Mudite Adnyane,
MSi, PhD, PAVet selaku dosen Pembimbing atas segala bimbingan, masukan, nasehat, dan dukungannya selama proses penelitian dan penulisan skripsi ini.
2. Dr Drh Koekoeh Santoso, selaku dosen Pembimbing Akademik yang telah memberikan nasehat dan dukungannya selama ini dalam kegiatan akademik. 3. Mama, Papa, Kakak-kakak (Erna Anggraeni, Maria Ulfah, Vani Amalia) dan Adik (Miftahul Fallah) atas semua dukungan, baik moral maupun materi yang telah diberikan selama ini kepada penulis.
4. Kak Aisyah, Mbak Umul, Ka Aras, dan Ka Eki atas semua bantuan dan arahan yang diberikan kepada penulis pada saat penelitian.
5. Teknisi Unit Rehabilitasi Reproduksi, Pak Bondan dan Selly Anggraeni atas bantuan yang diberikan kepada penulis pada saat penelitian.
6. Rekan satu penelitian sperma domba (Prista Ayu Nurjanah, Citra Ayu Lestari dan Faisal Amri Satrio) atas semangat, dukungan, dan bantuannya selama penelitian.
7. Sahabat-sahabat (Filika Amalia Isman, Sa’adah Daroyni Alhasanah, Rahajeng Harnastiti, Fauziyyah, Slyvia Oscarina) atas kebersamaan, dukungan, dan bantuan yang diberikan selama ini kepada penulis.
8. Rekan satu amanah, rekan Ganglion 48, dan semua pihak yang turut serta membantu penulis sehingga penulis mampu menyelesaikan skripsi ini. Penulis menyadari bahwa tulisan ini sangat jauh dari kesempurnaan. Oleh karena itu, adanya kritik dan saran yang membangun sangat diharapkan oleh penulis untuk kesempurnaan tulisan ini.
Semoga bermanfaat bagi semua pihak, khususnya bagi penulis sendiri.
DAFTAR ISI
DAFTAR TABEL vi
DAFTAR GAMBAR vi
PENDAHULUAN 1
Latar Belakang 1
Tujuan Penelitian 2
Manfaat Penelitian 2
METODE 2
Waktu dan Tempat 2
Bahan 2
Alat 3
Metode Penelitian 3
Analisis Data 5
HASIL DAN PEMBAHASAN 5
SIMPULAN DAN SARAN 10
Simpulan 10
Saran 10
DAFTAR PUSTAKA 11
DAFTAR TABEL
1 Kualitas semen segar domba lokal (Ovis aries) 5
DAFTAR GAMBAR
1 Motilitas spermatozoa semen segar, setelah ekulibrasi, dan post thawing 6 2 Viabilitas spermatozoa semen segar, setelah ekulibrasi, dan post
thawing 7
3 Membran plasma utuh spermatozoa semen segar, setelah ekulibrasi, dan
post thawing 8
4 Persentase status akrosom spermatozoa semen segar dan post thawing 9 5 Status akrosom spermatozoa domba dengan pewarnaan histokimia lektin
PENDAHULUAN
Latar Belakang
Inseminasi buatan (IB) merupakan salah satu bioteknologi reproduksi yang digunakan dalam upaya peningkatan populasi dan mutu genetik ternak (Koibur 2005). Teknologi inseminasi buatan di Indonesia sudah dikenal sejak tahun 1950-an. Berbagai hasil penelitian menunjukkan conseption rate (CR) hasil IB pada domba masih bervariasi antara 25–45%, hasil ini lebih rendah dari angka konsepsi pada sapi sebesar 76.73% (Koibur 2005). Inseminasi buatan dengan metode cervical insemination seperti pada babi dan domba menggunakan semen beku masih menghasilkan angka kebuntingan dan jumlah kelahiran yang rendah. Banyak faktor yang dapat mempengaruhi keberhasilan inseminasi buatan, salah satunya adalah kualitas semen beku yang digunakan saat inseminasi.
Pembekuan semen adalah proses penghentian sementara kegiatan hidup dari sel tanpa mematikan fungsi sel (Mumu 2009). Akan tetapi, masalah yang sering dihadapi dalam proses pembekuan adalah cold shock dan terbentuknya kristal es sehingga menyebabkan kerusakan sel pada spermatozoa ayam arab (Iskandar et al. 2006). Selama proses pembekuan dan pencairan kembali juga dapat menyebabkan kerusakan pada membran plasma dan tudung akrosom (Bag et al. 2002). Kerusakan tudung akrosom ini dapat menyebabkan keluarnya enzim-enzim yang diperlukan spermatozoa dalam proses fertilisasi. Hal tersebut akan menyebabkan penurunan fertilitas dari spermatozoa. Upaya untuk mengatasi hal tersebut, selama proses pembekuan semen biasanya ditambahkan bahan krioprotektan ke dalam pengencer. Krioprotektan ini berfungsi untuk mencegah terbentuknya kristal es dan menstabilkan membran plasma spermatozoa domba (Saili et al. 2009).
Upaya untuk meminimalkan kerusakan spermatozoa selain dengan penambahan krioprotektan, dapat dilakukan dengan menambahkan bahan pengencer ke dalam semen kerbau (Rizal et al. 2008). Penambahan bahan pengencer bertujuan untuk menyediakan sumber energi bagi spermatozoa sehingga menjamin kelangsungan hidup spermatozoa selama penyimpanan atau pembekuan (Suharyati dan Hartono 2011). Pengencer berbahan dasar tris mampu memelihara daya hidup spermatozoa sapi, karena berperan sebagai penyangga yang baik dengan toksisitas yang rendah (Negoro 2011). Secara umum, kuning telur biasanya ditambahkan dalam bahan pengencer yang berfungsi melindungi spermatozoa dari kejutan dingin (cold shock) selama penyimpanan (Tsutsui et al. 2003). Menurut Farina (2011) kualitas semen sapi pesisir yang terbaik setelah pengenceran terdapat pada bahan pengencer tris kuning telur dibandingkan dengan pengencer susu skim.
2
pembekuan. Akan tetapi, metode pemberian gliserol ke dalam medium perlu mendapatkan perhatian karena gliserol selain berfungsi memberikan perlindungan, gliserol juga dapat menyebabkan kerusakan pada struktur spermatozoa.
Metode one step atau satu tahap pada pemberian krioprotektan dilakukan dengan menambahkan gliserol pada medium sebelum medium diekuilibrasi, pada suhu 5 °C selama 120 menit. Sedangkan metode two step atau dua tahap dilakukan dengan menambahkan gliserol pada medium setelah medium diekuilibrasi. Metode one step lebih mudah dan lebih praktis untuk dilakukan dibandingkan dengan metode two step (Silva et al. 2003). Penelitian Herdis et al. (1999) menyatakan integritas spermatozoa kerbau lumpur (Bubalus bubalis) terbaik dicapai pada pemberian gliserol two step. Hal ini diduga berhubungan dengan lamanya kontak antara gliserol dengan spermatozoa (Salamon dan Maxwell 1995).
Tujuan Penelitian
Tujuan dari penelitian ini adalah untuk mengetahui karakteristik dan status akrosom spermatozoa domba (Ovis aries) setelah dibekukan dalam pengencer tris kuning telur atau tris susu skim dengan metode one atau two step.
Manfaat Penelitian
Memberikan informasi tentang bahan pengencer dan metode pemberian gliserol terbaik yang dapat digunakan antara pengencer tris kuning telur atau tris susu skim serta metode one step atau two step pada spermatozoa domba.
METODE
Waktu dan Tempat
Penelitian ini dilaksanakan pada bulan Januari sampai April 2015. Evaluasi spermatozoa dan kriopreservasi dilakukan di Laboraturium Fertilisasi In Vitro Bagian Reproduksi dan Kebidanan, Departemen Klinik, Reproduksi dan Patologi. Evaluasi status akrosom spermatozoa dilakukan di Laboratorium Histologi Bagian Anatomi, Histologi dan Embriologi, Departemen Anatomi, Fisiologi, dan Farmakologi, Fakultas Kedokteran Hewan Institut Pertanian Bogor.
Bahan
3 Alat
Peralatan yang digunakan dalam penelitian antara lain heating table, water bath, mikropipet kapasitas (10 μl, 100 µl dan 1000 µl), tabung Eppendorf 2.5 ml, pipet Pasteur, tube, obyek glass, cover glass, counting chamber, counter, straw, kertas tisu, kotak penyimpanan, inkubator CO2, mikroskop cahaya, mikroskop epifluorescens, gelas beker, dan vagina buatan.
Metode Penelitian
Koleksi Semen
Percobaan dilakukan menggunakan semen segar yang dikoleksi dari domba jantan dewasa kelamin berumur 1–2 tahun dengan bobot badan berkisar antara 25–30 kg. Domba dipelihara secara intensif dalam kandang individual yang berada di Unit Rehabilitasi Reproduksi, Fakultas Kedokteran Hewan, Institut Pertanian Bogor. Sumber makanan pokok domba adalah pakan hijauan dan konsentrat, serta air minum yang diberikan secara ad libitum. Penampungan semen dilakukan sebanyak dua kali seminggu (untuk menjaga kualitas dan kuantitas semen) menggunakan vagina buatan yang bertemperatur antara 40– 42 °C.
Bahan Pengencer
Penelitian ini menggunakan buffer tris yang dibuat dari 0.3025 g tris (hidroxymethyl amino-methane) (Merck, Germany), 0.17 g asam sitrat (Merck, Germany), 0.125 g fruktosa (Merck, Germany) yang dilarutkan dalam 8 ml aquades (Wittayarat et al. 2012). Komposisi dasar pengencer tris kuning telur untuk 10 ml adalah buffer tris 8 ml, kuning telur 2 ml ditambah streptomisin 1000 μg/ml dan penisilin 1000 IU/ml. Komposisi dasar pengencer tris susu skim untuk 10 ml terdiri atas buffer tris 10 ml, susu skim 0.15 g, ditambah streptomisin 1000 μg/ml dan penisilin 1000 IU/ml.
Kriopreservasi Spermatozoa
Semen segar setelah dikoleksi, dievaluasi karakteristiknya secara makroskopis dan mikroskopis. Evaluasi makroskopis meliputi volume, warna dan konsistensi. Sedangkan evaluasi mikroskopis meliputi motilitas, viabilitas, membran plasma utuh (MPU), status akrosom dan konsentrasi semen untuk menentukan jumlah pengencer yang akan ditambahkan. Semen yang mempunyai motilitas diatas 70% yang dapat diproses menjadi semen beku. Semen dibagi kedalam dua bagian. Bagian semen pertama diencerkan dalam pengencer tris kuning telur dan dibekukan dengan metode one step (OS-KT) atau two step (TS-KT). Bagian semen kedua diencerkan dalam pengencer tris susu skim dan dibekukan dengan metode one step (OS-SK) atau two step (TS-SK).
4
susu skim (TS-SK) yang masing-masing telah diberi semen, diekuilibrasi pada suhu 5 °C selama 2 jam. Setelah diekuilibrasi selama 2 jam dilakukan evaluasi mikroskopis pada semua tube.
Ketika akhir periode ekuilibrasi, semen dengan metode one step langsung dimasukan ke dalam straw dengan ukuran 0.25 ml. Sedangkan semen dengan metode two step terlebih dahulu ditambah gliserol 3%. Setelah itu, dilakukan pengemasan dengan cara memasukkan semen ke dalam straw berukuran 0.25 ml (I.V.M.,France). Straw diletakkan pada Styrofoam plate dalam uap nitrogen cair berjarak sekitar 4 cm dari permukaan nitrogen cair selama 20 menit dan segera dimasukkan ke dalam kontainer nitrogen cair untuk penyimpanan semen selama 10 menit. Setelah penyimpanan, straw dicairkan pada air bersuhu 32 °C selama 30 detik dan dievaluasi kembali.
Evaluasi Karakteristik dan Status Akrosom
1. Motilitas spermatozoa
Penilaian motilitas spermatozoa dilakukan secara visual. Persentase motilitas spermatozoa dinilai dengan cara meneteskan semen yang telah diencerkan dengan larutan 0.9% NaCl pada gelas objek lalu ditutup dengan gelas penutup. Pengamatan terhadap spermatozoa yang bergerak progresif dilakukan secara subjektif dengan mikroskop cahaya menggunakan pembesaran 400 . Penilaian yang diberikan berkisar antara 0–100%.
2. Viabilitas (Spermatozoa Hidup)
Pengamatan viabilitas dilakukan menggunakan metode pewarnaan eosin-negrosin (Cocchia et al. 2011). Sebanyak 10 µl sampel semen ditambah dengan 40 µl eosin-negrosin kemudian dicampur diatas gelas objek dan dibuat preparat ulas. Setelah itu, dikeringkan menggunakan heating table selama 15 detik. Sebanyak 200 spermatozoa diamati dengan mikroskop cahaya pembesaran 400 . Spermatozoa yang dikategorikan hidup adalah spermatozoa yang tidak menyerap warna sehingga bagian kepala spermatozoa tidak terwarnai (berwarna putih). Spermatozoa yang dikategorikan mati adalah spermatozoa yang menyerap warna sehingga bagian kepala spermatozoa akan terwarnai (berwarna merah).
3. Integritas Membran Plasma Spermatozoa
5 4. Status Akrosom dengan Metode FITC
Sebanyak 3 μl semen diulas pada gelas objek dan dikeringudarakan. Gelas
objek dicelupkan ke dalam larutan etanol absolut untuk difiksasi. Setelah 10
menit gelas objek dikeringudarakan dan diteteskan larutan flourescen
isothiocyanate (FITC) (Sigma, St. Luis MO) sebanyak 25 µl (konsentrasi 10 µg/ml dalam PBS) kemudian diinkubasi pada suhu 37 ºC selama 30 menit.
Preparat tersebut ditetesi dengan propidium iodide (PI) (Sigma, St. Luis MO)
sebanyak 5 µl (konsentrasi 10 µg/ml dalam PBS) dan diinkubasi selama 7
menit. Setelah diinkubasi, preparat dicuci dalam larutan PBS sebanyak dua kali untuk membersihkan sisa pereaksi yang tidak berikatan, lalu ditutup dengan
gelas penutup ukuran 24 24 mm. Pemeriksaan status akrosom dilakukan
menggunakan mikroskop epiflourecen (Nikkon, Eclipse E600, Japan) pada
panjang gelombang 380–420 nm dalam ruang gelap. Jumlah spermatozoa yang diamati pada setiap perlakuan adalah 200 spermatozoa. Hasil pemeriksaan dengan metode FITC dibedakan menjadi dua, yaitu spermatozoa dengan akrosom berwarna hijau dikategorikan sebagai akrosom intak (utuh), sementara spermatozoa yang tidak berwarna hijau dikategorikan sebagai akrosom rusak (tidak utuh) sesuai metode Cocchia et al. (2011).
Analisis Data
Persentase karakteristik spermatozoa (motilitas, viabilitas, dan membran plasma utuh) serta status akrosom spermatozoa ditansformasikan secara Arcsin sebelum dianalisis. Data yang telah ditransformasi, diuji dengan ANOVA dilanjutkan dengan uji Fisher’s Protected Least Significant Difference (PLSD) menggunakan program Statview (Abacus Concepts Inc., Berkeley, CA, USA). Perbedaan P<0.05 dianggap signifikan.
HASIL DAN PEMBAHASAN
Kualitas semen segar menjadi faktor penentu kelayakan semen untuk diproses menjadi semen cair atau semen beku. Kualitas semen segar domba lokal tertera dalam Tabel 1.
Tabel 1 Kualitas semen segar domba lokal (Ovis aries)
Karakteristik Semen Rata-rata ± SD
6
Berdasarkan hasil pemeriksaan makroskopis, volume semen ejakulat domba yang didapatkan sebesar 0.87±0.12 ml, dengan warna krem, konsistensi yang kental dan memiliki konsentrasi 3000±574 juta sel/ml. Sedangkan pada pemeriksaan mikroskopis, didapatkan persentase motilitas 80.0±0%, persentase hidup 91.5±3.0% dan persentase MPU 91.6±3.9%. Hal ini menunjukkan bahwa semen segar yang digunakan memiliki kualitas yang baik dan layak diproses menjadi semen beku sesuai dengan SNI 01-4869-1-1998.
Persentase motilitas spermatozoa setelah ekulibrasi dan post thawing pada kelompok one step dalam pengencer tris susu skim lebih rendah diantara semua kelompok (P<0.05). Sedangkan motilitas spermatozoa pada kelompok perlakuan two step tidak berbeda nyata antara kedua jenis bahan pengencer (P>0.05). Gambar 1 menunjukkan pengencer tris susu skim dengan metode pembekuan one step pada saat ekuilibrasi dan post thawing mengalami penurunan motilitas spermatozoa yang berbeda nyata (P<0.05).
Gambar 1 Motilitas spermatozoa semen segar, setelah ekulibrasi, dan post thawing. Superscript dengan huruf yang berbeda (a, b, c, d,e, f) pada bar yang sama menunjukkan perbedaan yang nyata (P<0.05). OS=one step, TS=two step, SK=susu skim, KT=kuning telur
Rendahnya persentase motilitas spermatozoa pada pengencer tris susu skim kemungkinan disebabkan kandungan laktosa yang tinggi pada susu skim. Laktosa merupakan golongan gula disakarida. Disakarida akan menyebabkan perubahan tekanan osmotik yang lebih nyata dibandingkan dengan monosakarida (Tiku 2014). Medium yang bersifat hipertonik akan menyebabkan dehidrasi sel yang akhirnya merusak membran plasma. Spermatozoa lebih rentan pada keadaan hipertonik dibandingkan hipotonik (Tiku 2014). Hasil ini diperkuat dengan penelitian Farina (2011), bahwa kualitas semen yang terbaik setelah pengenceran terdapat pada bahan pengencer tris kuning telur dibandingkan dengan pengencer susu skim pada semen sapi pesisir. Kuning telur mengandung lipoprotein dan lesitin tinggi yang berperan melapisi membran plasma sehingga terhindar dari pengaruh buruk kejutan dingin selama proses pengolahan (Zaidah 2014).
7 pada metode one step, sehingga waktu spermatozoa terpapar dengan gliserol menjadi lebih lama dibandingkan metode two step. Hal ini diduga berhubungan dengan sifat toksik dari gliserol karena lamanya interaksi antara gliserol dengan spermatozoa. Gliserol dapat merusak struktur membran plasma dan organel-organel spermatozoa sehingga menyebabkan terhambatnya metabolisme energi, dan berakhir pada kematian (Harpahmi 2012). Menurut Salamon dan Maxwell (1995) bahwa perlindungan efektif gliserol dapat diperoleh setelah kontak yang singkat dengan spermatozoa domba. Hasil ini didukung dengan penelitian Herdis et al. (1999) pada kerbau lumpur (Bubalus bubalis), bahwa integritas spermatozoa terbaik dicapai pada pemberian gliserol two step.
Persentase viabilitas spermatozoa setelah ekulibrasi menunjukkan pola yang sama dengan persentase post thawing (Gambar 2). Persentase viabilitas pada metode one step maupun two step tidak menunjukkan perbedaan yang nyata (P>0.05) dalam kedua bahan pengencer. Persentase terendah terlihat pada kelompok pengencer tris susu skim.
Gambar 2 Viabilitas spermatozoa semen segar, setelah ekulibrasi, dan post thawing. Superscript dengan huruf yang berbeda (a, b, c, d) pada bar yang sama menunjukkan perbedaan yang nyata (P<0.05). OS=one step, TS=two step, SK=susu skim, KT=kuning telur
8
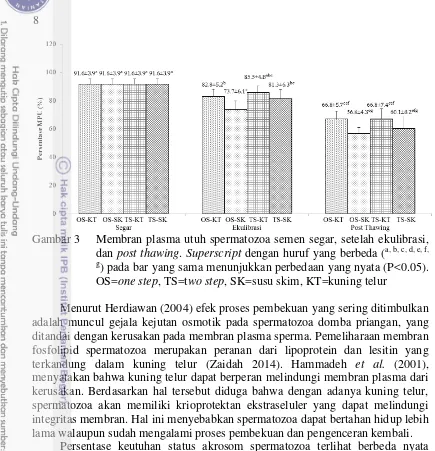
Gambar 3 Membran plasma utuh spermatozoa semen segar, setelah ekulibrasi, dan post thawing. Superscript dengan huruf yang berbeda (a, b, c, d, e, f, g
) pada bar yang sama menunjukkan perbedaan yang nyata (P<0.05). OS=one step, TS=two step, SK=susu skim, KT=kuning telur
Menurut Herdiawan (2004) efek proses pembekuan yang sering ditimbulkan adalah muncul gejala kejutan osmotik pada spermatozoa domba priangan, yang ditandai dengan kerusakan pada membran plasma sperma. Pemeliharaan membran fosfolipid spermatozoa merupakan peranan dari lipoprotein dan lesitin yang terkandung dalam kuning telur (Zaidah 2014). Hammadeh et al. (2001), menyatakan bahwa kuning telur dapat berperan melindungi membran plasma dari kerusakan. Berdasarkan hal tersebut diduga bahwa dengan adanya kuning telur, spermatozoa akan memiliki krioprotektan ekstraseluler yang dapat melindungi integritas membran. Hal ini menyebabkan spermatozoa dapat bertahan hidup lebih lama walaupun sudah mengalami proses pembekuan dan pengenceran kembali.
9
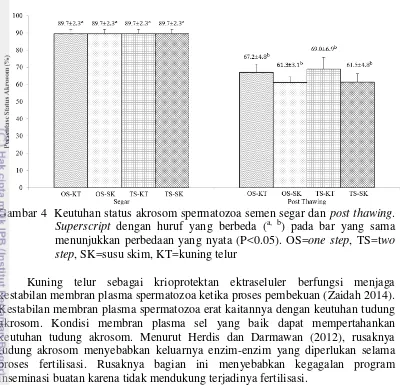
Gambar 4 Keutuhan status akrosom spermatozoa semen segar dan post thawing. Superscript dengan huruf yang berbeda (a, b) pada bar yang sama menunjukkan perbedaan yang nyata (P<0.05). OS=one step, TS=two step, SK=susu skim, KT=kuning telur
Kuning telur sebagai krioprotektan ektraseluler berfungsi menjaga kestabilan membran plasma spermatozoa ketika proses pembekuan (Zaidah 2014). Kestabilan membran plasma spermatozoa erat kaitannya dengan keutuhan tudung akrosom. Kondisi membran plasma sel yang baik dapat mempertahankan keutuhan tudung akrosom. Menurut Herdis dan Darmawan (2012), rusaknya tudung akrosom menyebabkan keluarnya enzim-enzim yang diperlukan selama proses fertilisasi. Rusaknya bagian ini menyebabkan kegagalan program inseminasi buatan karena tidak mendukung terjadinya fertilisasi.
10
Gambar 5 Status akrosom spermatozoa domba dengan pewarnaan histokimia lektin metode FITC (a) spermatozoa dengan tudung akrosom rusak sedangkan (b) spermatozoa dengan tudung akrosom utuh
Hasil pewarnaan lektin PNA yang dilabel FITC dan propidium iodine (PI) terlihat sel spermatozoa dengan tudung akrosom utuh (TAU) ditandai dengan kepala spermatozoa yang berwarna hijau dan inti berwarna merah (Gambar 5b). Pewarna PNA yang dilabel FITC akan berikatan dengan glikokonjugat pada membran akrosom spermatozoa sehingga memunculkan pendaran warna hijau. Tudung akrosom yang tidak utuh, hanya inti sel spermatozoa yang terwarnai merah oleh pewarna PI (Gambar 5a). Propidium iodine dapat berdifusi ke dalam inti sel, mewarnai DNA, dan memunculkan spektrum warna merah pada saat pengamatan dibawah mikroskop epifluorescens.
SIMPULAN DAN SARAN
Simpulan
Berdasarkan penelitian dapat disimpulkan bahwa pengencer tris kuning telur lebih baik dalam mempertahankan motilitas spermatozoa dibandingkan dengan pengencer tris susu skim. Metode pemberian gliserol (one step dan two step) tidak berpengaruh nyata terhadap kualitas spermatozoa post thawing.
Saran
11
DAFTAR PUSTAKA
Azizah, Arifiantini RI. 2009. Kualitas semen beku kuda pada pengencer susu skim dengan konsentrasi gliserol yang berbeda. Jurnal Veteriner. 10(2):63-70. Bag S, Joshi A, Naqvi SMK, Rawat PS, Mittal JP. 2002. Effect of freezing
temperature, at which straw were plunged into liquid nitrogen, on the post-thaw motility and acrosomal status of ram spermatozoa. Animal Reproduction Science. 72(3-4):175-183.
Cocchia N, Pasolinia M, Mancinib R, Petrazzuoloc O, Cristofarod I, Rosapane I. 2011. Effect of SOD (superoxide dismutase) protein supplementation in semen extenders on motility, viability, acrosome status, and ERK (extracellular signal-regulated kinase) protein phosphorylation of chilled stallion spermatozoa. Theriogenology. 75(1):1201-1210.
Farina Y. 2011. Pengaruh pengencer tris kuning telur, tris susu skim dan tris susu yang disuplementasi dengan gliserol 6% terhadap kualitas semen sapi pesisir [skripsi]. Padang (ID): Universitas Andalas.
Hammadeh ME, Zeginiadov T, Rosenbaum P, George T, Schmidt W, Strehler E. 2001. Predictive value of sperm chromatin condensation (aniline blue staining) in the assessment of male fertility. Archives of Andrology. 46:99-104.
Harpahmi. 2012. Pengaruh level gliserol dan waktu ekuilibrasi yang berbeda terhadap kualitas spermatozoa kerbau [tesis]. Padang (ID): Universitas Andalas.
Herdis, Darmawan IWA. 2012. Pengaruh maltosa sebagai krioprotektan ekstraseluler dalam meningkatkan kualitas semen beku guna mendukung keberhasilan teknologi inseminasi buatan. Jurnal Sains dan Teknologi Indonesia. 14(3):196-202.
Herdis, Purwantara B, Supriatna I, Putu IG. 1999. Integritas spermatozoa kerbau lumpur pada berbagai metode pembekuan semen. Jurnal Ilmu Ternak dan Veteriner. 4(1):7-12.
Herdis, Toelihere MR, Supriatna I, Purwantara B, Adikara RTS. 2005. Optimalisasi kualitas semen cair domba garut (Ovis aries) melalui penambahan maltosa ke dalam pengencer semen tris kuning telur. Media Kedokteran Hewan. 21(2):88-93.
Herdiawan I. 2004. Pengaruh laju penurunan suhu dan jenis pengencer terhadap kualitas semen beku Domba Priangan. Jurnal Ilmu Ternak dan Veteriner. 9(2):98-107.
Iskandar S, Mardalestari R, Hernawati R, Mardiah E, Wahyu E. 2006. Pengaruh jenis, konsentrasi krioprotektan dan metode thawing terhadap kualitas semen beku ayam arab. Jurnal Ilmu Ternak dan Veteriner. 11(1):34-38. Koibur JF. 2005. Evaluasi tingkat keberhasilan pelaksanaan program inseminasi
buatan pada sapi bali di kabupaten jayapura. Buletin Peternakan. 29(3):131-133.
12
Perez-Llano B, Lorenzo JL, Yenes P, Trejo A, García-Casado P. 2001. A short hypoosmotic swelling test for the prediction of boar sperm fertility. Theriogenology. 56(3):387-398.
Negoro FP. 2011. Pengaruh bahan pengencer tris kuning telur, tris susu skim dan tris susu sapi segar terhadap kualitas semen sapi pesisir dan sapi peranakan ongole (PO) [skripsi]. Padang (ID): Universitas Andalas.
Rizal M. 2008. Peningkatan kualitas spermatozoa epididimis kerbau belang yang dikriopreservasi dengan beberapa konsentrasi sukrosa. Jurnal Ilmu Ternak dan Veteriner. 8(4):183-188.
Rizal M, Herdis. 2005. Daya hidup spermatozoa epididimis domba garut yang dikriopreservasi menggunakan modifikasi pengencer tris. Hayati. 12(2):61-66.
Saili T, Adnyane IKM, Noor RR, Setiadi MA, Agungpriyono S, Boediono A. 2009. Perubahan viabilitas dan struktur subseluler spermatozoa domba setelah pengeringbekuan. Jurnal Veteriner. 10(4):213-218.
Salamon S, Maxwell WMC. 1995. Frozen storage of ram semen II causes of low fertility after cervical insemination and methods of improvement. Animal Reproduction Science. 38(1-2):1-36.
Silva AR, Cardoso RCS, Uchoa DC, Silva LDM. 2003. Quality of canine semen submitted to single or fractionated glycerol addition during the freezing process. Theriogenology. 59(3-4):821-829.
Suharyati S, Hartono M. 2011. Preservasi dan kriopreservasi semen sapi limousin dalam berbagai bahan pengencer. Jurnal Kedokteran Hewan. 5(2):53-58. Tiku LTB. 2014. Pengaruh laktosa dan kuning telur sebagai sumber energi
terhadap persentase hidup dan motilitas spermatozoa pada semen beku kambing peranakan etawa (PE) [skripsi]. Makassar (ID): Universitas Hasanuddin.
Toshimori K, Ito C. 2003. Fromation and organization of the mammalian sperm head. Archives of Histology and Cytology Journal. 66(5):383-396.
Tsutsui T, Tezuka T, Mikasa Y, Sugisawa H, Kirihara N, Hori T, Kawakami E. 2003. Artificial insemination with canine semen stored at a low temperature. Journal Veteriner Medicine Science. 65(3):307-312.
Wittayarat M, Kimura T, Kodama R, Namula Z, Chatdarong K, Techakumphu M, Sato Y, Taniguchi M, Otoi T. 2012. Long-term preservation of chilled semen using vitamin C in combination with green tea polyphenol. Cryoletters. 33(4):318-326.
13
RIWAYAT HIDUP
Penulis dilahirkan di Jakarta pada tanggal 13 Desember 1993 sebagai anak ke empat dari lima bersaudara dari pasangan Suryanto dan Kasminik. Penulis mendapat pendidikan sekolah menengah pertama di SMP Negeri 177 Jakarta pada tahun 2008. Pendidikan menengah atas diselesaikan di SMA Negeri 90 Jakarta pada tahun 2011. Pada tahun yang sama penulis diterima di Institut Pertanian Bogor melalui jalur SNMPTN Undangan di Fakultas Kedokteran Hewan.
Selama menjadi mahasiswa, penulis pernah menjadi asisten mata kuliah Anatomi Veteriner I (2012-2013), Embriologi dan Genetika Perkembangan (2013-2014) serta Ilmu Teknologi Reproduksi (2014-2015). Penulis juga aktif di berbagai organisasi di IPB antara lain: anggota Dewan Perwakilan Mahasiswa FKH IPB (2012-2013), anggota Majelis Perwakilan Mahasiswa IPB (2012-2013), anggota DKM An-Nahl FKH IPB (2013-2014) dan Bendahara Himpro Hewan Kesayangan dan Satwa Akuatik (2013-2014).
Sebagai salah satu syarat untuk memperoleh gelar Sarjana Kedokteran Hewan pada Fakultas Kedokteran Hewan, Institut Pertanian Bogor, penulis menyusun skripsi
berjudul “Karakteristik dan Status Akrosom Spermatozoa Domba (Ovis aries)