ABSTRAK
PENGARUH BERBAGAI BAGIAN BENIH SEBAGAI SUMBER EKSPLAN DENGAN UMUR KECAMBAH ENAM HARI TERHADAP
INDUKSI EMBRIO SOMATIK DUA VARIETAS KACANG TANAH (Arachis hypogaea L.)
Oleh
RENY MITA SARI
Kacang tanah merupakan komoditas yang penting di Indonesia sebagai sumber protein dan bahan dasar berbagai olahan pangan. Produksi kacang tanah perlu ditingkatkan dengan mengembangkan varietas yang tahan terhadap hama dan penyakit tanaman. Salah satu metode yang mendukung adalah rekayasa genetika melalui teknik kultur jaringan.
Untuk menerapkan metode rekayasa genetika memerlukan eksplan yang mampu menghasilkan embrio secara efisien. Teknik kultur jaringan melalui jalur
embriogenesis harus dikembangkan untuk memperoleh sistem regenerasi yang mantap untuk bahan transformasi genetik. Sumber eksplan dan umur kecambah merupakan salah satu faktor yang harus diperhatikan dalam pemilihan bahan tanam sebagai sumber eksplan karena sangat menentukan keberhasilan induksi embrio somatik secara in vitro.
Penelitian ini dilakukan di Laboratorium Kultur Jaringan, Gedung Bioteknologi, Fakultas Pertanian, Universitas Lampung, Bandar Lampung pada bulan
November 2011 hingga April 2012.
Penelitian ini dilaksanakan dengan menggunakan rancangan teracak lengkap (completely randomized design) dengan faktor tunggal. Perlakuan yang
Reny Mita Sari
Hasil penelitian menunjukkan bahwa hanya tipe eksplan leaflet dari kecambah umur enam hari yang menghasilkan embrio somatik pada varietas Kancil maupun Singa. Rata-rata jumlah embrio somatik yang dihasilkan eksplan leaflet varietas Kancil pada minggu ke-4, 8, dan 12 berturut-turut adalah 0,48, 1,05, dan 2,13 embrio per eksplan dan pada varietas Singa berturut-turut adalah 0,025, 1,05, dan 2,8 embrio per eksplan. Persentase eksplan yang membentuk kalus embriogenik yang dihasilkan eksplan leaflet varietas Kancil pada minggu ke-4, 8, dan 12 berturut-turut adalah 15%, 30%, dan 40% dan pada varietas Singa berturut-turut adalah 2,5%, 22,5%, dan 37,5%.
Eksplan leaflet dari kecambah umur enam hari varietas Kancil dan Singa membentuk kalus embriogenik, sedangkan eksplan kotiledon, hipokotil dan radikula tidak membentuk kalus embriogenik.
PENGARUH BERBAGAI BAGIAN BENIH SEBAGAI SUMBER EKSPLAN DENGAN UMUR KECAMBAH ENAM HARI TERHADAP
INDUKSI EMBRIO SOMATIK DUA VARIETAS KACANG TANAH (Arachis hypogaea L.)
Oleh
Reny Mita Sari
Skripsi
Sebagai Salah Satu Syarat untuk Mencapai Gelar SARJANA PERTANIAN
Pada
Program Studi Agroteknologi Fakultas Pertanian Universitas Lampung
UNIVERSITAS LAMPUNG
BANDAR LAMPUNG
DAFTAR GAMBAR
Gambar Halaman
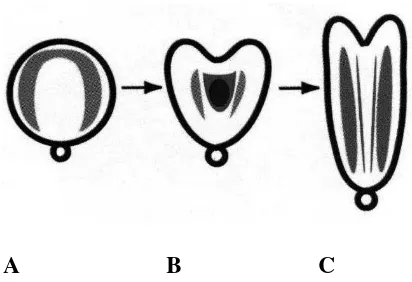
1. Beberapa tahap perkembangan embrio somatik. (A) globular, (B) hati,
dan (C) torpedo. ... 14 2. Posisi embriogenesis dalam segitiga keseimbangan auksin dan
sitokinin. ... 16 3. Rumus bangun pikloram. ... 17 4. Tahapan sterilisasi benih kacang tanah : (A) benih direndam dalam larutan
Bayclin+Tween, (B) benih dikocok, (C) dibilas dengan air steril, (D) bilasan kedua, (E) bilasan ketiga, (F) kulit benih dikupas, (G) benih
dikecambahkan dalam media MS0. ... 23 5. Bagian-bagian sumber eksplan. ... 23 6. Tahapan isolasi eksplan kacang tanah : (A) kecambah benih umur 6 hari,
(B) kotiledon dibuka, (C) kotiledon dipisahkan dan diambil salah satu sebagai eksplan, (D) leaflet dipisahkan, (E) radikula dan hipokotil dipisahkan, (F) eksplan kotiledon, (G) eksplan hipokotil, (H) eksplan
radikula, (I) eksplan leaflet. ... 24 7. Rak kultur dengan kondisi gelap dalam ruang inkubasi. ... 25 8. Tipe-tipe perkembangan kultur : (A) eksplan leaflet varietas
Kancil dengan kalus embriogenik, (B) eksplan leaflet varietas Singa dengan kalus embriogenik, (C) eksplan leaflet dengan kalus non embriogenik, (D) eksplan leaflet yang membesar kemudian mati, (E) eksplan hipokotil dengan kalus non embriogenik, (F) eksplan kotiledon dengan kalus non embriogenik, (G) eksplan
radikula dengan kalus non embriogenik. ... 29 9. Perkembangan eksplan hipokotil minggu keempat–delapan–dua belas
vii
Gambar Halaman
10. Perkembangan eksplan radikula minggu keempat–delapan–dua belas
varietas Kancil. ... 30 11. Perkembangan eksplan kotiledon minggu keempat–delapan–dua belas
varietas Kancil. ... 30
12. Perkembangan eksplan hipokotil minggu keempat–delapan–dua belas
varietas Singa. ... 31 13. Perkembangan eksplan radikula minggu keempat–delapan–dua belas
varietas Singa. ... 31 14. Perkembangan eksplan kotiledon minggu keempat–delapan–dua belas
varietas Singa. ... 31 15. Bentuk embrio somatik eksplan leaflet varietas Kancil (kiri) dan Singa
(kanan) berumur 12 minggu mst pada media induksi. ... 32 16. Rata-rata jumlah embrio somatik pada varietas Kancil pada minggu
ke-4 sampai minggu ke-12 setelah tanam pada media induksi. ... 32 17. Rata-rata jumlah embrio somatik pada varietas Singa pada minggu ke-4
sampai minggu ke-12 setelah tanam pada media induksi. ... 33 18. Persentase eksplan yang menghasilkan kalus embriogenik pada
varietas Kancil pada minggu ke-4 sampai minggu ke-12 mst pada
media induksi. ... 35 19. Persentase eksplan yang membentuk kalus embriogenik pada varietas
Singa pada minggu ke-4 sampai minggu ke-12 setelah tanam pada
DAFTAR ISI
Halaman
DAFTAR TABEL. ... iv
DAFTAR GAMBAR. ... vi
I. PENDAHULUAN 1.1 Latar Belakang dan Perumusan Masalah. ... 1
1.2 Tujuan Penelitian. ... 4
1.3 Landasan Teori. ... 4
1.4 Kerangka Pemikiran. ... 6
1.5 Hipotesis. ... 8
II. TINJAUAN PUSTAKA 2.1 Taksonomi dan Morfologi Kacang. ... 9
2.1.1 Akar (Radix). ... 9
2.1.2 Batang (Caulis). ... 10
2.1.3 Daun (Folium). ... 10
2.1.4 Bunga (Flos). ... 11
2.2 Kultur Jaringan. ... 11
2.3 Embriogenesis Somatik. ... 12
2.4 Zat Pengatur Tumbuh. ... 15
2.5 Lingkungan Tumbuh. ... 17
ii
IV. HASIL DAN PEMBAHASAN 4.1 Hasil. ... 27
4.1.1 Perkembangan Kultur. ... 27
4.1.2 Morfologi embrio somatik pada eksplan leaflet varietas Kancil dan Singa berumur 12 mst pada media induksi. ... 31
4.1.3 Rata-rata jumlah embrio somatik pada varietas Kancil. ... 32
4.1.4 Rata-rata jumlah embrio somatik pada varietas Singa. ... 33
4.1.5 Persentase eksplan yang membentuk kalus embriogenik pada varietas Kancil. ... 35
4.1.6 Persentase eksplan yang membentuk kalus embriogenik pada varietas Singa. ... 36
4.2 Pembahasan. ... 37
V. KESIMPULAN DAN SARAN 5.1 Kesimpulan. ... 41
MENGESAHKAN
1. Tim Penguji
Ketua : Akari Edy, S.P., M.Si. ………….
Sekretaris : Prof. Dr. Ir. Setyo Dwi Utomo, M.Sc. .………….
Penguji
Bukan Pembimbing : Ir. Sri Ramadiana M.Si. ………….
2. Dekan Fakultas Pertanian
Prof. Dr. Ir. Wan Abbas Zakaria, M.S. NIP 19610826 198702 1 001
Judul Skripsi : PENGARUH BERBAGAI BAGIAN BENIH SEBAGAI SUMBER EKSPLAN DENGAN UMUR KECAMBAH ENAM HARI TERHADAP INDUKSI EMBRIO SOMATIK DUA
VARIETAS KACANG TANAH (Arachis hypogaea L.)
Nama Mahasiswa :
Reny Mita Sari
Nomor Pokok Mahasiswa : 0814013198 Program Studi : Agroteknologi
Fakultas : Pertanian
MENYETUJUI 1. Komisi Pembimbing
Akari Edy, S.P., M.Si. Prof. Dr. Ir. Setyo Dwi Utomo, M.Sc. NIP 197107012003121001 NIP 196110211985031002
2. Ketua Program Studi Agroteknologi
RIWAYAT HIDUP
Penulis dilahirkan di Bandar Lampung pada tanggal 06 Januari 1991 sebagai anak tunggal dari keluarga Bapak Sujasmin dan Ibu Dalmidah.
Penulis mengawali pendidikan formal di TK Al – Azhar 4 yang diselesaikan pada tahun 1996, dan Sekolah Dasar Al – Azhar yang diselesaikan pada tahun 2002. Pada tahun yang sama penulis melanjutkan pendidikan di Sekolah Menengah Pertama Negeri 21 Korpri, Bandar Lampung yang diselesaikan pada tahun 2005, kemudian melanjutkan pendidikan ke Sekolah Menengah Atas Negeri 5 Bandar Lampung yang diselesaikan pada tahun 2008. Penulis meneruskan pendidikan di Perguruan Tinggi Negeri Universitas Lampung dan terdaftar sebagai mahasiswi Program Studi Agroteknologi, Fakultas Pertanian Universitas Lampung pada tahun 2008 melalui jalur Seleksi Ujian Masuk Perguruan Tinggi Negeri (SNMPTN).
Selama menjadi mahasiswi, penulis pernah menjadi Asisten Dosen Semester Pendek (SP) Bahasa Inggris Dasar dan Asisten Dosen mata kuliah Fisiologi Tumbuhan. Penulis pernah mengikuti Kegiatan Bakti Sosial Mahasiswa (KBSM) yang diadakan oleh Persatuan Mahasiswa Agroteknologi (Perma AGT) yang dilaksanakan pada tahun 2008. Penulis juga pernah diamanahkan dalam
kepengurusan Perma AGT sebagai kepala bidang Penelitian dan Pengembangan (Litbang) periode kepengurusan 2010/2011 dan sebagai anggota bidang
mengikuti organisasi eksternal kampus, Fosma Lampung (Forum Silaturahmi Mahasiswa Lampung) periode kepengurusan 2010/2012 dan diamanahkan sebagai ketua bidang Badan Usaha Fosma (BUF), selain itu juga diamanahkan di Fosma Nasional sebagai sekretaris Fosma Regional Sumatra periode kepengurusan 2011/2012. Penulis juga pernah menjadi Event Organizer seminar Give and Forgive pada tahun 2010. Penulis melaksanakan Praktik Umum di Dinas
SANWACANA
Puji syukur penulis panjatkan kehadirat Allah SWT atas limpahan rahmat, berkah dan karunia-Nya sehingga penulis dapat menyelesaikan penelitian dan menyusun skripsi ini.
Penulis menyadari bahwa penulisan skripsi ini tidak terlepas dari bantuan berbagai pihak. Untuk itu pada kesempatan ini penulis menyampaikan ucapan terimakasih kepada :
1. Bapak Akari Edy, S. P., M. Si., selaku Ketua Tim Penguji dan Pembimbing Pertama atas saran, pengarahan, motivasi, bantuan, kesabaran dan kemurahan hati dalam membimbing penulis selama penelitian hingga penyelesaian skripsi.
2. Bapak Prof. Dr. Ir. Setyo Dwi Utomo, M. Sc. selaku Sekretaris Tim Penguji dan Pembimbing Kedua atas saran, bimbingan, motivasi, bantuan dan kesabaran selama penulis menyelesaikan skripsi
4. Bapak Ir. Erwin Yuliadi, M. Sc., Ph. D. selaku Pembimbing Akademik yang telah memberikan bimbingan, saran, pengarahan, kerjasama, motivasi, bantuan, kesabaran dan kemurahan hati yang sangat berharga bagi penulis selama menjadi mahasiswa Fakultas Pertanian, Universitas Lampung.
5. Bapak Prof. Dr. Ir. Wan Abbas Zakaria, M.S. selaku Dekan Fakultas Pertanian Universitas Lampung dan Bapak Dr. Ir. Kuswanta F. Hidayat, M.P selaku ketua Program Studi Agroteknologi Universitas Lampung.
6. Seluruh dosen Program Studi Agroteknologi yang telah memberikan
pengetahuan dan pengalaman yang berharga selama penulis menuntut ilmu di Fakultas Pertanian Universitas Lampung.
7. Papa dan Mama yang telah memberikan dukungan dan do’a yang tiada pernah putus, motivasi, semangat, kasih sayang, kesabaran, dan segala bantuan moril maupun materi untuk keberhasilan penulis.
8. Sahabat-sahabat seperjuangan Rindang Andam Suri, S. P., Pebria Sisca S.P., Arif Aditya, Syamsu Ardhona, Satrio Tri Handono, Panji Setyo Arizka, Dewansyah Sabtaki, Rizki Hidayat, M. Iman Alzy S.P., Rizki Amelia, Minarsih, Ananda Yashinta R., Sri Hartati, Novarina Firzayanti S.P, Inggit Sagita, Savita (Mimi), Nico Alfredo, Intan Rahayu Ningtyas, Bella Christine, Devira Janu, Azanu Rudit, Formatin Crew, Bang Tyas, Bang Anggi, Bang Bagus, Fajar, Yoga, Reza, Santos, Putu, Rocky, Saede, Ma’ul, Eko, Angga (Mamang), Angga (Kaka), Dharma, Deri, Sandi, Agung Terang, Emon,
9. Teman-teman kru Kultur Jaringan, Mbak Yane, Mbak Eka, Mbak Eka P., Kak Ibnu, Mbak Vincen, Maiyulis S.P, Mia, Yesi, Bowo, Kresna Sifa S.P, Mario. 10. Teman-teman Fosma Lampung dan seluruh Alumni ESQ, Bunda Devi
Arfiana, Ayah Agus, Adam, Akang Irul, Elsa, Rian, Bang Benny, Mbak Tara, Dhani, Mail, Yunizar, Kak Tomy (Uda), Tiara, Lidya, Ruslan, Amin, Nuhada, Endah, Ceria, Ayen, Dodi, Bang Iman, Mpok Sari, Bang Tomi, adik-adik Poltekkes, Patriot Bangsa, sahabat Fosma Nasional Bang Taufik (Sumbar), Bang Sul (Makassar), Bang Subhan (Riau), Kang Dayat (NTB), Bang Pijar (Aceh), Kak Putri (Aceh), Purwa (Medan), dan seluruh saudara spiritual yang tidak dapat disebutkan satu-persatu, yang telah memberikan pengetahuan, persaudaraan, keceriaan, motivasi, semangat dan pencerahan kepada penulis selama penulis menjadi mahasiswa.
11. Keluarga kecil KKN Tematik Unila, Desa Srimulyo, Kecamatan Anak Ratu Aji Lampung Tengah, Arin, Budi, Bang Zulfadli Fajar S.P., Recky, Ervi, Okta atas kerjasama dan kekeluargaan selama berada di lokasi KKN.
12. Teman-teman semasa SMA Yeni Puspita A. Md., Azzahra Adhe Musnalika S.P, Rike Pratiwi A. Md., M. Iqbal Parabi S. SI., Hassanal Bolkiah, Teguh Wicaksono yang terus memberikan semangat hingga penulis menyelesaikan skripsi.
Penulis menyadari bahwa skripsi ini masih belum sempurna, namun penulis tetap berharap semoga skripsi ini dapat bermanfaat bagi pembaca. Semoga Allah SWT membalas segala kebaikan yang telah diberikan kepada penulis.
Bandar Lampung, Agustus 2012
Penulis,
1
I. PENDAHULUAN
1.1 Latar Belakang
Kacang tanah (Arachis hipogea L.) merupakan salah satu komoditas pertanian yang cukup penting. Komoditas kacang tanah diusahakan 70% di lahan kering dan hanya 30% di lahan sawah tadah hujan. Kacang tanah merupakan sumber protein nabati yang dapat diolah menjadi berbagai macam olahan bahan pangan. Permintaan kacang tanah dari tahun 1988 hingga 2010 mengalami peningkatan sebesar 1,45% per tahun (Hasanah et al., 2004). Data BPS (Badan Pusat
Statistik), menunjukkan bahwa produktivitas kacang tanah dari tahun 2008 sampai 2011 meningkat. Pada tahun 2008 produktivitas kacang tanah sebesar 12,15 Ku/Ha, pada tahun 2009 12,49 Ku/Ha, tahun 2010 12,56 Ku/Ha, dan pada tahun 2011 12,81 Ku/Ha. Selama tahun 2008 sampai 2011 rata-rata produktivitas kacang tanah hanya meningkat 22% dari empat tahun terakhir. Jumlah ini belum mampu memenuhi permintaan kacang tanah nasional sehingga mengakibatkan volume impor kacang meningkat. Untuk mengatasi hal tersebut perlu
2
Kultur jaringan merupakan teknik yang mendukung penerapan metode rekayasa genetika. Menurut Rahayu dan Sudarsono (2009), tanaman kacang tanah hasil seleksi in vitro menghasilkan varian somaklonal kualitatif yang mengindikasikan adanya peluang mendapatkan tanaman yang lebih toleran atau sama tingkat toleransinya.
Varietas kacang tanah yang tahan hama dan penyakit akan sangat mungkin dihasilkan jika sudah diperoleh metode perbanyakan melalui kultur jaringan kacang tanah. Teknik kultur jaringan dapat dilakukan melalui jalur
embriogenesis somatik. Penggunaan embrio somatik dapat mempercepat keberhasilan program pemuliaan tanaman melalui rekayasa genetika dengan peluang transformasi yang lebih tinggi. Hal ini disebabkan embrio somatik dapat berasal dari satu sel somatik. Embrio somatik juga dianggap bahan tanaman yang ideal untuk disimpan jangka pendek maupun jangka panjang karena bila
diregenerasikan masih dapat membentuk bibit somatik (Purnamaningsih, 2002).
Induksi embrio somatik merupakan proses sel somatik (baik haploid maupun diploid) yang berkembang membentuk tumbuhan baru melalui tahap
perkembangan embrio spesifik tanpa melalui fusi gamet. Struktur embrio somatik bipolar (mempunyai dua calon meristem, yaitu meristem akar dan meristem tunas). Struktur tersebut menyebabkan perbanyakan melalui induksi embrio somatik lebih menguntungkan dibandingkan pembentukan tunas adventif
3
Menurut Edy (2009), penerapan metode rekayasa genetika memerlukan eksplan yang mampu membentuk tunas dan embrio somatik secara efisien sebagai target transformasi genetik. Oleh karena itu, teknik regenerasi embrio somatik
(embriogenesis) harus dikembangkan sehingga diperoleh sistem regenerasi in vitro yang mantap baik untuk bahan transformasi genetik maupun untuk
perbanyakan rutin varietas unggul.
Beberapa penelitian mengenai induksi embrio somatik kacang tanah sudah dilakukan, yaitu menggunakan eksplan benih kacang tanah yang belum matang (immature) (Ozias-Akins et al., 1992), benih kacang tanah matang (mature) tanpa dikecambahkan (Chengalrayan et al., 1995, Iqbal et al., 2011 dan Cucco and Alberto 2000), dan benih yang dikecambahkan tiga hari (Sari, 2010).
Hasil penelitian Ozias-Akins et al. (1992) menunjukkan bahwa embrio somatik terbentuk dari kotiledon immature dan eksplan poros embrio. Penelitian
Chengalrayan et al. (1995) menunjukkan embrio somatik terbentuk dari eksplan leaflet dari benih kacang tanah mature. Penelitian Iqbal et al. (2011) menunjukkan
4
Berdasarkan latar belakang, maka dapat dirumuskan masalah, yaitu bagaimana respon empat bagian benih (kotiledon, leaflet, hipokotil, dan radikula) sebagai sumber eksplan dengan umur kecambah enam hari terhadap induksi embrio somatik?
1.2 Tujuan Penelitian
Berdasarkan identifikasi dan perumusan masalah, maka tujuan dari penelitian ini yaitu mengetahui respon berbagai bagian benih (kotiledon, leaflet, hipokotil, dan radikula) dengan umur kecambah enam hari sebagai sumber eksplan terhadap induksi embrio somatik.
1.3 Landasan Teori
Dalam rangka menyusun penjelasan teoritis terhadap pertanyaan yang telah dikemukakan, digunakan landasan teori sebagai berikut :
Kultur jaringan adalah metode untuk mengisolasi bagian tanaman seperti
protoplasma sel, jaringan dan organ serta menumbuhkannya dalam kondisi aseptik sehingga bagian-bagian tersebut dapat memperbanyak diri dan beregenerasi menjadi tanaman lengkap (Gunawan, 1988). Pembiakan kultur jaringan dapat dilakukan melalui jalur organogenesis dan embriogenesis somatik.
5
1998 dalam Srilestari et al., 2004), bentuk anatomi dan sifatnya serupa dengan embrio zigot benih biasa. Bibit yang diinginkan dengan mudah dapat dihasilkan hanya dengan mengecambahkan embrio yang masak tersebut. Apabila embrio somatik dapat dihasilkan melalui penginduksian kalus yang bersifat embriogenik, maka kalus tersebut dapat diperbanyak secara tidak terbatas dan dimasakkan setiap waktu (Merkle, 1995 dalam Srilestari et al., 2004).
Rahayu dan Sudarsono (2009), dalam penelitiannya menumbuhkan embrio kacang tanah menjadi tanaman, menggunakan embrio somatik sekunder yang berumur satu bulan. Dalam prosesnya, kalus ditanam dalam media MS+P16 (MS dengan penambahan pikloram 16 µM) dan disubkultur setiap bulan selama enam bulan untuk menginduksi terjadinya variasi somaklonal. Kemudian kalus ditanam dalam media MS+P16 dan dilakukan subkultur setiap bulan, setelah tiga bulan embrio somatik diisolasi dan ditanam dalam media MS+P16 selama dua bulan agar terjadi proliferasi kemudian diregenerasikan menjadi tanaman dalam media MS dengan penambahan arang aktif. Subkultur dilakukan setiap bulan sampai embrio berkembang sempurna dan dikecambahkan dalam media MS yang ditambahkan BAP 22 µM sampai terbentuk tunas kemudian dilanjutkan ke media pengakaran dengan penambahan NAA 10 mg/l selama satu minggu, kemudian ditanam kembali dalam media MS dengan penambahan arang aktif sampai terbentuk akar yang sempurna. Terakhir dilakukan aklimatisasi dan dipindahkan ke media tanah.
6
Menurut Edy (2008) eksplan leaflet embrio dalam media MS 0 tidak membentuk kalus embriogenik. Sedangkan eksplan dalam media dengan pikloram atau 2,4-D sebagian dapat berkembang membentuk kalus embriogenik. Menurut Ozias-Akins et al., (1992) eskplan kotiledon beberapa genotipe kacang tanah
menghasilkan embrio somatik setelah empat minggu dengan menggunakan media yang ditambahkan pikloram.
Faktor bahan tanaman yang turut menentukan keberhasilan kultur jaringan antara lain genotipe tanaman, umur eksplan, status fisiologi, ukuran eksplan dan sumber eksplan (Pierik, 1987). Pada proses pengecambahan pada sumber eskplan, masuknya air ke dalam sel akan mengaktifkan sejumlah enzim perkecambahan. Proses perkecambahan juga merupakan pengaktifan kembali aktivitas poros embrio (embryonic axis) yang terhenti, kemudian membentuk bibit (seedling) (Kamil, 1986).
1.4 Kerangka Pemikiran
7
hama dan penyakit dengan metode rekayasa genetika. Kultur jaringan merupakan teknologi terapan yang mendukung rekayasa genetika dan dapat memperbanyak tanaman secara klonal dengan cepat. Menurut Pierik (1987), keuntungan lain dari teknik kultur jaringan tanaman adalah sebagai bahan tanam dan pelaksanaannya tidak tergantung pada musim.
Zat pengatur tumbuh jenis auksin perlu ditambahkan pada media MS untuk
induksi embrio somatik. Hasil penelitian Edy (2008) menunjukkan eksplan leaflet dalam media MS 0 tidak membentuk kalus embrio somatik. Sebaliknya, eksplan dalam media pikloram atau 2,4-D sebagian dapat berkembang membentuk kalus embrio somatik. Penggunaan media MS dengan penambahan pikloram adalah yang paling efektif untuk menghasilkan embrio somatik, NAA merupakan ZPT kedua yang paling efektif untuk induksi embrio somatik dan pengakaran serta pengecambahan (Sellars et al., 1990).
8
Hasil penelitian Sari (2010), pada kacang tanah dengan umur kecambah tiga hari, hanya bagian eksplan leaflet, yang membentuk kalus embriogenik, sedangkan eksplan poros dan radikula tidak membentuk kalus embrio. Sedangkan menurut Murthy dan Saxena (1994) dalam Edy (2009), jumlah embrio somatik dan persentase embrio somatik paling banyak dihasilkan pada kecambah muda (sampai 9 hari), sedangkan kecambah umur 21 hari gagal membentuk embrio somatik. Menurut Edy (2009), persentase kalus embriogenik yang dihasilkan oleh eksplan leaflet beberapa varietas kacang tanah lebih tinggi pada umur kecambah tiga dan enam hari dibandingkan dengan tanpa dilakukan perkecambahan sebelumnya.
Dengan demikian, penelitian ini dilakukan untuk melihat kemampuan masing-masing bagian benih sebagai sumber eksplan terhadap induksi embrio somatik, apakah setelah dilakukan pengecambahan selama enam hari seluruh bagian eksplan yang digunakan akan membentuk kalus embriogenik.
1.5 Hipotesis
9
II. TINJAUAN PUSTAKA
2.1 Taksonomi dan Morfologi Kacang Tanah
Kedudukan kacang tanah dalam sistematika (taksonomi) tumbuhan diklasifikasikan sebagai berikut :
Divisi : Spermatophyta (tumbuhan berbiji) Sub divisi : Angiospermae (berbiji tertutup) Kelas : Dicotyledoneae (biji berkeping dua) Ordo : Rosales
Famili : Papilonaceae/Leguminosae Genus : Arachis
Spesies : Arachis hypogaea L.
2.1.1 Akar (Radix)
Perakaran tanaman kacang tanah terdiri atas akar lembaga (radikula), akar tunggang (radix primaria), dan akar cabang (radix lateralis). Pertumbuhan akar menyebar ke semua arah sedalam lebih kurang 30 cm dari permukaan tanah. Akar berfungsi sebagai organ penghisap unsur hara dan air untuk pertumbuhan tanaman. Akar tanaman kacang tanah bersimbiosis dengan bakteri Rhizobium radicicola. Bakteri ini terdapat pada bintil-bintil (nodula-nodula) akar tanaman
10
tidak dapat menambat (mengambil) nitrogen bebas (N2) dari udara tanpa bakteri
Rhizobium. Sebaliknya, bakteri Rhizobium tidak dapat mengikat nitrogen tanpa
bantuan tanaman kacang tanah. Pada bintil-bintil akar terdapat unsur nitrogen yang berguna untuk pertumbuhan tanaman dan ketersediaan unsur N dalam tanah (Rukmana, 2003).
2.1.2 Batang (Caulis)
Batang tanaman kacang tanah berukuran pendek, berbuku-buku, dengan tipe pertumbuhan tegak atau mendatar. Pada mulanya batang tumbuh tunggal,
kemudian lambat laun bercabang banyak seolah-olah merumpun. Panjang batang berkisar antara 30 cm–50 cm atau lebih, tergantung jenis atau varietas kacang tanah dan kesuburan tanah. Buku-buku (ruas-ruas) batang yang terletak di dalam tanah merupakan tempat melekat akar, bunga, dan buah. Ruas-ruas batang yang berada di atas permukaan tanah merupakan tempat tumbuh tangkai daun
(Rukmana, 2003).
2.1.3 Daun (Folium)
Daun berbentuk lonjong, terletak berpasangan (majemuk) dan bersirip genap. Tiap tangkai daun terdiri atas empat helai anak daun. Helaian daun bersifat nititropic, yaitu mampu menyerap cahaya matahari sebanyak-banyaknya.
11
2.1.4 Bunga (Flos)
Bunga tanaman kacang tanah berbentuk kupu-kupu, berwarna kuning, dan bertangkai panjang yang tumbuh dari ketiak daun. Fase berbunga biasanya berlangsung setelah tanaman berumur 4-6 minggu. Bunga kacang tanah
menyerbuk sendiri (self pollination) pada malam hari. Dari semua bunga yang tumbuh, hanya 70%-75% yang membentuk bakal polong (ginofora). Bunga mekar selama sekitar 24 jam, kemudian layu, dan gugur. Ujung tangkai bunga akan berubah bentuk menjadi bakal polong, tumbuh membengkok ke bawah, memanjang, dan masuk ke dalam tanah (Rukmana, 2003).
2.2 Kultur Jaringan
Secara umum, teknik kultur jaringan atau teknik kultur in vitro adalah teknik untuk mengisolasi bagian-bagian tanaman seperti protoplasma, sel, jaringan, atau organ, serta menumbuhkan bagian-bagian tersebut dalam media buatan aseptik yang kaya nutrisi serta zat pengatur tumbuh dalam wadah tertutup yang tembus cahaya dengan tujuan agar bagian-bagian tersebut memperbanyak diri dan
beregenerasi menjadi tanaman lengkap (Gunawan, 1995 dalam Karyanto, 1997). Berdasarkan bagian tanaman yang dikulturkan, secara lebih spesifik terdapat beberapa tipe kultur, yaitu kultur halus, kultur suspensi sel, kultur akar, kultur pucuk tunas, kultur embrio, kultur ovul, kultur anter, kultur kuncup bunga.
12
dilakukan sepanjang tahun tanpa bergantung pada musim, (4) bibit yang dihasilkan lebih sehat, (5) memungkinkan dilakukannya manipulasi genetik. Namun, teknik ini juga memiliki kelemahan, antara lain: (1) dibutuhkan biaya awal yang relatif tinggi, (2) dibutuhkan keahlian khusus untuk melaksanakannya, (3) tanaman yang dihasilkan berukuran kecil, aseptik, dan terbiasa hidup di tempat yang berkelembaban tinggi sehingga memerlukan aklimatisasi ke lingkungan eksternal (Yusnita, 2003).
2.4 Embriogenesis Somatik
Perbanyakan tanaman dengan kultur jaringan dapat dilakukan dengan dua cara, yaitu dengan organogenesis dan embriogenesis. Organogenesis artinya proses terbentuknya organ-organ (seperti pucuk dan akar) baik secara langsung dari eksplan maupun secara tidak langsung melalui pembentukan kalus terlebih dahulu. Sedangkan embriogenesis adalah proses terbentuknya embrio somatik.
Embriogenesis mempunyai beberapa tahap spesifik, yaitu (1) induksi sel dan kalus embriogenik, (2) pendewasan, (3) perkecambahan, dan (4) hardening. Pada tahap induksi kalus embriogenik dilakukan isolasi eksplan dan penanaman pada media tumbuh. Untuk induksi kalus embriogenik kultur umumnya ditumbuhkan pada media yang mengandung auksin yang mempunyai daya aktivitas kuat atau dengan konsentrasi tinggi (Bhojwani dan Razdan, 1989 dalam Purnamaningsih, 2002).
13
singkat. Di samping itu, untuk mendukung program pemuliaan tanaman melalui rekayasa genetika, penggunaan embrio somatik dapat mempercepat keberhasilan dengan peluang transformasi yang lebih tinggi karena embrio somatik dapat berasal dari satu sel somatik. Untuk penyimpanan jangka pendek maupun jangka panjang, embrio somatik dianggap merupakan bahan tanaman yang ideal untuk disimpan karena bila diregenerasikan dapat membentuk bibit somatik
(Purnamaningsih, 2002).
Keberhasilan akan tercapai bila kalus atau sel yang digunakan bersifat
embriogenik, yang dicirikan oleh sel yang berukuran kecil, sitoplasma padat, inti besar, vakuola kecil-kecil dan mengandung butir pati. Embrio somatik dapat dihasilkan dalam jumlah besar dari kultur kalus, namun untuk tujuan perbanyakan dalam skala besar, jumlahnya kadang-kadang dapat lebih ditingkatkan melalui inisisasi sel embrionik dari kultur suspensi yang berasal dari kalus primer (Wiendi et al., 1991 dalam Purnamaningsih, 2002).
Embriogenesis somatik merupakan suatu proses dimana sel somatik (baik haploid maupun diploid) berkembang membentuk tumbuhan baru melalui tahap
perkembangan embrio yang spesifik tanpa melalui fusi gamet (William dan Maheswara, 1986 dalam Sukmadjaja, 2005). Beberapa faktor yang
mempengaruhi pembentukan embrio somatik adalah jenis eksplan, sumber nitrogen dan gula, serta zat pengatur tumbuh.
14
kultur merupakan salah satu faktor penentu keberhasilan dalam pembentukan embrio somatik. Pola perkembangan eksplan via embriogenesis memerlukan ZPT (zat perngatur tumbuh) untuk merangsang potensi yang ada (Edy dan
Pujisiswanto, 2008).
Tahap perkembangan embrio somatik terdiri dari tahap globular, hati dan torpedo (Gambar 1). Penggunaan media yang tepat dapat menginduksi terjadinya seluruh tahap perkembangan embrio, sebaliknya pada media yang kurang sesuai tidak terlihat perkembangan embrio. Penggunaan auksin dikombinasikan dengan sitokinin dapat menginduksi pembentukan kalus embriogenik, tetapi tidak dapat menginduksi perkembangan embrio somatik.
A B C
15
2.5 Zat Pengatur Tumbuh
Zat pengatur tumbuh merupakan senyawa organik yang berperan dalam
pertumbuhan dan perkembangan kultur. ZPT yang digunakan antara lain auksin (2,4-D, 3,5-T, pikloram, dan NAA), sitokinin (BA, kinetin, dan adenine sulfat), GA3, dan inhibitor ABA. Konsentrasi zat pengatur tumbuh yang diguna-kan tergantung pada tahap perkembangan yang terjadi.
Zat pengatur tumbuh berperan dalam merangsang, mengatur, menghambat dan menentukan arah perkembangan suatu kultur in vitro. Ada beberapa jenis ZPT yang digunakan dalam kultur jaringan tanaman, namun efisiensi dan
efektivitasnya berbeda terhadap jenis tanaman yang berbeda. Sebagai contoh, kinetin sangat efektif untuk kultur buku batang (Carimi et al., 1995 dalam Nurwahyuni dan Elimasni, 2006), sementara sitokinin konsentrasi rendah dapat memacu perkembangan tunas sedangkan konsentrasi tinggi merangsang
penggandaan tunas (Nurwahyuni, 2004 dalam Nurwahyuni dan Elimasni, 2006). Auksin pada konsentrasi rendah dapat memacu pertumbuhan akar dan pada konsentrasi tinggi dapat merangsang pertumbuhan kalus (Magoon dan Singh, 1995; Goh et al., 1995 dalam Nurwahyuni dan Elimasni, 2006). Dengan demikian, pengaturan zat pengatur tumbuh di dalam media sangat menentukan terhadap keberhasilan pertumbuhan dan perkembangan kultur. Dalam
16
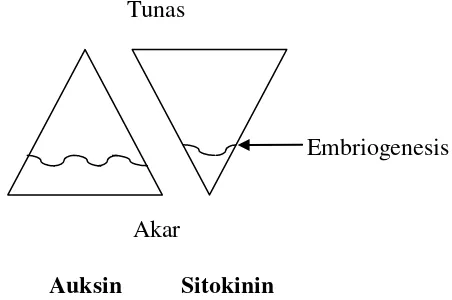
Dalam kultur jaringan auksin berperan dalam merangsang pertumbuhan kalus, serta suspensi sel dan organ. Sitokinin berperan penting dalam pengaturan pembelahan sel dan morfogenesis (Gunawan, 1988). Berdasarkan teori
keseimbangan sitokinin dan auksin (Gambar 2), jika nisbah sitokinin dan auksin tinggi maka akan merangsang terbentuknya tunas, begitu pula sebaliknya jika nisbah sitokinin dan auksin rendah maka akan merangsang terbentuknya akar. Embriogenesis terjadi ketika jumlah auksin pada eksplan lebih tinggi
dibandingkan dengan sitokinin (George and Sherrington, 1984) Tunas
Embriogenesis
Akar
Auksin Sitokinin
Gambar 2. Posisi embriogenesis dalam segitiga keseimbangan auksin dan sitokinin.
17
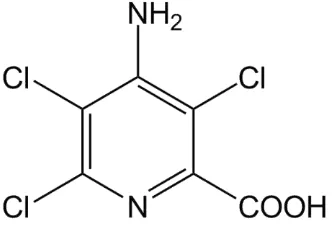
George dan Sherrington (1984) mengatakan bahwa penambahan auksin ke dalam media regenerasi in vitro berfungsi untuk menginduksi kalus, pembentukan kalus dan embrio somatik. Jenis ZPT 2,4-D, pikloram, dicamba dan NAA efektif untuk menginduksi pembentukan embrio somatik. Sedangkan IBA, IAA, 4-CPA dan 2.4.5-T diketahui tidak efektif (Edy dan Pujisiswanto, 2008). Bentuk rumus bangun pikloram (Gambar 3).
Gambar 3. Rumus bangun pikloram.
2.6 Lingkungan Tumbuh
Kondisi lingkungan tumbuh yang dapat mempengaruhi regenerasi tanaman meliputi :
a. Keasaman (pH)
18
b. Kelembaban
Kelembaban relatif (RH) lingkungan biasanya mencapai 100%. RH sekeliling kultur mempengaruhi pola perkembangan. Jadi, pengaturan RH pada keadaan tertentu memerlukan suatu bentuk diferensiasi khusus (Daisy et al., 1994).
c. Cahaya
Intensitas cahaya yang rendah dapat mempertinggi embriogenesis dan organogenesis. Cahaya ultra violet dapat mendorong pertumbuhan dan pembentukan tunas dari kalus pada intensitas yang rendah. Sebaliknya, pada intensitas yang tinggi proses ini akan terhambat. Pembentukan kalus maksimum sering terjadi di tempat yang gelap (Daisy et al., 1994).
d. Temperatur
Temperatur yang dibutuhkan agar terjadi pertumbuhan yang optimum umumnya adalah berkisar antara 20ºC-30ºC. Sedangkan pertumbuhan yang optimum untuk pembentukan kalus endosperm adalah sekitar 25ºC. Faktor lingkungan,
19
2.7 Eksplan
Eksplan yaitu bagian tanaman sebagai bahan inokulum awal yang ditanam dalam media, yang akan menunjukkan pertumbuhan dan perkembangan tertentu.
Umumnya bagian tanaman yang digunakan sebagai eksplan adalah jaringan muda yang sedang tumbuh aktif (Yusnita, 2003). Dalam hal perbanyakan tanaman secara kultur jaringan, eksplan merupakan faktor penentu keberhasilan. Umur fisiologis, umur ontogenetik, ukuran eksplan, serta bagian tanaman yang diambil merupakan hal-hal yang harus dipertimbangkan dalam memilih eksplan yang akan digunakan sebagai bahan awal kultur (Yusnita, 2003).
20
III. BAHAN DAN METODE
3.1 Tempat dan Waktu Penelitian
Penelitian ini dilaksanakan di Laboratorium Kultur Jaringan, Gedung
Bioteknologi, Fakultas Pertanian, Universitas Lampung dari Bulan November 2011 sampai dengan bulan April 2012.
3.2 Bahan dan Alat
Bahan yang digunakan dalam penelitian ini antara lain empat jenis tipe eksplan (kotiledon, hipokotil, leaflet, dan radikula) dari dua varietas kacang tanah nasional (Kancil dan Singa) yang diperoleh dari Balai Penelitian Tanaman
Kacang-kacangan dan Umbi-umbian Malang, bahan-bahan kimia sesuai dengan formula media MS (Murashige dan Skoog, 1962), aquades, pikloram 16 µM, agar-agar, Natrium hipoklorit/Bayclin, Tween-20, spritus, dan air steril.
21
3.3 Metode Penelitian
Rancangan perlakuan yang digunakan pada setiap varietas adalah Rancangan Acak Lengkap (RAL) tunggal dengan 4 perlakuan tipe eksplan (kotiledon,
hipokotil, leaflet, radikula) dan 8 ulangan. Varietas yang digunakan adalah Kancil dan Singa.
Unit percobaan terdiri dari lima eksplan yang dikulturkan dalam satu botol dan diulang sebanyak delapan kali (total 40 eksplan per perlakuan). Dari data hasil pengamatan dianalisis dengan uji t pada taraf 5%.
S2( ̅- ̅) = S ̅2 + S ̅2 = +
Keterangan =
S A2 = Nilai tengah leaflet
S B2 = Nilai tengah Kotiledon/Hipokotil/Radikula
3.4 Pelaksanaan Penelitian
3.4.1 Sterilisasi Alat
Alat-alat yang digunakan seperti botol kultur, alat-alat diseksi (gunting, pisau, pinset, spatula), dan peralatan gelas lainnya dicuci bersih terlebih dahulu.
22
3.4.2 Media Perlakuan
Media yang digunakan dalam penelitian ini ada dua jenis, yaitu media pada tahap pengecambahan benih dan induksi embrio somatik. Media pengecambahan benih adalah media MS 0 (media MS tanpa penambahan zat pengatur tumbuh).
Sedangkan media yang digunakan untuk induksi embrio somatik adalah media MS dengan penambahan pikloram 16 µM. Pada kedua media tersebut
ditambahkan sukrosa 30 g/l dan agar-agar pemadat 6 g/l. Sebelum disterilkan, pH media diatur sehingga mencapai 5,8.
3.4.3 Sterilisasi dan Isolasi Eksplan (Bagian Benih)
23
Gambar 4. Tahapan sterilisasi benih kacang tanah : (A) benihdirendam dalam larutan Bayclin+Tween, (B) benih dikocok, (C) dibilas dengan air steril, (D) bilasan kedua, (E) bilasan ketiga, (F) kulit benih dikupas, (G) benih dikecambahkan dalam media MS0.
3.4.4 Penanaman dan Sub Kultur
Sumber eksplan yang telah disterilkan ditanam secara aseptik (di dalam laminar air flow cabinet) pada media pengecambahan (MS 0). Setelah berumur enam
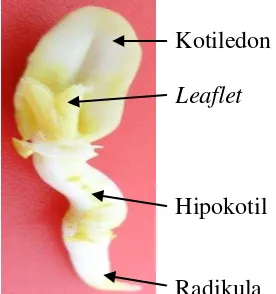
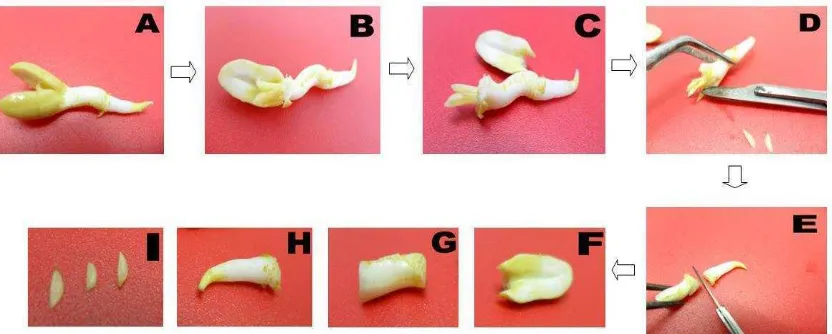
hari, benih sumber eksplan diisolasi, benih dibelah dan diambil empat bagian benihnya (Gambar 6) yaitu kotiledon (Gambar 6F), hipokotil (Gambar 6G), leaflet (Gambar 6I), dan radikula (Gambar 6H) untuk ditanam secara aseptik pada media induksi embrio somatik (MS+pikloram 16 µM).
Kotiledon Leaflet
Hipokotil
Radikula
24
Dalam satu botol terdapat lima eksplan dari masing-masing perlakuan. Subkultur dilakukan setiap empat minggu. Subkultur juga dilakukan secara aseptik di dalam laminar air flow cabinet setiap empat minggu sekali. Subkultur dilakukan
dengan cara memindahkan semua eksplan pada masing-masing ulangan ke dalam media induksi yang baru. Hal ini bertujuan untuk mengganti media lama yang telah digunakan selama empat minggu dengan media yang baru, agar nutrisi tanaman tetap terpenuhi.
Gambar 6. Tahapan isolasi eksplan Kacang Tanah : (A) kecambah benih umur 6 hari, (B) kotiledon dibuka, (C) kotiledon dipisahkan dan diambil salah satu sebagai eksplan, (D) leaflet dipisahkan, (E) radikula dan hipokotil dipisahkan, (F) eksplan kotiledon, (G) eksplan hipokotil, (H) eksplan radikula, (I) eksplan leaflet.
3.4.5 Pemeliharaan Kultur
25
Rak kultur
Gambar 7. Rak kultur dengan kondisi gelap dalam ruang inkubasi
Setiap hari kultur diamati untuk melihat apakah terjadi kontaminasi dan untuk mencegah tersebarnya kontaminasi pada eksplan lain dalam satu satuan
percobaan, maupun satuan percobaan lainnya. Apabila terjadi kontaminasi pada salah satu sub eksplan namun tidak melebihi dua eksplan pada setiap satuan percobaan, maka dilakukan sub kultur dengan cara memindahkan eksplan yang tidak terkena kontaminasi ke dalam media induksi yang baru. Namun, bila kontaminasi terjadi lebih dari dua eksplan dalam satu satuan percobaan, maka ulangan tersebut dikeluarkan dari rak kultur dan dilakukan pemotongan ulangan.
26
3.5 Variabel yang diamati
Pengamatan pada eksplan dilakukan setiap empat minggu sekali selama 12 minggu setelah tanam (mst) pada media induksi. Embrio yang diamati adalah embrio primer dan sekunder. Variabel yang diamati adalah :
1. Morfologi embrio somatik yang terbentuk pada eksplan.
Pada variabel ini, dilakukan pengamatan secara visual terhadap bentuk morfologi embrio somatik yang terbentuk pada eksplan untuk masing-masing varietas kacang tanah.
2. Rata-rata jumlah embrio somatik yang terbentuk per eksplan. Pengamatan rata-rata jumlah embrio somatik dilakukan dengan cara
menghitung jumlah embrio somatik yang terbentuk pada eksplan, pada setiap satu satuan percobaan. Berikut rumus rata-rata jumlah embrio somatik :
Jumlah embrio yang terbentuk pada eksplan Rata-rata jumlah per satuan percobaan
embrio somatik = Jumlah eksplan per satuan percobaan
3. Persentase eksplan yang membentuk kalus embriogenik.
Pengamatan persentase eksplan yang membentuk kalus embriogenik
dilakukan dengan cara menghitung jumlah eksplan yang menghasilkan kalus embriogenik pada setiap satu satuan percobaan. Berikut rumus persentase eksplan yang membentuk kalus embriogenik :
% eksplan yang Jumlah eksplan yang membentuk kalus embriogenik
Membentuk kalus = per satuan percobaan
DAFTAR PUSTAKA
Armini, A.N. M., Wattimena dan L.W. Gunawan, 1992. Perbanyakan Tanaman Bioteknologi Tanaman Laboratorium Kultur Jaringan. Departemen
Pendidikan dan Kebudayaan Pusat Antar Universitas Bioteknologi. Institut Pertanian Bogor.
BPS. 1994. Statistik Indonesia. Biro Statistik. Jakarta. BPS. 2009. Statistik Indonesia. Biro Statistik. Jakarta.
Chengalrayan, K., Vandana B. M.dan Sulekha H.1995. In Vitro Regulation of Mophogenesis in Peanut. Plant Sci. 110:259—268.
Cucco, M. F. and Alberto D. R. J. 2000. Protocol for regeneration in vitro of Arachis hypogaea L. Universidad Católica de Valparaíso – Chile. EJB Electronic Journal of Biotechnology.
Daisy P., Sriyanti Hendaryono dan Ari Wijayani. 1994. Teknik Kultur Jaringan. Penerbit Kanisius. Yogyakarta.
Darmanti, S. 2008. Pembentukan Cabang Lateral Jarak Pagar (Jatropha curcas) Setelah Perlakuan Girdling. Bioma. 10:7—11.
Edy, A dan H. Pujisiswanto. 2008. Pengaruh 2,4-D Terhadap Induksi Embrio Somatik Eksplan Leaflet Pada beberapa Varietas Kacang Tanah Secara In Vitro. Prosiding Seminar Nasional Sains dan Teknologi –II. Universitas Lampung. Bandar Lampung. 10 hlm.
Edy, A. 2009, Pengaruh umur kecambah sumber eksplan leaflet terhadap induksi embrio somatik pada beberapa varietas kacang tanah secara invitro. Prosiding Seminar Nasional SMAP (Sains MIPA dan Aplikasinya) 2009. Universitas Lampung. Bandar Lampung. 5 hlm.
Feng, Q. L., H. E. Patte, and H. T. Stalker. 1995. In Vitro Reproduvtive Development of Peanut, Arachis hypogaea L., as influenced by Plant Growth Regulators, Sucrose and pH. Peanut Sci. 22:135-141.
43
George, E. F. dan T. D. Sherrington. 1984. Plant Propagation by Tissue Culture. Handbook and Directionary of Commercial Laboratories. England. pp. 285—302.
Gunawan, L. W. 1988. Teknik Kultur Jaringan Tumbuhan. Institut Pertanian Bogor. Bogor. 304 hlm.
Harjadi, S. S. 2009. Zat pengatur tumbuh. Penebar swadaya. Jakarta. 76 hlm. Hasanah, R. W. Arief, dan J. Barus. 2004. Pengaruh Teknik Budidaya Terhadap
Intensitas Penyakit Karat dan Produksi Kacang Tanah. Jurnal Hama dan Penyakit Tumbuhan Tropika. 4 (2):102—105.
Iqbal, M. M., Farhat N., Javaid .I, Sadia T. and Yusuf Z. N. 2011. In Vitro Micropropagation of Peanut (Arachis hypogaea) Through Direct Somatic Embryogenesis and Callus Culture. Int. J. Agric. Biol. 13:811—814. Irawati. 2005. Pembentukan Kalus dan Embriogenesis Kultur Pelepah Daun dan
Daun Caladium Hibrida. Berita Biologi. 5 hlm.
Kamil, J. 1986. Teknologi Benih 1. Penerbit Angkasa Raya. Padang. 227 hlm. Karyanto, A. 1997. Aplikasi Teknik Kultur In Vitro Dalam Produksi Benih
Unggul. Prosiding Seminar Nasional PERAGI, Bandar Lampung, 8–9 Desember 1997:191—195.
Karyanto. A. 2009. Hormon Tanaman. Materi Kuliah Pertumbuhan dan Perkembangan Tanaman. (Tidak dipublikasikan). Universitas Lampung. Bandar Lampung. 20 hlm.
Hidayat. 2007. Induksi Pertumbuhan Eksplan Endosperm Ulin dengan IAA dan Kinetine. Agritrop. 26(4):147—152.
Manuhara, Y. S. W. 2011. Perbanyakan anthurium plowmanii croat menggunakan eksplan Daun dan tangkai daun secara in vitro. Universitas Airlangga.
Surabaya. 15 hlm.
Nurwahyuni. I dan Elimasni. 2006. Pertumbuhan dan Perkembangan Kultur Jaringan Kemenyan Sumatrana (Styrax benzoin Dryander). Jurnal Biologi Sumatera. 1(2):26—33.
Ozias-Akins, P., William F. Anderson and C. Corley Holbrook. 1992. Somatic Embryogenesis in Arachis hypogaea L.: Genotype Comparison. Plant Sci. (83):103—111.
44
Purnamaningsih, R. 2002. Regenerasi Tanaman melalui Embriogenesis Somatik dan Beberapa Gen yang Mengendalikannya. Buletin AgroBio. 5(2):51—58. Rahayu, E. S. dan Sudarsono. 2009. Varian Kualitatif Kacang Tanah Hasil Kultur
in Vitro dan Hasil Seleksi in Vitro. Biosaintifika. 1(1):33—40.
Roostika T., Ika and Ika M. 2003. In Vitro Culture of Pineapple by Organogenesis and Somatic Embryogenesis: Its Utilization and Prospect. Buletin AgroBio 6(1):3—40.
Rukmana. R. 2003. Benih Kacang Tanah. Yogyakarta. Kanisius.
Sari, J. D. 2010. Pengaruh Berbagai Bagian Benih (Sebagai Sumber Eksplan) Dengan Umur Kecambah Tiga Hari Terhadap Induksi Embrio Somatik Pada Dua Varietas Kacang Tanah (Arachis hypogaea L.). (Skripsi). Universitas Lampung. Bandar Lampung.
Sellars R. M., G. M. Shoutward, and Gregory C. Phillips. 1990. Cell Biology and Molecular Genetics – Adventitious Somatic Embryogenesis from Cultured Immature Zygotic Embryos of Peanut and Soybean. Crop Sci. 30:408—413. Sobardini, D., E. Suminar, dan Murgayanti. 2006. Perbanyakan Cepat Tanaman
Nilam (Pogostemon cablin Benth.) Secara Kultur Jaringan. Skripsi. Universitas Padjajaran.
Srilestari, R., Taryono, dan S. Trisnowati. 2004. Penggunaan Auksin dan Sukrosa untuk Induksi Embrio Somatik Kacang Tanah. Agrosains. 17(2):1—2 Suhartina. 2005. Deskripsi Varietas Unggul Kacang-kacangan dan Umbi-umbian.
Malang. Balai Penelitian Tanaman Kacang-kacangan dan Umbi-umbian. Sukmadjaja, D. 2005. Embriogenesis somatik langsung pada tanaman cendana.
Jurnal Bioteknologi Pertanian. 10(1):1—6.
Sumarjan dan A. Farid, H. 2009. Efektivitas polietilena glikol dan manitol sebagai agens penyeleksi in vitro untuk cekaman kekeringan terhadap pertumbuhan embrio somatik kacang tanah. Crop Agro. 2:30—36.
Utami, E. S. W., Sumardi I., Taryono, dan Semiarti E. 2007. Pengaruh α- Naphtaleneacetic Acid (NAA) terhadap Embriogenesis Somatik Anggrek Bulan Phalaenopsis Amabilis (L.) Bl. Biodiversitas. 8(2):295—299. Yusnita. 2003. Kultur Jaringan. Cara Perbanyakan Tanaman Secara Efisien.
V. KESIMPULAN DAN SARAN
5.1 Kesimpulan
Berdasarkan hasil pengamatan dan pembahasan, dapat diambil kesimpulan bahwa eksplan leaflet dari kecambah umur enam hari varietas Kancil dan Singa
membentuk kalus embriogenik, sebaliknya eksplan kotiledon, hipokotil dan radikula tidak membentuk kalus embriogenik. Rata-rata jumlah embrio somatik yang dihasilkan eksplan leaflet varietas Kancil pada minggu ke-4, 8, dan 12 berturut-turut adalah 0,48, 1,05, dan 2,13 embrio per eksplan dan pada varietas Singa berturut-turut adalah 0,025, 1,05, dan 2,8 embrio per eksplan. Persentase eksplan yang membentuk kalus embriogenik yang dihasilkan eksplan leaflet varietas Kancil pada minggu ke-4, 8, dan 12 berturut-turut adalah 15%, 30%, dan 40% dan pada varietas Singa berturut-turut adalah 2,5%, 22,5%, dan 37,5%.
5.2 Saran