STUDI PEMBUNGAAN DAN ISOLASI GEN APETALA1
PADA KAKAO (Theobroma cacao L.)
SAMANHUDI
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
BOGOR
Saya menyatakan bahwa disertasi yang berjudul “Studi Pembungaan dan Isolasi Gen APETALA1 pada Kakao (Theobroma cacao L.)” adalah benar-benar merupakan hasil karya saya sendiri dengan bimbingan Komisi Pembimbing dan belum pernah dipublikasikan. Semua sumber data dan informasi yang digunakan telah dinyatakan secara jelas dan dapat diperiksa kebenarannya.
Bogor, Juni 2006
RINGKASAN
SAMANHUDI 2006. Studi Pembungaan dan Isolasi Gen APETALA1 pada Kakao (Theobroma cacao L.). Di bawah bimbingan ROEDHY POERWANTO sebagai Ketua Komisi dan DJOKO SANTOSO, SOBIR dan AGUS PURWITO sebagai Anggota.
Kakao merupakan komoditas penting bagi Indonesia, baik secara ekonomi maupun sosial. Namun demikian, produktivitas perkebunan kakao di Indonesia masih rendah. Salah satu masalah yang mempengaruhi rendahnya produksi kakao tersebut adalah pembungaannya yang tidak konsisten. Pada perkebunan di daerah tropis, pohon kakao dewasa dapat berbunga sepanjang tahun, tetapi pembungaan terbesar terjadi pada saat pergantian dari musim kering ke musim hujan. Di luar musim tersebut, pembungaan pohon kakao dapat diinduksi dengan beberapa senyawa retardan. Kemajuan biologi molekuler juga telah berkontribusi secara nyata dalam menjelaskan beberapa proses biologi, termasuk proses pembungaan. Hal ini dapat membantu untuk mendapatkan solusi yang efektif berkaitan dengan masalah rendahnya produktivitas.
Tujuan penelitian ini adalah 1) untuk mendapatkan jenis dan konsentrasi senyawa penginduksi pembungaan, 2) untuk mengetahui perubahan kandungan beberapa zat endogen pada tanaman kakao selama induksi pembungaan, 3) untuk mengidentifikasi dan mengisolasi gen APETALA1 (AP1) pada kakao, 4) untuk menguji ekspresi gen AP1 pada berbagai jaringan tanaman kakao, dan 5) untuk menguji ekspresi gen TcAP1 (AP1 kakao) pada planlet tembakau sebagai tanaman model. Penelitian lapangan dilakukan di Kebun Rajamandala, Bandung, Jawa Barat mulai bulan Juli sampai dengan Nopember 2003 meng-gunakan rancangan acak kelompok dengan tujuh kali ulangan. Paklobutrazol diaplikasikan pada konsentrasi 0.5 dan 1 g bahan aktif/pohon, sedangkan CCC dengan konsentrasi 1.000 dan 2.000 ppm. Paklobutrazol dan CCC diaplikasikan dalam bentuk larutan baik secara sendirian maupun dikombinasikan dengan sukrosa 1%, dengan aplikasi melalui penyemprotan daun. Percobaan laborato-rium dilakukan di Plant Research International, Belanda dan di Balai Penelitian Bioteknologi Perkebunan Indonesia, yang meliputi isolasi RNA, RT-PCR, kloning, sekuensing, uji ekspresi gen AP1 pada berbagai jaringan tanaman kakao dan uji ekspresi gen TcAP1 pada tanaman model.
SAMANHUDI 2006. Studies on flowering and isolation of APETALA1 gene in cacao (Theobroma cacao L.). Supervised by ROEDHY POERWANTO as chairman and DJOKO SANTOSO, SOBIR and AGUS PURWITO as members of the advisory committee.
Cacao is economically and socially important commodity to Indonesia. However, productivity of cacao plantation in Indonesia is considerably low. One of problems contributing to this inferiority of production is inconsistent flowering. In tropical plantations, mature cacao trees makes flower all the time in the year, with high flowering season takes place on early rainy season. During non-flowering season, cacao non-flowering can be induced by some growth retardants. Advancement on molecular biology has contributed significantly in better under-standing on some biological processes, included of flowering process. This may help in finding an effective way to improve productivity of cacao.
The objectives of this research are to 1) examine flowering-inducing formulas, 2) determine changes of endogenous substances during flowering induction, 3) identification and isolation of APETALA1 gene in cacao, 4) assay the AP1 expression in the various cacao tissues, and 5) assay the TcAP1 (Theobroma cacao AP1) expression in tobacco plantlets. The field trials was conducted in Rajamandala plantation, Bandung, West Java from July to November 2003 using a randomized block design with seven replications. Paclobutrazol solution was applied at 0.5 and 1 g.a.i/tree and CCC at 1.000 and 2.000 ppm. Both paclobutrazol and CCC were applied alone or combined with 1% sucrose by foliar spray. The laboratory experiment was conducted in Plant Research International (PRI), Wageningen, the Netherlands and Indonesian Biotechnology Research Institute for Estate Crops, comprises of RNA isolation, RT-PCR, cloning, sequencing, assay the AP1 expression in the various cacao tissues and assay the TcAP1 expression in model plants.
STUDI PEMBUNGAAN DAN ISOLASI GEN
APETALA1
PADA KAKAO (
Theobroma cacao
L.)
SAMANHUDI
Disertasi
sebagai salah satu syarat untuk memperoleh gelar
Doktor pada
Program Studi Agronomi
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
BOGOR
Nama Mahasiswa : Samanhudi Nomor Pokok : A156010041 Program Studi : Agronomi
Disetujui Komisi Pembimbing
Prof. Dr. Ir. H. Roedhy Poerwanto, M.Sc Dr. Ir. H. Djoko Santoso, M.Sc
Ketua Anggota
Dr. Ir. Sobir, M.Si Dr. Ir. Agus Purwito, M.Sc
Anggota Anggota
Diketahui
Ketua Program Studi Agronomi Dekan Sekolah Pascasarjana
Dr. Ir. Satriyas Ilyas, M.S Dr. Ir. Khairil Anwar Notodiputro, M.S
RIWAYAT HIDUP
Penulis dilahirkan di Kudus, Jawa Tengah pada tanggal 10 Juni 1968 sebagai anak ke tujuh dari tujuh bersaudara pasangan ayah Sutono (alm) dan ibu Hj. Siti Aminah.
Pendidikan sarjana ditempuh di Jurusan Budidaya Pertanian, Fakultas Pertanian Universitas Sebelas Maret Surakarta (UNS) dan lulus tahun 1993. Pada tahun 1998, penulis melanjutkan ke program magister pada Program Studi Agronomi, Program Pascasarjana, Institut Pertanian Bogor dan lulus tahun 2001. Pada tahun 2001 itu pula penulis mendapatkan kesempatan untuk melanjutkan ke program doktor pada program studi dan perguruan tinggi yang sama, dengan beasiswa BPPS dari Departemen Pendidikan Nasional.
Penulis pernah bekerja sebagai Sarjana Pendamping Purna Waktu (SP2W) untuk Program Inpres Desa Tertinggal (IDT) BAPPENAS pada tahun 1994 sampai dengan tahun 1997. Sejak tahun 1995 penulis diangkat sebagai staf pengajar di Jurusan Budidaya Pertanian, Fakultas Pertanian Universitas Sebelas Maret Surakarta.
Puji syukur penulis panjatkan ke hadirat Allah SWT atas segala rahmat, taufik dan hidayah-Nya sehingga penelitian dan penulisan disertasi berjudul “Studi Pembungaan dan Isolasi Gen APETALA1 pada Kakao (Theobroma cacao L.)” dapat terlaksana.
Pada kesempatan ini penulis menyampaikan penghargaan dan terima kasih yang tulus kepada Bapak Prof. Dr. Ir. H. Roedhy Poerwanto, M.Sc sebagai Ketua Komisi Pembimbing, atas segala bimbingan dan arahan beliau yang cermat, terarah dan sistematis mulai dari penyusunan proposal, pelaksanaan penelitian, sampai dengan penulisan laporan disertasi ini. Penghargaan dan ucapan terima kasih yang tulus juga disampaikan kepada Bapak Dr. Ir. H. Djoko Santoso, M.Sc, Bapak Dr. Ir. Sobir, M.Si dan Bapak Dr. Ir. Agus Purwito, M.Sc sebagai Anggota Komisi Pembimbing, atas bimbingan dan saran-saran beliau yang sangat berharga untuk mempertajam pemikiran penulis dalam perencanaan dan pelaksanaan penelitian serta penulisan disertasi ini.
Ucapan terima kasih disampaikan kepada Rektor Universitas Sebelas Maret dan Dekan Fakultas Pertanian Universitas Sebelas Maret Surakarta, atas ijin dan kesempatan yang diberikan kepada penulis untuk mengikuti program doktor di Institut Pertanian Bogor. Kepada Rektor Institut Pertanian Bogor, Dekan Sekolah Pascasarjana IPB, Dekan Fakultas Pertanian IPB dan Ketua Program Studi Agronomi SPS-IPB, disampaikan terima kasih dan penghargaan atas segala fasilitas dan pelayanannya.
Agricultural Center (IAC) di Belanda, yang telah memberikan fasilitas dan biaya penelitian kepada penulis untuk melakukan penelitian di Belanda. Kepada Direktur PT Perkebunan Nusantara VIII Jawa Barat beserta staf dan Kepala Balai Penelitian Bioteknologi Perkebunan Indonesia, yang telah memberikan ijin dan fasilitas untuk penelitian ini, penulis sampaikan terima kasih. Kepada pengelola BPPS Ditjen Dikti, Departemen Pendidikan Nasional, disampaikan terima kasih atas beasiswa yang telah diberikan.
Rasa hormat dan terima kasih yang tulus penulis persembahkan kepada Ibunda Hj. Siti Aminah dan almarhum Ayahanda Sutono, beserta seluruh anggota keluarga, yang telah memberikan doa restu, dorongan, semangat dan motivasi, serta dukungan finansial. Penghargaan dan kebanggaan dengan segala ketulusan disampaikan kepada istrinda tercinta Iswatun, S.Pd dan anak-anakku tersayang Aninditya Verinda Putrinadia dan Luthfiana Nadhiifa Khoirunnisa, atas segala doa, pengorbanan, pengertian, ketabahan dan dorongan semangat yang telah diberikan selama penulis menyelesaikan pendidikan Strata-3 di Sekolah Pascasarjana IPB.
Bapak Dr. Ir. Darda Efendi, M.Si, Bapak Dr. Ir. Hasanuddin Ibrahim, Sp.I dan Bapak Prof. Dr. Ir. Bambang Sapta Purwoko, M.Sc yang telah bersedia menjadi penguji luar komisi pembimbing atas pertanyaan dan saran-saran untuk perbaikan dalam penulisan disertasi ini.
Kepada rekan-rekan mahasiswa Program Studi Agronomi, Sekolah Pascasarjana IPB, terima kasih atas kerja samanya selama ini. Kepada semua pihak yang telah membantu penulis, baik pada saat pengamatan di lapangan, analisis kimia di laboratorium maupun dalam penulisan disertasi ini yang tidak dapat penulis sebutkan satu per satu disampaikan terima kasih.
Akhirnya penulis berharap semoga laporan disertasi ini bermanfaat bagi kita semua. Semoga Allah SWT membalas kebaikan bapak, ibu dan saudara semua dan memberikan kemudahan dalam segala urusan. Amiin.
Bogor, Juni 2006
DAFTAR ISI
Halaman DAFTAR TABEL ...
DAFTAR GAMBAR ……….. DAFTAR SINGKATAN ... I. PENDAHULUAN ...………..……...
Latar Belakang ……..…………...………... Perumusan Masalah .………....……….……….... Tujuan Penelitian ………....………...……... Hipotesis Penelitian ...………...…….…………... Manfaat Penelitian ..………...………... II. TINJAUAN PUSTAKA ...……..………... Botani dan Morfologi Tanaman Kakao ...………... Fisiologi Pembungaan .……...…...……..…………... Senyawa Penginduksi Pembungaan ………...……….. Perubahan Zat Endogen selama Induksi Pembungaan ... Studi Molekuler Pembungaan .………...………... III. INDUKSI PEMBUNGAAN PADA TANAMAN KAKAO ...
Abstrak ... Pendahuluan ... Bahan dan Metode ... Bahan Tanaman ... Prosedur Pelaksanaan ... Hasil dan Pembahasan ... Kesimpulan ... IV. PERUBAHAN KANDUNGAN BEBERAPA ZAT ENDOGEN PADA
KAKAO ... Perancangan Primer Heterologous Spesifik AP1 ... Sintesis First-Strand cDNA Bunga Kakao ... Reverse Transcriptase PCR (RT-PCR) ………..…………. Ekstraksi dan Purifikasi AP1 …... Kloning AP1 ke dalam Vektor pGEM-T Easy .………... Miniprep DNA Plasmid ...………... Sekuensing dan Analisis Hasil Sekuensing ……..……….. Hasil dan Pembahasan ... Isolasi AP1 dari Jaringan Bunga Kakao ... Analisis Sekuen AP1 dari Tanaman Kakao ... Kesimpulan ... VI. UJI EKSPRESI GEN APETALA1 PADA BERBAGAI JARINGAN
VIII. PEMBAHASAN UMUM ...
IX. KESIMPULAN DAN SARAN ... Kesimpulan ... Saran ...
DAFTAR PUSTAKA ... LAMPIRAN ... GLOSSARY ...
116
130 130 131
132 143 156
Halaman 1
2
Rata-rata saat muncul bunga pertama, waktu berbunga, jumlah tandan bunga, jumlah bunga, saat muncul pentil pertama, jumlah pentil total, persentase pentil layu, jumlah pentil sehat, jumlah tunas, panjang tunas dan jumlah daun pada tanaman kakao yang diinduksi pembungaannya ... Seleksi koloni hasil transformasi AP1 ke dalam vektor kloning ...
38 81
DAFTAR GAMBAR
Kerangka studi pembungaan dan isolasi gen APETALA1 pada tanaman kakao serta target yang akan dicapai ... Lokasi penghambatan biosintesis giberelin oleh CCC dan paklo-
butrazol (Rademacher 1995; Williams et al. 1999) ... Alur genetik perkembangan bunga pada Arabidopsis (Blazquez 2000) ...………...………... Grafik perkembangan jumlah bunga kakao ... Grafik perkembangan jumlah pentil total ... Grafik perkembangan jumlah pentil sehat ... Penampilan bunga kakao pada 24 HSP (Hari Setelah Perlakuan) .. Penampilan bunga kakao pada 12 HSM (Hari Setelah Muncul) ... Kandungan giberelin bantalan bunga kakao pada 0 dan 3 MSP ... Kandungan sukrosa bantalan bunga kakao pada 0 dan 3 MSP ... Kandungan karbohidrat bantalan bunga kakao pada 0 dan 3 MSP .. Kandungan nitrogen bantalan bunga kakao pada 0 dan 3 MSP ... Nisbah C/N bantalan bunga kakao pada 0 dan 3 MSP ... Hasil elektroforesis RNA total bunga kakao ... Hasil RT-PCR cDNA bunga kakao ... Hasil miniprep DNA plasmid ... Hasil digesti DNA plasmid dengan enzim EcoRI ... Sekuen nukleotida full-length AP1 pada tanaman kakao (824 pb) ... Hasil BLASTN sekuen nukleotida AP1 kakao (824 pb) ... Hasil BLASTP sekuen asam amino AP1 kakao (241 aa) ... Hasil alignment sekuen asam amino AP1 kakao dengan beberapa spesies lain menggunakan Program ClustalW ...
23
24
25 26
27 28
29 30 31
Hasil analisis phylogenetic tree antara protein TcAP1 (AP1 kakao) dengan protein MADS-box lain menggunakan Program TreeView .. Hasil elektroforesis RNA total dari berbagai jaringan tanaman kakao ... Ekspresi AP1 pada berbagai jaringan tanaman kakao ... Pengujian PCR spesifik TcAP1 terhadap DNA genomik planlet tembakau ... Morfologi kultur planlet tembakau setelah transformasi genetik ... Hasil RT-PCR spesifik TcAP1 terhadap RNA total daun planlet tembakau ... Planlet tembakau in vitro pada umur 3.5 bulan ... Diagram model gen ABC (Yanofsky 1995) ... Bunga kakao dan diagram susunan organ bunga ...
90
98 100 110
112
113 115 124 125
DAFTAR SINGKATAN
CTAB = Cetyltrimethyl Ammonium Bromide
DNA = Deoxyribo Nucleic Acid
dNTP = Deoxynucleoside Triphosphate
dpl = Diatas permukaan laut
DTT = Dithiothreitol
EB = Extraction Buffer
EDTA = Ethylenediamine Tetraacetic
EMBL-EBI = European Molecular Biology Laboratory – European Bioinformatics Institute
EMF = EMBRIONIC FLOWER
FBP = FLORAL BINDING PROTEIN
GA3 = Gibberellic Acid
HPLC = High Performance Liquid Chromatography
LLSEP3 = Lilium longiflorum SEPALLATA3
MADS = MCM1 AGAMOUS DEFICIENS SRF MdMADS = Malus domestica MADS
MgCl2 = Magnesium Chloride
MQ = MilliQ grade water
mRNA = Messenger RNA
MS media = Murashige & Skoog media
MSP = Minggu Setelah Perlakuan
NaCl = Natrium Chloride
NCBI = National Center for Biotechnological Information
NEB buffer = New England Biolabs buffer
NtAP1 = Nicotiana tabacum APETALA1 NtLFY = Nicotiana tabacum LEAFY
O/N = Overnight
pb = Pasang basa
PCR = Polymerase Chain Reaction
PE buffer = Polyethylene buffer
pH = Power of hydrogen
PI = PISTILLATA
ppm = Part per million
PVPP = Polyvinyl Polypyrollidone
RB = Right border
RNA = Ribonucleic Acid
RNase = Ribonuclease
rpm = Rotations per minute
RT-PCR = Reverse Transcriptase – Polymerase Chain Reaction
SEP3 = SEPALLATA3
Taq = Thermophilus aquaticus
TBM = Tanaman Belum Menghasilkan
TcAG = Theobroma cacao AGAMOUS TcAP1 = Theobroma cacao APETALA1 TFL1 = TERMINAL FLOWER1 UAH = Upper Amazone Hybrid
X-Gal = 5-bromo-4-chloro-3-indolyl-β-D-galactopyranoside
I. PENDAHULUAN
Latar Belakang
Tanaman kakao (Theobroma cacao L.) merupakan salah satu komoditas perkebunan yang perkembangannya sangat pesat, terutama perkebunan rakyat dan perkebunan swasta. Potensi pengembangan kakao di Indonesia cukup besar, baik sumber daya yang dimiliki, teknologi yang dikuasai, maupun peluang pasar dalam dan luar negeri yang akan terus berkembang pada masa yang akan datang.
Kakao merupakan salah satu komoditas ekspor Indonesia yang penting, karena Indonesia merupakan negara penghasil kakao terbesar ke dua di dunia setelah Pantai Gading. Areal tanaman kakao yang diusahakan di Indonesia pada tahun 2003 seluas 961.107 ha dengan total produksi sebesar 695.361 ton serta tingkat produktivitasnya sebesar 723.5 kg/ha/tahun (Departemen Pertanian 2006). Salah satu usaha untuk meningkatkan produksi kakao yaitu dengan meningkatkan produktivitasnya. Produktivitas kakao di Indonesia masih memungkinkan untuk ditingkatkan karena didukung oleh tersedianya tenaga kerja yang banyak serta teknologi yang cukup.
Pembungaan pada tanaman kakao perlu mendapatkan perhatian karena pada bulan-bulan tertentu bunganya sangat banyak tetapi pada bulan-bulan yang lain bunganya sangat sedikit. Pada saat tidak berbunga atau bunganya sedikit tersebut, tanaman kakao dapat ditingkatkan pembungaannya misalnya dengan menggunakan senyawa penginduksi pembungaan. Pada Arabidopsis thaliana, pembungaan dapat diinduksi dengan menggunakan senyawa giberelin (Blazquez 2000). Hal ini berlawanan dengan induksi pembungaan pada pohon buah-buahan, dimana induksi pembungaan pada pohon buah-buahan dan tanaman berkayu lainnya berkorelasi negatif dengan aktivitas giberelin. Karena itu penggunaan zat-zat yang bersifat anti giberelin diharapkan dapat merangsang pembungaan (Poerwanto et al. 1997). Giberelin endogen yang berperan sebagai penghambat pembungaan dapat berasal dari buah, biji, tunas dan daun, dan hal ini dapat dikurangi aktivitasnya dengan mengaplikasikan senyawa anti giberelin seperti paklobutrazol (Kulkarni 1995).
3
Terhambatnya produksi giberelin menyebabkan penurunan laju pembelahan sel dan diferensiasi sel, sehingga pertumbuhan vegetatif menjadi menurun dan fotosintat yang terbentuk dialihkan ke pertumbuhan reproduktif yang diperlukan untuk pembentukan bunga, buah dan perkembangan buah (Gianfagna 1995; Rademacher 1995; Yuceer et al. 2003).
Chlormequat chloride (Chlorocholine chloride, CCC) juga mempunyai pengaruh yang berlawanan dengan GA3 terhadap pertumbuhan dan per-kembangan tanaman. GA3 meningkatkan pertumbuhan tunas dan menghambat pembungaan dan infloresen, sedangkan CCC menghambat pertumbuhan dan mempercepat pembungaan. Pengaruh CCC dapat menghambat pertambahan tinggi tanaman dan panjang infloresen, dan meningkatkan jumlah tunas lateral, infloresen dan bunga (Hamza dan Helaly 1983). Sebagai senyawa anti giberelin, CCC telah terbukti berperan positif terhadap pembungaan dan pengaturan fase vegetatif dari berbagai tanaman hias maupun tanaman berkayu. Pada Lantana, aplikasi CCC dapat mengurangi luas daun dan meningkatkan produksi bunga (Matsoukis et al. 2004). Pada cabai, hasil tanaman yang diperlakukan dengan CCC juga meningkat tajam dan hal ini diduga karena adanya penghambatan pertumbuhan vegetatif (Belakbir et al. 1998).
intensif selama lebih dari sepuluh tahun terakhir. Pengaruh senyawa seperti karbohidrat dan fitohormon telah banyak dilaporkan. Melalui pendekatan genetika molekuler, pada Arabidopsis juga telah berhasil diidentifikasi dan kloning beberapa gen yang terlibat dalam pengaturan transisi pembungaan.
Pada Arabidopsis, APETALA1 (AP1) dan LEAFY (LFY) merupakan dua gen kunci yang berperan dalam proses inisiasi pembungaan (Irish 1999; Wada dan Kotoda 2003). Mutasi pada salah satu gen tersebut dapat mengakibatkan perubahan bunga menjadi meristem vegetatif (Irish 1999). Ekspresi LFY dapat mengubah meristem vegetatif menjadi meristem bunga, sebagaimana yang diakibatkan oleh ekspresi AP1 (Mandel dan Yanofsky 1995; Weigel dan Nilsson 1995). Selama fase vegetatif, LFY endogen hanya diekspresikan pada level yang rendah, dan pada saat terjadi perubahan dari fase vegetatif ke perkembangan reproduktif ekspresi LFY tersebut meningkat, yang diikuti oleh peningkatan ekspresi AP1 (Blazquez et al. 1997). Jadi, LFY mengatur transisi ke perkembangan bunga, paling tidak dengan menginduksi ekspresi AP1 pada daerah meristem tunas apikal yang membentuk primordia bunga (William et al. 2004).
5
Pada tanaman kakao, kurangnya informasi mengenai mekanisme pembentukan dan perkembangan bunga secara molekuler merupakan salah satu kendala dalam memperbaiki produktivitasnya. Melalui aplikasi paklobutrazol, CCC dan sukrosa untuk menginduksi pembungaan kakao diharapkan senyawa-senyawa tersebut dapat mengaktifkan gen-gen pembungaan pada kakao, termasuk gen APETALA1. Dengan demikian diharapkan dapat membuka peluang untuk melakukan identifikasi dan karakterisasi lebih lanjut terhadap gen-gen pembungaan pada kakao.
Perumusan Masalah
Studi perubahan kandungan beberapa zat endogen selama induksi pembungaan
(Percobaan 2)
Secara fisiologi dapat mengakibatkan perubahan kandungan beberapa zat endogen dan secara molekuler dapat mengaktifkan gen-gen pembungaan seperti : LEAFY, APETALA1, CAL, dll
Identifikasi dan isolasi gen APETALA1
pada tanaman kakao (Percobaan 3)
Uji ekspresi AP1 pada berbagai jaringan tanaman kakao (Percobaan 4)
Diketahui perubahan kandungan beberapa zat endogen selama induksi pembungaan
Didapatkan full-lengthAP1
Dapat menjelaskan ekspresi AP1 pada berbagai jaringan tanaman kakao
Uji ekspresi AP1 kakao pada tanaman model (Percobaan 5)
Dapat menjelaskan ekspresi dan fungsiAP1kakao pada spesies lain pembungaan tanaman kakao
(Percobaan 1)
Pembungaan Tanaman Kakao :
● Terjadi sepanjang tahun ● Polanya sangat bervariasi ● Dapat diinduksi dari luar
6
7 Tujuan Penelitian
Tujuan Umum :
Mengembangkan metode dasar bagi peningkatan produksi kakao di luar musim dan mempelajari gen yang terlibat dalam pembungaan kakao.
Tujuan Khusus :
1. Mendapatkan jenis dan konsentrasi senyawa yang tepat untuk menginduksi pembungaan tanaman kakao.
2. Mengetahui perubahan kandungan beberapa zat endogen pada tanaman kakao selama induksi pembungaan.
3. Mengidentifikasi, mengisolasi dan kloning gen pembungaan (APETALA1) pada tanaman kakao.
4. Menguji tingkat ekspresi gen APETALA1 pada berbagai jaringan tanaman kakao.
5. Menguji ekspresi gen APETALA1 kakao pada tanaman model.
Hipotesis Penelitian
1. Pembungaan tanaman kakao dapat diinduksi oleh senyawa retardan secara eksogen dengan konsentrasi tertentu.
2. Terjadi perubahan kandungan beberapa zat endogen pada tanaman kakao selama induksi pembungaan.
3. Gen APETALA1 dapat diidentifikasi dengan PCR menggunakan primer heterologous dan diklon dengan vektor pGEM-T.
4. Gen APETALA1 diekspresikan secara diferensial pada berbagai jaringan tanaman kakao.
Manfaat Penelitian
II. TINJAUAN PUSTAKA
Botani dan Morfologi Tanaman Kakao
Tanaman kakao (Theobroma cacao L.) termasuk tanaman kaulifloral,
yaitu jenis tanaman yang membentuk bunga dan buah pada batang dan cabang
yang tua. Tanaman kakao dapat tumbuh pada dataran rendah tropis dengan
ketinggian hingga 1.000 m dpl, dimana temperatur rendah merupakan faktor
pembatas. Tanaman kakao juga memerlukan curah hujan yang merata
sepanjang tahun dengan minimal 90-100 mm per bulan. Kakao dapat tumbuh
dengan baik pada tanah dengan kisaran pH 6.0-7.0 (Pusat Penelitian Kopi dan
Kakao Indonesia 2004).
Kakao merupakan tanaman dikotil tahunan dari famili Sterculiaceae dan
mempunyai jumlah kromosom 2n = 20. Tanaman dewasa dapat mencapai tinggi
6-9 m. Bunga kakao berwarna merah muda sampai putih, reguler, hermafrodit
dan memiliki lima sepal, lima petal, 10 stamen yang tersusun dalam dua
lingkaran, dan sebuah ovari superior yang merupakan gabungan dari lima carpel.
Bunga kakao muncul secara bergerombol pada bantalan bunga, yaitu jaringan
yang menebal yang terbentuk pada ketiak bekas menempelnya tangkai daun.
Sejak bakal bunga muncul pada bantalan tersebut sampai bunga mekar
diperlukan waktu sekitar 30 hari. Bila pada saat mekar bunga tidak mengalami
penyerbukan, maka bunga akan segera gugur (Tjasadihardja 1987).
Iklim merupakan salah satu faktor yang berpengaruh terhadap pola
pembentukan bunga. Pola curah hujan di suatu daerah dapat menentukan pola
pertumbuhan vegetatif dan generatif tanaman kakao. Bunga kakao dapat
terbentuk sepanjang tahun tetapi intensitas pembentukannya beragam dari waktu
berikutnya. Di Pulau Jawa, musim pembungaan besar biasanya dimulai pada
bulan Nopember (awal musim hujan) dan berlangsung terus sampai bulan
Juni, dengan puncak pada bulan Desember-Januari. Pembungaan besar
tersebut akan menghasilkan panen besar pada bulan Mei-Juni. Peningkatan
pembentukan bunga selama musim hujan diduga berkaitan juga dengan
pergantian dari lingkungan kering selama musim kemarau ke lingkungan basah
selama musim hujan (Tjasadihardja 1987).
Meskipun tanaman kakao dapat berbunga berkali-kali sepanjang tahun,
tetapi pembungaan yang utama terjadi pada saat hujan pertama setelah musim
kering. Tanaman mulai berbunga setelah berumur dua tahun sejak tanam, dan
untuk mencapai buah matang diperlukan waktu 5-6 bulan setelah polinasi. Buah
yang telah masak dinamakan pod dan ukurannya dapat mencapai diameter
10 cm dan panjang 30 cm. Biji kakao kaya akan karbohidrat dan lemak,
sehingga merupakan sumber energi yang baik. Kakao juga mengandung
senyawa theobromin yang secara kimia dapat dikonversi menjadi kafein yang
dapat digunakan untuk minuman maupun keperluan kesehatan. Selain itu kakao
juga mengandung senyawa antioksidan (Mims 1998). Karena itu pemanfaatan
biji kakao tidak hanya untuk memenuhi bahan makanan, tetapi juga untuk
keperluan farmasi (Potts 2002).
Faktor musim terutama musim kemarau mempengaruhi perkembangan
dan produksi tanaman kakao. Pada musim kemarau intensitas cahaya matahari
sangat tinggi karena derajat awan rendah, kelembaban udara sangat rendah,
sebaliknya temperatur lingkungan meningkat sangat tajam, sehingga tanaman
kakao mengalami cekaman air (Suhadi 2002). Dalam kondisi seperti ini tanaman
11
Fisiologi Pembungaan
Pembungaan tanaman merupakan kejadian fisiologis yang kompleks
yang secara morfologi terjadi perubahan dari fase vegetatif menuju terbentuknya
organ-organ bunga. Proses pembentukan bunga tersebut secara garis besar
terdiri atas empat tahap yaitu inisiasi bunga, diferensiasi bunga, pendewasaan
bunga dan anthesis. Dari keempat tahap tersebut, fase inisiasi bunga merupakan
fase yang paling kritis dari pembungaan yang merupakan proses biokimia dari
fase vegetatif ke arah reproduktif, namun secara morfologi tidak nampak
(Ryugo 1988).
Terdapat beberapa konsep yang mendasari para peneliti mempelajari
proses pembungaan. Konsep pertama yaitu konsep nutrisi yang menerangkan
bahwa pembungaan dikontrol oleh keseimbangan karbohidrat dan nitrogen atau
nisbah C/N (konsep Kraus and Kraibill), dan konsep yang kedua yaitu konsep
hormonal yang menjelaskan bahwa proses pembungaan pada tanaman tertentu
diatur oleh zat pendorong pembungaan (florigen). Hormon ini diproduksi oleh
daun kemudian ditranslokasi ke sebagian tunas yang akan memproduksi organ
generatif (Ryugo 1988). Analisis nisbah C/N pada Sinapsis alba dan Arabidopsis
yang sedang diinduksi bunganya, menunjukkan bahwa nisbah C/N pada cairan
floem meningkat dengan nyata dan cepat, yang mengindikasikan bahwa
penurunan suplai N dan peningkatan C organik ke meristem apikal merupakan
kejadian penting pada transisi pembungaan (Corbesier et al. 2002).
Dalam pembungaan tanaman, transisi dari fase pertumbuhan vegetatif ke
fase reproduktif merupakan proses perkembangan yang kritis, yang ditandai oleh
sejumlah perubahan pada apeks tunas pada tingkat molekuler, fisiologi dan
morfologi. Dengan kondisi lingkungan yang dapat menginduksi dan kemampuan
berkembang menjadi meristem reproduktif, yang mana dapat secara langsung
menjadi infloresen dan kemudian menghasilkan banyak bunga (Immink et al.
1999). Pada kebanyakan tanaman, faktor lingkungan (terutama panjang hari dan
temperatur) berperan mengendalikan transisi dari meristem vegetatif ke meristem
bunga. Meristem vegetatif menjadi meristem infloresen yang selanjutnya akan
membentuk satu atau lebih meristem bunga (Staveley 2005).
Dalam kondisi yang menginduksi pembungaan, meristem tunas utama
dari tanaman Arabidopsis menghasilkan meristem bunga lebih cepat daripada meristem daun yang mengapitnya. Selama fase vegetatif, meristem tunas utama
dari Arabidopsis menghasilkan daun roset dengan jarak yang sangat dekat.
Transisi ke fase reproduksi, yang dikontrol dengan ketat oleh jaringan kompleks
dari gen pengontrol waktu pembungaan, dipengaruhi oleh sinyal lingkungan,
seperti panjang hari, kualitas cahaya dan temperatur, sebagaimana faktor
internal seperti umur tanaman.
Pada beberapa spesies, waktu pembungaan terutama dipengaruhi oleh
faktor lingkungan yang memberikan kondisi pertumbuhan yang baik untuk
reproduksi seksual dan pemasakan biji. Faktor ini meliputi fotoperiod atau
panjang hari, kualitas cahaya, kuantitas cahaya, vernalisasi, dan ketersediaan
nutrisi dan air. Pembungaan dapat juga diinduksi oleh stres seperti defisiensi
nutrisi, kekeringan dan kerapatan tanaman (Levy dan Dean 1998). Sementara
itu Ratcliffe dan Riechmann (2002), mengatakan bahwa transisi pembungaan
merupakan proses yang plastis, yang selain dipengaruhi oleh faktor endogen
juga faktor lingkungan, yang meliputi panjang hari, kualitas cahaya, temperatur,
stres biotik dan stres abiotik.
Aplikasi GA jarang efektif untuk menginduksi pembungaan pada tanaman
short-day. Pada umumnya GA menghambat pembungaan pada tanaman
13
(Pharis dan King 1985). Pada satsuma mandarin (Citrus unshiu Marc.), GA1+3
dapat menghambat pembentukan kuncup bunga. GA eksogen memperlihatkan
penghambatan terhadap pembentukan kuncup bunga tidak hanya pada citrus,
tetapi juga pada apel, pear, cherrie dan peach. Bahkan tidak hanya GA eksogen
yang menghambat, tetapi GA endogen juga menurunkan pembentukan kuncup
bunga (Koshita et al. 1999).
Berdasarkan pada penelitian-penelitian di atas, maka dalam pengaturan
pembungaan diperlukan zat yang dapat menghambat biosintesis giberelin yang
kemudian disebut retardan. Namun demikian, pemberian retardan selain
mendorong pembungaan juga dapat mengakibatkan dormansi tunas. Untuk itu
diperlukan usaha pemecahan dormansi pada tunas yang sudah terinduksi
bunganya.
Senyawa Penginduksi Pembungaan
Zat penghambat tumbuh (retardan) merupakan zat yang mempunyai
efek fisiologis memperlambat pertumbuhan vegetatif dan dapat mendorong
pembungaan pada tanaman tertentu yaitu dengan menghambat pembelahan dan
pembesaran sel subapikal. Retardan ini menghambat sintesis giberelin, sehingga
akan menghambat pembelahan dan pembesaran sel (pertumbuhan vegetatif)
dan mendorong pertumbuhan generatif.
Dari kelompok senyawa triazol yang digunakan untuk meginduksi
pembungaan pada tanaman berkayu, paklobutrazol adalah yang paling umum
digunakan (Meilan 1997). Dasar teori penggunaan paklobutrazol adalah bahwa
senyawa ini dapat menghambat biosintesis giberelin. Paklobutrazol menghambat
biosintesis giberelin pada oksidasi ent-kaurene menjadi ent-kaurenoic acid
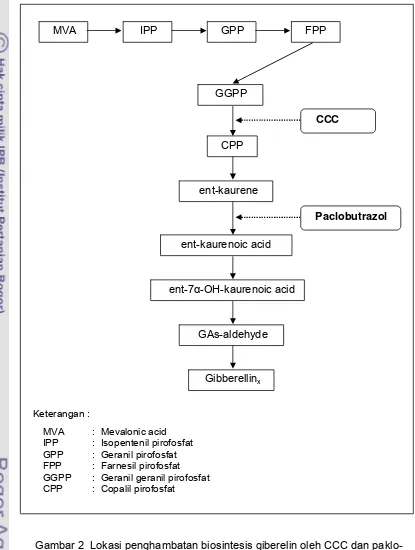
(Gambar 2). Hasil penelitian yang dilakukan oleh William dan Edgerton (1983)
25 tahun dengan dosis 2 g/m2 melalui penyiraman akar dapat mengendalikan pertumbuhan vegetatif dan meningkatkan hasil.
Hasil serupa terjadi pada tanaman Eucalyptus nitens dan E. globulus,
suatu tanaman berkayu yang berbunga secara biennial atau sporadis, dengan
aplikasi paklobutrazol melaui penyiraman, penyemprotan lewat daun, atau injeksi
batang ternyata dapat menginduksi inisiasi kuncup bunga. Paklobutrazol juga
diketahui dapat menurunkan level giberelin endogen pada beberapa spesies,
meningkatkan aktivitas reproduktif, menekan pertambahan tinggi dan produksi
daun (Hasan 1993; Moncur dan Hasan 1994). Karena itu induksi pembungaan
dengan paklobutrazol merupakan metode praktis dalam memacu pembungaan
untuk keperluan pemuliaan dan produksi biji.
Perlakuan paklobutrazol dapat menyebabkan pembungaan pada pohon
durian. Aplikasi senyawa paklobutrazol dengan dosis 15 g/pohon dapat
menghasilkan pembungaan secara nyata pada pohon durian (Utama 2003).
Aplikasi paklobutrazol juga dapat meningkatkan kandungan karbohidrat dalam
jaringan kayu. Kandungan karbohidrat ini merupakan sumber energi untuk
pembentukan bunga. Namun secara tidak langsung aplikasi paklobutrazol
dapat meningkatkan biosintesis asam absisat (ABA), sehingga mengakibatkan
terjadinya dormansi tunas. Untuk itu diperlukan penyemprotan dengan zat
pemecah dormansi sesudah aplikasi paklobutrazol (Usman 1997).
Pada tanaman mangga, perlakuan paklobutrazol mampu menginduksi
pembungaan di luar musim dengan cara menghambat biosintesis giberelin
sehingga dapat menstimulir pembungaan dan meningkatkan munculnya tunas
reproduktif. Perlakuan paklobutrazol dengan dosis 1.0 g bahan aktif/pohon dan
waktu pemberian ethephon 60 hari sesudah aplikasi paklobutrazol mempunyai
15
jumlah ranting berbunga, meningkatkan jumlah malai normal dan meningkatkan
jumlah bunga sempurna (Usman 1997).
Keterangan :
MVA : Mevalonic acid IPP : Isopentenil pirofosfat GPP : Geranil pirofosfat FPP : Farnesil pirofosfat GGPP : Geranil geranil pirofosfat CPP : Copalil pirofosfat
MVA IPP GPP FPP
GGPP
CCC
CPP
ent-kaurene
Paclobutrazol
ent-kaurenoic acid
ent-7α-OH-kaurenoic acid
GAs-aldehyde
Gibberellinx
Aplikasi paklobutrazol pada tanaman mangga juga dapat menyebabkan
dormansi mata tunas yang berkepanjangan, sehingga mata tunas yang mungkin
sudah terinduksi menjadi bakal bunga tersebut tidak segera muncul. Karena itu,
penyemprotan dengan zat pemecah dormansi setelah aplikasi paklobutrazol
diharapkan dapat mempercepat munculnya bunga dan meningkatkan jumlah
bunga. Terdapat beberapa bahan kimia yang dapat memecahkan dormansi
pada pohon buah-buahan, diantaranya yang telah berhasil mempercepat
munculnya bunga dan meningkatkan jumlah bunga pada tanaman jeruk siem,
yaitu ethephon 200 ppm, KNO3 20 g/l atau BA 100 ppm, yang disemprotkan pada
1-2 bulan setelah aplikasi paklobutrazol (Poerwanto dan Susanto 1996).
Aplikasi paklobutrazol didasarkan pada ukuran kanopi pohon dan
biasanya dengan kisaran dosis 1.0-1.5 g bahan aktif per pohon (Nartvaranant
et al. 2000). Pada pohon lychee, aplikasi paklobutrazol melalui penyiraman
tanah dengan dosis 1.0 atau 1.5 g b.a./m2 dapat mengurangi terjadinya flush
selama periode pembungaan dibandingkan dengan kontrol (Chaitrakulsub et al.
1992). Pada pohon E. nitens, paklobutrazol dan juga CCC dapat mengontrol
pertumbuhan vegetatif dan merangsang pembungaan, serta menurunkan level
GA1 dan GA20 pada apeks sebagai akibat terjadinya penghambatan biosintesis
GA pada daerah tersebut (Williams et al. 1999).
Chlormequat chloride (CCC) juga merupakan senyawa yang bersifat anti
giberelin, yang menghambat biosintesis giberelin pada tahap pembentukan
copalil pirofosfat dari geranil geranil pirofosfat (Gambar 2). Pemberian CCC
dapat menurunkan pertumbuhan batang, daun dan stolon, tetapi dapat memacu
pengumbian kentang (Sharma et al. 1998). Penyemprotan CCC juga dapat
meningkatkan kandungan gula pereduksi, pati dan sukrosa pada batang.
Sukrosa merupakan salah satu produk akhir dari proses fotosintesis dan
17
tanaman. Menurut Latimer et al. (2001), CCC biasanya diaplikasikan melalui
foliar-spray dengan konsentrasi 1.500 sampai 3.000 ppm. Pada Hibiscus, aplikasi
CCC dengan konsentrasi 1.000 ppm dapat memacu pembungaan lebih awal dan
menghasilkan jumlah bunga yang lebih banyak.
CCC secara signifikan menghambat pertumbuhan tunas pada mangga,
baik pada tanaman muda maupun pada tanaman dewasa. Pengaruh perlakuan
CCC terhadap penurunan pertumbuhan terjadi lebih nyata pada tanaman
dewasa daripada pada tanaman yang masih muda. Lebih lanjut, penghambatan
pemanjangan tunas secara linier terjadi pada pohon dewasa dan muda dengan
konsentrasi CCC yang lebih tinggi. Penurunan pemanjangan secara linier pada
tanaman dewasa terjadi dengan perlakuan CCC 2.000 ppm, sedangkan pada
tanaman muda dengan konsentrasi CCC 4.000 ppm. CCC menyebabkan
penurunan produksi giberelin pada daun muda yang pada akhirnya akan
menurunkan produksi auksin pada meristem apikal (Maiti et al. 1972).
Pemberian CCC pada berbagai tanaman dapat memperbaiki
pem-bungaan dan membuat tanaman lebih kompak, dengan pertumbuhan tunas yang
seragam. Pada tanaman jeruk, ketika senyawa penghambat tumbuh tersebut
digunakan untuk menstimulasi hasil pada pohon muda, maka pengaruhnya
terhadap pemanjangan dan vigor menjadi kurang efektif dan sebaliknya akan
memacu pembungaan dan pembentukan buah. Aplikasi CCC dengan
konsentrasi 500, 1.500, dan 3.000 ppm pada pohon jeruk muda yang berumur
11 bulan dapat menginduksi saat pembungaan yang lebih cepat dan
memperbaiki pembentukan buah. Penurunan pemanjangan tunas pada tanaman
yang diperlakukan dengan CCC dapat menghasilkan penampilan pohon yang
kompak. Dengan perlakuan CCC, pembentukan buah diinisiasi lebih awal dan
hasil akhir juga meningkat. Buah dari tanaman yang diperlakukan dengan CCC
tanaman kontrol. Kandungan bahan kering buah sebagai bagian dari bahan
kering total menjadi meningkat, dan hanya terjadi penurunan yang relatif kecil
pada daun dan akar. Penurunan total bahan kering yang dihasilkan per tanaman
secara keseluruhan hanya terjadi pada konsentrasi CCC yang paling tinggi
(3.000 ppm), tetapi distribusi relatif dari bahan kering ke berbagai bagian
tanaman dipengaruhi oleh CCC pada semua level (Salomon 1981).
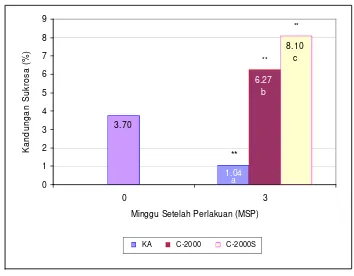
Studi fisiologi menunjukkan bahwa terdapat biomolekul kecil yang terlibat
dalam transisi pembungaan. Molekul tersebut meliputi gula, sitokinin dan
giberelin (GA). Studi pada Sinapsis alba, setelah induksi pembungaan,
konsentrasi molekul tersebut pada apeks meningkat dengan cepat dan nyata
(Bernier et al. 1993). Hal ini membuktikan bahwa secara genetik pembungaan
dikontrol oleh gula (Levy dan Dean 1998). Pada Arabidopsis, GA dapat memacu
pembungaan paling tidak dalam mengaktifkan ekspresi LFY. Blazquez et al.
(1998) juga menganalisis pengaruh langsung dari GA dengan dan tanpa sukrosa
terhadap aktivitas promoter LFY. Perlakuan GA saja tidak memberikan
pengaruh, perlakuan sukrosa saja menghasilkan sedikit peningkatan, sedangkan
jika keduanya diberikan secara bersamaan dapat memberikan pengaruh
sinergis (Levy dan Dean 1998). Meilan (1997) juga melaporkan bahwa
karbohidrat endogen memainkan peranan dalam mengontrol induksi
pembungaan pada pohon buah-buahan. Karbohidrat dapat merefleksikan status
metabolit dari suatu tanaman. Hubungannya dengan proses pembungaan,
bahwa sukrosa ini akan menstimulasi ekspresi LFY yang selanjutnya akan
menstimulasi pembungaan (Zufall 2002).
Walaupun gula telah diketahui dapat memacu transisi pembungaan pada
beberapa spesies tanaman, tetapi dalam konsentrasi yang tinggi (5%) sukrosa
19
transisi pembungaan disebabkan oleh bertambahnya fase vegetatif, yang
diakibatkan oleh lambatnya aktivasi ekspresi LFY. Konsentrasi sukrosa 1%
dapat memacu transisi pembungaan dari mutan yang lambat berbunga. Hasil ini
menunjukkan bahwa gula dapat mempengaruhi transisi pembungaan dengan
mengaktifkan gen yang berperan mengontrol transisi pembungaan, bergantung
pada konsentrasi gula, latar belakang genetik tanaman dan kapan gula tersebut
diberikan (Ohto et al. 2001).
Perubahan Zat Endogen selama Induksi Pembungaan
Pada spesies tertentu pertumbuhan batang dan daun terhenti pada saat
terjadi pembungaan. Alokasi asimilat pada tanaman yaitu untuk pertumbuhan
vegetatif yang meliputi pertumbuhan akar, batang dan daun, dan pertumbuhan
reproduktif yang meliputi pembentukan bunga, buah dan biji. Fase induksi dalam
proses pembungaan merupakan fase paling penting yang menentukan apakah
tanaman tersebut akan berbuah atau tidak. Pada fase ini terjadi perubahan
fisiologis atau biokimia pada mata tunas dari pertumbuhan vegetatif menuju
pertumbuhan generatif. Perubahan fisiologis atau biokimia yang terjadi pada fase
induksi pembungaan tersebut antara lain meliputi perubahan kandungan
karbohidrat, nitrogen, asam amino dan hormon (Poerwanto 2003).
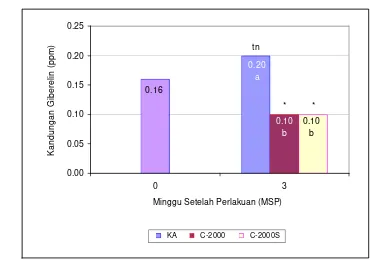
Giberelin merupakan salah satu hormon yang berperanan penting pada
proses pembungaan tanaman. Giberelin adalah faktor endogen yang dapat
menghambat pembungaan jeruk disamping beberapa pohon buah-buahan
lainnya, dan induksi bunga tersebut memerlukan penurunan aktivitas hormon
giberelin (Krajewski dan Rabe 1995). Aktivitas zat mirip giberelin pada daun jeruk
Satsuma yang terinduksi bunganya lebih rendah daripada yang tidak terinduksi
bahwa perangsangan pembungaan dapat dilakukan dengan perlakuan yang
menghambat biosintesis giberelin (Koshita et al. 1999).
Krajewski dan Rabe (1995) menyebutkan bahwa pembungaan pada jeruk
meliputi banyak proses fisiologi. Salah satu proses fisiologi tersebut adalah yang
berkaitan dengan hormon giberelin. Giberelin secara endogen dapat menjadi
penghambat pembungaan bagi tanaman. Berdasarkan studi pembungaan pada
jeruk, ditemukan senyawa GA1 dan GA4 terdapat dalam konsentrasi yang lebih
tinggi pada pucuk vegetatif dibandingkan pada pucuk berbunga. Disamping itu
kedua jenis giberelin tersebut ditemukan pada konsentrasi yang rendah pada
saat terjadinya pembungaan. Salah satu fungsi fisiologis giberelin adalah
pemanjangan batang dan meningkatkan pertumbuhan daun-daun muda dengan
meningkatkan aktivitas pemanjangan dan pembelahan sel. Kandungan giberelin
yang tinggi dapat meningkatkan aktivitas pertumbuhan vegetatif berupa
pemanjangan tunas dan pertumbuhan sel pada jaringan meristem (Hooley 1994).
Pada manggis, tanaman asal sambungan memiliki kandungan GA3, GA5 dan GA7
lebih rendah dibandingkan dengan tanaman asal biji (Rai 2004).
Pada kebanyakan tanaman buah-buahan, pucuk dapat terinduksi atau
tidak terinduksi untuk berbunga erat kaitannya dengan perbedaan kandungan
hormon tumbuh (Krajewski dan Rabe 1995; Koshita et al. 1999), perbedaan
keseimbangan karbohidrat dan nitrogen serta kondisi nutrisi yang optimum
bersamaan dengan perubahan-perubahan dalam tunas pucuk (Lyndon 1990;
Hempel et al. 2000). Pada manggis induksi bunga juga ditandai dengan
penurunan tajam kandungan giberelin dan peningkatan tajam gula total dan
nisbah C/N dibandingkan dengan sebelum induksi. Pada stadium induksi terjadi
peningkatan kandungan gula total dan penurunan nitrogen dibandingkan dengan
sebelum induksi, baik pada tanaman asal biji maupun pada tanaman asal
21
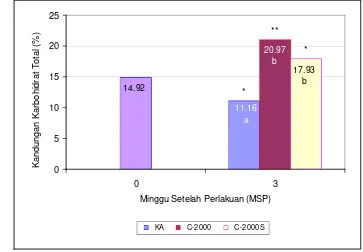
Proses pembungaan dipengaruhi oleh kandungan gula total daun, nisbah
C/N daun dan gula total kulit ranting. Peningkatan gula total dan penurunan
nitrogen bermakna cukup penting dalam pembungaan, karena penurunan
kandungan nitrogen disertai dengan peningkatan gula total dapat meningkatkan
nisbah C/N, yang berperanan sangat penting dalam menginduksi bunga.
Kandungan gula yang tinggi pada pucuk diperlukan sebagai sumber energi awal
bagi proses induksi bunga, proses perkembangan daerah meristem dan
bagian-bagian bunga. Pada lengkeng, kandungan gula terlarut meningkat tajam pada
meristem pucuk yang terinduksi untuk berbunga (Prawitasari 2001).
Pentingnya peranan gula total dan nisbah C/N pada proses induksi bunga
terlihat pula pada perbedaan kandungan gula total dan nisbah C/N antara pucuk
berbunga dan pucuk tidak berbunga pada tanaman manggis. Pada stadium
induksi, kandungan gula total dan nisbah C/N pucuk berbunga nyata lebih tinggi
dibandingkan dengan pucuk tidak berbunga. Hal tersebut menunjukkan bahwa
pada saat terjadi induksi bunga gula total dan nisbah C/N di pucuk meningkat
dan peningkatan yang lebih besar terjadi pada pucuk-pucuk yang akan
menginduksi bunga. Pucuk yang tidak mengalami peningkatan gula total secara
tajam tidak mampu menginduksi bunga sehingga pucuk-pucuk tersebut tidak
berbunga (Rai 2004).
Studi Molekuler Pembungaan
Pembungaan merupakan proses yang memerlukan banyak faktor yang
dikontrol oleh integrasi sinyal endogen, yang berhubungan dengan faktor seperti
umur tanaman dan status metabolit, dengan sinyal lingkungan seperti panjang
hari, status nutrien dan temperatur. Gen yang berintegrasi dengan sinyal ini, gen
pengontrol waktu pembungaan, bertindak sebagai inducer (penginduksi) atau
posisi sentral dan merupakan gen yang terekspresi secara absolut untuk
keperluan inisiasi bunga secara normal. Gen-gen yang terlibat dalam
metabolisme senyawa dapat memainkan sebagian sinyal tanaman endogen,
seperti hormon tanaman giberelin dan sukrosa (status metabolit) (Nilsson 2002).
Fungsi gen-gen tersebut telah banyak dilaporkan, dan dapat dikelompokkan
kedalam alur genetik yang berbeda dan saling berinteraksi dalam pengaturan
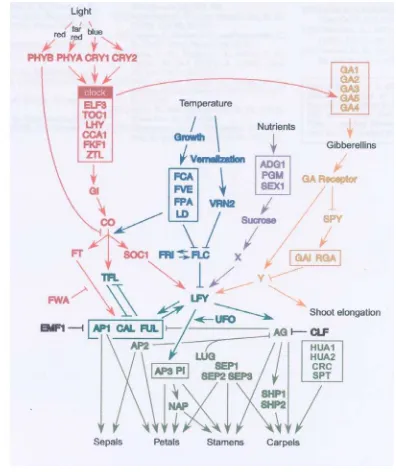
pembungaan (Simpson et al. 1999). Menurut Blazquez (2000) dan Zufall (2002),
paling tidak terdapat empat alur atau lintasan yang mempengaruhi aktivitas
gen-gen pembungaan yaitu lintasan photoperiodic, lintasan autonomous, lintasan
sucrose dan lintasan gibberellin (Gambar 3).
Tahap pertama dalam perkembangan bunga adalah terjadinya transisi
dari meristem vegetatif menjadi meristem bunga. Setiap meristem bunga
didiferensiasi menjadi bunga yang mengandung empat tipe organ yang
menempati posisi secara tepat dalam empat lingkaran konsentris. Studi genetik
pada Arabidopsis thaliana dan Antirrhinum majus telah berhasil diidentifikasi
gen-gen yang bertindak lebih awal yang menentukan penanda meristem bunga dan
gen-gen yang bertindak pada tahapan berikutnya yang menentukan penanda
organ bunga (Mandel et al. 1992). Pada Arabidopsis, perubahan perkembangan
dari vegetatif ke reproduktif dikontrol oleh beberapa faktor, dan sebagai
konsekuensinya muncullah beberapa kelompok gen yang terlibat dalam
pengaturan tersebut. LFY merupakan gen pertama yang diekspresikan pada
primordia yang mengapit meristem tunas apikal yang akan menjadi bunga.
Peningkatan jumlah kopi LFY akan mempercepat waktu pembungaan,
sedangkan penurunan level LFY akan memperlambat waktu pembungaan. Hasil
ini menunjukkan bahwa LFY bertindak sebagai gen pengatur waktu pembungaan, yang mengindikasikan bahwa LFY merupakan switch yang
23
bahwa konversi daun menjadi bunga dikontrol oleh kombinasi level LFY dan
kemampuan untuk merespon LFY (Blazquez et al. 1997).
Gambar 3 Alur genetik perkembangan bunga pada Arabidopsis (Blazquez 2000).
Pembungaan melibatkan serangkaian aktivitas dari dua grup gen, yaitu
yang mengontrol transisi dari meristem vegetatif ke bunga (gen penanda
berbagai bagian bunga (gen penanda organ bunga) (Levy dan Dean 1998).
Sejumlah gen penanda meristem bunga telah diisolasi dari Arabidopsis thaliana
dan spesies tanaman model lainnya. Salah satu gen tersebut, LEAFY (LFY),
terlibat dalam mengontrol transisi dari meristem vegetatif menjadi meristem
bunga. Gen yang lain, APETALA1 (AP1), selain terlibat dalam mengontrol
transisi dari meristem vegetatif ke meristem bunga juga diperlukan untuk
perkembangan sepal dan petal. Weigel et al. (1992) memperlihatkan bahwa
LEAFY berinteraksi dengan gen pengontrol pembungaan yang lain, yaitu
APETALA1, untuk memacu transisi dari meristem vegetatif ke meristem bunga.
Dalam alur genetik perkembangan bunga pada Arabidopsis tersebut, meristem
vegetatif berkembang menjadi meristem bunga, dan kemudian menghasilkan
primordia organ bunga. Pada proses ini, produk gen LFY dan AP1 berinteraksi
secara sinergis untuk memacu perkembangan meristem bunga. Peranan utama
dari LEAFY adalah secara langsung menekan gen penanda tunas vegetatif atau
menekan faktor intermediet yang mengaktifkan gen penanda tunas vegetatif
(Parcy et al. 2002). Ketika AP1 atau LFY tersebut diekspresikan secara konstitutif
pada Arabidopsis transgenik secara in vitro, tanaman akan berbunga hanya
dalam 10 hari (Mandel dan Yanofsky 1995; Weigel dan Nilsson 1995).
Perubahan bentuk dari meristem vegetatif menjadi meristem bunga
mengakibatkan roset, hingga meristem infloresen menghasilkan daun dan bunga.
Hal ini tergantung pada aktivitas dari LFY dan AP1 sebagai gen penanda
meristem bunga (Bowman et al. 1993; Mandel dan Yanofsky 1995). Kedua gen
tersebut diekspresikan pada level yang tinggi pada primordia bunga yang
muncul, tetapi hanya LFY yang diekspresikan pada primordia daun sebelum
transisi ke pembungaan. Tingkat ekspresi LFY pada primordia lateral meningkat
25
setelah batas ambang ini tercapai, primordia tersebut akan berkembang dari
primordia daun menjadi primordia bunga (Blazquez et al. 1997).
Pembentukan meristem bunga Arabidopsis terutama dikontrol oleh gen
penanda meristem bunga yaitu LFY, AP1 dan CAULIFLOWER (CAL). Liljegren
et al. (1999) dan Burnham (2000) juga menjelaskan bahwa interaksi antara LFY,
AP1, dan CAL secara positif memacu fase transisi dari produksi tunas vegetatif
ke pembentukan bunga. Di samping menentukan pembentukan bunga, aktivitas
bersama antara LFY, AP1 dan CAL dapat menghambat ekspresi gen penanda meristem tunas vegetatif TERMINAL FLOWER1 (TFL1) pada meristem lateral,
sehingga mencegah pembentukan tunas vegetatif. Dalam membentuk meristem
bunga, LFY dapat mengaktifkan AP1 secara langsung, sedangkan LFY, AP1 dan
CAL masing-masing diregulasi secara tidak langsung melalui regulasi negatif
oleh TFL1 (Liljegren et al. 1999). Pada tanaman tingkat tinggi, perubahan fase
perkembangan diregulasi melalui alur gen yang kompleks. Hilangnya fungsi gen
akibat mutasi pada gen EMBRYONIC FLOWER (EMF1 dan EMF2)
mengakibat-kan Arabidopsis langsung berbunga, menghindari pertumbuhan tunas vegetatif.
Fenotip ini mendukung pendapat bahwa gen EMF berperan utama dalam
menekan program reproduktif (Yoshida et al. 2001; Moon et al. 2003).
Ekspresi AP1 pada meristem lateral salah satunya adalah diregulasi oleh
LFY. LFY mempercepat ekspresi AP1 pada meristem lateral wild-type di bawah
kondisi yang menginduksi pembungaan, sehingga pada mutan lfy ekspresi AP1
menjadi tertunda. Hal ini menunjukkan bahwa LFY merupakan regulator positif
bagi aktivitas AP1. Namun pada gilirannya, AP1 juga dapat meregulasi LFY
secara positif, karena pada tanaman yang mengekspresikan AP1 secara
konstitutif, LFY diekspresikan lebih awal pada meristem bunga yang telah
tanaman 35S::AP1, dan konversi tunas ke bunga pada tanaman 35S::LFY
terutama ditekan oleh mutasi AP1 (Mandel dan Yanofsky 1995; Weigel dan
Nilsson 1995). Gen AP1 telah berhasil diklon dan memperlihatkan bahwa gen
tersebut mengkode putative faktor transkripsi yang mengandung MADS-domain
(DNA-binding domain). RNA AP1 diekspresikan secara seragam pada primordia
bunga muda, dan selanjutnya terlokalisir pada sepal dan petal. Hal ini
menunjukkan bahwa AP1 bertindak secara lokal untuk pembentukan penanda
meristem bunga dan untuk menentukan perkembangan sepal dan petal
(Mandel et al. 1992).
Fakta bahwa mutasi LFY hanya berpengaruh kecil terhadap pembungaan
dan transformasi dari tunas ke bunga yang lebih cepat pada tanaman yang
mengekspresikan AP1 secara konstitutif, menunjukkan bahwa AP1 bertindak
downstream dari LFY dalam membentuk penanda meristem bunga (Liljegren
et al. 1999). Namun demikian, berbagai fakta membuktikan bahwa aktivitas
gabungan dari LFY dan AP1 adalah lebih efektif daripada aktivitasnya secara
sendiri-sendiri. Pada kondisi yang menginduksi pembungaan, tanaman yang
membawa mutasi LFY dan AP1 menunjukkan transformasi yang hampir lengkap
dari semua bunga menjadi cabang-cabang tunas aksilar (Huala dan Sussex
1992; Weigel et al. 1992). Analisis genetik terhadap tanaman yang
mengekspresikan LFY secara konstitutif menunjukkan bahwa tunas lateral akan
menjadi penanda bunga ketika LFY diekspresikan secara konstitutif, dan
transformasi ini akan kembali lagi jika tidak ada aktivitas AP1 (Weigel dan
Nilsson 1995). Lebih lanjut dijelaskan bahwa meskipun aktivitas AP1 konstitutif
tersebut cukup untuk merubah tunas lateral menjadi bunga, namun bunga
yang dihasilkan memperlihatkan beberapa karakteristik seperti tunas jika aktivitas
27
Gen yang berhubungan dekat dengan AP1, yaitu CAULIFLOWER (CAL)
juga mempunyai fungsi yang terlibat dalam penentuan penanda meristem bunga
(Rounsley et al. 1995). Fenotip mutan ap1 juga dapat ditingkatkan lebih lanjut
oleh mutasi CAL yaitu dengan tidak terjadinya konversi secara lengkap dari
meristem vegetatif menjadi meristem bunga pada double mutans ap1 cal.
Karena meristem bunga tidak dihasilkan oleh tunas utama pada tanaman
ap1 cal di dalam kondisi tumbuh normal, maka tunas tersebut tidak pernah
menghasilkan transisi secara lengkap dari fase vegetatif ke fase reproduktif
(Bowman et al. 1993).
Studi gain-of-function dari tanaman transgenik yang mengekspresikan
LFY, AP1 atau CAL secara konstitutif di bawah kendali promoter Cauliflower
Mosaic Virus 35S (CaMV 35S) memperkuat kesimpulan hasil studi berdasarkan
loss-of-function dan menunjukkan bahwa aktivitas AP1 adalah downstream dan
diregulasi oleh LFY. Tanaman yang mengekspresikan LFY, AP1 atau CAL
secara konstitutif berbunga lebih cepat dan mengalami transformasi dari
meristem tunas primer dan sekunder menjadi meristem bunga, meskipun fenotip
yang dihasilkan oleh 35S::CAL lebih lemah daripada 35S::LFY atau 35S::AP1
(Mandel dan Yanofsky 1995; Weigel dan Nilsson 1995). Jadi sesuai dengan
pendapat Liljegren et al. (1999), bahwa LFY, AP1 dan CAL bertindak
bersama-sama untuk memacu transisi dari fase produksi tunas dan daun (fase vegetatif)
ke pembentukan meristem bunga (fase reproduktif).
Ekspresi AP1 dibatasi secara spatial untuk meristem bunga oleh aksi gen
penanda meristem vegetatif TERMINAL FLOWER1 (TFL1) (Bowman et al.
1993). Pada tanaman wild-type, AP1 dan TFL1 diekspresikan pada tempat
yang berbeda, dimana TFL1 diekspresikan pada daerah subapikal meristem
pertumbuhan, TFL1 juga mempunyai pengaruh antagonis terhadap AP1 dalam
pembentukan penanda meristem, karena TFL1 memacu penanda meristem
vegetatif dan AP1 menentukan meristem bunga. Fenotip tanaman yang
mengekspresikan AP1 secara konstitutif mencerminkan fenotip tanaman yang
mengalami mutasi TFL1. Tanaman 35S::AP1 dan mutan tfl1 memperpendek fase
pertumbuhan vegetatifnya dan mengalami transformasi dari tunas vegetatif
menjadi bunga (Mandel dan Yanofsky 1995). TFL1 diekspresikan pada level
yang rendah dalam meristem vegetatif dan tampaknya berperan untuk mencegah
pembungaan sebelum waktunya. Pada stadia lebih lanjut, TFL1 mengatur dan
berperan dalam menekan ekspresi gen penanda meristem bunga seperti LFY
dan AP1 pada meristem vegetatif (Jack 2004).
Selain sebagai gen penanda meristem bunga, AP1 juga bertindak
sebagai gen kelas A yang diperlukan untuk membentuk whorl pertama dan
kedua dari penanda organ bunga (Bowman et al. 1993). Sesuai dengan kedua
peranannya dalam menentukan penanda meristem dan penanda organ, AP1
pada awalnya diekspresikan pada meristem bunga muda dan kemudian menjadi
terbatas pada daerah dimana akan dibentuk primordia sepal dan petal (Mandel
et al. 1992; Gustafson-Brown et al. 1994). Karena gen AP1 berperan dalam
mengontrol pembentukan primordia bunga dan organ bunga, maka mutasi gen
AP1 dapat mengganggu kedua fase perkembangan bunga tersebut. Pengaruh ini
ditunjukkan dengan terjadinya konversi sebagian bunga menjadi infloresen tunas
dan gangguan terhadap perkembangan sepal dan petal. Tanaman mutan ap1
akan mengalami kegagalan pembentukan sepal dan petal pada whorl pertama
dan whorl ke dua dari bunga, sedangkan pengaruhnya terhadap pembentukan
29
Pada tanaman tomat transgenik, pengaruh utama dari ekspresi AP1
adalah mempercepat saat pembungaan. Tanaman transgenik rata-rata berbunga
setelah memproduksi enam daun, sedangkan pada tanaman kontrol (wild-type)
setelah memproduksi 11 daun baru berbunga. Tanaman tomat yang
meng-ekspresikan AP1 juga mengalami konversi lebih awal dari meristem vegetatif
menjadi bunga. Setelah 18 minggu pada kondisi greenhouse, tanaman
transgenik menghasilkan konversi bunga dari meristem vegetatif dua kali lipat
lebih tinggi dibandingkan tanaman kontrol (Ellul et al. 2004). Selain tidak mempengaruhi fertilitas bunga, tanaman tomat transgenik yang
mengekspresi-kan AP1 juga tidak mengakibatkan abnormalitas bentuk dan ukuran buah yang
dihasilkan. Ekspresi konstitutif AP1 pada tanaman tomat transgenik tersebut
dapat memperpendek fase vegetatifnya secara signifikan, tanpa menyebabkan
abnormalitas infloresen, perkembangan bunga dan produksi buah. Hasil ini
sesuai dengan ekspresi AP1 yang telah diteliti pada jeruk (Pena et al. 2001).
Pada tanaman jeruk, yang mempunyai fase juvenil yang panjang dengan
menunda perkembangan reproduktifnya antara 6-20 tahun, juga dapat dipercepat
pembungaannya dengan mentransformasikan gen AP1 atau LFY. Bibit tanaman
jeruk yang mengekspresikan secara konstitutif gen AP1 atau LFY dari
Arabidopsis, dapat memproduksi bunga dan buah pada tahun pertama, sehingga
dapat memperpendek fase juvenilnya. Selanjutnya dapat dijelaskan bahwa
ekspresi AP1 adalah sama efisiennya dengan LFY di dalam menginisiasi
pembungaan yang lebih awal, dan tidak menghasilkan perkembangan yang
abnormal. Kedua tipe tanaman jeruk transgenik tersebut bunganya normal dan
fertil, serta berbunga dalam tahun-tahun berikutnya (Pena et al. 2001).
Gen penanda meristem bunga seperti AP1 dan LFY memang sangat
diperlukan untuk memacu pembungaan (Mandel dan Yanofsky 1995; Weigel
Arabidopsis menyebabkan produksi bunga terminal sebagaimana fenotip yang
diakibatkan oleh mutan pada gen TFL1 (Bradley et al. 1997). Ekspresi konstitutif
dari AP1 atau LFY pada herbaceous maupun spesies berkayu tersebut telah
terbukti dapat mempercepat inisiasi pembungaan melalui penekanan yang kuat
terhadap fase juvenil (Weigel dan Nilsson 1995; Pena et al. 2001). Hasil ini
telah membuka kemungkinan baru untuk program domestikasi, perbaikan
genetik, dan penelitian lebih lanjut, terutama pada pohon buah-buahan dan
spesies berkayu lainnya.
Berdasarkan pada pernyataan di atas, pengaturan ekspresi gen oleh
perkembangan, lingkungan dan signal metabolit, adalah sangat mungkin terjadi
pula dalam pengaturan inisiasi pembungaan pada tanaman kakao dengan
mengikuti jalur yang sama, dimana hal tersebut ditandai oleh adanya signal
penginduksi, protein pengatur transduksi signal, dan interaksi gen-gen yang
III. INDUKSI PEMBUNGAAN PADA TANAMAN KAKAO
Abstrak
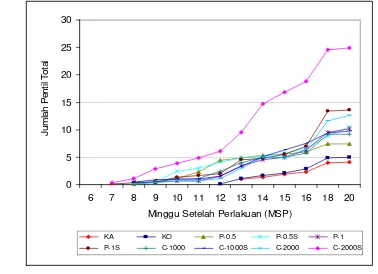
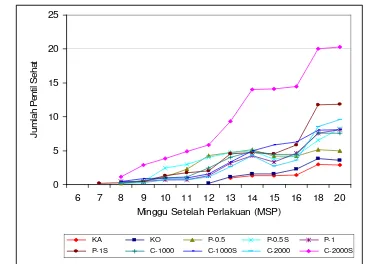
Kakao merupakan komoditas penting bagi Indonesia, baik secara ekonomi maupun sosial. Namun demikian, produktivitas perkebunan kakao di Indonesia masih rendah. Salah satu masalah yang mempengaruhi rendahnya produksi kakao tersebut adalah pembungaannya yang tidak merata sepanjang tahun. Pada perkebunan di daerah tropis, pohon kakao dewasa dapat berbunga sepanjang tahun, tetapi pembungaan terbesar terjadi pada saat pergantian dari musim kering ke musim hujan. Di luar musim tersebut, pembungaan pohon kakao dapat diinduksi dengan beberapa senyawa retardan. Tujuan penelitian ini adalah untuk mendapatkan jenis dan konsentrasi senyawa penginduksi pembungaan. Penelitian dilakukan di Kebun Rajamandala, Bandung, Jawa Barat mulai bulan Juli sampai dengan Nopember 2003 menggunakan rancangan acak kelompok dengan tujuh ulangan. Paklobutrazol diaplikasikan pada konsentrasi 0.5 dan 1 g bahan aktif/pohon, sedangkan CCC dengan konsentrasi 1.000 dan 2.000 ppm. Paklobutrazol dan CCC diaplikasikan dalam bentuk larutan baik secara sendirian maupun dikombinasikan dengan sukrosa 1%, dengan aplikasi melalui penyemprotan daun. Hasil penelitian menunjukkan bahwa perlakuan CCC 2.000 ppm yang dikombinasikan dengan sukrosa 1% merupakan penginduksi pembungaan kakao yang efektif, karena dengan perlakuan tersebut bunga dan pentil muncul lebih cepat, yaitu berturut-turut pada 24.3 hari setelah perlakuan (HSP) atau 21 hari lebih cepat dan 56.3 HSP atau 43 hari lebih cepat dibandingkan dengan kontrol yang baru muncul bunga pada 45.6 HSP dan pentil pada 98.9 HSP. Perlakuan tersebut juga menghasilkan jumlah bunga dan pentil yang tertinggi, yaitu masing-masing 304.7 buah (terjadi peningkatan 399.52%) dan 24.9 buah (terjadi peningkatan 500.48%) dibandingkan dengan tanaman kontrol.
Kata kunci : senyawa penginduksi, retardan, paklobutrazol, CCC, sukrosa.
Pendahuluan
memenuhi kebutuhan pasar dunia, apalagi mutu biji kakao Indonesia masih tergolong rendah. Hal ini disebabkan sebagian besar pengusahaan kakao di Indonesia masih bersifat sederhana, serta teknik budidaya yang belum dikuasai sepenuhnya. Karena itu diperlukan pengelolaan yang lebih intensif untuk meningkatkan produktivitasnya.
Salah satu aspek fisiologis yang penting dalam hubungannya dengan peningkatan produksi buah kakao adalah pertumbuhan reproduktif yang terdiri atas pembungaan dan pembentukan buah. Pembungaan pada tanaman kakao perlu mendapatkan perhatian karena pada bulan-bulan tertentu bunganya sangat banyak tetapi pada bulan-bulan yang lain bunganya sangat sedikit. Pada saat tidak berbunga atau bunganya sedikit tersebut, tanaman kakao dapat ditingkat-kan pembungaannya misalnya dengan menggunaditingkat-kan senyawa penginduksi pembungaan seperti paklobutrazol dan CCC. Paklobutrazol dan CCC merupakan senyawa kimia yang bekerja secara fisiologis dalam menghambat biosintesis giberelin (Rademacher 2000).
33
Hasil penelitian Poerwanto et al. (1997) menunjukkan bahwa aplikasi paklobutrazol pada mangga dapat menginduksi pembungaan di luar musim. Walaupun paklobutrazol menghambat munculnya tunas vegetatif, tetapi menginduksi munculnya bunga. Tanaman yang tidak mendapat paklobutrazol tidak berbunga, tetapi tunas vegetatif yang muncul banyak. Pada tanaman yang memperoleh paklobutrazol jumlah tunas vegetatif yang muncul menurun, tetapi muncul bunga. Pada manggis, pemberian paklobutrazol menyebabkan tanaman berbunga pada saat 48 hari setelah aplikasi, lebih cepat dibandingkan tanaman kontrol. Jumlah bunga dan buah tanaman yang diberi paklobutrazol juga lebih banyak dibandingkan kontrol (Poerwanto 2003).
Chlormequat chloride (CCC) juga mempunyai pengaruh yang berlawanan dengan GA3 terhadap pertumbuhan dan perkembangan tanaman. Menurut Gianfagna (1995), CCC merupakan senyawa penghambat tumbuh yang dapat mengurangi pemanjangan tunas pada pohon buah-buahan, menghambat pertumbuhan vegetatif dan memacu inisiasi kuncup bunga. Pemberian CCC pada berbagai tanaman dapat memperbaiki pembungaan dan membuat tanaman lebih kompak, dengan pertumbuhan tunas yang seragam. Pada tanaman jeruk, ketika senyawa penghambat tumbuh tersebut digunakan untuk menstimulasi hasil pada pohon muda, maka pengaruhnya terhadap pemanjangan dan vigor menjadi kurang efektif dan sebaliknya akan memacu pembungaan dan mempercepat pembentukan buah (Salomon 1981).
konsentrasi molekul tersebut pada apeks meningkat dengan cepat dan nyata (Bernier et al. 1993).
Tujuan penelitian ini adalah untuk mendapatkan jenis dan konsentrasi senyawa yang tepat untuk menginduksi pembungaan tanaman kakao.
Bahan dan Metode
Bahan Tanaman
Bahan tanaman yang digunakan adalah kakao jenis UAH (Upper Amazone Hybrid), yang ditanam pada tahun 1990 di Kebun Rajamandala, Bandung, milik PT Perkebunan Nusantara VIII Jawa Barat. Pemilihan pohon kakao sebagai tanaman sampel dilakukan seseragam mungkin berdasarkan besar batang, tinggi tanaman dan ukuran tajuk atau kanopi, serta dipilih pohon yang tidak sedang berbunga atau berbuah.
Prosedur Pelaksanaan
35
Adapun perlakuannya secara rinci adalah sebagai berikut : P-0.5 (paklobutrazol 0.5 g bahan aktif/pohon), P-0.5S (paklobutrazol 0.5 g b.a./pohon + sukrosa 1%), P-1 (paklobutrazol 1 g b.a./pohon), P-1S (paklobutrazol 1 g b.a./pohon + sukrosa 1%), C-1000 (CCC 1.000 ppm), C-1000S (CCC 1.000 ppm + sukrosa 1%), C-2000 (CCC 2.000 ppm), C-2000S (CCC 2.000 ppm + sukrosa 1%), KO (kontrol, tanpa disemprot) dan KA (kontrol, disemprot air). Peubah yang diamati meliputi : saat muncul bunga pertama, waktu berbunga (50% muncul bunga), jumlah tandan bunga, jumlah bunga, saat muncul pentil pertama, jumlah pentil total, persentase pentil layu, jumlah pentil sehat, jumlah tunas, panjang tunas dan jumlah daun.
Saat muncul bunga pertama adalah saat pertama kali muncul titik bunga pada batang tanaman yang diamati, dihitung dalam hari setelah perlakuan (HSP). Waktu berbunga ditentukan ketika jumlah bunga yang muncul pada satu pohon telah mencapai 50% (dalam HSP). Jumlah tandan bunga diamati setiap minggu sekali dengan cara menghitung berapa titik tempat munculnya gerombol bunga pada batang yang diamati, mulai dari permukaan tanah sampai dengan setinggi 2 m. Jumlah bunga diamati setiap minggu sekali dengan cara menghitung semua kuncup bunga yang muncul pada permukaan batang yang diamati, mulai dari permukaan tanah sampai dengan setinggi 2 m.
pada permukaan batang yang diamati, mulai dari permukaan tanah sampai dengan setinggi 2 m (jumlah pentil total dikurangi dengan jumlah pentil layu).
Jumlah tunas diamati setiap minggu sekali dengan cara menghitung semua tunas yang muncul pada batang yang diamati, mulai dari permukaan tanah sampai dengan setinggi 2 m. Panjang tunas diukur setiap minggu sekali dengan cara mengukur semua tunas yang muncul pada wilayah pengamatan, mulai dari pangkal tunas sampai dengan titik tumbuh tunas (dalam cm). Jumlah daun diamati setiap minggu sekali dengan cara menghitung semua daun yang terbentuk pada semua tunas yang diamati, mulai dari permukaan tanah sampai dengan setinggi 2 m.
Data hasil pengamatan dianalisis dengan menggunakan analisis ragam (Anova) dan jika terdapat beda nyata dilanjutkan dengan uji Duncan dan uji kontras orthogonal.
Hasil dan Pembahasan