PENENTUAN AKTIVITAS ANTIOKSIDAN EKSTRAK
MAHKOTA DEWA, TEMU PUTIH, SAMBILOTO, DAN
KELADI TIKUS SECARA
IN VITRO
DEDY IRAWAN
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
ABSTRAK
DEDY IRAWAN. Penentuan Aktivitas Antioksidan Ekstrak Mahkota Dewa, Temu Putih, Sambiloto, dan Keladi Tikus Secara In Vitro. Dibimbing oleh GUSTINI SYAHBIRIN dan DYAH ISWANTINI PRADONO.
Buah mahkota dewa (Phaleria macrocarpa, Boerl), temu putih (Curcuma zeodaria), sambiloto (Andrographis paniculata, Nees), dan keladi tikus (Typhonium flagelliforme)
berkhasiat sebagai tanaman obat. Tanaman tersebut berpotensi untuk mengobati kanker dan kandungan senyawa di dalamnya diduga berperan sebagai antioksidan.Penelitian ini bertujuan menentukan daya antioksidan dari tanaman mahkota dewa, temu putih, sambiloto, dan keladi tikus dengan menggunakan metode asam tiobarbiturat. Pada metode ini, asam linoleat dioksidasi dengan udara pada suhu 40 oC selama 8 hari, sehingga membentuk produk malondialdehida. Malondialdehida yang terbentuk akan bereaksi dengan asam tiobarbiturat membentuk produk berwarna merah yang serapannya dapat diukur pada panjang gelombang 532 nm. Potensi antioksidan dari keempat ekstrak tanaman tersebut dilihat dari kemampuannya dalam menghambat proses oksidasi. Daya hambat masing-masing tanaman pada konsentrasi 200 ppm untuk ekstrak akuademineral, air panas, dan etanol secara berturut-berturut sebesar 83,44%, 70,86%, 81,84% (mahkota dewa), 60,21%, 82,74%, 69,28% (temu putih), 81,45%, 81,45%, 67,96% (sambiloto), 68,60%, 63,53 %, 72,17% (keladi tikus), dan 87,01% (vitamin E).Berdasarkan uji statistik Anova dan Duncan potensi antioksidan masing-masing tanaman pada konsentrasi 200 ppm jika dibandingkan dengan vitamin E berbeda nyata pada selang kepercayaan 95%.
ABSTRACT
DEDY IRAWAN. In Vitro Determination of Antioxidant Activity of Mahkota Dewa Extract, Temu Putih, Sambiloto and Keladi Tikus Supervised by GUSTINI SYAHBIRIN dan DYAH ISWANTINI PRADONO.
Mahkota dewa (Phaleria macrocarpa, Boerl), temu putih (Curcuma zeodaria), sambiloto (Andrographis paniculata, Nees), and keladi tikus (Typhonium flagelliforme)
PENENTUAN AKTIVITAS ANTIOKSIDAN EKSTRAK
MAHKOTA DEWA, TEMU PUTIH, SAMBILOTO, DAN
KELADI TIKUS SECARA
IN VITRO
DEDY IRAWAN
Skripsi
Sebagai salah satu syarat untuk memperoleh gelar
Sarjana Sains pada
Departemen Kimia
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
Judul : Penentuan Aktivitas Antioksidan Ekstrak Mahkota Dewa, Temu Putih, Sambiloto, dan Keladi Tikus Secara In Vitro.
Nama : Dedy Irawan NIM : G44201030
Disetujui:
Pembimbing I, Pembimbing II,
Dra. Gustini Syahbirin, M.S. Dr. Dyah Iswantini Pradono, M.Agr. NIP 131 842 414 NIP 131 956 706
Diketahui
Dekan Fakultas Matematika dan Ilmu Pengetahuann Alam Institut Pertanian Bogor
Dr.Ir. Yonny Koesmaryono, MS NIP 131 473 999
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah SWT atas segala karunia-Nya sehingga karya ilmiah ini berhasil diselesaikan. Judul penelitian ini ialah Penentuan Aktivitas Antioksidan Ekstrak Mahkota Dewa, Temu Putih, Sambiloto, dan Keladi Tikus Secara In Vitro.
Dalam penyusunan karya ilmiah ini penulis banyak mendapatkan bantuan, bimbingan dan arahan. Oleh karena itu penulis mengucapkan terima kasih kepada Dra. Gustini Syahbirin MS dan Dr. Dyah Iswantini Pradono, M.Agr. yang telah memberikan bimbingan dan pengarahan dalam penyusunan karya tulis ini. Ungkapan terima kasih juga kepada keluarga-keluarga terdekat atas segala dukungan dan doanya. Penghargaan penulis sampaikan kepada Mas Hery, Pak Sabur, dan Staf-staf Laboratorium Kimia Organik atas bantuannya hingga penelitian penulis dapat terlaksana. Selain itu, ucapan terima kasih kepada sahabat-sahabatku Jefri, Ardy, Eng, Joe, Aldi, Marudut, Agung, Riki, Ara, Stev, Dwi capello, Peris sitanggang, dan Iyan.
Semoga karya ilmiah ini bermanfaat.
Bogor, April 2006
RIWAYAT HIDUP
DAFTAR ISI
Halaman
DAFTAR TABEL... vii
DAFTAR GAMBAR ... vii
DAFTAR LAMPIRAN...viii
PENDAHULUAN ... 1
TINJAUAN PUSTAKA Temu Putih (Curcuma zeoderia) ... 1
Sambiloto (Andrographis paniculata Nees)... 2
Mahkota Dewa (Phaleria Macrocarpa, Boerl)... 2
Keladi Tikus (Typhonium flagelliforme)... 3
Kanker, Radikal Bebas, dan Lipid Peroksida ... 3
Antioksidan ... 4
Asam Tiobarbiturat (TBA) ... 5
BAHAN DAN METODE Bahan dan Alat... 5
Metode Penelitian ... 5
HASIL DAN PEMBAHASAN Oksidasi Asam Linoleat ... 6
Analisis Potensi Antioksidan ... 7
Potensi antioksidan ekstrak mahkota dewa... 7
Potensi antioksidan ekstrak temu putih... 8
Potensi antioksidan ekstrak sambiloto ... 8
Potensi antioksidan ekstrak keladi tikus ... 8
Uji statistik ANOVAdanDUNCAN... 9
SIMPULAN DAN SARAN Simpulan ... 10
Saran ... 10
DAFTAR PUSTAKA ... 10
DAFTAR TABEL
Halaman
1 Hasil analisis hidroperoksida ... 6
2 Persen inhibisi berbagai ekstrak tanaman ... 7
DAFTAR GAMBAR
Halaman 1 Profil rimpang temu putih (Curcuma Zeodaria)... 22 Profil sambiloto (Andrographis paniculata, Nees)... 2
3 Profil mahkota dewa (Phaleria Macrocarpa, Boerl)... 2
4 Reaksi peroksida lipid... 4
5 Reaksi antara malondialdehida dengan asam tiobarbiturat ... 4
6 Potensi antioksidan daging buah mahkota dewa ... 7
7 Potensi antioksidan temu putih ... 8
8 Potensi antioksidan sambiloto ... 8
DAFTAR LAMPIRAN
Halaman
1 Diagram alir penelitian ... 13
2 Diagram analisis hidroperoksida dari asam linoleat dengan metode tiosianat... 14
3 Pembuatan kurva standar ... 14
4 Pengukuran kadar malondialdehida sampel... 15
5 Struktur asam linoleat ... 15
6 Struktur vitamin E... 15
7 Hasil uji potensi antioksidan vitamin E dan kontrol negatif ... 15
8 Absorbansi standar TMP... 16
9 Hasil uji potensi antioksidan dengan metode TBA mahkota dewa... 17
10 Hasil uji potensi antioksidan dengan metode TBA temu putih... 18
11 Hasil uji potensi antioksidan dengan metode TBA sambiloto ... 19
12 Hasil uji potensi antioksidan dengan metode TBA keladi tikus ... 20
13 Analisis statistik ekstrak mahkota dewa ... 21
14 Analisis statistik ekstrak temu putih ... 22
15 Analisis statistik ekstrak sambiloto... 22
PENDAHULUAN
Penyakit kanker telah dikenal sebagai suatu penyakit yang mematikan oleh kebanyakan masyarakat di Indonesia. Penyakit ini menyerang manusia tanpa memandang usia mulai dari anak-anak sampai dewasa. Selain itu kanker menyerang berbagai organ tubuh yang tersusun atas sel-sel somatis yang sering mengalami pergantian sel (Zakaria 2001). Jenis kanker dapat digolongkan berdasarkan organ tubuh yang diserang. Upaya pencegahan maupun pengobatan penyakit kanker tersebut harus semakin diperhatikan.
Upaya pencegahan kanker dapat dilakukan dengan menerapkan gaya hidup sehat melalui pengaturan pola makan. Cara ini ditempuh dengan mengurangi makanan yang berlemak tinggi, menghindari makan instan yang mengandung bahan pewarna, dan pengawet, serta memperbanyak mengkonsumsi sayur-sayuran atau buah-buahan. Sedangkan upaya pengobatan dapat dilakukan mulai dari operasi, radioterapi, imunoterapi, dan kemoterapi yang memerlukan biaya yang cukup mahal sampai obat alternatif yang dapat dijangkau oleh masyarakat dan memiliki efek samping yang kecil.
Umumnya penyakit kanker ditimbulkan oleh adanya pengaruh radikal bebas yang menyerang berbagai komponen sel dalam tubuh, salah satunya adalah nukleotida. Radikal bebas yang menyerang nukleotida (DNA/RNA) akan mengubah struktur nukleotida tersebut yang menyebabkan mutasi dalam sel (Zakaria 2001).
Salah satu mekanisme untuk mengatasi radikal bebas ialah melalui antioksidasi. Untuk menjalankan mekanisme tersebut diperlukan antioksidan. Antioksidan alami dapat diperoleh dari berbagai jenis tumbuh-tumbuhan. Antioksidan merupakan senyawa yang dapat melawan radikal bebas dengan cara peroksidasi. Antioksidan ini dapat diperoleh dari sayuran misalnya timun yang mengandung senyawa likopen (Widowati 2004). Menurut penelitian Ernawati (2001), ekstrak daun sicerek (Clausena excavata Burm) mengandung senyawa alkaloid, steroid, terpenoid, dan flavonoid. Senyawa tersebut berperan sebagai antioksidan dengan cara menghambat peroksida lipid sehingga dapat melindungi tubuh dari penyakit kanker.
Terdapat beberapa contoh tanaman yang diduga memiliki potensi sebagai antioksidan diantaranya mahkota dewa (Phaleria Macrocarpa, Boerl), temu putih (Curcuma
Zeodaria), sambiloto (Andrographis paniculata, Nees), dan keladi tikus (Typhonium flagelliforme) (Wijayakusuma 1994). Pendugaan tersebut didasarkan atas kandungan senyawa aktif yang terdapat pada keempat jenis tanaman tersebut. Menurut berbagai hasil penelitian daging buah mahkota dewa mengandung flavonoid, alkaloid, terpenoid, saponin, dan senyawa resin (Harmanto 2002; Winarto 2003).
Pemanfaatan tanaman-tanaman di atas kebanyakan masih merupakan suatu pembuktian empiris berdasarkan pengalaman para pengguna dan masih sedikit pembuktian secara ilmiah. Oleh karena itu, penelitian secara ilmiah khususnya mengenai potensi antioksidan penting dilakukan.
Penelitian ini bertujuan menentukan akti-vitas antikosidan mahkota dewa, temu putih, sambiloto, dan keladi tikus secara in vitro dengan metode asam tiobarbiturat (TBA). Analisis ini diharapkan dapat memberikan informasi ilmiah dari keempat jenis tanaman tersebut yang diduga memiliki potensi sebagai antioksidan.
TINJAUAN PUSTAKA
Temu Putih (Curcuma zeodaria)
Temu putih dengan nama ilmiah Curcuma zerumbet diklasifikasikan ke dalam dunia Spermatophyta, filum Angiospermae, kelas Monocotyledoneae, bangsa Zingiberales, suku Zingiberaceae, dan marga Curcuma. Jenis Curcuma zeodaria dapat dilihat pada Gambar 1.
Di Indonesia, temu putih banyak ditemukan sebagai tumbuhan liar di kawasan Jawa Barat dan Jawa Tengah, terutama di lahan yang kurang subur pada daerah dengan ketinggian 1000 meter di atas permukaan laut. Zeodary adalah nama asing dari temu putih, sedangkan nama obat patennya adalah Leilipen dan Pao Kwun Tan (Flach & Rumawas 1996).
2
Khasiat lain dari tanaman temu putih, yaitu sebagai antiflogostik, kholeretik, stomakik, dan antipiretik (Soedibyo et al. 1998).
Gambar 1 Temu putih.
Secara empiris, rimpang temu putih digunakan sebagai antiinflamasi (Utami 2000), antioksidan, antikanker, melancarkan sirkulasi darah, bersifat fibrinolitik, dan antineoplastik. Ekstrak kasar Curcuma zeodaria mampu menginhibisi enzim HMG Co-A reduktase. Temu putih yang mengandung terpenoid, alkaloid, dan flavonoid mempunyai potensi tinggi sebagai antikanker.
Sambiloto
(Andrographis paniculata Nees)
Tumbuhan dari suku Acanthacea yang lebih dikenal dengan nama sambiloto, bidoro, sadiloto, takilo (Jawa), ki oray, ki peurat, takilo (Sunda), papaitan (Melayu) merupakan tumbuhan yang menjanjikan khasiat sebagai obat berbagai penyakit, termasuk AIDS dan simptom-simptom kelainan sistem kekebalan tubuh.
Klasifikasi sambiloto termasuk dalam dunia Spermatophyta, filum Angiospermae, kelas Dicotyledoneae, bangsa Solanales, suku Acanthaceae, marga Andrographis, jenis Andrographis paniculata Nees (Gambar 2).
Gambar 2 Sambiloto.
Sambiloto merupakan tanaman musiman yang masih suku jeruju-jerujuan, tumbuh liar di tempat-tempat terbuka seperti di pinggir jalan, di ladang, tanah kosong yang tanahnya agak lembab, atau di tanam di pekarangan
sebagai tanaman obat. Bentuk biji sambiloto gepeng kecil dan berwarna coklat, selain itu tananaman ini mudah diperbanyak dengan biji (Wijayakusuma et al. 1994).
Senyawa golongan flavonoid telah diisolasi dari akarnya, yaitu dari senyawa polimetoksiflavon, andrograpin, panikolin, dan apipgenin-7,4-dimetil eter (Wijaya-kusuma et al., 1994). Tanaman ini mengandung alkaloid dan saponin, di samping itu daunnya juga mengandung polifenol dan kulit buahnya mengandung flavonoid.
Mahkota Dewa
(Phaleria macrocarpa (Scheff.) Boerl.)
Mahkota dewa merupakan tanaman yang berasal dari Papua. Tanaman ini digolong-kan dalam dunia Spermatofita, filum Angiosprmae, kelas Dycotyledoneae, suku Thymelaeales, marga Thymelaeaceae, dengan genus Phaleria dan nama spesies Phaleria macrocarpa (Scheff) Boerl (Gambar 3). Tanaman ini dikenal juga dengan nama; mahkota ratu, pusaka dewa, mahkota raja, trimahkota, buah simalakama, raja obat, pau (Cina), dan the crown of god (Inggris) (Harmanto 2001).
Tanaman ini berupa pohon perdu dengan tajuk pohon bercabang-cabang. Ketinggiannya sekitar 1,5-2,5 meter, namun jika dibiarkan bisa mencapai lima meter.
Gambar 3 Buah mahkota dewa.
Secara empiris tanaman ini dilaporkan berkhasiat untuk menyembuhkan berbagai penyakit antara lain: kanker, penyakit hati, ginjal, diabetes, asam urat, rematik, darah tinggi, penyakit jantung, lemah syahwat, sirosis hati, paru-paru, disentri, alergi, flu, serta berbagai penyakit kulit (Taryono 2002).
3
Keladi Tikus (Thyponium flageliforme)
Keladi tikus dengan nama lain T. divaricatum, famili Araceae merupakan salah satu jenis tumbuhan liar yang berpotensi dapat mengobati penyakit kanker. Tumbuhan ini dikenal dengan nama daerah bira kecil, daun panta susu, kalamoyang, ileus, ki babi dan trenggiling mentik. Penderita kanker men-dapatkan manfaat baik setelah mengonsumsi sari (juice) keladi tikus tersebut.
Penggunaan keladi tikus sebagai obat kanker alternatif cukup dikenal masyarakat sehingga penelitian intensif tentang keladi tikus ini dari berbagai segi perlu terus dilakukan. Berkaitan dengan hal tersebut, maka salah satu aspek yang harus diperhatikan adalah ketersediaan bahan tumbuhan ini sebagai obat maupun bahan kegiatan penelitian. Tanaman keladi tikus dapat membunuh berbagai jenis sel kanker dalam waktu yang relatif singkat. Kandungan kimia yang terdapat dalam keladi tikus belum banyak diketahui. Sari tanaman keladi tikus dapat menghambat pertumbuhan dan menghancurkan sel kanker, serta menghilangkan efek buruk kemoterapi.
Kanker, Radikal bebas, dan Lipid peroksida
Kanker merupakan penyakit yang disebabkan oleh pertumbuhan sel pada jaringan tubuh secara tidak normal. Ketidaknormalan tersebut dikarenakan sel telah termutasi atau telah terjadi perubahan struktur DNA. Menurut Zakaria (2001), satu sel saja yang mengalami kerusakan genetik atau telah terjadi 5-10 mutasi DNA sudah cukup untuk menghasilkan jaringan kanker.
Pada umumnya, sel baru akan membelah apabila ada sel yang mati atau rusak sehingga memerlukan pergantian sel. Pada penyakit kanker terjadi penurunan atau hilangnya kontrol terhadap pertumbuhan sel sehingga sel akan berkembang dengan cepat dan tidak terkendali.
Perubahan struktur DNA dapat terjadi melalui berbagai mekanisme. Secara umum mekanisme tersebut terbagi menjadi tiga. Pertama, perubahan struktur DNA disebabkan oleh kesalahan replikasi yang terjadi pada sel-sel yang rusak digantikan oleh sel-sel-sel-sel yang baru. Kesalahan replikasi meskipun dengan sistem perbaikan yang sangat efisien masih memungkinkan adanya mutasi yang lolos dari sistem perbaikan (Murray 1999). Sel-sel yang
membelah dengan perlahan, karena sedikitnya kesempatan hidup untuk memperbaiki DNA sebelum pembelahan sel. Oleh karena itu kanker banyak ditemui pada sel-sel somatik organ yang sering mengalami pergantian sel (Zakaria 2001).
Kedua, DNA akan mengalami mutasi yang disebabkan oleh radikal bebas. Pada saat radikal bebas dalam tubuh berikatan dengan DNA, maka DNA mengalami perubahan struktur dan memasuki tahap awal untuk terjadinya kanker. Selain itu radikal bebas dapat berikatan dengan sistem perbaikan DNA sehingga aktivitas dan fungsinya terganggu. Dengan kata lain proses perbaikan mutasi DNA tidak dapat berjalan (Zakaria 2001).
Ketiga, perubahan strutur DNA dapat disebabkan oleh faktor eksternal seperti: virus, polusi udara, radiasi dan bahan-bahan kimia yang bersifat karsinogen. Faktor eksternal tersebut juga dapat membentuk radikal bebas Sebagai contoh radiasi dari sinar ultraviolet, sinar X, dan sinar gamma. Selain mengaki-batkan mutasi, radiasi tersebut juga dapat pula membentuk radikal bebas. Bahan kimia yang bersifat karsinogen pada proses metabolisme dalam tubuh juga membentuk radikal bebas (Murray 1999).
Menurut The World Cancer Research Fund (WCRF) dan The American Institute of Cancer Reasearch (AICR), penyebab kanker 80-85% berasal dari faktor eksternal dan 10-15% karena kesalahan replikasi dan kesalahan genetik yang diturunkan dari orang tua (Mangan 2003). Berdasarkan data dari WCRF dan AICR, kanker dapat dicegah dengan menangkal faktor eksternal yang dapat menimbulkan radikal bebas melalui anti-oksidan yang merupakan benteng strategis dalam melawan kanker.
4
N N HS OH OH CH2 CHO CHO TBA MDA N N S OH OH CH C H CH PRODUK N N OH SH OH2H2O
AIR 2
molekul oksigen sebagai berikut (Siregar 1992):
O2 + e¯ O2¯ · O2¯ · + e¯ + 2H+ H2O2 H2O2 + e¯ OH· + OH¯ OH· + e¯ + H+ H2O OH¯ + H+ H2O
O2 + 4e¯ + 4H+ 2H2O
Radikal bebas juga dapat dihasilkan dari berbagai proses kimia atau enzimatik selama proses metabolisme tubuh yang melibatkan senyawa organik maupun anorganik:
1. H2O2 + Fe2+ Fe3+ + OH¯ + OH· 2. H2O2 + Cu+ Cu2+ + OH¯ + OH· 3. OH· + RH H2O + R·
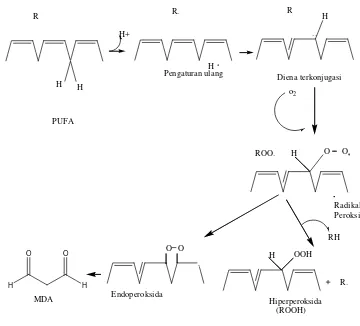
Selain itu, proses fagositosis oleh sel fagositosik termasuk neutrofil, monosit, makrofag, dan eosinofil juga akan menghasilkan radikal bebas superoksida (Gitawati 1995). Radikal bebas yang bersifat tidak stabil dan sangat reaktif dapat menimbulkan kerusakan berbagai komponen sel hidup seperti: DNA/RNA, lipid, protein, karbohidrat, dan gugus tiol non protein. Radikal bebas juga dapat mengakibatkan peroksidasi lipid. Peroksidasi lipid merupakan reaksi yang terjadi antara asam lemak tak jenuh ganda yang menyusun membran sel (linoleat, linolenat, dan arakidonat) sehingga terbentuk radikal lipid peroksida. Hal ini terjadi karena lipid merupakan molekul yang paling sensitif terhadap serangan radikal bebas (Gambar 4).
Reaksi ini terjadi secara berantai dan terus menerus sampai ada molekul yang memberikan elektron yang dibutuhkan radikal bebas atau baru dapat berakhir bila dua buah gugus radikal bebas saling berinteraksi membentuk ikatan non radikal. Reaksinya sebagai berikut: (Murray 1999)
1. Inisiasi
RH + OH· R· + H2O 2. Propagasi
R· + O2 ROO· ROO· + RH ROOH + R·
3. Terminasi
ROO· + ROO· ROOR ROO· + R· ROOR R· + R· RR
Gambar 4 Reaksi peroksida lipid.
Reaksi peroksida lipid akan menghasilkan produk akhir malondialdehida (MDA) yang merupakan senyawa dialdehida berkarbon tiga yang reaktif. Menurut Yagi (1994), konsentrasi MDA yang dihasilkan dapat diukur dengan metode TBA, karena MDA dapat bereaksi dengan asam tiobarbiturat membentuk produk berwarna merah yang dapat diukur pada panjang gelombang 532 nm (Gambar 5).
Gambar 5 Reaksi antara malondialdehida dengan asam tiobarbiturat.
Antioksidan
Radikal bebas secara kontinu dibentuk oleh tubuh. Di samping itu, tubuh memiliki sistem antioksidan yang dapat menangkal radikal bebas baik melalui proses enzimatis atau non-enzimatis. Antioksidan dapat diartikan sebagai senyawa pemberi elektron yang diperlukan oleh radikal bebas dalam rangka menstabilkan dirinya. Dengan demikian antioksidan dapat menghentikan pembentukan radikal bebas, mengurangi radikal bebas, dan memperbaiki kerusakan yang ditimbulkannya (Atmosukarto 2003). Antioksidan dapat juga diartikan sebagai enzim yang dapat menetralkan senyawa-senyawa oksigen aktif.
5
Berdasarkan mekanisme kerjanya antioksidan terbagi menjadi tiga, yaitu antioksidan primer, sekunder, dan tersier. Antioksidan primer berperan untuk mengurangi pembentukan radikal bebas baru dengan memutus reaksi berantai dan mengubahnya menjadi produk yang lebih stabil. Antioksidan primer terdiri atas superoksida dismutase (SOD), katalase, dan glutation peroksidase. Ketiga antioksidan ini dapat mengubah radikal superoksida menjadi air. Antioksidan sekunder berperan mengikat radikal bebas dan mencegah amplifikasi radikal. Antioksidan sekunder terdiri atas vitamin C, vitamin B, vitamin E, β-karoten, dan lain-lain. Antioksidan tersier terdiri atas enzim perbaikan DNA, metionin sulfoksida reduktase dan lain-lain (Kartikawati 1999) yang berperan sebagai mekanisme bio-molekuler.
Antioksidan alami dapat ditemukan dalam berbagai tumbuh-tumbuhan. Baik berupa tanaman berkayu, sayur-sayuran, atau buah-buahan. Pada tumbuhan berkayu diketahui banyak senyawa yang berfungsi sebagai antioksidan seperti: flavonoid, alkaloid, senyawa fenol, terpenoid, dan masih banyak lagi lainnya. Sedangkan pada sayuran atau buah-buahan diketahui banyak mengandung vitamin A, vitamin B, vitamin C, vitamin E, dan karotenoid (β-karoten). Vitamin-vitamin tersebut diyakini dapat berperan sebagai antioksidan, sehingga mampu melindungi tubuh dari penyakit kanker (Atmosukarto 2003).
Asam Tiobarbiturat (TBA)
Pada penelitian ini digunakan metode TBA untuk mengukur produk oksidasi asam linoleat yang bereaksi dengan asam tiobarbiturat menghasilkan produk berwarna merah yang diukur pada panjang gelombang 532 nm (Santoso 2001). Uji potensi antioksidan diukur melalui metode TBA. Alasan pemilihan metode TBA: 1) metode TBA merupakan cara yang paling sering digunakan untuk mengukur peroksidasi asam lemak pada membran sel dan makanan,. 2) reaksi TBA diketahui bersifat sensitif terhadap peroksida lipid, dan 3) reaksi antara malondialdehida dengan asam tiobarbiturat akan menghasilkan produk yang sama dengan reaksi yang terjadi antara lipid peroksida dengan asam tiobarbiturat (Yagi 1994).
Sebelum diuji potensi antioksidan, terlebih dahulu dilakukan pengukuran hidroperoksida yang merupakan produk primer dari oksidasi
asam linoleat dengan metode tiosianat. Pengukuran hidroperoksida dilakukan untuk menentukan waktu inkubasi asam linoleat.
Menurut Kikuzaki dan Nakatani (1993) pengukuran potensi antioksidan dengan metode TBA sebaiknya dilakukan setelah satu atau beberapa hari dari puncak absorbansi asam linoleat. Hal ini karena peroksida akan mengalami dekomposisi membentuk malon-dialdehida.
BAHAN DAN METODE
Bahan dan Alat
Bahan baku yang digunakan diperoleh dari peneliti sebelumnya, yaitu temu putih (Pratiwi 2006), sambiloto (Puspitasari 2006), keladi tikus (Affandi 2006), dan daging buah mahkota dewa (Salim 2006). Bahan kimia yang digunakan adalah etanol 75%, amonium tiosianat 30%, FeCl2 0,02 M dalam HCl 3,5%, air bebas ion, pereaksi 1,1,3,3-tetrametoksipropana (TMP), TBA 1% (b/v) dalam asam asetat 50%, asam trikloroasetat (TCA) 20%, asam linoleat 50 mM dalam etanol 99,8%, bufer fosfat 0,1 M pH 7. Alat yang digunakan adalah alat-alat kaca, water bath, spektrofotometer spektronik-20, sentrifus, pipet, tabung reaksi, dan termometer.
Metode Penelitian
Analisis hidroperoksida dari asam Linoleat dengan metode Tiosianat (Chen et al. 1996)
Diagram alir penelitian ini dapat dilihat pada Lampiran 1. Sebelum pengukuran potensi antioksidan dari masing-masing ekstrak, dilakukan pengukuran hidroperoksida sebagai produk primer asam linoleat yang teroksidasi dengan metode tiosianat (Lampiran 2). Metode tiosianat mengukur peroksida melalui kompleks warna Fe[Fe(SCN)6].
Sebanyak 2 ml bufer fosfat 0,1 M pH 7, 2 ml asam linoleat 50 mM dalam etanol 99,8%, dan 1 ml air bebas ion diletakkan pada botol gelap, kemudian campuran diinkubasi pada suhu 40ºC. Lama inkubasinya sampai tercapai absorban maksimum.
6
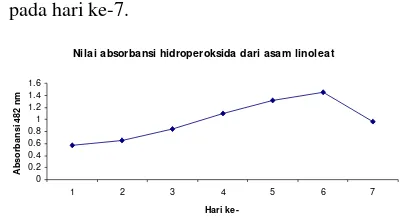
Nilai absorbansi hidroperoksida dari asam linoleat
0 0.2 0.4 0.6 0.8 1 1.2 1.4 1.6
1 2 3 4 5 6 7
Hari ke-A b so rb a n si 4 82 n m
didiamkan 3 menit, absorbansi diukur pada panjang gelombang 482 nm. Analisis hidroperoksida diukur setiap hari sampai tercapai absorbansi maksimum.
Analisis Potensi Antioksidan dengan Metode TBA (Kikuzaki & Nakatani1993)
Analisis potensi antioksidan dari masing-masing ekstrak dilakukan dengan berbagai seri konsentrasi larutan uji, yaitu 50, 200, dan 1000 ppm. Uji Potensi antioksidan dilakukan dengan metode TBA.
Larutan standar 1,1,3,3-tetra metoksi propana (TMP) konsentrasi 6 M diencerkan menjadi 0.15, 0.3, 0.6, 0.75, 1.5, dan 3.0 µM (Lampiran 3). Masing-masing konsentrasi dipipet sebanyak 1 ml, selanjutnya ditambahkan 2 ml TCA 20% dan 2 ml TBA 1% (b/v) dalam pelarut asetat 50% (v/v). Selanjutnya semua tabung diinkubasi pada suhu 100ºC selama 10 menit dan didinginkan pada suhu kamar. Setelah dingin, campuran di atas disentrifugasi pada kecepatan 3000 rpm, kemudian absorbansinya menggunakan spektrofotometer pada panjang gelombang 532 nm (Yagi 1968).
Sampel dibuat dengan campuran yang terdiri atas 2 ml bufer fosfat 0,1 M pH 7, 2 ml asam linoleat 50 mM dalam etanol 99,8%, dan 1 ml larutan uji. Sebagai kontrol negatif dibuat campuran yang sama seperti di atas, tetapi 1 ml larutan uji diganti dengan 1 ml air bebas ion. Sedangkan sebagai pembanding dibuat campuran yang terdiri atas 2 ml bufer fosfat 0,1 M pH 7, 2 ml asam linoleat 50 mM dalam etanol 99,8% yang mengandung -tokoferol (vitamin E 200 ppm), dan 1 ml air bebas ion.
Semua campuran reaksi tersebut diinkubasi dalam penangas air yang bersuhu 40ºC dengan lama inkubasi berdasarkan hasil pengukuran hidroperoksida dari asam linoleat. Campuran reaksi itu diuji potensi antioksidannya setelah 1 atau beberapa hari dari puncak absorban asan linoleat. Masing-masing campuran reaksi diambil 1 ml kemudian ditambahkan 2 ml TCA 20%, dan 2 ml larutan TBA 1% dalam pelarut asam asetat 50%. Lalu campuran reaksi tersebut ditempatkan pada penangas air yang bersuhu 100ºC selama 10 menit. Setelah dingin dilakukan sentrifugasi pada 3000 rpm selama 15 menit, selanjutnya diukur dengan spektro-fotometer pada panjang gelombang 532 nm (Lampiran 4).
HASIL DAN PEMBAHASAN
Oksidasi Asam Linoleat
Pengujian aktivitas antioksidan dengan metode TBA didasarkan pada pengukuran kadar malondialdehida (MDA) yang merupakan produk akhir dari reaksi lipid peroksida (Gambar 5). MDA merupakan senyawa dialdehida berkarbon tiga yang reaktif. MDA yang dihasilkan dapat diukur dengan uji TBA. MDA dapat bereaksi dengan TBA membentuk produk yang berfluoresensi dan dapat diukur pada panjang gelombang 532 nm. Sebagai standar digunakan 1,1,3,3-tetrametoksipropana (TMP) sehingga dapat diukur kadar MDA yang terbentuk. TMP merupakan senyawa turunan MDA yang cukup stabil. Pengukuran aktivitas antioksidan dengan metode TBA ini dilakukan setelah terjadi tingkat oksidasi asam linoleat maksimum karena pada saat itu juga terbentuk MDA maksimum yang dihasilkan dari reaksi oksidasi lipid.
Potensi antioksidan dari tanaman mahkota dewa, temu putih, sambiloto, dan keladi tikus dapat dilihat dari kemampuannya menghambat oksidasi asam linoleat. Struktur asam linoleat dapat dilihat pada Lampiran 5. Adanya senyawa metabolit sekunder seperti alkaloid, flavonoid, tanin, dan saponin diduga dapat menghambat reaksi oksidasi asam linoleat. Hasil pengukuran hidroperoksida yang merupakan hasil reaksi oksidasi asam linoleat menunjukkan puncak serapannya pada hari ke-6 (Tabel 1).
Asam linoleat yang teroksidasi oleh oksigen pada tahap awal akan membentuk hidroperoksida. Kadar hidroperoksida ini akan semakin meningkat dan setelah mencapai kadar maksimum, hidroperoksida akan mengalami dekomposisi membentuk malondialdehida yang merupakan produk akhir dari reaksi peroksida lipid. Terbentuknya malondialdehida ini terjadi pada hari ke-7.
7
Analisis Potensi Antioksidan
Pengukuran potensi antioksidan dilakukan pada hari ke-8 dengan harapan semua hidroperoksida yang terbentuk dari hasil oksidasi asam linoleat telah mengalami dekomposisi menjadi malondialdehida (MDA). Berdasarkan penelitian Salim (2006) diperoleh 3 ekstrak mahkota dewa, yaitu ekstrak dengan pelarut akuademineral, air panas, dan etanol. Setelah itu, ketiga ekstrak tersebut diuji aktivitas antioksidannya.
Potensi antioksidan dari semua jenis tanaman dapat diketahui melalui per-bandingan nilai absorbansi yang menggam-barkan konsentrasi MDA. Nilai absorbansi berbanding lurus dengan konsentrasi MDA dan berbanding terbalik dengan potensi antioksidan. Nilai absorbansi yang rendah menunjukkan bahwa tanaman memiliki potensi antioksidan yang tinggi. Hal ini menunjukkan bahwa sampel dapat meng-hambat proses oksidasi (Artinya dapat mengurangi jumlah MDA yang bereaksi dengan asam tiobarbiturat yang membentuk produk berwarna merah).
Penelitian ini menggunakan vitamin E sebagai standar dengan konsentrasi 200 ppm. Struktur vitamin E dapat dilihat pada Lampiran 6. Alasan pemilihan vitamin E sebagai standar adalah pada konsentrasi 200 ppm persen inhibisinya sudah mendekati 100%. Hasil penelitian Satria (2005) daya hambat vitamin E (200 ppm) dengan metode TBA sebesar 93,0%, sedangkan hasil penelitian Indariani 92005) potensi antioksidan vitamin E (200 ppm) dalam menghambat reaksi oksidasi lipid sampai 92,11%. Pada penelitian ini, vitamin E dengan konsentrasi 200 ppm memiliki daya hambat sebesar 87,01%. Nilai daya hambat tersebut lebih besar daripada ekstraksi akuademineral, air panas, dan etanol. Hal ini disebabkan karena kandungan senyawa antioksidan di dalam vitamin E lebih murni.
Data hasil uji potensi antioksidan vitamin E dan kontrol negatif dapat dilihat pada Lampiran 7. Dari hasil pengukuran standar 1,1,3,3-tetrametoksi propana (TMP) diperoleh regresi linier y = 0,0240X + 0,0269, R= 99,82%. Persamaan regresi tersebut diguna-kan untuk menghitung kadar MDA dari hasil pengujian TBA untuk masing-masing ekstrak (Lampiran 8).
Potensi antioksidan ekstrak mahkota dewa
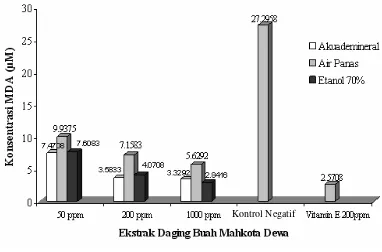
Daya hambat ekstrak tanaman yang diuji, menggunakan pelarut akuademineral, air panas dan etanol pada konsentrasi 50, 200, dan 1000 ppm dapat dilihat pada Tabel 2.
Gambar 7 Potensi antioksidan daging buah mahkota dewa.
Daya hambat ekstrak mahkota dewa pada konsentrasi 50 ppm untuk ketiga jenis pelarut tergolong cukup besar (lebih dari 50%) dalam menghambat proses pembentukan MDA. Konsentrasi MDA pada ekstrak mahkota dewa dapat dilihat pada Gambar 7.
Hampir semua senyawa metabolit sekunder bersifat polar. Akuademineral memiliki tingkat kepolaran lebih tinggi dari etanol. Ekstraksi akuademineral (50 dan 200 ppm) pada tanaman mahkota dewa memiliki potensi antioksidan lebih tinggi daripada ekstrak air panas dan etanol. Hal ini disebabkan kemampuan ekstraksi pelarut berbanding lurus dengan tingkat kemurnian pelarut tersebut. Dalam hal ini akuademineral lebih murni dari air panas. Sedangkan ekstraksi etanol (1000 ppm) lebih tinggi potensinya dibandingkan dengan ekstraksi akuademineral dan air panas. Hal ini disebabkan konsentrasi pelarut sudah melewati batas maksimum konsentrasi pembanding (vitamin E 200 ppm), sehingga diduga ada senyawa lain yang terekstrak. Hasil uji potensi antioksidan ekstrak mahkota dewa dapat dilihat pada Lampiran 9.
Ekstraksi akuademineral mahkota dewa memiliki potensi antioksidan yang cukup baik pada konsentrasi 200 ppm karena sudah cukup mendekati nilai daya hambat dari vitamin E sebagai kontrol positif. Berdasarkan penelitian Salim (2006), pada uji fitokimia alkaloid, flavonoid, tanin, dan saponin menunjukkan hasil uji positif. Senyawa-senyawa tersebut sangat berperan sebagai zat yang yang mampu menghambat reaksi oksidasi lipid. Pada Gambar 7 terlihat bahwa kontrol negatif /
8
perlakuan yang tidak diberi ekstrak (tanpa antioksidan) memiliki konsentrasi MDA yang tinggi, yaitu 27,2958 µM. Hal ini disebabkan Tidak adanya senyawa yang mampu menghambat proses oksidasi.
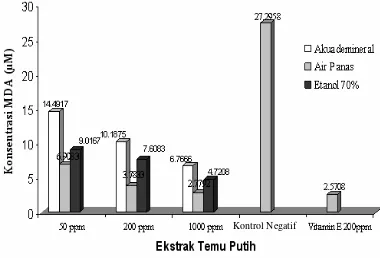
Potensi antioksidan ekstrak temu putih Potensi antioksidan ekstrak temu putih juga menunjukkan nilai daya hambat yang cukup tinggi pula (Gambar 8). Hasil uji potensi antioksidan ekstrak temu putih dapat dilihat
Gambar 8 Potensi antioksidan temu putih.
pada Lampiran 10. Air panas memiliki tingkat kepolaran yang lebih tinggi dari pada etanol sehingga diduga banyak terdapat senyawa metabolit sekunder yang terekstrak. Senyawa yang memiliki tingkat kepolaran yang tinggi akan terdistribusi lebih banyak di dalam air panas. Di samping itu mungkin juga disebabkan oleh pengaruh suhu dan kandungan senyawa yang berbeda pada masing-masing ekstrak yang diuji. Faktor tersebut menyebabkan jenis pelarut yang mampu mengekstrak secara maksimal tidak sama untuk masing-masing jenis ekstrak tanaman yang diuji, sehingga hasil daya hambat ekstrak temu putih berbeda dengan ekstrak mahkota dewa. Berdasarkan penelitian Pratiwi (2006), pada uji fitokimia alkaloid dan flavonoid menunjukkan hasil uji positif. Senyawa-senyawa ini diduga berperan sebagai antioksidan untuk menghambat reaksi peroksida lipid.
Potensi antioksidan ekstrak sambiloto Ekstraksi akuademineral pada ekstrak sambiloto (konsentrasi 50, 200 dan 1000
ppm) memiliki daya hambat paling besar jika dibandingkan dengan ekstrak air panas dan etanol (Gambar 9). Diduga kandungan senyawa metabolit sekunder seperti alkaloid, tanin, saponin, dan flavonoid yang terdapat pada ekstraksi akuademineral cukup besar. Berdasarkan penelitian Puspitasari (2006), pada uji fitokimia alkaloid dan terpenoid menunjukkan hasil positif untuk ketiga jenis pelarut. Sedangkan flavonoid menunjukkan hasil negatif hanya pada pelarut etanol dan tanin hanya pada pelarut akuademineral.Daya hambat pada konsentrasi 200 ppm untuk pelarut akuademineral dan air panas memiliki nilai yang sama. Hal ini menunjukkan akuademineral dan air panas memiliki kemampuan daya hambat yang sama meskipun tingkat kemurniannya berbeda. Hasil uji potensi antioksidan ekstrak sambiloto dapat dilihat pada Lampiran 11.
Gambar 9 Potensi antioksidan sambiloto.
Potensi antioksidan dari masing-masing ekstrak ini pada konsentrasi 200 ppm jika dibandingkan dengan vitamin E (200 ppm) masih terlihat lebih rendah (Gambar 7). Meskipun demikian perbedaan potensi antioksidan antara masing-masing ekstrak pada konsentrasi 50, 200, dan 1000 ppm tidak begitu terlihat. Hal ini disebabkan karena konsentrasi ekstrak terlalu besar dan tidak sebanding dengan konsentrasi subtrat asam linoleat.
Potensi antioksidan ektrak keladi tikus Ekstraksi akuademineral (50 ppm) ekstrak keladi tikus memiliki potensi antioksidan
Akuademineral (ppm) Air panas (ppm) Etanol (ppm)
50 200 1000 50 200 1000 50 200 1000 Mahkota dewa 69,70 83,44 84,34 61,09 70,80 76,24 69,28 81,73 86,05
Temu putih 44,75 60,21 72,24 71,74 82,74 86,27 54,33 69,28 79,44 Sambiloto 74,56 81,45 86,17 69,46 81,45 76,91 54,50 67,96 74,05 Keladi tikus 64,05 68,60 78,66 24,32 63,53 78,66 47,72 72,17 75,99
Tabel 2 Persen inhibisi yang diperoleh dari ekstrak tanaman untuk berbagai jenis pelarut
Kontrol Negatif
9
lebih tinggi dari pada ekstrak air panas dan etanol (Gambar 10). Hal ini disebabkan karena akuademineral memiliki tingkat kepolaran yang tinggi dibandingkan etanol
Gambar 10 Potensi antioksidan keladi tikus.
dan lebih murni dari pada air panas, sehingga diduga banyak senyawa metabolit sekunder seperti alkaloid dan flavonoid yang memiliki tingkat kepolaran yang tinggi juga terdistribusi di dalamnya. Berdasarkan penelitian Affandi (2006), pada uji fitokimia Alkaloid, flavonoid, dan tanin menunjukkan hasil positif. Senyawa-senyawa ini merupakan senyawa penangkal radikal bebas yang mampu menghambat reaksi oksidasi.
Pada konsentrasi 200 ppm ekstraksi etanol memiliki daya hambat yang lebih tinggi Hal ini disebabkan senyawa yang terkandung pada ekstrak keladi tikus lebih banyak terdistribusi pada etanol, meskipun tingkat kepolarannya lebih rendah dari akuademineral dan air panas. Berdasarkan hasil tersebut dapat disimpulkan bahwa daya hambat antioksidan tidak selamanya berbanding lurus dengan tingkat kemurnian dan kepolaran dari pelarut yang digunakan.
Sementara itu, pada konsentrasi 1000 ppm daya hambat akuademineral dan air panas memiliki nilai yang sama tetapi lebih tinggi dari etanol. Hal ini disebabkan, pada konsentrasi diatas batas maksimal (200 ppm) memiliki perbedaan potensi antioksidan yang tidak begitu terlihat, sehingga sulit dibedakan pengaruh tingkat kemurnian dan kepolaran suatu pelarut. Hasil uji potensi antioksidan ekstrak keladi tikus dapat dilihat pada Lampiran 12.
Berdasarkan hasil penelitian yang diperoleh disimpulkan bahwa buah mahkota dewa, temu putih, sambiloto dan keladi tikus dengan tiga macam jenis ekstrak, yaitu akuademineral, air panas dan etanol sangat berpotensi sebagai antioksidan. Hal ini dapat dilihat pada konsentrasi 200 ppm nilai daya
hambat masing- masing ekstrak tersebut mendekati nilai daya hambat vitamin E.
Alkaloid dan flavonoid memberikan hasil positif pada semua jenis tanaman yang diuji (Salim 2006). Flavonoid dan alkaloid merupakan senyawa pereduksi yang baik. Flavonoid bertindak langsung sebagai penampung yang baik untuk radikal bebas hidroksil dan superoksida (Robinson 1995). Menurut Mangan (2003), zat flavonoid berfungsi sebagai penangkal radikal bebas yang dapat mengacaukan sistem keseimbangan tubuh dan dapat memicu timbulnya kanker.
Tanin merupakan senyawa yang banyak dalam tanaman teh. Berdasarkan hasil pene-litian Yen (1995) dilaporkan bahwa berbagai jenis teh memilki aktivitas antioksidan. Berdasarkan hasil penelitian itu juga tanin dapat menghambat proses mutasi dan kanker. Radikal bebas dan menginduksi enzim yang bersifat sebagai antioksidan.
Saponin di dalam tumbuhan diketahui telah dapat dimanfaatkan untuk pengobatan. Saponin yang terkandung dalam tanaman cuplikan (Physalis angulota Linn.) berkhasiat sebagai antitumor dan menghambat pertumbuhan kanker terutama kanker usus besar (Mangan 2003). Selain itu saponin yang terdapat dalam tanaman kunyit, tapak dara, sabung nyawa, mengkudu, kitolod dan pegagan memilki khasiat sebagai antikanker.
Uji Statistik ANOVA dan DUNCAN
Uji statistik yang digunakan untuk potensi antioksidan yaitu dengan ANOVA dan DUNCAN. Uji ini hanya dilakukan pada konsentrasi 200 ppm untuk masing-masing tanaman pada ekstraksi akuademineral, air panas, dan etanol yang langsung dibandingkan dengan vitamin E (200 ppm).
Uji statistik ANOVA ekstrak mahkota dewa, temu putih, sambiloto, dan keladi tikus menunjukkan hasil yang berbeda nyata. Hal ini dapat dilihat dari nilai F hitung yang lebih besar dari F tabel (Lampiran 13). Oleh karena itu perlu dilakukan uji lanjut dengan menggunakan uji DUNCAN untuk melihat apakah ada perbedaan potensi antioksidan pada ekstraksi akuademineral, air panas, etanol dan vitamin E pada masing-masing tanaman. Uji DUNCAN menunjukkan hasil yang berbeda dari masing-masing ekstrak tanaman. Hal ini disebabkan karena kandungan senyawa metabolit sekunder yang terdapat di dalam ekstrak berbeda sehingga
10
daya hambatnya terhadap pembentukan MDA berbeda pula.
SIMPULAN DAN SARAN
Simpulan
Ekstrak mahkota dewa, temu putih, sambiloto, dan keladi tikus memiliki potensi sebagai antioksidan berdasarkan kemam-puannya dalam menghambat pembentukan MDA. Data hasil penelitian menunjukkan bahwa daya hambat terkecil terdapat pada ekstrak keladi tikus sebesar 24,32% pada konsentrasi 50 ppm dengan pelarut air panas. Sedangkan daya hambat terbesar terdapat pada ekstrak temu putih pada konsentrasi 1000 ppm se-besar 86,27% dengan pelarut yang sama.
Uji statistik ANOVA masing-masing tanaman pada konsentrasi 200 ppm untuk ekstrak akuademineral, air panas, etanol, dan vitamin E menunjukkan hasil yang berbeda nyata. Uji statistik DUNCAN menunjukkan bahwa potensi antioksidannya berbeda.
Saran
Perlu dilakukan penelitian lanjutan dengan metode yang berbeda untuk menguji aktivitas antioksidan beberapa tanaman obat. Selain itu perlu dilakukan uji aktivitas antioksidan tana-man mahkota dewa, temu putih, sambiloto, dan keladi tikus sebagai antikanker secara in vivo.
DAFTAR PUSTAKA
Affandi Y. 2006. Daya hambat ekstrak air dan etanol keladi tikus (Typhonium flagelliforme) terhadap enzim tirosin kinase secara in vitro. [Skripsi]. Bogor: fakultas matematika dan ilmu pengetahuan alam, Institut Pertanian Bogor.
Atmosukarto K. 2003. Mencegah penyakit degeneratif dengan makanan. Cermin dunia kedokteran 140: 41-49.
Chen J et al. 1996. The Protective effect of tea on cancer: Human Evidance. Di dalam Phytochemicals As Bioactive Agents. Basel: Technomic Publishing Co., inc.
Ernawati MDW. 2001. Aktivitas antioksidan ekstrak daun sicerek (Clausena eccavata
Burm.F). [Skripsi]. Jambi: Universitas Jambi.
Flack M, Rumawas F. 1996. Plant Resources of South East Asia: Plants Yielding Non-seed Carbohydrates. V.9. Bogor: Prosea.
Gitawati R. 1995. Radikal bebas-sifat dan peran dalam menimbulkan kerusakan/kematian sel. Cermin dunia kedokteran 102: 33-36.
Halliwel B. 1995. Oxygen radicals. A commonsense look at their nature and medical importance. Medical Biology 62:71-77
Harmanto N. 2002 Mahkota Dewa Obat Pusaka Para Dewa. Jakarta: Agromedia Pustaka.
Indariani S. 2005. Uji aktivitas antioksidan ekstrak daun jambu biji (psidium guajava L.). Pusat studi Biofar-maka,LPPM-IPB.
Kartikawati D. 1999. Studi efek protektif vitamin C dan E terhadap respon imun dan enzim antioksidan pada mencit yang dipapar paraquat [tesis] Bogor: Program pascasarjana, Institut pertanian Bogor.
Kikuzaki H & Nakatani N. 1993. Antioxidant effect of some ginger constituents. Journal of Food Science 58(6);1407-1410.
Mangan. 2003. Cara bijak Menaklukan Kanker. Jakarta:Agromedia pustaka.
Murray RK. 1999. Biokimia harper. Hartono A, penerjemah; Santoso AH,editor.Jakarta: Penerbit Buku Kedokteran EGC. Terjemahan dari: Harper’s Biochemistry.
Pratiwi W. 2006. Penetuan daya inhibisi ekstrak air dan etanol temu putih (Curcuma zeodaria) terhadap aktivitas tirosin kinase secara in vitro. [Skripsi]. Bogor: fakultas matematika dan ilmu pengetahuan alam, Institut Pertanian Bogor.
11
Robinson T. 1995. Kandungan Organik Tumbuhan Tinggi. Bandung: Penerbit ITB.
Salim. 2006. Penentuan daya inhibisi ekstrak air dan etanol daging buah mahkota dewa (Phaleria macrocarpa (Scheff.)Boerl.) Terhadap aktivitas enzim tirosin kinase secara in vitro. [Skripsi]. Bogor: fakultas matematika dan ilmu pengetahuan alam, Institut Pertanian Bogor.
Satria E. 2005. Potensi antioksidan dari daging buah mahkota dewa (Phaleria macrocarpa (Scheff.) Boerl.) [Skripsi]. Bogor: fakultas matematika dan ilmu Pengetahuan Alam, Institut Pertanian Bogor.
Santoso A. 2001. Isolasi senyawa bioaktif yang berpotensi antioksidan dari daun benalu the Scurrula atropurpurea (BL.) danser [Skripsi]. Bogor: Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor.
Siregar P. 1992. Metabolit oksigen radikalbebas dan kerusakan jaringan. Cermin Dunia Kedokteran 80:112-115
Soedibyo M et al. 1998. Inventaris Tanaman Obat Indonesia (II). Jakarta: Depkes RI.
Syukur C, Hernani. 2001. Budi Daya Tanaman Obat Komersial. Bogor: Penebar Swadaya.
Tang W, Eisenbrand G. 1992. Chinese Drugs of Plant Origin: Chemistry, Pharmacology, and Use in Traditional and Modern Medicine. Berlin: Springer Verlag.
Taryono R. 2002. Mahkota Dewa Si Raja Obat. Warta Balitro 45: 45-49.
Utami KP. 2000. Temu putih redam kanker leher rahim. Trubus 31 (366):19-20.
Wijaya H. 2005. Mahkota Dewa Obat Pusaka Para Dewa. www.bhineka.com [4 Mei 2006].
Wijayakusuma HMH. 1994. Hidup Sehat Secara Hembing. Buku 6. Jakarta: PT Gramedia.
Winarto WP. 2003. Mahkota dewa: Budi daya dan pemanfaatan Untuk Obat Jakarta: Agromedia Pustaka.
Widowati L. 2004. Obat Tradisional. Depkes RI, [4 Mei 2006].
Yagi K. 1968. Assay for serum lipid peroxide. Vitamin 39: 105
Yagi K. 1994. Lipid peroxides and related radicals in linical medicine. Di dalam free Radical in Diagnostic Medicine. Newyork: Plenum Press.
Yen GC. 1995 Antioxidant Activity of various extracts in relation to their antimutagenicity. J Agric Food Chem 43:27-32.
13
Lampiran 1 Diagram alir penelitian
Ekstrak Temu Putih, Sambiloto, Mahkota Dewa, dan Keladi
Air panas
Kontrol negatif
Ekstrak Kasar
Vitamin E
(
α
-Tokoferol) 200
ppm
Larutan uji 50, 200,
1000 ppm
Akuademineral
Etanol 70%
Uji TBA
Analisis Hidroperoksida
14
Lampiran 2 Diagram analisis hidroperoksida dari asam linoleat dengan metode tiosianat
Botol gelap
+ 2 ml buffer fosfat 0,1 M pH 7
+ 2 ml asam linoleat 50 mM dalam etanol 99,8% +1 ml air bebas ion
Inkubasi 40ºC
Larutan diatas dipipet 50µL + 6 ml etanol 75%
+ 50µL ammonium tiosianat
+ 50µL FeCI2 0,02 M dalam HCI 3,5%
Didiamkan 3 menit
Diukur absorbansi pada hari ke-1 sampai ke-7 panjang gelombang 482 nm
Lampiran 3 Pembuatan kurva standar
Tetrametoksi propana
0,15µM 0,3µM 0,6µM 0,75µM 1,5µM 3,0µM
Tiap larutan dipipet 1 ml
+2 ml TCA 20%
+2 ml TBA 1% dalam asam asetat 50% Tabung reaksi
Inkubasi T= 100ºC, t=10 menit Didinginkan
Sentrifugasi 3000 rpm, t= 15 menit
15
Lampiran 4 Pengukuran kadar malondialdehida sampel
Larutan uji 50, 200, 1000 ppm Kontrol negatif tanpa antioksidan vitamin E 200 ppm
Inkubasi 40ºC Hari ke-8
Tiap larutan dipipet 1 ml
+2 ml TCA 20%
+2 ml TBA 1% dalam asam asetat
Tabung reaksi
Inkubasi T=100ºC, t= 10 menit Didinginkan
Sentrifugasi 300 rpm, t= 15 menit
Diukur absorbansi pada panjang gelombang 532 nm
Lampiran 5 Struktur asam linoleat
CH3(CH2)4CH=CHCH2CH=CH(CH2)7COOH
Lampiran 6 Struktur vitamin E
Lampiran 7 Hasil uji potensi antioksidan vitamin E dan kontrol negatif
Perlakuan Absorbansi Absorbansi
rata-rata
Kadar MDA (µM)
Kontrol negatif 0.6904 0.682 27.2958
0.6861 0.6696
Vitamin E (kontrol positif) 0.0904 0.0886 2.5708
0.0861 0.0843
O O
H
CH3
CH3
C H3
CH3
CH3
CH3
CH3
16
Kurv a Standar TM P
y = 0.024x + 0.0269
R2 = 0.9982
0 0.02 0.04 0.06 0.08 0.1 0.12
0 1 2 3 4
Konsentrasi (µM)
A
b
so
rb
an
(5
3
2
n
m
)
Lampiran 8 Absorbansi standar TMP (1,1,3,3-tetrametoksipropana)
Absorbansi Konsentrasi
(µM) 1 2
Absorbansi rata-rata
0,15 0,0264 0,0366 0,0315
0,3 0,0325 0,0327 0,0326
0,6 0,0376 0,0436 0,0406
0,75 0,0417 0,0485 0,0451
1,5 0,0675 0,0611 0,0643
17
Lampiran 9 Hasil uji potensi antioksidan dengan metode TBA buah mahkota dewa
Perlakuan Absorbansi Absorbansi rata-rata Kadar MDA (µM)
1.Akuadem
50 ppm 0.2062 0.2062 7.4708
0.2076 0.2048
200 ppm 0.1128 0.1129 3.5833
0.1113 0.1146
1000 ppm 0.1068 0.1068 3.3292
0.1101 0.1035
2. Air panas
50 ppm 0.2644 0.2654 9.9375
0.2692 0.2628
200 ppm 0.2034 0.1987 7.1583
0.1884 0.2048
1000 ppm 0.1662 0.162 5.6292
0.1637 0.1561
3. Etanol 70 %
50 ppm 0.2132 0.2095 7.6083
0.2048 0.2104
200 ppm 0.1239 0.1238 4.0375
0.1239 0.1237
1000 ppm 0.0969 0.0951 2.8416
18
Lampiran 10 Hasil uji potensi antioksidan dengan metode TBA temu putih
Perlakuan Absorbansi Absorbansi rata-rata Kadar MDA (µM)
1.Akuadem
50 ppm 0.3768 0.3747 14.4917
0.3747 0.3726
200 ppm 0.266 0.2714 10.1875
0.2823 0.266
1000 ppm 0.1965 0.1893 6.7666
0.1831 0.1884 2. Air panas
50 ppm 0.2090 0,2164 7,8958
0,2198 0.2204
200 ppm 0.1215 0.1177 3.7833
0.1146 0.1169
1000 ppm 0.0947 0.0936 2.7792
0.0936 0.0926 3. Etanol 70%
50 ppm 0.2262 0.2433 9.0167
0.2487 0.2549
200 ppm 0.2147 0.2095 7.6083
0.2034 0.2104
1000 ppm 0.2297 0.1402 4.7208
19
Lampiran 11 Hasil uji potensi antioksidan dengan metode TBA sambiloto
Perlakuan Absorbansi Absorbansi rata-rata Kadar MDA (µM)
1. Akuadem
50 ppm 0.1765 0.1735 6.1083
0.1713 0.1726
200 ppm 0.1261 0.1265 4.15
0.1319 0.1215
1000 ppm 0.0926 0.0943 2.8083
0.0958 0.0947 2. Air panas
50 ppm 0.2262 0.2083 7.5583
0.2062 0.1952
200 ppm 0.1898 0.1866 6.6542
0.1858 0.1844
1000 ppm 0.1649 0.1575 5.4417
0.1415 0.1662 3. Etanol 70%
50 ppm 0.2457 0.2421 8.9666
0.2411 0.2395
200 ppm 0.2161 0.2185 7.9833
0.219 0.2204
1000 ppm 0.1871 0.177 6.2541
20
Lampiran 12 Hasil uji potensi antioksidan dengan metode TBA keladi tikus
Perlakuan Absorbansi Absorbansi rata-rata Kadar MDA (µM)
1. Akuadem
50 ppm 0.2411 0.2452 9.0958
0.2396 0.2549
200 ppm 0.1925 0.2141 7.8
0.2161 0.2336
1000 ppm 0.1439 0.1455 4.9417
0.1475 0.1451 2. Air panas
50 ppm 0.5171 0.5161 20.3833
0.5143 0.5171
200 ppm 0.2441 0.2487 9.2417
0.2503 0.2518
1000 ppm 0.1662 0.1675 5.8583
0.1688 0.1675 3. Etanol 70%
50 ppm 0.3456 0.3565 13.7333
0.3585 0.3565
200 ppm 0.1884 0.1898 6.7875
0.1898 0.1911
1000 ppm 0.1662 0.1637 5.7
0.1574
0.1675
Contoh perhitungan:
%
100
%
x
Ablanko
Asampel
Ablanko
Inhibisi
=
−
%
100
682
.
0
2062
.
0
682
.
0
x
−
=
%
7654
.
69
21
Lampiran 13 Analisis statistik potensi antioksidan ekstrak mahkota dewa
Uji Anova menunjukkan hasil yang berbeda nyata
Lampiran 14 Analisis statistik potensi antioksidan ekstrak temu putih
Uji Anova menunjukkan hasil yang berbeda nyata
Duncana
3 2.501400
3 3.583367
3 4.038900
3 7.165300
1.000 1.000 1.000 1.000
MDA vitE
akudemineral etanol air panas Sig.
N 1 2 3 4
α
= 0.05ANOVA
36.074 3 12.025 290.987 .000
.331 8 4.132E-02
36.405 11
Perlakuan Galat Total
JK
df KT F hitung Sig.
ANOVA
111.876 3 37.292 599.760 .000
.497 8 6.218E-02
112.373 11
Perlakuan Galat Total
JK
df KT F hitung Sig.
22
Lanjutan Lampiran 12
Uji Duncan menunjukkan bahwa potensi antioksidan tiap pelarut dan vitamin E berbeda
Lampiran 15 Analisis statistik potensi antioksidan ekstrak sambiloto
Uji Anova menunjukkan hasil yang berbeda nyata
Duncana
3 2.501400
3 3.781967
3 7.608333
3 10.188900
1.000 1.000 1.000 1.000
MDA vitE air panas etanol akudemineral Sig.
N 1
α
2 3 4= 0.05
ANOVA
111.876 3 37.292 599.760 .000
.497 8 6.218E-02
112.373 11
Perlakuan Galat Total
JK
23
Lanjutan Lampiran 15
Uji Duncan menunjukkan bahwa potensi antioksidan tiap pelarut dan vitamin E berbeda
Lampiran 16 Analisis statistik potensi antioksidan ekstrak keladi tikus
Uji Anova menunjukkan hasil yang berbeda nyata
Uji Duncan menunjukkan bahwa potensi antioksidan tiap pelarut dan vitamin E berbeda
Duncana
3 2.501400
3 3.781967
3 7.608333
3 10.188900
1.000 1.000 1.000 1.000
MDA vitE air panas etanol akudemineral Sig.
N 1
α
2 3 4= 0.05
ANOVA
111.876 3 37.292 599.760 .000
.497 8 6.218E-02
112.373 11
Perlakuan Galat Total
JK
df KT F hitung Sig.