DIAGNOSIS JENIS
Shorea parvifolia
Dyer DAN
Shorea leprosula
Miq
BERDASARKAN
RANDOM AMPLIFIED POLYMORPHIC DNA
(RAPD)
Mukhamad Ari Hidayanto
E14201052
DEPARTEMEN MANAJEMEN HUTAN
FAKULTAS KEHUTANAN
DIAGNOSIS JENIS
Shorea parvifolia
Dyer DAN
Shorea leprosula
Miq
BERDASARKAN
RANDOM AMPLIFIED POLYMORPHIC DNA
(RAPD)
Mukhamad Ari Hidayanto
Karya Ilmiah
Sebagai salah satu syarat untuk
memperoleh gelar Sarjana Kehutanan
Fakultas Kehutanan Institut Pertanian Bogor
DEPARTEMEN MANAJEMEN HUTAN
FAKULTAS KEHUTANAN
LEMBAR PENGESAHAN
Judul Penelitian : Diagnosis Jenis S. parvifolia Dyer dan S. leprosula Miq Berdasarkan Random Amplified Polymorphic DNA (RAPD)
Nama Mahasiswa : Mukhamad Ari Hidayanto Nomor Pokok : E14201052
Menyetujui Dosen Pembimbing
Dr. Ir. Iskandar Z.Siregar, M.For.Sc NIP. 131878498
Mengetahui Dekan Fakultas Kehutanan
Prof. Dr. Ir. Cecep Kusmana, M.S NIP. 131430779
KATA PENGANTAR
Puji syukur penulis panjatkan kehadirat Alloh SWT karena berkat rahmat dan hidayah-Nya penulis dapat menyelesaikan skripsi ini. Sholawat dan salam juga penulis haturkan kepada Nabi Muhamad SAW yang senatiasa memberi suri tauladan yang baik sehingga membimbing penulis untuk tetap sabar dan tegar di jalan Islam.
Skripsi ini merupakan salah satu syarat untuk memperoleh gelar Sarjana Kehutanan Institut Pertanian Bogor. Skripsi yang berjudul “Diagnosis Jenis Shorea parvifolia Dyer dan Shorea leprosula Miq Berdasarkan Random Amplified Polymorphic DNA (RAPD)” diharapkan dapat membuka wacana keilmuan dalam bidang kehutanan, khususnya dalam diagnosis jenis tanaman. Selama ini diagnosis jenis masih banyak terjadi kesalahan, padahal diagnosis jenis adalah bagain awal dari pengenalan tumbuhan. Kesalahan dari awal akan berdampak panjang bagi pembelajaran berikutnya, sehingga dengan skripsi ini penulis berharap dapat mereduksi kesalahan-kesalahan yang seharusnya bisa dihindari, agar tidak terjadi kesalaan yang berakibat fatal.
Penulis menyadari sepenuhnya bahwa skripsi ini masih jauh dari sempurna, oleh sebab itu penulis mengharapkan kritik dan saran yang membangun. Dengan segala kerendahan hati penulis berharap semoga skripsi ini berguna bagi yang membutuhkan.
Bogor, Februari 2006
UCAPAN TERIMA KASIH
Pada Kesempatan ini, penulis dengan penuh kerendahan hati penulis menyampaikan penghargaan dan terima kasih kepada:
1. Kedua orang tua kami, Bapak Sungeb dan Ibu Toyibah serta ketiga Kakakku yang senatiasa mendoakan dan memberikan perhatian yang lebih kepada kami.
2. Dr. Ir. Iskandar Z. Siregar, M.For.Sc selaku Dosen pembimbing atas kesabaran dan keikhlasan memfasilitasi dalam penelitian, dan mengarahkan dalam penulisan skripsi.
3. Tatang Tiryana, S.Hut, M.S atas arahan dan konsultasi statistik yang diberikan.
4. Dr. Ir Agus Hikmat, M.Sc dan Dr. Ir. Wayan Hermawan, M.Sc selaku dosen penguji, terima kasih atas masukan-masukan dan sarannya.
5. Tedi Yunanto, S.Hut selaku teman seperjuangan dalam penelitian, penyusunan draf sampai selesainya skripsi ini.
6. Mas Zulfahmi, S.Hut yang selalu memberikan masukan ide, penjelasan mengenai ilmu dasar genetik.
7. Efi Rustining Tyas dan Dyiah Ayu Pandan Wangi yang telah rela merelakan waktunya untuk mengurus konsumsi dalam keperluan seminar dan sidang.
8. Rekan dan Rekanita Budi Daya Hutan angkatan 38 yang selalu mendukung dalam setiap langkah dengan kebersamaan dan kekompakan. 9. Rekan dan Rekanita Budi Daya Hutan angkatan 39 dan 40 yang
menginspirasikan penulis untuk segera selesai.
10.Semua pihak yang telah membantu baik secara langsung dan tidak langsung yang tidak bisa penulis sebutkan satu persatu.
RIWAYAT HIDUP
Penulis dilahirkan di Pacitan pada tanggal 2 Februari 1983 merupakan anak ke empat dari empat bersaudara, dari pasangan Pak Sungeb dengan Ibu Toyibah. Penulis Lulus TK Dharma Wanita Desa Semanten pada tahun 1989. Pada tahun 1989 penulis melanjutkan SDN Desa Semanten Pacitan dan lulus pada tahun 1995, kemudian melanjutkan SLTP Majelis Tafsir Alquran Gemolong, Sragen dan lulus pada tahun 1998. Pada tahun yang sama penulis melanjutkan jenjang pendidikan di SMU Majelis Tafsir Alquran Surakarta dan lulus tahun 2001.
Penulis diterima di Institut Pertanian Bogor (IPB) pada tahun 2001 melalui Undangan Seleksi Masuk IPB (USMI) dengan memilih departemen Manajemen Hutan, Fakultas Kehutanan. Tahun 2004 penulis melakukan Praktek Umum Kehutanan (PUK) di daerah Baturraden, Cilacap, Nusa Kambangan dan Praktek Umum Pengelolaan Hutan (PUPH) di KPH Blora, Cepu, Ngawi dan Lawu DS. Pada bulan Juni – Agustus 2005 penulis melakukan Kuliah Kerja Nyata (KKN) di Desa Karyamukti, Kecamatan Panyingkiran, Kabupaten Majalengka, Jawa Barat.
Selama menjadi mahasiswa penulis aktif dalam organisasi kemahasiswaan diantaranya sebagai Director Asean Forestry Student Association (AFSA) tahun 2004 – 2005, Vice Director Asean Forestry Student Association (AFSA) 2003-2004, Pengurus Koperasi Mahasiswa (KOPMA) IPB 2001 – 2003, Wakil Kepala Departemen Sosial Politik Badan Eksekutif Fakultas Kehutanan (BEM- E) tahun 2003, Wakil Ketua Simposium Nasional Kehutanan Pekan Ilmiah Kehutanan Nasional (PIKNAS) II tahun 2003. Delegasi Mahasiswa Kehutanan Indonesia dalam pembahasan isu kehutanan yang diadakan oleh Departemen Kehutanan tahun 2004. Ketua Komite Pengawas Pemilihan Raya BEM-E tahun 2005. Pernah menjadi Asisten Dosen Mata Kuliah Genetika Hutan, Pemuliaan Pohon, Sistem Sivikultur Hutan Alam, Ilmu Tanah Hutan, Silvikultur, Bioteknologi Hutan.
RINGKASAN
Mukhamad Ari Hidayanto. E14201052. Diagnosis Jenis Shorea parvifolia Dyer dan Shorea leprosula Miq Berdasarkan Random Amplified Polymorphic DNA (RAPD). Dosen Pembimbing: Dr.Ir. Iskandar Zulkarnaen Siregar, M.For.Sc
Shorea parvifolia dan Shorea leprosula termasuk jenis penting dalam hutan hujan tropis Indonesia. Dalam sebaran alaminya, jenis S. leprosula dan S. parvifolia sering ditemukan pada daerah yang sama, yaitu menyebar pada tipe hutan dataran rendah sampai pegunungan bawah dengan ketinggian 0 – 800 mdpl, yang meliputi pulau Sumatera, Kalimantan dan Jawa. Pada beberapa lokasi kedua jenis diatas memiliki karakter morfologi dari daun yang sulit dibedakan, terutama pada saat fase semai dan pancang. Sehingga hal tersebut dapat menyebabkan kesalahan diagnosis jenis. Diagnosis jenis dengan menggunakan karakter morfologi akan lebih akurat jika ditunjang dengan teknologi penanda ADN (Asam Deoksiribosa Nukleat) salah satunya menggunakan RAPD.
Penelitian ini dilakukan di Laboratorium Silvikultur, Departemen Manajemen Hutan, dengan tujuan untuk mempelajari karakter morfologi daun S. parvifolia dan S. leprosula dari beberapa lokasi yang dapat dijadikan sebagai alat diagnosis jenis dan mengkonfirmasikan hasil diagnosis jenisberdasarkan karakter morfologi daun dengan bantuan RAPD.
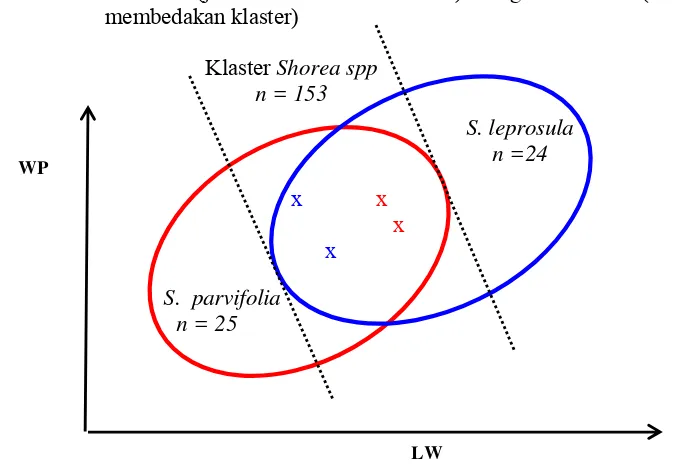
Dari 21 variabel yang digunakan dalam diagnosis jenis berdasarkan morfologi daun, didapatkan 2 variabel pengukuran yang dapat digunakan sebagai alat diagnosis yaitu variabel lebar daun (leaf wide, LW) dan jarak dari daun terlebar terhadap petiole (widest leaf to petiole, WP). Kedua variabel dapat digunakan sebagai alat diagnosis jenis karena korelasi kedua variabel tersebut 0,728 dan memiliki peta sebaran jenis yang dapat membedakan dengan jelas 2 klaster dari jenis S. parvifolia dan S. leprosula. Peta sebaran jenis berdasarkan korelasi LW-WP tersebut membagi 202 individu menjadi 3 klaster yaitu klaster S. parvifolia, klaster S. leprosula dan klaster Shorea spp. (campuran antara jenis S. parvifolia dan S. leprosula), dengan perincian 25 individu merupakan jenis S. parvifolia, 24 individu masuk jenis S. leprosula dan 153 individu masuk dalam jenis Shorea spp. Munculnya Shorea spp. mengindikasikan ketidakakuratan diagnosis jenis berdasarkan karakter morfologi daun antara jenis S. parvifolia dan
S. leprosula.
Konfirmasi dengan RAPD dilakukan untuk mengidentifikasi jenis individu-individu yang termasuk dalam klaster Shorea spp. sehingga status jenis dalam
Shorea spp. jelas. Dengan mengambil 5 sampel dari klaster S. parvifolia dan S. leprosula, serta 10 sampel dari klaster Shorea spp. didapatkan satu lokus penanda, yaitu lokus pertama pada primer OPY-13. Dengan ditemukan lokus penanda tersebut dapat dilakukan identifikasi jenis secara langsung, sehingga secara umum sebagian besar dari klaster Shorea spp. masuk dalam S. parvifolia.
Shorea spp. Dari dendrogram UPGMA berdasarkan individu terdapat 13 individu yang masuk dalam klaster S. parvifolia, sedangkan 7 individu masuk dalam klaster S. leprosula. Analisis berdasarkan individu didapatkan perbedaan genetik yang ditunjukkan oleh perbedaan jarak genetik yang tinggi antara individu S. spp
nomor 7 dan S. spp nomor 8 dengan klaster jenis S. parvifolia dan S. leprosula. Dengan penelitian ini disimpulkan bahwa karakter morfologi daun yang diwakili oleh LL dan WP dapat digunakan untuk diagnosis jenis S. parvifolia dan
DAFTAR ISI
Halaman
DAFTAR ISI ... i
DAFTAR TABEL ... iii
DAFTAR GAMBAR ... iv
DAFTAR LAMPIRAN ... v
I. PENDAHULUAN 1.1. Latar Belakang ... 1
1.2. Tujuan Penelitian ... 2
1.3. Hipotesis ... 2
II.TINJAUAN PUSTAKA 2.1. Taksonomi S. parvifolia Dyer ... 3
2.2. Taksonomi S. leprosula Miq ... 4
2.3. Manfaat Penanda Genetik ... 5
2.4. Variasi Genetik ... 6
2.5. Pengukuran Variasi Genetik ... 7
2.6. Polymerase Chain Reaction (PCR) ... 8
2.7. Random Amplified Polymorphic DNA (RAPD) ... 10
III. METODOLOGI PENELITIAN 3.1. Tempat dan Waktu Penelitian ... 15
3.3. Bahan Dan Alat Penelitian ... 15
3.3. Prosedur Penelitian... 15
IV. HASIL DAN PEMBAHASAN 4.1. Hasil ... 22
4.1.1. Karakterisasi Jenis Berdasarkan Morfologi Daun ... 22
4.1.2. Karakterisasi Jenis Berdasarkan Analisis Penanda Genetik ... 25
4.1.2.1. Variasi Genetik dalam Popolulasi ... 26
4.1.2.2. Variasi Genetik antar Populasi ... 27
4.2.1. Klarifikasi Jenis S. parvifolia dan S. leprosula Berdasarkan
Morfologi Daun dengan Penanda RAPD ... 30 4.2.2. Implikasi Klarifikasi Jenis S. parvifolia dan S. leprosula
Berdasarkan Morfologi Daun dengan RAPD ... 29 4.3. Implikasi Karakter Morfologi dan Genetik terhadap Penduga
Akurat Jenis Shorea parvifolia dan Shorea leprosula ... 32 V. KESIMPULAN DAN SARAN
5.1. Kesimpulan ... 36 5.2. Saran ... 36 DAFTAR PUSTAKA
DAFTAR TABEL
No Teks Halaman
1. Letak Geografis Lokasi Pengambilan Sampel Daun ... 14
2. Simbol dan Keterangan Variabel Pengukuran Morfologi Daun. ... 16
3. Komposisi Buffer Ekstrak Metode CTAB ... 18
4. Nama Primer dan Susunan Basa dalam Proses PCR-RAPD ... 21
5. Komposisi Bahan dalam Proses PCR-RAPD ... 21
6. Nilai Korelasi Variabel Pengkuran pada Morfologi Daun ... 22
7. Hasil Analisa Genetik Masing-masing Populasi ... 27
DAFTAR GAMBAR
No Teks Halaman
1. Prinsip Kerja PCR ... 10
2. Urutan Kegiatan Penelitian ... 13
3. Karakter Morfologi Variabel Pengukuran ... 16
4. Urutan Penomoran Daun ... 17
5. Perbedaan Variabel Morfologi Daun S. parvifolia dan S. leprosula ... 23
6. Perbandingan Peta Sebaran Jenis Berdasarkan Nilai Korelasi antara LW-WP (jelas membedakan klaster) dengan LL-WP (tidak jelas membedakan klaster) ... 24
7. Ilustrasi Klaster S. leprosula dan S. parvifolia ... 24
8. Hasil PCR-RAPD Primer OPY – 13 ... 25
9. Hasil PCR- RAPD Semua Primer ... 26
9a. Primer OPY-3 ... 26
9b. Primer OPY-13 ... 26
9c. Primer OPO-13 ... 26
10. Dendrogram Kedekatan Genetik antar Populasi ... 28
DAFTAR LAMPIRAN
No Teks Halaman
1. Hasil Uji Korelasi Semua Variabel ... 36
2. Keterangan Individu yang Dilakukan Pengujian Amplifikasi ADN ... 38
3. DataSkoring Hasil Amplifikasi ADN ... 39
4. Gambar Alat yang Digunakan dalam Penelitian ... 41
I. PENDAHULUAN
1.1.Latar Belakang
Shorea parvifolia dan Shorea leprosula tergolong jenis penting dalam hutan hujan tropis. Kedua jenis tersebut biasa dikenal dengan nama dagang meranti merah (red meranti). Selain memiliki karakteristik seperti golongan Shorea spp, yang pada umumnya memiliki tinggi total (TT) dan diameter setinggi dada (DBH) yang besar, jenis S. parvifolia dan S. leprosula memiliki sifat cepat tumbuh (fast growth) dengan rata-rata riap tahunan berkisar 1,2 cm. Dengan riap tersebut kedua jenis diatas akan memerlukan waktu yang lebih singkat untuk membentuk DBH dan TT yang sama dibandingkan dengan jenis Shorea spp yang lain.
Dalam sebaran alaminya, jenis S. leprosula dan S. parvifolia sering ditemukan pada daerah yang sama. Jenis tersebut menyebar pada tipe hutan dataran rendah sampai pegunungan bawah dengan ketinggian dari 0 – 800 mdpl, yang meliputi pulau Sumatera, Kalimantan dan Jawa. Pada beberapa lokasi kedua jenis diatas memiliki morfologi daun yang sulit dibedakan, terutama pada saat fase semai dan pancang. Hal ini berdampak pada kesalahan diagnosis jenis.
Diagnosis jenis pada tanaman kehutanan biasanya dilakukan oleh para pengenal tumbuhan/dendrolog. Dendrolog dituntut untuk dapat membedakan jenis tanaman kehutanan dengan menggunakan karakter morfologis (morphology characteristic) dengan mengacu dari pengalaman, buku literatur, dan pakar/ahli. Karakter morfologi atau penampakan luar (phenotype) merupakan ekspresi dari interaksi 2 faktor, yaitu faktor genetik (genotype) dan lingkungan (environment). Akibat diagnosis dengan menggunakan karakter morfologi saja, dapat menyebabkan rendahnya akurasi (ketepatan) diagnosis jenis.
Diagnosis jenis dengan menggunakan karakter morfologi akan lebih akurat jika ditunjang teknologi penanda ADN (Asam Deoksiribosa Nukleat). Contoh penggunaan teknologi penanda ADN dapat dilakukan dengan Restriction Fragmen Length Polymorfism (RFLP), Random Amplified Polymorphic DNA
jenis dengan menggunakan karakter morfologi daun S. parvifolia dan S. leprosula
kemudian dilanjutkan dengan pengklarifikasian menggunakan teknologi penanda ADN untuk meningkatkan akurasi diagnosis jenis terutama kedua jenis diatas belum banyak dilakukan dan perlu dikembangkan lebih lanjut.
1.2. Tujuan
Tujuan penelitian ini adalah:
1. Mempelajari karakter morfologi daun S. parvifolia dan S. leprosula dari beberapa lokasi yang dapat dijadikan sebagai alat diagnosis jenis.
2. Mengkonfirmasikan hasil diagnosis jenis S. parvifolia dan S. leprosula
berdasarkan karakter morfologi daun dengan bantuan penanda genetik RAPD.
1.3. Hipotesis
Hipotesis yang akan diuji pada penelitian ini adalah:
1. Terdapat karakter morfologi daun S. parvifolia dan S. leprosula yang dapat dijadikan alat diagnosis jenis.
II. TINJAUAN PUSTAKA
2.1. Taksonomi S. parvifolia Dyer
Klasifikasi S. parvifolia adalah sebagai berikut: Kingdom : Plantae
Devisi : Magnoliophyta Klas : Magnoliospida Ordo : Malvales Famili : Dipterocarpaceae Sub Famili : Dipterocarpoidae Genus : Shorea
Spesies : Shorea parvifolia
Sub Spesies : parvifolia
S. parvifolia pada umumnya memiliki karakteristik daun sebagai berikut: susunan daun alternante, petiolate, bentuk daun membundar, menjorong atau membundar telur, panjang 5 – 8 cm, lebar 2,5 – 5 cm, panjang petiole 0.6 – 1.5 cm ada yang berbulu dan ada yang tidak, bagian permukaan atas daun halus, bagian pangkal daun membulat, jumlah pertulangan sekunder (veins) 9–13 pasang, dometiana kadang ada, jika ada berada terangkat di ketiak, tulang tersier jelas terlihat dan mirip tangga (Rudjiman, 2002 dan Kebler, 2000).
S. parvifolia dengan nama lain meranti sarang punai termasuk dalam famili Dipterocarpaceae. Kayu dari jenis ini di dalam perdagangan digolongkan dalam kelompok meranti merah dan merupakan kayu ekspor yang penting dari hutan-hutan Kalimantan dan Sumatera.
Selain di Kalimantan dan Sumatera jenis ini juga banyak terdapat di hutan-hutan Malaysia, Serawak, Brunei dan Sabah. Meranti merah biasanya tumbuh berkelompok di hutan Dipterocarpaceae dataran rendah dan bukit sampai ketinggian 800 meter di atas permukaan laut, pada tanah liat dan tanah pasir dengan drainase baik.
Pohon S. parvifolia dapat berbunga setiap waktu, kecuali bulan Maret. Perbungaan berbentuk malai, terletak pada ujung ranting atau ketiak daun. Buah berbentuk bulat telur atau panjang, ujung lancip dengan ukuran panjang bervariasi, kebanyakan 1 cm. Buah bersayap, tiga sayap bagian luar lebar dengan panjang 6 cm dan sayap lainnya lebih pendek.
Kayu jenis ini terdiri dari kayu gubal berwarna kuning muda dan kayu teras berwarna merah. Berat jenis 0.45 - 0.62. Kayu ini termasuk kelas awet III - IV dan kelas kuat II - IV, mudah diserang jamur busuk putih (white rot), tetapi tahan terhadap serangan jamur busuk kering (dry rot). Pada umumnya kayu S. parvifolia
banyak digunakan sebagai sambungan, perabot rumah tangga, bahan bangunan, kayu lapis, lantai, papan dinding, bahan.
2.2. Taksonomi S. leprosula Miq
Klasifikasi S. leprosula adalah sebagai berikut: Kingdom : Plantae
Devisi : Magnoliophyta Klas : Magnoliospida Ordo : Malvales Famili : Dipterocarpaceae Sub Famili : Dipterocarpoidae Genus : Shorea
Spesies : Shorea leprosula
Adapun karakteristik daun jenis S. leprosula yaitu memiliki susunan daun alternate, petiolate, bentuk daun lonjong, menjorong atau membundar telur sungsang, panjang daun 6 – 14,5 cm lebar 3,5 – 7,5 cm, panjang petiole 0.9 – 2.3 cm berbulu lebat, permukaan bawah daun kasar jika disentuh, tulang sekunder 10– 16 pasang, tulang daun sekunder hampir tidak ada, dometia ada yang memanjang pada tulang daun utama atau menyebar pada tulang daun sekunder berbentuk sisik, pipih (Rudjiman, 2002 dan Kebler, 2000).
Berat jenis kering udara kayunya 0,51 dengan kayu gubal tipis berwarna putih sampai kuning dan kayu teras tebal berwarna merah coklat. Kayunya agak lunak dan peka terhadap serangan beberapa hama penggerek kayu atau penyakit-penyakit kayu lainnya, bila dibiarkan terbuka atau berhubungan langsung dengan tanah. Kayunya mudah dikerjakan, tidak mudah pecah atau mengkerut, termasuk kelas awet III - IV serta kelas kuat III-IV (Tantra, 1983).
S. leprosula berbunga setiap 2-3 tahun sekali pada bulan Juni-September. Berbuah muda pada bulan Oktober-Desember dan berbuah masak bulan Desember-Maret. Produksi buah berkisar antara 36.000-249.000 buah per pohon dan yang berhasil masak hanya 5.000-11.400 buah, biasanya disebabkan oleh serangan hama. Jenis ini dalam 1 kg memiliki 1.900-2.268 biji. S. leprosula pada umur 13 tahun telah mampu mengadakan pembungaan dan pembuahan sekali dalam interval 3-5 tahun, setelah terjadi periode kering yang nyata.
S. leprosula tersebar merata hampir di seluruh hutan dipterocarpaceae dataran rendah di Malaysia, Sumatera dan Kalimantan, dimana temperatur dan curah hujan relatif tinggi sepanjang tahun, serta tumbuh dan berkembang bila curah hujan tahunan rata-rata berkisar antara 2.000 - 2.500 mm dengan selang temperatur hanan antara 22,2°C sampai 32,2°C.
S. leprosula tumbuh pada hampir semua jenis tanah yang berdrainase baik dan bahkan tumbuh juga pada tanah-tanah yang memiliki sifat-sifat fisik dan kimia yang buruk. Pertumbuhan terbaik adalah pada tanah-tanah berlereng, bergelombang atau berbukit, agak kurang pada tanah-tanah datar dan tidak pernah ada pada tanah-tanah berlumpur atau di muara-muara sungai. Di Sumatera dan Kalimantan tumbuh sampai ketinggian 500 mdpl (Bappenas, 2003).
2.3. Manfaat Penanda Genetik
reproduksi (meliputi sistem perkawinan dan aliran gen), (5) Bukti selektifitas (misalnya berkaitan dengan praktek pengelolaan hutan atau perubahan lingkungan), (6) Identifikasi lokus sifat kuantitatif atau Quantitative Trait Loci (QTLs) Finkeldey (2005).
Dari beberapa manfaat tersebut yang berkaitan langsung dengan penelitian ini adalah identifikasi klon, identifikasi hibrid dan pengukuran variasi genetik dalam dan antar populasi. Menurut Kamus Pemuliaan Pohon yang diterbitkan Departemen Kehutanan (2004) pengertian klon adalah populasi yang terdiri dari sel-sel atau individu yang identik genetiknya. Seperti populasi yang diperoleh melalui pembelahan mitosis atau reproduksi aseksual. Sedangkan hibrid adalah turunan yang secara genetik jelas berasal dari tetua yang berbeda. Istilah hibrid diterapkan untuk keturunan yang berasal dari perkawinan dalam spesies disebut intraspesifik, jika antar spesies dinamakan interspesifik.
2.4. Variasi Genetik
Variasi genetik suatu spesies adalah hasil dan perkembangbiakan secara seksual. Pada proses perkembangbiakan seksual terjadi peristiwa meiosis yang mereduksi jumlah kromosom diploid (2n) dalam sel tetua menjadi haploid (n) dalam gamet, mengikuti hukum segregasi bebas seperti diungkapkan oleh Mendel (Hukum Mendel 1). Selanjutnya diperjelas lagi pada Hukum Mendel 2 meiosis kromosom homolog juga akan mengalami pindah silang dan kadang-kadang terjadi perubahan susunan genetik. Selain perkawinan dan mutasi ditambahkan oleh Finkeldey (2005) bahwa migrasi, aliran genetik, penyimpangan genetik, dan proses seleksi. Keragaman genetik adalah suatu besaran yang mengukur variasi fenotip yang disebabkan oleh faktor-faktor genetik. Fenotip salah satu tanaman akan berbeda dengan tanaman yang lainnya dalam satu atau beberapa hal.
memberikan peluang yang lebih besar diperolehnya karakter-karakter yang diinginkan.
Soerianegara dan Djamhuri (1979) mempertegas bahwa dalam satu jenis pohon dapat dijumpai keragaman geografis (antar provenan), keragaman lokal (antar tempat tumbuh), dan keragaman dalam pohon serta keragaman antar pohon. Ada dua sebab yang menimbulkan keragaman, yaitu perbedaan lingkungan dan perbedaaan susunan genetik. Keragaman lingkungan biasanya disebabkan oleh perbedaan tempat tumbuh, sifat tanah, atau jarak tanam. Adapula keragaman yang tidak dapat diterangkan dengan perbedaan tempat tumbuh, misalnya perbedaan bentuk batang, taper batang, tebal cabang, dan berat jenis
Kayu dan pohon-pohon dalam suatu tegakan. Dalam hal ini keragaman dipengaruhi oleh perbedaaan genetik yang diturunkan tetua kepada keturunannya (keragaman genetik). Adanya keragaman dalam suatu jenis perlu diketahui lebih dahulu sebelum memulai dengan pemuliaan pohon, karenakeragaman genetik merupakan syarat mutlak dalam pemuliaan, yaitu untuk memungkinkan seleksi dan untuk mencegah dihasilkannya tanaman yang tidak bermutu.
2.5. Pengukuran Variasi Genetik
Variasi genetik dapat diukur dengan dua metode yaitu dalam populasi dan antar populasi. Variabel yang sering digunakan untuk mencirikan variasi genetik dalam populasi yaitu: (1) Persentase Lokus Polimorfik (PLP), suatu lokus gen dikatakan polimorfik jika sekurang-kurangnya ada dua varian yang berbeda (alel) dijumpai. Suatu lokus gen dikatakan monomorfik jika tidak memperlihatkan variasi genetik. Suatu lokus gen dikatakan polimorfik jika frekuensi dari alel yang paling sering ditemukan adalah kurang dari 95%. (2) Multiplisitas Genetik dan Rata-rata Jumlah Alel per Lokus (A/L), multiplisitas alel dari populasi pada lokus tunggal adalah jumlah alel yang diamati tanpa memandang frekuensi alelnya. Jumlah rata-rata alel tiap lokus gen (A/L) dihitung dengan menjumlahkan semua alel yang diamati pada L
Adapun variabel yang digunakan untuk mencirikan variasi genetik antar populasi yaitu: (1) Jarak Genetik, jarak genetik digunakan untuk mengukur perbedaan struktur genetik antar dua populasi pada suatu lokus gen tertentu. Sebagian besar tetapi tidak semua ukuran jarak bervariasi antara 0 dan 1. Nilai minimum 0 diperoleh jika struktur genetik dari dua populasi identik. Nilai maksimum 1 dicapai jika dua populasi tidak membagi apapun tipe genetik (alel atau genotipe). Perbedaan genetik lebih dari dua populasi biasanya dianalisa oleh sebuah matrik dengan elemen-elemennya berupa jarak genetik dengan pasangan kombinasinya yaitu populasi. (2) Pembagian Variasi Genetik (FST dan GST), FST (GST) adalah suatu ukuran
diferensiasi secara relatif terhadap keseluruhan keragaman. Konsep pembagian variasi genetik dalam sebuah komponen dalam dan satu komponen di antara populasi (FST) merupakan ukuran yang lebih luas digunakan dibandingkan dengan perhitungan diferensiasi genetik δ. (3) Analisis Klaster/kelompok, analisis klaster adalah metode untuk menggambarkan perbedaan genetik antar populasi secara geografis. Hal ini didasarkan atas perhitungan jarak genetik. Populasi dengan jarak genetik yang kecil, yaitu populasi yang secara genetik sama, bersatu pertama kali dan kemudian bersatu lagi dengan populasi yang secara genetik berbeda jarak. Dalam cara ini, pohon keturunan dapat digambarkan yang mempermudah pengkajian pola diferensiasi genetik populasi-populasi. Populasi tunggal atau OTUs (Original Taxonomic Units) biasanya berklaster menjadi beberapa cabang pohon. Analisis klaster dapat digunakan untuk mengetahui keberadaan hibrid (Finkeldey, 2005).
2.6. Polymerase Chain Reaction (PCR)
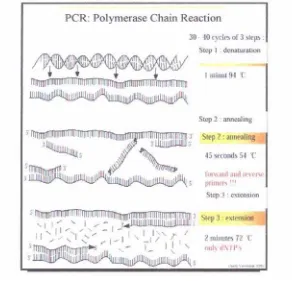
PCR adalah metode untuk menggandakan ADN yang diisolasi pada sebuah tabung reaksi kecil dengan melalui replikasi berulang. Proses PCR memiliki 3 tahap, yaitu :
(1) Denaturasi
lebih lama dalam tahap denaturasi. Hal ini akan berimplikasi pada turunnya kemampuan enzim taq ADN polimerase (Yonatan, 1998).
(2) Annealing
Annealing merupakan tahapan penempelan primer pada ADN cetakan. Suhu annealing tergantung pada panjang dan jumlah basa G (guanin) dan C (sitosin) yang terdapat pada primer serta konsentrasi garam dalam buffer. Konsentrasi garam dapat ditentukan dengan persamaan berikut:
Konsentrasi Garam (M) = 0,67 (Konsentrasi Tris – HCl) (Yonatan, 1998).
Besarnya suhu annealing yang digunakan dapat dirumuskan sebagai berikut: C = Banyaknya basa sitosin dalam primer yang digunakan N = panjang primer (dalam bp)
(3) Ekstension
Ekstension merupakan tahap polimerisasi nukleotida oleh enzim Taq ADN polimerase. Reaksi polimerisasi nukleotida dimulai dari ujung 5’ – fosfat dan berakhir pada ujung 3’ gugus hidroksil (OH). Suhu yang digunakan pada tahap ini berkisar antara 70 – 74oC karena pada selang suhu tersebut enzim Taq ADN polimerase bekerja optimum. Lamanya tahap ekstention berkisar dari 1 – 2 menit. Jika waktu pada tahap ini terlalu lama akan menghasilkan produk amplifikasi yang tidak spesifik (Saiki et al. dalam Yonatan,1998). Pembagian tahapan dan ilustrasi proses disajikan dalam Gambar 1.
Gambar 1 Prinsip Kerja PCR Sumber: Rimbawanto (1999)
2.7. Random Amplified Polymorphic DNA (RAPD)
keanekaragaman, (2) Hubungan antar filogenetik, (3) Identifikasi dan verifikasi galur, (3) Kesehatan dan Epidemiologi, (4) Teknologi Pangan dan (5) Ekologi Molekuler. Metode RAPD juga dapat diterapkan dalam penelitian pada bakteri, jamur, serangga, tanaman, alga, dan manusia.
Dengan menggunakan RAPD dapat dibuktikan bahwa hasil yang didapat dapat diandalkan, canggih, dan sangat cepat. Adapun fitur utama RAPD adalah: (1) Digunakan secara umum sehingga ADN apa saja dapat dikelompokkan tanpa perlu mengetahui urutan basa. (2) Sederhana karena tidak memerlukan ADN dalam jumlah besar dan lebih menghemat tenaga. (3) Kecepatan, untuk dapat mengetahui hasil amplifikasi hanya 6-8 jam. (4) Keterulangan yang tinggi, yang tergantung pada komposisi buffer, konsentrasi Mg ++, pilihan enzim ADN Polymerase, kualitas Nukleotida (ADN). (5) Resolusi Tinggi, Pemisahan potongan ADN pada gel agarose yang sangat tipis memungkinkan tercapainya resolusi tertinggi dalam elektroforesis manual. Jika deteksi menggunakan pewarna perak – silver, setiap potongan ADN dengan kisaran 50-200 basa, akan tampak dengan jelas. Para peneliti ilmu biologi telah membuat kemudahan dengan menyediakan gel siap pakai, bahan kimia elektroforesis yang dapat diandalkan dan sistem pewarnaan perak otomatis.
III. METODOLOGI PENELITIAN
3.1. Tempat dan Waktu Penelitian
Penelitian ini dilakukan di Laboratorium Silvikultur Departemen Manajemen Hutan Fakultas Kehutanan IPB Darmaga. Penelitian ini dilakukan selama 8 bulan dari Mei 2005 – Desember 2005.
3.2. Bahan dan Alat Penelitian
Bahan yang digunakan dalam penelitian ini meliputi : Herbarium meranti (S. parvifolia dan S. leprosula) yang berasal dari PT. Asia Log, Haurbentes, PT. ITCI, Pasir Mayang, TNBT, PT. Sumalindo, PT. Sari Bumi Kusuma, Bukit Bangkirai dan Nanjak Makmur. Bahan untuk analisis genetik meliputi daun
S. parvifolia dan S. leprosula, nitrogen cair, bahan kimia yang digunakan untuk membuat buffer ekstrak, PCR, ADN, agaros serta Ethidium Bromida (EtBr).
Adapun alat yang digunakan dalam penelitian ini adalah penggaris ukuran 30 cm,busur, tally sheet, alat tulis, alat hitung, spidol permanen, kertas label, kamera digital, flash disk, program Minitab 14, Microsoft Excel 2003, POPGENE versi 32, NTSys versi 2.0 dan komputer. Alat untuk keperluan analisis genetik meliputi plastik klip, sterofom, mortar beserta pestel, sarung tangan, pipet, pipet mikro, sentrifugasi, vortex, spatula, koleksi tabung, cetakan gel, bak elektroforesis, tray,
microwave, power supply, pH meter, gelas piala, gelas ukur, timbangan analitik, pengaduk magnetik (stirer), lemari pendingin, water bath, ultraviolet transiluminator, kamera digital.Secara lebih jelas ditampilkan dalam Lampiran 4.
3.3. Prosedur Penelitian
Gambar 2 Urutan Kegiatan Penelitian
IDENTIFIKASI JENIS
DOKUMENTASI MORFOLOGI
UJI KORELASI ANTAR PARAMETER MORFOLOGI DAUN
(r > 0.7)
PETA SEBARAN JENIS BERDASARKAN KORELASI PARAMETER
ANALISIS JENIS BERDASARKAN PETA
SEBARAN JENIS
PENGAMBILAN SAMPEL
Mix (n = 10)
S. parvifolia (n = 5) S. leprosula (n = 5)
KONFIRMASI PENANDA GENETIK
3.3.1. Pengumpulan Sampel
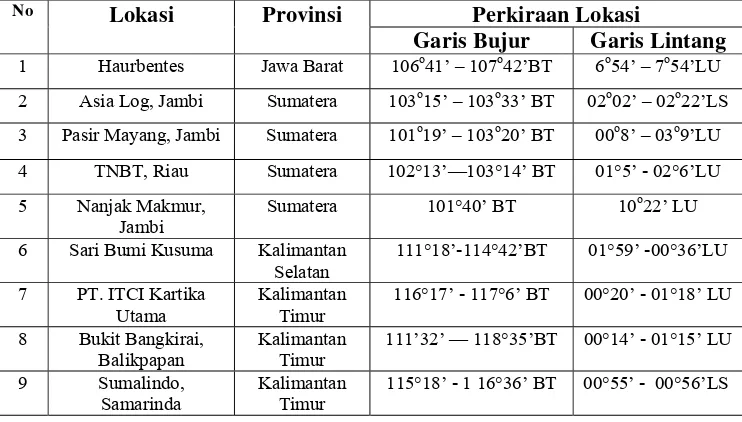
Sampel daun dikumpulkan dari 9 tempat yaitu PT. Asia Log, Haurbentes, PT. ITCI, Pasir Mayang, TNBT, PT. Sumalindo, PT. Sari Bumi Kusuma, Bukit Bangkirai dan Nanjak Makmur. Jumlah sampel yang digunakan sebanyak 202 buah yang terdiri dari 101 S. leprosula dan 101 S. parvifolia. Adapun letak geografis lokasi pengambilan sampel terdapat pada Tabel 1.
Tabel 1 Letak Geografis Lokasi Pengambilan Sampel Daun
No Lokasi Provinsi Perkiraan Lokasi
Garis Bujur Garis Lintang
Dalam kegiatan identifikasi jenis ada dua metode yang digunakan. Metode pertama dengan menggunakan identifikasi jenis berdasarkan pengenal pohon langsung dari tempat asal sampel dikumpulkan. Metode kedua dengan mengirimkan sebagian sampel ke Herbarium Bogoriense. Dari dua metode yang dipakai semua jenis yang diidentifikasi secara langsung dari lapangan menunjukkan jenis yang sama dengan hasil identifikasi jenis dari Herbarium Bogoriense.
3.3.3. Dokumentasi Morfologi
variabel, yang secara umum dibagi menjadi dua kelompok yaitu 7 variabel pengukuran dan 21 variabel turunan. Variabel turunan dapat dihitung jika variabel pengukuran telah diketahui. Adapun simbol dan keterangan variabel ditampilkan pada Tabel 2. Bagian-bagian variabel yang diukur tersebut dalam daun ditunjukkan dalam Gambar 3. Teknis pengukuran variabel pengukuran adalah dengan mengambil 5 sampel daun setiap herbarium yang digunakan sebagai ulangan, untuk memudahkan pengukuran dan penelusuran data dalam penomoran sampel daun digunakan kaidah penomoran searah jarum jam. Sebagaimana ditunjukkan dalam Gambar 4.
3.3.4. Analisis Jenis Berdasarkan Peta Sebaran Jenis
Variabel pengukuran dan variabel turunan dari masing-masing jenis dilakukan uji korelasi, dengan menggunakan Minitab 14. Dari hasil uji korelasi dapat diketahui variabel yang memiliki korelasi yang kuat antara dua variabel. Kemudian data yang memenuhi kriteria r > 0.7 dilakukan pemetaan. Hasil pemetaan tersebut dinamakan Peta Sebaran Jenis. Setelah didapatkan peta sebaran jenis dilanjutkan dengan penyeleksian hasil peta, peta sebaran jenis yang baik menunjukkan munculnya 2 klaster (gerombol) titik hasil uji korelasi yang jelas.
Dari dua klaster yang berjauhan dilakukan penelusuran ulang untuk mengetahui nama jenis klaster. Jenis yang memiliki titik hasil uji korelasi yang berdekatan dengan klaster yang telah diidentifikasi dinamakan sesuai nama klaster yang bersangkutan.
3.3.5. Pengambilan Sampel
Pengambilan sampel dilakukan untuk pengklarifikasian dengan penanda RAPD. Pengambilan sampel dilakukan secara acak pada individu yang terletak pada klaster S. parvifolia dan S. leprosula masing-masing sebanyak 5 individu, dan diambil juga 10 individu yang berada pada klaster Shorea sp (campuran dari individu S. leprosula dan S. parvifolia), dengan kriteria 5 individu S. parvifolia
Tabel 2 Simbol dan Keterangan Variabel Pengukuran Morfologi Daun.
No Simbol Keterangan
1 LL Panjang daun (leaf length) 2 PL Panjang petiole (petiole length) 3 LW Lebar daun (leaf width)
4 WP Jarak daun terlebar ke petiole (widest leaf to petiole) 5 DL Panjang dometiana (dometiana length)
6 NL Besar sudut pertulangan daun (number of lobes) 7 NV Jumlah tulang daun (number of veinations) 8 LLPLR Leaf Length-Petiole Length Ratio
9 LLLWR Leaf Length-Leaf Wide Ratio
10 LLWPR Leaf Length-Widest leaf to Petiole Ratio 11 LLDLR Leaf Length-Dometiana Length Ratio 12 LLNLR Leaf Length-Number of Lobes Ratio 13 LLNVR Leaf Length-Number of Veination Ratio 14 PLLWR Petiole Length- Leaf Wide Ratio
15 PLWPR Petiole Length- Widest Leaf to Petiole Ratio 16 PLDLR Petiole Length- Dometiana Length Ratio 17 PLNLR Petiole Length- Number of Lobes Ratio 18 PLNVR Petiole Length- Number of Veination Ratio 19 LWWPR Leaf Wide- Widest Leaf to Petiole Ratio 20 LWDLR Leaf Wide- Dometiana Length Ratio 21 LWNLR Leaf Wide- Number of Lobes Ratio 22 LWNVR Leaf Wide- Number of Veination Ratio
23 WPDLR Widest Leaf to Petiole - Dometiana Length Ratio 24 WPNLR Widest Leaf to Petiole - Number of Lobes Ratio 25 WPNVR Widest Leaf to Petiole - Number of Veination Ratio 26 DLNLR Dometiana Length- Number of Lobes Ratio 27 DLNVR Dometiana Length- Number of Veination Ratio 28 NLNVR Number of Lobes - Number of Veination Ratio
1
3.3.6. Ekstraksi ADN
Prosedur ekstraksi ADN menggunakan metode Mini kit Qiagen untuk 16 sampel dan 4 sampel dengan metode CTAB. Perbedaan metode tersebut tidak mempengaruhi munculnya pita pada gel agarose. Pada metode CTAB, pertama yang dilakukan adalah melakukan pemotongan sampel daun yang telah sesuai dengan nomor individu dan asal lokasi. Pemotongan dilakukan pada sebagian kecil dari daun yang meliputi sebagian kecil dari ujung daun, pangkal daun, bagian sisi daun, dan bagian tengah daun dan. Hal ini dilakukan karena peneliti tidak tahu letak ADN yang paling banyak terletak di bagian daun yang mana.
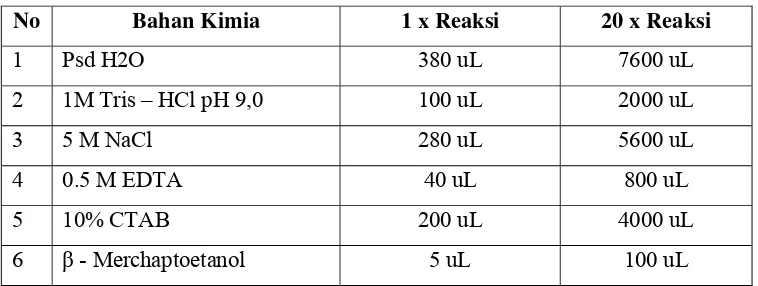
Langkah kedua adalah menggerus potongan kecil daun dengan alat mortal beserta pestel dengan bahan nitrogen cair, sehingga didapatkan serbuk. Serbuk kemudian dipindahkan kedalam microtube berukuran 1,5 mL. Berikutnya berikutnya tambahkan 800 uL larutan buffer ekstrak dan 10 uL PVP 2%, lakukan vortex secepatnya setelah kedua bahan kimia ditambahkan dalam microtube, agar serbuk tidak mengendap. Adapun komposisi dari Buffer ekstrak metode ini ditunjukkan pada Tabel 3.
Langkah keempat dilakukan inkubasi microtube, dalam inkubator dengan suhu 650 C, selama 45 – 60 menit dan setiap 15 menit dilakukan pengocokan (bolak-balik) dengan tujuan untuk meratakan semua bagian dalam microtube. Sehingga ADN akan mudah keluar dari sel. Kelima, microtube diangkat dari
Gambar 4 Urutan Penomoran Daun Sumber: Foto Pribadi
2 3
4
inkubator didiamkan pada suhu ruangan selama 5 – 10 menit, kemudian ditambahkan 500 uL IAA chloroform pada setiap sampel, disentrifuse selama 2 menit pada 13000 rpm, sambil menunggu sentrifuse selesai dapat digunakan untuk menyiapkan microtube yang baru.
Tabel 3 Komposisi Buffer Ekstrak Metode CTAB
No Bahan Kimia 1 x Reaksi 20 x Reaksi
Langkah keenam, microtube diangkat dari sentrifuse, supernatannya diambil dengan menggunakan pipet mikro berukuran 100 uL, supernatant dipindahkan ke dalam microtube baru. Ketujuh, 700 IAA chloroform ditambahkan dalam
microtube yang telah diisi supernatant. Kemudian disentrifuse selama 2 menit pada 13000 rpm. Setelah selesai supertanant diambil dengan pipet mikro ukuran 100 uL, dipindahkan ke microtube yang baru.
Langkah kedelapan, 300 uL isopropanol dingin dan 20 uL NaOC atau NaCl 1 M ditambahkan dalam microtube, kocok kemudian dimasukan dalam freezer selama 45 – 60 menit. Setelah itu microtube diangkat dari freezer, disentrifuse selama 2 menit pada 13000 rpm. Cairan yang berada dalam microtube dibuang semua dengan hati-hati supaya pellet ADN tidak terbuang. Kesembilan, dengan
Langkah kesebelas merupakan tahap pengujian keberadaan ADN hasil ekstraksi dengan teknik elektroforesis agarose 2%, bahan yang diperlukan adalah agarose larutan TAE (Tris Acetate with EDTA). Pertama adalah membuat gel/agar, dengan melarutkan agaros 0,66 gram dengan mencampurkan 33 mL larutan TAE. Larutan tersebut dipanaskan dalam microwave sampai mendidih, kemudian didinginkan dalam suhu ruangan sebentar untuk mengurangi gelembung udara, baru dituang kedalam cetakan gel. Cetakan jel tersebut telah dipasang sisi/comb yang berfungsi untuk membuat cetakan sumur gel/well
elektroforesis. Gel kemudian di dinginkan sampai membeku. Sambil menunggu gel membeku, siapkan tray yang akan digunakan untuk mencampur ADN dengan
blue juice. Setelah yakin gel membeku, ambil sisir/comb. Masukan gel dalam bak elektroforesis yang telah diisi dengan larutan TAE. Ambil 4 uL ADN dari mikro tube dengan pipet mikro, tuangkan dalam tray, campurkan 3 uL blue juice. Dengan pipet mikro ambil 7 uL campuran ADN dan blue juice dan masukkan kedalam sumur gel elektroforesis, hati-hati jangan sampai campuran ADN dan
blue juice tersebar keluar sumur gel. Setelah semua campuran ADN dan blue juice
dimasukkan, tutup bak elektroforesis dan hidupkan power supply, running dengan menggunakan voltage kostan 100 volt, selama 30 – 40 menit.
Gel yang telah dielektroforesis dilakukan pewarnaan dengan menggunakan larutan ethidium bromide (EtBr) selama kurang lebih satu jam. Keberadaan ADN dapat dilihat dengan menggunakan ultraviolet transluminator.
Perbedaan dengan metode Mini Kit Qiagen tahap pertama disebut tahap prespitasi yaitu tahap menggerus daun berukuran 2 x 1 cm dengan bantuan nitrogen cair sehingga menjadi bubuk. Bubuk dimasukkan dalam microtube 2 mL, kemudian ditambahkan 400 uL buffer AP1 dan 4 uL RNAse A (100 mg/mL). Larutan tersebut kemudian dikocok dengan vortex. Setelah divortex larutan diinkubasi dalam water bath selama 10 menit pada suhu 65oC, dengan diselingi pengocokan selama 2-3 kali selama inkubasi dilakukan. Setelah selesai 130 uL
pada kecepatan 13000 rpm. Larutan yang mengalir melalui fraksi dipindahkan dalam microtube yang baru (tanpa penambahan). Kemudian 1,5 volume buffer AP 3/E (buffer sebelumnya ditambahkan etanol) ditambahkan pada larutan bersih dan dicampurkan dalam microtube. Larutan DNeasy mini spin column sebanyak 650uL ditambahkan dalam microtube kemudian disentrifuse pada 8000 rpm selama 2 menit, kemudian cairan yang melewati fraksi dibuang.
Tahap kedua disebut tahap pencucian dimulai dengan menempatkan DNeasy column pada microtube yang baru kemudian ditambahkan 500 uL buffer AW.
Microtube tersebut disentrifuse selama 1 menit pada 8000 rpm. Cairan yang melewati dibuang, kegiatan ini dilakukan dua kali, kemudian disentrifuse selama 2 menit pada 13000 rpm.
Tahap ketiga disebut tahap elution, dilakukan dengan menyimpan DNeasy column pada 2 mL microtube, 100 uL larutan buffer AE hangat (65oC) dicampurkan dalam membran DNeasy, kemudian diinkubasi selama 5 menit pada suhu ruangan. Setelah selesai microtube disentrifuse selama 1 menit pada 8000 rpm, kegiatan ini dilakukan 2 kali, sehingga akan didapatkan ADN hasil ekstraksi sebanyak 200 uL.
Tahapan berikutnya adalah uji kualitas ADN, secara teknis dalam uji kualitas ADN baik dengan metode CTAB maupun metode Mini kit Qiagen tidak jauh berbeda, sehingga tidak diuraikan lebih jauh.
3.3.7. Proses PCR-RAPD
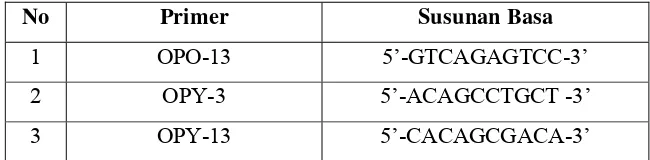
ADN hasil ekstraksi diamplifikasi dengan menggunakan mesin PCR teknik yang digunakan adalah RAPD. Kombinasi primer yang digunakan adalah primer universal (hampir terdapat di semua tumbuhan). Primer yang digunakan adalah OPO–13, OPY–3 dan OPY-13. Urutan nukleotida dari masing-masing primer secara lebih terperinci disajikan dalam Tabel 4.
Primer yang akan digunakan sebelumnya dilakukan pengenceran terlebih dahulu, dengan tujuan untuk menghindari hablurnya pita ADN pada saat running
elektroforesis. Pengenceran dilakukan dengan mengambil primer tersebut sebanyak 1 uL dan ditambahkan 4 uL H2O yang telah di autoklaf jika pengenceran
adalah 5X, dan 10X. Adapun bahan-bahan yang dicampurkan dalam satu
microtube pada proses PCR-RAPD terdapat pada Tabel 5.
Tabel 4 Nama Primer dan Susunan Basa dalam Proses PCR-RAPD
No Primer Susunan Basa
1 OPO-13 5’-GTCAGAGTCC-3’
2 OPY-3 5’-ACAGCCTGCT -3’
3 OPY-13 5’-CACAGCGACA-3’
Tabel 5 Komposisi Bahan dalam Proses PCR-RAPD
No Bahan Kimia 1 x Reaksi
1 Psd H2O 7,5 uL
2 Enzim Taq DNA polymerase 2,5 uL
3 Primer oligonukleid 1,5 uL
4 DNA pekat 1,5 uL
3.3.8. Analisis Genetik
Hasil elektroforesis akan menunjukkan beberapa pita/band. Berdasarkan identifikasi pita dapat ditemukan lokus penanda yang membedakan satu individu dengan individu lain. Dengan menggunakan lokus penanda secara kasar, diagnosis jenis dapat dilakukan. Diagnosis jenis berdasarkan lokus penanda secara umum dilakukan sebelum scoring dilakukan.
Scoring dilakukan dengan memberi nilai 1 (satu) bagi lokus yang memiliki pita, dan memberi nilai 0 (nol) bagi lokus yang tidak memiliki pita. Adapun ketentuan yang perlu diperhatikan dalam penentuan nomor lokus yang secara umum digunakan pada penelitian-penelitian sebelumnya adalah penomoran lokus dimulai dari pita yang memiliki berat molekul yang paling ringan. Dalam gel agarose pita tersebut ditunjukkan dengan jarak yang paling jauh dari sumur gel. Data hasil scoring dari masing-masing primer kemudian dianalisis dengan
IV. HASIL DAN PEMBAHASAN
4.1. Hasil
4.1.1. Karakterisasi Jenis Berdasarkan Analisis Morfologi Daun
Hasil pengukuran langsung dari kedua spesies diperoleh data bahwa secara kuantitatif morfologi S. parvifolia memiliki karakter panjang daun (LL), panjang
petiole (PL), lebar daun (LW), panjang dari daun terlebar ke petiole (WP) lebih pendek dari pada S. leprosula. Pada karakter jumlah tulang daun sekunder (veination) S. parvifolia juga memiliki jumlah veination yang lebih sedikit dibanding S. leprosula yaitu rata–rata hanya mencapai 13,08 buah, terpaut hampir 3 buah veination dengan S. leprosula. Namun S. parvifolia secara umum memiliki besar sudut tulang daun utama dengan tulang daun sekunder (NL) yang lebih besar yaitu 61,96o sedangkan S. leprosula hanya memiliki sudut sebesar 56o. Secara lebih terperinci dapat dilihat pada Gambar 5. Adapun gambar semai dan daun segar dari S. parvifolia dan S. leprosula disajikan dalam Lampiran 5.
Dari 202 individu S. parvifolia dan S. leprosula yang berasal dari 9 lokasi setelah dilakukan uji korelasi, diperoleh 46 kombinasi karakter morfologi daun yang memiliki r > 0,7. Dari kombinasi tersebut terdapat empat kombinasi dari pengukuran langsung yang memiliki koefisien korelasi (r) > 0,7 (Tabel 6), secara lebih terperinci terdapat pada Lampiran 1.
Tabel 6 Nilai Korelasi Pengkuran Langsung pada Morfologi Daun
Karakter LL PL LW WP DL NL
Satuan dalam (cm)
S. parvifolia S. leprosula
NL
(61,96o) (56o)
S. parvifolia S. leprosula
Gambar 5 Perbedaan Variabel Morfologi Daun S. parvifolia dan S. leprosula
Klaster S. leprosula DAN S. parvifolia
klaster S. parvifolia, 24 individu termasuk dalam klaster S. leprosula dan 153 individu termasuk dalam klaster Shorea sp .
Gambar 6 Perbandingan Peta Sebaran Jenis Berdasarkan Nilai Korelasi antara LW-WP (jelas membedakan klaster) dengan LL-WP (tidak jelas
4.2.2. Karakterisasi Jenis Berdasarkan Analisis Penanda Genetik
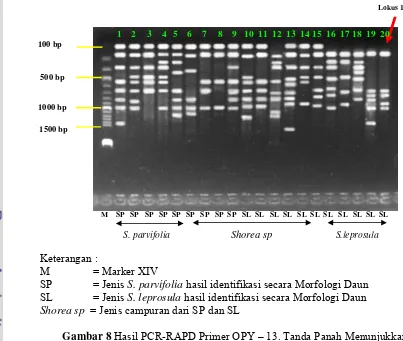
Hasil PCR-RAPD dengan menggunakan 3 primer yaitu OPY-3, OPY-13 dan OPO-13 didapatkan bahwa ukuran produk hasil amplifikasi berkisar dari 100– 1500 bp, dengan jumlah lokus yang berbeda pada setiap primer. Pada primer OPY-13 terdapat 25 lokus, primer OPY-3 terdapat 10 lokus, dan primer OPO-13 terdapat 19 lokus. Selain itu berdasarkan hasil PCR-RAPD pada primer OPY-13 ditemukan 1 lokus penanda tepatnya pada lokus ke-1 yang selanjutnya diberi kode OPY-13-L1 (Gambar 8). Tampilan pita dalam gel agarose untuk semua primer disajikan pada Gambar 9. Keterangan nomor pohon, nomor individu, simbol dan asal individu ditampilkan pada Lampiran 2. Dari data skoring diperoleh 54 lokus polimorfik semua primer yang digunakan. Hasil skoring secara lebih terperinci disajikan pada Lampiran 4.
M SP SP SP SP SP SP SP SP SP SL SL SL SL SL SL SL SL SL SL SL
Keterangan :
M = Marker XIV
SP = Jenis S. parvifolia hasil identifikasi secara Morfologi Daun SL = Jenis S. leprosula hasil identifikasi secara Morfologi Daun
Shorea sp = Jenis campuran dari SP dan SL
Gambar 8 Hasil PCR-RAPD Primer OPY – 13. Tanda Panah Menunjukkan Lokus 1 yang dijadikan Penanda (OPY-13-L1)
100 bp
500 bp
1000 bp
1500 bp
Lokus 1
S. parvifolia Shorea sp S.leprosula
M 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 M 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20
(a) (b)
M 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 (c)
Gambar 9 Hasil PCR- RAPD Semua Primer (a) Primer OPY-3 (b) Primer OPY-13 (c) Primer OPO – 13
4.1.2.1. Variasi Genetik dalam Populasi
Asumsi yang digunakan dalam analisis penanda genetik adalah dengan menganggap klaster sebagai populasi, sehingga terdapat 3 populasi yaitu populasi
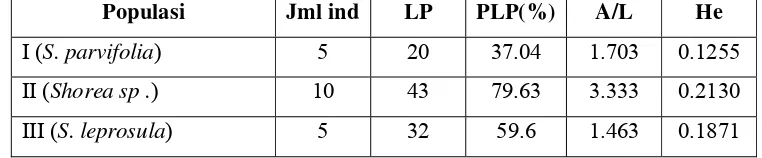
S. parvifolia, S. leprosula, dan populasi Shorea sp . Berdasarkan hasil analisis variasi genetik dalam populasi, didapatkan perbedaan yang jelas dari 3 populasi yang diuji. Populasi S. parvifolia memiliki jumlah lokus polimorfik yang lebih kecil dibandingkan S. leprosula yaitu hanya sebanyak 20 buah lokus, sedangkan
S. leprosula memiliki 32 lokus. Hal tersebut berakibat pada persentase lokus polimorfik (PLP) dan keragaman genetik (He) S. parvifolia lebih kecil dibanding PLP dan (He) S. leprosula. Adapun nilai PLP dan (He) pada S. parvifolia secara berurutan adalah 37.04 % dan 0.1255 sedangkan nilai PLP dan (He) S. leprosula
dan (He) populasi Shorea sp . secara berurutan adalah 79.63% dan 0.213. Hasil analisa variasi genetik dalam populasi secara lebih terpeinci disajikan dalam Tabel 7.
Tabel 7 Hasil Analisa Genetik Masing-masing Populasi
Populasi Jml ind LP PLP(%) A/L He
I (S. parvifolia) 5 20 37.04 1.703 0.1255 II (Shorea sp .) 10 43 79.63 3.333 0.2130
III (S. leprosula) 5 32 59.6 1.463 0.1871
Keterangan:
LP = Lokus Polimorfik,
PLP = Persentase Lokus Polimorfik, A/L = Rata-rata Jumlah Alel Setiap Lokus, He = Keragaman Genetik
4.1.2.2. Variasi Genetik antar Populasi
Berdasarkan hasil analisis penanda genetik antar populasi diperoleh jarak genetik populasi S. parvifolia dengan populasi Shorea sp . sebesar 0.0703 sedangkan jarak dari populasi Shorea sp .terhadap populasi S. leprosula sebesar 0.1149, serta jarak dari populasi S. parvifolia terhadap populasi S. leprosula
sebesar 0.1926. Selain itu diketahui pula nilai Hs sebesar 0.1752, Ht sebesar 0.2402, Gst sebesar 0.2708.
Analisis kedekatan genetik antar populasi dapat diketahui dari dendrogram yang disajikan dalam Gambar 10. Untuk menguatkan dalam klarifikasi jenis dilakukan analisis penanda ADN berdasarkan individu. Hasil dari uji penanda ADN berdasarkan individu disajikan dalam Gambar 11. Sedangkan dari Tabel 8 dapat menjelaskan bahwa jarak genetik terkecil dimiliki oleh S. parvifolia 2 terhadap Shorea sp nomor 3 dan jarak dari Shorea sp . nomor 2 terhadap Shorea sp . nomor 3 yaitu 0,0972. Jarak genetik terbesar ditunjukkan oleh Shorea sp .
nomor 8 terhadap S. lep 1 yaitu sebesar 0,7710.
Gambar 10 Dendrogram Kedekatan Genetik antar Populasi
Tabel 8 Jarak Genetik dari Masing-masing Individu
Individu S.spar1 S.spar2 S.spar3 S.spar4 S.spar5 S.sp1 S.sp2 S.
sp3 S.sp4 S.sp5 S.sp6 S.sp7 S.sp8 S.sp9 S.sp
10 S.lep1 S.lep2 S.lep3 S.lep4 S.lep5
S.spar1 0.000
S.spar2 0.139 0.000
S.spar3 0.139 0.118 0.000
S.spar4 0.182 0.118 0.118 0.000
S.spar5 0.300 0.325 0.325 0.182 0.000
S.sp1 0.300 0.275 0.325 0.228 0.251 0.000
S.sp2 0.182 0.118 0.205 0.118 0.182 0.182 0.000
S.sp3 0.160 0.097 0.182 0.182 0.300 0.205 0.097 0.000
S.sp4 0.118 0.182 0.139 0.139 0.251 0.251 0.182 0.205 0.000
S.sp5 0.275 0.300 0.251 0.351 0.493 0.325 0.351 0.325 0.325 0.000
S.sp6 0.139 0.251 0.205 0.300 0.325 0.378 0.251 0.228 0.182 0.251 0.000
S.sp7 0.351 0.493 0.434 0.493 0.657 0.523 0.555 0.463 0.406 0.325 0.434 0.000
S.sp8 0.351 0.434 0.434 0.555 0.588 0.588 0.555 0.463 0.351 0.493 0.275 0.351 0.000
S.sp9 0.351 0.275 0.275 0.378 0.588 0.463 0.434 0.300 0.351 0.434 0.325 0.463 0.406 0.000
S.sp10 0.300 0.228 0.228 0.325 0.523 0.463 0.325 0.251 0.351 0.378 0.275 0.657 0.523 0.251 0.000
S.lep1 0.378 0.406 0.463 0.463 0.555 0.555 0.351 0.434 0.434 0.588 0.523 0.693 0.555 0.770 0.555 0.000
S.lep2 0.493 0.406 0.406 0.463 0.555 0.493 0.463 0.378 0.434 0.406 0.406 0.555 0.378 0.434 0.434 0.523 0.000
S.lep3 0.378 0.406 0.406 0.351 0.378 0.434 0.406 0.434 0.325 0.406 0.406 0.555 0.493 0.622 0.434 0.351 0.351 0.000
S.lep4 0.523 0.622 0.622 0.622 0.588 0.523 0.555 0.523 0.406 0.555 0.434 0.588 0.351 0.657 0.588 0.493 0.275 0.378 0.000
S.lep5 0.351 0.378 0.434 0.434 0.523 0.406 0.378 0.300 0.406 0.434 0.493 0.523 0.463 0.588 0.523 0.434 0.139 0.378 0.251 0.000
4.2. Pembahasan
4.2.1. Klarifikasi Jenis S. parvifolia dan S. leprosula Berdasarkan Morfologi Daun dengan Penanda RAPD
Karakter morfologi selama ini sering digunakan dalam diagnosis jenis. Adapun karakter morfologi yang paling sering digunakan adalah morfologi organ daun. Selain mudah dan cepat dilakukan, juga banyak literatur mengenai morfologi daun. Namun disisi lain diagnosis jenis dengan menggunakan karakter morfologi daun terdapat beberapa kelemahan, terutama pada jenis yang memiliki morfologi daun yang mirip. Kemiripan bentuk morfologi daun dapat terjadi, hal ini disebabkan karena morfologi merupakan fenotipe, dimana fenotipe memiliki ketidakstabilan terhadap faktor lingkungan. Hal serupa juga disampaikan Finkeldey (2005) yang menjelaskan bahwa karakter morfologi tidak dapat secara tepat membedakan satu jenis dengan jenis yang lain. Karena morfologi dari satu jenis merupakan ekspresi dari faktor genetik dan faktor lingkungan.
Sebagaimana ditunjukkan dalam Gambar 7, dengan menggunakan karakter morfologi daun, muncul klaster Shorea sp . yang berada diantara jenis S. parvifolia dan S. leprosula. Implikasi dari munculnya daerah tersebut menandakan adanya beberapa jenis yang didiagnosis meragukan antara kedua jenis. Diagnosis daerah yang meragukan tersebut akan menyebabkan keakuratan pendugaan jenis dengan menggunakan karakter morfologi rendah, dan sebaliknya kesalahan diagnosis jenis menjadi besar. Kesalahan diagnosis jenis akan berakibat fatal baik dalam jangka panjang maupun jangka pendek, terutama jika berkaitan tentang kegiatan pemuliaan pohon, pengadaan bibit yang berkualitas dll.
Menurut Finkeldey (2005) dijelaskan bahwa untuk membedakan jenis dapat digunakan penanda genetik. Penanda genetik lebih stabil terhadap faktor lingkungan. Dengan kemajuan teknologi genetika molekuler sekarang ini penanda genetik dapat dilihat dari lokus penanda atau gen penanda yang hanya dapat dilihat dengan teknologi penanda ADN. Ada beberapa teknik penanda ADN yang sekarang dikembangkan antara lain RLFP, RAPD, AFLP, mikrosatelit dll.
klarifikasi yang terdiri dari 5 individu S. parvifolia dan S. leprosula serta 10
individu dari klaster Shorea sp , dapat diklasifikasikan menjadi 14 individu
S. parvifolia dan 6 individu S. leprosula. Secara lebih terperinci individu nomor 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11,13,14,15 masuk dalam jenis Shorea parvifolia. Sedangkan jenis Shorea leprosula meliputi individu nomor 12,16,17,18,19 dan 20. Secara umum hasil dari klarifikasi berdasarkan lokus penanda pada primer OPY-13, sebagian besar klaster Shorea sp . masuk dalam jenis S. parvifolia.
Hasil skoring (Lampiran 3) setelah dilakukan analisis dengan software
POPGENE versi 32 dan NTSys lebih menguatkan diagnosis jenis berdasarkan lokus penanda. Berdasarkan Gambar 10 dalam analisis variasi genetik antar populasi, dapat dijelaskan bahwa jarak genetik antara populasi S. leprosula
terhadap populasi Shorea sp . lebih jauh dibandingkan jarak genetik S. parvifolia
terhadap populasi Shorea sp , yang lebih jelas digambarkan dalam diagram pohon bahwa populasi S. parvifolia bergabung dengan populasi Shorea sp . diawal diagram pohon.
Hasil analisis penanda ADN berdasarkan individu (Gambar 11) juga menguatkan klarifikasi jenis berdasar lokus penanda. Sebagian besar individu
Shorea sp . masuk dalam populasi S. parvifolia. Dendrogram menjelaskan bahwa dari 20 individu dibagi menjadi 2 klaster, yaitu klaster S. parvifolia yang terdiri dari 13 individu dan klaster S. leprosula terdiri 7 individu. Klarifikasi penanda ADN berdasarkan individu lebih spesifik dalam klasifikasi jenis.
Berdasarkan nilai Gst dari penelitian yang dilakukan oleh Finkeldey (2005) jenis dan tempat yang hampir sama, diperoleh nilai Gst dari S. parvifolia
4.2.2. Implikasi Klarifikasi Jenis S. parvifolia dan S. leprosula Berdasarkan Morfologi Daun dengan RAPD
Diagnosis jenis S. parvifolia dan S. leprosula pada dasarnya adalah kegiatan idnetifikasi klon S. parvifolia dan klon S. leprosula. Dalam mempelajari klon masing-masing jenis dapat lebih terperinci melalui variasi genetik dalam populasi. Variasi satu jenis dalam satu populasi akan lebih kecil jika dibandingkan dengan variasi genetik berbeda jenis dengan populasi yang sama. Walaupun jenis
S. parvifolia dan S. leprosula pada umumnya sering ditemukan pada daerah yang sama (lingkungan yang hampir sama), namun keragaman antara jenis S. parvifolia
dan S. leprosula tetap akan berbeda terutama dari segi genetik. Hal ini dibuktikan dari analisis dalam populasi kedua jenis (Tabel 6), jenis S. parvifolia memiliki lokus polimorfik yang secara umum lebih sedikit dibandingkan dengan jenis
S. leprosula, begitu pula pada nilai keragaman genetiknya. Berdasarkan nilai keragaman genetik S. leprosula yang lebih tinggi menjelaskan bahwa jenis frekuensi munculnya pita pada S. leprosula lebih tinggi dari pada S. parvifolia.
V. KESIMPULAN DAN SARAN
5.1 Kesimpulan
Kesimpulan dari penelitian ini adalah sbb:
1. Variabel pengukuran lebar daun (leaf wide, LW) dan jarak daun terlebar terhadap petiole (widest leaf to petiole, WP) dapat dijadikan alat diagnosis jenis Shorea parvifolia dan Shorea leprosula berdasarkan morfologi daun yang berasal dari hutan alam pada fase semai dan pancang.
2. S. parvifolia secara umum mempunyai nilai rata-rata LW dan WP yang lebih kecil dibandingkan S. leprosula yaitu LW = 4,10 cm dan WP = 4,10 cm untuk S. parvifolia sedangkan untuk S. leprosula LW = 4,99 cm dan WP = 5,17 cm.
3. Teknik RAPD dapat mengklarifikasi jenis antara S. parvifolia dan
S. leprosula yang tidak bisa dilakukan dalam diagnosis jenis menggunakan morfologi daun. Penggunaan primer OPY-13 (5’-CACAGCGACA-3’) khususnya OPY-13-L1 dijadikan penanda genetik.
5.2. Saran
1. Perlu dilakukan uji lanjutan untuk meyakinkan keberadaan hibrid atau keberadaan jenis lain, melalui penggunaan marka genetik lain khususnya marka genetik ko-dominan seperti mikrosatelit.
DAFTAR PUSTAKA
Alimi. 2001. Pembiakan Vegetatif dengan Stek Pucuk untuk Produksi Bibit
Shorea leprosula Miq. di HPH PT Intracawood Manufacturing Kalimantan Timur. Skripsi. Program Diploma III Budi Daya Hutan Tanaman, Jurusan Manajemen Hutan, Fakultas Kehutanan, IPB. Bogor
Awasthi et al. 2004. Genetic Diversity and Relationship in Mulbery (Genus
Morus) and Revealed by RAPD and ISSR Marker Assays. Biomed Central.USA
Bappenas. 2003. Indonesian Biodiversity Strategy and Action Plan Dokumen Regional. Bappenas. Jakarta
Dayanandan et al. 1999. Phylogeny of Tropical Tree Family Dipterocarpaceae Based on Nucleotide Sequences of The Chloroplast RBCL Gene. American Jurnal of Botany. USA
Direktorat Perbenihan Tanaman Hutan. 2004. Kamus Pemuliaan Pohon. Departemen Kehutanan. Jakarta
Finkeldey. 2005. Pengantar Genetika Hutan Tropis. Fakultas Kehutanan, IPB. Bogor.
Handhadari. 2002. Trend Kebutuhan Bahan Baku Kayu Mendatang. http://www.kompas.com/artikel/html/. [15 Juni 2005]
Joker, D. 2002. Informasi Singkat Benih Shorea leprosula Miq. Direktorat Perbenihan Tanaman Hutan. Jakarta
Kebler. 2000. Pedoman Lapangan Mengenal Jenis Pohon Penting Daerah Berau. Berau Forest Management Project PT Inhutani I. Jakarta
Khaerudin. 1999. Pembibitan Tanaman HTI. Penebar Swadaya. Jakarta
Kremer et al. 2002. Leaf Morphological Differentiation between Quercus robur
and Quercus patraea is Stable Across Western European Mixed Oak Stands. Ann. For. Sci. (2002) hal 777 - 787. Germany
Laboratorium Genetika Molekuler. 2002. Petunjuk Teknis Kegiatan Laboratorium Genetika Molekuler. Pusat Penelitian dan Pengembangan Bioteknologi Pemuliaan Tanaman Hutan (P3BPTH). Yogyakarta
Nawangsasih.1989. Percobaan Perbanyakan Vegetatif Meranti Merah (Shorea leprosula) melalui Kultur Jaringan. Skripsi. Jurusan Manajemen Hutan, Fakultas Kehutanan, IPB. Bogor
Rimbawanto, et al. 2001. Estimation of Genetic Variation of Shorea leprosula in the Hedge-Orchad of the Inhutani I Dipterocarp Center East Kalimantan using DNA Markers. [research report]. Gadjah Mada University
Sabri. 1996. Angka Bentuk dan Model Penduga Volume Batang Meranti Merah Lempung (Shorea parvifolia Dyer) Berdasarkan Integrasi Persamaan Taper di HPH PT ITCI Kalimantan Timur. Skripsi. Jurusan Manajemen Hutan, Fakultas Kehutanan, IPB. Bogor Saleh. 1988. Pengaruh Zat Pengatur Tumbuh Rootone F dan Ukuran Stump
terhadap Pertumbuhan Stump Shorea leprosula Miq. Skripsi. Jurusan Manajemen Hutan, Fakultas Kehutanan, IPB. Bogor Schmidt. 2000. Pedoman Penanganan Benih Tanaman Hutan Tropis dan Sub
Tropis. Direktorat Jenderal Rehabilitasi Lahan dan Perhutanan Sosial, Departemen Kehutanan. Jakarta
Soerianegara dan Djamhuri.1979. Pemuliaan Pohon Hutan. Fakultas Kehutanan. Institut Pertanian Bogor
Soerianegara dan Indrawan.2002. Ekologi Hutan Indonesia. Laboratorium Ekologi Hutan, Fakultas Kehutanan, IPB. Bogor
Tantra. 1981. Flora Pohon Indonesia. Balai Penelitian Hutan Bogor. Bogor
Thielges, Sastrapradja dan Rimbawanto. 2003. Insitu and Ex situ Conservation of Commersial Tropical Trees. Faculty of Forestry, Gadjah Mada University. Yogyakarta
Wahyudi. 1993. Studi Bentuk Perakaran jenis Shorea leprosula, S. palembanica
dan S. stenoptera pada Tanah Latosol. Skripsi. Jurusan Manajemen Hutan, Fakultas Kehutanan, IPB. Bogor
Lampiran 2 Keterangan Individu yang Dilakukan Pengujian Amplifikasi ADN
No Individu No Pohon Simbol Asal Jenis secara
Morfologi
Klaster
1 760 S.spar1 Pasir Mayang Shorea parvifolia I
2 744 S.spar2 Pasir Mayang Shorea parvifolia I
3 573 S.spar3 PT Asia Log Shorea parvifolia I
4 1158 S.spar4 Nanjak Makmur Shorea parvifolia I 5 2028 S.spar5 Bukit Bangkirai Shorea parvifolia I
6 1153 S.sp1 Nanjak Makmur Shorea parvifolia II 7 762 S.sp2 Pasir Mayang Shorea parvifolia II
8 761 S.sp3 Pasir Mayang Shorea parvifolia II 9 574 S.sp4 PT Asia Log Shorea parvifolia II 10 583 S.sp5 PT Asia Log Shorea leprosula II 11 584 S.sp6 PT Asia Log Shorea leprosula II
12 1414 S.sp7 Sari Bumi Kusuma Shorea leprosula II 13 1404 S.sp8 Sari Bumi Kusuma Shorea leprosula II 14 2039 S.sp9 Bukit Bangkirai Shorea leprosula II 15 598 S.sp10 PT Asia Log Shorea leprosula II 16 81 S.lep1 Haurbentes Shorea leprosula III
17 51 S.lep2 Haurbentes Shorea leprosula III 18 67 S.lep3 Haurbentes Shorea leprosula III 19 60 S.lep4 Haurbentes Shorea leprosula III
Lampiran 3 (lanjutan) Primer OPO-13
Individu ke-
PIPET MIKRO
PCR TIMBANGAN ANALITIK
PENGADUK OVEN
PHOTO
UV FREEZER SENTRIFUSE
pH
METER VORTEX
POWER SUPPLY
Lampiran 5 Gambar Daun Segar S. parvifolia dan S. leprosula pada Fase Semai
2 cm
Shorea parvifolia
Shorea parvifolia
Shorea leprosula