Latar BeIakang
Kentang merupakan tanaman yang mendapat prioritas &lam pengembangannya karena merupakan tanaman pangan dunia setelah padi, gandum dan jagung. Selain itu kentang juga merupakan tanaman sayuran yang populer di Indonesia. Beberapa alasan pengembangan tanaman kentang adalah (1 ) mernpuny ai m a yang enak serta nutrisi yang berimbang antara protein, lemak, karbohidrat, vitamin dan asam amino esensial yang baik; (2) dapat dipakai sebagai komoditi yang ideal untuk diversifikasi pangan yang ideal (Wattimena, 1994); (3) sangat
menbwtungkan petani karena harganya cukup tingg, umbi relatif tidak mudah nrsak dan fluktuasi harga d i p x u rendah (Watbmena, 1993); (4) sebagai bahan baku penting pada industn french fries, chip dan berbagai makanan ringan lainnya.
Pengembangan tanaman kentang di daerah tropis ~ m a s u k Indonesia pada umumnya dibatasi oleh sejumiah kendda seperti ketersediaan bibit bermutu, keterbatasm lokasi tanam, serta kerusakm oleh hama dan penyakit. Produksi bibit berrnutu di daerah tropis sulit dilakukan karena tidak adanya m u s h dm daerah yang bebas penyakit atau vektor dari penyakit, sehingga bibit bennutu selalu diimpor dari negara Iain dengan harga yang mahal, apalagi dengan perbanhngan ni lai tukar rupiah pa& saat ini.
Di daerah tropis, kentang hanya dapat ditanam di dataran tinggi yang suhunya cukup rendah. Penanaman kentang di dataran rendah akan menyebabkan produksi menwun, karena suhu yang tinggi menyebabkan semakin berkurang asirnilat yang &simpan dalam umbi dan serangan penyakit yang lebih banyak. Tercatat sehtar 266 hama dan penyakit yang menyerang tanaman kentang yang terdiri dari 23 v i m , 38 cendawan, 6 bakteri, 2 mikoplasma, 1 vitoid, 68 nematoda dm 128 insekta (Mendom, 1 987).
Menurut Machmud ( 1 990), S a r a umum penyakit dabat serangan bakteri lebih sukar dikendalikan dibanding penyakit lain. Tindakan tepat pengenchlian kimia secara praktis dan efektif tidak ada (Martin & fiench, 1 997). Salah satu metode untuk mengendaiikan penyakit tersebut adalah dengan menggunakan kultivar y ang tahan
(French, 1994). Pengendalian dengan menanam varietas yang tahan merupakan m a yang efektif, efisien dan aman bagi lingkungan.
Beberapa si fat ketahanan peny akit sebenamya telah terdapat pada beberapa species liar Solanurn secara terpisah. Menurut Hawkes ( 1 994) species-species than tersebut antara lain S. phureju, S. microdonturn, S. verney, S. chucoense, S, berthuoultii, S. verrucusum, yang khan terhadap bakteri hawar dam, S chacoease, S. phureja, S microdonturn, tahan terhadap layu bakteri dm S. bulhocustcmum, S. chacoenre, S phureja, S. microdonturn, S. pinnurisectum tahan terhadap busuk lunak
(sop rot) serta beberapa species lain yang tahan PVX, PVY, PLRV, nematoda dan secangga. Untuk itu perlu dilakukan pengujian dari klon-klon yang diduga membawa si fat ketahanan tersebut, sehingga dapat digunakan dalam pemuliaan tanaman selanjutnya untuk mendapatkan klon baru yang juga membawa sifat ketaharm tersebut dan berdaya hail tinggi serta kualitas yang baik.
Pengujian ketahanan tanaman melalui inokulasi alarni di lapangan telah banyak dilakukan, namun metode ini sering mengalami diseuse escup. Disamping itu lahan yang digunakan untuk pengujian tersebut &pat menjadi sumber penyalut banr tenrtama untuk patogen-patogen yang bersifat tular tanah seperh R. solanucear~im dm E. curomvora. Metode lain yang &pat ditempuh
dan
relatif lebih aman adalah tehnik seleksi in vitro. Tehnik ini lebih efisien dan efektif karena &pat mengurangt terjadinya escape, has11 seleksi dapat diulang d i m a h kaca, patogen yang digunakan tetap terbatas di laboratorium dm umumnya rnemberikan hasil yang relatif tidak berbeda dengan inokdasi di Iapang (Samanhudi, 200 1 ).dapat dilakukan melalui persilangan dengan spesies liar yang tahan rnaupun penggunaan metode rekayasa genetik, mutasi buatan atau hibridisasi somatik
.
Pemuliaan secara konvensional untuk mendapatkan kultivar kentang yang tahan terhadap E. c pv curotovora rnaupun R solanacearum mempunyai beberapa kendala. Kendala ini disebabkan pemuliaan tanaman kentang pada level tetraploid merupakan pekejam yang sulit dan lama, krutama kmkternya yang dtturunkan secara tetrasomik, heterosigositasnya tinggi, adanya self incompatibility dan mandul jantan pada kberapa Mtivar (Wenzel, 1994). SeIain itu sifat ketahanan tersebut seringkali terdapat pa& species liar yang mempunyai nilai EBN (Endosperm Balance Number) krbeda (Purwito, 1999). Species liar yang mempunyai ketahanan texhadap penyakit l a y bakteri dan busuk lunak seperh S. chacoense dan S. microdonturn mempunyai nilai EBN 1, sehingga tidak bisa hsilangkan dengan kentang dhaploid yang mempunyai nilai EBN 2 seperh BF 1 5 , Nicola, Cardid dan beberapa species budidaya lainnya
sesuai untuk menumbuhkan dan meregenerasikan protoplas menjadi tanaman. Seringkali pekerjaan dan media yang saw k&ka dilakukan pada labratorim atau waktu yang berbeda memberikan hasil yang berbeda. Hal ini disebabkan lingkungan dan perahtan yang digunakan sangat mempengaruhi keberhasi f an isolasi, kultur dan regenerasi protoplas tanarnan.
Tujuan Penelitiao Penelitian ini bertujuan untuk :
( 1 ) Menguj i tingkat ketahanan beberapa species kentang terhadap penyakit layu W e r i dan busuk lunak secara in vitrcl
(2) Mencari media tumbuh in vipo tanaman kentang yang baik sebagai material sumber protoplas
(3) Mencari media ymg &pat meregenerasikan mesofil daun clan internode tanaman kentang yang merupakan organ penghasil protoplas.
(4) Mendapatkan metode isolasi dan kultur protoplas beberap klon kentang
Kegunaan Penelitiao
Beberapa kegunaan dm penelitian ini adalah d l d a p a h y a beberapa infomasi awal yang menunjang suatu penelitian y ang terintegrasi h i a m perakitan kultivar lmggul tanaman kentang yang rnempunyai ketahanm terhadap p y a k i t iayu bakteri dan bus& lunak, khususnya dengan metode hibridisasi somatik. Beberapa species kentang liar yang diketahui membawa sifat ketafianan terhadap Id
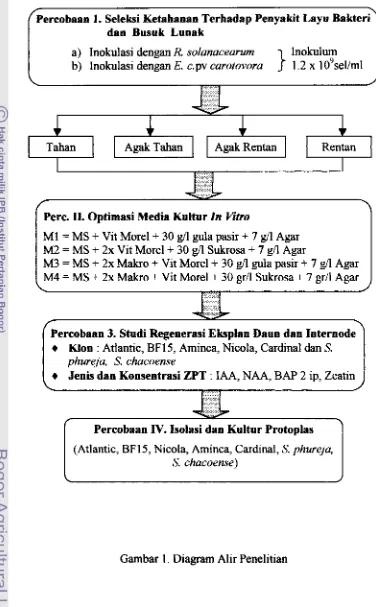
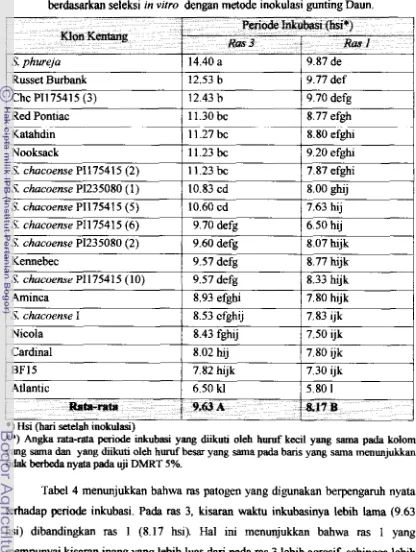
1. Selebi Ketahannn Terhadap Penyakit Layu Bakteri dan Busuk Lueak
a) Inokulasi dengan R solanaceumm lnokulum b) Znokulasi dengan E. c. pv carotovora 1.2 x 1 0~sellrn1
I
Pere. TI. Optirnasi Media Kultur In YinoI
TahanM1 = MS
+
Vit Morel + 30 gll gda pasir + 7 g/l AgarM2 = MS + 2x Vit Morel
+
30 g/l Sukrosa + 7 g/l AgarM3
= MS + 2x Makro + Vit Morel+
30 gll gula pasir+
7 gll Agar , M4 = MS+
2x Makro + Vit Morel + 30 gdl Sukrosa + 7 gr/l Agar ,Percobaan 3. Studi Regenerasi Eksplsn Dauo dan Internode Moo : Atlantic, BF 15, Aminca, Nicola, Cardinal dan S. phureja, S. chacoense
+
Jenk dan Konsentrasi ZPT : IAA, NAA, BAP 2 ip, Zeatin Agak Tahan Agak RentanI
Percobaan IV. Isolasi dam Kultur Protoplas1
Rentan(Atlantic, BF 15, Nicola, Aminca, Cardinal, S. phureja,
[image:139.576.77.453.79.686.2]S. chacoense)
Daftar Pustaka
French, E.
R.
1 994. Strateges for integrated control of bacterial disease. Pp 249-446. In: A. C. Hayward and G. L. Harbnan (eds). 1994. Bacterial Wilt: The diseaseand its causative agent, P.solanaceanrm. CAB, International, WalIingford. Hawkes, J.G. 1994. Origin of cultivated potato and species relationships, In: J.E.
Bradshaw and G. R. Mackay
Vds).
Potato Genetic. Pp. 342. CAB International. Mahmud, 1990. Penyalut bakteri tanaman pangan dan hortiMturad~
Indonesiadalam perlindungan tanaman (Eds) Prawiro Soernardjo, S.D. Sudarrnadji, Harsono d m I.S. Basuki. PT. Agricon. Hal 233-25 1.
Martin, C. and E. R. French. 1997. Bacterial wilt of potato. Bacterial wilt. A Training Manual. International Potato Center (CIP), Lima, Peru.
Mendoza, H. A. 1987. Advance in population breeding and its potential impact on the efficiency of breeding potatoes for developing countries. P. 234-246. In G . J . Jeeiisand D.E. richardson (Eds): The Production of New Potato Varieties Technology Advance. Cambridge Univ. Press. Cambridge.
Millam, S., L.A. Payne and G.R. Mackay. 1995. The integration of protoplast fusion derived material a potato breehng programme: a review of progress and problems. Euphytica 85:45 1 4 5 5 .
Purwito, A. 1999. Fusi protopla intra dan interspecies pada tanaman kentang. Disertasi Program Pmasarjana IPB, Bogor. 223
hal.
Sarnanhudi. 2001. ldentifikasi ketahanan klon kentang hasil fusi protoplas BF15 dengan Solanurn stenotomum terhadap p y a k i t Iayu bakteri (Raistonia solanuceurum). Thesis Pascasarjana IPB, Bogor. 88 ha1 .
Wattimena, G. A. 1993. Studi pemdiaan tanaman kentang. Laporan Penelitian Riset Unggulan Terpadu (RUT) I. Fakultas Pertanian LPB.
---
1994. Merakit kultivar kentang toleran terhadap penyakit degenerasi (PVX, PVY dan PLRV), penyakit layu bakteri dan penyalut hawardam melalui ekstraksi, trafisformasi dan h i . Laporan Hibah tim. Direktorat Jendral Perguruan tinggi. Jakarta.
TLNJAUAN PUSTAKA
Botani Tanaman Kentang
Kentang merupakan tanaman semusim yang berbentuk semak atau herbaciow. Batang tanaman cukup tebal berbentuk bulat sam pai persegi , berwarna hijau dan keunguan bila mengandung antosianin dengan susunan utama terdiri atas stolon, umbi, batang, daun, bunga
dan
biji, serta akar. Stolon merupakan tunas lateral yang twnbuh dari ketiak daun dibawah permukaan tanah (Rukmana, 1997).Daun kentang adaiah daun rnajemuk yang menyirip ganjil dengan anak dam primer tersusun diantara anak daun sekunder. Bentuk daun prime^ hulat sampai lonjong, susunannya diakhiri dengan anak daun tunggal pada ujung tangkai. Wama daun hrjau atau hjau keputih-putihan. Posisi tangkai daun terhadap batang tanaman membentuk sudut kurang dari 45 derajat atau lebih. Pada
dasar
tangkai daun terdapat tunas ketiak yang dapat berkembang menjadi cabang sekunder (Rukmana, 1 997).Bunga tanaman kentang merupkm bunga hermapradit, setiap bunga rnempunyai lima benang sari yang mengelilinp sebuah putik. Putik tanaman kentang lebih cepat rnasak dibanding tepungsarinya (protogeni), sehingga terjadi penyerbukan silang . Bunga tersusun dalam karangan bunga dan tumbuh pada ujung batang dan tiap karangan memilib 7 - 15 kuntum bunga. Mahkota bunga berwarna putih, merah atau
biru (Thompson clan Kelly, 1957).
Buah kentang be- hijau tua s a m p keunguan, berbentuk bulat ($ 2.5 cm) dan berongga dua Buah mengandung sekitar 500 bakal biji, tetapi yang dapat berkembang menjadi biji hanya berkisar 10
-
300 biji. Biji berwama krem, krukuran kecil(4
0.5 mm) clan rnempunyai masa domansi lebih kurang 6 bulan (Rukrnana,1997).
Introduksi tanaman kentang di Indonesia dilakukan oleh Belanda pada bhun 1794 yang mulai ditanam didaerah Cisarua, Cimahi, kemudian menyebar ke daerah lain seperti Lembang, Pangalengan, Wonosobo, Curug, Brastagi dm Tomohon (Wattimena, 1994).
Soianum ruberosum terdiri dari dua subspecies, yaitu subsp. andigena
dan
subsp ruberosum. Keduanya mempunyai jurnlah kromosom 2n = 4x = 48. Perbedaandari kedua subspecies ini addah pada komponen sitoplasrniknya. Kemungkman S. tuherosum subsp. t uberosum mendapat kan komponen sitoplasmiknya dari S. chacoense (Grun, 1 990). Solanum catherosum subsp, andigena berasal dari persilangan S. stenotomum (2n = 2X) dengan S. , ~ p ~ r . ~ i p i I u m (2n = 2x) yang diikuti
dengan proses penggandaan kromosom. Kentang yang sekarang urnum
di budidayakan disel uruh dunia adalah kentang tetrapl oid (2n=4x=48) yang berasal dari Peru dan Bolivia dan dikenal dengan tuherosum dan tuhermum barn. Demikian juga hibrida antara kedua spesies tersebut atau hibrida dengan spesies lain, misdnya dari species liar. Genus Solanurn mempunyai sekitar 2000 species dan 160 diantaranya benunbi (Hawkes, 1994).
Kondisi lingkungan dan iklim mem pengaruhl perturnbuhan tanaman kentang dan tingkat produksi wnbi. Tanaman kentang umumnya tumbuh baik di daerah dataran tinggi dengan ketinggian 500 - 3000 m dari permukaan lad (dpl).
Selama pertumbuhan diperlukan curah hujan rata-rata 1000 mm atau sekitar 200 -
300 m m setiap bulan. Au yang berlebihan dapat menyebabkan umbi busuk, sedangkan pada konhsi kering dapat terbentuk umbi abnormal. Suhu rendah 1 5 - 20
"C, cukup sinar matahari dan kelembaban udara tinggi 80 - 90 O h sangat baik untuk
pertumbuhan dan perkembangan bunga. Sebaliknya suhu tinggi, keadaan berawan dan kelembaban yang rendah mmghambat perhrmbuhan
dan
perkembangan umbi serta bunga. Pembentukan umbi kentang mernerlukan suhu udara rnaupun suhu tanah yang dingin berkisar antara 1 0 - 20 "C. Jika selama pembentukm umbi suhu udaraumbi akan rendah. Suhu malam yang dingn serta perbedaan suhu siang dan malam yang besar sangat membantu pengisisan umbi kentang (Wattimena, 1994).
Penyakit Layu Bakteri pada Tanaman Kentang
Penyalut layu sampai saat ini masih m e r u m kendala utama Warn pertanian & Indonesia, terutama untuk fmili Solanaceae. Penyakit l a p dapat disebabkan oleh bakteri dm jarnur patogen. Layu yang disebabkan oleh bakteri R
solunaceartrm mirip dengan layu yang disebabkan kekurangan air atau patogen- patogen lainnya seperti Fmarium dan Verticillim Penyebab layu dapt di ketahui dengan cara merendam potongan batang atau umbi tanaman sskit dalarn air jernih. Jika penyebab layu adalah e r i maka dalam beberapa menit ptongan batang tersebut akan rnengeluarkan cairan putih kenrh yang merupakan eksudat bakteri, ha1 ini y ang membedakannya dari Fwurium (Semangun, 1989).
Penyebab penyakit layu bakteri pertama kali dilaporkan oleh Smith pada tahun 1 896. Patogen penyebabnya dinarnakan Bacterium solanuceanmt kemudian diganti namanya menjah Phytomonas solanacearum, P,vewlomonas ,~olanaceurum, Rukhoderia solanacearum (Kelman et al-, 1 994 ). Termasuk dalam Ordo Pseudomonadales, Fam il i Pseudornonadaceae dan Genus Pseudo~nonas (Hooker, 198 1). Sekarang patogen tersebut dikenal dengan narna Rdstonia solanacearum (Yabuuch ef n l , 1995). Penyakit layu bakteri merupakan penyakit utama pada tanaman kentang, tomat, terung, la&, jahe, cabe, kacang tanah, pisang dm tembakau baik
d~
daerah tropis maupun sub tropis.Iherr h Sebaran Patogen
inang d m R. solanuceurum termasuk dalam famili Solanaceae, Musaceae, Asteraceae dan Fabaceae (Kelman, 1953; French, 1996). Pada tahun 1994 dilaporkan bahwa inang dari patogen ini telah mencapai 50 famili tanaman, baik spesies budidaya maupun spesies liar. Sedangkan tanrunan yang sangat rentan terhadap penyakit ini adalah kentang, tomat, tembakau, terong, cabai, paprika dan kacang tanah (Hay ward,
1990).
Sumber utama penularan penyakit layu bakteri di lapangan adalah melalui umbi bibit yang terinfeksi, termas.uk umbi yang terinfeksi secara laten, serta tanah yang terinfeksi. Perpindahan umbi bibit yang terinfeksi yang dipanen di daerah yang relatif panas ke lokasi yang lebih dingin terrnasuk dataran tinggi di daerah tropis juga merupakan salah satu sebab tejadmya infeksi secara laten pada umbi yang di
prduksi ol eh tanaman yang keli hatannya sehat di lapangan (French, 1 994).
Di Indonesia, penyakit layu bakteri dijumpai di seluruh daerah sentra produksi kentang di pulau Jawa. Penyakit ini dapat menyebabkan kematian tanaman kentang 1&30 % bahkan kadang-kadang menurunkan hasil produksi kentang sampai 80 % (Wattimena, 1994).
Ciri-ciri R solQmcearirutr
Bakteri R solanacearum W n t u k batang dan berujung bulat, gram negatif, aerobik, tidak membentuk spra, tidak berkapsul, dan sering bersifat tidak motil (Kelman, 1953; Martin dan French, 1996). Berukuran 0.5 - 1.0 x 1.5 - 4.0 pm
(Hildebrand et al., 1988). Ukuran ini tergantung dari kondisi pertumbuhan dari bakteri tersebut. Isolat yang virulen umumnya ti& berflagela dan tidak dapat bergerak, sedangkan yang tidak v i d e n mengandung 1 - 4 flagela, &pat bergerak dan ti& membentuk spora istirahat ( K e h q 1953).
Bentuk koloni bakteri bervariasi dan tidak tembus cahaya sampai bintik- bintik kecil atau intermediet. Strain virulen sering d a p t d i k e d i dengan bentuk koloni yang berlendir atau fluidal yang kemudian berubah menjadi tidak virulen dengan bentuk koloni kecil-kecil atau bintik-bintik. Perbedaan bentuk koloni dm deraj at virulensinya dihubungkan dengan produksi cairan yang mengmdung polisakarida.
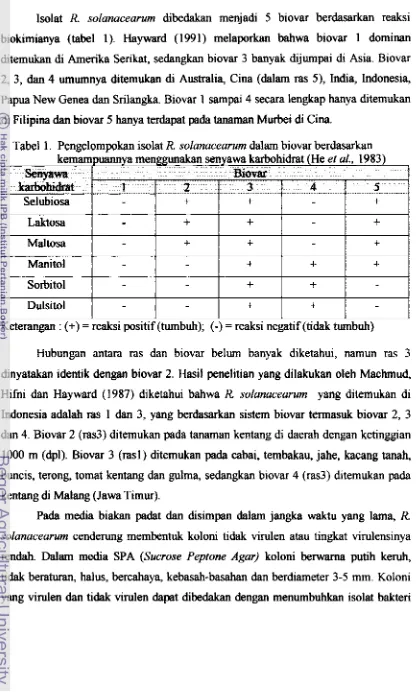
Klasifikasi R solanacearum dibedakan &lam dua sistem, yaitu sistern ras dan sistem biovar. Ras dan biovar ini merupkan pengelompokan informal pada tingkat inm sub-species d m bukm dikembangkan melalui pengkodean nomenklatur bakteri
.
Pengelompokan dalam sistem ras didasarkan pa& herah asal hangdan
kisaran inangnya, morfologi koloni, tramrnisi oleh insekta dm adaptasi suhu serta hubungan patogenitas dengan inang. Sedangkan si stem bi ovar didasarkan p d a perkdaan sifat biokimia, serologi dan si fat-si fat lainnya pada media biakan, yaitu kemampuan bakteri menggunakan atau menghidrolisi s tiga seny awa disakarida (selubiosa, laktosa dan maltosa) dan tiga alkohol heksosa (manitol, sorbitol dan dubitol).Berdasarkan sistem ras, saat ini isolat R solanaceurum hbedakan menjadi 5
ras, yaitu : ras 1 mempunyai kisluan inang yang sangat luas di daerah tropis dan sub
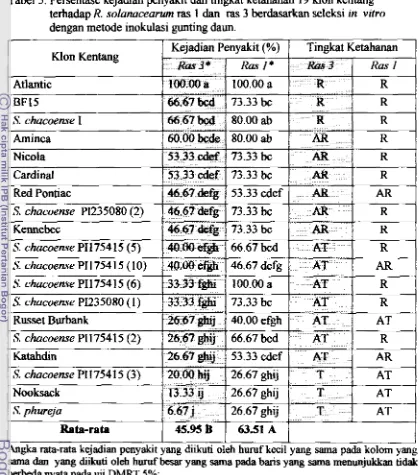
Isolat R solanacearum dibedakan menjadi 5 biovar berdasarkan reaksi biokimianya (tabel 1). Ham (1991) melaporkan bahwa biovar 1 dominan ditemukan di Arnerika Serikat, sedangkan biovar 3 banyak dijumpai di Asia. Biovar 2, 3, dan 4 umumnya ditemukan di Australia, Cina (&lam ras 51, India, Indonesia, Papua New Genea dan Srilangka. Biovar 1 s a m p 4 secara lengkap hanya ditemukan & Filipina dan biovar 5 hanya terdapat pada tanaman Murbei di Cina.
Tabel 1. Pengelompokan isolat R. soIanucearum dalam biovar berdasarkan
I
Sorbitol1
-1
-
1
+
1
+
1
-
1
kem-mp-Ya menggunakan senyawa karbohidrat (He et ol., 1983)
w w
8 i m, karmidM 1
Selubiosa -
Hubungan antara ras dan biovar belum banyak diketahui, namun ras 3 Bulsitol
dinyatakan identik dengan biovar 2. Hasil penelitian yang dilakukan oleh Machmud, Hifni dan Hayward ( I 987) diketahui bahwa
R
solanacearum yang ditemukan di2 I
+
Indonesia adalah ras 1 dm 3, yang berdawkan sistem biovar tennasuk biovar 2, 3
dm
4. Biovar 2 (m3) diternukan pdatanman kentang di daerah dengan ketinggan Keterangan : (+) = reaksi positif (tumbuh);(-1
= reaksi negatif (tidak tumbuh)-
1000 m (dpl). Biovar 3 (rasl) ditemukan pada cabai, tembakau, jahe, h a n g tanah,
3
1
4I
5buncis, terong, tomtit kentang dan gulrna, sedangkarn biovar 4 (ras3) btemukan pada
+
-
kentsng di Malang (Jawa Timur).
-
+
Pada media biakan padat dan disimpm &lam jangka waktu yang lama,
R
+
solanacearum cenderung rnembentuk koloni ti& virulen atau tingkat vimlensinya rendah. DaIam media SPA (Sucrose Peptone Agar) koloni berwarna putih keruh, tidak b e r a m , halus, bercahaya, kebasd-bas& dan berdiameter 3-5 mm. Koloni yang virulen dan tidak virulen &pat di-n dengan menumbuhkan isolat bakteri
[image:146.576.75.491.72.764.2]pada medurn yang mengandung 2,3,5 -triphenyl tetrazolium chloride (media TZC ) .
Koloni yang virulen berwarna putih dengan pusat berwarna merah muda
dan
berbentuk bulat tak beraturan, sedangkan yang tidak virulen koloninya berbentuk bulat kecil dan berwama rnerah tua. Pada media cair bakteri yang virulen biasanya non motil, s e h g k a n yang a h f bergerak biasanya adalah bakteri yang tidak virulen (Kelman, 195 3; Hooker, 1 990).Gejala Penyakit
Gejala penyakit layu yang disebabkan R salanuceurum d a p t terlihat pada setiap fase perhmbuhan tanaman kentang, baik pada bagian tanaman di atas maupun di bawah tanah. Gejala khas
di
atas permukaan tanah ditandai dengan te jadinya kelayuan pada pucuk, rontok, tanaman kerdil dan daun rnenguning. Kadangkala kelayuan kurang berkembang, akan tetapi tejadi pengerdilan pada tanaman muda, terutama pada varietas-varietas yang rentan (Kelman, 1953; Martin dan French,1996).
Pada tanaman kentang gejala penyakit pertama kali biasanya terlihat pada tanaman yang befufnur sekitar enam minggu. Dam-daun layu biasanya dimulai dari dam muda dan awalnya hanya pa& satu cabang yang lam kemudian jika penyakit berkembang c e p t maka seluruh daun dapat layu tanpa banyak mengalami perubahan warna. hundaun b e ~ w n a s m sampai hijau pucat, akhimya benrbab menjadl coklat tanpa ctiikuti penggulungan tepi daun. Kelayuan yang hebat disertai dengan robohnya batang lebih sering terjadi pada tanaman muda dan s M e n dari varietas- vari etas yang rentan (Semangun, 1 989).
umbi terinfeksi bakteri berasal dari tanaman layu dan juga tidak semua umbi terinfeksi dapat menunj ukkan gejala atau umbi salut dapat berasal dm tanaman y ang sehat (infeksi laten). lnfeksi laten dapat di deteksi dengan cara umbi di inkubasi pada suhu 30 "C dengm kelembahan yang tinggi. Setelah 2-3 minggu gejala yang khas dapat diamati (Martin and French, 1997).
Penyakit Busuk Lunak pada Tanaman Kentang
Penyaht kaki hitam (black leg) pada tanaman kentang dan busuk lunak (soft rot) pada umbi merupakan penyakit yang tersebar luas, dan merupakan pengharnbai pertumbuhan pertanaman kentang yang penting di berbagai belahan dunia. Di Indonesia yang rnerupakan &erah tropis penyakit ini disebabkan oleh bakteri E. c. pv curotovora. Salah satu upaya menghindari k m a k a n oleh penyakit ini dilakukan dengan ti&k menanam kentang di Man-lahan basah atau tidak melakukan pengairan y ang berlebi han. Memanen umbi pa& waktunya (setelah tua) d m tidak menempatkan umbi hasil panen dihwah sinar matahari dapat mengurangi resi ko terserang penyaki t ini. Sebaiknya umbi harus kering dulu sebelurn disimpan atau di kernas (Bradbwy,
1986; Lelliot, 1 987). Daerah Sebaran Patogen
Daerah sebaran penyakit ini cukup Iuas terutamst daerah beriklim hangat yaitu E. c. ssp curr~fovora. Sedangkan di daerah benklim sejuk (dingin) biasanya di dominasi oleh E. c. ssp atroseptica dan di daerah panas di dominasi oleh h'. chrysunthemi (French dan Lindo, 1979). E. c. pv carolovora dan E. ch?ysunthernr mempunyai kisaran inang yang luas termasuk famili Solanaceae, sedangkan E. c. pv atrosepticu mernpunyai hang yang spesifik yaitu tanaman kentang.
Berbagai faktor yang mendorong berkembangny a pen yakit bus& lunak telah banyak diidentifikasi, namun bagaimam mekanisme serangan penyakit ini masih
terkontaminasi oleh patogen ini . Penyebaran pen yalut busuk lunak seringkali terjadi melalui penggunaan bibit urnbi yang telah terkontaminasi oleh patogen ini. Pertumbuhan tanaman yang b e r d dan bibit yang terinfeksi oleh penyakit (busuk kering, layu, late blight, dll) atau kenrsakan secara fisiolog sering rnembuat level busuk Iunak b e d diatas rata-rata. Dari beberapa penelitian juga dilaporkan adanya hubungan antara blackleg dan rendahnya level keseburan tanah (Semangun, 1989). Ciri-ciri E. c. pv carotovora.
Bakteri E. c. pv carofovora merupakan bakteri pektolitik, berbentuk batang, berukuran 0.5 - 3 pin, bentuk tunggal, berpasangan atau d a m keaderan tertentu dapat membentuk rantai dan merupdan organisme prohotik yang tidak mempuny ai klorofil. Termasuk gram negatif, sebagian besar bersifat saprofit fakultatif, anaembik, tidak membentuk s p a , tidak berkapsul, bergerak menggunakan flagel yang terdapat disekeliling batang dan mampu memproduksi enzim pektinase dalarn jumlah ksar. E. c pv carotovora merupakan bakteri tular
tanah yang &pat menyerang apa saja dari bagan tanaman. Sebagan besar strain tidak marnpu mernpraduksi polisakarida ekstra seluler daiam jumlah besar pada media yang kaya gula (French and Lindo, 1979).
Ddam media biakan mumi, E. c pv carotavara berbentuk bulat dengan pin-r tidak rata, berwarna kekuningan (krem), cembung dm agak encer. Untuk r n e m b d a h
kaloni
yang virulerrdm
ti&
vinzlen dapat dilakukan dengan rnenumbuhkan isol at bakteri pada medi urn yang mengindung 2,3,5 -tnphenyl tetrazolium chloride. KoIoni yaag vinden berwarna krem dengan pusatberwama
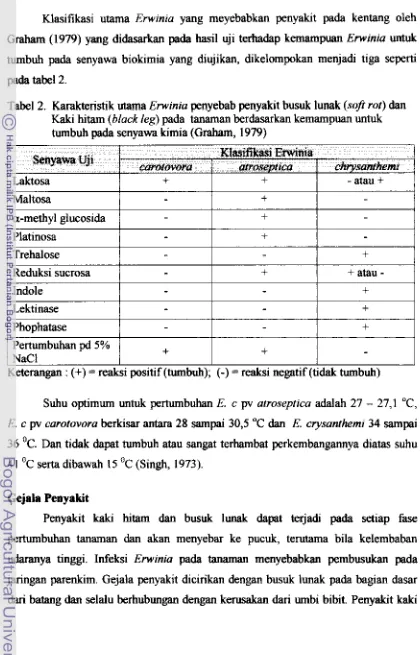
rnerah muda sedangkan yang tidak virulen koloninya berbentuk bulat kecil dan berwarna merah tua.Klasifikasi utama Ewinia yang meyebabkan penyakit pada kentang oleh
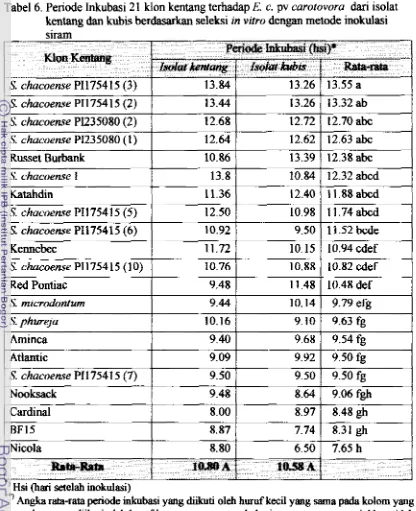
[image:150.576.69.489.71.726.2]Graham (1979) yang didasarkan pada h i 1 uji terhadap kemampuan Envinia untuk tumbuh pada senyawa biokimia yang diujikan, dikelompokan menjah tiga seperti
Tabel 2. Karakteristi
k
m aE m inza peny ebab penyakit busuk lunak (so8 r ~ ) dan Kaki hitam (black leg) pada tanaman berdasarkan kemampuan untuk turnbuh pada senyawa kimia (Graham, 1 979)-
I
+
I
1
a-methyl glucosidai
-I
I
PlatinosaI
-
I
+
I
-
I
Trehalose Reduksi sucrosa
I
Phophatase - -+
Indole Lektinase
-
-
Suhu optimum untuk pertumbuhan E. c pv atroseprica addah 27 - 27,l "C, 17. c pv carotovora berkisar antara 28 sampai 30,5 "C dan E. crysunthemi 34 sampai 36 OC. Dan tidak dapat tumbuh atau sangai terhambat perkembangannya d i m suhu
41 OC serta dibawah 15 'C (Singh, 1973).
-
-
Pertumbuhan pd 5% NaCl
Gejala Penyakit
Penyakit kaki hitarn dm busuk lunak &pat terjadr pada setiap fase perhmbuhan tanarnan dan akan menyebar ke pucuk, terutama bila kelembaban udaranya tinggi. Infeksi Erwinia pada tanaman menyebabkan pembusukan pads jaringan parenkim. Gejala penyakit dicirikan dengan busuk lunak pa& hapan dasar dari batang dan selalu krhubungan dengan kerusakan dari umbi bibit. Penyakit kaki
-
+
+
+ atau
-
-
-
Ketemgan : (+) = reaksi positif (tumbuh);
I-)
= reaksi negatif (tidak twnbuh)+
+
+
hitam dan busuk luinak terjadi secara sporadis pa& umbi sehingga membusuk atau sebaliknya hitam. Luka berlendir seringkdi menyebabkan batang menjadi kunak secara cepat karena umbi bibit yang membusuk. Infeksi pada tunas muda atau stolon yang lanjut biasanya menyebabkan kematian pada tatlaman. Busuk pa& uj ung stolon
terjad pada umbi-urnbi mu&. Tanaman muda umumnya kerdil dan tegak. Dam-dam menguning clan menggulung ke atas, seringkali diikuti dengan l a p dm matinya tanaman. Ketika tunas yang lebih tua terinfeksi, pada awal perkernbangan penyakit daun rnenjadi tegak dan pada daun yang lebih mudanya menggulung kedalam seperti gejala yang disebabkan leafroll virus. Bedanya, pada busuk
lunak
hanya keberapa dam yang menggulung sedangkan leaftoll virus menyebabkan seluruh daun menggulung (French dan Lindo, 1979).Pada cuaca kering pucuk yang terinfeksi rnenjadi kering dan mati, kemudian gugur, biasanya pada pangkal batang berwama coklat tua atau hitam. Gejala kaki hitam dan busuk lunak dapat krkembsng di setiap masa pertumbuhan tanaman dan serangan di distribusikan secara acak (Semangun, 1 989).
Dalam penyirnpanan, Erwinia menyebabkan kerusakan pa& umbi dengan terjadinya busuk lunak. Bakteri busuk lunak menpnfeksi lentisel rnelalui permukaan umbi yang basah, menyebabkan permukaan tersebut tertekan (terdepresi) secara sirkuler (melingkar). Umbi busuk menyebar dengin cepat pada saat pengangkutan atau penytmpanan d~ gudang. Di Iapangan atau digudang bus& lunak sering dipicu oleh kemakan mekanik atau kerusakan oleh serangan hama dan penyakit lainnya pada umbi. Jaringan yang terinfeksi menjah basah, berwarna krem kehitam-hiiaman dan lunak, sehingga mudah dibedakan dari jaringan yang sehat (CIP dm Balitsa,
I 999).
ktahansn Tsnaman Kentang terhadap Penyakit
Gen virulensi patogen dan gen kerentmm pa& umumnya bersifat spesifik untuk satu atau beberap species tanaman yang masih berhubungan secara taxonomi. Spesifitas gen vindensi dm gen kerentanan dapat menerangkan mengapa suatu gen patogen virulen pda satu species tanaman dm tidak pa& species tanaman lain atau sebaliknya mengapa suatu species tanaman rentan terhadap patogen tertentu tapi
tahan
terhadap patogen yang lainnya.Ketahanan suatu tanaman terhadap patogen dapat dibedakm menj adi
ketahanan horizontal dm ketahanan veriikal. Ketahanan horiwntal di kontrol oleh banyak gen sehingga disebut ketahanan poligeni k atau rnultigenik. e n - g e n yang
k p a n
dalam ketahanan horimntscl mernberi pengaruh d q g n cam mengontroltahaptahap fisiologrs
tanaman
yang menyebabkan terjadkya mekanisme pertahanan. Ketahanan horizontal tidak melindungi tanaman dm infeksi, tetapi menghambat perkembangan patogen sehmgga penyebaran penyaki t j uga terhambat dan ini akanr n e m p e n m epidemi penyakit di1apanga.n ( Semangun, 199 I ).
Ketahanan vertikal dikontrol oleh satu atau beberap gen sehingga disebut j uga ketahamn monogenik atau oligogenik. Gen monogeni k mengontrol sebagian besar tahaptahap dalm interaksi inang dm patogen, sehingga besar peranannya dalm ekspresi ketahmm. Oleh karena itu terdapat tanaman yang sangat tahan terhadap satu atau bekrapa ras patogen namun rentan terhadap ras lainnya dari patogen yang sama. Interaksi inang-patogen yang tidak cocok menyebabkan patogen tidak dapat bertahan dan memperbanyak diri dalam tanaman inang. Ketahanan vertikaI meqbambat epidemi dengan cara membatasi inokulwn (Agnos, 1988).
Pemuliaan tanaman kentang terhadap penyakit layu b&eri
di
Indonesia telahdimulai sejak tahun 1975, dengan rnemperkenalkan sebanyak 25 klon kentang yang berasal dari persilangan S. phureja dun
S
tubero.~um, yang memberikan tingkatketahanan
yang k a r i a s i . Untuk rnendapatkan tanaman kentang yang benar-benartahan terhadap R. solanacearum bukanlah suatu pekerjaan y ang mudah, sehingga
ketahanan yang tinggi terhadap penyakit layu bakteri tersebut (Sahat dan Sulaiman, 1990).
Sahat (1985) menyimpulkan bahwa sifkt ketahmm tanaman terhadap layu bakteri dikontrol oleh tiga gen dominan. Sedangkan Hooker ( 1 990) rnengatakan bahwa setidaknya terdapst tiga gen dominan
dan
gen bebas yang mengontrol sifat ketahanan kentang terhadap penyakit l a p bakteri. Pada tanaman kacang tanah ketahanan terhadap penyakit layu bakteri bersifat dominan dan dikendalikan oleh tiga pasang gen mayor dan tingkat ketahanan populasi hibridnya lebih besar jikadi bandingkan dengan rata-rata tetuaaya.
Rowe ( 1 970) mengemukakan bahwa sumber Iretahanan terhadap penyaki t Iayu bsskteri terdapat pada s p i e s kentang liar seperh S. phzaqa,
dan
berkesirnpuianbahwa sifat ketahmannya dikontrol oleh
beberapw
gen y ang bersifat oligogenikdominan, S. phure~a telah digunakan ddam program pemuliaan kentang semi
sumber utama gen ketahanan terhadap R. solanaceunmr (Elphinstone, 1994). Reaksi k e t a h m klon-klon hasil silangan S phweja bervariasi terhadap strain-strain R solanacearum. Hal ini menunj ukkan bahwa si fat ketahanan terhadap strain tertentu & p e n m i oleh banyak gen. Selain dari S. phureja, Schimiediche (1986) mengatakan Mwa sumber ketahanan terdapat pula pada species S. spustprlum, S.
chucoense dan S. microdontm dan sifat ketahmnya tersebut kemungkinan dlwariskan secara poligenik oleh gen mayor. Sedangkan Iwanaga (1980) menyebutkan bahwa species liar seperti S chucoeme, S. sparspilum dm S. stenoronurn juga merupkan sumbw ketahanan terhadap penyakit layu bakteri.
Namun demikian gen yang terlibat Uarn ekspresi ketahanan tersebut s a m p saat ini belurn di ketahui
.
Tung et al., (1 992) menyatakan bahwa kestabilan ekspresi k e t a h m pada
kondi si daerah tropis meningkat apabila gen tahatl bkombinasi dengan gen adaptasi
Tingkat ketahanan yang dapat diterirna tergantung pada kepentingan produksi kentang yang dihasilkan (French, 1996). Apabila dig& untuk konsumsi segar maka persentase infeksi masih dapat ditoleransi, akan tetapi jika digunakan untuk produksi benih, maka persentase layu dalam jumlah kecl sekalipun tidak bisa di tolerir (Hakim, 1999). Hal ini karena dengan beberapa bibit saja terinfeksi, maka sudah dapat I m p a n untuk menye- penyakit dalam areal yang lebih luas.
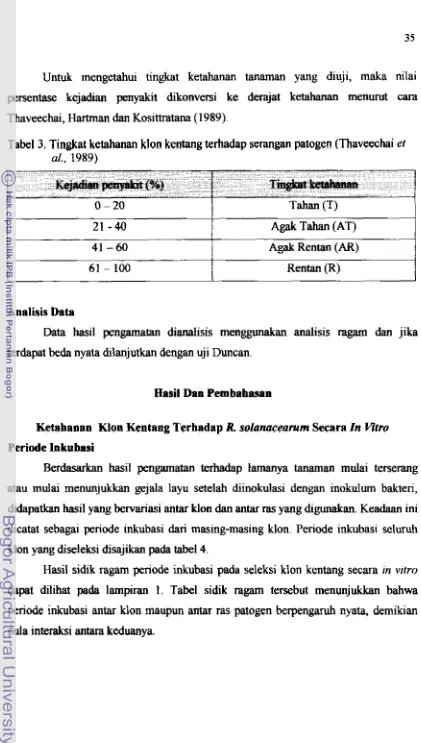
Seleksi ketahanan trtnaman kentang terhadap patogen secara ~n vitro rnerupakan salah satu metode yang memberikan harapan, karena mempunyai beberap keuntungan antara hn dapat mengwangi kemuagluaan terjadinya escape yang biasa teqadi melalui inokulasi alami dilapang, hasil seleksi &pat diulang di rumah kaca atau di lapang, dan patogen yang digunakan tetap &tas di
laboratoriurn. Metade seleksi in vrtro dapat menghemat biaya dan waktu pengujian dengan hasil yang relatif
m a
dmgm pmmjian di lapwng karena hmya klon-lrlorryang
tahan
dalam p g u j i a n in vltro saja yang dilanjutkan pengujiannya di lapang. Metode ini mudah dikerjakan dan telah dipelajari pada beberap tanman dalamprogram pemuliaan untuk mendapatkan sifat ketahanm terhadap pen yakit Samanhudi (200 1 ).
Regeaerasi pada Tansmaa Kentang
Regenemi tanaman mmpakan salah satu tahapan penting dalam pengembangan tehnik pemuliaan tanaman melalw kultur j aringan, seperb tmsformasi, kultur dan fusi protoplas atau induksi variasi somaklonal untuk mendapatkan tanaman baru dengan sifat-si fat tertentu. Keberhasilan regenerasi tanaman tidak hanya dipen- oleh faktor genetik tetapi juga faktor-faktor kimiawi se- media tumbuh dan faktor fisiolog seperh pH, temperatur m a n , cahaya dm lain-lain.
Menurut
George dan
Sherrington (1984), Pierik (1987) dm Phillips & Hubstenberg (19951, regenerasi &pat dilakukan melalui proses organogenesis atau embriogenesis. Cara pertama rtkan diperoleh tunas atau akar sedangkm cam kedua akan dihasilkan suatu bentuk bipolar dimana tunas dan akar dalam suatu kesatuan yang utuh. Pada umumnya penel i tian regenerasi yang berhasil pada tanman kentangadalah dengan menggunakan dua tahap media. Tahap pertama adalah induksi kalus
dengan penmbahsrr! auksir!
dm
z m i n atau zeatin ribasida serta media tahapkadua
untuk regenmi tunas dengan menggunakm sitokinin
selain
zeatin(De
Block, 1988; Yadaf clan Sticklen, 1995).Peranan media dan zat pengatclr twnbuh penting dalarn mengatur arah pertumbuhan dan perkembangan eksplan (George d m sherrington, 1 984; Pierik, 1987). Penggunaan sitokinin selain zeatin clan pengmngan tahap media regenerasi akan menguntungkan, karena mengurangi biaya dan lamanya kultur beregenerasi .
Sitokinin 2 ip merupakm salah satu altematif yang sering diwbakan sebagai pengganti zeatin dalam proses regenerasi pada tanaman kentang. 2 ip mempunyai struktur molekd yang lebih mendekati zeatin daripada sitokinin lainnya, sehingga kemungkinan mempunyai aktivitas yang mendekati zeatin (Weaver, 1972).
Di ddam perbanyakan zn vim, peranan auksin adalah merangsang pembentukm kalus, pernanjangan sel, p k s a r a n jaringan dm pembentukm aka. Beberapa eksplan secara alamiah rnemproduksi cukup auksin. Jeais auksin indogen
Pierik ( 1 9871, N A A sebagai auksin sintetik dipergunakan pada selang 0.00 1 mgll sampai 10 mglI. Pengaruh sitokinin &lam perbanyakan in vitro adalah merangsang pemklahan sel dm rnultifikasi tunas (George dan Sherrington, 1984). Sitokinin yang biasa digunakan dab BAP, kinetin, 2 ip dan zeatm. Keseimbangan ~11t.a.m auksin
dan sitokinin yang yang tambahkan pada media tumbuh akan menentukan arah perkembangan e k s p h ( Wattirnena, 1992). Tunas akan terkntuk apabila perbandingan konsentrasi sitokinin lebih tinm dan pada auksin, sedangankan akar
akan terbentuk apabila perbandingan auksin lebih t i n a dari sitokinin. bolasi dan Kultur Protoplas
Media Tumbuh Tamman In
Vr~ro
Media tumbuh bag^ tanaman in vitru sangat memegang peranan penting terhsdap arah perturnbuhan
dari
eksplan. Media tumbuh yang sesuai akan rnenghasilkan tanaman in vitro sesuai dengan harapan. Mesofil daundari
tanaman invitro paling banyak digunakan sebagai sumber protoplas pada Solanuceae (Nyman
dan
Waara, 1997; Jar1 et ul., 1999). Hal ini karena tingkat keseragaman tanamanm
vitro lebih tinggi, dapat tersedia s&ap saat dan ti& perlu melakukan sterilisasi.Pada tanaman kentang in vitro, pengaturan cam clan intensitas penyinaran, peningkatan konsentmi media dasar dan sukrosa, serts pemberian aerasi pada kultur dapat rnemperbailu ukuran dam dan meningkatkan produksi protoplas yang dihasilkan (Purwito, 1999). Pertumbuhan tanaman in vitro yang kurus, banyak percabangan dengan daun yang kecil biasan ya hsebabkan kurangnya sirkulasi udara sehingga te jadi akumulasi gas etilen di dalam tabung kultur (Cassells et al., 1980; Mollers er nl., 1992). Untuk mengatasi
hd
tersebut &pat dilakukan dengan cara memperbesar ukuran tabung kultur, memberikan aerasi atau dengan memaaipulasi media hunbuh,b o k i ProtopIas
(Hall dan Cocking, 1974), jaringan buah (Cocking, 1970), tajuk bunga (Potrykus, 19731, serbuk sari (Bajaj, 19771, kultur Wus (Schenk dm Hildebrandt, 1969; Gosch e6 ul., 1975), daun in vitro (Binding el aL , 1 982, Serraf er a[., 1 99 1 ) .
lsolasi protoplas umumny a dilakukan secara enzimatik. Jenis dan konsentrasi enzim yang Q gmakan sangat menentukan keberhasilan dari isolasi protoplas. Menurut Punvito (1999), sedikitnya a& 15 en* yang dapat digunakan untuk mengsolasi protoplas tanaman, yaitu pektin glikosidase, pektinase, selulase R 1 0, silanase, maseroenzim, meiselase, rohamen P, selulase Onozuka RS, driselase, pektoliase Y-23, hemisellulase, selulisin, maserase dan rozim.
1sol;tsi protoplas s e w enzimatik dapt dilakukan dengan dua cara, yaitu (1 ) metode langsung dan (2) metode tidak langsung. Metode langsung dilahkan dengan cara memasukkan cacahan dam dalam petri yang berisi campuran enzim steril(0.5 % maseroenzim + 2 % selulase onozuka R-1 0 dalam 13 % sorbitol atau manitol pada pH
5.4) kemuctian diinkubasi semalam (15-18 jam) pda suhu 25 "C (Power et al., 1970). Setelah diinkubasi, potongan dam dig0 y ang agar protoplasn y a terlepas kedalam larutan, kemudian disaring dm supernatan disentifuse I00 g selarna 1 menit. Protoplas akan mernbentuk pelet sedangkan debris pada supernatan &bung dengan hati-hati. Proses ini diulang tiga kali,
dan
terakhir protoplas dicuci dengan 13 % sorbitol. Pada akhir pencucian sorbitol & g a d dengan 20 % sukrosa kemudian disentrifbse 200 g selama 1 menit. P r o s e h ini menghasilkan protoplas yang tercuci melayang diatas lamtan. Protoplas yang berada diatas tersebut kemudian dipipet secara hati-hati dengan pipet steril (Power et uL., 1 970).Metode dua tahap adalah modifikasi dari metode Otsuh dm Takak el ai
(1996).
Pada
tahap prtama cacahan dam dimasukkan dalam campuran enzim A (maseroenzim 0.5 %, kalium dextran sulphate 0.3 % dalam 13 % manitol, pH 5.8) selama 5 menit dalam desikator, kemudian ditransfer &lam waterbath pada suhu 25O C dengan penggoyangan lam hat. Setel ah 1 5 menit campuran enzi m kemudi an
dibuang perlahan dan digantikan dengan enzirn baru dengan komposisi yang sarna
disentifuse 100 g selama 1 menit dm dicuci 3 kali dengan 13 % manitol untuk mendapatkan sel yang terisolasi. Tahap kedua adalah menginkubasi has11 dari tahap 1 dengan campuran enzim B (2 % selulase, 13 % larutan manitol, pH 5.4) selama 90 menit pada suhu 30 "C. Setelah itu disentifuse lagi pada 100 g selama 1 menit, sehingga protoplas mengendap sebagai pelet. Supematan dibuang dm protoplas dicuci 3 kali dengan manitol dan selanjutnya diisolasi dengan cara melayangkan protoplas tersebut pada 20 - 30 % lamtan sukrosa (Power ei u., 1970).
Umumnya protoplas yang didapat dari metode langsung leblh banyak dari pada metode 2 tahap, namun berisi campuran protoplas dari mesofil spongi dan mesofil palisade, Sedangkan penggrrnaan metode dua tahap hanya diisolasi protoplas dari mesofil palisade (Bajaj, 1 977).
Kultur dan Regenerasi ProtopIas
Beberapa publikasi menunjukkan bahwa keberhasilan kultur protoplas dm regenerasinya menjadi tanaman ditenmkan oleh banyak faktor seperti genotipe, jaringan yang dipergumkm, kondisi fisiologis dari jaringan, kemurnian enzim, periode clan konhsi inkubasi, media kultur serta zat pengatur tumbuh (Serraf el a/.,
1991 ; Bradsaw
dan
Mackay, 1994).Protoplas yang ditanam dalam media kultur dapat meregenerasikan dinding sel disekelilingnya untuk mernbentuk sel sempurna yang &pat rnembelah diri mernbentuk
rnikro
kalus. Dengan rnemanipulasi nutnsi dan kondisi fisiologis, kultur kalus tersebut dapat terinduksi menjadi anaman (Vasil dan Vasi I, 1 973). Umumnya untuk menginduksi pembelahan, protoplas h a m ditanam dalam kernpatan tidak lebih dari 1o4
protopladm1 (Abersheim, 1974).Menurut Evan dm Bravo (1 983) paling tidak 28 species protoplas telah dapat diregenemilcan menjad tanaman. Walaupun demikim regenerasi masih merupakm masalah p d a beberapa tanaman.
Media Kultur Protoplair
Media kultur protoplas merupakan faktor sentral yang ban yak diteliti, baik y ang berkenaan dengan isolasi, pembentukan mikrokali
dan
regenerasi menjaditanaman (Nagata
dan
Takebe, 1971; Hakrlach et aL, 1985; Sihachakr et al., 1989). Meda KM8p (Kao clan Michaluk, 1975) dm media V-KM yang merupakan kombinasi media V-47 (Binding, 1974) dan KM8p banyak digunakan sebagai media dalam percobam-percobaan kultur protoplas untuk Solanaceae (Binding dan Nehls, 1977; Kowalczyk et al., 1983; Serraf et al., 1991; Mollers et d., 1992; Thach el aJ., 1993). Thach er a1 (1993) menggunakan media VKM, SKM clan SKMmod dengan menambahkan 0.1 M manit01 atau 0.2 mg.1 zeatin dalarn kdtur somatik hibrid untuk menghasilkan kentang tahan virus.Shepard
dan
Totten (1 977) j u g telah mmgembangkan media y ang terdiri dar~ media A (pernumian protoplas), media B (induksi kalus), media C dan media I3 (regenerasi tunas) serta media E (perkembangan !mas serta inisiasi a h ) . M d a ini berhasil meregenerasi kan protoplas dari mesofil daun kentang kultivar Russet Burbank. Media yang banyak dipaJrai untuk kultur protopias Solanuceae adalah KM8p (Kao dan Michaluk, 19751, VKM (Binding dan Nehls, 1977), SKM (Huntdan
Hegelson, 1 989) dan ST (Shepard dan Totten, 1 977). Beberap media lain yang clapat dipakai wltuk kultur protoplas yaitu media Thomas (1981), DPD (Durand er al.,
1 973)
dan
VKCLG (Foulger ddn Jones, 1986).Meskipun beberapa kdtivar
dan
ge fibs Solarium telah dapat diregenerasi kandari
protoplas, prosedur kultur dan regenetasi pa& banyak kasus masih hams diperbaiki (Purwito, 1 999). Proses pra isolasi , sumber protoplas, genotipe tanamanSELEKSI KETAHANAN TANAMAN KENTANG TElUiADAP PEWYAKIT LAYU BAKTERI DAN
BUSUK LUNAK SECARA IN WTRO
Penyakit yang sarnpai saat ini masih mengancam produksi kentang dan sangat ditakuti oleh para petani adalah penyakit layu bakteri, kalau penyakit ini menyerang tanaman maka pupustah harapan petani untuk mendapatkan hasil panen y ang bai k.
Pen yakit dapat te jadi akibat interaksi antara patogen yang vimien, inang yang rentan dan lingkungan yan g rnendukung. Pen yakit 1 ayu bakteri ( R solanucearum) terdapat di semua daerah penanaman kentang hampir di seluruh dunia termasuk di Indonesia. R. soianacearurn adalah bakteri yang hidup di dalam tanah krsama dengan mikroorganisme lainnya. Penyakit ini &pat terjadi pada kisaran i m g yang sangat Iuas mulai daerah tropis sampai daerah subtropis dan rnerupakan penyakit yang paling serius di Asia (Perdey ei ul., 1986).
Bakteri R solanaceurum memiliki kista dan bisa hidup pada kurang lebih 200 species tanaman, 33 famili diaritaranya rnenjadi inang. Sebagian besar species adalah dicotyledone dengan fami11 Solanuceae, termasuk terong, tomat, kentang, cabe clan lain-lain. Gejala penyakit layu mirip sekali dengan tanaman yang kekurangan air. Penyakit layu umumnnya tidak langsung melayukan seluruh tanaman, tapi pa& s e w a n cabang dahdu b m kemudian jika penyakit berkembang s e l d bagian tanaman akan menjadi layu (Semangun, 1989). Layu yang disebabkan bakteri ini
sangat tergantung oleh temperatur dan kelembaban, kepadatan inokulum
dsn
tingkat resistensi inang. Rulstonra akan menyerang inang melalui I d a . Untuk melihat gejala yang di t i m b u l b tergmtung pa& kondisi lingkungan, resistensi inang dan umur tanaman (Klement et al., 1990).dapat hdup & dalarn tanah (khususnya rizosfer), sisa-sisa tanaman, bij i , serangga dan
jaringan tanaman ymg terinfeksi. Bakteri masuk kedalam tanaman melalui luka atau
lubang alami kemudian tumbuh secara inter seluler dan intra seluler. Bakteri E. carotovora umumnya menyerang tanaman yang sukulen atau tanaman yang j aringannya lunak atau berdagtng .
Patogen busuk lunak dapat b e d m hidup pada bagian yang busuk dari tanaman. Bakteri yang masuk melalui luka akan t w u s krkembang dalam ruang antar
sel, serta menghasilkan enzim pektalitik yang dapat mencerna jaringan tanaman inangnya sehngga mengalami degradasi dm pembusukan.
Gejala penyaki t dapat meny mang b e h p a
jeni
stamman
inang yang berbeda, sebaliknya beberapa jenis bakteri dapat menyerang suatu tanaman secara krsama.Dernihan pula dengan gejala yang ditimbulkannya, satu bakteri &pat rnenimbdkan
lebih
dari
satu gejala padti suatu jenis tanaman. Bakteri menghasilkan enzim extra seluler yang &pat memecah senyawa pektin diantara dinding sel yang menyebabkan melunaknya jaringan dan ~ m y a berubah menjadi pasta. Sel-sel mengalami plasmolisis clan akhirnya mati (Prombelo~1979).E. curotovoru dapat berhhan hdup didalam tanah selama bertahun-tahun dan berkemhg cepat pa& cuaca berawan dm W. Penyebaran penyakit ini diduga juga disebabkan oleh serangga sayur-sayuran, b u a h - b d m dan bmga-bungaan,
sehingga bakteri selalu terdapat dan musim ke musim.
Beberapa sistem pengendalian penyakit oleh bakteri yang telah ditempuh petani adalah dengan membersibkan lahan tanam dari sumber kontaminan, konsewasi dan pergi f iran tanaman, pengolahan tanah, pengendalian secara kimia dan biolog s sampai dmgan penggunaan bibit
dm
varietastahan.
Penggunaan varietas tahanmerupakan faktor yang sangat potensial untuk mengendali
kan
penyakit tanaman(Schmiediche, 1986; French, 1994;
Martin
& French 1996; Amos, 1997). Apabila kultivar yang benar-benar tahan telah diperaleh, penggunaanmnya merupakan upaya yang paling mwah,mudah,
amandan
efektif sejauh varieta tersebut tersedia. Olehterm diupayakan. Namun demikian, pada kenyataannya penggunaan varietas tahan saja secara tun@ untuk mengendalikan penyakit layu bakteri tidak disarankan, karena berpotensi mtuk te jadinya perubahan strain patogen menjadi lebih virulen (Akiew dan Ttevorrow, 2 994).
Percobaan ini bertujuan mencari klon kentang y m g tahan atau agak tab terhadap penyakit layu bakteri (R solanacearum) dm busuk lunak (E.c. pv carotovora) meMui seleksi in vitro.
Seleksi Ketabanan Penyakit Layu Bakteri Rancangan Percobaan
Perwbaan disusun dalam Rancangm Acak LRngkap (RAL) Faktorial yang terdiri dar~ dua faktor, yaitu faktor Wan kentang yang terdiri dari 19 Wan (Atlantic,
BF 15, Nicola,
M n c a ,
Cardinal, S.