NONI MARDIAN TRIZANA
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
Dengan ini saya menyatakan bahwa tesis yang berjudul Uji kinerja
promoter gen LEAFY dan AGAMOUS tanaman kakao (Theobroma cacao L.) pada
tanaman tembakau (Nicotiana tabacum L.) adalah benar hasil karya saya dengan
arahan dari komisi pembimbing dan belum diajukan dalam bentuk apapun kepada
perguruan tinggi manapun. Sumber informasi yang berasal atau dikutip dari karya
yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam
teks dan dicantumkan dalam Daftar Pustaka tesis ini.
Bogor, Maret 2012
Noni Mardian Trizana
L.) LEAFY and AGAMOUS promoters in tobacco plant (Nicotiana tabacum L.)1) Supervised by I MADE ARTIKA and TETTY CHAIDAMSARI
Performance of cocoa’s (Theobroma cacao L.) gene promoters, TcLFY and TcAG, in a tobacco plant (Nicotiana tabacum L.) used as a plant model has been tested. The two promoters were introduced into the tobacco plant cells using a modified leaf discs method employing Agrobacterium tumifaciens AGL0. The transformed tobacco plant cells were then regenerated and their morphology were observed periodically. The tobacco plants harbouring the gene promoter TcLFY, during regeneration, showed a leaf morphology similar to that of the positive control. However, the growth rate of tobacco plants inserted with promoter TcLFY was faster compared to that of the positive control. Tobacco plants harbouring gene promoter TcAG, during regeneration, showed imperfect leaf morphology. The growth rate of these tobacco plants was slower than that of the positive control and of the tobacco plants inserted harbouring gene promoter TcLFY. These results indicated that the introduced promoters affect the morphology of the tobacco plants. In order to further confirm the presence of the GFP gene and activation of TcLFY: GFP and TcAG: GFP, a molecular verification test was carried out. Variation of sucrose concentration in the media was made to examine the effect of sucrose on the activity promoters TcAG and TcLFY in tobacco plants. The sucrose concentration tested were 0%, 0,5% and 4% followed by observation on the 3rd and 7th day of cultivation. At 0% sucrose concentration the tobacco plants harbouring promoter TcLFY showed yellowish leaf, while those cultivated in the media with sucrose concentration of 0.5% and 4% grew well and normal. This indicated that sucrose affects the activity of the promoter TcLFY in tobacco plants. Tobacco plants inserted with promoter TcAG did not show significant morphological changes when grown in a medium of 0%, 0,5% or 4% sucrose concentration. This indicated that addition of sucrose does not significantly affect the induction of expression of the AG gene and the activation of the promoter TcAG.
AGAMOUS Tanaman Kakao (Theobroma cacao L.) pada Tanaman Tembakau (Nicotiana tabacum L.). Dibimbing oleh I MADE ARTIKA dan TETTY CHAIDAMSARI
Kakao merupakan tanaman perkebunan yang memiliki potensi dalam
pertumbuhan perekonomian Indonesia. Perkebunan kakao di balik potensinya
yang besar masih memiliki kendala yaitu hama tanaman, kualitas rendah,
pembungaan dan layu pentil. Pendekatan secara biologi molekuler dilakukan
untuk uji lanjut terhadap promoter gen pembungaan yaitu promoter gen TcLFY
yang berperan sebagai gen pusat pembungaan dan promoter gen TcAG yang
berperan pada proses pembungaan dan pembuahan. Uji kinerja dari promoter ini
dilakukan dengan transformasi ke tanaman model tembakau.
Penyisipan promoter TcLFY dengan ukuran 1650 bp dan promoter TcAG
dengan ukuran 1200 bp dari tanaman kakao (Theobroma cacao L.) telah
dilakukan pada tanaman tembakau (Nicotiana tabacum L.) yang berfungsi sebagai
tanaman model. Transformasi genetik promoter gen TcLFY dan promoter gen
TcAG ke dalam sel tanaman tembakau dilakukan dengan teknik cakram daun (leaf
disk) yang dimodifikasi melalui Agrobacterium tumifaciens AGL0. Morfologi
tanaman diamati secara berkala. Tanaman tembakau yang disisipi promoter
TcLFY selama regenerasinya menunjukkan morfologi atau bentuk daun yang
mirip dengan daun tembakau kontrol positif. Namun pertumbuhan tanaman
tembakau yang disisipi promoter TcLFY, pertumbuhannya lebih cepat jika
dibandingkan kontrol positif. Tanaman tembakau yang disisipi promoter TcAG
selama regenerasinya menunjukkan morfologi daun atau bentuk daun yang tidak
sempurna. Namun pertumbuhan tanaman tembakau yang disisipi promoter TcAG
lebih lambat jika dibandingkan kontrol positif dan tanaman tembakau yang
disisipi promoter TcLFY. Hasil dari pengamatan bentuk daun pada tanaman
tembakau tersebut menunjukkan bahwa promoter mempengaruhi morfologi pada
tanaman. Verifikasi secara biologi molekuler dilakukan untuk konfirmasi lebih
lanjut keberadaan gen GFP dan aktivasi dari TcLFY:GFP dan TcAG:GFP.
Sukrosa diketahui mengaktifkan promoter LEAFY pada Arabidopsis.
Variasi media sukrosa dilakukan untuk menguji pengaruh sukrosa terhadap kerja
promoter TcLFY dan TcAG pada tanaman tembakau.Variasi sukrosa dilakukan
pada 3 konsentrasi sukrosa yaitu 0%, 0,5% dan 4% dengan jangka waktu 3 hari
pengamatan dan 7 hari pengamatan. Pada konsentrasi sukrosa 0% tanaman
tembakau yang disisipi promoter TcLFY memperlihatkan daun yang menguning,
berbeda halnya dengan media sukrosa 0,5% dan 4% yang tumbuh dengan baik.
Hal ini mengidentifikasikan bahwa sukrosa mampu mempengaruhi aktivitas dari
promoter TcLFY pada tanaman tembakau. Tanaman tembakau yang disisipi
promoter TcAG tidak memperlihatkan perubahan morfologi yang signifikan
seperti promoter TcLFY pada variasi sukrosa 0%, 0,5% dan 4%. Penambahan
induksi sukrosa tidak terlalu berpengaruh terhadap ekspresi dari gen AG. Hal ini
juga terjadi pada aktivitas promoter TcAG yang tidak berpengaruh aktivitasnya
© Hak Cipta Milik IPB, tahun 2012 Hak Cipta dilindungi Undang-Undang
1. Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumber
a. Pengutipan untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik atau tinjauan suatu masalah.
b. Pengutipan tidak merugikan kepentingan yang wajar IPB.
NONI MARDIAN TRIZANA
Tesis
Sebagai salah satu syarat untuk memperoleh gelar Magister Sains pada
Mayor Biokimia
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
Nama : Noni Mardian Trizana NIM : G851100071
Disetujui
Komisi Pembimbing
Dr. Ir I Made Artika, M.App.Sc Dr. Tetty Chaidamsari, M Si
Ketua Anggota
Diketahui :
Ketua Program Studi Biokimia Dekan Sekolah Pascasarjana
Prof. Dr. drh. Maria Bintang, MS Dr. Ir. Dahrul Syah, M.Sc, Agr
Alhamdulillah segenap rasa syukur penulis ucapkan ke hadirat Allah SWT
yang telah melimpahkan rahmat dan karunia-Nya, sehingga penelitian yang
berjudul Uji Kinerja Promoter Gen LEAFY dan AGAMOUS Tanaman Kakao
(Theobroma cacao L.) pada Tanaman Tembakau (Nicotiana tabacum L.)
dapat diselesaikan. Sholawat beriring salam terus tercurahkan kepada suri
tauladan kita yang mulia Rasulullah Muhammad SAW.
Penulis menyampaikan ucapan terima kasih kepada pihak-pihak yang telah
membantu dan mendukung penelitian ini yaitu:
1. Bapak Dr.Ir I Made Artika, M.App.Sc dan Ibu Dr. Tetty Chaidamsari, MSi
sebagai dosen pembimbing yang memberikan arahan dan motivasi beliau
sehingga tulisan ini dapat diselesaikan.
2. Ibu Prof. Dr. drh. Maria Bintang MS yang telah memberikan motivasi dan
arahan sehingga sehingga tulisan ini dapat diselesaikan.
3. Bapak Dr. Djoko Santoso sebagai pembimbing pada proses Isolasi
Promoter TcAG tanaman kakao
4. Ucapan terima kasih juga Penulis sampaikan kepada keluarga, Ayah dan
Ibu tercinta, yang telah memberi dukungan berupa do’a dan materil
5. Teknisi di Balai Penelitian Bioteknologi Perkebunan Indonesia yang
mendukung dalam penelitian yang telah dilakukan. Teknisi yang ikut
mendukung yaitu teh Herti, teh Nia, teh Aan, teh Nina, teh Rini, teh Riana,
mas Heri, dan mas Topan.
6. Teman-teman Biokimia 2010 yaitu Mbak Martha, Mbak Sri, Mbak Eliz,
Mbak Lia, Mbak Nunu, Kak Bobi, yang telah memberikan motivasi dan
do’anya.
7. Kepada teman-teman seperjuangan yaitu Uni Zikra, Upik, Isni, Cicin,
Mbak Maria, Eka, Teh Kanti yang selalu memberi motivasi dan do’anya.
Penulis juga menyadari keterbatasan pengetahuan dan pengalaman dalam
penulisan usulan penelitian ini, untuk itu Penulis sangat terbuka terhadap kritik
Bogor, Maret 2012
Noni Mardian Trizana
dari pasangan Slamet Sutrisno dan Supriyanti. Penulis memulai pendidikannya
pada tahun 1993 di SDN 11 Kampung Surian, Kecamatan Barangin, Sawahlunto
dan lulus pada tahun 1999. Tahun 2002 penulis lulus dari SLTPN 02 Sawahlunto,
yang kemudian melanjutkan ke SMU 01 Sawahlunto dan menyelesaikannya
hingga tahun 2005. Tahun yang sama penulis diterima sebagai mahasiswa
Program Biokimia, Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut
Pertanian Bogor melalui jalur SPMB. Penulis menyelesaikan program studi
Halaman
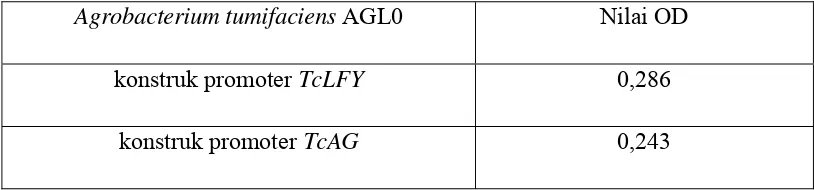
1 Nilai OD Agrobacterium tumifaciens AGL0 dari kedua konstruk yang diukur pada panjang gelombang 600 nm………...
2 Perbedaan jumlah inisiasi pada tanaman tembakau………...
3 Variasi media dengan sukrosa pada inkubasi 3 hari……….….………
4 Variasi media dengan sukrosa pada inkubasi 7 hari……….. 25
29
41
1 Bagian bunga kakao, stamen (Sta), sepal (Se), petal (Pe), pistil (Pi) dan
staminod (Std)……….. 7
2 Aktivasi gen kelas A,B dan C oleh gen LFY………...
3 Model ABC dari perkembangan pembungaan Arabidopsis, fungsi gen kelas A, B dan C yang mempengaruhi bentuk dari meristem bunga (Se: sepal, Pe: petal, St: stamen, Ca: karpel)………...
4 Posisi promoter dalam suatu gen…...………..
5 Struktur kanamisin………..
6 Posisi promoter dan gen reporter GFP pada vektor pGWB serta gen seleksi kanamisin nptII………...………..
7 Kondisi kultur bakteri Agrobacterium tumifaciens AGL0 yang membawa konstruk promoter TcLFY dan promoter TcAG (a) hari ke 0 (b) setelah 2 hari inkubasi……….
8 Mekanisme transformasi promoter TcLFY dan TcAG dari Agrobacterium tumifaciens AGL0 ke tanaman tembakau……….…………...
9 Proses inisiasi eksplan pada tanaman tembakau yang berumur 18 hari (a) tanaman kontrol negatif, (b) tanaman kontrol positif, (c) tanaman tembakau yang disisipi promoter gen TcAG, (c) tanaman tembakau yang disisipi promoter gen TcLFY………...
10 Perbedaan morfologi tanaman tembakau yang berumur 40 hari, (a) tanaman kontrol negatif, (b) tanaman kontrol positif, (c) tanaman tembakau yang disisipi promoter gen TcAG, (d) tanaman tembakau yang disisipi promoter gen TcLFY………
11 Perbedaan morfologi tanaman tembakau yang berumur 2 bulan, (a) tanaman kontrol negatif, (b) tanaman kontrol positif, (c) tanaman tembakau yang disisipi promoter gen TcAG, (d) tanaman tembakau yang disisipi promoter gen TcLFY………..………..
12 Perbedaan morfologi tanaman tembakau yang berumur 4 bulan, (a) tanaman kontrol, (b) tanaman tembakau yang disisipi promoter gen TcAG, (c) tanaman tembakau yang disisipi promoter gen TcLFY………...
13 Proses aktivasi dan inaktivasi gen MAD-Box pembungaan pada tanaman. Agamous (AG) menghambat ekspresi dari Apetala (AP), leafy (LFY) dan (WUS), LFY mengaktifkan ekspresi AG, AP dan
AP3………...
14 Mekanisme pengaktifan promoter AG oleh protein LFY……….
Halaman
1 Diagram alir penelitian………...… 52
2 Komposisi media………
3 Gen-gen yang terlibat dalam organogenesis tanaman………
4 Gen yang berperan pada proses pembungaan (promoter) dan penghambat proses pembungaan (repressor)……….
5 Ekpresi gen ABC pada pembungaan……….
6 Proses pembuatan coklat………
7 Perubahan berat yang terjadi pada tanaman tembakau………... 53
54
55
56
57
58
PENDAHULUAN
Latar BelakangKakao merupakan salah satu komoditas perkebunan yang penting bagi
perekonomian nasional yaitu sebagai penyedia lapangan kerja, sumber pendapatan
dan devisa negara. Kakao juga berperan dalam mendorong pengembangan
wilayah. Perkebunan kakao telah menyediakan lapangan kerja dan sumber
pendapatan bagi sekitar 900 ribu kepala keluarga petani yang sebagian besar
berada di Kawasan Timur Indonesia (KTI) pada tahun 2002, serta memberikan
sumbangan devisa terbesar ke tiga sub sektor perkebunan setelah karet dan kelapa
sawit dengan nilai sebesar US$ 701 juta (Lingga 2007). Namun pada tahun 2008
sumbangan devisa ini meningkat menjadi US$ 1150 juta (BBP2TP 2010).
Saat ini Indonesia menduduki urutan ke tiga di dunia sebagai penghasil
kakao setelah Pantai Gading (38,3%) dan Ghana (20,2%). Angka produksi kakao
Indonesia sebesar 13,6% (BBP2TP 2010). Permintaan dunia terhadap komoditas
kakao semakin meningkat dari tahun ke tahun. Organisasi ICCO (International
Cocoa Organization) memperkirakan produksi kakao dunia akan mencapai 4,05
juta ton, sementara konsumsi akan mencapai 4,1 juta ton, sehingga akan terjadi
defisit sekitar 50 ribu ton per tahun. Produksi kakao Indonesia pada tahun 2005
yaitu 435 ribu ton/tahun. Hal ini tidak sebanding mengingat Indonesia masih
mempunyai banyak lahan kosong yang sebenarnya bisa digunakan untuk produksi
kakao. Kendala lain yang dialami Indonesia dalam produksi kakao yaitu serangan
hama, kualitas dari buah kakao yang masih rendah dan benih yang dipakai oleh
petani kakao bukan merupakan benih unggul. Potensi kerugian biji kakao
Indonesia ke Amerika Serikat akibat mutu rendah sebesar US$ 301,5/ton, dan
produk kakao Indonesia di pasar internasional dikenai diskon US$ 200/ton atau
10-15% dari harga pasar. Harga kakao dunia saat ini bisa mencapai US$ 3300 per
ton (BBP2TP 2010).
Permasalahan lain pada produksi kakao yaitu pada permasalahan
pembungaan dan layu pentil. Layu pentil merupakan penyakit fisiologis pada
tanaman kakao. Persentase layu pentil bisa mencapai 60-90% dan berlangsung
secara pembungaan dilakukan secara biologi molekuler. Salah satu usahanya yaitu
penemuan gen-gen yang berperan penting pada proses pembungaan dan proses
pembungaan menuju buah. Gen-gen yang berperan tersebut antara lain LEAFY
(LFY), APETALA1 (AP1), CAULIFLOWER (CAL), FRUITFULL (FUL), dan
AGAMOUS (AG) (Dean & Simpson 2002). Promoter gen pembungaan dari buah
kakao yang akan dilakukan uji lanjut diantaranya yaitu Theobroma cacao L.
AGAMOUS (TcAG) dan Theobroma cacao L. LEAFY (TcLFY).
Proses pembungaan bisa diinduksi oleh senyawa tambahan yang diberikan
secara eksogen untuk mempengaruhi ekspresi dari gen pembungaan. Induksi
dengan senyawa chlormequat chloride (CCC) diketahui telah berhasil
mempercepat proses pembungaan dengan mengaktifkan senyawa sukrosa endogen
tanaman (Samanhudi 2006). Selain dengan induksi CCC, induksi dengan giberelin
juga telah terbukti mempengaruhi aktivitas pembungaan. Blazquez et al., (1998)
melaporkan bahwa pemberian giberelin dan sukrosa secara eksogen mampu
mempengaruhi proses pembungaan dengan mengaktifkan kerja dari promoter LFY
pada Arabidopsis.
Tingginya kebutuhan kakao dunia membuat Indonesia semakin giat untuk
meningkatkan produksi dan kualitas kakao. Buah kakao Indonesia mengalami
peningkatan sedikit dari segi kuantitas tetapi dari segi kualitas, kakao Indonesia
masih tergolong rendah. Peningkatan kualitas diupayakan Indonesia dimulai
dengan usaha penyediaan bibit unggul, pemupukan, peningkatan kualitas tanah,
dan pengendalian genetik kakao untuk peningkatan kualitas bunga dan buah.
Pengendalian genetik dengan induksi pembungaan dilakukan untuk mempercepat
proses pembungaan. Pengendalian genetik dengan induksi ini bisa dilakukan
dengan bagian gen berupa promoter. Penelitian ini bertujuan mempelajari fungsi
promoter gen TcLFY dan TcAG tanaman kakao (Theobroma cacao L.) dengan
Tujuan Penelitian
Penelitian ini bertujuan mempelajari fungsi promoter gen TcLFY dan
TcAG tanaman kakao (Theobroma cacao L.) dengan transformasi tanaman model
tembakau (Nicotiana tabacum L.).
Hipotesis Penelitian
Promoter yang digunakan untuk mengontrol ekspresi gen TcLFY dan
TcAG pada tanaman tembakau dapat dipelajari sifat dan pengaruhnya.
Manfaat Penelitian
a. Bagi perguruan tinggi
Hasil dari penelitian ini diharapkan dapat mendorong insitusi untuk
mengembangkan teknik dan mencari ide-ide baru dalam pengembangan tanaman
perkebunan, salah satunya tanaman kakao sehingga dapat dihasilkan kualitas dan
kuantitas dari tanaman kakao yang lebih tinggi.
b. Bagi mahasiswa
Penelitian ini diharapkan mampu memacu mahasiswa untuk berfikir
kreatif, inovatif, dan dinamis. Khususnya dalam hal membantu petani dalam
menyelesaikan permasalahannya dalam meningkatkan produksi kakao dari segi
kualitas dan kuantitas. Pelaksaan penelitian ini juga membantu menumbuhkan
sikap kepedulian mahasiswa terhadap permasalahan yang terjadi pada petani.
Selain itu mahasiswa juga bisa menambah wawasan dan pengalamannya.
c. Bagi masyarakat
Hasil penelitian ini diharapkan dapat membantu mengatasi masalah dari
Theobroma cacao L.dalam hal perbanyakan buah dan mendapatkan kualitas buah
yang terbaik. Promoter gen TcLFY dan TcAG dapat digunakan sebagai regulator
mempunyai kualitas yang bagus, mengalami peningkatan harga dan bisa
mensejahterakan kehidupan petani.
d.bagi pemerintah
Pemerintah diharapkan dari hasil penelitian ini dapat membantu petani
kecil baik sarana dan prasarana untuk mendukung kelancaran petani dalam
TINJAUAN PUSTAKA
Botani dan Morfologi Tanaman Kakao (Theobroma cacao L.)
Tanaman kakao (Theobroma cacao L.) merupakan tanaman dikotil dan
termasuk ke dalam famili Sterculiaceae. Jumlah kromosom yang dimiliki tanaman
kakao yaitu 2n = 20. Tanaman kakao dewasa bisa mencapai ketinggian 6-9 m
(Tjasadiharja 1987). Daerah dataran rendah tropis dengan ketinggian 1000 m di
atas permukaan laut merupakan daerah tanaman kakao tumbuh. Curah hujan yang
merata sepanjang tahun dengan minimal 90-100 mm per bulan diperlukan pula
oleh tanaman kakao. Curah hujan yang baik untuk pertumbuhan tanaman kakao
dipengaruhi juga oleh sifat fisik tanah itu sendiri (Siregar et al., 2004). Tanaman
kakao juga memerlukan pH tanah yang berkisar antara 6.0-7.0 (Goenadi &
Hardjono 1985).
Suhu lingkungan yang baik untuk kakao tumbuh adalah 18-32°C dengan
suhu rata-rata tahunan 25°C. Suhu rata-rata bulanan terdingin tidak boleh kurang
dari 15°C. Pengaruh suhu ini sangat erat hubungannya dengan sinar matahari,
ketersediaan air, dan kelembaban udara. Jika suhu rendah maka akan
menyebabkan pembungaan terlambat. Penurunan suhu di bawah 22°C bisa
menyebabkan primordia bunga terhenti (Wachjar & Iskandar 1988). Kondisi pada
pembentukan cabang sehingga mengakibatkan daun-daun tidak berkembang
(Wood 1985).
Salah satu sifat khusus dari daun kakao adalah adanya dua persendian
(articulation) yang terletak di pangkal dan ujung tangkai daun. Persendian ini
berperan pada pergerakan untuk menyesuaikan dengan arah datangnya sinar
matahari. Bentuk helai daun bulat memanjang, ujung daun meruncing, dan
pangkal daun runcing. Susunan tulang daun menyirip dan tulang daun menonjol
ke permukaan bawah helai daun. Warna daun dewasa yaitu hijau tua. Panjang
daun dewasa 30 cm dan lebarnya 10 cm. Permukaan daun mengkilap dan licin
(PPKKI 2004).
Kakao merupakan tanaman yang kaulifloral, yaitu bunga tumbuh dan
berkembang dari bekas ketiak daun pada batang dan cabang (PPKKI 2004).
Tanaman ini mempunyai bunga yang berwarna merah muda sampai putih, reguler,
hermafrodit, sebuah ovari superior yang merupakan gabungan dari lima karpel,
memiliki lima sepal, lima petal, dan 10 stamen (Tjasadiharja 1987). Menurut
Siregar et al., (2004) kelopak daun bunga kakao berwarna putih dan
kadang-kadang makin ke ujung warna kelopak terlihat ungu kemerahan. Mahkota bunga
bentuknya seperti cawan, mempunyai panjang 8-9 mm dan berwarna putih
kekuningan atau putih kemerahan. Bunga kakao akan muncul secara bergerombol
pada bantalan bunga. Bantalan bunga yaitu jaringan yang menebal pada ketiak
bekas menempelnya tangkai daun. Waktu yang diperlukan dari munculnya bakal
bunga sampai mekar yaitu 30 hari. Bila saat mekar bunga tidak mengalami
penyerbukan maka bunga akan gugur (Tjasadiharja 1987). Pembungaan kakao
dipengaruhi oleh beberapa faktor yaitu umur tanaman, status nutrisi, korelasi
internal, aktivitas kambium, naungan, suhu, distribusi hujan dan kelembapan.
Warna buah kakao ketika muda yaitu hijau agak putih dan berwarna
kuning jika masak. Selain itu ada juga jenis lain yaitu berwarna merah ketika
muda dan berwarna jingga ketika masak. Buah akan masak setelah berumur enam
bulan. Biji tersusun dalam lima baris mengelilingi poros buah. Jumlahnya
beragam yaitu 20-50 butir per buah. Pembuahan kakao dipengaruhi oleh beberapa
hal yaitu jumlah bunga yang tumbuh, persentase bunga yang diserbuki, persentase
masak (PPKKI 2004). Bentuk bunga kakao dapat dilihat pada Gambar 1 (Hinsley
Gambar 1 Bagian bunga kakao, stamen (Sta), sepal (Se), petal (Pe), pistil (Pi) dan staminod (Std).
Gen Pembungaan
Perkembangan organ bunga sangat penting pada proses pembungaan.
Pembentukan organ ini dikendalikan oleh gen-gen yang berperan pada proses
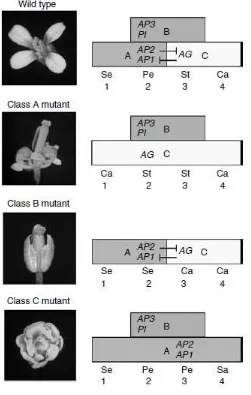
tersebut. Pengembangan gen pada bunga dapat diisyaratkan menjadi model ABC.
Model ini mengkoordinasikan ekspresi dan fungsi dari gen menjadi transkripsi A,
B dan C. Aktivitas transkripsi tipe A disandikan oleh gen APETALA1 (AP1) dan
APETALA2 (AP2) yang mengontrol pembentukan sepal dan petal. Tipe B yang
disandikan oleh gen APETALA3 (AP3) dan APETALA1 (AP1) mengontrol
pembentukan petal dan stamen. Sedangkan tipe C disandikan oleh gen
AGAMOUS (AG) yang mengontrol perkembangan stamen dan karpel (Pinero &
Couplan 1998).
Gen AGAMOUS merupakan keluarga dari gen MADS-Box (MCM1,
AGAMOUS, DEFICIENS, and SRF) yang diperlukan dalam pembentukan
identitas bunga (Bao et al., 2004). Gen yang berperan dalam mengontrol
pembentukan stamen dan karpel ini, ekspresinya dapat ditekan oleh gen lain yaitu
gen BELLRINGER (BELL) sehingga pengaruh dari gen AG dalam pembentukan
meristem bunga dan inflorensia menjadi terhambat (Bao et al., 2004). Menurut
LEUNIG (LUG), SEUSS (SEU), STERILE APETALA (SAP), CURLY LEAF
(CLF), INCURVATA2 (ICU2) dan BELLRINGER (BELL).
Chaidamsari (2005) melaporkan bahwa kloning dari cDNA encoding
TcAG (homolog AG dari kokoa) telah diekspresikan pada stamen dan ovari, yang
dibandingkan dengan AG pada Arabidopsis. Gen TcAG selalu diekspresikan pada
dinding buah (sebagian kecil) selama perkembangan. Kakao homolog dari AG
pada Arabidopsis (TcAG) berpengaruh pada pembentukan kelopak bagian dalam
dari organ pembungaan, staminode, stamen dan ovari. Pada tanaman yang lain,
TcAG hanya terekspresi pada pembungaan dan predominan pada staminode,
stamen dan ovari. Homolog gen pembungaan kakao pada Arabidopsis
berpengaruh baik pada koregulasi inisiasi pembungaan dan berpengaruh juga pada
determinasi identitas dari sepal dan petal (Chaidamsari 2005).
Gen LFY diketahui mampu mengaktifkan ekspresi dari gen kelas A, kelas
B dan kelas C (Gambar 2) (Jordan 2006). Model ekspresi dari gen A, B dan C
diperlihatkan pada Gambar 3. Ekspresi AG diketahui diaktifkan oleh LFY dan
protein LFY yang berperan untuk mengikat in vitro pada intron kedua AG.
Pembatasan berikutnya dari transkripsi AG ke pada perkembangan bunga adalah
hasil dari kombinasi aktivitas LFY dan WUSCHEL (WUS). Gen WUS
mengkodekan homeodomain faktor transkripsi yang diperlukan untuk menentukan
proliferasi seluler dalam meristem. Keberadaan LFY dinyatakan kuat dalam organ
bunga muda primordia dan meristem bunga. Gen LFY juga terlibat dalam aktivasi
ekspresi AP1 dan CAL. Gen LFY memiliki efek yang kuat pada identitas
meristem karena mengaktifkan transkripsi dari rangkaian gen lain (Glover 2007).
Jenis gen kakao lain yang mengkode faktor transkripsi dari kelas
MADS-box yang diperkirakan mempengaruhi regulasi waktu pembungaan dan
pembentukan bunga yaitu Theobroma cacao L. APETALA1 (TcAP1)
(Chaidamsari 2005). Gen TcAP1 diekspresikan pada pembungaan dan dalam
bunga predominan terekspresi pada sepal dan petal pada level yang rendah pada
organ pembungaan yang lain. Menurut Parcy et al., (1998) protein LFY juga
diketahui mampu mengaktifkan ekspresi dari gen AP1 dengan cara mengikat
Gambar 2 Aktivasi gen kelas A,B dan C oleh gen LFY (Jordan 2006).
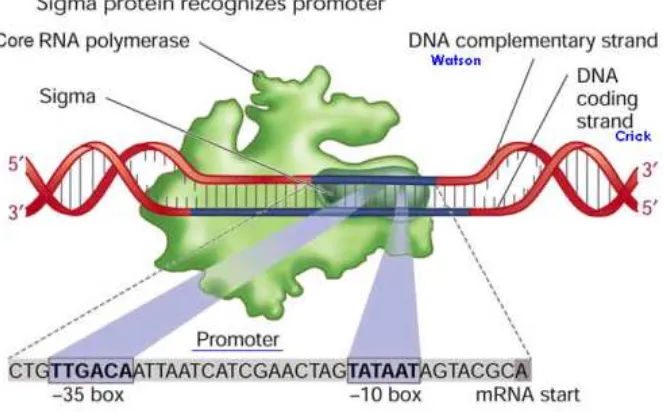
Promoter DNA
Promoter adalah bagian gen yang berfungsi sebagai pengatur proses
ekspresi genetik (transkripsi) bagian struktural. Promoter ini bagian yang akan
dikenali pertama kali oleh enzim RNA polimerase dan protein regulator sebelum
proses transkripsi dimulai (Yuwono 2005). Daerah promoter merupakan daerah
awal terjadinya sintesis RNA dan proses sintesis ini berlangsung hingga bagian
akhir sekuen. Daerah promoter terdiri dari daerah kecil dengan urutan basa-N
yang pada umumnya mempunyai urutan yang tetap atau sering disebut
TATA-box. TATA-box merupakan bagian DNA yang banyak mengandung basa timin
dan adenin dan berada pada bagian upstream dan dilokasikan pada -10 dan -35 bp
upstream (Murray et al., 2003). Sekuens pada kotak TATA menentukan titik
inisiasi transkripsi secara tepat. Penghilangan kotak TATA pada β-globin menyebabkan penurunan transkripsi secara invitro. Pengubahan sekuens TATA
menjadi TAGA atau TAAA akan menghilangkan proses transkripsi (Yuwono
2005).
Kotak TATA mempunyai peranan yang penting dalam proses transkripsi,
namun ada banyak gen yang tidak mempunyai kotak TATA. Gen yang tidak
mempunyai kotak TATA dapat dikelompokkan menjadi dua kelas yaitu gen house
keeping dan gen-gen yang diatur ekspresinya berdasarkan atas perkembangan
organisme. Gen house keeping yaitu gen-gen yang diekspresikan secara konstitutif
pada semua sel karena gen ini diperlukan dalam metabolisme utama. Gen-gen
yang diatur ekspresinya berdasarkan atas perkembangan organisme yaitu gen-gen
homeotik yang mengatur perkembangan lalat buah atau gen-gen yang terlibat di
dalam perkembangan sistem kekebalan pada mamalia (Yuwono 2005). Posisi
promoter dalam suatu gen untuk lebih jelasnya dapat dilihat pada Gambar 4
(Hunter 2011). Promoter mempunyai aktivitas spesifik pada jaringan atau organ
spesifik. Salah satu aktivitas tersebut yaitu dalam hal pengkontrolan ekspresi
Gambar 4 Posisi promoter dalam suatu gen (Hunter 2011).
Tanaman Tembakau
Tembakau berkembang luas pada berbagai bagian dunia. Tembakau
mempunyai stuktur batang tegak, kuat dan berkayu. Tinggi tanaman bervarisasi
tergantung pada varietasnya. Jika kondisi lingkungan baik, maka tingginya bisa
mencapai 2 meter. Batang tembakau tidak bercabang, tetapi pada saat berbunga di
bagian atas ketiak daun akan tumbuh tunas-tunas lateral. Tunas-tunas tersebut
akan tumbuh menjadi sirung atau sulang. Jika batang tembakau rebah, maka
tunas-tunas lateral tersebut akan berpotensi tumbuh menjadi sulang. Varietas yang
banyak sulang tidak disukai karena pertumbuhannya akan mengurangi zat-zat hara
dan nutrisi yang diperlukan untuk pertumbuhan daun (Suwarso 1999).
Tembakau merupakan jenis tanaman dikotil yang berakar tunggang.
Bentuk daun dipengaruhi oleh posisi di batang. Daun bawah bentuknya lebih bulat
dibandingkan daun-daun di atasnya. Daun pucuk bentuknya lebih runcing. Daun
ditopang oleh ibu tulang daun dengan cabang-cabang yang berbentuk menyirip.
Permukaan atas dan bawah daun terdapat stomata dan bulu-bulu kelenjer (trikom).
Stomata lebih banyak terdapat di permukaan bawah daun (Suwarso 1999).
Kingdom : Plantae (Tumbuhan)
Super Divisi : Spermatophyta (Menghasilkan biji)
Spesies N. Tabacum L. pada umumnya merupakan tanaman hari netral.
Waktu pembungaan tidak dipengaruhi oleh lamanya waktu penyinaran matahari.
Tanaman akan membentuk karangan bunga di ujung batang pada fase generatif
tanaman. Bunga dewasa mempunyai mahkota berbentuk terompet sepanjang 4-5
cm yang mempunyai lima lekuk di bagian tepinya. Mahkota bunga berwarna
merah muda pada bagian atas dan berwarna putih pada bagian bawahnya.
Beberapa saat sebelum bunga mekar, tepung sari telah masak dan kepala putik
reseptif sehingga siap menerima tepung sari. Bila penyerbukan berhasil,
pembuahan akan terjadi sekitar 36 jam kemudian. Buah akan mulai masak 3-4
minggu setelah terjadi pembuahan (Suwarso 1999).
Tanaman tembakau mempunyai kecendrungan yang kuat untuk melakukan
proses penyerbukan sendiri. Hal ini menjadi salah satu alasan dipilihnya tanaman
tembakau sebagai tanaman untuk transformasi. Selain itu pertumbuhan dari
tanaman tembakau sangat mudah, proses pembungaan yang cepat dan
pembungaan yang tidak dipengaruhi oleh penyinaran (Bock 2007).
Transformasi Tanaman
Transformasi tanaman adalah penyisipan materi genetik asing yang masuk
melalui dinding sel tanaman.Teknik transformasi ke tanaman ada banyak macam
tetapi secara garis besar dapat dibagi ke dua kelompok yaitu menggunakan bakteri
Agrobacterium tumifaciens dan transformasi secara langsung. Transformasi secara
langsung antara lain mikroinjenksi, fusi steroplas, fusi liposom, imbisi embrio,
pendekatan biolistik. Teknik ini dinamakan teknik transformasi secara langsung
karena DNA diintroduksi tanpa menggunakan perantara (Loedin 1994).
Transformasi menggunakan Agrobacterium tumifaciens merupakan
metode transformasi yang paling sering digunakan. Bakteri gram negatif ini
menginfeksi pada tanaman dikotil yang menyebabkan penyakit tumor batang
(crown gall). Kemampuan ini didukung oleh keberadaan plasmid Ti pada bakteri.
Ketika Agrobacterium tumifaciens menginfeksi tanaman, bagian dari molekul
DNA berupa transferred DNA (T-DNA) akan terintegrasi pada DNA kromosom
tanaman. sifat unik ini memungkinkan plasmid Ti menjaid alat transpor dari gen
lain dengan menyisipkan gen asing tersebut pada T-DNA. Kemudian dengan
teknik transformasi Agrobacterium tumifaciens diinfeksikan pada sel tanaman.
Teknik ini telah berhasil diterapkan pada tanaman tembakau, tomat, pepaya,
pisang, kentang, dan tanaman dikotil lainnya (Zupan et al., 2000). Keuntungan
dari teknik ini adalah gen yang terintegrasi umumnya hanya satu kopi karena
disisipkan pada T-DNA (Loedin 1994).
Plasmid yang digunakan untuk transformasi dinamakan juga dengan
vektor. Vektor inilah yang membantu untuk transfer gen ke tanaman. Selain gen
target terdapat pula gen reporter. Gen reporter yang biasa digunakan adalah gen
Gus penyandi β-glukuronidase, synthetic green fluorescent protein (sGFP), luciferase (LUC), enhanced yellow fluorescent protein (EYFP), dan enhanced
cyan fluorescent protein (ECFP) (Nakagawa 2007). Hasil positif Gus adalah
terdapatnya warna biru sedangkan GFP terdapatnya warna hijau. Analisis yang
tercepat untuk menunjukkan gen terintegrasi secara stabil pada tanaman adalah
dengan analisis histokimia enzim gen penanda (gen reporter) dan analisis PCR
(Loedin 1994).
Kultur Jaringan
Kultur jaringan adalah metode untuk mengisolasi bagian tanaman berupa
sekelompok sel atau jaringan yang ditumbuhkan pada kondisi aseptik, sehingga
bagian tanaman tersebut dapat memperbanyak diri menjadi tanaman yang lengkap
membentuk daun, batang dan akar. Teknik kultur jaringan ini memanfaatkan
Sebagian besar metode kultur jaringan menggunakan media garam mineral
Murashige & Skoog (MS) sebagai media tanam yang diperkaya dengan sukrosa.
Kultur jaringan disebut juga sebagai kultur in vitro. Tanaman yang
pertumbuhannya dilakukan secara in vitro termasuk golongan heterotrof (Miller &
Chandler 1990). Metode perbanyakan tanaman secara in vitro dapat dilakukan
melalui perbanyakan tunas dari mata tunas apikal, melalui pembentukan tunas
adventif, dan embriogenesis somatik. Jaringan yang digunakan sebagai eksplan
dalam kultur jaringan yaitu jaringan muda yang belum mengalami diferensiasi dan
masih aktif membelah sehingga memiliki kemampuan regenerasi yang tinggi.
Jaringan tipe pertama ini biasa ditemukan pada tunas apikal, tunas aksiler, bagian
tepi daun, ujung akar, maupun kambium batang. Tipe jaringan lain yang
digunakan yaitu jaringan parenkim. Jaringan parenkim yaitu jaringan penyusun
tanaman muda yang sudah mengalami diferensiasi dan menjalankan fungsinya.
Contoh jaringan tersebut yaitu jaringan daun yang telah mampu melakukan
aktivitas fotosintesis dan jaringan batang atau akar yang berfungsi sebagai tempat
cadangan makanan (Evert et al., 2006).
Tanaman yang spesifik membutuhkan media tanam yang spesifik pula
(Miller & Chandler 1990). Tanaman kentang yang dikulturkan pada media MS
dengan dua kali unsur makro yang ditambah 60 g/L sukrosa dapat meningkatkan
vigor tanaman akan tetapi tanaman akan menjadi lebih pendek, jumlah daun
menjadi sedikit, diameter menjadi lebih sempit, dan percabangan lebih banyak
(Purwito 1999). Menurut Hapsoro (1999) peningkatan konsentrasi sukrosa
menyebabkan penurunan jumlah tunas dan panjang tunas pada tanaman famili.
Nutrien anorganik ditambahkan pada tanaman kultur dalam bentuk garam
mineral. Bahan mineral yang diberikan tersebut dapat berupa kation dan anion.
Seperti contoh kalsium, magnesium dan kalium diserap oleh akar tanaman kultur
jaringan dalam bentuk kation Ca2+, Mg2+ and K+. Nitrogen diserap dalam bentuk
anion NO3 dan kation NH4+. Tanaman kultur jaringan juga menyerap fosfat dalam
bentuk ion HPO42- and H2PO4- dan menyerap sulfat dalam bentuk ion SO42-.
Sistem penyerapan pada kultur jaringan dipengaruhi oleh konsentrasi
unsur lainnya, pH, suhu, dan status biokimia atau fisiologis tanaman jaringan.
ioniknya. Misalnya, Mg2+ bersaing dengan kation lain untuk proses
pengambilannya. Jika kondisi K+ tinggi maka konsentrasi Ca2+, Mg 2+ akan
mengalami kekurangan. Penyerapan aktif fosfat terjadi jika pH larutan menjadi
sedikit basa ketika ion (H2PO4) - berubah menjadi (HPO4)2 -. Amonium lebih
mudah digunakan dibandingkan nitrat pada suhu rendah. Serapan amonium ke
dalam sel tanaman ditingkatkan pada kondisi tingkat karbohidrat yang tinggi di
dalam sel. Kalsium tidak diserap secara efisien dan konsentrasi dalam jaringan
tanaman cenderung proporsional dengan yang ada di tanah (George 1996).
Tanaman relatif tidak sensitif terhadap ion sulfat. Jika konsentrasi fosfat
terlarut tinggi maka bisa menekan pertumbuhan. Hal ini karena melalui proses
kompetitif yang mengurangi penyerapan unsur-unsur minor Zn, Fe dan Cu.
Proses penyerapan mineral pada tanaman kultur jaringan bisa terjadi melalui
stomata daun dan dilanjutkan ke pembuluh xilem. Ketika eksplan yang pertama
ditempatkan pada media, terdapat kebocoran ion dari sel yang rusak, terutama
kation (Na+, Ca2+, K+, Mg2+) untuk 1-2 hari pertama, sehingga konsentrasi dalam
jaringan tanaman benar-benar menurun. Penyerapan aktif dimulai dan konsentrasi
internal sel perlahan-lahan naik. Fosfat dan nitrogen (terutama amonium) diserap
BAHAN DAN METODE
Waktu dan Tempat Penelitian
Penelitian dilaksanakan di Laboratorium Biologi Molekuler dan Rekayasa
Genetika, Balai Penelitian Bioteknologi Perkebunan Indonesia, Bogor. Penelitian
ini berlangsung dari bulan Juni 2011 hingga Februari 2012.
Alat dan Bahan
Alat-alat yang digunakan adalah cawan petri, gelas piala, tabung sentrifus,
sentrifus Beckman Allegra 64R, sentrifus effendorf 5417R, tabung effendorf,
pipet mikro, tips, spektrofotometer UV-VIS Beckman, mortar, penangas air,
autoklaf, pipet tetes, stirer, pipet Mohr, labu Erlenmeyer, oven, pH meter, alat
elektroforesis (sisir, cetakan agar, bak elektroforesis, adaptor 100 Volt, dan UV
T2201), cawan petri, speed vac, neraca analitik, shaker incubator, laminar air
flow cabinet dan alat PCR (Biometra T-Personal).
Bahan-bahan yang digunakan adalah bufer ekstraksi (1 M Tris-Hcl, 0,5 M
EDTA, 5 M NaCl, 10% CTAB, dan akuades steril), 1% β-merkaptoetanol, isopropanol, CH3COONa, etanol absolut, PVPP, nitrogen cair, kultur daun
tembakau steril, gene specific primer (GSP) gen GFP yaitu GFP forward
(TCACTGGAGTGGTCCCAGTT) dan GFP reverse
(CCATGTGTAATCCTAGCAGC), dNTP, Taq polymerase recombinant
invitrogen, gel agarose, loading dye, etidium bromida, Agrobacterium tumifaciens
AGL0, tris borat EDTA (TBE), media LB cair, rifamisin, kanamisin,
asetosiringon, sefotaksim, media MS padat (A, B, C, D, E, dan F), benzil amino
purin (BAP), vitamin 10mL/L, agar kultur jaringan, dan sukrosa.
Metode Penelitian
Transformasi ke tanaman tembakau
Penyisipan genetik promoter gen TcLFY dan promoter gen TcAG ke dalam
sel tanaman tembakau dilakukan dengan teknik cakram daun (leaf disk) yang
media cair LB yang mengandung kanamisin 50 ppm dan rifamisin 100 ppm
selama 24-48 jam pada suhu 28°C dengan pengocokan 150 rpm dalam keadaan
gelap. Setelah diencerkan dengan media MS cair, Agrobacterium tumifaciens
AGL0 tersebut dikulturkan kembali selama sekitar 0,5-1 jam dan diukur nilai
optical density (OD) hingga mencapai 0,1-0,3. Pengukuran nilai OD dilakukan
dengan menggunakan spektrofotometer pada panjang gelombang 600 nm.
Potongan-potongan eksplan daun tembakau, ukuran cakram diameter 0,5-1,0 cm
diinkubasi selama 15 menit dengan 1/10 volume kultur cair Agrobacterium
tersebut. Ko-kultivasi pada media MS padat yang mengandung asetosiringon 100
ppm dilakukan selama 1 hari. Setelah itu dipindahkan ke media yang mengandung
sefotaksim 250 ppm selama 5 hari. Seleksi tanaman transforman dilakukan pada
media MS padat yang mengandung antibiotika kanamisin 50 ppm dan sefotaksim
250 ppm (Samanhudi 2006).
Kultur Jaringan
Kultur jaringan untuk regenerasi planlet tembakau dilakukan
menggunakan metode standar melalui organogenesis. Potongan eksplan daun
steril dikulturkan pada media MS padat yang mengandung BAP 0.5 ppm. Kultur
eksplan diinkubasi pada suhu 26-28°C. Sub kultur ke media segar dilakukan
setiap 4-6 minggu sekali. Kultur eksplan transgenik dilakukan dengan metode dan
kondisi yang sama dengan non-transgenik kecuali komposisi media. Seleksi dan
kultur eksplan transgenik dalam media tumbuhnya ditambahkan antibiotik
penyeleksi yang sesuai yaitu kanamisin 50 ppm. Pada masa tumbuh ini morfologi
tanaman tembakau diamati. Tanaman tembakau yang mengandung promoter gen
target akan tumbuh pada media seleksi kanamisin dan yang tidak mengandung
promoter gen target tanaman ini akan mati (Samanhudi 2006).
Isolasi DNA tembakau
Isolasi DNA daun tembakau mengacu kepada metode Orozco et al.,
(1994) yang dimodifikasi. Daun tembakau sebanyak 0,1-0,2 gram digerus hingga
halus dengan nitrogen cair dan ditambah PVPP. Bufer ekstraksi hangat
CTAB, dan akuades steril). Sebanyak 10 μL β-merkaptoetanol ditambahkan dan larutan daun tembakau divortex. Larutan diinkubasi pada suhu 65ºC selama 30
menit. Kemudian diekstrak dengan kloroform : isoamil alkohol (24:1). Sampel
selanjutnya disentrifugasi pada 11000 selama 10 menit. Lapisan atas (supernatan)
diambil dan dipindahkan ke dalam tabung Effendorf baru. Kemudian sampel
diekstrak kembali dengan kloroform : isoamil alkohol (24:1). Sampel selanjutnya
disentrifugasi kembali pada 11000 selama 10 menit. Pelet dikeringkan dengan
membalikkan tube secara hati-hati. Kemudian pelet ditambahkan bufer TE
sebanyak 500 μL dan natrium asetat 1/10 volume pH (5,2) serta etanol absolut sebanyak 2 volume. Larutan diinkubasi selama 30 menit di freezer. Larutan
disentrifus pada 12000 rpm selama 10 menit dan 4ºC. Endapan dicuci
menggunakan etanol 70% dingin dan dikeringkan dengan sentrifugasi pada 8000
rpm selama 5 menit dan 4ºC. Sampel dilarutkan dalam 50 μL ddH2O. Kualitas DNA diuji dengan elektroforesis dengan konsentrasi agar 1%. DNA genomik
tembakau yang berhasil diisolasi kemudian diinjeksikan pada agar sebanyak 2 μL yang dilarutkan pada 1 μL larutan loading dye. Bufer yang digunakan pada elektroforesis yaitu bufer TBE (Tris Borat EDTA). Pita DNA divisualisasikan
menggunakan sinar UV dan difoto.
PCR
PCR dilakukan untuk mengetahui planlet transgenik yang digenerasikan
tersebut berhasil atau tidak. Campuran pereaksi PCR mengandung DNA templat
sebanyak 1-10 ng, keempat dNTP masing-masing 0.2 μM, sepasang primer NPTII masing-masing sebanyak 1 μL dan DNA Taq polymerase 0,5 μL. Reaksi dilakukan dengan volume 25 μl, dengan program PCR sebagai berikut yaitu denaturasi pada suhu 94°C selama 30 detik, penempelan pada suhu 50°C selama
30 detik, perbanyakan pada suhu 72°C selama 2 menit, dengan pengulangan
sebanyak 35 siklus. Hasil PCR diperiksa menggunakan gel agarose dengan
konsentrasi 1%. Amplikon hasil PCR kemudian diinjeksikan pada agar sebanyak
5 μL yang dilarutkan pada 1 μL larutan loading dye. Bufer yang digunakan pada elektroforesis yaitu bufer TBE (Tris Borat EDTA). Pita DNA divisualisasikan
Variasi media sukrosa
Variasi media mengacu pada metode Balzquez et al., (1998) yang
dimodifikasi. Variasi media sukrosa dilakukan dengan menanam tanaman
tembakau transgenik TcLFY dan TcAG ke tiga jenis media sukrosa dengan
konsentrasi 0%, 0,5% dan 4%. Daun yang terdapat pada satu tanaman harus
berjumlah minimal 2 pasang daun. Tanaman tembakau diamati warna dan bentuk
HASIL DAN PEMBAHASAN
Konsentrasi kanamisin
Penggunaan kanamisin sebagai seleksi tanaman telah banyak dilakukan
pada proses transformasi. Menurut Makful (2004) kanamisin sangat baik
digunakan sebagai seleksi tanaman transforman karena kanamisin mudah
dilarutkan, tidak terpengaruh pH, tidak mahal dan stabil. Sebelum melakukan
transformasi tanaman, perlu dilakukan optimasi konsentrasi kanamisin terlebih
dahulu. Optimasi konsentrasi kanamisin untuk penelitian ini telah dilakukan
sebelumnya dengan menggunakan beberapa konsentrasi kanamisin. Variasi
konsentrasi yang dilakukan yaitu 0, 50, 100, 150 dan 200 ppm. Hasil dari optimasi
kanamisin yang dilakukan diperoleh hasil bahwa konsentrasi optimum yang
diperoleh yaitu 50 ppm (mg/L) untuk menyeleksi transforman karena konsentrasi
tersebut telah mampu menghambat pertumbuhan tanaman tembakau yang bukan
transforman. Oleh karena itu, pada penelitian ini digunakan kanamisin pada
konsentrasi 50 mg/L.
Hal yang sama dilakukan oleh Dobhal et al., (2010) yang melakukan
transformasi menggunakan tanaman tembakau dengan promoter 35S dan gen
reporter GUS dengan konsentrasi akhir kanamisin yang digunakan yaitu 50 mg/L.
Sebanyak 3,9% tanaman tembakau telah berhasil ditransformasikan dan melewati
masa seleksi media kanamisin menggunakan vektor pCAMBIA 2301 dan
menggunakan gen reporter GUS pada konsentrasi akhir kanamisin 50 mg/L
(Dobhal et al., 2010). Transfomasi promoter 35S dan gen reporter GUS ke
tanaman tembakau yang dilakukan Chaidamsari (1999) pun menggunakan
konsentrasi kanamisin 50 mg/L.
Optimasi kanamisin perlu dilakukan untuk mengetahui kondisi tanaman
yang akan ditransformasi. Kondisi ini berupa konsentrasi kanamisin yang mampu
membunuh tanaman. Tanaman yang berbeda mempunyai optimasi kanamisin
yang berbeda (Bhau & Wakhlu 2001). Seperti halnya optimasi kanamisin tanaman
tomat yang dilakukan oleh Yelli (2009), setelah dilakukan variasi konsentrasi dari
kanamisin diperoleh kanamisin optimum dari tomat yaitu 50 mg/L. Makful (2004)
1-aminosiklopropan-1-asam karboksilat oksidase adalah 150 mg/L. Konsentrasi
yang digunakan untuk seleksi harus menggunakan kadar antibiotik terendah yang
menghasilkan tekanan seleksi yang optimal.
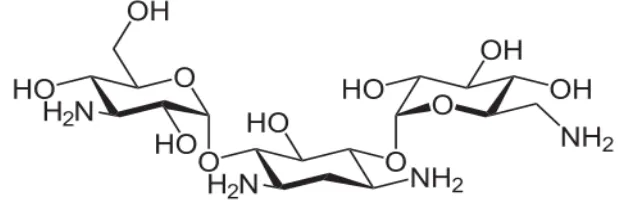
Kanamisin termasuk ke dalam antibiotik golongan aminoglikosida
(Gambar 5). Kanamisin mempengaruhi kerja dari 30S subunit ribosom yang
menyebabkan mutasi dan mencegah translasi RNA. Mutasi ini menyebabkan
kesalahan pada pembacaan kodon CAT menjadi kodon ATG yang dibaca oleh
aminoasill tRNA (aa-tRNA). Kesalahan ini akan berpengaruh terhadap
pengenalan kodon dan anti-kodon (Ahsen et al., 1991). Aminoasil tRNA akan
membawa asam amino yang berbeda karena antikodon aa-tRNA yang berbeda
(Yuwono 2005). Asam amino yang berbeda akan mempengaruhi sintesis protein
(Makful 2004). Tanaman yang tidak membawa konstruk promoter dan gen
ketahanan terhadap kanamisin (nptII) maka tanaman ini akan mati karena induksi
dengan kanamisin akan mempengaruhi sintesis protein di dalam selnya.
Transformasi konstruk ke tanaman tembakau (Nicotiana tabacum L.)
Konstruksi promoter gen reproduktif LEAFY dari Theobroma cacao L.
(TcLFY) dan promoter gen reproduktif AGAMOUS dari Theobroma cacao L.
(TcAG) pada vektor ekspresi pGateway B telah dilakukan dengan metode
Gateway. Promoter TcLFY sebelumnya telah berhasil diisolasi dengan panjang
1650 bp. Metode yang digunakan untuk mengisolasi promoter TcLFY yaitu
dengan metode program Polymerase Chain Reaction (PCR) genome walkingTM
(Santoso 2010). Promoter TcAG juga telah berhasil diisolasi dengan panjang 1200
bp. Metode yang digunakan untuk mengisolasi promoter ini yaitu dengan metode
Thermal Asymmetric Interlaced Polymerase Chain Reaction (TAIL PCR)
(Trizana 2010).
Kedua vektor pGateway B yang membawa fragmen promoter TcLFY dan
TcAG ini digunakan untuk transformasi ke bakteri Agrobacterium tumifaciens
AGL0 menggunakan metode kejut dingin. Kemudian diperoleh dua
Agrobacterium tumifaciens AGL0 yang membawa vektor pGateway B TcLFY dan
TcAG. Setelah berhasil ditransformasikan ke bakteri Agrobacterium tumifaciens
AGL0 promoter ini kemudian diuji untuk mengetahui fungsinya pada tanaman
model tembakau (Nicotiana tabacum L.). Kedua konstruk ini selanjutnya
disisipkan ke dalam tanaman tembakau menggunakan metode leaf disk.
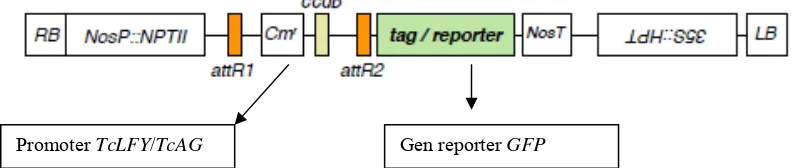
Konstruksi vektor pGWB yang digunakan mengandung selectable marker
gene yaitu gen neomycin phosphotransferase II (npt II) (Gambar 6). Gen npt II
mengkodekan ketahanan terhadap antibiotika kanamisin. Keberadaan gen ini
digunakan sebagai seleksi bakteri Agrobacterium tumifaciens AGL0 pada saat
kultur dan seleksi tanaman tembakau yang terinsersi fragmen promoter TcLFY
dan TcAG yang diberikan pada media pertumbuhan.
Gambar 6 Posisi promoter dan gen reporter GFP pada vektor pGWB serta gen seleksi kanamisin nptII.
Transformasi tanaman tembakau dilakukan untuk menginsersikan
promoter gen TcLFY dan promoter gen TcAG pada genom tembakau.
Transformasi pada penelitian dilakukan menggunakan bakteri Agrobacterium
tumifaciens AGL0 yang membawa promoter TcLFY dan promoter TcAG. Sebelum
ditransformasi bakteri ini dikulturkan selama 2 hari dalam keadaan gelap pada
suhu 28ºC menggunakan antibiotik kanamisin dan rifamisin. Setelah 2 hari
diinkubasi terjadi perubahan warna pada media kultur. Perubahan warna yang
terjadi yaitu dari warna kuning jernih menjadi warna kuning keruh (Gambar 7).
Perubahan warna ini mengindikasikan bahwa bakteri yang dikulturkan tumbuh
dan bisa digunakan untuk proses transformasi ke tanaman tembakau. Kanamisin
digunakan untuk seleksi bakteri Agrobacterium tumifaciens AGL0 yang
membawa vektor pGateway B. Pada vektor ini terdapat gen ketahanan terhadap
kanamisin (nptII). Sedangkan rifamisin digunakan untuk membunuh bakteri selain
bakteri Agrobacterium tumifaciens AGL0.
(a) (b)
Gambar 7 Kondisi kultur bakteri Agrobacterium tumifaciens AGL0 yang membawa konstruk promoter TcLFY dan promoter TcAG (a) hari ke 0 (b) setelah 2 hari inkubasi.
Pada proses transformasi, nilai optical density (OD) juga harus
diperhatikan. Nilai OD600 Agrobacterium tumifaciens AGL0 yang membawa
konstruk promoter TcLFY yang diperoleh yaitu 0,286. Nilai OD600 Agrobacterium
tumifaciens AGL0 yang membawa konstruk promoter TcAG yang diperoleh yaitu
0,243 (Tabel 1). Nilai OD600 yang disarankan untuk proses ini yaitu sekitar 0,1-0,3
(Dobhal et al., 2010). Jika nilai OD600 diatas 0,3 maka akan terjadi penumpukkan
Tabel 1 Nilai OD Agrobacterium tumifaciens AGL0 dari kedua konstruk yang diukur pada panjang gelombang 600 nm
Agrobacterium tumifaciens AGL0 Nilai OD
konstruk promoter TcLFY 0,286
konstruk promoter TcAG 0,243
Sebanyak 50 eksplan tanaman tembakau ditransformasikan dengan ukuran
1x1 cm2 untuk setiap eksplan pada media MS dan penambahan asetosiringon.
Penambahan asetosiringon ke dalam media berperan sebagai senyawa fenol yang
dapat mempermudah proses transformasi dan infeksi bakteri Agrobacterium
tumefaciens AGL0. Infeksi ini dilakukan dengan menginduksi gen Vir pada
bakteri Agrobacterium tumefaciens AGL0 yang mentransfer T-DNA beserta
konstruk promoter dari bakteri ke dalam sel (Gambar 8).
Bakteri Agrobacterium tumifaciens merupakan bakteri fitopatogen yang
menyerang tanaman dikotil dan mampu membentuk tumor. Tumor ini digunakan
bakteri sebagai penghasil karbon untuk sumber makanannya. Pada proses infeksi
ini, bakteri mampu mentransfer potongan DNA ke dalam genom tanaman yang
dikenal dengan istilah T-DNA (Rahmawati 2006).
Sinyal yang dihasilkan dari luka pada potongan eksplan berupa senyawa
fenol dan penambahan asetosiringon pada media merangsang induksi gen Vir.
Komponen genetik yang terlibat dalam proses pembentukan tumor yaitu gen
virulen kromosom (chromosomal virulence disingkat Chv), gen virulen (Vir) dan
daerah T-DNA yang juga terletak pada plasmid. Gen Chv yang terdapat pada
kromosom Agrobacterium tumifaciens berfungsi dalam pelekatan bakteri dengan
sel tanaman. Gen virulen (Vir) yang terdapat dalam plasmid Ti berperan dalam
menginduksi transfer dan integrasi T-DNA. Pada daerah T-DNA inilah promoter
konstruk TcLFY atau TcAG berada. Selain konstruk promoter, gen seleksi nptII
juga berada pada daerah T-DNA ini (Rahmawati 2006).
Mekanisme masuknya T-DNA ke sel tanaman dari bakteri Agrobacterium
dilakukan dengan bantuan tipe IV secretion system (T4SS). T4SS merupakan
sistem transport membran pada proses konyugasi bakteri. Asetosiringon yang
merangsang gen Vir membantu dalam proses pemindahan T-DNA ini. Salah satu
gen Vir yang berperan yaitu gen VirD2. Gen VirD2 akan mengikat sekuen
T-DNA dan membantu untuk memindahkan T-T-DNA dari sel bakteri ke tanaman
(Gambar 8). Gen VirD2 dan T-DNA dalam proses perpindahannya akan
membentuk komplek nukleo protein. Komplek nukleo protein ini akan dilapisi
oleh utas tunggal VirE2 binding protein menuju nukleus tanaman dan tergabung
ke dalam genom tanaman (Zupan et al., 2000).
Hal yang harus diperhatikan dalam melakukan proses transformasi yaitu
teknik yang digunakan untuk menginfeksi eksplan tanaman dengan kultur bakteri
Agrobacterium tumefaciens AGL0. Ketika memotong eksplan tanaman dari
tanaman aslinya harus dilakukan secara perlahan menggunakan ujung dari pinset.
Daun yang dipotong akan mengeluarkan senyawa fenol yang berfungsi untuk
menarik bakteri Agrobacterium tumefaciens AGL0. Selain penambahan
senyawa fenol ketika luka saat pemotongan. Faktor lain yang menentukan
keberhasilan transformasi khususnya transformasi melalui vektor Agrobacterium
diantaranya adalah jenis dan perkembangan jaringan yang akan diinfeksi, genotip,
jenis vektor, strain Agrobacterium, gen marker seleksi yang efisien, penambahan
fitohormon selama ko-kultivasi, media ko-kultivasi, lamanya periode ko-kultivasi,
penambahan asetosiringon dan waktu inokulasi.
Regenerasi eksplan tembakau yang membawa kontruksi promoter gen
TcLFY dan promoter gen TcAG
Morfologi tanaman
Tanaman tembakau yang telah berhasil ditransformasi kemudian
dikokultivasi pada media asetosiringon pada keadaan gelap selama sehari dan
dipindahkan ke media sefotaksim selama 4 hari. Menurut Chaidamsari (1999)
waktu kokultivasi yang terlalu lama akan menyebabkan kontaminasi oleh bakteri
Agrobaterium tumifaciens AGL0 dan mempengaruhi kesehatan eksplan. Eksplan
tembakau yang telah diinkubasi pada media sefotaksim selama 4 hari telah
menunjukkan perubahan dibandingkan pada eksplan tembakau pada saat
dipotong. Pada saat eksplan tembakau dipotong, keadaan daun masih lemas
seperti daun pada tanaman aslinya. Eksplan tembakau yang telah diinkubasi pada
media sefotaksim selama 4 hari keadaan daun sudah mulai berubah yaitu sedikit
keras, tebal dan ukuran daun yang mulai bertambah. Eksplan ini kemudian
dipindahkan ke media seleksi kanamisin dan sefotaksim serta diamati
pertumbuhannya. Pertumbuhan pada daun eksplan akan dimulai dengan
terbentuknya inisiasi calon tunas daun. Tanaman tembakau yang tidak berhasil
disisipi oleh konstruksi promoter gen TcLFY dan promoter gen TcAG maka pada
media seleksi kanamisin tanaman tembakau ini akan mati.
Proses transformasi ini menggunakan kontrol positif dan kontrol negatif.
Kontrol positif adalah tanaman tembakau non-transgenik yang ditumbuhkan pada
media tanpa kanamisin. Kontrol positif digunakan sebagai pembanding dengan
adalah tanaman tembakau yang non-transgenik yang ditumbuhkan pada media
yang mengandung kanamisin. Kontrol negatif digunakan sebagai acuan tanaman
tembakau yang tidak berhasil disisipi oleh promoter TcLFY dan TcAG. Kontrol
negatif dan tanaman tembakau yang tidak berhasil disisipi oleh promoter TcLFY
dan TcAG dalam pertumbuhannya akan mati karena tidak memiliki gen ketahanan
terhadap kanamisin (Gambar 9a).
(a) (b)
(c) (d)
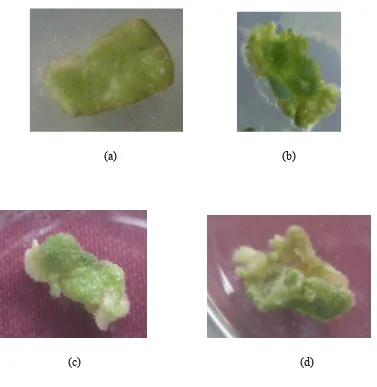
Inisiasi pada tanaman tembakau sudah dapat diamati dengan jelas pada
hari ke-18 (Gambar 9). Jumlah inisiasi pada daun tembakau yang disisipi
promoter gen TcLFY dan promoter gen TcAG memperlihatkan perbedaan. Inisiasi
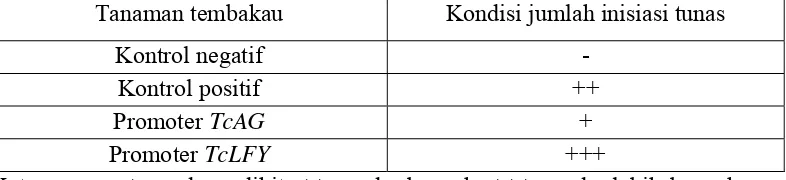
pada tanaman tembakau yang disisipi promoter gen TcLFY memperlihatkan
jumlah inisiasi yang lebih banyak bila dibandingkan dengan inisiasi pada tanaman
tembakau yang disisipi promoter gen TcAG dan tanaman tembakau kontrol positif
(Gambar 9d). Inisiasi pada tanaman tembakau yang disisipi promoter gen TcAG
memperlihatkan jumlah inisiasi yang sedikit bila dibandingkan dengan tanaman
tembakau kontrol positif (Tabel 2). Inisiasi ini diinduksi dengan bantuan senyawa
benzil amino purin (BAP) pada media. BAP merupakan senyawa pengatur
tumbuh sitokinin yang bersifat sintetik. BAP berperan dalam induksi pembelahan
sel pada masa pertumbuhan dan pembentukan cabang-cabang tunas daun
(Wakushima et al., 1996 ).
Tanaman tembakau kontrol negatif belum menunjukkan morfologi adanya
inisiasi tunas. Semua tanaman tembakau ditanam pada media seleksi kanamisin
kecuali tanaman kontrol positif. Sebanyak 10% dari 50 eksplan tanaman tembakau
untuk setiap promoter berhasil ditransformasikan dan melewati masa seleksi
media kanamisin. Menurut Dobhal et al., (2010) Sebanyak 3,9% tanaman
tembakau telah berhasil ditransformasikan dan melewati masa seleksi media
kanamisin menggunakan vektor pCAMBIA 2301 dan menggunakan gen reporter
GUS.
Tabel 2 Perbedaan jumlah inisiasi pada tanaman tembakau
Tanaman tembakau Kondisi jumlah inisiasi tunas
(a) (b)
(c) (d)
Gambar 10 Perbedaan morfologi tanaman tembakau yang berumur 40 hari, (a) tanaman kontrol negatif, (b) tanaman kontrol positif, (c) tanaman tembakau yang disisipi promoter gen TcAG, (d) tanaman tembakau yang disisipi promoter gen TcLFY.
Eksplan awal
Eksplan awal Eksplan
Inisiasi yang muncul pada permukaan daun akan membentuk tunas yang
selanjutnya akan membentuk daun kecil. Daun-daun kecil ini ini tumbuh menjadi
besar sehingga dari satu eksplan akan memperoleh banyak tunas daun. Pada
Gambar 10 terlihat bentuk daun yang berasal dari inisiasi tunas. Bentuk daun
tembakau yang disisipi promoter gen TcLFY dan promoter gen TcAG
menunjukkan perbedaan morfologi. Daun tembakau yang disisipi promoter gen
TcLFY mempunyai banyak tunas daun, bentuk struktur daun yang terlihat jelas,
dan pertumbuhan yang cepat. Berbeda halnya dengan daun tembakau yang
disisipi promoter gen TcAG yang memperlihatkan bentuk daun tidak sempurna
dengan sedikit tunas daun bila dibandingkan dengan daun tembakau yang disisipi
promoter gen TcLFY. Pertumbuhan tanaman tembakau yang disisipi promoter
gen TcAG memiliki pertumbuhan yang lambat.
Tanaman tembakau kontrol positif memperlihatkan bentuk daun yang
sempurna. Bentuk daun tembakau yang disisipi promoter gen TcLFY bila
dibandingkan dengan daun kontrol juga terlihat ada perbedaan. Daun tembakau
yang disisipi promoter gen TcLFY membentuk tunas yang lebih banyak bila
dibandingkan dengan tunas daun tanaman kontrol, namun daun tembakau yang
disisipi promoter gen TcLFY terlihat tidak sempurna seperti kontrol dan terdapat
lekukan-lekukan pada daunnya. Tanaman yang diamati pada umur 40 hari ini
belum dipisahkan dari eksplan indukannya (Gambar 10). Hal yang berbeda
ditunjukkan oleh tanaman tembakau kontrol negatif. Tanaman tembakau kontrol
negatif (Gambar 10a) memperlihatkan eksplan daun yang sebagian telah mati
dan sebagian lagi masih hidup. Eksplan yang berwarna coklat menunjukkan
tanaman tembakau yang telah mati. Eksplan daun tembakau yang berwarna hijau
menunjukkan eksplan ini masih bertahan hidup walaupun tidak menunjukkan
inisiasi tunas.
Tunas daun tembakau yang tumbuh dipotong dari eksplan indukan dan
dipindahkan ke media seleksi kanamisin baru sehingga diperoleh individu baru
yang akan membentuk tanaman tembakau utuh. Sehingga dari satu ekplan
tanaman tembakau bisa diperoleh sekitar 4-10 tanaman tembakau baru. Morfologi
tanaman tembakau yang disisipi promoter terhadap media seleksi kanamisin juga
diamati.
(a) (b)
(c)
(d)
Bentuk daun tembakau terlihat jelas perbedaannya dari daun tembakau
yang disisipi promoter gen TcLFY dan promoter gen TcAG pada umur 2 bulan.
Bentuk daun tembakau pada umur 2 bulan telah mampu menunjukkan jati diri dan
morfologi dari pengaruh insersi promoter. Perbedaan morfologi pertumbuhan
tanaman sangat terlihat jelas. Alasan lain untuk mengamati tanaman ini pada umur
2 bulan yaitu karena pada umur ini tanaman tembakau sudah melewati tahap
seleksi dengan menggunakan media kanamisin. Ketahanan terhadap kanamisin ini
mengindikasikan terjadinya ekspresi dari gen nptII yaitu gen ketahanan
kanamisin. Jika terjadinya ekspresi nptII maka secara tidak langsung
mengindikasikan bahwa sekuen promoter gen TcLFY dan promoter gen TcAG
terdapat pada tanaman transforman. Menurut Setyodjatmiko (2000), tembakau
yang berumur 2-3 bulan telah mempunyai ketahanan terhadap kanamisin.
Tanaman tembakau yang tidak berhasil melewati proses transformasi dengan baik
maka pada media yang mengandung kanamisin tanaman ini akan mati. Indikator
yang digunakan yaitu tanaman tembakau kontrol negatif yang ditanam pada media
yang mengandung kanamisin. Pada Gambar 11a, kontrol negatif yang berumur 2
bulan terlihat putih dan tidak bisa bertahan hidup.
Pertumbuhan daun merupakan pertumbuhan yang banyak diamati karena
menunjukkan morfologi yang terlihat ekstrim terutama untuk promoter gen TcAG.
Tanaman kontrol menunjukkan bentuk daun yang normal. Tanaman yang
terinsersi promoter gen TcAG menunjukkan bentuk daun yang tidak seragam,
bentuk daun yang tidak sempurna dan pertumbuhan daunnya yang lambat
(Gambar 11c). Tanaman yang terinsersi promoter gen TcLFY memiliki bentuk
daun seperti tanaman kontrol, bentuk daun yang hampir seluruhnya sempurna dan
pertumbuhan daun seperti tanaman kontrol positifnya (Gambar 11d). Bentuk daun
tembakau dari ekspresi promoter gen TcAG yang tidak sempurna dan bentuk daun
tembakau dari ekspresi promoter gen TcLFY seperti tanaman kontrol telah
mengindikasikan bahwa promoter aktif dalam melakukan proses transkripsi.
(a) (b) (c)
Gambar 12 Perbedaan morfologi tanaman tembakau yang berumur 4 bulan, (a) tanaman kontrol, (b) tanaman tembakau yang disisipi promoter gen TcAG, (c) tanaman tembakau yang disisipi promoter gen TcLFY.
Setelah berumur 4 bulan pertumbuhan dari ketiga tanaman terlihat jelas
(Gambar 12). Tanaman tembakau kontrol positif memiliki bentuk daun yang
normal dengan pertumbuhan daun yang normal. Tanaman tembakau yang
terinsersi promoter gen TcAG memiliki bentuk daun yang berbeda dari tanaman
tembakau kontrol positif, ukuran daun lebih kecil dan terlihat tidak normal, serta
pertumbuhan daun yang lambat (Gambar 12b). Hal yang sama juga dilakukan
oleh Yang et al., (2011) yang menunjukkan morfologi ukuran tanaman tembakau
yang terinsersi second intron AG lebih pendek dari tanaman kontrol. Tanaman
tembakau yang terinsersi promoter gen TcLFY memiliki bentuk daun yang sedikit
berbeda dari tanaman kontrol tetapi memperlihatkan bentuk daun mendekati
tanaman kontrol, dan pertumbuhan daun yang cepat (Gambar 12c). Menurut
Blazquez et al., (1998) tingkat ekspresi LFY sangat penting untuk berubah bentuk
dari daun untuk bractless bunga.
Ekspresi gen AG yang berlebihan diketahui dapat menekan ekspresi dari
gen AP dan WUS (Gustafson et al., 1994). Hal yang sama juga terjadi pada
aktivasi dari promoter gen TcAG yang berlebihan. Aktivasi dari promoter TcAG
yang berlebihan akan menghambat ekspresi dari AP1. Gen AP1 diketahui mampu
mengaktifkan ekspresi gen LFY. Proses penghambatan gen AP1 oleh AG secara
tidak langsung juga akan menghambat ekspresi dari LFY.Penghambatan ekspresi
LFY melalui jalur penghambatan gen AP1 juga menghambat ekspresi dari gen
mengaktifkan gen MADS BOX pada pembungaan. Gen MADS BOX yang
terpengaruh penghambatannya terdiri dari AP1, AP2, AP3, dan AG (Jordan 2005).
Gen LFY diketahui diekspresikan pada masa vegetatif daun (Blazquez et al.,
1998). Penghambatan ekspresi dari LFY ini juga akan berpengaruh terhadap
morfologi dari daun tembakau.
Gambar 13 Proses aktivasi dan inaktivasi gen MAD-Box pembungaan pada tanaman. Agamous (AG) menghambat ekspresi dari Apetala1 (AP), dan (WUS), LFY mengaktifkan ekspresi AG, AP1 dan AP3.
Gen LFY dalam sistem gen pembungaan tidak termasuk ke dalam gen
MADS BOX tetapi berada di luar gen MADS BOX. Pada sistem pembungaan gen
LFY termasuk ke dalam gen pada pusat pembungaan yang mampu mengaktifkan
ekspresi dari gen MADS BOX. Gen MADS BOX yang diaktifkan oleh gen LFY
terdiri dari gen-gen yang berada pada sistem ABC pembungaan yaitu AP1, AP2,
AP3 dan AG.
Bentuk daun tembakau yang disisipi promoter gen TcLFY terlihat seperti
daun tembakau kontrol positif dan tidak memperlihatkan daun tembakau yang
tidak sempurna seperti tanaman tembakau yang disisipi promoter gen TcAG.
Namun jika dibandingkan dengan tanaman tembakau kontrol positif, daun
tembakau yang disisipi promoter gen TcLFY mempunyai ekspresi daun yang
berbeda dari segi bentuk. Hal ini karena gen LFY secara aktif berperan dalam
pengaktifan gen AG dan gen AP (Gambar 13), sehingga proses bolak balik antara
gen ini tidak terlalu mempengaruhi bentuk daunnya dan terlihat seperti daun
kontrol positif.
Protein LFY mengaktifkan gen-gen lainnya dengan cara membentuk ikatan
dengan sekuen gen target yang dikenal dengan istilah DNA-binding protein
(Jordan 2005). Mekanisme ini terjadi pada aktivasi AG, protein LFY membentuk
Meyerowitz 1997, Busch et al., 1999, Deyholos & Sieburth 2000). Proses aktivasi
ini juga dibantu dengan regulator. Regulator ini yaitu berupa protein WUSCHEL
(WUS) yang diekspresikan oleh gen WUS. Protein regulator WUS mempunyai
peran khusus di dalam sel yaitu sebagai regulator gen kelas C pada pembungaan
(Gambar 14).
Gambar 14 Mekanisme pengaktifan promoter AG oleh protein LFY (Sharma et
al., 2003)
Aktivasi gen AP3 oleh LFY dibantu oleh regulator gen yaitu UNUSUAL
FLORAL ORGANS (UFO). Gen UFO seperti halnya gen WUS berperan sebagai
regulator khusus yaitu pada pengaktifan gen kelas B pada pembungaan. Protein
LFY juga berperan melakukan ikatan dengan sekuen DNA pada gen AP1. Aktivasi
gen AP1 oleh LFY terjadi secara langsung tanpa bantuan regulator (Parcy et al.,
1998). Menurut Samanhudi (2006) aktivasi promoter AP1 mampu mempengaruhi
perkembangan tanaman sehingga tanaman mampu berbunga dengan cepat dan