PENGGUNAAN RUMEN SAPI SEBAGAI AKTIVATOR PADA PEMBUATAN KOMPOS DAUN LAMTORO (Leucaena leucocephala)
SKRIPSI
HEPPY LOVE RIDA SINAGA 090822046
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS SUMATERA UTARA
PENGGUNAAN RUMEN SAPI SEBAGAI AKTIVATOR PADA PEMBUATAN KOMPOS DAUN LAMTORO (Leucaena leucocephala)
SKRIPSI
Diajukan untuk melengkapi tugas dan memenuhi syarat mencapai gelar Sarjana Sains.
HEPPY LOVE RIDA SINAGA 090822046
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS SUMATERA UTARA
PERSETUJUAN
Judul : PENGGUNAAH RUMEN SAPI SEBAGAI AKTIVATOR PADA PEMBUATAN KOMPOS DAUN LAMTORO
(Leucaena leucocephala)
Kategori : SKRIPSI
Nama : HEPPY LOVE RIDA SINAGA NIM : 090822046
Program Studi : SARJANA ( S1 ) EKSTENSI KIMIA Departemen : KIMIA
Fakultas : MATEMATIKA DAN ILMU PENGETAHUAN ALAM (FMIPA) UNIVERSITAS SUMATERA UTARA
Disetujui, Medan, Juli 2011
Komisi Pembimbing :
Dosen Pembimbing II Dosen Pembimbing I
Drs. Firman Sebayang, MS Jamahir Gultom, PhD NIP. 195607261985031001 NIP. 195209251977031001
Diketahui / Disetujui oleh
Departemen Kimia FMIPA USU Ketua,
PERNYATAAN
PENGGGUNAAN RUMEN SAPI SEBAGAI AKTIVATOR PADA PEMBUATAN KOMPOS DAUN LAMTORO (Leucaena leucocephala)
SKRIPSI
Saya mengakui bahwa skripsi ini adalah hasil kerja saya sendiri, kecuali beberapa kutipan dan ringkasan yang masing-masing disebutkan sumbernya.
Medan , Juli 2011
PENGHARGAAN
Puji dan syukur penulis panjatkan kehadirat Tuhan Yang Maha Kuasa, karena kasihNya yang luar biasa sehingga penulis dapat menyelesaikan penelitian dan menyusun skripsi ini..
Dalam kesempatan ini dengan segala kerendahan hati penulis menyampaikan ucapan terimakasih sebesar-besarnya kepada :
1. Orang Tua, abang dan adik-adikku tercinta yang telah mendukung penulis baik dalam doa ataupun materi dan memberi semangat bagi penulis sehingga penulis dapat menyelesaikan skripsi ini.
2. Bapak Jamahir Gultom, PhD selaku dosen pembimbing I dan Bapak Drs. Firman Sebayang selaku dosen pembimbing II yang telah memberikan perhatian, bimbingan, dan saran kepada penulis selama penelitian dan penyusunan skripsi. 3. Ibu DR. Rumondang Bulan, MS selaku ketua jurusan Kimia Fakultas Matematika
dan Ilmu Pengetahuan Alam Universitas Sumatera Utara.
4. Bapak Drs. Albert Pasaribu, M.Sc selaku sekretaris jurusan Kimia Fakultas Matematika dan Ilmu Pengetahuan Alam Universitas Sumatera Utara.
5. Buat seluruh staf dosen yang mengajar di jurusan Kimia Fakultas Matematika dan Ilmu Pengetahuan Alam Universitas Sumatera Utara.
6. Buat adek-adek kelompokku ( Martina dan Evi) yang telah mendoakan penulis dan yang selalu memberi semangat.
ABSTRAK
Telah dilakukan penelitian tentang penggunaan rumen sapi sebagai aktivator pada pembuatan kompos daun lamtoro (Leucaena leucocephala). Pengambilan sampel dilakukan secara acak dari Simalingkar B. Sampel terlebih dahulu dikeringkan sebelum dikomposkan dengan rumen sapi dengan waktu pengomposan 15 hari dan interval waktu analisis 3 hari. Penentuan C-organik dilakukan dengan metode Walkey Black, Nitrogen (N) dengan metode Kjehldahl, Posfor (P) sebagai P2O5 dengan
metode Spektrofotometeri dan Kalium (K) sebagai K2O dengan Spektrofotometer
Serapan Atom (SSA). Prosedur yang sama dilakukan terhadap sampel tanpa pengomposan. Hasil penelitian menunjukkan bahwa kadar C-organik pada sampel tanpa pengomposan dan setelah pengomposan 15 hari dengan interval waktu analisis 3 hari secara berurutan adalah 38,43%; 36,45%; 35,11%; 32,33%; 30,90% dan 28,95%. Kadar Nitrogen (N) pada daun lamtoro sebelum dan setelah pengomposan 15 hari secara berurutan adalah 2,81%; 3,13%; 3,05%; 3,00%; 3,07% dan 3,15%. Kadar Posfor sebagai P2O5 sebelum dan setelah pengomposan 15 hari secara
berurutan adalah 0,23%; 0,24%; 0,24%; 0,27%; 0,33% dan 0,34%. Kadar Kalium (K) sebagai K2O sebelum dan setelah pengomposan 15 hari secara berurutan adalah
THE USING OF COW RUMEN AS ACTIVATOR IN MAKING OF LAMTORO (Leucaena leucocephala) LEAF COMPOST
ABSTRACT
It had conduted a research about the using of cow rumen as activator in making of lamtoro (Leucaena leucocephala) leaf compost. The sample was took by random sampling from Simalingkar B. The sample was dried before make a compost with cow rumen during 15 days and the time interval of analysis iss 3 days. The determining of C-organic is conducted by Walkey Black, Nitrogen (N) with Kjehdahl method. Phosphor (P) as P2O5 by Spectrophotometer method and potassium (K) as (K2O) by
Atom Absorption Spectrophotometer. The same procedur is applied to the sample without composting. The result research indicted that the content of C-Organic on sample without composting and after composting in 15 days by time interval analysis 3 days in sequence are 38,43%; 36,45%; 35,11%; 32,33%; 30,90%; 28,95%. The Nitrogen (N) content on lamtoro leaf before an after composting in 15 days are 2,81%; 3,13% ; 3,05%; 3,00%; 3,07% and 3,15%. The content of Phosphor (P) as P2O5 before and after composting 15 days is 0,23%; 0,24%; 0,24%; 0,27%; 0,33%
and 0,34%. The content of Potassium (K) as K2O before and after composting 15 days
DAFTAR ISI
Halaman
PERSETUJUAN ii
PERNYATAAN iii
PENGHARGAAN iv
ABSTRAK v
ABSTRACT vi
DAFTAR ISI vii
DAFTAR TABEL x
DAFTAR GAMBAR xi
BAB 1 PENDAHULUAN
1.1. Latar Belakang 1
1.2. Permasalahan 2
1.3. Pembatasan Masalah 4
1.4. Tujuan Penelitian 4
1.5. Manfaat Penelitian 4
1.6. Lokasi Penelitian 4
1.7. Metodologi Penelitian 4
BAB 2 TINJAUN PUSTAKA
2.1. Lamtoro 6
2.5. Bahan Organik Tanah 13
2.6. Penentuan Kadar C – Organik 14
2.7. Nitrogen 15
2.8. Nisbah C/N 16
2.9. Penentuan Nitrogen Metode Kjehldahl 17
2.10. Penentuan P- Total 18
2.11. Penentuan Kalium 19
2.12. Rumen Sapi 20
2.12.1. Bakteri Rumen 21
2.12.2. Protozoa Rumen 21
BAB 3 BAHAN DAN METODE PENELITIAN
3.1. Alat - alat 23
3.2. Bahan – bahan 23
3.3. Prosedur Penelitian 24
3.3.1. Penyediaan Sampel Daun Lamtoro 24 3.3.2. Pembuatan Aktivator dari Rumen Sapi 24
3.3.3. Pembuatan Kompos 24
3.3.4. Pembuatan Pereaksi dan Larutan Standart 25 3.3.4.1. Pembuatan Pereaksi dan Larutan Standar untuk
Penentuan P-total Metode Spektrofotometri 25 3.3.4.2. Pembuatan Pereaksi untuk Penentuan C – Organik 26 3.3.4.3. Pembuatan Pereaksi untuk Penentuan Nitrogen
Metode Kjehldahl 27 3.3.4.3. Pembuatan Pereaksi untuk Kalium dengan SSA 28 3.3.5. Penentuan P – Total Metode Spektofotometri 29
3.3.5.1. Preparasi Sampel 29
3.3.5.2. Pembuatan Kurva Kalibrasi 29 3.3.5.3. Penentuan Kadar Posfor pada sample 29 3.3.6. Penentuan Kadar C – Organik dengan Metode
Walkey Black 29
3.3.7. Penentuan Nitrogen dengan Metode Kjehldahl 30 3.3.8. Penentuan Kalium dengan SSA 31
3.4. Bagan Penelitian 32
3.4.1. Pembuatan Kompos 32
3.4.2. Penentuan C – Organik dengan Metode Walkey Black 33 3.4.3. Penentuan Nitrogen dengan Metode Kjehldahl 34 3.4.4. Penentuan P – Total Metode Spektofotometri 35 3.4.4.1. Pengekstrak daun lamtoro 35 3.4.4.2. Pengukuran Absorbansi dari Larutan Standar P Untuk Kurva Kalibrasi 35 3.4.4.3. Pengukuran Absorbansi untuk Ekstrak Daun Lamtoro 36 3.4.5. Penentuan Kalium dengan Spektorfotometri Serapan Atom 37 BAB 4 HASIL DAN PEMBAHASAN
4.1. Hasil dan Pengolahan Data 38
4.1.6.2. Perhitungan Koefesien Korelasi 50 4.1.6.3. Perhitungan Standar Deviasi 52 4.1.6.4. Penentuan Batas Deteksi 52 4.1.6.5. Penentuan % K pada sampel 52 4.2. Pembahasan
BAB 5 KESIMPULAN DAN SARAN
5.1. Kesimpulan 57
5.2. Saran 57
DAFTAR PUSTAKA
DAFTAR TABEL
Halaman
Tabel 4.1. Data Volume FeSO4 0,9319 N yang Terpakai pada 38
Penentuan C – organik dengan Metode Walkey Black.
Tabel 4.2. Data Volume HCl 0,0112 N yang Terpakai pada Penentuan 39 Nitrogen dengan Metode Kjeldahl
Tabel 4.3. Data Absorbansi Pada Penentuan Posfor dengan Metode 39 Spektrofotometri dengan λ= 710 nm
Tabel 4.4. Data Absorbansi Pada Penentuan Kalium dengan Spektrofotomer 40 Serapan Atom (SSA) pada λ= 766,5 nm
Tabel 4.5. Data Pengukuran C – Organik dengan Metode Walkey Black 61 Tabel 4.6. Data Pengukuran Nitrogen dengan Metode Kjehldahl 61
Tabel 4.7. Data Nisbah C/N 61
Tabel 4.8. Data Pengukuran Posfor (P) dengan Metode Spektrofotometeri 62 Tabel 4.9. Data Pengukuran Kalium (K) dengan Spektrofotometer Serapan
Atom (SSA) 62
Tabel 4.10. Data Penentuan Panjang Gelombang Maksium dari Larutan
Standar 2,0 mg/L P 63
Tabel 5.1. Penentuan Kurva Kalibrasi 63
DAFTAR GAMBAR
Halaman
Gambar 1. Kurva Penentuan Panjang Gelombang Maksimum Larutan
Standar P Konsentrasi 2,0 mg / L 66 Gambar 2. Kurva Kalibrasi Larutan Standar Posfor ( P ) 66 Gambar 3. Kurva Kalibrasi Larutan Standar Kalium ( K ) 66
Gambar 4. Tumbuhan Lamtoro 67
ABSTRAK
Telah dilakukan penelitian tentang penggunaan rumen sapi sebagai aktivator pada pembuatan kompos daun lamtoro (Leucaena leucocephala). Pengambilan sampel dilakukan secara acak dari Simalingkar B. Sampel terlebih dahulu dikeringkan sebelum dikomposkan dengan rumen sapi dengan waktu pengomposan 15 hari dan interval waktu analisis 3 hari. Penentuan C-organik dilakukan dengan metode Walkey Black, Nitrogen (N) dengan metode Kjehldahl, Posfor (P) sebagai P2O5 dengan
metode Spektrofotometeri dan Kalium (K) sebagai K2O dengan Spektrofotometer
Serapan Atom (SSA). Prosedur yang sama dilakukan terhadap sampel tanpa pengomposan. Hasil penelitian menunjukkan bahwa kadar C-organik pada sampel tanpa pengomposan dan setelah pengomposan 15 hari dengan interval waktu analisis 3 hari secara berurutan adalah 38,43%; 36,45%; 35,11%; 32,33%; 30,90% dan 28,95%. Kadar Nitrogen (N) pada daun lamtoro sebelum dan setelah pengomposan 15 hari secara berurutan adalah 2,81%; 3,13%; 3,05%; 3,00%; 3,07% dan 3,15%. Kadar Posfor sebagai P2O5 sebelum dan setelah pengomposan 15 hari secara
berurutan adalah 0,23%; 0,24%; 0,24%; 0,27%; 0,33% dan 0,34%. Kadar Kalium (K) sebagai K2O sebelum dan setelah pengomposan 15 hari secara berurutan adalah
THE USING OF COW RUMEN AS ACTIVATOR IN MAKING OF LAMTORO (Leucaena leucocephala) LEAF COMPOST
ABSTRACT
It had conduted a research about the using of cow rumen as activator in making of lamtoro (Leucaena leucocephala) leaf compost. The sample was took by random sampling from Simalingkar B. The sample was dried before make a compost with cow rumen during 15 days and the time interval of analysis iss 3 days. The determining of C-organic is conducted by Walkey Black, Nitrogen (N) with Kjehdahl method. Phosphor (P) as P2O5 by Spectrophotometer method and potassium (K) as (K2O) by
Atom Absorption Spectrophotometer. The same procedur is applied to the sample without composting. The result research indicted that the content of C-Organic on sample without composting and after composting in 15 days by time interval analysis 3 days in sequence are 38,43%; 36,45%; 35,11%; 32,33%; 30,90%; 28,95%. The Nitrogen (N) content on lamtoro leaf before an after composting in 15 days are 2,81%; 3,13% ; 3,05%; 3,00%; 3,07% and 3,15%. The content of Phosphor (P) as P2O5 before and after composting 15 days is 0,23%; 0,24%; 0,24%; 0,27%; 0,33%
and 0,34%. The content of Potassium (K) as K2O before and after composting 15 days
BAB 1
PENDAHULUAN
1.1. Latar Belakang
Dalam kondisi saat ini pemahaman masyarakat tentang pupuk semakin baik dimana permintaan pupuk organik di Sumatera Utara terus meningkat setiap tahunnya. Dengan semakin meningkatnya permintaan pupuk organik tersebut otomatis masyarakat tidak lagi ketergantungan dengan pupuk kimia yang dapat menghilangkan unsur hara dalam tanah juga dapat menurunkan produksi tanaman. Kepala Dinas Pertanian Sumut Mohammad Room menerangkan bahwa untuk memulihkan kondisi tanah tersebut perlu kembali disiram dengan pupuk organik yang berasal dari tumbuhan, kotoran ternak, dan lainnya sehingga dapat mengembalikan kesuburan tanah. Beliau berharap agar petani dapat membuat pupuk organik setidaknya untuk kebutuhan produksinya sendiri karena keterbatasan pupuk organik yang tersedia (Room, 2011).
kapsitas tukar kation (KTK), ketersediaan unsur hara, dan ketersediaan asam humat. Secara biologi, kompos yang tidak lain bahan organik ini merupakan sumber makanan bagi mikroorganisme tanah. Dengan adanya kompos, fungi, bakteri, serta mikroorganisme yang menguntungkan akan berkembang secara cepat. Banyaknya mikroorganisme tanah yang menguntungkan dapat menambah kesuburan tanah (Simamora, 2006).
Pembuatan kompos dengan menggunakan aktivator sudah banyak beredar di pasaran diantaranya EM4 (Effective Microorganisms), orgadec dan stardec. Pada dasarnya aktivator ini adalah mikroorganisme yang berada dalam cairan bahan penumbuh, apabila cairan yang berisi mikroorganisme dilarutkan air dan dicampurkan kedalam bahan yang akan dikomposkan maka dengan cepat mikroorganisme ini berkembang. Sebenarnya aktivator ini dapat dibuat sendiri yaitu dengan mengembangbiakkan mikroorganisme yang berasal dari perut (kolon, usus) hewan ruminansia, misalnya sapi atau kerbau (Isniani, 2006). Bakteri rumen sapi terdiri dari kumpulan beberapa mikroorganisme yang sangat bermanfaat dalam proses pengolahan pupuk kandang, kompos, pupuk organik cair, dan sekaligus mampu memperbaiki tingkat kesuburan tanah. Keunggulan bakteri rumen sapi antara lain : dapat dibuat sendiri, bahan tersedia dan mudah didapatkan, peralatan cukup sederhana, sangat berguna bagi petani
Berdasarkan hasil isolasi dan identifikasi mikroba yang terkandung dalam cairan rumen diperoleh bakteri xilanolitik yaitu : Bacillus, Cellumonas, Lactobacillus,
Pseudomonas dan Acinetobakter sp (Lamid. 2006. Jurnal Universitas Airlangga).
Hasil pengamatan yang dilakukan oleh Rahayu. 2003 (Jurnal Fakultas Peternakan Universitas Jendral Soedirman Purwokerto) selama isolasi menunjukkan bahwa populasi terbesar adalah bakteri anaerobik dan sejumlah kecil bakteri aerobik.
rumen sapi yang diaktifkan terbukti telah meningkatkan C-organik, Nitrogen, Posfor, dan Kalium. Secara umum daun lamtoro mengandung unsur hara Nitrogen, Fosfor, dan Kalium (Sutanto, 2002). Semua unsur hara yang terkandung merupakan unsur hara essensial yang sangat dibutuhkan oleh tanaman dalam pertumbuhan dan perkembangannya (Sutedjo, 2002).
Tumbuhan lamtoro (Leucaena leucocephala) adalah tumbuhan yang biasa ditemukan di pekarangan sebagai tanaman pagar atau tanaman peneduh dan tumbuh liar, berasal dari Sumatera Utara. Keberadaan tumbuhan tersebut terdapat di daerah Simalingkar B, Kabupaten Karo, Deli Serdang, Tapanuli Utara, dan Samosir tumbuh di sepanjang pinggir jalan bahkan ada yang tumbuh dilereng bukit dan gunung. Oleh karena itu, penulis tertarik untuk melakukan penelitian terhadap daun lamtoro dengan tujuan pembuatan kompos yang bermanfaat bagi masyarakat petani dengan penambahan rumen sapi sebagai aktivator yang dapat dibuat dengan mudah. Dengan melakukan penelitian diharapkan dapat memperoleh pupuk kompos yang kaya akan kandungan C–Organik, Nitrogen, Posfor dan Kalium.
1.2. Permasalahan
1. Berapakah kandungan C-Organik, Nitrogen, Posfor, dan Kalium pada Daun Lamtoro (Leucaena leucocephala) sebelum dan sesudah dikomposkan 2. Berapa waktu optimum yang dibutuhkan untuk pengomposan Daun Lamtoro
(Leucaena leucocephala) dengan menambahkan rumen sapi.
3. Apakah Daun Lamtoro (Leucaena leucocephala) dapat digunakan sebagai bahan baku pupuk organik berdasarkan kandungan C-Organik, Nitrogen, Posfor dan Kalium.
Penelitian ini dibatasi pada penentuan C-Organik, Nitrogen, Posfor dan Kalium pada Daun Lamtoro (Leucaena leucocephala) sebelum pengomposan dan sesudah pengomposan.
1.4. Tujuan Penelitian
1. Untuk mengetahui kadar C-Organik, Nitrogen, Posfor dan Kalium didalam Daun Lamtoro (Leucaena leucocephala) sebelum dikomposkan dan sesudah dikomposkan sehingga dapat diketahui apakah Daun Lamtoro (Leucaena
leucocephala) dapat digunakan sebagai bahan baku pupuk organik.
2. Pembuatan kompos daun lamtoro dengan menggunakan rumen sapi sebagai aktivator
1.5. Manfaat Penelitian
1. Hasil Penelitian ini dapat digunakan sebagai informasi yang berguna untuk pembuatan pupuk organik.
2. Diharapkan masyarakat dapat memanfaatkan Daun Lamtoro (Leucaena
leucocephala) sebagai bahan baku pupuk organik.
1.6. Lokasi Penelitian
Penelitian dilakukan di Laboratorium Kimia Analitik dan Laboratorium Sentral Fakultas Pertanian Universitas Sumatera Utara.
1.7. Metodologi Penelitian
1. Penelitian ini merupakan eksperimen laboratorium.
2. Sampel Daun Lamtoro (Leucaena leucocephala) diambil secara acak di daerah Simalingkar B.
4. Penentuan C-Organik, Nitrogen, Posfor, dan Kalium ditentukan sebelum dan sesudah pengomposan (dengan interval waktu penentuan 3, 6, 9, 12, dan 15 hari). 5. Penentuan C-Organik dilakukan dengan metode Walkey Black.
6. Penentuan Nitrogen dilakukan dengan metode Kjehldahl.
7. Penentuan Posfor (P) dilakukan dengan menggunakan metode spektrofotometri 8. Penentuan Kalium (K) dilakukan dengan menggunakan Spektrofotometer Serapan
BAB 2
TINJAUAN PUSTAKA
2.1. Lamtoro
Kingdom : Plantae
Subkingdom : Tracheobionta Divisi : Magnoliophyta Kelas : Magnoliopsida Sub Kelas : Rosidae Ordo : Fabales Famili : Fabaceae
Spesies : Leucaena leucocephala
Nama umum Indonesia : Petai cina, Kemlandingan, Lamtoro, Lamtoro gung (Jawa), Peuteuy selong
Lamtoro (Leucaena leucocephala) adalah tumbuhan yang biasa ditemukan di pekarangan sebagai tanaman pagar atau tanaman peneduh dan kadang tumbah liar.
Leucaena leucocephala merupakan tumbuhan berkayu (lignaceus) atau merupakan
tumbuhan yang memiliki batang pohon keras dan berukuran tidak besar. Tingginya mencapai 2-10 m, ranting berbentuk bulat silindris, dan ujungnya berambut rapat. Daunnya majemuk, menyirip genap ganda. Anak daun ukurannya kecil-kecil, terdiri dari 5-20 pasang, berbentuk bulat lanset, ujung runcing, tepi rata. Bunganya berbentuk bonggol yang bertangkai panjang berwarna putih kekuningan dan terangkai dalam karangan bunga majemuk. Bunganya yang berjambul warna putih sering disebut cengkaruk. Buahnya mirip dengan buah petai, namun ukurannya jauh lebih kecil dan berpenampang lebih tipis.
Secara umum daun lamtoro mengandung unsur hara Nitrogen, Fosfor, dan Kalium (Sutanto, 2002). Semua unsur hara yang terkandung merupakan unsur hara essensial yang sangat dibutuhkan oleh tanaman dalam pertumbuhan dan perkembangannya. Unsur hara makro sangat dibutuhkan untuk pertumbuhan-pertumbuhan bagian-bagian vegetatif tanaman seperti akar, batang dan daun, dan apabila ketersediaan unsur makro dan mikro tidak lengkap dapat menghambat pertumbuhan dan perkembangan tanaman (Sutedjo, 1992).
2.2. Pupuk Organik
Pupuk organik berasal dari pelapukan sisa-sisa mahkluk hidup, seperti tanaman, hewan, dan manusia serta kotoran hewan. Pupuk ini umumnya merupakan pupuk lengkap karena mengandung unsur hara makro dan mikro meskipun dalam jumlah yang sedikit. Walaupun demikian, pupuk organik lebih unggul dibandingkan pupuk anorganik karena beberapa hal sebagai berikut :
a. Memperbaiki struktur tanah. Bahan organik dapat mengikat butir-butir tanah menjadi butiran yang lebih besar dan remah sehingga tanah menjadi lebih gembur.
b. Menaikkan daya serap tanah terhadap air. Bahan organik dapat mengikat air lebih banyak dan lebih lama.
c. Menaikkan kondisi kehidupan di dalam tanah. Jasad renik dalam tanah amat berperan dalam perubahan bahan organik. Dengan adanya pupuk organik, jasad renik tersebut aktif menguraikannya sehingga pupuk organik mudah diserap tanaman.
d. Sumber makanan bagi tanaman. Walaupun dalam jumlah sedikit, pupuk organik mengandung unsur hara yang lengkap.
2.3. Humus dan Kompos
2.3.1. Humus
Humus adalah sisa tumbuhan berupa daun, akar, cabang, dan batang yang sudah membusuk secara alami lewat bantuan mikroorganisme di dalam tanah dan cuaca diatas tanah. Ciri khas humus adalah berwarna hitam sampai cokelat tua sifatnya tidak berbeda dengan kompos, yaitu mudah mengikat dan merembeskan air, dan gembur. Itulah sebabnya humus sangat berguna untuk memperbaiki keadaan tanah yang tidak beres. Sayangnya humus sangat sulit dicari. Satu-satunya cara yang biasa digunakan ialah menanam pupuk hijau di lahan. Dengan membenamkan pupuk hijau di dalam tanah maka akan terjadi pembusukan sehingga membentuk humus.
Pembentukan humus di alam berjalan dalam kondisi tidak terkendali. Mikroba aerobik dan anaerobik saling bergantian mengambil peran sesuai kondisi lingkungannya. Faktor utama yang menyebabkan pergantian kedua jenis bakteri tersebut adalah ada atau tidaknya oksigen. Hal inilah yang mengakibatkan jangka waktu pembentukan humus relatif lama (Lingga, 2008).
2.3.2. Kompos
Kompos merupakan salah satu jenis pupuk organik alami yang banyak dikenal oleh petani. Istilah kompos lazim digunakan untuk pupuk organik yang berasal dari daun atau bagian tanaman lainnya. Setelah dilapukkan, daun atau bagian tanaman lain akan menjadi bahan yang berbeda dengan asalnya dan sebagai penyedia unsur hara bagi tanaman. Selain sisa tanaman, untuk membuat kompos dapat juga digunakan sampah kota atau sampah rumah tangga.
Penjelasan lengkap mengenai proses yang terjadi adalah sebagai berikut : a. Hidrat arang (selulosa, hemiselulosa dan lain-lain) diurai menjadi CO2 dan
air atau CH4 dan H2
b. Zat putih telur diurai melalui amida-amida, asam-asam amino, menjadi amoniak, CO2 dan air
c. Berbagai jenis unsur hara terutama N di samping P dan K dan lain-lain, sebagai hasil uraian, akan terikat dalam tubuh jasad renik dan sebagian yang terikat menjadi tersedia di dalam tanah. Apa yang terikat ini kelak akan dikembalikan ke dalam tanah setelah jasad-jasad renik mati.
d. Juga ada unsur-unsur hara dari senyawa organik yang akan terbebas menjadi senyawa anorganik sehingga menjadi persediaan didalam tanah bagi keperluan pertumbuhan dan perkembangan tanaman.
e. Lemak dan lilin akan terurai menjadi CO2 dan air (Sigit, 2001).
Akibat dari perubahan tersebut, berat dan volume kompos menjadi sangat berkurang. Sebagian besar senyawa organik akan hilang, menguap ke udara. Kadar senyawa-senyawa N yang larut (ammoniak) meningkat (Murdandono, 1995).
2.3.1. Syarat Pembuatan Kompos
a. Campuran kompos harus homogen agar kadar N dan kecepatan fermentasi dapat merata dan tetap. Oleh karena itu bahan mentah perlu dipotong-potong hingga menjadi bagian - bagian kecil.
b. Temperatur awal harus tinggi untuk membunuh patogen, biji rumput – rumputan, lalat dan telurnya, serta larva hama lain beserta penyakit (cendawan) yang terbawa ke dalam tumpukan (Yuliarti, 2009).
2.3.2. Faktor yang mempengaruhi proses pengomposan
1. Nilai C/N bahan
Semakin rendah nilai C/N bahan, waktu yang diperlukan untuk pengomposan semakin singkat.
2. Ukuran bahan
Bahan yang berukuran lebih kecil akan lebih cepat proses pengomposannya karena semakin luas bahan yang tersentuh dengan bakteri. Untuk itu, bahan organik perlu dicacah sehingga berukuran kecil.
3. Jumlah mikroorganisme
Biasanya dalam proses ini bekerja bakteri, fungi, aktinomycetes dan protozoa. Sering ditambahkan pula mikroorganisme kedalam bahan yang akan dikomposkan. Dengan bertambahnya jumlah mikroorganisme, diharapkan proses pengomposan akan lebih cepat.
4. Kelembapan dan Aerasi
Umumnya mikroorganisme tersebut dapat bekerja dengan kelembapan sekitar 40-60%. Kondisi tersebut perlu dijaga agar mikroorganisme dapat bekerja secara optimal. Kelembapan yang lebih rendah atau tinggi dapat menyebabkan mikroorganisme tidak berkembang atau mati. Adapun kebutuhan aerasi tergantung dari proses berlangsungnya pengomposan tersebut aerobik atau anaerobik.
5. Temperatur
Temperatur optimal sekitar 30-500C (hangat). Bila temperatur terlalu tinggi mikroorganisme akan mati. Bila temperatur relatif rendah mikroorganisme belum dapat bekerja atau dalam keadaan dorman. Aktivitas mikroorganisme dalam proses pengomposan tersebut juga menghasilkan panas sehingga untuk menjaga temperatur tetap optimal sering dilakukan.
6. Keasaman
2.3.3. Proses Pengomposan
Campuran bahan yang sudah ditambah bioaktivator difermentasi dengan cara menutupnya dengan menggunakan terval dan membiarkannya selama 5-7 hari. Pada hari kedua dan ketiga, temperatur bahan kompos akan meningkat menjadi 40-600C. Jika temperatur meningkat, tumpukan bahan tersebut harus dibalik, kemudian ditutup lagi. Tiga hari kemudian temperatur akan turun kembali dan berangsur-angsur stabil. Jika temperatur sudah stabil, bahan tersebut sudah menjadi kompos dan siap dikemas atau digunakan (Sofian, 2006).
2.3.4. Mekanisme Pengomposan
Ada dua mekanisme pengomposan yaitu aerob dan anaerob. Secara aerob oksigen dan air dibutuhkan untuk merombak senyawa organik dan mengasimilasi senyawa karbon, nitrogen, Posfor, belerang dan unsur lainnya untuk sintesa protoplasma. Proses pengomposan aerob menghasilkan humus, CO2, dan asam organik yang memiliki
bobot rendah seperti asam asetat, asam propinoat, asam butirat, asam laktat, dan asam suksinat (Djuarnani, 2005).
Reaksi – reaksi yang terjadi pada proses pengomposan yaitu : Reduksi sulfat :
CH3CHOHCOOH + SO42- 2CH3COOH + H2S + 2OH-
4 H2 + SO42- 2H2O + H2S + 2OH-
Reduksi karbon organik secara anaerobik :
CH3COOH CH4 + CO2
4CH3OH 3CH4 + CO2 + 2H2O
C6H12O6 bakteri 3CH3COOH
C6H12O6 Kapang 2CH3CH2OH + 2CO2
Reduksi karbon dioksida :
2CH3CH2OH + CO2 2CH3COOH + CH4
4H2 + CO2 CH4 + 2H2O
4H2 + 2CO2 CH3COOH + 2H2O
CH3COOH + 2O2 CO2 + 2H2O
2H2 + O2 CO2 + 2H2O
CH4 + 2O2 CO2 + 2H2O
(Judoamidjojo, 1992)
Reaksi aminasi :
Protein proses enzimatik Senyawa asam amino kompleks + O2 + amina
R – NH2 + HO hidrolisa enzim R – OH + NH3 + energi
Reaksi amonifikasi :
2NH3 + H2CO3 (NH4)2CO3 2NH4+ + CO3
2-Reaksi Nitrifikasi:
NH4+ + O NO2- + H2O + H+ + Energi
NO2 + O2 NO3- + Energi
(Sutedjo, 2002)
2.4. Manfaat Kompos
Kompos sangat berperan dalam proses pertumbuhan tanaman. Kompos tidak hanya menambah unsur hara, tetapi juga menjaga fungsi tanah sehingga tanaman dapat tumbuh dengan baik. Manfaat kompos bagi tanaman adalah :
- Kompos memperbaiki struktur tanah
- Kompos memberikan nutrisi bagi tanaman
Berdasarkan jumlah yang dibutuhkan tanaman, unsur hara yang diperlukan tanaman dibagi menjadi dua golonngan.
Unsur hara makro adalah unsur hara yang dibutuhkan dalam jumlah banyak seperti Nitrogen (N), Posfor (P), dan Kalium (K).
Unsur hara mikro yaitu unsur hara yang dibutuhkan dalam jumlah yang sedikit seperti Kalsium (Ca), Magnesium (Mg), Belerang (S), Besi (Fe), Mangan (Mn), Klor (Cl), Molibdenum (Mo), dan lain-lain.
- Kompos meningkatkan kapasitas tukar kation
K apasitas tukar kation (KTK) adalah sifat kimia yang berkaitan erat dengan kesuburan tanah.Tanah dengan KTK tinggi lebih mampu menyediakan unsur hara daripada tanah dengan KTK rendah.
- Kompos meningkatkan aktivitas biologi tanah
Kompos berisi mikroorganisme yang menguntungkan tanaman. Jika berada di dalam tanah, kompos akan membantu kehidupan mikroorganisme di dalam tanah. Selain berisi bakteri dan jamur dekomposer, keberadaan kompos akan membuat tanah menjadi sejuk, kondisi ini disenangi oleh mikroorganisme.
- Kompos menambah kemampuan tanah untuk menahan air
Tanah mempunyai pori-pori, yaitu suatu bagian yang tidak berisi bahan padat. Bagian yang tidak terisi ini akan diisi oleh air dan udara. Tanah yang bercampur dengan bahan organik seperti kompos mempunyai pori-pori dengan daya rekat yang lebih baik sehingga mampu mengikat serta menahan ketersediaan air didalam tanah. Kompos dapat menahan erosi secara langsung.
- Kompos meningkatkan unsur hara makro
- Kompos tidak menimbulkan masalah lingkungan
Pupuk kimia dapat menimbulkan masalah lingkungan yaitu dapat merusak keadaan tanah dan air, sedangkan kompos justru memperbaiki sifat tanah dan lingkungan (Yuwono, 2006).
2.5. Bahan Organik Tanah
Sumber bahan organik tanah adalah jaringan tanaman baik yang berupa serasah atau sisa tanaman yang berupa batang, akar atau daun yang kemudian dirombak oleh mikroorganisme tanah, atau sisa hewan yang berupa kotoran maupun bangkai hewan. Secara kimiawi bahan organik tanah tersusun atas karbohidrat, protein, lignin dan sejumlah senyawa kecil seperti lemak, lilin dan sebagainya. Salah satu hasil perombakan bahan organik adalah humus, yang mempunyai kapasitas pengikatan unsur hara dan air yang sangat tinggi, meniliki kekhususan koloidal dan mampu mengikat air 80-90% dari berat keringnya, bandingkan dengan tanah liat yang hanya mengikat air 15-20%. Humus memberi warna tanah menjadi agak kehitaman dan sangat bermanfaat bagi pertanian karena mempengaruhi struktur tanah.
Bahan organik dalam tanah sangat berhubungan dengan kecepatan pelapukannya. Bahan organik yang mempunyai C/N rasio rendah akan lebih cepat melapuk dibandingkan bahan organik yang mempunyai C/N rasio yang tinggi. Dalam perombakan dan pelapukan oleh mikroorganisme itu akan membebaskan unsur-unsur penyusun bahan organik. Senyawa karbon yang ada misalnya, tidak teroksidasi semuanya dan dilepaskan tetapi sebagian diasimilasi dalam tubuh mekroorganisme. Kandungan bahan organik dalam tanah juga berpengaruh terhadap warna tanah, makin tinggi kandungan bahan organiknya maka warna tanah semakin kelam atau gelap. Selain kandungan bahan organik warna tanah juga dipengaruhi oleh kadar lengas atau tingkat pengikatan air, semakin lembab atau basah maka warnanya semakin gelap (Isnaini, 2006).
2.6. Penentuan C-Organik Dengan Metode Walkey Black
yang tidak terdekomposisi menjadi humus yang berwarna coklat sampai hitam dan bersifat koloidal. Pengukuran kandungan bahan organik tanah berdasarkan jumlah organik yang mudah teroksidasi dan mereduksi Cr2O72- yang diberikan secara
berlebihan. Terjadi reaksi ini karena adanya panas yang dihasilkan oleh reaksi H2SO4
pekat dan K2Cr2O7. Keadaan ini menyebabkan Cr6+ direduksi oleh C-organik menjadi
warna hijau dari Cr3+ (Suin, 2002).
Teknik penetapan C-organik yang paling standar adalah oksidasi bahan organik oleh dikromat yang mana metode ini lebih sering disebut metode Walkey dan Black. Dalam prosedurnya Kalium dikromat (K2Cr2O7) dan asam sulfat (H2SO4)
ditambahkan kedalam bahan organik, dimana larutan tersebut harus didinginkan terlebih dahulu sebelum ditambahkan dengan air. Penambahan asam pospat (H3PO4)
kedalam larutan tersebut berguna untuk mengurangi interferensi dari Fe3+ yang mungkin sering terjadi.
Persamaan reaksinya adalah sebagai berikut :
Prosedur dari Walkey dan black ini sangat luas digunakan, sederhana, cepat dan tidak memerlukan peralatan yang mahal, akan tetapi prosedur ini hasil oksidasi tidak dapat mencapai hasil yang optimal, yang mana prosedur tersebut hanya mampu mengoksidasi bahan organik antara 60% - 75% (Zimmerman, 1997).
2.7. Nitrogen
Nitrogen diserap tanaman dalam bentuk ion nitrat (NO3-) dan ion amonium (NH4-).
Sebagian besar nitrogen diserap dalam bentuk ion nitrat karena ion tersebut bermuatan negatif sehingga selalu berada di dalam larutan tanah dan mudah terserap oleh akar. Karena selalu berada dalam larutan tanah, ion nitrat lebih mudah tercuci oleh aliran air. Arah pencucian menuju lapisan dibawah daerah perakaran sehingga tidak dapat dimanfaatkan oleh tanaman. Sebaliknya, ion amonium bermuatan positif sehingga terikat oleh koloid tanah. Ion tersebut dapat dimanfaatkan oleh tanaman setelah melalui proses pertukaran kation. Karena bermuatan positif, ion amonium tidak mudah hilang oleh proses pencucian.
Nitrogen dapat kembali ke tanah melalui pelapukan sisa makhluk hidup (bahan organik). Nitrogen yang berasal dari bahan organik ini dapat dimanfaatkan
oleh tanaman setelah melalui tiga tahap reaksi yang melibatkan aktivitas mikroorganisme tanah. Tahap reaksi tersebut sebagai berikut :
- Penguraian protein yang terdapat pada bahan organik menjadi asam amino.Tahap ini disebut reaksi aminasi
- Perubahan asam amino menjadi senyawa-senyawa amonia (NH3) dan
Amonium (NH4+). Tahap ini disebut amonifikasi
- Perubahan senyawa amonia menjadi nitrat yang disebabkan oleh bakteri Nitrosomonas dan nitrosococus. Tahap ini disebut reaksi nitrifikasi.
Proses pengurain protein secara enzimatik menjadi amonium dilakukan oleh mikroba heterotropik. Amonium merupakan ion tersedia sehingga jika tidak diakumulasi tanaman atau mikroba maka akan hilang melalui pencucian dan volatilisasi dalam bentuk gas amonia, atau mengalami nitrifikasi yang menghasilkan nitrit (NO2-) yang merupakan anion toksit, dilakukan oleh nitrosomonas sp, kemudian
dilanjutkan ke nitrasi yang menghasilkan nitrat (NO3-) yang juga tersedia merupakan
N tersedia oleh bakteri nitrobacter sp (Hanafiah, 2005). 2.8. Nisbah C/N
Nisbah Carbon dan Nitrogen (nisbah C/N) sangat penting dalam memasok hara yon ang diperlukan mikroorganisme selama proses pengomposan berlangsung. Karbon diperlukan oleh mikroorganisme sebagai sumber energi dan nitrogen diperlukan untuk membentuk protein. Mikroorganisme akan membentuk protein. Mikroorganisme akan mengikat nitrogen tetapi tergantung pada ketersediaan karbon. Bila ketersediaan karbon terbatas (nisbah C/N terlalu rendah) tidak cukup senyawa sebagai sumber energi yang dimanfaatkan mikroorganisme untuk mengikat nitrogen bebas. Dalam hal ini jumlah nitrogen bebas dilepaskan dalam bentuk gas NH3 dan kompos yang
dihasilkan mempunyai kualitas rendah. Apabila ketersediaan karbon berlebih (C/N>40) jumlah nitrogennya sangat terbatas sehingga menjadi faktor pembatas pertumbuhan mikroorganisme.
cukup besar juga menunjukkan sebagai bahan bakar yang sukar terdekomposisi, sedangkan nisbah C/N rendah relatif menunjukkan persentase yang lebih besar daripada bahan yang mudah terdekomposisi (Sutanto, 2002).
Bila bahan organik yang memiliki rasio C/N tinggi tidak dikomposkan terlebih dahulu (langsungb diberikan ketanah) maka proses penguraiannya akan terjadi di tanah, ini tentu kurang baik karena proses penguraian bahan segar dalam tanah biasanya berjalan cepat karena kandungan air dan udaranya cukup. Akibatnya, CO2
dalam tanah meningkat sehingga dapat berpengaruh buruk bagi pertumbuhan tanaman. Bahkan, untuk tanah ringan dapat mengakibatkan daya ikatnya terhadap air semakin kecil serta srtuktur tanahnya menjadi kasar dan berserat (Lingga,2004).
Nisbah C/N bahan organik merupakan indikator ketersediaan hara yang dikandunganya, N-mineral hanya tersedia bagi tanaman apabila nisbah ini skitar 20 : 1 atau lebih kecil lagi, nisbah yang lebih besar menunjukkan bahwa N-mineral hanya cukup atau malahan lebih rendah ketimbang yang dimobilisasi oleh mikroba dekomposer untuk perkembangan dan aktivitasnya. Fenomena inilah yang menyebabkan sering terjadinya defisiensi atau tidak efisiennya pemupukan N di lapangan apabila kita memberikan bahan organik bernisbah C/N tinggi. Nisbah C/N bahan organik yang ideal adalah yang mendekati C/N tanah subu, yaitu 10 : 1 (Hanafiah, 2005).
2.9. Penentuan Nitrogen Dengan Metode Kjehldahl
Cara ini terutama penting dalam penentuan kadar protein. Pada dasarnya, bahan dasarnya, bahan dioksidasi dengan asam sulfat pekat panas hingga hancur. Tahap ini disebut tahap digestion. Disini nitrogen diubah menjadi ammonium. Pada tahap berikutnya, larutan ditambah basa kuat sehingga bereaksi basa lalu didestilasi. Hasil destilasi ditampung dengan HCl baku yang tertentu jumlahnya untuk mengikat NH3
Selisih HCl yang ditambahkan dengan yang dititrasi merupakn jumlah yang diikat NH3 sehingga dapat dihitung sebagai NH3 yang terdestilasi dan dengan
demikian N di dalam analit. Reaksi – reaksi :
a. Protein + oksidator NH4+ + CO2 + H2O + lain-lain
(digestion)
b. NH4+ + OH- NH3 + H2O ( destilasi )
c. NH3 + HCl berlebih NH4Cl ( penampungan )
d. HClsisa + NaOH NaCl + H2O ( titrasi )
atau :
e. NH3 + H3BO4 NH4H2BO4 ( penampungan )
f. NH4H2BO4 + HCl H3BO4 + NH4Cl ( titrasi )
(Harjadi, 1993). 2.10. Posfor
Fosfor diserap tanaman dalam bentuk H2PO4-, HPO4-2 dan PO4-2, atau tergantung dari
nilai pH tanah. Posfor sebagian besar berasal dari pelapukan batuan mineral alami, sisanya berasal dari pelapukan bahan organik. Walaupun sumber posfor di dalam tanah mineral cukup banyak, tanaman masih bisa mengalami kekurangan posfor. Pasalnya, sebagian besar posfor terikat secara kimia oleh unsur lain sehingga menjadi senyawa yang sukar larut di dalam air. Mungkin 1% posfor yang dapat dimanfaatkan tanaman.
Selain pH, faktor lain yang menentukan pasokan posfor pada tanah adalah sebagai berikut :
- Aerasi. Ketersedian oksigen didalam tanah (aerasi) diperlukan untuk meningkat pasokan posfor lewat proses perombakan bahan organik oleh mikroorganisme tanah. Pada tanah yang padat atau tergenang air, penyerapan posfor dan unsur-unsur lainnya akan terganggu.
akan meningkat karena proses perombakan bahan organik juga meningkat. Ketersediaan posfor menipis pada suhu rendah.
- Bahan organik. Sebagian posfor yang mudah larut diambil oleh mikroorganisme tanah pada pertumbuhannya. Posfor ini akhirnya akan diubah menjadi humus. Karena itu, untuk menyediakan cukup posfor, kondisi tanah yang menguntungkan bagi pertumbuhan mikroorganisme tanah perlu dipertahankan.
- Unsur hara lain. Tercukupinya jumlah unsur hara lain dapat meningkatkan penyerapan posfor. Ammonium yang berasal dari nitrogen dapat meningkatkan penyerapan posfor. Kekurangan unsur hara mikro dapat menghambat respon tanaman terhadap pemupukan posfor.
Pemupukan posfor dapat merangsang pertumbuhan awal bibit tanaman. Posfor merangsang pertumbuhan bunga, buah dan biji. Bahkan mampu mempercepat pemasakan buah dan membuat biji menjadi lebih bernas. Pemupukan posfor sangat diperlukan oleh tanaman yang tumbuh didaerah dingin, tanaman dengan perkembangan akar yang lambat atau terhambat, dan tanaman yang seluruh bagiannya dipanen.
Jika terjadi kekurangan posfor, tanaman menunjukkan gejala pertumbuhan sebagai berikut :
- Perkembangan akar terhambat
- Gejala pada daun sangat beragam, beberapa tanaman menunjukkan warna hijau tua mengilap yang tidak normal.
- Pematangan buah terhambat
2.11. Kalium
Kalium diserap oleh tanaman dalam bentuk ion K+. Di dalam tanah, ion tersebut bersifat sangat dinamis. Tak mengherankan jika mudah tercuci pada tanah berpasir dan tanah dengan pH rendah, dari ketiga unsur hara yang paling banyak diserap oleh tanaman (N,P,K), kaliumlah yang jumlahnya paling melimpah di permukaan bumi. Dalam hal ini dapat pula ditegaskan bahwa kalium berperan membantu :
- pembentukan protein dan karbohidrat
- Mengeraskan jerami dan bagian kayu dari tanaman - Meningkatkan resistensi tanaman terhadap penyakit
- Mengaktifkan sejumlah besar enzim yang berperan penting dalam metabolisme tanaman
- Meningkatkan kualitas biji/buah (Novizan, 2002).
Defisiensi unsur K menyebabkan tanaman tampak kerdil, internoda antar ruas memendek, ujung dan tepi daun menjadi hitam dan seperti hangus (scorch), tepi daun melekuk kebawah yang dimulai dari daun terbawah, tanaman mudah rebah dan retan terhadap serangan penyakit, serta produksi buah menurun yang diikuti dengan penurunan kualitas. Selian itu, tanaman menjadi rentan terhadap kelebihan amonium dengan gejala klorosis atau berbintik hitam yang tersebar di permukaan daun, khususnya pada tanaman dikotil. Pada tanaman monokotil, ujung dan tepi daun mengering (Sutiyoso, 2003).
2.12. Rumen Sapi
2.12.1. Bakteri Rumen
Dilihat dari fungsinya, bakteri dalam rumen terdiri atas beberapa kelompok bakteri yang berperan dalam memfermentasikan bahan makanan ialah :
a. Kelompok Pencerna Selulosa
Bakteri ini menghasilkan enzim yang dapat menghidrolisis ikatan glukosida β 1,4, selulosa dan dimer selobiosa. Sepanjang yang diketahui tak satupun hewan yang mampu memproduksi enzim selulosa sehingga pencernaan selulosa sangat tergantung pada bakteri yang terdapat disepanjang saluran perncernaan. Beberapa bakteri selulolitik antara lain adalah Bacteriodes succinogenes, Ruminicoccus flavefaciens,
Ruminicoccus albus, Cillobacterium cellulosolvens.
b. Kelompok Bakteri Pencerna Hemiselulosa
Hemiselulosa merupakan struktur polisakrida yang penting dalam dinding sel tanaman. Mikroorganisme yang dapat menghidrolisis selulosa biasanya juga dapat menghidrolisa hemiselulosa sedangkan mikroorganisme yang mampu menghidrolisa hemiselulosa belum tentu mampu menghidrolisa selulosa. Bakteri yang mencerna hemiselulosa ialah Butyrivibrio fibrisolvens, Lachnospira multiparus, dan Bactroides
ruminicola.
c. Kelompok Pencerna Pati
Pada ruminansia tidak terlalu banyak mikroorganime amilolitik dalam rumen. Bakteri amilolitik akan menjadi dominan dalam jumlahnya apabila makanan mengandung pati tinggi. Bakteri amilolitik yang terdapat dalam rumen antara lain : Bacteroides
amylophillus, Bacteroides ruminicola, Bacteroides alactacidigens, Butyrivibrio
fibrisolvens.
2.12.2. Protozoa Rumen
Protozoa rumen umumnya adalah ciliata, namun terdapat pula beberapa spesies flagellata yang berukuran kecil. Ciliata merupakan non patogen dan anaerobic
michroorganism. Dari hasil serangkaian studi, diperoleh informasi bahwa diduga
ciliata mempunyai peranan sebagai sumber protein dengan keseimbangan kandungan asam amino yang lebih baik dibandingkan dengan bakteri sebagai makanan ternak ruminansia.
2.12.3. Fungi Rumen
Beberapa spesies fungi telah ditemukan dalam rumen. Signifikansi fungi dalam proses pencernaan atau habitat ekologi belum ditemukan dengan baik seperti pada bakteri. Beberapa fungi tidak melakukan pencernaan, namun terbawa serta dalam pakan. Beberapa spesies fungi telah diketahui mencerna serat kasar dan lignin misalnya
Pleurotus sajor-keju, Pleurotus florida atau Pleurotus ostreatus. Fungi rumen sangat
menarik karena dapat memanfaatkan enzim dengan variasi yang luas. Diantara enzim yang sangat potensial dihasilkan oleh fungi ialah xylanase yang dapat mendegradasi cellulose dan hemicellulose sangat sempurna (Sembiring, 2010).
Pengembangbiakan mikroorganisme yang berasal dari rumen sapi sebagai aktivator dapat dilakukan dengan mendidihkan gula jawa atau gula pasir dengan air secukupnya. Setelah gula mencair ditambah dengan bekatul/dedak dan terasi dan diaduk sampai rata, kemudian didinginkan. Setelah benar-benar dingim ditambah dengan rumen dan diaduk sampai rata, serta ditutup rapat selama dua hari. Pada hari ketiga diaduk selama kurang lebih 10 menit, dan pada hari keempat campuran tersebut sudah bisa digunakan sebagai aktivator secara langsung (Isniani, 2006). Keunggulan penggunaan rumen sapi antara lain : dapat dibuat sendiri, bahan tersedia dan mudah didapatkan, peralatan cukup sederhana, sangat berguna bagi petani
BAB 3
BAHAN DAN METODE PENELITIAN
3.1. Alat – alat
- Gelas ukur Pyrex
- Labu erlenmeyer Pyrex
- Beaker glass Pyrex
- Pipet volum Pyrex
- Labu takar Pyrex
- Buret Pyrex
- Mikro Pipet Pyrex
- Hot plate Stirer PMC
- Labu Kjehdahl Pyrex
- Timbangan Elektrik Mettler PM 400 - Klemp
- Statif
- Oven Galamerican
- Spektrofotometer Spektronik 20 Milton Roy - Kertas saring Whatman No.40
- Kuvet - pH meter
- Spektrofotometer Serapan Atom ( SSA )
3.2. Bahan – bahan
- Tumbuhan Lamtoro - Terasi
- Dedak - Gula Putih - Rumen sapi - Akuades
- HCl(p) p.a E. Merck
- H3PO4(p) p.a E. Merck
- FeSO4.7H2O p.a E. Merck
- K2Cr2O7 p.a E. Merck
- H2C2O4 p.a E. Merck
- NaOH p.a E. Merck
- H3BO3 p.a E. Merck
- Fenolftalein p.a E. Merck
- Metil Merah p.a E. Merck
- Metil Biru p.a E. Merck
- Bromtimol Biru p.a E. Merck
- Alkohol 96% Teknis
- KH2PO4 p.a E. Merck
3.3. Prosedur Penelitian
3.3.1. Penyedian Sampel Daun Lamtoro
Daun lamtoro diambil secara acak, dikeringkan dibawah sinar matahari selama 4 hari.
3.3.2. Pembuatan Aktivator dari Rumen Sapi
Dimasukkan 250 g gula pasir kedalam suatu wadah yang berisi 3 liter air kemudian dimasak sampai mendidih, setelah mendidih dan gula larut ditambahkan 1000 g dedak dan 125 g terasi diaduk hingga rata, kemudian didinginkan. Setelah benar-benar dingin ditambahkan 250 ml rumen sapi, diaduk sampai rata, kemudian ditutup rapat selama dua hari, pada hari ketiga diaduk kembali dan pada hari keempat campuran tersebut sudah dapat digunakan sebagai aktivator secara langsung.
3.3.4. Pembuatan Kompos
mengeluarkan gas-gas yang terbentuk dan agar suhu adonan tidak terlalu tinggi. Kemudian analisa kadar C-Organik, Nitrogen, Posfor dan Kalium ditentukan dengan interval waktu 3, 6, 9,12 dan 15 hari.
3.3.5. Pembuatan Pereaksi dan Larutan Standar
3.3.5.1. Pembuatan Pereaksi dan Larutan standar untuk Penentuan P-total Metode Spektrofotometri
a. Larutan HCl 25%
Dipipet 173,6 ml HCl(p), dimasukkan kedalam labu takar 250 ml, diencerkan dengan
akuades hingga garis tanda dan dihomogenkan.
b. Larutan Standar P 100 ppm
Ditimbang 0,2195 g kristal KH2PO4 secara kuantitatif, dimasukkan kedalam gelas
piala 250 ml, dilarutkan dengan akuades secukupnya, dimasukkan kedalam labu takar 500 ml, diencerkan dengan akuades hingga garis tanda, dan dihomogenkan.
c. Larutan H2SO4 5 N
Dipipet 13,72 ml H2SO4(p), dimasukkan kedalam labu takar 100 ml yang telah berisi
20 ml akuades, diencerkan dengan akuades hingga garis tanda, didinginkan dan dihomogenkan.
d. Larutan Amonium Molibdat 4%
Ditimbang 1,883 g kristal (NH4)6Mo7O24.4H2O, dimasukkan kedalam gelas piala 50
ml, dilarutkan dengan akuades dengan secukupnya, dimasukkan kedalam labu takar 50 ml, diencerkan dengan akuades hingga garis tanda, dan dihomogenkan.
e. Larutan Asam Askorbat 0,1 M
Ditimbang 0,880 g kristal C6H8O6, dimasukkan kedalam gelas piala 50 ml, dilarutkan
f. Larutan Kalium Antimoli Tartarat 1 mg Sb / mL
Ditimbang 0,105 g kristal KSbOC4H4O6.1/2 H2O, dimasukkan kedalam gelas piala 50
ml, dilarutkan dengan akuades secukupnya, dimasukkan kedalam labu takar 50 ml, diencerkan dengan akuades hingga garis tanda, dan dihomogenkan.
g. Larutan Seri Standar P dalam ekstrak HCl 0,95 N
Dipipet masing-masing 20 ml akuades dan 11,7 ml HCl 25% ke dalam labu takar 100 ml, dipipet 2 ml, 4 ml, 6 ml, 8 ml, 10 ml larutan standar 100 ppm secara kuantitatif, diencerkan dengan akuades hingga garis tanda, dan dihomogenkan.
h. Pembuatan Larutan Campuran Pengkompleks
Dipipet 25 ml H2SO4 5 N dalam labu takar 50 ml, ditambahkan 7,5 ml larutan
(NH4)6Mo7O24 4 %, ditambakan 15 ml larutan asam askorbat, ditambahkan 2,5 ml
larutan KSbOC4H4O6 0,1 M dan dihomogenkan.
3.3.5.2. Pembuatan Pereaksi untuk Penentuan C-Organik
a. Larutan K2Cr2O7 1 N
Ditimbang secara kuantitatif kristal K2Cr2O7 sebanyak 12,257 g, dimasukkan ke
dalam gelas piala 250 ml, dilarutkan dengan akuades secukupnya, dimasukkan kedalam labu takar 250 ml, diiencerkan hingga garis tanda, dan dihomogenkan.
b. Larutan FeSO4 1 N
Ditimbang secara kuantitatif kristal FeSO4.7H2O sebanyak 69,505 g, dimasukkan ke
dalam gelas piala 250 ml, dilarutkan dengan akuades secukupnya, ditambahkan 37,5 ml H2SO4 pekat secara perlahan – lahan, diaduk hingga larut, dimasukkan kedalam
labu takar 250 ml, ditambahkan akuades hingga garis tanda, didinginkan dan dihomogenkan.
c. Larutan Difenilamin (C6H5)2NH4)
Ditimbang 0,5 g kristal difenilamin, dilarutkan dengan 20 ml akuades dalam gelas piala 250 ml, ditambahkan dengan 100 ml H2SO4 pekat secara perlahan – lahan
3.3.5.3. Pembuatan Pereaksi untuk Penentuan Nitrogen Metode Kjehldahl
a. Larutan NaOH 40%
Ditimbang sebanyak 40 g kristal NaOH, dimasukkan kedalam gelas piala 250 ml, kemudian dilarutkan dengan akuades, dimasukkan kedalam labu takar 100 ml, diencerkan hingga garis tanda dan dihomogenkan.
b. Larutan Indikator Fenolftalein
Ditimbang kristal fenolftalein sebanyak 1 g dilarutkan dengan alkohol 96%, dimasukkan kedalam labu takar 100 ml, diencerkan hingga garis tanda dan dihomogenkan.
c. Larutan H3BO3 3%
Ditimbang H3BO3 sebanyak 3 g, dimasukkan kedalam gelas piala 250 ml, dilarutkan
dengan akuades, dimasukkan kedalam labu takar 100 ml, diencerkan hingga garis tanda dan dihomogenkan.
d. Larutan Indikator Campuran
Sebanyak 2 bagian indikator metil biru 0,1% (b/v) dan 1 bagian indikator metil merah 0,2% (b/v) dalam etanol.
e. Larutan H2C2O4 0,01 N
Ditimbang kristal H2C2O4.2H2O secara kuantitatif sebanyak 0,63 g, dimasukkan
kedalam gelas piala 250 ml, dilarutkkan dengan akuades, dimasukkan kedalam labu takar 1000 ml, diencerkan hingga garis tanda, dan dihomogenkan.
f. Larutan NaOH 0,01 N
g. Larutan HCl 0,01 N
Sebanyak 0,83 ml HCl 37% dipipet kedalam labu takar 1000 ml, diencerkan hingga garis tanda dengan akuades, dan dihomogenkan.
h. Standarisasi Larutan NaOH 0,01 N
- Dipipet 10 ml larutan H2C2O4 0,01 N dimasukkan kedalam gelas erlenmeyer
- Ditambahkan 3 tetes indikator fenolftalein
- Dititrasi dengan NaOH hingga terjadi perubahan warna menjadi merah lembayung - Dilakukan hal yang sama sebanyak 3 kali
i. Standarisasi HCl 0,01 N
- Dipipet 10 ml larutan HCl 0,01 N dimasukkan kedalam gelas erlenmeyer - Ditambahkan 3 tetes indikator bromtimol biru
- Dititrasi dengan NaOH yang telah distandarisasi hingga terjadi perubahan warna biru menjadi hijau kekuningan
- Dilakukan hal yang sama sebanyak 3 kali.
3.3.5.4. Pembuatan Pereaksi Unruk Penentuan Kalium Dengan Spektrofotometer Serapan Atom (SSA)
a. Larutan HCl 25%
Dipipet 173,6 ml HCl(p), dimasukkan kedalam labu takar 250 ml, diencerkan dengan
akuades hingga garis tanda dan dihomogenkan.
b. Larutan Kalium 1000 ppm
Dilarutkan 1,907 g KCl p.a. dengan akuades dalam labu takar 1000 ml hingga garis tanda. Larutan ini mengandung 1 mg K/L.
c. Larutan standar Kalium 100 ppm
d. Larutan standar Kalium 10 ppm
Sebanyak 10 ml larutan standar kalium 100 ppm diencerkan dengan akuades dalam labu takar 100 ml hingga garis tanda.
e. Larutan Seri Standar Kalium untuk kalibrasi
Dari larutan standar 10 ppm kalium masing-masing dipipet 2,5; 5; 10; 15 ; 20 ml, kemudian masing-masing diencerkan dengan akuades dalam labu takar 100 ml hingga garis tanda. Masing-masing larutan adalah 0,5; 1,0; 2,0; 3,0; 4,0 ppm kalium.
3.3.6. Penentuan P-Total Metode Spektrofotometri
3.3.6.1. Preparasi Sampel
Ditimbang 1 g sampel yang telah dikeringkan dibawah sinar matahari, dimasukkan kedalam gelas erlenmeyer 250 ml, ditambahkan dengan 12,5 HCl 25%, dikocok dengan mesin pengocok selama 2 jam, disaring kertas saring no. 40, ditampung ekstrak sampel kedalam labu takar 100 ml, diencerkan dengan akuades hingga garis tanda, dan dihomogenkan.
3.3.6.2. Pembuatan Kurva Kalibrasi
Dipipet 10 ml masing – masing larutan standar kedalam tabung reaksi, ditambahkan 5 ml akuades, ditambahkan 1 ml larutan campuran, didiamkan selama 15 menit, diukur absorbansinya dengan spektrofotometer, pada λ = 710 nm, dibuat kurva kalibrasi dengan memplotkan konsentrasi terhadap absorbansi.
3.3.6.3. Penentuan Kadar Posfor pada Sampel
Dipipet 10 ml ekstrak sampel kedalam tabung reaksi, ditambahkan 5 ml akuades, ditambahkan 1 ml larutan campuran, didiamkan selama 15 menit, diukur absorbansinya dengan spektrofotometer, pada λ = 710 nm.
3.3.7. Penentuan Kadar C-Organik dengan metode Walkey Black
Ditimbang secara kuantitatif sebanyak 0,1 g sampel yang telah dihaluskan dan kering udara dimasukkan kedalam erlenmeyer 500 ml
Ditambahkan 20 ml H2SO4 secara perlahan
Diaduk selama 1 menit Didiamkan selama 30 menit Ditambahkan 200 ml akuades
Ditambahkan 5 ml H3PO4 pekat (85%) dan 1 ml larutan difenilamin
Dititrasi dengan larutan FeSO4 hingga terjadi perubahan warna dari ungu
menjadi hijau
Dicatat volume FeSO4 yang terpakai
Dilakukan hal yang sama sebanyak 3 kali dan diambil hanya rata-rata
Catatan : Terlebih dahulu dilakukan hal yang sama pada blanko untuk standarisasi FeSO4
3.3.8. Penentuan Nitrogen dengan Metode Kjehldahl
Ditimbang secara kuantitatif sebanyak 0,1 g sampel dimasukkan kedalam labu Kjehldahl
Ditambahkan 0,3 g selenium dan 25 ml H2SO4 pekat
Didestruksi sampel hingga sampel berubah menjadi larutan coklat kehitaman Dipindahkan kedalam labu destilasi dan ditambahkan 50 ml akuades
Ditambahkan 3 tetes indikator fenolftalein dan NaOH 40% sehingga berwarna merah lembayung
Disedikan penampung untuk hasil destilat berupa labu erlenmeyer yang berisi 50 ml H3BO3 3% dan 3 tetes indikator campuran
Dipasang tabung destilasi pada alat destilasi
Dilakukan destilasi hingga diperoleh warna hijau muda
Destilat kemudian dititrasi dengan HCl 0,01 N sampai terbentuk merah lembayung
Dicatat volume titran ditentukan % N
Dilakukan hal yang sama sebanyak 3 kali dan diambil hanya rata-rata.
3.3.9. Penentuan Kalium Dengan Spektrofotome Serapan Atom (SSA)
Ditimbang sebanyak 5 g sampel kering lalu dimasukkan ke dalam erlenmeyer 100 ml
Ditambahkan 12,5 ml HCl 25% kedalam erlenmeyer 100 ml yang berisi sampel
Didekstruksi selama 3 jam
Larutan dibiarkan selama 1 malam
Kemudian dikocok dengan mesin pengocok bolak-balik selama 2 jam sampai terbentuk suspensi
Larutan disaring kedalam labu takar 100 ml dengan menggunakan kertas saring whatman No.40, sambil dicuci sebanyak 3 kali dengan akuades
Kemudian labu ukur dipenuhkan dengan akuades sampai garis tanda Filtrat disimpan didalam botol plastik untuk penetapan kadar kalium
3.4. Bagan Penelitian
3.4.1. Pembuatan Kompos
Dikeringkan dibawah sinar matahari selama 4 hari
Ditimbang sebanyak 500 g
Daun Lamtoro
500 g daun lamtoro kering
Dimasukkan kedalam ember plastik yang telah diberi Pori-pori
Ditambahkan 550 ml aktivator yang telah dibuat sampai merata Ditutup rapat ember plastik
Disimpan pada tempat yang bersih
Dilakukan pengadukan sekali 24 jam untuk
mengeluarkan gas-gas yang terbentuk dan menjaga suhu adonan
Dibuat variasi waktu fermentasi selama 15 hari
Kompos daun lamtoro
Ditentukan kadar C-Organik, N-total, P-total, dan K masing-masing kompos dengan variasi waktu analisis 3, 6, 9, 12 dan 15 hari
3.4.2. Penentuan C-Organik
Catatan : Prosedur ini dilakukan untuk masing-masing kompos daun lamtoro
sesudah pengomposan dengan variasi waktu 3 sampai 15 hari
pengukuran dilakukan sebanyak 3 kali dan disajikan sebagai nilai rata-
rata
0,1 g serbuk daun lamtoro
Ditambahkan 10 ml K2Cr2O7 1 N
Ditambahkan 20 ml H2SO4 pekat
Diaduk selama 1 menit Didiamkan selama 30 menit
Larutan hijau kekuningan
Ditambahkan 100 ml akuades Ditambahkan 5 ml H3PO4 85 %
Ditambahkan 1 ml larutan difenilamin
Larutan ungu
Dititrasi dengan FeSO4 0,9319 N hingga warna berubah
menjadi hijau
Dicatat volume FeSO4 0,9319 N yang terpakai
3.4.3. Penentuan Kadar Nitrogen pada daun Lamtoro
Catatan : Prosedur ini dilakukan untuk masing-masing kompos daun lamtoro
sesudah pengomposan dengan variasi waktu 3 sampai 15 hari
pengukuran dilakukan sebanyak 3 kali dan disajikan sebagai nilai rata-
rata.
0,1 g serbuk daun lamtoro yang telah dikeringkan
Ditambahkan 0,3 g selenium dan H2SO4 pekat
Didekstruksi hingga mencapai larutan coklat kehitaman
Larutan coklat kehitaman
Dipindahakan ke dalam labu destilasi Ditambahkan 50 ml akuades
Ditambahkan 3 tetes indikator fenolftalein
Ditambahkan NaOH 40% sampai berwarna merah lembayung Didestilasi
Ditampung destilat ke dalam gelas erlenmeyer yang berisi 50 ml H3BO3 3% dan 3 tetes indikator campuran hingga berwarna hijau
Destilat berwarna hijau
Ditampung dalam gelas erlenmeyer yang berisi 50 ml H3BO3
3% dan 3 tetes indikator campuran Dititrasi dengan HCl 0,01 N
Larutan merah muda Ditentukan % N
3.4.4. Penentuan Posfor sebagai P2O5 Metode Spektrofotometri
3.4.4.1. Pengekstrak daun Lamtoro
Catatan : Prosedur ini dilakukan pada masing-masing kompos daun lamtoro
sesudah pengomposan dengan variasi waktu 3 sampai 15 hari
3.4.4.2. Pengukuran Absorbansi dari Larutan Standar P untuk Kurva Kalibrasi Untuk Larutan Standar 2 ppm
Catatan : Dilakukan hal yang sama untuk larutan standar 4 ppm, 6 ppm, 8 ppm dan 10 ppm
1 g serbuk daun lamtoro yang telah dikeringkan
Ditambahkan 12,5 ml HCl 25%
Dikocok selama 2 jam dengan mesin pengocok dengan Kecepatan 20 rpm
Disaring dengan kertas saring whatman No.40
Ekstrak daun Lamtoro Residu
Dimasukkan kedalam labu takar 100 ml
Diencerkan dengan akuades hingga garis tanda Dihomogenkan
Ekstrak daun Lamtoro encer
1 ml larutan standar 2 ppm
Larutan berwarna biru
Dimasukkan kedalam tabunng reaksi Ditambahkan 5 ml akuades
Ditambahkan 1 ml larutan campuran pengkompleks Didiamkan selama 15 menit
Diukur absorbansinya dengan spektrofotometer λ = 710 nm
3.4.4.3. Pengukuran Absorbansi untuk Ekstrak daun Lamtoro
Catatan : Prosedur ini dilakukan untuk masing-masing kompos daun lamtoro
sesudah pengomposan dengan variasi waktu 3 sampai 12 hari
Pengukuran dilakukan sebanyak 3 kali dan disajikan sebagai nilai rata-rata.
Dimasukkan kedalam tabunng reaksi Ditambahkan 5 ml akuades
Ditambahkan 1 ml larutan campuran pengkompleks Didiamkan selama 15 menit
Diukur absorbansinya dengan spektrofotometer λ = 710 nm 10 ml ekstrak daun lamtoro
Larutan berwarna biru
3.4.5. Penentuan Kalium Dengan Spektrofotometri Serapan Atom
Didinginkan dalam desikator selama 30 menit Dimasukkan ke dalam erlenmeyer 100 ml Dilarutkan dengan 12,5 ml HCl 25% Didesktruksi selama 3 jam
didiamkan selama 1 malam
Didinginkan, lalu disaring pada labu takar 100 ml dengan kertas saring whatman no. 40
Diencerkan dengan akuades sampai garis tanda Didinginkan pada suhu kamar selama 12 jam
Disaring dengan kertas saring Whatman No. 42 Cawan dicuci tiga kali dengan akuades
Kertas saring dicuci tiga kali dengan akuades
Dibuat pH ± 3 dengan penambahan NH4OH 20% tetes demi tetes
Diencerkan dengan akuades hingga garis tanda
Konsentrasi K diukur dengan Spektrofotometer Serapan Atom
Catatan : Prosedur ini dilakukan untuk masing-masing kompos daun lamtoro
sesudah pengomposan dengan variasi waktu 3 sampai 15 hari
pengukuran dilakukan sebanyak 3 kali dan disajikan sebagai nilai rata-
rata.
5 g sampel kering di dalam gelas timbangan
Larutan
Filtrat (dalam labu takar 100 ml)
Konsentrasi kalium
BAB 4
HASIL DAN PEMBAHASAN
4.1. Hasil dan Pengolahan Data 4.1.1. Hasil Penelitian
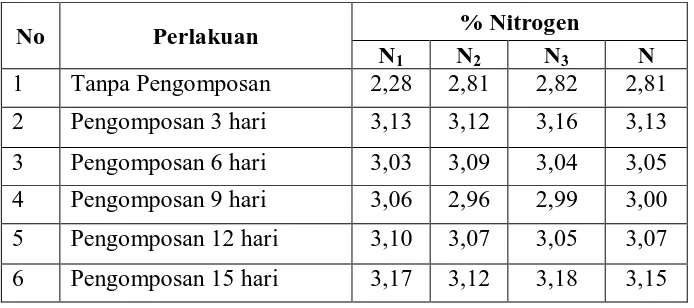
Data hasil Penentuan C – Organik dengan Metode Walkey Black dapat dilihat pada tabel 4.1, penentuan Nitrogen dengan metode Kjehldahl dapat dilihat pada tabel 4.2, penentuan Posfor dengan metode Spektrofotometri dapat dilihat pada tabel 4.3 dan penentuan Kalium dengan Spektrofotometer Serapan atom ( SSA ) dapat dilihat pada tabel 4.4.
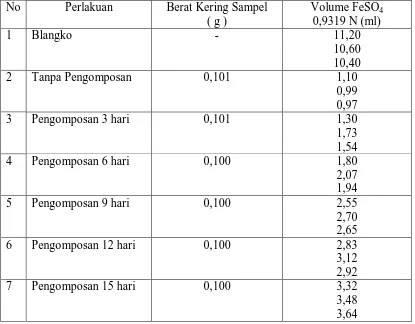
Tabel 4.1. Data Volume FeSO4 0,9319 N yang Terpakai pada Penentuan
C – organik dengan Metode Walkey Black.
No Perlakuan Berat Kering Sampel ( g )
Volume FeSO4
0,9319 N (ml)
1 Blangko - 11,20
10,60 10,40
2 Tanpa Pengomposan 0,101 1,10
0,99 0,97
3 Pengomposan 3 hari 0,101 1,30
1,73 1,54
4 Pengomposan 6 hari 0,100 1,80
2,07 1,94
5 Pengomposan 9 hari 0,100 2,55
2,70 2,65
6 Pengomposan 12 hari 0,100 2,83
3,12 2,92
7 Pengomposan 15 hari 0,100 3,32
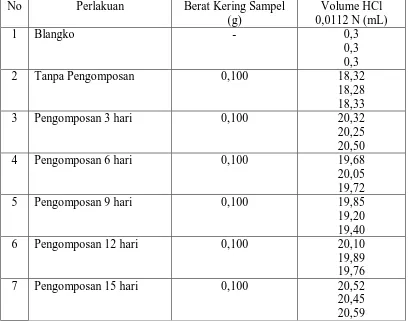
Tabel 4.2 Data Volume HCl 0,0112 N yang Terpakai pada Penentuan Nitrogen dengan Metode Kjeldahl
No Perlakuan Berat Kering Sampel (g)
Tabel 4.3. Data Absorbansi Pada Penentuan Posfor dengan Metode Spektrofotometri dengan λ= 710 nm
No Perlakuan Berat Kering Sampel (g) Absorbansi
0,464
6. Pengomposan 15 hari 1,006 0,469
0,462 0,466
Tabel 4.4. Data Absorbansi Pada Penentuan Kalium dengan Spektrofotomer Serapan Atom (SSA) pada λ= 766,5 nm
No Perlakuan Berat Kering Sampel (g) Absorbansi
1 Tanpa Pengomposan 5,003 0,3680
4.1.2 Penentuan % C-Organik
Penentuan Normalitas FeSO4 standar yang digunakan untuk menentukan %
N FeSO4 =
Penentuan % C-Organik dalam sampel dapat dihitung dengan menggunakan rumus sebagai berikut :
C – Organik (%) =
[
(
)
]
Catatan : Nilai 0,33 menyatakan bahwa 1 grek K2Cr2O7 dapat mengoksidasi 3 grek
FeSO4 dan nilai 0,77 menyatakan bahwa sebanyak 77% senyawa
organik yang dapat dioksidasi K2Cr2O7.
Berdasarkan data volume FeSO4 0,9319 N yang terpakai dalam penentuan C-Organik
dengan metode Walkey Black ( tabel 4.1 ) maka dapat ditentukan % C-Organik pada sampel yaitu :
Pengukuran I
- Daun lamtoro sebelum pengomposan
V1 = 1,10 V2 = 0,99 V3 = 0,97
4.1.3.Penentuan % Nitrogen
Penentuan Normalitas HCl standar yang digunakan untuk menentukan % Nitrogen :
N HCl =
Maka Normalitas HCl Standar adalah :
N HCl =
Penentuan Nitrogen dalam sampel dapat dihitung dengan menggunakan rumus sebagai berikut :
% Nitrogen = Vb = mL larutan HCl standar yang terpakai mentitrasi blangko N HCl = Normalitas HCl
Berdasarkan data Volume HCl 0,0112 N yang terpakai dalam penentuan nitrogen dengan metode Kjehldahl ( tabel 4.2 ) maka ddapat ditentukan % Nitrogen pada sampel yaitu :
Pengukuran I
Untuk daun lamtoro sebelum dikomposkan
Hasil pengukuran Nitrogen II dan III pada daun lamtoro sebelum dikomposkan ditunjukan pada tabel 4.6 pada lampiran demikian juga untuk data hasil pengukuran Nitrogen pada daun lamtoro sesudah pengomposan dengan variasi pengomposan 3 sampai 15 hari dengan interval waktu analisis 3 hari (setiap pengukuran Nitrogen masing-masing dilakukan sebanyak 3 kali.
4.1.4.Penentuan C/N
Setelah % C-Organik dan % Nitrogen ditentukan , maka C/N dari daun lamtoro dapat ditentukan dengan membandingkan nilai % C-Organik rata-rata ( tabel 4.5 ) dengan % Nitrogen rata-rata ( tabel 4.6 ).
C/ N =
Nitrogen Organik C
%
% −
Maka nilai C/N dari daun lamtoro sebelum pengomposan C/ N =
% 82 , 2
% 11 , 38
= 13,51
Dan untuk data C/N pada daun lamtoro setelah pengomposan dengan waktu pengomposan selama 15 hari dengan interval waktu analisis 3 hari dapat ditunjukkan pada tabel 4.7 pada lampiran.
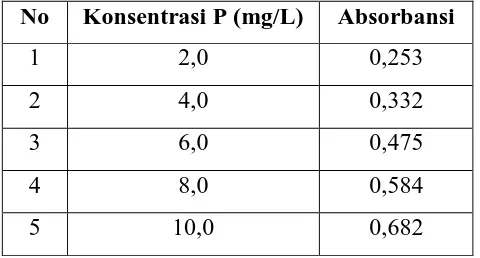
4.1.5. Penentuan Posfor sebagai P-Total 4.1.5.1. Penurunan Persamaan Garis Regresi.
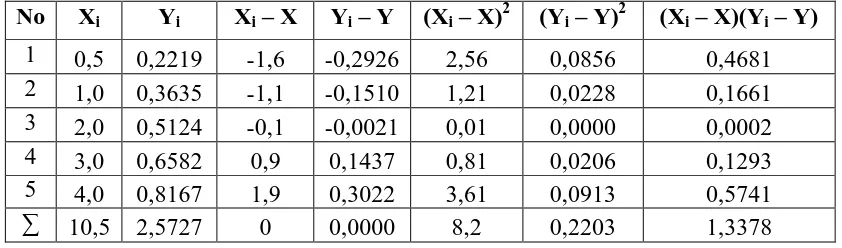
No Xi Yi Xi – X Yi – Y (Xi – X)2 (Yi – Y)2 (Xi – X)(Yi – Y)
Keterangan : Xi : Konsentrasi Yi : Absorbansi
Persamaan garis regresi untuk kurva kalibrasi dapat diturunkan dari persamaan garis : Y = aX + b
Dengan : a = slope b = intersep
Selanjutnya harga slope dapat ditentukan dengan menggunakan metode Least Square sebagai berikut :
Sehingga diperoleh harga slope (a) = 0,0555
Nilai b (intersep) diperoleh melalui substitusi harga (a) ke persamaan berikut :
Sehingga diperoleh harga intersep (b) = 0,1322 Maka persamaan garis regresi yang diperoleh adalah :
Y = 0,0555 X + 0,1322
4.1.5.2. Perhitungan Koefisien Korelasi
Koefisien korelasi (r) dapat ditentukan sebagai berikut
Sehingga diperoleh harga koefisien korelasi (r) : 0,9977
Setelah diperoleh persamaan garis regresi dan koefisien korelasi (r) pada pengukuran larutan standar maka absorbansi dari larutan standar diplotkan terhadap konsentrasi larutan standar seperti pada lampiran.
4.1.5.3. Perhitungan Standar Deviasi
Dengan mensubtitusikan nilai konsentrasi larutan standar (Xi) ke persamaan garis
regresi maka diperoleh nilai Y yang baru (
^
Y ), seperti yang tercantum pada tabel
berikut:
Dari tabel di atas maka dapat ditentukan standar deviasi untuk intersep ( Sb ) yaitu :
Sb =
Sehingga diperoleh : Sb =
Nilai Sb dihitung untuk menentukan batas kepercayaan nilai intersep yaitu b ± t(Sb), dimana t diperoleh dari t-distribusi dengan derajat kepercayaan 95% dan derajat kebebasan (n – 2 ) = 5 – 2 = 3. Diperoleh p = 0,05 dan t = 3,18 sehingga batas kepercayaan untuk nilai intersep adalah :
0,1322 ± 3,18 (0,0122) 0,1322 ± 3,879 . 10-2 0,1322 ± 0,0387
Deviasi slope dari standar dapat dihitung dengan :
Sa = Sy ⁄x
Sesuai dengan cara untuk menentukan batas kepercayaan nilai intersep maka batas kepercayaan nilai slope dapat ditentukan adalah a ± t(Sa).
4.1.5.4. Penentuan Batas Deteksi
Batas deteksi dapat dihitung dengan menggunakan persamaan : 3Sb = Y - Yb
Y = 3 Sb + Yb Dimana :
Y = Signal pada batas deteksi
Yb = Intersept dari kurva kalibrasi ( b ) Sb = Standar deviasi untuk slope
Persamaan Kurva Kalibrasi Y = 0,0555 X + 0,1322, dimana Yb = 0,1322 dan Sb = Sy ⁄x = 0,0774
Maka dengan mensubsitusikan Yb dan Sb pada Persamaan Y = 3 Sb + Yb diperoleh nilai batas deteksi :
Y = 3 Sb + Yb
= 3 (0,0774 ) + 0,1322 = 0,3644
Batas deteksinya dapat dihitung dengan mensubtitusikan harga Y terhadap persamaan garis regresi Y = 0,0555 X + 0,1322, maka didiperoleh nilai X yaitu ;
X =
Jadi batas deteksi untuk penentuan konsentrasi Posfor dalam penelitian ini adalah 4,1838 mg/L.
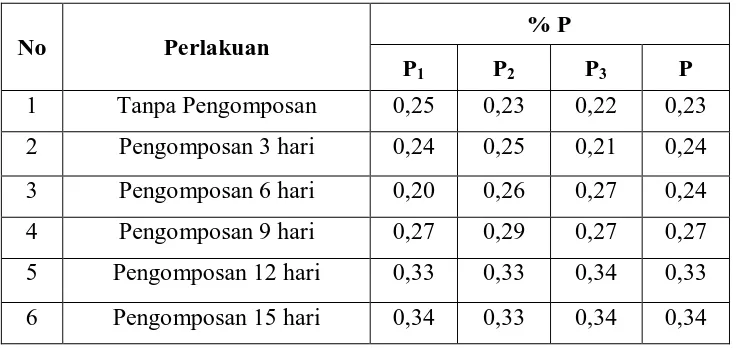
4.1.5.5. Penentuan % P -Total pada Sampel
Kadar posfor (P) dapat ditentukan dalam sampel dengan menggunakan metode kurva kalibrasi dengan mensubstitusi nilai Y (absorbansi) yang diperoleh dari pengukuran tabel 4.3 terhadap persamaan garis regresi dari kurva kalibrasi.
Untuk daun lamtoro sebelum pengomposan