TEMULAWAK (
Curcuma xanthorrhiza
Roxb.)
DELVI MARETTA
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
i Dengan ini saya menyatakan bahwa tesis Pembentukan Rimpang Mikro secara In vitro dan Analisis Kestabilan Genetik antar Sub-kultur Temulawak (Curcuma xanthorrhiza Roxb.) adalah karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apapun kepada perguruan tinggi manapun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Bogor, Oktober 2010
ii DELVI MARETTA. Micro Rhizome Formation of Temulawak (Curcuma xanthorrhiza Roxb.) and Genetic Stability Analysis to Repeated Sub-cultured Plantlets. Under direction of DARDA EFENDI, SANDRA ARIFIN AZIZ and DODO RUSNANDA SASTRA.
Temulawak (Curcuma xanthorrhiza Roxb.) was used to be propagated from rhizome. High propagul weight will produce high yield. The use of big sized rhizome for seedling will reduce its use for consumption and processing purposes. Therefore, in vitro micro rhizome could be used as propagul alternative for the propagation of temulawak because of its simplicity and high multiplication in shorter time.
Plantlet from repeated sub-cultures induced to form micro rhizome. High rate shoot multiplication caused somaclonal variation. In plants propagation, somaclonal variation was not desired because seed uniformity was very important. Therefore, genetic stability of plantlets for get true to type seed from the use of repeated sub-culture in vitro shoot for micro rhizome formation must be studied.
This research used RFLP and sequencing method to find the genetic stability of plantlet among sub-cultures generations. RFLP method was used to mother
plant’s DNA and plantlet’s DNA from 3rd, 4th, 5th and 12th sub-cultures. Sequencing analysis was used to mother plant’s and 12th sub-cultures plantlet DNA. In vitro micro rhizome formation research consisted of three studies : 1) The effect of physical of media (liquid and solid medium) and sucrose (30, 60, 90, 120 gL-1); 2) The effect of the strength of MS medium (half and full strength) and sucrose (30, 60, 90, 120 gL-1) ; 3) The effect of level of BAP (0, 1, 2, 3 mgL-1) and sucrose (30, 60, 90, 120 gL-1) to plantlet growth and micro rhizome formation. Cultures were incubated in the dark for 16 hours day-1.
Electrophoresis band of DNA temulawak in RFLP analysis with restriction enzymes MBo1, Taq1 and Alu1 showed the same pattern between 5 samples DNA. There is possibility of genetic stability of temulawak plantlet between generation 3rd, 4th, 5th, and 12thsub-culturesand mother’s plants DNA. Homology result of sequencing DNA also showed genetic stability for 300 bp DNA. There is genetic sequence equality between DNA mother plants sequence at base number 61-361 and DNA plantlet 12th sub-culture at base sequence number 61-361.
Micro rhizomes of temulawak was formed in liquid half and full strength MS. Interaction BAP and sucrose have significant effect on rhizomes formation at 18 weeks after planting. The higher frequency of rhizomes formation was enhanced in medium with BAP 1 and 2 mgL-1 on sucrose concentration 60, 90, 120 gL-1. The increased of sucrose concentration also had positive effect to higher number, diameter and weight of micro rhizomes 8 weeks after acclimatization.
iii DELVI MARETTA. Pembentukan Rimpang Mikro secara In Vitro dan Analisis Kestabilan Genetik antar Sub-Kultur Temulawak (Curcuma xanthorrhiza Roxb.). Dibimbing oleh DARDA EFENDI, SANDRA ARIFIN AZIZ dan DODO RUSNANDA SASTRA.
Temulawak (Curcuma xanthorrhiza Roxb.) adalah tumbuhan obat asli Indonesia dan berbagai penelitian telah mengungkapkan khasiat temulawak. Khasiat temulawak terutama disebabkan oleh kandungan senyawa berwarna kuning golongan kurkuminoid dan minyak atsiri yaitu xanthorrizol. Selama ini pembibitan temulawak masih menggunakan bibit yang berasal dari rimpang. Semakin tinggi bobot rimpang bibit temulawak yang ditanam semakin tinggi hasil yang diperoleh, akan tetapi pemakaian rimpang bibit berukuran besar untuk memperoleh hasil panen yang tinggi menyebabkan kebutuhan bibit cenderung besar, sehingga dapat mengurangi jumlah rimpang untuk konsumsi atau untuk olahan.
Teknik in vitro adalah teknologi yang dapat diterapkan untuk memenuhi kebutuhan bibit berupa rimpang mikro. Rimpang mikro dapat ditanam secara langsung tanpa proses aklimatisasi, penyimpanan dan transportasi rimpang mikro untuk bibit lebih mudah. Percobaan pembentukan rimpang mikro telah dilakukan terhadap tanaman jahe, temuputih dan kunyit tetapi belum dilakukan pada temulawak. Untuk itu perlu dilakukan penelitian pembentukan rimpang mikro temulawak secarain vitro.
Rimpang mikro diinduksi dari tunas-tunasin vitrohasil sub-kultur berulang dapat menyebabkan penyimpangan genetik tanaman. Oleh karena itu penggunaan tunasin vitrountuk induksi rimpang mikro temulawak sebagai sumber bibit harus memperhatikan kestabilan genetik plantlet hasil multiplikasi berulang supaya bibit yang dihasilkan true to type. Dengan kemajuan biologi molekuler, kestabilan genetik plantlet antar generasi sub-kultur dapat diketahui dengan pendekatan marka DNA.
Tujuan dari penelitian ini adalah menentukan jumlah tahapan sub-kultur yang tetap mempertahankan kestabilan genetik plantlet temulawak serta mempelajari pengaruh bentuk fisik media (media cair dan padat), komposisi media (komposisi media MS konsentrasi penuh dan setengah konsentrasi), konsentrasi BAP dan sukrosa terhadap pertumbuhan eksplan dan pembentukan rimpang mikro temulawak pada kulturin vitro.
iv Pengaruh BAP (0, 1, 2, 3 mgL ) dan sukrosa (30, 60, 90, 120 gL ), terhadap pertumbuhan dan pembentukan rimpang mikro temulawak. Percobaan II akan dilakukan berdasarkan hasil dari Percobaan I sedangkan Percobaan III akan dilakukan berdasarkan hasil dari Percobaan I dan II. Ketiga percobaan menggunakan rancangan faktorial acak lengkap. Data dianalisis dengan sidik ragam dan jika berbeda nyata akan dilakukan uji lanjut DMRT pada taraf kesalahan 5 %. Dilakukan persemaian terhadap rimpang mikro dan aklimatisasi terhadap plantlet yang memiliki rimpang mikro serta analisis bahan aktif terhadap rimpang mini yang dipanen setelah aklimatisasi.
Analisis kestabilan genetik dengan metode RFLP menghasilkan gambar elektroforasi dengan pola pita yang sama. Ketiga enzim memotong DNA kelima tanaman sampel pada posisi yang sama. Hal tersebut berarti kemungkinan besar terdapat kestabilan genetik plantlet antar sub kulturin vitrotemulawak.
Produk PCR yang berhasil di-sequensing dengan kualitas baik berukuran 300 bp untuk kedua sampel tanaman. Sequen DNA tanaman induk mulai dari urutan basa nomor 61–361, sedangkan sequen DNA plantlet sub-kultur ke-12 dari urutan basa nomor 58–358. Hasil homologi kedua sequen tersebut menunjukkan urutan basa 100% sama. Hal ini berarti tahapan sub-kultur yang berulang hingga 12 kali dapat mempertahankan kesamaan genetik sebesar 300 bp.
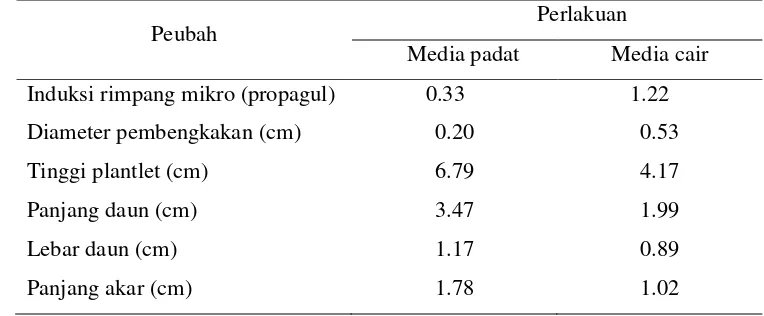
Hasil sidik ragam percobaan I menunjukkan induksi pembentukan rimpang mikro lebih dipengaruhi oleh faktor tunggal bentuk fisik media. Rata-rata induksi rimpang mikro lebih banyak pada media cair (1.22 per plantlet) dibandingkan pada media padat (0.33 per plantlet). Pada media cair ukuran plantlet semakin tinggi (korelasi -0.99*), daun yang lebih luas dan akar yang lebih panjang menghasilkan jumlah rimpang mikro yang semakin sedikit.
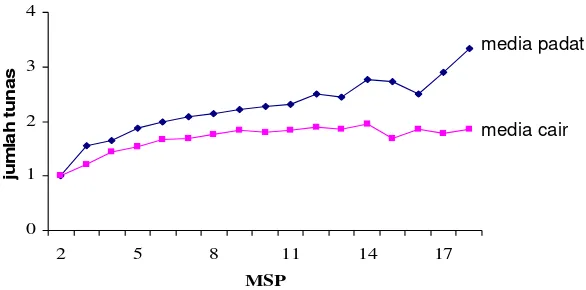
Berdasarkan percobaan I maka media cair digunakan pada percobaan II. Sampai 18 MSP pembentukan rimpang mikro tidak dipengaruhi oleh faktor tunggal komposisi media atau sukrosa maupun interaksi keduanya. Media MS ½ konsentrasi dapat digunakan untuk pembentukan rimpang mikro karena secara ekonomi lebih murah dan tidak berbeda nyata dengan media MS konsentrasi penuh.
Berdasarkan hasil dua percobaan sebelumnya maka pada percobaan III media yang digunakan adalah media cair MS ½ konsentrasi. Pada percobaan ini interaksi BAP dan sukrosa berpengaruh nyata terhadap jumlah rimpang pada 18 MSP. Hasil uji lanjut menunjukkan interaksi BAP 2 mgL-1 dan sukrosa 120 gL-1 membentuk rimpang mikro nyata terbanyak yaitu 2 rimpang mikro per plantlet. Konsentrasi sukrosa yang semakin tinggi, pada media tanpa BAP serta dengan penambahan BAP 1 dan 2 mgL-1 jumlah rimpang mikro yang terbentuk semakin banyak. Sebaliknya pada media dengan penambahan BAP 3 mgL-1 jumlah rimpang akan semakin sedikit. Hasil interpretasi nilai korelasi menyatakan bahwa rimpang mikro berjumlah lebih banyak dan berukuran besar dipanen dari tunas-tunas yang berukuran kecil.
v Aklimatisasi dilakukan terhadap plantlet dari perlakuan yang memiliki rimpang mikro pada 12 MSP. Setelah 8 MST diperoleh rimpang mini pada setiap plantlet dari semua perlakuan yang diaklimatisasi. Seratus persen rimpang mikro yang diaklimatisasi mengalami peningkatan ukuran. Terdapat pertambahan jumlah rimpang sebesar 89.29% (5.3 rimpang mini per tanaman) dan ukuran diameter sebesar 47.68% (rata-rata berdiameter 0.99 cm). Bobot kering rimpang mini sebesar 8.73% dari bobot basahnya. Proses pengeringan rimpang mini menyebabkan penyusutan bobot hingga 91.27%. Rimpang mini berwarna kuning, memiliki ubi akar, berbau khas temulawak dan hanya terdiri dari rimpang primer. Warna kuning pada rimpang menandakan adanya kandungan kurkumin pada rimpang. Hasil analisa bahan aktif dengan metode HPLC menunjukkan rimpang mini menghasilkan kurkumin sebesar 0.17 mg/g dan xanthorrizol sebesar 7.88 mg/g.
vi Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; pengutipan tersebut tidak merugikan kepentingan yang wajar IPB
vii
TEMULAWAK (
Curcuma xanthorrhiza
Roxb.)
DELVI MARETTA
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains pada
Departemen Agronomi dan Agronomi
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
viii xanthorrhizaRoxb.)
Nama : Delvi Maretta
NRP : A151060131
Disetujui
Komisi Pembimbing
Dr. Ir. Darda Efendi, MSi Ketua
Dr. Ir. Sandra Arifin Aziz, MS Dr. Ir. Dodo Rusnanda Sastra, MSi
Anggota Anggota
Mengetahui
Ketua Program Studi Dekan Sekolah Pascasarjana
Agronomi
Dr. Ir. Munif Ghulamahdi, MS Prof. Dr. Ir. Khairil A. Notodiputro, MS
ix Alhamdulillah penulis panjatkan kehadirat Allah SWT atas karunia-Nya sehinggga karya ilmiah ini berhasil diselesaikan. Karya ilmiah ini merupakan hasil dari percobaan pembentukan rimpang mikro temulawak secara in vitro yang dilaksanakan sejak bulan Oktober 2008 hingga Mei 2010 di Laboratorium Pengembangan Teknologi Agro dan Biomedika, Kawasan Puspiptek Serpong.
Ucapan terimakasih penulis sampaikan kepada Dr. Ir. Darda Efendi, MSi, Dr. Ir. Sandra Arifin Aziz, MS dan Dr. Ir. Dodo Rusnanda Sastra, MSi selaku pembimbing yang telah memberikan saran dan arahan selama penulis melaksanakan penelitian dan penyusunan karya ilmiah ini. Terima kasih juga penulis ucapkan untuk Direktur Pusat Teknologi Produksi Pertanian, Badan Pengkajian dan Penerapan Teknologi beserta jajarannya, rekan-rekan sekerja di Bidang Teknologi Produksi Tanaman Pangan dan Hortikultura, teman-teman yang telah banyak membantu di LAPTIAB selama penelitian berlangsung, serta kepada Pusbindiklat yang telah mendanai studi penulis. Tak lupa penulis ucapkan terima kasih pada seluruh keluarga, mama, papa (alm), suami dan ananda tercinta atas
do’a, dukungan dan pengertian selama penulis menjalani studi. Semoga karya ilmiah ini bermanfaat.
Bogor, Oktober 2010
x Penulis dilahirkan di Palembang, 20 Maret 1979 dari ayah Sapuan dan Ibu Kurma. Penulis merupakan putri pertama dari tiga bersaudara. Tahun 2006 penulis menikah dengan Chan Jayadi dan dikaruniai satu putri bernama Alma Nurwasita.
Tahun 1997 penulis lulus dari SMU Muhammadiyah Yogyakarta. Di tahun yang sama penulis terseleksi menjadi mahasiswi IPB melalui jalur Undangan Seleksi Masuk IPB pada Program Studi Hortikultura – Jurusan Budidaya Pertanian Fakultas Pertanian.
xi
Halaman
DAFTAR TABEL ... xii
DAFTAR GAMBAR... xiii
DAFTAR LAMPIRAN ... xv
PENDAHULUAN Latar Belakang... 1
Tujuan ... 4
Hipotesis... 4
TINJAUAN PUSTAKA Botani Tanaman Temulawak... 5
Potensi dan Kegunaan Temulawak... 6
Propagasi Tanaman Temulawak... 7
Kultur Jaringan Tanaman ... 8
Keragaman Somaklonal dalam Kultur Jaringan Tanaman... 9
Analisis Kestabilan Genetik dengan Penanda DNA... 10
Mikropropagasi Tanaman Zingiberaceae... 10
Pembentukan Organ Bawah Tanah secaraIn vitro... 12
Zat Pengatur Tumbuh Golongan Sitokinin ... 13
Sumber Karbon Tanaman dalam KulturIn vitro... 14
BAHAN DAN METODE Tempat dan Waktu... 15
Bahan dan Alat ... 15
Metodologi Pengujian Kestabilan Genetik antar Generasi Plantlet... 16
Pembentukan Rimpang Mikro secaraIn vitro... 16
Pelaksanaan Pengujian Kestabilan Genetik antar Generasi Plantlet ... 20
Pelaksanaan Percobaan Pembentukan Rimpang Mikro... 22
HASIL DAN PEMBAHASAN Pengujian Kestabilan Genetik dengan Metode RFLP ... 26
Pengujian Kestabilan Genetik dengan Analisis Sequen ... 29
Kondisi Umum Tanaman pada Percobaan ... 32
Pengaruh Bentuk Fisik Media dan Sukrosa terhadap Pembentukan Rimpang Mikro... 33
Pengaruh Komposisi Media MS dan Sukrosa terhadap Pembentukan Rimpang Mikro... 36
Pengaruh BAP dan Sukrosa terhadap Pembentukan Rimpang Mikro. 39 Persemaian, Aklimatisasi dan Pasca Aklimatisasi ... 43
Pembahasan ... 49
SIMPULAN ... 53
DAFTAR PUSTAKA... 54
xii
Halaman
1. Luas panen, produksi dan produktivitas temulawak tahun 2000 s.d 2005 di Indonesia... 7
2. Rata-rata jumlah induksi rimpang mikro dan ukuran plantlet (15 MSP) 33
3. Nilai korelasi daun hijau dan daun mati pada 13, 14, 15 MSP ... 35
4. Rata-rata tinggi plantlet, jumlah tunas dan daun hijau pada 12 MSP.. 37
5. Korelasi panjang daun, jumlah daun mati, tinggi plantlet, panjang akar, dan jumlah tunas dengan jumlah rimpang mikro pada 18 MSP... 40
6. Korelasi panjang daun, jumlah daun mati, tinggi plantlet, panjang akar, dan jumlah tunas dengan diameter rimpang mikro pada 18 MSP ... 41
7. Uji lanjut pengaruh faktor tunggal sukrosa pada pra-aklimatisasi 12, 15 dan 18 MSP ... 41
8. Tinggi dan jumlah daun bibit temulawak berasal dari rimpang mikro 43
9. Pertambahan ukuran rimpang mikro dari plantlet umur 12 MSP setelah aklimatisasi selama 8 minggu... 45
xiii
Halaman
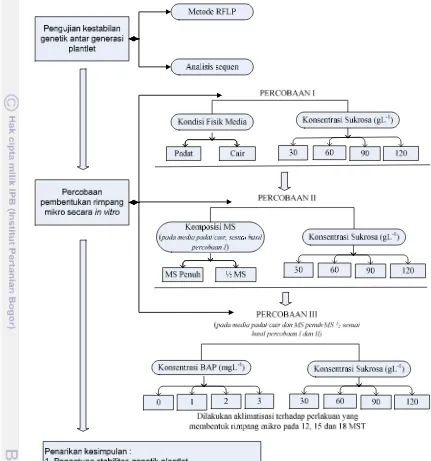
1. Bagan alir penelitian ... 19
2. Pembengkakan pada bagian basal (A) dan pembentukan rimpang
mikro (B) ... 24
3. Struktur rimpang temulawak ... 25
4. Kondisi tunasin vitropada sub-kultur ke-4 (A) dan sub-kultur kee-7 (B) saat 4 minggu setelah sub-kultur ... 26
5. Hasil elektroforasi total genom dan produk PCR ... 27
6. Elektroforasi hasil pemotongan DNA dengan enzim Taq1 ... 28
7. Elektroforasi hasil pemotongan DNA dengan enzim MBo1 dan Alu1 29
8. Elektroforasi produk PCR genom plantlet SK 12 (1) dan genom
tanaman induk (2) ... 30
9. Homologi hasil sequensing DNA tanaman induk dan plantlet SK 12 31
10. Pembengkakan pada bagan basal plantlet di media cair ... 33
11. Jumlah tunas rata-rata pada media padat dan media cair... 35
12. Pertambahan jumlah daun hijau dan daun mati pada media padat (A) dan media cair (B)... 35
13. Plantlet mati pada 18 MSP. Perlakuan media cair dengan sukrosa
30 gL-1(A) dan perlakuan media padat dengan sukrosa 90 gL-1(B) ... 36
14. Induksi rimpang pada perlakuan komposisi media ½ MS (A) dan
perlakuan media MS konsentrasi penuh (B) ... 37
15. Grafik pertambahan daun hijau dan mati pada media dengan sukrosa 30 gL-1(A), 60 gL-1(B), 90 gL-1(C) dan 120 gL-1(D) ... 38
16. Grafik jumlah rimpang mikro pada media tanpa BAP dan dengan
BAP 1, 2, dan 3 mgL-1... 39
xiv 19. Rimpang mikro yang bertunas di persemaian 1 MSS... 43
20. Bibit yang berasal dari persemaian rimpang mikro berumur 5 MSS .. 44
21. Pengaruh konsentrasi sukrosa terhadap jumlah, diameter dan bobot
basah rimpang mini setelah 8 MST aklimatisasi ... 45
22. Rimpang mini yang dipanen setelah 8 MST ... 46
23. Rimpang mini, ubi akar dan perakaran dari tanaman yang dipanen
setelah 8 minggu aklimatisasi... 46
xv
Halaman
1. Tabel komposisi media Murashige and Skoog... 61
2. Tabel rekapitulasi sidik ragam Percobaan I untuk peubah yang
diamati di dalam botol... 62
3. Tabel rekapitulasi sidik ragam Percobaan I untuk peubah yang
diamati saat pra-aklimatisasi ... 64
4. Tabel rekapitulasi sidik ragam Percobaan II untuk peubah yang
diamati di dalam botol... 65
5. Tabel rekapitulasi sidik ragam Percobaan II untuk peubah yang
diamati saat pra-aklimatisasi ... 67
6. Tabel rekapitulasi sidik ragam Percobaan III untuk peubah yang
diamati di dalam botol... 68
7. Tabel rekapitulasi sidik ragam Percobaan III untuk peubah yang
diamati saat pra-aklimatisasi ... 70
8. Tabel rekapitulasi sidik ragam pertumbuhan plantlet yang
diaklimatisasi pada umur 12 MSP ... 71
9. Tabel rekapitulasi sidik ragam pertumbuhan plantlet yang
diaklimatisasi pada umur 15 MSP ... 72
10. Tabel rekapitulasi sidik ragam pertumbuhan plantlet yang
Latar Belakang
Saat ini penggunaan obat tradisional mendapatkan perhatian secara global. Populasi penduduk yang telah menggunakan obat ini di negara China 40%, di Chili 71% dan di Columbia 40. Di India, 65% penduduknya menerapkan Ayurveda dan memanfaatkan tanaman obat untuk memenuhi kebutuhan pengobatan (WHO 2003). Tahun 2000 total pasar herbal dunia mencapai 20 miliar USD yang terdistribusi ke Eropa 34%, Amerika Utara 22 %, Asia 39% dan wilayah lainnya 5% (Indofarma 2005).
Indonesia memiliki keragaman hayati terbesar kedua di dunia setelah Brazilia yang meliputi 28,000 jenis tumbuhan berguna. Dari jumlah tersebut 1,200 jenis merupakan tumbuhan obat (Setiyono et al. 2000). Tumbuhan obat tersebut akan sangat bermanfaat bagi peningkatan devisa negara dan peningkatan perekonomian rakyat jika dibudidayakan dan diolah menjadi obat dan kosmetik yang bermutu yang dapat menembus perdagangan dunia (Sumaryono 2005). Pangsa pasar Indonesia dalam perdagangan obat tradisional masih tertinggal jauh dari Malaysia dan Thailand. Diperkirakan pada tahun 2010 pangsa pasar obat tradisional domestik akan meningkat menjadi Rp 7.2 triliun dari 2.0 triliun pada tahun 2003, kecenderungan yang sama akan terjadi juga di pasar global (Deptan 2005).
Temulawak (Curcuma xanthorrhiza Roxb.) adalah tumbuhan obat asli Indonesia yang memiliki banyak khasiat dan potensi untuk dikembangkan. Khasiat temulawak terutama disebabkan oleh kandungan senyawa berwarna kuning golongan kurkuminoid dan minyak atsiri yaitu xanthorrizol. Kurkuminoid berkhasiat menetralkan racun, menghilangkan rasa nyeri sendi, meningkatkan sekresi empedu, menurunkan kadar kolestrol dan trigliserida darah, sedangkan xanthorrizol berkhasiat mengobati kanker payudara, paru-paru, ovarium, antibakteri pencegah rusaknya email gigi (Sidik 2006).
menerapkan teknik sederhana dengan menggunakan bibit yang berasal dari rimpang yang sudah cukup tua dari tanaman yang dipanen ketika berumur sembilan bulan atau lebih. Semakin tinggi bobot rimpang bibit temulawak yang ditanam maka semakin tinggi hasil yang diperoleh (Djakamihardja et al. 1985). Penggunaan rimpang bibit berbobot 40g menghasilkan produksi rimpang per tanaman lebih tinggi dibandingkan penggunaan rimpang bibit berbobot lebih rendah (Kasiran 2008), akan tetapi pemakaian rimpang bibit berukuran besar untuk memperoleh hasil panen yang tinggi menyebabkan kebutuhan bibit cenderung besar, sehingga dapat mengurangi jumlah rimpang untuk konsumsi atau untuk olahan. Oleh karena itu, perlu suatu teknik pengadaan bibit temulawak yang sehat dan berkualitas serta hemat pemakaian bahan tanaman.
Aplikasi teknik meregenerasikan sel tanaman atau organ menjadi tanaman lengkap secara in vitro adalah teknologi yang dapat diterapkan untuk memenuhi kebutuhan bibit. Bibit yang dihasilkan dapat berupa plantlet atau rimpang mikro. Tyagi et al. (2006) dan Anisuzzaman et al. (2008) menyatakan bahwa rimpang mikro dapat ditanam secara langsung tanpa proses aklimatisasi sehingga penyediaan bibit tidak terhalang masa dormansi. Penyimpanan dan transportasi rimpang mikro untuk bibit dapat dilakukan lebih mudah karena ukurannya yang relatif kecil. Dengan menggunakan bibit rimpang mikro maka hasil panen tidak berkurang akibat sebagian digunakan untuk bibit. Rimpang mikro juga dapat dimanfaatkan untuk usaha konservasi plasma nutfah sehingga masa penyimpanan lebih lama dan lebih efisien.
keragaman somaklonal menjanjikan akurasi dan efisiensi yang tinggi karena perbedaan genetik dapat dilihat pada tingkat DNA sehingga tidak dipengaruhi lingkungan dan dapat dilakukan pada tahap awal pertumbuhan tanaman. Diantara teknik molekular berdasarkan pada polimorfisme gen secara langsung adalah Restricted Fragment Length Polymorphism (RFLP) dan analisis sequen. Analisis RFLP menggunakan enzim restriksi tertentu untuk melihat polimorfisme genom tanaman sedangkan pada analisis sekuen polimorfisme dilihat dari urutan basa sequen DNA dari fragmen tertentu suatu genom tanaman.
Induksi rimpang mikro merupakan pembentukan organ secara in vitro melalui jalur organogenesis yang terjadi apabila sel-sel dari suatu eksplan membelah kemudian berdiferensiasi membentuk suatu organ. Menurut Wattimena (2006) jalur regenerasi ditentukan oleh genotip, jenis dan umur eksplan, zat pengatur tumbuh, media, suhu dan penyinaran. Pada tanaman yang membentuk organ umbi atau rimpang, induksi akan berlangsung pada kondisi-kondisi tertentu yang memengaruhinya. Salisbury dan Ross (1992) menyatakan bahwa pembentukan organ penyimpanan akan diinduksi oleh sukrosa dan zat pengatur tumbuh yang ditambahkan pada media. Beberapa penelitian telah dilakukan untuk studi pembentukan rimpang mikro diantaranya pada tanaman jahe (Rahmawatiet al. 2003, Tyagi et al. 2006), temuputih (Anisuzzaman et al. 2008), kunyit (Shirgurkaret al.2001), tetapi belum dilakukan pada temulawak. Untuk itu perlu dilakukan penelitian pembentukan rimpang mikro terhadap temulawak.
mikroCurcuma aromaticaSalisb L pada media dengan konsentrasi sukrosa 60-90 gL-1(Nayak 2000).
Penelitian ini akan mengaplikasikan metode RFLP dan analisis sequen untuk menentukan jumlah tahapan sub-kultur yang tetap mempertahankan kestabilan genetik plantlet antar generasi. Selanjutnya plantlet akan digunakan sebagai bahan tanaman untuk percobaan pembentukan rimpang mikro secara in vitro.
Tujuan
Tujuan dari penelitian ini adalah :
1. Menentukan jumlah tahapan sub-kultur yang tetap mempertahankan kestabilan genetik plantlet antar generasi yang akan digunakan untuk induksi rimpang mikro temulawak menggunakan marka molekuler RFLP dan analisis sequen.
2. Mempelajari pengaruh bentuk fisik media (media cair dan padat), komposisi media (komposisi media MS konsentrasi penuh dan setengah konsentrasi), konsentrasi BAP dan sukrosa terhadap pertumbuhan eksplan dan pembentukan rimpang mikro temulawak pada kulturin vitro.
Hipotesis
1. Terdapat kestabilan genetik antar generasi plantlet hasil multiplikasi sub-kultur ke-3, 4, 5 dan 12 yang akan digunakan untuk induksi rimpang mikro temulawak secarain vitro
2. Terdapat pengaruh interaksi kondisi fisik media dan konsentrasi sukrosa terhadap pertumbuhan eksplan dan pembentukan rimpang mikro temulawak secarain vitro.
3. Terdapat pengaruh interaksi komposisi media dan konsentrasi sukrosa terhadap pertumbuhan eksplan dan pembentukan rimpang mikro temulawak secarain vitro.
Botani Tanaman Temulawak
Temulawak (Curcuma xanthorrhiza Roxb.) termasuk ke dalam suku Zingiberaceae yang merupakan tanaman terna tahunan (perennial) yang tumbuh merumpun. Tinggi tanaman ini berkisar 1.5–2 m yang merupakan tanaman tertinggi diantara kerabat semarganya. Batangnya tersusun atas upih-upih daun. Jumlah daun per batang 6–8 helai dengan bentuk helai jorong agak melonjong (oblong elliptic). Pada sisi kiri kanan ibu tulang daun biasanya terdapat tanda semacam pita memanjang berwarna merah keunguan. Pembungaannya muncul langsung dari rimpang (Exantha) dengan tinggi bunga 40–60 cm. Bagian atas pembungaan terdiri dari daun pelindung yang membentuk kantung-kantung. Daun-daun pelindung pada ujung pembungaann berwarna merah lembayung dan bersifat mandul. Kantung-kantung daun pelindung yang lain mengandung 3–5 kuntum bunga yang mekar satu per satu secara bergiliran. Bunga berwarna kuning (Prana 1985).
Rimpang temulawak berukuran besar terbagi menjadi dua bagian yaitu rimpang induk yang berbentuk bulat panjang dengan warna kuning tua atau coklat kemerahan dan pada bagian dalamnya berwarna jingga kecoklatan. Dari rimpang induk keluar rimpang kedua yang berukuran lebih kecil dengan jumlah 3–7 buah. Anak rimpang ini tumbuh ke arah samping dan berwarna lebih muda dan berbau khas temulawak serta rasanya pahit agak pedas. Ujung akar membengkak membentuk umbi kecil. Klasifikasi botani temulawak termasuk kedalam : (Syamsuhidayat dan Hutapea 1991) :
Kingdom : Plantae
Divisi : Spermatophyta Sub Divisi : Angiospermae Kelas : Monocotyledonae Ordo : Zingiberales Famili : Zingiberaceae Genus : Curcuma
Potensi dan Kegunaan Temulawak
Temulawak merupakan salah satu bahan baku obat tradisional yang potensi untuk dikembangkan. Impor temulawak oleh negara-negara Eropa sangat kecil dibandingkan dengan impor kunyit, tetapi penggunaannya sebagai obat di dalam negeri lebih banyak dibandingkan kunyit (Nurdjannah et al. 1994). Temulawak lebih banyak diproduksi, dikonsumsi dan diperdagangkan secara lokal tetapi antara tahun 1934-1938 kurang lebih 10 ton irisan kering temulawak diekspor setiap tahun dari Indonesia ke Belanda dan Jerman (Indofarma 2000).
Rimpang merupakan bagian dari tanaman temulawak yang banyak dimanfaatkan terutama untuk obat. Produk setengah jadi dari tanaman temulawak adalah simplisia, pati, minyak dan ekstrak, sedangkan produk industrinya adalah makanan/minuman, kosmetika, sirup, instan, bedak, tablet dan kapsul (Deptan 2005).
Menurut Hadi (1985) temulawak dikenal sebagai obat tradisional yaitu sebagai obat gangguan saluran cerna, penyakit kuning dan lainnya. Rimpang temulawak mengandung 0.1-0.3% kurkumin yang dapat menurunkan kadar kolesterol dalam darah dan hati. Kurkumin bersifat antihepatotoksik sehingga rimpang temulawak juga sering digunakan untuk mengobati beberapa penyakit hati. Selanjutnya dijelaskan bahwa temulawak mempunyai sifat merangsang produksi empedu dari sel hati dan mensekresikannya ke kandung empedu dan usus halus serta merangsang sekresi pankreas. Dengan adanya rangsangan tersebut maka temulawak dapat dimanfaatkan sebagai obat untuk beberapa penyakit saluran cerna yaitu pada kelainan hati kandung empedu, pankreas dan usus halus. Soenarjo (1985) menyatakan bahwa temulawak dapat digunakan sebagai obat untuk memperbaiki kerja fisiologi/metabolik dan meningkatkan kesuburan pada wanita maupun ternak betina.
Tabel 1. Luas panen, produksi dan produktivitas temulawak tahun 2000 s.d 2005 di Indonesia
Tahun Luas panen (m2) Produksi (kg) Produktivitas (kg/m2)
2000 6,014,696 5,674,042 0,94
2001 5,612,786 6,089,077 1,08
2002 5,075,686 7,173,513 1,41
2003 6,844,951 11,761,984 1,72
2004 10,548,033 16,666,504 1,58
2005 16,574,255 22,582,041 1,67
Sumber : Departemen Pertanian (www.deptan.go.id)
Semakin banyaknya pemanfaatan temulawak di kalangan masyarakat mendorong perluasan lahan panen dan produksi tanaman temulawak di Indonesia. Dari tahun 2000-2005 luas panen temulawak semakin meningkat yang diikuti dengan peningkatan produktivitas (Tabel 1). Hal ini didukung pula dengan dicanangkannya oleh Pemerintah Republik Indonesia Gerakan Nasional Minum Temulawak (GNMT) tepatnya pada tanggal 14 Juli 2005. Tujuan gerakan ini diantaranya untuk meningkatkan penggunaan temulawak secara luas oleh masyarakat dan menjadikannya produk unggulan Indonesia yang dapat bersaing di seluruh dunia (Info POM-Republika 2006).
Propagasi Tanaman Temulawak
segera ketika musim hujan. Rimpang temulawak yang mulai bertunas inilah yang dapat digunakan sebagai bibit. Hasil panen yang diperoleh pada umumnya tergantung pada kesuburan tanah serta besar kecilnya bibit yang ditanam. Semakin tinggi bobot rimpang bibit yang dipakai maka semakin tinggi hasil yang diperoleh (Djakamihardjaet al.1985).
Kultur Jaringan Tanaman
Kultur jaringan adalah suatu prosedur untuk menumbuhkan jaringan tanaman (kalus, sel, protoplas) dan organ (batang, akar, embrio) pada kondisi aseptik atau disebut juga dengan kulturin vitro. Perbanyakan tanaman secarain vitro disebut mikropropagasi tanaman (Hartmann 1997). Mikropropagasi secara umum dapat diartikan sebagai usaha meregenerasikan tanaman dalam media aseptik dan memperbanyaknya hingga menghasilkan tanaman sempurna (Gunawan 1992).
Regenerasi tanaman menggunakan metode kultur jaringan dapat dicapai dengan menumbuhkan bagian tanaman yang bersifat meristematik secara langsung melalui pembentukan tunas adventif atau tidak langsung melalui pembentukan kalus terlebih dahulu (Armini et al. 1991). Regenerasi tanaman secara langsung atau tidak langsung tersebut akan melalui salah satu dari dua proses yaitu organogenesis atau embrio somatik. Organogenesis adalah proses pembentukan salah satu organ tunas atau akar sedangkan embrio somatik adalah pembentukan struktur bipolar yang terdiri dari meristem pucuk dan akar (Phillips dan Hubstenberger 1995) .
diperbanyak secara generatif dan tanaman yang banyak diminta pasar dalam waktu singkat. Perbanyakan dengan teknikin vitroini dapat juga digunakan untuk memperoleh tanaman yang bebas patogen, tanaman yang mempunyai sifat yang sama dengan induknya dan memungkinkan penyediaan tanaman sepanjang tahun.
Keragaman Somaklonal dalam Kultur Jaringan Tanaman
Kultur jaringan pada mulanya untuk membuktikan teori totipotensi sel dimana sel dapat tumbuh dan berkembang menjadi tanaman lengkap. Pada perkembangan selanjutnya teknik ini dipakai dalam propagasi tanaman secara in vitrountuk menghasilkan bibit tanaman yang sama dengan induknya dan seragam disebut dengan istilah true to type (Gunawan 1992). Pada kenyataannya dalam propagasi in vitro terdapat ketidakstabilan somatik sekalipun terjadi dalam frekuensi yang rendah (Wattimena dan Mattjik 1992).
Istilah variasi somaklonal diperuntukkan bagi regeneran dari perbanyakanin vitro yang mengalami perubahan epigenetic yang muncul pada tanaman hasil perbanyakan kultur jaringan (Larkin dan Scowcroft 1981 dalam Wattimena dan Mattjik 1991). Salah satu penyebab terjadinya variasi somaklonal adalah penggunaan zat pengatur tumbuh pada media perbanyakan dalam kurun waktu yang lama (Jayasankar 2005). Bairuet al.(2006) melaporkan bahwa zat pengatur tumbuh menyebabkan variasi somaklonal pada pisang Cavendish secara tidak langsung sejalan dengan peningkatan multiplikasi. Makin tinggi tingkat multiplikasi maka akan semakin besar variasi yang terjadi. Biswas et al. (2009) menyatakan bahwa BAP konsentrasi tinggi dapat menginduksi terjadinya variasi somaklonal pada mikropropagasi strawberi.
induksi variasi somaklonal tanaman strawberi secara in vitro paling efektif diperoleh dari sumber eksplan tunas meristem.
Analisis Kestabilan Genetik dengan Penanda DNA
Kestabilan genetik diartikan sebagai tampilan konsisten sebuah karakter dari sebuah genotipe pada berbagai lingkungan atau waktu (Fernandez 1991). Variasi somaklonal merupakan ketidakstabilan somatik yang dapat berlanjut pada kultur in vitro meskipun perbanyakan tanaman selalu dilakukan secara vegetatif (Wattimena dan Mattjik 1992). Terdapat perbedaan antar variasi dan mutasi. Variasi merupakan perubahan fenotip antar generasi sedangkan mutasi lebih mengarah pada keberadaan perubahan susunan genetik yang kadang tidak terekspresikan secara fenotipik (Jayasankar 2005).
Kemajuan teknologi penanda DNA berkembang sangat pesat sejalan dengan perkembangan fasilitas mesin PCR yang semakin canggih. Teknologi ini dapat diaplikasikan untuk fingerprinting genotip dalam penentuan kemurnian benih (Kumar 1999). Penggunaan teknologi penanda DNA sangat efisien untuk menentukan keberadaan variasi somaklonal ataupun kestabilan genetik tanaman yang diperbanyak secara in vitro. Penanda RAPD (Random amplified polymorphicDNA) digunakan untuk mengetahui kestabilan genetik klon tanaman apel hasil mikropropagasi (Modgil et al. 2005), mengetahui keberadaan variasi somaklonal pada plantlet pisang hasil multiplikasi berulang (Bairu 2006) serta mendeteksi variasi somaklonal pada 9 generasi sub-kultur plantlet strawberi hingga aklimatisasi (Minano 2009). Teknik AFLP (Amplified Fragment Length Polymorphism) dapat mendeteksi 99% keseragaman genetik klon hasil mikropropagasi Echinacea purpurea (Chuang et al. 2009). Penanda RFLP (Restriction Fragment Length Polymorphisms)telah digunakan untuk mengetahui kesamaan genetik antar aksesi pisang dan pendugaan keanekaragaman genetik tanaman melon (Silberstein 1997) dan tanaman pisang (Ning 2007)
Mikropropagasi Tanaman Zingiberaceae
diantaranya kencur, jahe, kunyit, dan temulawak. Seswita (1996) melaporkan bahwa aplikasi kultur jaringan tanaman kencur (Kaempferia galangaL. Seedling) pada media cair lebih baik daripada media padat. Kultur tanaman kencur dengan eksplan dari mata tunas pada media MS cair dengan penambahan BA 1 mgL-1dan IAA 1 mgL-1 selama dua minggu terbentuk rata-rata 10.2 tunas. Proses aklimatisasi menggunakan media tanah saja atau campuran tanah dan pupuk kandang (1:1) memberikan persentase keberhasilan yang cukup tinggi yaitu 70-80%.
Gati et al. (1989) menyatakan bahwa eksplan jahe merah (Zingiber officinaleRosc) yang ditanam pada media dasar MS yang diperkaya dengan BAP dapat membentuk kalus yang kompak kemudian membentuk tunas adventif dan akhirnya membentuk tanaman lengkap. Pemakaian BAP 10 mgL-1 dan NAA 0.1 mgL-1 efektif merangsang penumbuhan tunas adventif secara tidak langsung. Setiap tunas adventif yang terbentuk dapat dikembangkan secara sempurna dengan melakukan sub kultur dalam medium baru yang mengandung kinetin 1 mgL-1, masing-masing mata tunas dapat membentuk lebih dari satu tunas adventif. Ikeda dan Tanabe (1989) melaporkan bahwa tanaman jahe yang dikulturkan secara pada medium dasar MS dengan penambahan 11 uM BA dan 0.6 uM NAA menghasilkan rata-rata 5 tunas dan 15.3 akar. Khatun et al. (2003) melaporkan bahwa kultur ujung pucuk jahe secara in vitro pada media MS dengan penambahan 2.5 mgL-1 BAP dan 0.5 mgL-1 kinetin dapat diperoleh 22 tunas per eksplan dimana waktu yang dibutuhkan untuk induksi tunas selama 26 hari dan induksi akar selama 30 hari. Seratus persen plantlet yang dihasilkan dapat tumbuh di lapang tanpa proses aklimatisasi.
BAP 1 mgL-1 dapat dipilih untuk multiplikasi tunas, pertumbuhan daun dan meningkatkan jumlah akar kunyit. Penambahan IBA dengan konsentrasi 0.25 mgL-1 berpengaruh nyata terhadap pertambahan panjang akar in vitro tunas kunyit.
Mukhri et al. (1985) melaporkan bahwa tunas in vitro temulawak yang ditanam pada media Ringe dan Nitsch (RN) yang diperkaya dengan 1 mgL-1 BA dan 1 mgL-1 NAA akan membentuk akar. Jika tunas ditanam pada media RN dengan penambahan 10 mgL-1BA dan 15 mgL-1NAA maka akan terbentuk kalus. Djajanegara dan Zatnika (1996) melaporkan bahwa tunas dari rimpang temulawak adalah sumber eksplan yang paling responsif dalam pembentukan kalus dan kalus akan tumbuh optimum pada media Gamborg B5 dengan penambahan 1.0 mgL-1 2,4D.
Pembentukan Organ Bawah Tanah secaraIn vitro
Percobaan pembentukan organ bawah tanah secara in vitro telah banyak dilakukan terhadap berbagai jenis tanaman, diantaranya kentang, bawang merah, jahe, dan lili. Pembentukkan organ tersebut pada masing-masing tanaman membutuhkan kondisi media dan lingkungan tumbuh tertentu. Rahmawati (2007) melaporkan hasil percobaan pembentukan umbi mikro bawang merah dapat terjadi pada media MS padat ditambah dengan sukrosa 30 gL-1 dan tanpa penambahan ZPT dengan penyinaran selama 16 jam, penambahan retardan SADH berpengaruh pada penurunan jumlah umbi mikro yang terbentuk.
membantu dalam pembentukan rimpang dibandingkan sumber karbohidrat dari jenis lain.
Zat Pengatur Tumbuh Golongan Sitokinin
Hormon didefinisikan sebagai senyawa organik bukan nutrisi yang aktif dalam jumlah kecil (10-6-10-5 mM) yang disintesiskan pada bagian tertentu tanaman dan pada umumnya diangkut ke bagian lain tanaman yang akan menimbulkan tanggapan secara biokimia, fisiologis dan morfologis. Hormon seringkali diistilahkan sebagai zat pengatur tumbuh tanaman (ZPT) karena istilah tersebut mencakup zat endogen maupun zat eksogen yang dapat mengubah pertumbuhan tanaman (Wattimena 1988).
Dalam kultur jaringan, dua golongan zat pengatur tumbuh yang sangat penting adalah sitokinin dan auksin. Zat pengatur tumbuh ini akan mempengaruhi pertumbuhan dan morfogenesis dalam kultur sel, jaringan dan organ. Interaksi dan perimbangan antar ZPT yang diberikan dalam media dan yang diproduksi oleh sel secara endogen akan menentukan arah perkembangan suatu kultur (Gunawan 1992).
Sitokinin adalah ZPT yang merupakan turunan dari adenin, yang dikarakterisasi karena kemampuannya menginduksi pembelahan sel dalam jaringan. Semua sitokinin memiliki rantai samping yang kaya akan karbon dan hidrogen, yang menempel pada nitrogen yang menonjol dari puncak cincin purin. Setiap sitokinin bisa ditemukan dalam bentuk basa bebas atau sebagai nukleosida yang gugus ribosanya melekat pada atom nitrogen pada kedudukan 9 (Salisbury dan Ross 1992).
Sumber Karbon Tanaman dalam KulturIn vitro
Sebagian besar tanaman dalam kultur in vitro tidak dapat melakukan fotosintesis secara efektif, dikarenakan berbagai hal : sel-sel belum terorganisasi dengan baik, jaringan belum terbentuk sempurna, kurangnya kandungan klorofil, terbatasnya pertukaran udara (CO2 dan O2) dalam botol kultur, dan tidak
terdapatnya kondisi lingkungan tumbuh yang optimum salah satunya adalah rendahnya intensitas cahaya (Beyl 2005). Pada kondisi tumbuh yang heterotrop demikian, tanaman tidak dapat menyintesis sendiri kebutuhan akan karbonnya. Oleh karena itu, sumber karbon harus disediakan untuk energi pertumbuhan tanaman. Taji et al. (1993) menyatakan sumber karbon yang dapat digunakan dapat berupa glukosa, maltosa, galaktosa dan laktosa, tetapi yang umum digunakan adalah sukrosa. Menurut Gunawan (1992) sukrosa dalam media akan dihidrolisa menjadi monosakarida selama dalam kultur. Taji et al. (1993) menyatakan bahwa sukrosa akan mengalami hidrolisa menjadi glukosa dan fruktosa ketika dilakukan proses sterilisasi dalam autoclave. Glukosa dan fruktosa digunakan lebih efisien oleh tanaman dalam kultur.
Gamborg dan Phillips (1995) menyatakan bahwa karbohidrat memegang peranan penting dalam mempertahankan potensial osmotik media. Sukrosa akan meningkatkan potensial osmotik sejalan dengan terjadinya proses hidrolisa sukrosa menjadi glukosa dan fruktosa (Beyl 2005).
Tempat dan Waktu
Penelitian ini dilakukan di Laboratorium Pengembangan Teknologi Industri Agro dan Biomedika (LAPTIAB) BPPT, di Kawasan Puspiptek, Serpong. Kegiatan berlangsung dari bulan Oktober 2008- Mei 2010.
Bahan dan Alat
Bahan tanaman yang digunakan adalah tanaman temulawak berasal dari daerah Pagar Alam – Sumatera Selatan dan diperbanyak secara in vitro. Bahan tanaman yang digunakan merupakan hasil kultur berulang mulai dari sub-kultur ke-3 hingga ke-12. Media digunakan untuk multiplikasi tunas adalah media Murashige dan Skoog (MS) dengan penambahan BAP 2 mgL-1 dan IBA 0.5 mgL-1, agar 8 gL-1 dan sukrosa 30 gL-1. Tunas yang telah bermultiplikasi dipisah-pisah menjadi tunas tunggal sebagai propagul untuk pembentukan rimpang mikro. Sebelum diinkubasikan ke dalam media perlakuan propagul dibersihkan dari akar dan daun. Propagul yang digunakan berukuran ± 3 cm.
Bahan-bahan yang digunakan untuk pengujian keseragaman genetik plantlet adalah nitrogen cair, tris HCl, EDTA, NaCl, β-mercapto etanol, K-asetat, chloroform-isoamyl, isopropanol, RNAase, larutan TE, larutan SDS. Untuk proses amplifikasi PCR digunakan dua primer yaitu primer yang disusun dari DNA mitokondria temuputih (Sasaki et al. 2004) dan primer yang disusun dari DNA MatK kloroplas temuputih (Hausneret al. 2006). Kedua primer ini dimodifikasi dari DNA temuputih (Curcuma zedoaria) di Gen Bank menggunakan program genetik komputasi dengan software Genetics 7.0. Bahan yang digunakan untuk perlakuan stimulasi rimpang mikro adalah komposisi media Murashige and Skoog (MS), benzylaminopurin (BAP) dan sukrosa, bahan pemadat (agar) dan kertas saring.
diseksi (scalpel, gunting, dan pinset), pembakar spritus, dan rak kultur yang dilengkapi dengan lampu influorescent.
Metodologi
Penelitian terdiri dari pengujian kestabilan genetik antar generasi plantlet dan percobaan stimulasi rimpang mikro secarain vitro(Gambar 1).
Pengujian Kestabilan Genetik antar Generasi Plantlet
Pengujian kestabilan genetik dilakukan terhadap 5 sampel daun temulawak yaitu daun juvenil temulawak tanaman induk, daun plantlet dari sub-kultur ke-3 (SK 3), ke-4 (SK 4), ke-5 (SK 5) dan sub-kultur ke-12 (SK 12). Dilakukan dua metode pengujian yaitu Restriction Fragment Length Polymorphism (RFLP) dan metode sequensing. Kegiatan yang dilakukan meliputi isolasi total genom tanaman temulawak, amplifikasi menggunakan primer spesifik, pemotongan menggunakan enzim dan sequensing.
Pembentukan Rimpang Mikro secaraIn vitro
Percobaan pembentukan rimpang mikro terdiri dari tiga percobaan secara berseri yaitu :
a) Percobaan I : Pengaruh bentuk fisik media dan sukrosa terhadap pertumbuhan dan pembentukan rimpang mikro temulawak
b) Percobaan II : Pengaruh komposisi media MS dan sukrosa terhadap pertumbuhan dan pembentukan rimpang mikro temulawak
c) Percobaan III : Pengaruh BAP dan sukrosa terhadap pertumbuhan dan pembentukan rimpang mikro temulawak
Percobaan II akan dilakukan berdasarkan hasil dari percobaan I sedangkan percobaan III akan dilakukan berdasarkan hasil dari percobaan I dan II.
Percobaan I : Pengaruh Bentuk Fisik Media dan Sukrosa
penambahan agar serbuk. Pada media cair digunakan kertas saring sebagai penyanggah bahan tanaman (tanpa dikocok menggunakan shaker). Semua kultur dipelihara dalam lingkungan tumbuh gelap selama 16 jam setiap hari.
Faktor A adalah bentuk fisik media yang terdiri dari 2 taraf yaitu padat dan cair. Faktor B adalah konsentrasi sukrosa dengan 4 taraf konsentrasi yaitu 30, 60, 90 dan 120 gL-1. Terdapat 8 kombinasi perlakuan (dalam rancangan faktorial acak lengkap) dengan 10 ulangan per perlakuan sehingga terdapat 80 satuan percobaan pada Percobaan I.
Percobaan II : Pengaruh Komposisi Media MS dan Sukrosa
Kondisi fisik media (padat atau cair) ditentukan berdasarkan hasil penelitian pada percobaan I. Sebagai faktor A adalah komposisi media MS yang terdiri dari 2 taraf yaitu ½ konsentrasi media MS dan konsentrasi penuh. Faktor B adalah konsentrasi sukrosa dengan 4 taraf konsentrasi yaitu 30, 60, 90 dan 120 gL-1. Terdapat 8 kombinasi perlakuan (dalam rancangan faktorial acak lengkap) dengan 20 ulangan per perlakuan sehingga terdapat 160 satuan percobaan pada Percobaan II. Selama percobaan berlangsung kultur dipelihara dalam lingkungan tumbuh gelap selama 16 jam setiap hari.
Jika pada perlakuan tertentu terdapat pembentukan rimpang mikro maka ketika kultur berumur 12, 15 dan 18 MST akan dilakukan aklimatisasi (selama 8 minggu) dan pengamatan anatomi rimpang mikro. Pada masing-masing perlakuan pada umur tersebut akan diambil 3 botol untuk aklimatisasi dan 3 botol untuk pengamatan anatomi rimpang mikro.
Percobaan III : Pengaruh BAP dan Sukrosa
maka akan dilakukan aklimatisasi ketika kultur berumur 12, 15 dan 18 MST selama 8 minggu. Pada masing-masing waktu akan diambil 3 botol per perlakuan.
Model Statistik
Rancangan percobaan I, II dan III akan menggunakan rancangan faktorial acak lengkap. Data dianalisis dengan sidik ragam dan apabila hasilnya berbeda nyata akan dilakukan uji lanjut DMRT (Duncan Multiple Range Test) pada taraf kesalahan 5 %.
Model linier aditif dari rancangan faktorial acak lengkap adalah :
Yijk=
µ + α
i+
β
j+ (
αβ
)
ij+
ε
ijkYijk: Nilai pengamatan pada faktor A taraf ke-i faktor B taraf ke-j dan
ulangan ke-k
µ:
Nilaitengah umum (rata-rata)α
i : Pengaruh faktor APercobaan I : A = Pengaruh kondisi media ke-i (i = media padat, media cair).
Percobaan II : A = Pengaruh komposisi media MS ke-i (i = konsentrasi penuh, setengah konsentrasi).
Percobaan III : A = Pengaruh konsentrasi BAP ke-i (i = 0, 1, 2 , 3 mgL-1)
β
j: Pengaruh faktor BPercobaan I, II dan III : B = Pengaruh konsentrasi sukrosa ke-j (j = 30, 60, 90, 120 gL-1).
(
αβ
)
ij: Komponen interaksi faktor A dan faktor BPelaksanaan Pengujian Kestabilan Genetik antar Generasi Plantlet
Pelaksanaan pengujian keseragaman plantlet temulawak terdiri dari isolasi total genom, amplifikasi PCR, restriksi DNA menggunakan enzim restriksi dan sequensing. Isolasi total genom dilakukan terhadap daun juvenil dari tanaman temulawak tanaman induk, daun plantletin vitrosub-kultur ke-3, 4, 5 dan ke-12.
Isolasi total genom tanaman temulawak
Daun juvenil dari tanaman temulawak ditimbang 4 g kemudian digerus menggunakan mortal dan pistil yang diberi nitrogen cair. Kemudian tepung halus tersebut dimasukkan dalam tabung 15 ml dan ditambahkan 4.5 ml buffer ekstraksi A (100 mM Tris HCl pH 8, 50 mM EDTA pH 8, 500 mM NaCl dan 1% mercaptoethanol) yang telah dihangatkan padawaterbath 65 °C campur secara perlahan kemudian tambahkan 600 µl 10% SDS yang telah dihangatkan pada waterbath 65 °C kemudian diinkubasi pada suhu 65 °C selama 30 menit. Selanjutnya campuran tersebut ditambahkan 1.5 ml 5 M K-Acetat dan diinkubasi di es selama 10 menit, tambahkan 1 volume (± 6 ml ) chloroform-iso amyl (24:1) dan campur secara berlahan.
Campuran tersebut kemudian disentrifuse dengan kecepatan penuh selama 40 menit, kemudian fase aqueous dipindahkan pada tabung baru dan ditambahkan 0.6 volume isopropanol dan diinkubasi pada suhu ruang selama 30 menit. Kemudian disentrifuse selama 40 menit dan buang supernatant, pellet dicuci menggunakan alkohol 70% etanol (5 ml) dan disentrifuse selama 10 menit, kemudian buang supernatant dan pellet dikeringanginkan. Setelah pellet dikeringanginkan dilarutkan dengan 500 µl buffer TE pH 8, ditambahkan RNase (7 ml) dan diinkubasi pada suhu 37 °C selama 1 jam, RNase disimpan pada suhu -20 °C.
menggunakan buffer TE. Konfirmasi hasil isolasi DNA genom tanaman dilakukan dengan elektroforesis yang dilakukan dengan gel agarose 0.8% dengan tegangan 100 V selama 20-30 menit.
Metode Pengujian RFLP
Amplifikasi PCR menggunakan primer forward yaitu 5’
-CTTTGGGAGGGATGCATTTA-3’ (TLF) dan primer reverse
5’-AACCAGACAAATCGCTCCAC-3’(TLR). Campuran reaksi PCR untuk satu sampel DNA sebanyak 1 µl terdiri atas campuran air bebas nuklease sebanyak 16.4 µl, 10x buffer PCR sebanyak 2.5µl, dNTPmixture sebanyak 2.5 µl, primer forward (20 pmol/µl) sebanyak 1 µl, primerreverse(20 pmol/µl) sebanyak 1 µl, DNA Tag polymerase sebanyak 0.6 µl dan sample DNA 1µl sehingga total campuran 25µl yang merupakan volume akhir dari PCRproduct.
Kondisi PCR diawali dengan dengan tahap pradenaturasi pada suhu 95 °C selama 5 menit, kemudian 30 siklus untuk tahap denaturasi pada suhu 95 °C selama 30 detik, annealing pada suhu 51 °C selama 30 detik, dan polimerisasi pada suhu 72 °C selama 1 menit kemudian diikuti polimerisasi lanjutan pada suhu 72°C selama 5 menit dan diakhiri dengan tahap rest pada suhu 4 °C. Sampel DNA hasil amplifikasi kemudian dielektroforesis dengan gel agaros 0.8% dengan tegangan 100 V selama 20-30 menit.
Hasil PCR tanaman temulawak di-digest menggunakan enzim restriksi MBo1, Alu1, dan Taq1. Pemotongan produk PCR dilakukan berdasarkan prosedur yang tertera pada manual Fermentas. Komposisi reaksi terdiri 3 µl PCR product, 0.5 µl enzim, 1 µl 10 x buffer (sesuai dengan enzim yang digunakan) dan 5.5 µl air bebas nuklease. Untuk melihat hasil restriksi dilakukan elektroforesis dengan gel agaros 0.8%.
Metode Pengujian Sequensing
Amplifikasi PCR menggunakan primer forward yaitu 5’ -ATTCCATTTTCGCTGCAGTT-3’ (MatKF) dan primer reverse
16.4 µl, 10x buffer PCR sebanyak 2.5µl, dNTPmixture sebanyak 2.5 µl, primer forward (20 pmol/µl) sebanyak 1 µl, primerreverse(20 pmol/µl) sebanyak 1 µl, DNA Tag polymerase sebanyak 0.6 µl dan sample DNA 1µl sehingga total campuran 25µl yang merupakan volume akhir dari PCRproduct.
Kondisi PCR diawali dengan dengan tahap pradenaturasi pada suhu 95 °C selama 5 menit, kemudian 30 siklus untuk tahap denaturasi pada suhu 95 °C selama 30 detik,annealing pada suhu 45.6 °C selama 30 detik, dan polimerisasi pada suhu 72 °C selama 1 menit kemudian diikuti polimerisasi lanjutan pada suhu 72 °C selama 5 menit dan diakhiri dengan tahap rest pada suhu 4 °C. Sampel DNA hasil amplifikasi kemudian dielektroforesis dengan gel agaros 0.8% dengan tegangan 100 V selama 20-30 menit, PCRproductdisimpan pada suhu -20°C.
Hasil PCR kemudian akan di-sequensing menggunakan Kit PRISM (Ready Reaction Dye Primer UniCycle Sequencing) dari Biosystems yang ditambahkan primer MatKF dan primer MatKR dalam dua campuran yang terpisah. Reaksi sequensing menggunakan alat automatic sequence analyzer dari Biosystem Genetic Analyzer 3130. Untuk mengetahui kualitas hasil sequensing dilakukan pengukuran intensitas sinyal panjang gelombang menggunakan Software Sequence ScannerVol 1.0
Pelaksanaan Percobaan Pembentukan Rimpang Mikro
Pelaksanaan percobaan induksi rimpang mikro temulawak secara in vitro meliputi penyiapan bahan tanaman (penunasan rimpang temulawak), sterilisasi aquades, alat-alat dan botol, sterilisasi bahan tanaman, pembuatan larutan stok, pembuatan dan sterilisasi media, penanaman pada media perlakuan, pemeliharaan, dan pencatatan data
Persiapan Alat dan Media
Untuk memudahkan membuat media komposisi media MS disimpan dalam larutan stok. Larutan stok yang disiapkan adalah stok A (persenyawaan NH4NO3),
B (persenyawaan KNO3), C (Persenyawaan KH2PO4, H3BO3, KI,
Na2MoO4.2H2O, dan CoCl2.6H2O), D (CaCl2.2H2O), E (MgSO4.7H2O,
MnSO4.4H2O, ZnSO4.7H2O dan CuSO4.5H2O, F (Na2EDTA dan FeSO4.7H2O),
myo inositol dan vitamin dengan konsentrasi tertentu. Zat pengatur tumbuh juga disimpan dalam bentuk larutan stok sesuai dengan kebutuhan. Semua larutan stok disimpan dalam lemari es, khusus untuk larutan stok F botol dibungkus dengan Alu1munium foil terlebih dahulu sebelum disimpan dalam lemari es.
Prosedur pembuatan 1 l media MS adalah sebagai berikut : sejumlah larutan stok (Lampiran 1) dipipet kemudian dimasukkan ke dalam labu takar 1 l yang telah diisi dengan aquades 1/3 volume. Air kelapa atau BAP ditambahkan ke dalam labu takar sesuai dengan perlakuan. Sukrosa ditimbang sesuai dengan perlakuan, setelah dilarutkan dengan sejumlah aquades dimasukkan ke dalam labu takar. Tambahkan aquades sampai tanda tera (1 l) dan pH diatur supaya berkisar antara 5.6-5.8 dengan menambahkan KOH/NaOH atau HCl 1 N. Larutan ini dituang ke dalam botol, diberi kertas saring dan ditutup dengan plastik kemudian disterilisasi menggunakan autoclave.
Sterilisasi Eksplan
Setelah tunas temulawak dicuci dengan sabun, tunas dibiarkan di bawah air mengalir selama 30 menit. Selanjutnya di dalam laminar tunas tersebut direndam dalam larutan sabun (super pell) 15% selama 15 menit kemudian dibersihkan dengan aquades sebanyak 3 kali. Setelah itu, direndam dalam larutan dithane-M45 2 gL-1 dan 2 tetes tween selama 20 menit dan dibilas dengan aquades sebanyak 3 kali.
Pengamatan dan Pencatatan Data KulturIn vitro
Pengamatan dilakukan seminggu sekali. Persentase kontaminasi dan jenis kontaminan diamati untuk melihat kondisi umum kultur. Parameter yang diamati setiap minggu dimulai dari satu minggu setelah perlakuan (MSP) ketika plantlet masih di dalam botol adalah :
1. Jumlah daun hijau dan daun mati 2. Jumlah akar
3. Jumlah tunas
Parameter yang diamati di luar botol dengan cara mengeluarkan plantlet dari botol kultur pada 12, 15 dan18 MST adalah :
1. Tinggi plantlet
2. Lebar dan panjang daun yang terpanjang
3. Jumlah pembengkakan bagian basal dan jumlah rimpang mikro dalam kultur (Gambar 2)
Gambar 2 Pembengkakan pada bagian basal (A) dan pembentukan rimpang mikro (B)
4. Panjang akar (diukur dari pangkal munculnya akar sampai ujung akar yang terpanjang)
5. Rimpang pada Gambar 3 (struktur anatomi, diameter, warna, aroma, akar yang muncul dari rimpang dan keberadaan rimpang sekunder)
Parameter yang diamati ketika aklimatisasi adalah : 1. Tinggi tanaman
2. Persentase tanaman hidup A
3. Ukuran diameter rimpang mini 4. Bobot rimpang mini
Gambar 3 Struktur rimpang temulawak Rimpang primer
Rimpang sekunder
Ubi akar
Pengujian Kestabilan Genetik dengan Metode RFLP
Genetik plantlet temulawak diharapkan tetap memiliki kestabilan genetik antar generasi sub-kultur, akan tetapi pada tahap perbanyakan fenotipik plantlet memperlihatkan pertumbuhan yang kurang baik sejak sub-kultur ke-4. Pertumbuhan kultur yang kurang baik ditandai dengan ukuran tunas kerdil, multiplikasi menurun dari 5-7 pada sub-kultur ke-4 menjadi 1-3 tunas per eksplan pada sub-kultur ke-7, dan daun cepat mengalami senesen yang ditandai dengan sebagian daun mengalami perubahan warna dari hijau menjadi kuning (Gambar 4).
Gambar 4 Kondisi tunasin vitropada sub-kultur ke-4 (A) dan sub-kultur ke-7 (B) saat 4 minggu setelah sub-kultur
Total genom dari 5 sampel (tanaman induk, plantlet sub-kultur ke-3, 4, 5 dan 12) yang diuji berhasil diisolasi dari bagian daun juvenil dan dapat diamplifikasi dengan PCR menggunakan primer forward5’
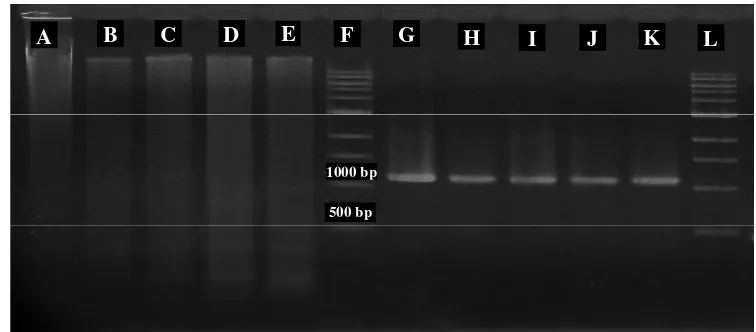
-CTTTGGGAGGGATGCATTTA-3’ dan primer reverse TML R 5’-AACCAGACAAATCGCTCCAC-3’. Gambar elektroforasi hasil amplifikasi PCR menunjukkan genom berukuran 1 kb dan sama pada semua sampel yang diuji (Gambar 5).
Gambar 5 Hasil elektroforasi total genom dan produk PCR
Ket : Total genom tanaman induk (A); Total genom DNA plantlet SK 3 (B); Total genom plantlet SK 4 (C); Total genom plantlet SK 5 (D); Total genom plantlet SK 12 (E); Marker 1 kb (F); Produk PCR tanaman induk (G); Produk PCR plantlet SK 3 (H); Produk PCR plantlet SK 4 (I); Produk PCR plantlet SK 5 (J); Produk PCR plantlet SK 12 (K); Marker 1 kb (L).
Teknik RFLP menggunakan enzim restriksi untuk mengetahui kesamaan atau perbedaan antar sekuens DNA dari 5 sampel yang diuji. Enzim restriksi Taq1 akan mengenali dan memotong sequen T-CGA, enzim MBo1 mengenali dan memotong sequen –GATC dan Alu1 pada sequen AG-CT. Kestabilan genetik dapat dilihat dari pola pita DNA yang dihasilkan oleh potongan-potongan enzim restriksi. Enzim-enzim restriksi akan memotong sequen DNA yang dikenalinya dan hasil pemotongan masing-masing enzim akan menunjukkan pola fragmen dengan panjang yang berbeda. Gambar 6 dan 7 merupakan hasil elektroforasi pemotongan DNA sampel-sampel yang diuji, yang menunjukkan kesamaan pola pita pemotongan pada lima sampel DNA tanaman. Hal demikian berarti enzim-enzim memotong DNA lima sampel tersebut pada sequen basa dan ukuran panjang fragmen yang sama. Menurut Hartl (1994) perbedaan panjang fragmen dapat dilihat dari hasil elektroforasi. Dari hasil tersebut kemungkinan besar terdapat kestabilan genetik plantlet antar generasi sub-kultur in vitrotemulawak sehingga plantlet yang digunakan untuk induksi rimpang mikro true to type. Hal tersebut dimungkinkan, karena sumber tanaman yang digunakan untuk perbanyakan adalah tunas meristem yang merupakan organ vegetatif tanaman.
A B C D E F G H I J K L
Selaras dengan laporan Borchetia et al. (2009) yang menyatakan bahwa mikropropagasi tanamanCamelliaspp dari tunas aksilar menghasilkan klon yang true to type. Klon in vitro tanaman gerbera berasal dari tunas pucuk menurut Bhatia et al.(2009) menunjukkan kesamaan genetik, begitu pula halnya menurut Minanoet al. (2009) pada klon tanaman krisanthemum hasil mikropropagasi.
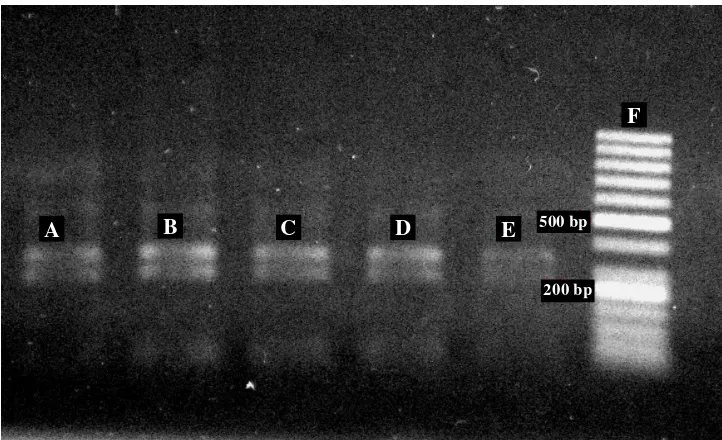
Gambar 6 Elektroforasi hasil pemotongan DNA dengan enzim Taq1
Ket : Pemotongan dengan enzim Taq1 pada DNA tanaman induk (A); pada DNA plantlet SK 3 (B); pada DNA plantlet SK 4 (C); pada DNA plantlet SK 5 (D); pada DNA plantlet SK 12 (E); Marker 50 bp (F)
500 bp
200 bp
A B C D E
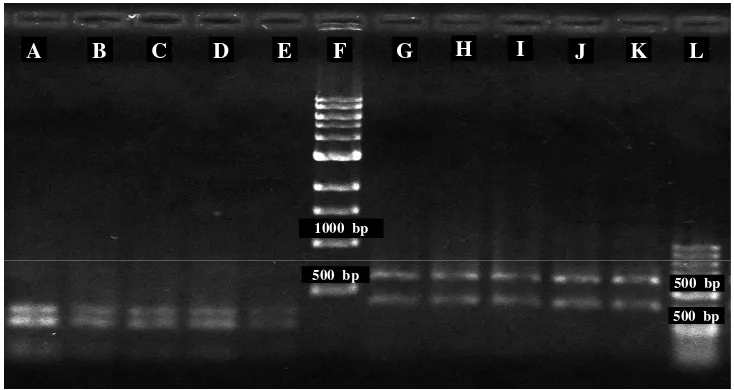
Gambar 7 Elektroforasi hasil pemotongan DNA dengan enzim MBo1 dan Alu1.
Ket : Pemotongan dengan enzim MBo1 pada DNA tanaman induk (A); Enzim MBo1 pada DNA plantlet SK 3 (B); Enzim MBo1 pada DNA plantlet SK 4 (C); Enzim MBo1 pada DNA plantlet SK 5 (D); Enzim MBo1 pada DNA plantlet SK 12 (E); Marker 1 kb (F), Enzim Alu1 pada DNA tanaman induk (G); Enzim Alu1 pada DNA plantlet SK 3 (H); Enzim Alu1 pada DNA plantlet SK 4 (I); Enzim Alu1 pada DNA plantlet SK 5 (J); Enzim Alu1 pada DNA plantlet SK 12 (K); Marker 50 bp (L),
Pengujian Kestabilan Genetik dengan Analisis Sequen
Total genom tanaman induk dan plantlet SK 12 untuk analisis sequen berhasil diamplifikasi menggunakan primer forward 5’
-CTTTGGGAGGGATGCATTTA-3’ dan primer reverse 5’
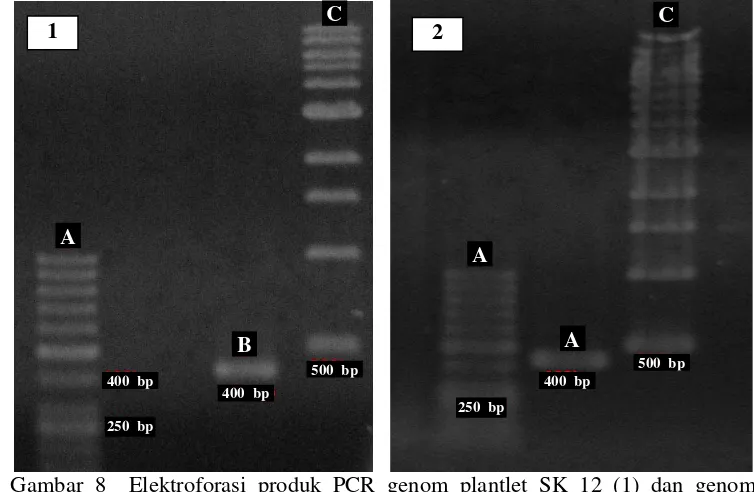
-AACCAGACAAATCGCTCCAC-3’. Ukuran genom yang teramplifikasi sebesar 400 bp dan produk PCR yang diperoleh berukuran sama pada 2 sampel yang diuji (Gambar 8).
Dari hasil pengukuran dengan intensitas sinyal panjang gelombang menggunakan Software Sequence ScannerVol 1.0 diketahui produk PCR yang berhasil di-sequensing dengan kualitas baik berukuran 300 bp pada kedua sampel tanaman. Sequen DNA tanaman induk mulai dari urutan basa nomor 61–361, sedangkan sequen DNA plantlet SK 12 dari urutan basa nomor 58–358. Hasil homologi kedua sequen tersebut menunjukkan urutan basa 100% sama (Gambar 9).
A B C D E F G H I J K L
1000 bp
500 bp
500 bp
Gambar 8 Elektroforasi produk PCR genom plantlet SK 12 (1) dan genom tanaman induk (2)
Ket = 1. Marker 50 bp (A); Produk PCR plantlet SK 12 (B); Marker 1 kb (C) 2. Marker 50 bp (A); Produk PCR tanaman induk (B); Marker 1 kb (C)
Sub-kultur yang berulang hingga 12 kali belum menyebabkan perubahan genetik pada sequen DNA hingga 300 bp. Sejalan dengan laporan Minano et al. (2009) bahwa terdapat kestabilan genetik yang tinggi pada plantlet krisanthemun hingga sub-kultur ke-9. Berbeda halnya dengan hasil penelitian Bairuet al.(2006) yang melaporkan bahwa ketidakstabilan genetik tanaman pisang hasil mikropropagasi dapat terdeteksi secara molekular sejak sub-kultur ke-4.
1 2
250 bp 400 bp
400 bp
500 bp
400 bp
500 bp
250 bp
A
B
C
A
A
Kondisi Umum Tanaman pada Percobaan
Pada tahap sterilisasi bahan tanaman dapat diperoleh 95 % eksplan steril. Di media perlakuan terjadi kontaminasi 7.5 % pada Percobaan I, 7.5 % pada Percobaan II, dan 6.25 % pada Percobaan III yang semuanya disebabkan oleh cendawan. Menurut Gunawan (1992) penyebab kontaminasi dapat berupa debu, kotoran dan berbagai kontaminan yang hidup pada permukaan dan kontaminan yang berasal dari jaringan tanaman itu sendiri (internal).
Secara umum eksplan yang diinkubasikan ke dalam media perlakuan beregenerasi seminggu setelah perlakuan. Tunas aksilar tumbuh secara langsung tanpa melalui pembentukan kalus terlebih dahulu. Tunas yang telah memiliki minimal 2 daun dapat membentuk rimpang mikro yang diawali dengan pembengkakan pada bagian basal. Bagian basal akan terus membesar dan berubah warna dari putih menjadi kekuningan.
pembentukan rimpang mikro dibutuhkan lingkungan tumbuh gelap pada kultur dengan periode yang berbeda-beda untuk masing-masing tanaman.
Pengaruh Bentuk Fisik Media dan Sukrosa
terhadap Pembentukan Rimpang Mikro
Pada Percobaan I ini induksi rimpang mikro ditandai dengan pembengkakan pada bagian basal tunas (Gambar 10). Interpretasi dari hasil olah data menunjukkan interaksi bentuk fisik media dan sukrosa tidak berpengaruh nyata terhadap semua parameter pengamatan hingga akhir masa percobaan. Induksi pembentukan rimpang mikro lebih dipengaruhi oleh faktor tunggal bentuk fisik media (Tabel 2) dan tidak dipengaruhi oleh faktor tunggal sukrosa.
Gambar 10 Pembengkakan pada bagian basal plantlet di media cair
Tabel 2. Rata-rata jumlah induksi rimpang mikro dan ukuran plantlet (15 MSP)
Peubah Perlakuan
Media padat Media cair
Induksi rimpang mikro (propagul) 0.33 1.22
Diameter pembengkakan (cm) 0.20 0.53
Tinggi plantlet (cm) 6.79 4.17
Panjang daun (cm) 3.47 1.99
Lebar daun (cm) 1.17 0.89
Panjang akar (cm) 1.78 1.02
ukuran plantlet lebih tinggi, daun yang lebih luas dan akar yang lebih panjang. Pertambahan tinggi plantlet temulawak pada percobaan ini selaras dengan hasil percobaan Bejoy dan Anish (2006) yang melaporkan bahwa penggunaan agar 4 gL-1 media dapat menstimulasi perpanjangan tunas in vitro Curcuma haritha. Menurut Wala dan Jasrai (2003) media MS semi-padat tidak cocok digunakan untuk induksi perakaran tunas Curculigo orchioides Gaertn. Induksi rimpang mikro lebih banyak dan berukuran lebih besar pada media cair (Tabel 2). Pembentukan rimpang mikro pada media cair telah berhasil dilakukan pada Curcuma aromatica Salisb. (Nayak et al. 2000) dan Curcuma longa L. (Islam 2004).
Pada media cair, plantlet yang semakin tinggi menghasilkan jumlah rimpang mikro yang semakin sedikit (korelasi -0.99*). Pertambahan ukuran panjang dan lebar daun juga berbanding terbalik dengan pertambahan jumlah rimpang mikro yang dihasilkan
0
Gambar 11 Jumlah tunas rata-rata pada media padat dan media cair.
0.0
Gambar 12 Pertambahan jumlah daun hijau dan daun mati pada media padat (A) dan media cair (B)
Pada 18 MSP tidak diperoleh data pra-aklimatisasi karena 75% plantlet mengalami kematian. Plantlet yang mengalami kematian pada akhir pengamatan berasal dari kultur dengan perlakuan media cair pada semua level konsentrasi sukrosa dan media padat dengan sukrosa 90 dan 120 gL-1. Gejala kematian tampak pada perubahan warna daun dari hijau menjadi pucat kusam hingga menjadi coklat (Gambar 13). Pada perlakuan media padat dengan sukrosa 30 dan 60 gL-1 plantlet masih dapat bertahan hidup yang ditunjukkan oleh daun yang masih berwarna hijau.
Gambar 13 Plantlet mati pada 18 MSP. Perlakuan media cair dengan sukrosa 30 gL-1(A) dan perlakuan media padat dengan sukrosa 90 gL-1(B)
Pengaruh Komposisi Media MS dan Sukrosa terhadap
Pembentukan Rimpang Mikro
Pada percobaan I induksi rimpang mikro terjadi lebih banyak pada media cair sehingga pada percobaan II media yang digunakan adalah media cair. Sampai 18 MSP pembentukan rimpang mikro tidak dipengaruhi oleh faktor tunggal komposisi media atau sukrosa maupun interaksi keduanya (Gambar 14). Dari hasil percobaan ini maka media MS ½ konsentrasi dapat digunakan untuk pembentukan rimpang mikro karena secara ekonomi lebih murah dan tidak berbeda nyata dengan perlakuan media MS konsentrasi penuh. Pembentukan rimpang mikro kunyit (Curcuma longa Linn.) menurut Shirgurkar et al. (2001) optimum pada media MS ½ konsentrasi, sedangkan menurut Islam (2004) jumlah dan ukuran rimpang mikro optimum pada media ¾ MS. Berbeda halnya dengan hasil penelitian Kenyo et al. (2002) yang menyatakan bahwa umbi mikro dua kultivar lili (Avignon dan Bergamo) lebih banyak pada media MS konsentrasi penuh.
Gambar 14 Induksi rimpang pada perlakuan komposisi media ½ MS (A) dan perlakuan media MS konsentrasi penuh (B)
Pada 12 MSP faktor tunggal media MS berpengaruh nyata terhadap tinggi plantlet, jumlah tunas dan daun hijau (Tabel 4), dengan nilai rata-rata yang lebih tinggi terdapat pada media MS konsentrasi penuh. Komposisi media sangat menentukan pertumbuhan dan perkembangan eksplan. Pada media MS konsentrasi penuh kesediaan hara lebih banyak dibandingkan pada media MS ½ konsentrasi sehingga pertumbuhan plantlet temulawak menjadi lebih pesat. Kenyo et al. (2002) menyatakan bahwa jumlah daun kultur in vitro tanaman lili lebih banyak pada media MS konsentrasi penuh dibandingkan pada media ½ dan ¼ MS. Menurut Yusniawati (2004) semakin rendah konsentrasi nutrisi yang diberikan pada kultur pisang menyebabkan plantlet semakin pendek dan jumlah daun semakin sedikit. Salisbury dan Ross (1992) menyatakan bahwa persediaan hara di bawah optimal dapat mengganggu metabolisme tanaman yang pada akhirnya akan menekan pertumbuhan plantlet.
Tabel 4. Rata-rata tinggi plantlet, jumlah tunas dan daun hijau pada 12 MSP
Peubah Media MS
konsentrasi penuh
Media MS ½ konsentrasi Tinggi plantlet (cm)
Jumlah tunas Jumlah daun hijau
7.23 2.19 1.29
4.24 1.60 0.56
Pada semua level perlakuan sukrosa jumlah daun mati mengalami peningkatan pada tiap minggu pengamatan. Pada perlakuan sukrosa 30 gL-1 peningkatan daun mati tidak mengakibatkan penurunan jumlah daun hijau. Hal ini dikarenakan daun baru terus tumbuh pada media kontrol ini hingga 18 MSP tetapi
dalam jumlah yang rendah. Akibatnya jumlah daun hijau cenderung sama pada setiap minggunya yaitu berkisar 2-3 daun hijau per botol meskipun jumlah daun mati terus bertambah. Pada 3 perlakuan sukrosa lainnya yaitu 60, 90 dan 120 gL-1 peningkatan jumlah daun mati terus diikuti dengan pengurangan jumlah daun hijau (Gambar 15). Faktor lain yang dapat menyebabkan kematian sel pada daun-daun tua adalah konsentrasi sukrosa yang tinggi yaitu diatas 60%. Trigiano dan Gray (2005) menyatakan bahwa konsentrasi sukrosa yang sering digunakan sebagai sumber karbon dan energi berkisar antara 20-60%. Tingginya konsentrasi sukrosa menyebabkan tekanan osmotik di dalam media lebih tinggi dibandingkan pada sel tanaman sehingga air menjadi tidak tersedia bagi tanaman. Kondisi demikian dapat diartikan tanaman mengalami cekaman kekeringan. Cekaman kekeringan merupakan stress bagi tanaman. Dalam keadaan stres air, daun mengalami kehilangan turgor dan layu.
y(daun hijau) = 0.0069x + 2.39 R2 = 0.03
y (daun hijau)= -0.1543x + 2.70 R2 = 0.95 y (daun mati)= 0.2061x + 0.13
R2 = 0.82
y(daun mati) = 0.1637x + 0.15 R2 = 0.74
y(daun hijau) = -0.1043x + 1.74 R2 = 0.82
y(daun mati) = 0.1279x + 0.19 R2 = 0.80
y (daun hijau)= -0.076x + 1.28 R2 = 0.62
Gambar 15 Grafik pertambahan daun hijau dan mati pada media dengan sukrosa 30 gL-1(A), 60 gL-1(B), 90 gL-1(C) dan 120 gL-1(D)
A B
Pengaruh BAP dan Sukrosa terhadap Pembentukan Rimpang Mikro
Berdasarkan hasil dua percobaan sebelumnya maka pada percobaan III media yang digunakan adalah media cair MS ½ konsentrasi. Pada percobaan ini interaksi BAP dan sukrosa berpengaruh nyata terhadap jumlah rimpang yang terbentuk pada 18 MSP (Lampiran 7). Hasil uji lanjut menunjukkan interaksi BAP 2 ppm dan sukrosa 120 gL-1 berpengaruh pada pembentukan rimpang mikro
Ket * = nilai regresi nyata pada taraf kesalahan 5 %
Gambar 16 Grafik jumlah rimpang mikro pada media tanpa BAP dan dengan BAP 1, 2, dan 3 mgL-1