PEMBUATAN DAN KARAKTERISASI ELEKTRODA
SELEKTIF BERBASIS KARBON NANOPORI/MOLECULARLY
IMPRINTED POLYMER UNTUK ANALISIS GLUKOSA
DALAM MADU
SKRIPSI
HAYATI IKA PUSPITASARI
PROGRAM STUDI S-1 KIMIA DEPARTEMEN KIMIA
FAKULTAS SAINS DAN TEKNOLOGI UNIVERSITAS AIRLANGGA
ii
PEMBUATAN DAN KARAKTERISASI ELEKTRODA SELEKTIF BERBASIS KARBON NANOPORI/MOLECULARLY IMPRINTED
POLYMER UNTUK ANALISIS GLUKOSA DALAM MADU
SKRIPSI
Sebagai Salah Satu Syarat untuk Memperoleh Gelar Sarjana Sains Bidang Kimia Pada Fakultas Sains dan Teknologi
Universitas Airlangga
Disetujui oleh: Pembimbing I,
Dr. Muji Harsini, M.Si NIP. 19640502 198903 2 002
Pembimbing II,
LEMBAR PENGESAHAN NASKAH SKRIPSI
Judul : Pembuatan dan karakterisasi elektroda berbasis karbon nanopori / molecularly imprinted polymer untuk analisis glukosa dalam madu
Penyusun : Hayati Ika Puspitasari
NIM : 080810263
Tanggal Ujian : 20 Juli 2012
Disetujui oleh :
Pembimbing I,
Dr. Muji Harsini, M.Si NIP. 19640502 198903 2 002
Pembimbing II,
Dr. Ir. Suyanto, M.Si NIP. 19520217 198203 1 001
Mengetahui, Ketua Departemen Kimia
Fakultas Sains dan Teknologi Universitas Airlangga
iv
PEDOMAN PENGGUNAAN SKRIPSI
KATA PENGANTAR
Segala puji dan syukur kepada Allah SWT atas Rahmat dan KaruniaNya, sehingga penyusun dapat menyelesaikan skripsi dengan judul ”Pembuatan dan
Karakterisasi Elektroda Selektif Berbasis Karbon Nanopori / Molecularly Imprinted Polymer Untuk Analisis Glukosa Dalam Madu”. Skripsi ini dibuat
dalam rangka memenuhi persyaratan akademis pendidikan dalam bidang Kimia Fakultas Sains dan Teknologi Universitas Airlangga.
Pada kesempatan ini, penyusun menyampaikan ucapan terima kasih kepada : 1. Dr. Muji Harsini, M.Si selaku dosen pembimbing I dan Dr. Ir. Suyanto,
M.Si selaku dosen Pembimbing II yang telah meluangkan waktu dan tenaga dalam memberikan bimbingan, saran, dan nasihat dalam penyusunan skripsi ini
2. Tjitjik Srie Tjahjandarie, Ph.D. selaku penguji I dan Dr. Alfinda Novi Kristanti, DEA. selaku penguji II yang telah memberikan kritik dan saran untuk lebih baiknya skripsi ini
3. Dr. Nanik Siti Aminah,M.Si selaku dosen wali yang selalu memberikan semangat serta waktu agar kami menjadi lebih baik
4. Dr. Alfinda Novi Kristanti, DEA. selaku Ketua Departemen Kimia yang banyak memberikan informasi dalam penyusunan skripsi ini
5. Bapak dan Ibu dosen di Departemen Kimia atas ilmu yang telah diberikan 6. Bapak Umar Said, Ibu Sampuni, serta adik-adikku Indah Alfi dan Shandy
Abdillah yang tak henti memberikan doa, semangat, dukungan moral dan materi
7. Prof. Ris. Dr. Gustan Pari, M.Si dari PUSLITBANG hasil hutan yang telah membantu dalam penyediaan bahan-bahan skripsi khususnya karbon nanopori dan sebagian bahan kimia
vi
9. Sahabat kost Liana Erdita Steny, Eka Fitri Timika, Sanityasa Hanggana Raras, Yushi Roosdiantini atas semangat, motivasi, dan kenangan yang indah
10.Teman satu bimbingan Rani, Pipit, dan khususnya Asri Zulchana atas kerjasama selama penelitian maupun di luar penelitian
11.Sahabat-sahabatku Adelia Junia, Julie Andrya, Dyah respati ‘culan’,
Marina Lukita, Radita Yuniar, Bela Kharisma, Haidy Okta atas motivasi dan semangat selama kuliah
12.Teman- teman Chemistry 2008 atas kenangan 4 tahun yang luar biasa
13.Mas Rochadi dan Pak Giman atas bantuan sehingga skripsi ini dapat terselesaikan
14.Semua pihak yang tidak dapat satu persatu hingga skripsi ini terselesaikan Penulis menyadari bahwa skripsi ini masih banyak kekurangan. Oleh karena itu demi kesempurnaan skripsi ini, kritik dan saran dari pembaca sangat
diharapkan.
Surabaya, Juli 2012
Penyusun,
Puspitasari, Hayati Ika, 2012, Pembuatan dan Karakterisasi Elektroda Selektif Berbasis Karbon Nanopori/Molecularly Imprinted Polymer Untuk Analisis Glukosa dalam Madu. Skripsi ini dibawah bimbingan Dr. Muji Harsini., M.Si dan Dr. Ir. Suyanto, M.Si, Departemen Kimia, Fakultas Sains dan Teknologi, Universitas Airlangga, Surabaya
ABSTRAK
Telah dilakukan pembuatan dan karakterisasi elektroda selektif berbasis karbon nanopori/molecularly imprinted polymer (MIP) untuk analisis glukosa dalam madu. Penelitian ini bertujuan mengetahui kondisi optimum dan kinerja elektroda selektif berbasis karbon nanopori/MIP untuk analisis glukosa dalam madu dan kinerja elektroda selektif berbasis karbon nanopori/MIP. Molecularly imprinted polymer (MIP) dibuat dengan mereaksikan glukosa sebagai template, asam metakrilat sebagai monumer dan etilen glikol dimetakrilat sebagai crosslinker dengan perbandingan berturut-turut 1:4:12. Elektroda dibuat dengan mencampurkan karbon nanopori, MIP dan parafin dengan perbandingan berturut-turut 45:20:35. Dari penelitian diperoleh pH optimum larutan glukosa sebesar 7,0-8,0, faktor Nernst sebesar 27,8 mV/dekade, jangkauan pengukuran sebesar 10-6 M-10-2M. Konsentrasi terkecil glukosa yang dapat diukur oleh elektroda sebesar 6,17x10-7M. Koefisien selektivitas dari larutan fruktosa dan sukrosa sebesar 1,786x10-3 dan 5,155x10-4 yang berarti adanya larutan tersebut tidak mengganggu pengukuran. Elektroda ini memiliki akurasi pengukuran sebesar 93,86% untuk konsentrasi 10-2M dan sebesar 132% untuk konsentrasi 10-4M, presisi dinyatakan dengan koefisien variasi sebesar 1,09% untuk konsentrasi 10-2M dan 2,26% untuk konsentrasi 10-4M serta diperoleh kadar glukosa dalam madu sebesar 22,4% b/b.
viii
Puspitasari, Hayati Ika, 2012, Preparation and Characterization of Selective Electrodes Based on Nanoporous Carbon/Molecularly Imprinted Polymer for Glucose Analysis in Honey, Script under guidance of Dr. Muji Harsini., M.Si and Dr. Ir. Suyanto, M.Si, Departement of Chemistry, Faculty of Science and Technology, Airlangga University, Surabaya
ABSTRACT
Preparation and characterization of selective electrodes based on nanoporous carbon/molecularly imprinted polymer (MIP) for glucose analysis in honey have been done. The purpose of the research is to know the optimum condition of electrodes based on nanoporous carbon/MIP and to know its electrode performance. Molecularly imprinted polymer (MIP) was made by mixing glucose as template, methacrylic acid as monomer and ethylene glycol dimethacrylate as crosslinker with a rasio 1:4:12. The electrodes was made by mixing nanoporus carbon, MIP and paraffin with rasio 45:20:35. This research obtained optimum pH of glucose solution is 7,0-8,0, Nersnt factor is 27,8 mV/decade, range of measurement from concentration 10-6M until 10-2M. Limit detection of this electrodes is 6,17x10-7M. The selectivity coefficient of fructose and sucrose solution are 1,786x10-3 and 5,155x10-4 which means these solution
doesn’t interference measurement. The accuration of this electrodes is 93,86% for
concentration 10-2M and 132% for concentration 10-4M, coefficient of variation is 1,09% for concentration 10-2M and 2,26% for concentration 10-4M. The content of glucose in honey which measured using this electrode is 22,4% w/w.
DAFTAR ISI
BAB I PENDAHULUAN 1.1 Latar Belakang Masalah... 1
1.2 Rumusan Masalah ... 5
1.3 Tujuan Penelitian ... 5
1.4 Manfaat Penelitian ... 5
BAB II TINJAUAN PUSTAKA 2.1 Glukosa ... 6
2.7.6 Koefisien selektivitas ... 17
BAB III METODE PENELITIAN 3.1 Lokasi dan Waktu Penelitian ... 19
3.2 Bahan dan Alat Penelitian ... 19
3.2.1 Bahan penelitian ... 19
x
3.3.5 Pembuatan larutan pengganggu ... 24
3.3.6 Pembuatan MIP ... 25
3.3.7 Pembuatan elektroda pasta karbon nanopori/MIP ... 25
3.3.8 Pembuatan sampel madu ... 26
3.3.9 Optimasi elektroda ... 26
3.3.10 Pembuatan kurva standar glukosa ... 27
3.3.11Penentuan parameter validasi ... 28
BAB IV HASIL DAN PEMBAHASAN 4.1 Hasil pembuatan MIP ... 31
4.2 Hasil pembuatan polimer kontrol ... 34
4.3 Karakterisasi MIP dan polimer kontrol ... 35
4.4 Pembuatan dan optimasi elektroda ... 38
4.4.1 Optimasi komposisi elektroda ... 39
4.4.2 Optimasi pH ... 43
4.5 Kurva kalibrasi glukosa ... 44
4.6 Uji kinerja elektroda karbon nanopori/MIP ... 45
4.6.1 Jangkauan pengukuran ... 45
4.8 Mekanisme timbulnya beda potensial ... 51
BAB V KESIMPULAN DAN SARAN 5.1 Kesimpulan ... 53
5.2 Saran ... 53
DAFTAR PUSTAKA ... 54
DAFTAR TABEL
Nomor Judul Halaman
2.1 Persyaratan mutu madu 7
3.1 Komposisi volume CH3COOH 0,2 M dan
CH3COONa.3H2O pada pembuatan buffer asetat
22
3.2 Komposisi volume K2HPO4.3H2O 0,2M dan KH2PO4 0,2M pada pembuatan buffer fosfat
23
3.3 Komposisi pasta karbon nanopori/MIP 27
4.1 Pengaruh komposisi karbon nanopori dan MIP terhadap kinerja elektroda
40
4.2 Data pengukuran glukosa menggunakan Elektroda optimum (E7) pada pH optimum (pH 7)
45
4.3 Jangkauan pengukuran E7 (MIP 20%wt) dan E8 (MIP 25%wt) menggunakan karbon nanopori/MIP secara potensiometri
46
4.4 Faktor Nernst dan koefisien korelasi masing-masing elektroda
47
4.5 Akurasi pengukuran menggunakan elektroda karbon nanopori/MIP secara potensiometri
48
4.6 Data pengukuran koefisien variasi menggunakan elektroda karbon nanopori/MIP secara potensiometri
49
4.7 Koefisien selektivitas elektroda glukosa berbasis karbon nanopori/MIP secara potensiometri
xii
DAFTAR GAMBAR
Nomor Judul Halaman
2.1 Struktur glukosa 6
2.2 Jangkauan pengukuran 14
2.3 Kurva penentuan batas deteksi 16
3.1 Konstruksi elektroda pasta karbon nanopori/MIP 26 4.1 Perkiraan reaksi antara glukosa dan asam metakrilat 31 4.2 Perkiraan polimerisasi asam metakrilat dan glukosa saat
ditambahkan crosslinker EGDMA
32
4.3 Hasil MIP glukosa menggunakan monomer asam metakrilat 33 4.4 Cetakan MIP glukosa menggunakan monomer asam
metakrilat yang telah diekstraksi
34
4.5 Reaksi polimerisasi asam metakrilat 35
4.6 Hasil polimer kontrol tanpa penambahan glukosa menggunakan monomer asam metakrilat
35
4.7 Spektra FT-IR asam metakrilat (1) polimer kontrol (2) dan MIP glukosa (3)
36
4.8 Spektra FT-IR MIP glukosa menggunakan monomer asam metakrilat sebelum diekstraksi (1) dan MIP sesudah diekstraksi (2)
37
4.9 Kurva hubungan antara Log konsentrasi glukosa demgan potensial pada berbagai variasi komposisi elektroda
41
4.10 Kurva hubungan antara Log konsentrasi glukosa dengan potensial diukur menggunakan E1 (karbon nanopori), E2 (karbon nanopori/NIP) dan E7 (karbon nanopori/MIP)
43
4.11 Grafik hubungan antara pH dan potensial diukur menggunakan karbon nanopori/MIP secara potensiometri
44
4.12 Kurva kalibrasi glukosa menggunakan elektroda karbon nanopori/MIP (E7) secara potensiometri
45
4.13 Kesetimbangan dalam elektroda karbon nanopori/MIP dalam pengukuran glukosa secara potensiometri
xiv
DAFTAR LAMPIRAN
Nomor Judul
1 Pembuatan larutan induk dan larutan kerja glukosa
2 Perhitungan faktor Nernst, persamaan regresi dan koefisien korelasi masing-masing elektroda
3 Data dan grafik dari masing-masing elektroda 4 Data optimasi pH
5 Analisis jangkauan pengukuran 6 Analisis batas deteksi
7 Analisis akurasi pengukuran
8 Analisis koefisien variasi pengukuran 9 Perhitungan pembuatan larutan penggangu 10 Perhitungan koefisien selektivitas
BAB I
PENDAHULUAN
1.1 Latar Belakang Masalah
Glukosa, suatu monosakarida, adalah satu karbohidrat terpenting yang digunakan sebagai sumber tenaga bagi hewan dan tumbuhan. Glukosa biasa disebut gula darah (karena dijumpai dalam darah), gula anggur (karena dijumpai dalam buah anggur), atau dekstrosa (karena dapat memutar bidang polarisasi kekanan) (Fessenden, 1995). Glukosa mempunyai rumus molekul C6H12O6. Glukosa merupakan suatu heksosa karena mengandung enam atom karbon.
Di alam, glukosa terdapat dalam buah-buahan dan madu lebah. Madu dihasilkan oleh lebah madu dengan memanfaatkan bunga tanaman. Komponen utama madu adalah fruktosa, glukosa, sedikit sukrosa, mineral, vitamin, dan berbagai enzim (Maun, 1999). Menurut SNI ( 2004) standar mutu madu yang baik adalah mengandung gula pereduksi (dihitung sebagai glukosa) minimal 65% b/b dan mengandung sukrosa maksimal 5% b/b.
Madu memiliki nilai ekonomis yang cukup tinggi serta mengandung zat-zat yang unik sehingga sering terjadi pemalsuan madu. Madu dapat dipalsukan dengan berbagai cara salah satunya dengan menambahkan pemanis buatan atau dengan menambahkan gula pasir (sukrosa), sehingga berbahaya jika diberikan pada bayi atau penderita Diabetes Mellitus (Maun, 1999).
yang mengandung glukosa direaksikan dengan pereaksi Nelson-Somogyi kemudian ditambahkan reagen arsenomolibdat membentuk kompleks berwarna yang diukur secara spektrofotometri. Metode ini akurat hingga 0,01 mg glukosa, namun menjadi kurang spesifik karena dapat memberikan respon positif terhadap senyawa pereduksi selain glukosa misalnya fruktosa dan galaktosa.
Metode lain dalam penentuan glukosa yang populer adalah menggunakan biosensor. Clark dan Lyson (1962) adalah orang pertama yang menggunakan sensor enzim untuk penentuan glukosa secara amperometri. Biosensor glukosa ini berbasis pada fakta bahwa enzim glukosa oksidase (GOD) dapat mengkatalisis oksidasi glukosa menjadi asam glukonat. Kadar glukosa ditentukan berdasarkan pemakaian oksigen yang diperlukan untuk oksidasi glukosa (Yoo, 2010). Biosensor ini memang spesifik karena menggunakan enzim, namun mempunyai umur yang relatif pendek karena enzim mudah rusak. Biosensor glukosa Clark pertama kali dikomersialkan oleh Yellow Springs Instrument company pada tahun 1975 untuk pengukuran langsung glukosa berbasis deteksi amperometri dengan hidrogen peroksida. Pengukuran pembentukan peroksida memiliki keuntungan lebih sederhana, terutama ketika miniaturnya mulai dipertimbangkan, namun, menjadi kurang selektif saat ada gangguan dari asam askorbat, asam urat, atau obat-obatan tertentu.
(2011) menentukan kadar gula dalam madu secara LC-MS. Metode ini lebih spesifik karena memungkinkan untuk penentuan masing-masing gula utama seperti fruktosa, glukosa dan sukrosa, serta memungkinkan penentuan maltosa yang kadang-kadang ditemukan dalam sampel. Namun analisis ini memerlukan biaya operasional yang cukup tinggi. Dari permasalahan tersebut perlu adanya pengembangan metode alternatif yang lebih sederhana dan murah namun tetap sensitif yaitu menggunakan teknik elektrokimia khususnya potensiometri dengan modifikasi. Modifikasi yang digunakan adalah molecularly imprinted polymer (MIP).
Potensiometri adalah metode analisis berdasar pada pengukuran potensial sel elektrokimia pada arus nol. Beda potensial timbul karena adanya analit yang dapat dipertukarkan pada permukaan elektroda. Permukaan elektroda merupakan sensor yang harus mengandung komponen yang bereaksi secara kimia dan reversibel dengan analit (Skoog, 2004).
Molecularly imprinted polymer (MIP) merupakan teknik polimerisasi yang
Penelitian menggunakan elektroda termodifikasi berbasis sensor potensiometri telah banyak dilaporkan. Prasad, dkk (2006) menggunakan membran Polyvynil Chloride (PVC) yang dilapisi MIP sebagai sensor untuk deteksi atrazine diperoleh limit deteksi sebesar 0,1 mg/L dan jangkauan pengukuran sebesar 1,0 x 10-7 – 1,0 x 10-2M. Tehrani, dkk (2009) memodifikasi
elektroda grafit dengan MIP untuk analisis metropolol diperoleh limit deteksi sebesar 1,26 x 10-7M dan jangkauan pengukuran sebesar 2,0 x 10-7 - 8,0 x 10-3M. Javanbakht, dkk (2010) menggunakan pasta karbon yang dilapisi MIP untuk analisis hydroxyzine diperoleh limit deteksi sebesar 7,0 x 10-7M dan jangkauan pengukuran sebesar 1,0 x 10-6 - 1,0 x 10-1M.
Pada penelitian ini dilakukan modifikasi elektroda dengan MIP yang digunakan sebagai sensor glukosa dalam madu. Molecularly Imprinted Polymer (MIP) glukosa dibuat dengan mereaksikan monomer asam metakrilat, etilen glikol dimetakrilat (EGDMA) sebagai crosslinker, dan benzoil peroksida sebagai inisiator. Dalam penelitian ini digunakan karbon nanopori karena bersifat inert dan memiliki konduktivitas yang tinggi (Pyun dan Lee, 2007).
1.2 Rumusan Masalah
Dari latar belakang di atas, dapat dirumuskan beberapa rumusan masalah sebagai berikut.
1. Bagaimanakah kondisi optimum elektroda selektif berbasis karbon nanopori / molecularly imprinted polymer (MIP) untuk analisis glukosa dalam madu?
2. Berapakah batas deteksi, faktor Nernst, jangkauan pengukuran, akurasi, presisi dan koefisien selektivitas elektroda selektif berbasis karbon nanopori / molecularly imprinted polymer (MIP) untuk analisis glukosa dalam madu?
1.3 Tujuan Penelitian
Tujuan penelitian ini adalah.
1. Menentukan kondisi optimum elektroda selektif berbasis karbon nanopori / molecularly imprinted polymer (MIP) untuk analisis glukosa dalam madu.
2. Menentukan batas deteksi, faktor Nernst, jangkauan pengukuran, akurasi, presisi dan koefisien selektivitas elektroda selektif berbasis karbon nanopori / molecularly imprinted polymer (MIP) untuk analisis glukosa dalam madu.
1.4 Manfaat Penelitian
BAB II
TINJAUAN PUSTAKA
2.1 Glukosa
Glukosa merupakan karbohidrat terpenting dalam kaitannya dengan penyediaan energi di dalam tubuh. Hal ini disebabkan karena karena semua jenis karbohidrat baik monosakarida, disakarida maupun polisakarida yang dikonsumsi oleh manusia akan terkonversi menjadi glukosa di dalam hati. Glukosa ini kemudian akan berperan sebagai salah satu molekul utama bagi pembentukan energi dalam tubuh (Irawan, 2007)
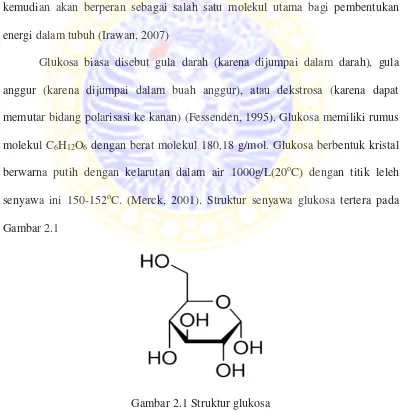
Glukosa biasa disebut gula darah (karena dijumpai dalam darah), gula anggur (karena dijumpai dalam buah anggur), atau dekstrosa (karena dapat memutar bidang polarisasi ke kanan) (Fessenden, 1995). Glukosa memiliki rumus molekul C6H12O6 dengan berat molekul 180,18 g/mol. Glukosa berbentuk kristal berwarna putih dengan kelarutan dalam air 1000g/L(20oC) dengan titik leleh senyawa ini 150-152oC. (Merck, 2001). Struktur senyawa glukosa tertera pada Gambar 2.1
Penentuan glukosa sebagai gula pereduksi didasarkan pada metode Nelson-Somogyi secara spektrofotometri (Sudarmadji, 1994), sedangkan secara enzimatis dikembangkan oleh Clark dan Lyson (1962) yang merupakan orang pertama yang menggunakan sensor enzim untuk penentuan glukosa secara amperometri. Untuk penentuan glukosa yang lebih spesifik dilakukan dengan metode Kromatografi Cair Kinerja Tinggi (KCKT) (Ratnayani dkk, 2008) karena memungkinkan untuk penentuan masing-masing gula utama seperti fruktosa, glukosa dan sukrosa dalam sampel.
2.2 Madu
Madu adalah cairan alami yang umumnya mempunyai rasa manis yang dihasilkan oleh lebah madu dari sari bunga tanaman (floral nectar) atau bagian lain dari tanaman (extra floral nectar) atau ekskresi serangga (SNI, 2004). Persyaratan mutu madu menurut SNI dapat dilihat pada Tabel 2.1
Tabel 2.1 Persyaratan Mutu Madu
No Jenis Uji Satuan Persyaratan
1 Aktifitas enzim diastase, min. DN 3
2 Hidroksimetilfurfural (HMF), maks. mg/kg 50
3 Air, maks. %b/b 22
4 Gula pereduksi (dihitung sebagai glukosa), min. 6 Padatan yang tak larut dalam air,
maks
%b/b 0,5
7 Abu, maks. %b/b 0,5
8 Cemaran logam Timbal (pb), maks. Tembaga (Cu), maks.
mg/kg mg/kg
1,0 5,0
Analisis glukosa sebagai gula pereduksi dalam madu telah banyak dilakukan. K.Ratnayani, dkk (2006) menentukan kadar glukosa dan fruktosa pada madu randu dan kelengkeng dengan HPLC, Kamal (2010) menentukan gula dalam madu secara liquid chromatography, Soria (2005) melakukan estimasi sampel madu secara SPME menggunakan GC-MS.
2.3 Polimer
Polimer merupakan molekul rantai panjang yang memiliki berat molekul sangat tinggi, mencapai ratusan ribu. Polimer sering disebut sebagai makromolekul (Sperling, 2006). Reaksi penggabungan antara monomer-monomer membentuk sebuah molekul polimer disebut reaksi polimerisasi (Odian, 2004). Panjang rantai polimer menyatakan banyaknya satuan penyusun dalam suatu rantai yang disebut derajat polimerisasi (Suyanto, 2009).
cepat. Sedangkan pada tahap terminasi terjadi penghentian pembentukan rantai polimer (Odian, 2004). Polimerisasi adisi lebih dipilih dalam pembuatan Molecularly Imprinted Polymer (MIP) karena tidak melepaskan molekul air
(H2O) seperti dalam pembuatan MIP untuk sensor melamin secara potensiometri (Mandasari, 2011).
2.4 Molecularly Imprinted Polymer (MIP)
Molecularly Imprinted polymer (MIP) adalah teknik pembuatan polimer
yang memiliki sifat spesifik untuk pengenalan senyawa tertentu. Reaksi polimerisasi yang sering digunakan dalam sintesis MIP adalah polimerisasi adisi karena pada polimerisasi ini tidak melepaskan molekul air (H2O) yang dapat mengganggu ikatan antara monomer dan template. Sintesis MIP dilakukan dengan cara mereaksikan suatu monomer fungsional dengan molekul target yang bertindak sebagai template melalui interaksi kovalen atau non kovalen. Selanjutnya dilakukan polimerisasi dengan crosslinker untuk membentuk struktur polimer. Template dipisahkan dari polimer yang terbentuk sehingga diperoleh MIP ( Tehrani dkk, 2009).
template dan monomer fungsional melalui ikatan Van der Walls, interaksi
elektrostatik, dan ikatan hidrogen (Komiyama dkk, 2003).
Beberapa dekade terakhir penelitian MIP semakin berkembang dalam aplikasinya sebagai molekul pengenal sehingga digunakan sebagai sensor kimia. Hal ini dikarenakan material MIP memiliki sensitivitas dan selektivitas yang tinggi, inert, dan tidak larut dalam sebagian pelarut organik dan air (Tehrani dkk, 2009).
2.5 Potensiometri
2.5.1 Tinjauan umum potensiometri
Metode Potensiometri merupakan metode analisis berdasar pengukuran potensial (Skoog, 1992). Metode ini merupakan metode analisis yang sangat disarankan dan serbaguna. Dalam metode ini dilakukan pengukuran potensial sel. Beda potensial terjadi karena adanya kecenderungan reaksi oksidasi dan reduksi dari elemen, molekul, atau ion untuk menangkap dan melepas elektron sesuai reaksi redoks berikut:
Aox + ne- = Ared 2.1
potensial dihasilkan oleh elektroda tepatnya pada elektroda kerja yang diukur pada 25oC sesuai persamaan Nersnt (James dan Schenk, 1987):
ܧ ൌ ܧι െǤହଽଵହ ೝ
ೣ 2.2
dengan ketentuan Eo merupakan potensial elektroda standard an aAred dan aAox
Dalam potensiometri, dibutuhkan dua elektroda untuk menentukan potensial suatu analit. Hal tersebut terkait dengan nilai potensial elektroda absolut yang besarnya tidak dapat diketahui jika hanya menggunakan satu elektroda (Braun, 1987). Oleh karena itu dibutuhkan elektroda lain sebagai standar (Mulja, 1995).
2.5.2. Elektroda kerja
Elektroda kerja merupakan elektroda yang direndam dalam larutan analit yang memberikan nilai potensial berdasarkan aktifitas analit. Elektroda kerja yang digunakan pada potensiometri umumnya memiliki selektifitas yang tinggi (Skoog, 1991). Elektroda yang umum digunakan dalam potensiometri adalah elektroda logam dan elektroda membran. Terdapat dua jenis elektroda logam. Pada elektroda jenis pertama analit yang diukur terlibat langsung dalam reaksi elektroda sedangkan elektroda jenis kedua pengukuran analit tidak langsung berhubungan dalam reaksi elektroda (Basset dkk, 1991), contohnya titrasi potensiometri penentuan Ca menggunakan EDTA. Pada potensiometri, elektroda kerja merupakan suatu kunci utama yang dapat memberikan respon selektif terhadap suatu ion tertentu. Elektroda ini dinamakan elektroda selektif ion (Evans, 1991). Elektroda membran merupakan elektroda yang memiliki sensor berupa membran pada permukaan elektroda.
2.5.3 Elektroda pembanding
(elektroda kerja) (Evans, 1991). Elektroda pembanding yang ideal adalah yang reversibel dan memenuhi hukum Nernst, memiliki potensial yang akurat dan diketahui, kokoh, mudah dirakit, dan dapat mempertahankan potensial jika dilewatkan pada arus kecil (Skoog, 1992). Elektroda pembanding yang umumnya digunakan adalah Hg2Cl2 (kalomel), Ag/AgCl dan Hg/Hg2SO4 (Evans, 1991). Elektroda Ag/AgCl mempunyai kelebihan dibandingkan elektroda kalomel. Elektroda Ag/AgCl dapat digunakan pada suhu 60oC sedangkan pada suhu tersebut tidak dapat digunakan elektroda kalomel. Selain itu, ion Ag+ pada elektroda Ag/AgCl relatif stabil. Sedangkan ion Hg+ pada elektroda kalomel dapat bereaksi dengan beberapa komponen analit yang dapat menutup pori (Mulja, 1995).
2.5.4 Elektroda Selektif Molekul
Faktor-faktor yang terpenting dalam pemilihan suatu ESI antara lain dapat memberikan respon nernstian terhadap aktivitas ion tertentu, tidak memberikan respon terhadap aktivitas ion lain, bersifat inert, serta memiliki stabilitas mekanik yang cukup fleksibel (Evans, 1991).
2.6 Karbon Nanopori
Karbon nanopori merupakan hasil pirolisis bahan yang mengandung karbon dan memiliki luas internal yang spesifik (Rahmawati, 2010). Karbon nanopori memiliki ukuran pori dibawah 100 nm. Secara fisik karbon nanopori terdiri dari bahan padat berisi karbon (matriks) dan rongga kosong (pori). Karbon nanopori dapat dibuat dari bahan polimer alam seperti kayu, batubara dan tempurung kelapa serta dapat dibuat dari polimer sintetis seperti resin phenol formaldehid dan polyacrylonitrile (PAN).
2.7 Kinerja Elektroda
2.7.1 Jangkauan pengukuran
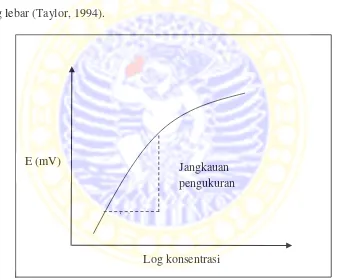
Range konsentrasi jika kurva potensial (E) terhadap log konsentrasi masih
memberikan garis lurus dan masih memenuhi persamaan Nersnt disebut jangkauan pengukuran (Bakker, 1997). Suatu ESI yang bagus diharapkan mempunyai jangkauan pengukuran yang lebar pada rentang konsentrasi yang relatif rendah. Elektroda selektif ion biasanya memiliki jangkauan pengukuran yang lebar (Taylor, 1994).
Gambar 2.2 jangkauan pengukuran
2.7.2 Faktor Nernst
Kualitas suatu ESI dapat ditentukan melalui Persamaan Nersnt. Persamaan Nersnt merupakan persamaan yang menghubungkan antara potensial dari sebuah elektroda tunggal atau sebuah sel dan aktifitas reaktan-reaktannya (Day, 2002). Persamaan Nernst dapat dituliskan sebagai berikut:
E (mV)
Esel = Eo ± 2,303 ோ்ி log C 2.3 Besarnya faktor Nersnt ditentukan dari nilai kemiringan (slope) grafik potensial (E) terhadap log konsentrasi analit. Dengan memasukkan nilai R sebagai tetapan gas ideal sebesar 8,314 joule Kelvin-1 mol-1, T sebagai suhu sebesar 273K dan F merupakan tetapan faraday sebesar 96489 coloumb ekivalen, diperoleh persamaan
Esel= Eo ± ǡହଽଶ log C 2.4 dengan ketentuan Esel merupakan potensial sel yang terukur (V), Eo merupakan potensial sel standar, n merupakan muatan ion dan C merupakan konsentrasi analit. Suatu ESI dikatakan memenuhi persamaan Nersnt jika memenuhi 0,0592/n (± 1-2 mV).
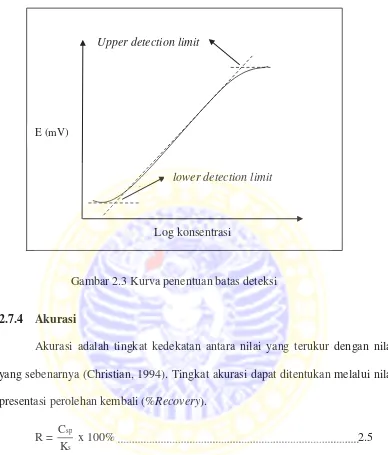
2.7.3 Batas deteksi
Gambar 2.3 Kurva penentuan batas deteksi
2.7.4 Akurasi
Akurasi adalah tingkat kedekatan antara nilai yang terukur dengan nilai yang sebenarnya (Christian, 1994). Tingkat akurasi dapat ditentukan melalui nilai presentasi perolehan kembali (%Recovery).
R = x 100% 2.5
dengan ketentuan R adalah persen recovery, Csp adalah konsentrasi glukosa terukur, dan Ks adalah konsentrasi glukosa sebenarnya.
2.7.5 Presisi
Sedangkan presisi adalah keterulangan hasil yang merupakan tingkat ketelitian antara replikasi pengukuran. Presisi yang baik tidak menjamin akurasi
s sp
K C
Upper detection limit
lower detection limit E (mV)
yang baik (Christian, 1994). Tingkat presisi dapat dilihat dari perhitungan simpangan baku (Standar Deviasi=SD) dan koefisien variasi (KV).
SD =
dengan ketentuan Xi merupakan nilai dari setiap pengukuran, X merupakan nilai
rata-rata pengukuran, dan n merupakan jumlah pengukuran.
2.7.5 Koefisien selektivitas
Selektivitas merupakan kemampuan alat yang hanya dapat mengukur analit secara cermat dengan adanya komponen lain yang ada dalam sampel. Pada potensiometri suatu elektroda mempunyai karakter selektif terhadap analit tertentu yang ditentukan dari nilai koefisien selektivitas. Pada pengukuran secara potensiometri diharapkan membran akan melakukan sensor terhadap analit, namun terdapat ion atau molekul lain yang dapat berinteraksi dengan membran tersebut. Nicolsky merumuskan pengaruh ion pengganggu terhadap sensor potensiometri sebagai berikut :
dalam dua larutan secara terpisah. Koefisien selektivitas selanjutnya dihitung melalui persamaan:
݇ǡ௧ ൌ ୟ୧ǤଵሺଶିଵሻȀୱିୟ୧ǯ
ೕȀೣ 2.9
Dengan ketentuan ai adalah aktifitas ion utama, ai’ adalah aktifitas campuran, aj
adalah aktifitas ion pengganggu dalam larutan dan s adalah kemiringan kurva kalibrasi ion utama (Cattral, 1997).
BAB III
METODE PENELITIAN
3.1 Lokasi dan Waktu Penelitian
Penelitian dilaksanakan di Laboratorium Kimia Analitik, Departemen Kimia, Fakultas Sains dan Teknologi, Universitas Airlangga Surabaya. Penelitian dimulai pada bulan Februari 2012 hingga bulan Juni 2012.
3.2 Bahan dan Alat Penelitian
3.2.1 Bahan penelitian
Bahan-bahan yang digunakan dalam penelitian ini adalah glukosa, fruktosa, sukrosa, asam metakrilat, kloroform, etilen glikol dimetakrilat (EGDMA), benzoil peroksida, air Ultra High Pure (UHP), metanol, asam asetat, natrium asetat trihidrat, kalium hidrogenfosfat trihidrat, kalium dihidrogenfosfat, kawat Ag, parafin padat dan karbon nanopori. Karbon nanopori diperoleh dari puslitbang hasil hutan LIPI dengan spesifikasi pada Lampiran 12. Semua bahan kimia berderajat kemurnian pro analisis.
3.2.2 Alat penelitian
3.3 Prosedur Penelitian
3.3.1 Diagram alir penelitian
Glukosa
Asam metakrilat + EGDMA + benzoil
peroksida
Karbon nanopori MIP
Analisis glukosa
- komposisi elektroda
Validasi Metode
- Jangkauan pengukuran
- Faktor Nersnt
- Batas deteksi
- Akurasi
- Presisi
3.3.2 Pembuatan larutan induk glukosa 10-1M
Larutan induk glukosa 10-1M dibuat dengan cara menimbang glukosa secara kuantitatif sebanyak 1,8018 gram kemudian dilarutkan dalam 20 mL air UHP dalam gelas piala 50 mL. Larutan tersebut selanjutnya dipindahkan secara kuantitatif ke dalam labu ukur 100 mL dan diencerkan dengan air UHP sampai tanda batas dan dikocok hingga homogen.
3.3.3 Pembuatan larutan kerja glukosa 10-2 M-10-8 M
Larutan kerja glukosa 10-2 M, dibuat dengan cara memipet 2,5 mL larutan glukosa 10-1 M, larutan kemudian dipindahkan secara kuantitatif ke dalam labu ukur 25 mL lalu ditambahkan air UHP sampai tanda batas dan dikocok hingga homogen. Untuk pembuatan larutan kerja glukosa 10-3 M, 10-4 M, 10-5 M, 10-6 M, 10-7 M, dan 10-8 M menggunakan prosedur yang sama melalui pengenceran.
3.3.4 Pembuatan larutan buffer
3.3.4.1 Pembuatan larutan asam asetat 0,2 M
Larutan asam asetat 0,2 M dibuat dengan cara mengencerkan sebanyak 1,14 mL larutan asam asetat glasial 14 N sampai tanda batas dalam labu ukur 100 mL kemudian dikocok hingga homogen.
3.3.4.2 Pembuatan larutan natrium asetat trihidrat 0,2 M
ke dalam labu ukur 100 mL lalu diencerkan dengan air UHP sampai tanda batas dan dikocok hingga homogen.
3.3.4.3 Pembuatan larutan buffer asetat
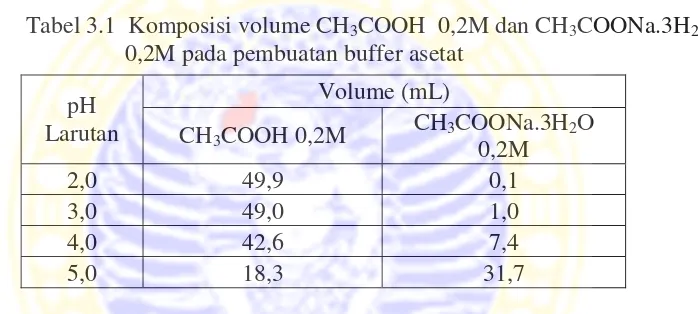
Larutan buffer asetat dibuat dalam variasi pH 3,0; 3,5; 4,0; 4,5 dan 5,0. Larutan ini dibuat dengan cara mencampurkan 0,2 M larutan asam asetat dan 0,2 M natrium asetat trihidrat sesuai komposisi volume pada Tabel 3.1. Komposisi diperoleh melalui persamaan:
Tabel 3.1 Komposisi volume CH3COOH 0,2M dan CH3COONa.3H2O 0,2M pada pembuatan buffer asetat
Kedua larutan dicampurkan dalam gelas beker dan diencerkan dengan air UHP hingga 100 mL. Selanjutnya pH larutan diukur dengan pH meter. Apabila pH buffer terlalu asam maka ditambahkan ke dalamnya larutan CH3COONa.3H2O 0,2M tetes demi tetes hingga pH yang diinginkan. Apabila pH buffer terlalu basa maka ditambahkan tetes demi tetes larutan CH3COOH 0,2M sampai diperoleh pH yang diinginkan.
3.3.4.4 Pembuatan larutan kalium hidrogenfosfat trihidrat 0,2M
Larutan kalium hidrogenfosfat trihidrat (Mr 228) 0,2M dibuat dengan cara melarutkan 4,5644 gram K2HPO4.3H2O dalam 50 mL air UHP dalam gelas piala 100 mL. Larutan kemudian dipindahkan secara kuantitatif ke dalam labu ukur 100
pH Larutan
Volume (mL)
CH3COOH 0,2M CH3COONa.3H0,2M 2O
2,0 49,9 0,1
3,0 49,0 1,0
4,0 42,6 7,4
mL dan diencerkan dengan air UHP sampai tanda batas dan dikocok hingga homogen.
3.3.4.5 Pembuatan larutan kalium dihidrogenfosfat 0,2M
Larutan kalium dihidrogenfosfat (Mr 136) 0,2 M dibuat dengan cara menimbang 2,7217 gram KH2PO4 dan dilarutkan dalam 25 mL akuades dalam gelas piala 50 mL. Larutan kemudian dipindahkan secara kuantitatif ke dalam labu ukur 100 mL lalu diencerkan dengan air UHP sampai tanda batas dan dikocok hingga homogen.
3.3.4.6 Pembuatan larutan buffer fosfat
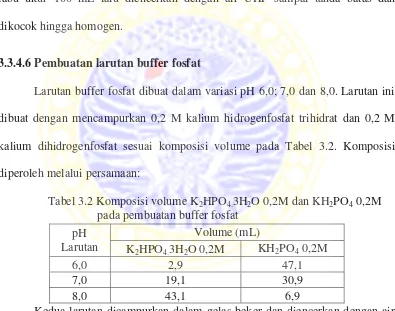
Larutan buffer fosfat dibuat dalam variasi pH 6,0; 7,0 dan 8,0. Larutan ini dibuat dengan mencampurkan 0,2 M kalium hidrogenfosfat trihidrat dan 0,2 M kalium dihidrogenfosfat sesuai komposisi volume pada Tabel 3.2. Komposisi diperoleh melalui persamaan:
Tabel 3.2 Komposisi volume K2HPO4.3H2O 0,2M dan KH2PO4 0,2M pada pembuatan buffer fosfat
Kedua larutan dicampurkan dalam gelas beker dan diencerkan dengan air UHP sampai volume 100 mL. Larutan kemudian diukur dengan pH meter. Apabila pH terlalu asam ditambahkan larutan kalium hidrogenfosfat trihidrat 0,2M tetes demi tetes ke dalamnya hingga pH yang diinginkan. Apabila pH buffer terlalu basa maka ditambahkan larutan kalium dihidrogenfosfat 0,2M hingga diperoleh pH yang diinginkan.
3.3.5 Pembuatan larutan pengganggu
3.3.5.1 Pembuatan larutan fruktosa 10-3 M
Sebelum membuat latutan fruktosa 10-3 M terlebih dahulu dibuat larutan fruktosa 10-1 M. larutan ini dibuat dengan cara menimbang secara teliti fruktosa sebanyak 1,8018 gram kemudian dilarutkan dengan air UHP dalam gelas piala 50 mL. Larutan tersebut dipindahkan secara kuantitatif ke dalam labu ukur 100 mL kemudian diencerkan dengan air UHP hingga tanda batas dan dikocok hingga homogen. Larutan fruktosa 10-3 M dibuat dengan cara memipet sebanyak 1 mL larutan fruktosa 10-1 M, larutan kemudian dipindahkan secara kuantitatif ke dalam labu ukur 100 mL lalu ditambahkan air UHP sampai tanda batas dan dikocok hingga homogen.
3.3.5.2 Pembuatan larutan sukrosa 10-3 M
3.3.6 Pembuatan Molecularly Imprinted Polymer (MIP)
Molecularly Imprinted Polymer (MIP) dibuat dengan cara mencampur 0,0688 gram monomer asam metakrilat dalam 5 mL kloroform dicampur dengan 0,0360 gram glukosa sebagai template yang sudah dilarutkan dalam 5 ml kloroform dalam gelas beker, campuran tersebut didiamkan selama 1 jam. Dalam gelas beker yang berbeda disiapkan 0,4752 gram crosslinker etilen glikol dimetakrilat (EGDMA) dan 0,2422 gram inisiator benzoil peroksida yang telah dilarutkan dalam 1 ml kloroform. Ke dalam campuran asam metakrilat dan glukosa ditambahkan crooslinker dan inisiator lalu dipanaskan di atas hotplate pada temperatur 60oC selama kurang lebih 2 jam tanpa pengadukan. Padatan yang terbentuk dikeringkan di udara terbuka. Padatan kemudian digerus dan diayak dengan ukuran 200 mesh sehingga diperoleh padatan yang homogen. Selanjutnya, MIP yang sudah terbentuk dicuci menggunakan asam asetat dan metanol dengan perbandingan 2:8 dan air 70oC (Qin dkk, 2009). Pembuatan polimer kontrol dilakukan dengan prosedur yang sama tanpa penambahan glukosa.
3.3.7 Pembuatan badan elektroda pasta karbon nanopori/MIP
Gambar 3.1 Konstruksi elektroda pasta karbon nanopori/MIP
3.3.8 Pembuatan Sampel Madu
Sampel dibuat dengan menimbang 2,5 gram madu kemudian dilarutkan dalam air UHP (Ultra High Pure) dalam gelas beker 50 mL. Larutan tersebut dipindahkan secara kuantitatif ke dalam labu ukur 100 mL kemudian diencerkan dengan air UHP hingga tanda batas dan dikocok hingga homogen.
3.3.9 Optimasi elektroda
3.3.9.1 Optimasi pH larutan glukosa
Untuk optimasi pH larutan glukosa digunakan larutan glukosa 10-3 M. larutan ini dibuat dengan mengencerkan larutan kerja glukosa 10-1 M dalam larutan buffer pH 2, 3, 4, 5, 6, 7 dan 8 di dalam gelas piala. Masing-masing larutan kemudian dipindahkan secara kuantitatif ke dalam labu ukur 25 mL dan diencerkan dengan larutan buffer pH 2, 3, 4, 5, 6, 7 dan 8 sampai tanda batas dan dikocok hingga homogen. Larutan-larutan tersebut kemudian diukur
Kawat Ag
menggunakan elektroda kerja pasta karbon nanopori/MIP dengan elektroda pembanding Ag/AgCl. Untuk mendapat pH optimum dilihat saat elektroda memberikan potensial yang relatif konstan.
3.3.9.2 Optimasi komposisi elektroda
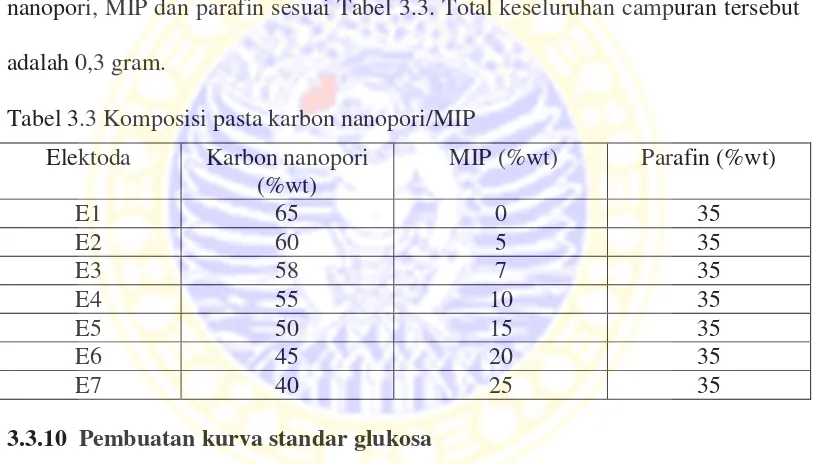
Optimasi komposisi elektroda dilakukan agar didapatkan elektroda yang mampu bekerja secara optimum. Dari beberapa komposisi yang dibuat akan dilihat faktor Nersnt, linieritas dan batas deteksi. Komposisi antara karbon nanopori, MIP dan parafin sesuai Tabel 3.3. Total keseluruhan campuran tersebut adalah 0,3 gram.
Tabel 3.3 Komposisi pasta karbon nanopori/MIP
3.3.10 Pembuatan kurva standar glukosa
Untuk membuat kurva standar glukosa dilakukan pengukuran larutan glukosa pada konsentrasi 10-1 M – 10-8 M pada range pH optimum menggunakan elektroda karbon nanopori / MIP yang telah dioptimasi. Dari data yang dihasilkan selanjutnya dibuat kurva hubungan antara potensial terhadap log konsentrasi glukosa. Kurva yang memberikan garis lurus adalah kurva standar glukosa.
Elektoda Karbon nanopori (%wt)
MIP (%wt) Parafin (%wt)
E1 65 0 35
E2 60 5 35
E3 58 7 35
E4 55 10 35
E5 50 15 35
E6 45 20 35
3.3.11 Penentuan parameter validasi
3.3.11.1 Jangkauan pengukuran
Untuk menentukan jangkauan pengukuran dilakukan pengukuran larutan glukosa 10-8M – 10-1M menggunakan elektroda karbon nanopori/MIP yang telah dioptimasi. Dari hasil pengukuran dibuat kurva standar potensial (mV) terhadap log [glukosa] dan ditentukan persamaan regresi liniernya. Range yang masih memberikan garis lurus pada kurva adalah jangkauan pengukuran.
3.3.11.2 Faktor Nernst dan linieritas
Untuk memperoleh faktor Nersnt dilakukan pengukuran larutan kerja glukosa menggunakan elektroda karbon nanopori/MIP yang telah dioptimasi. Dari hasil potensial yang diperoleh dibuat kurva standar antara potensial (mV) terhadap log [glukosa] sehingga diperoleh persamaan garis regresi linier
y = bx +a ……….3.1
Kemiringan kurva (slope) merupakan faktor Nersnt.
Linieritas kurva kalibrasi dinyatakan dengan koefisien korelasi (r) Pearson sesuai persamaan
3.3.11.3 Penentuan batas deteksi
Sebelum menentukan batas deteksi harus ditentukan terlebih dahulu persamaan garis linier dari kurva antara potensial dan log konsentrasi glukosa. Selanjutnya menentukan persamaan garis non linier pada kurva potensial (mV) terhadap log [glukosa]. Kedua persamaan garis tersebut diekstrapolasi ke absis, maka akan diperoleh log konsentrasi glukosa batas deteksi elektroda.
3.3.11.4 Penentuan koefisien variasi (presisi)
Untuk menentukan koefisien variasi (presisi) dari penelitian ini dilakukan pengukuran larutan glukosa dengan konsentrasi 10-2M dan 10-4Mmenggunakan elektroda karbon nanopori/MIP pada pH optimum sebanyak 3 kali. Dari hasil pengukuran ditentukan simpangan baku (standar deviasi=SD) dan koefisien variasi sesuai persamaan berikut
SD =
dengan ketentuan Xi merupakan nilai dari setiap pengukuran, X merupakan nilai
rata-rata pengukuran, dan n merupakan jumlah pengukuran.
3.3.11.5 Penentuan persen recovery (% R)
konsentrasi glukosa terukur. Dengan menganggap konsentrasi glukosa 10-2Mdan 10-4M sebagai konsentrasi sebenarnya, harga % recovery dihitung sesuai persamaan
R = x 100% 3.5
dengan ketentuan R adalah persen recovery, Csp adalah konsentrasi glukosa terukur, dan Ks adalah konsentrasi glukosa sebenarnya.
3.3.11.6 Penentuan koefisien selektivitas
Untuk menentukan selektivitas dari elektroda dapat dilakukan dengan melakukan pengukuran pada larutan pengganggu yaitu larutan fruktosa dan larutan sukrosa 10-3M menggunakan elektroda karbon nanopori/MIP yang telah dioptimasi. Nilai potensial (y) larutan pengganggu disubstitusikan dalam persamaan regresi linier sehingga diperoleh konsentrasi glukosa (x). koefisien selektivitas ditentukan sesuai persamaan:
݇
ǡ௧ൌ
௦௧௦௨௧௨௦௦௨௨௬௫……
3.6s sp
BAB IV
HASIL DAN PEMBAHASAN
4.1. Hasil Pembuatan Molecularly Imprinted Polymer (MIP)
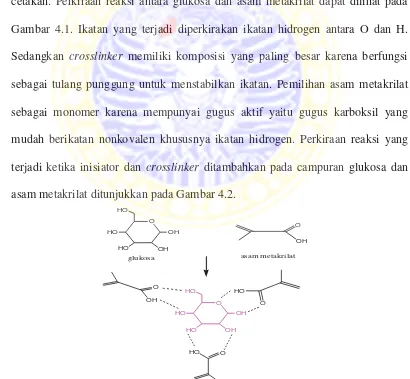
Bahan dasar pembuatan MIP adalah monomer asam metakrilat, template glukosa, dan crosslinker etilen glikol dimetakrilat (EGDMA) dengan perbandingan berturut-turut 4:1:12 (Qin dkk, 2009). Jumlah mol monomer dibuat lebih besar dari template agar monomer dapat mengelilingi template dan terbentuk cetakan. Perkiraan reaksi antara glukosa dan asam metakrilat dapat dilihat pada Gambar 4.1. Ikatan yang terjadi diperkirakan ikatan hidrogen antara O dan H. Sedangkan crosslinker memiliki komposisi yang paling besar karena berfungsi sebagai tulang punggung untuk menstabilkan ikatan. Pemilihan asam metakrilat sebagai monomer karena mempunyai gugus aktif yaitu gugus karboksil yang mudah berikatan nonkovalen khususnya ikatan hidrogen. Perkiraan reaksi yang terjadi ketika inisiator dan crosslinker ditambahkan pada campuran glukosa dan asam metakrilat ditunjukkan pada Gambar 4.2.
Gambar 4.1 Perkiraan reaksi antara glukosa dan asam metakrilat
Gambar 4.2 Perkiraan polimerisasi asam metakrilat dan glukosa saat ditambahkan crosslinker EGDMA
Polimerisasi yang terjadi antara template, monomer dan crosslinker pada MIP adalah polimerisasi adisi. Dalam penelitian ini dipilih polimerisasi adisi karena jika terjadi polimerisasi kondensasi akan disertai pembentukan molekul kecil seperti H2O yang akan mengganggu ikatan antara monomer dan template. Pada polimerisasi kondensasi pembentukan polimer terjadi bukan karena adanya inisiator melainkan karena adanya kondensasi antara dua molekul polifungsional untuk membentuk satu molekul polifungsional yang lebih besar dengan kemungkinan terjadinya eliminasi molekul kecil seperti air. Polimerisasi adisi merupakan polimerisasi yang membutuhkan inisiator. Inisiator yang digunakan adalah benzoil peroksida untuk menginisiasi asam metakrilat sehingga membentuk radikal. Setelah radikal terbentuk terjadi propagasi yaitu pemanjangan
rantai. Tahap terakhir pada proses ini adalah terminasi yaitu berhentinya proses polimerisasi (Odian, 2004).
Polimerisasi dilakukan selama 2 jam pada suhu 60oC hingga pelarut yang digunakan yaitu kloroform habis menguap. Polimerisasi dilakukan pada suhu 60oC karena beberapa penelitian menunjukkan polimerisasi MIP pada temperatur tersebut lebih selektif daripada pada temperatur tinggi (Yan, 2006). Terjadinya proses polimerisasi dapat dilihat dari larutan yang berubah menjadi padatan kekuningan yang menempel pada dasar gelas beker yang seperti ditunjukkan pada Gambar 4.3. Padatan kemudian digerus dan diayak dengan ukuran 200 mesh kemudian dicuci dengan campuran asam asetat dan metanol dengan perbandingan 2:8 (v/v). Pencucian dilakukan untuk menghilangkan sisa reaktan yang tidak bereaksi. Agar diperoleh MIP maka template diekstraksi menggunakan air panas (Qin dkk, 2009). Ikatan yang terjadi antara glukosa dengan monomer asam metakrilat adalah ikatan hidrogen.
Ikatan hidrogen merupakan ikatan sekunder yang mudah diputus. MIP akan mudah membentuk cetakan yang spesifik terhadap molekul glukosa saat diekstraksi menggunakan air panas. Cetakan MIP glukosa yang telah diekstraksi dapat dilihat pada Gambar 4.4
Gambar 4.4 Cetakan MIP glukosa menggunakan monomer asam metakrilat yang telah diekstraksi (Qin dkk, 2009)
4.2 Hasil Pembuatan Polimer Kontrol
Pembuatan polimer kontrol dilakukan sama seperti pembuatan MIP namun tanpa penambahan glukosa. Hal ini membuat polimer kontrol tidak memiliki sisi pengenalan yang spesifik terhadap molekul glukosa. Polimerisasi yang terjadi adalah polimerisasi adisi, sama dengan polimerisasi pada pembuatan MIP. Reaksi polimerisasi asam metakrilat dapat dilihat pada Gambar 4.5. Hasil polimer kontrol hampir sama dengan MIP yaitu padatan kekuningan yang menempel pada dasar gelas beker yang dapat dilihat pada Gambar 4.6. Padatan ini diperlakukan sama dengan MIP yaitu dihaluskan, diayak dengan ukuran 200 mesh, dan dicuci dengan campuran asam asetat : metanol (2:8) untuk menghilangkan sisa reaktan yang
tidak ikut bereaksi. Polimer kontrol dibuat untuk mengetahui perbandingan kinerja elektroda dengan atau tanpa sisi pengenalan yang spesifik yaitu glukosa.
OH
O
OH
O
CO2H CO2H
CO2H
n
Gambar 4.5 Reaksi polimerisasi asam metakrilat (Munk dkk, 1994)
Gambar 4.6 Hasil polimer kontrol tanpa penambahan glukosa menggunakan monomer asam metakrilat
4.3 Karakterisasi Molecularly Imprinted Polymer (MIP) dan Polimer Kontrol
Gambar 4.7 Spektra FT-IR asam metakrilat (1) polimer kontrol (2) dan MIP glukosa (3)
1
2
Berdasarkan spektra FT-IR terjadi pergeseran pita serapan C=O yang terkonjugasi C=C dari monomer asam metakrilat pada bilangan gelombang 1697 cm-1 (spektrum 1) bergesar menjadi 1728,22cm-1 yang merupakan pita serapan C=O biasa dari polimer kontrol (spektrum 2) yang menunjukkan bahwa telah terjadi polimerisasi pada polimer kontrol. Polimerisasi MIP glukosa juga ditunjukkan dengan adanya pergeseran pita serapan C=O terkonjugasi C=C dari asam metakrilat pada bilangan gelombang 1697 cm-1 (spektrum 1) bergeser menjadi 1728,22 cm-1 yang merupakan pita serapan C=O biasa dari MIP glukosa (spektrum 3). Adanya ikatan hidrogen antara template glukosa dan monomer asam metakrilat pada MIP ditunjukkan dengan adanya pita serapan O-H melebar pada bilangan gelombang 3425,58 cm-1. Sedangkan pada polimer kontrol tidak ditambahkan template glukosa sehingga tidak terjadi ikatan hidrogen antara monomer dan template. Hal ini menjadikan pita serapan O-H bebas pada polimer kontrol agak tajam pada bilangan gelombang 3425,58 cm-1.
Gambar 4.8 Spektra FT-IR MIP glukosa menggunakan monomer asam metakrilat sebelum ekstraksi (1) dan sesudah ekstraksi (2)
4.4 Pembuatan dan optimasi elektroda
Elektroda adalah suatu sensor analit pada potensiometer yang harus mampu bekerja secara optimum. Karena hal tersebut harus dilakukan optimasi elektroda. Optimasi yang dilakukan adalah optimasi komposisi elektroda dan optimasi pH larutan.
4.4.1 Optimasi komposisi elektroda
Komponen membran elektroda adalah karbon nanopori, MIP, dan parafin. Karbon nanopori dipilih sebagai salah satu bahan elektroda karena memiliki konduktivitas tinggi, inert dan memiliki ukuran nano yang menyebabkan permukaannya lebih luas sehingga pertukaran analit berlangsung lebih cepat (Pyun dan Lee, 2007). Karbon nanopori sebelumnya dihilangkan dari mineralnya dengan mencuci menggunakan asam nitrat. Pengggunaan MIP bertujuan agar elektroda memiliki selektivitas dan sensitifitas yang tinggi karena MIP memiliki sisi pengenalan molekul yang selektif (Tehrani dkk, 2009). Sedangkan penambahan parafin dimaksudkan agar campuran ketiga bahan tersebut dapat memadat ketika dimasukkan ke dalam tip mikropipet sehingga tidak terlepas dari tip mikropipet saat digunakan dalam pengukuran. Dalam penelitian ini dibuat delapan komposisi variasi karbon nanopori dan MIP yang dapat dilihat pada Tabel 3.3. Sedangkan komposisi parafin dibuat tetap.
Tabel 4.1 Pengaruh komposisi karbon nanopori dan MIP terhadap kinerja elektroda
Elektroda Karbon nanopori
Kinerja elektroda dalam potensiometri salah satunya ditentukan oleh faktor Nernst. Suatu ESI dikatakan memenuhi persamaan Nernst jika memenuhi 0,0592/n (± 1-2 mV). Besarnya faktor Nernst menunjukkan suatu elektroda dapat bekerja secara sensitif dan selektif terhadap analit yang diukur. Glukosa merupakan molekul divalen. Oksidasi glukosa membentuk asam glukonat melepas dua elektron (Park dkk, 2005) sehingga besarnya faktor Nernstnya 59,2mV/n yaitu mendekati 29,5mV/dekade (Cattral, 1997).
Hasil pengukuran terhadap masing-masing elektroda menunjukkan bahwa E7 dan E8 memiliki faktor Nernst yang mendekati 29,5 mV/dekade. Namun, selain faktor Nernst perlu diperhatikan juga linieritas dan jangkauan pengukuran elektroda.
(r) yang baik adalah mendekati 1. Elektroda 7 (E7) dan elektroda 8 (E8) memiliki koefisien korelasi berturut-turut 0,997 dan 0,980 yang mendekati 1 sehingga dapat dikatakan elektroda tersebut memiliki sensitivitas yang relatif tinggi. Namun jika dilihat dari faktor Nernst maka E7 merupakan elektroda yang lebih baik dengan faktor Nernst 27,8 mV/dekade .
Jangkauan pengukuran dari suatu elektroda yang optimum juga diharapkan luas. Jangkauan pengukuran ditunjukkan oleh kurva yang masih memberikan garis lurus (Bakker, 1997). Berdasarkan hasil pengukuran kedelapan elektroda dengan berbagai variasi, komposisi elektroda ketujuh (E7) merupakan elektroda yang memiliki kinerja optimum dengan faktor Nernst 27,8 mV/dekade, jangkauan pengukuran antara 10-6M-10-2M dan koefisien korelasi sebesar 0,997.
Gambar 4.9 Kurva hubungan antara log konsentrasi glukosa dengan potensial pada berbagai variasi komposisi elektroda
Penentuan komposisi elektroda yang optimum didasarkan pada banyaknya karbon nanopori dan MIP yang digunakan karena keduanya akan memberikan respon dalam pengukuran potensial glukosa. Karbon nanopori berfungsi sebagai penghantar yang menyampaikan respon dari kawat Ag menuju potensiometer. Kawat Ag yang digunakan dilapisi dengan AgCl melalui proses elektrolisis sederhana. Sedangkan MIP merupakan sisi pengenal yang dapat merespon analit secara selektif sesuai cetakannya. Banyaknya MIP yang digunakan mempengaruhi jumlah sisi pengenal terhadap analit yang meningkatkan selektivitas elektroda.
Gambar 4.10 Kurva hubungan antara log konsentrasi glukosa dengan potensial diukur menggunakan E1 (karbon nanopori), E2 (karbon nanopori/polimer kontrol) dan E7 (karbon nanopori/MIP)
4.4.2 Optimasi pH
Pada setiap pengukuran kondisi yang berbeda dapat mempengaruhi respon alat terhadap hasil pengukuran. Kondisi yang perlu diperhatikan adalah pH larutan. Kondisi pH yang berbeda akan memberikan respon yang berbeda pula. Dalam penelitian ini dilakukan optimasi pH larutan dalam hubungannya dengan potensial yang dihasilkan. Range pH yang digunakan yaitu antara pH 2-8 agar diketahui respon yang dihasilkan ketika larutan glukosa diukur pada pH asam, netral dan basa.
Pengukuran hanya dilakukan pada larutan standar glukosa pada konsentrasi 10-3M dengan asumsi konsentrasi yang lain akan memberikan respon yang sama. pH optimum dilihat saat elektroda memberikan potensial yang relatif konstan. Potensial yang diberikan pada masing-masing pH dapat dilihat pada Gambar 4.11 dengan data selengkapnya pada Lampiran 4. Berdasarkan grafik dapat dilihat bahwa pengukuran glukosa memberikan respon yang konstan pada
pH 7-8 sehingga pH ini disebut pH optimum. Glukosa berada dalam keadaan stabil pada pH 7,4. Dalam larutan basa glukosa berada sebagai ion karboksilat rantai terbuka sedangkan pada suasana asam glukosa cepat berubah menjadi lakton (Fessenden, 1995).
Gambar 4.11 Grafik hubungan antara pH dan potensial diukur menggunakan karbon nanopori/MIP secara potensiometri
4.5 Kurva Kalibrasi Glukosa
Kurva kalibrasi glukosa didapat dengan mengukur larutan glukosa dengan rentang konsentrasi antara 10-8M hingga 10-1M menggunakan elektroda dengan komposisi optimum yaitu E7 pada pH optimum yaitu pH 7. Dari data potensial yang diperoleh dibuat kurva antara log C terhadap potensial. Kurva yang menunjukkan garis lurus merupakan kurva kalibrasi glukosa. Kurva kalibrasi glukosa memiliki range konsentrasi dari 10-6M hingga 10-1M. Data pengukuran dapat dilihat pada Tabel 4.2 dan kurva kalibrasi glukosa dapat dilihat pada Gambar 4.12.
0 50 100 150 200 250
0 1 2 3 4 5 6 7 8 9
Potensi
al (m
V)
Tabel 4.2 Data pengukuran glukosa pada berbagai konsentrasi menggunakan Elektroda optimum (E7) pada pH optimum (pH 7)
Konsentrasi glukosa (M) Potensial (mV)
10-8 299
Gambar 4.12 Kurva kalibrasi glukosa menggunakan elektroda karbon nanopori/MIP (E7) secara potensiometri
4.6 Uji Kinerja Elektroda Karbon Nanopori/MIP
4.6.1 Jangkauan pengukuran
Suatu elektroda yang baik diharapkan memiliki jangkauan pengukuran yang relatif lebar sehingga dapat memberikan respon pada rentang konsentrasi yang luas. Jangkauan pengukuran dapat dilihat pada kurva yang masih memberikan garis lurus. E7 dan E8 memiliki jangkauan pengukuran yang relatif
lebar dan memiliki faktor Nernst mendekati 0,0592mV/n (Cattral, 1997) dan linieritas mendekati 1. Jangkauan pengukuran, faktor Nernst dan linieritas ditunjukkan pada Tabel 4.3 dan analisis perhitungannya dapat dilihat pada Lampiran 5.
Tabel 4.3 Jangkauan pengukuran E7 (MIP 20%wt) dan E8 (MIP 25%wt) menggunakan karbon nanopori/MIP secara potensiometri
Elektroda Konsentrasi (M)
Regresi Linier Faktor Nersnt Berdasarkan tabel tersebut elektroda yang memiliki jangkauan pengukuran relatif lebar ditunjukkan oleh E7 (elektroda dengan komposisi MIP 20%) dengan jangkauan pengukuran antara 10-6M-10-2M.
4.6.2 Faktor Nersnt dan linieritas
Nernst dan koefisien variasi masing-masing elektroda dapat dilihat pada Tabel 4.4.
Tabel 4.4 Faktor Nernst dan koefisien korelasi masing-masing elektroda Elektroda Karbon
nanopori
4.6.3 Batas deteksi
Batas deteksi adalah konsentrasi terkecil dari analit dalam sampel yang masih dapat ditentukan secara statistik oleh alat (Christian, 1994). Batas deteksi diperoleh dengan membuat titik potong antara garis linier dan garis nonlinier. Dari hasil perhitungan diperoleh batas deteksi dari elektroda sebesar 6,17x10-7 M. Kecilnya batas deteksi elektroda tersebut menunjukkan bahwa elektroda masih memberi respon yang bagus pada konsentrasi kecil. Analisis perhitungannya dapat dilihat pada Lampiran 6.
4.6.4 Akurasi
standar sebenarnya. Pada penentuan akurasi digunakan larutan standar dengan konsentrasi 10-2M dan 10-4M.
Berdasarkan potensial yang diperoleh dan hasil perhitungan diperoleh akurasi sebesar 98,36% dan 132%. Hal tersebut menunjukkan bahwa elektroda memiliki akurasi yang baik pada konsentrasi tinggi sedangkan kurang baik pada konsentrasi rendah. Elektroda karbon nanopori ini memiliki akurasi yang baik pada konsentrasi 10-2M karena masih masuk dalam jangkauan pengukuran yang masih ditoleransi yaitu 90-107% (Harmita, 2004). Data akurasi dapat dilihat pada tabel 4.5 dan analisis perhitungan dapat dilihat pada Lampiran 7.
Tabel 4.5 Akurasi pengukuran menggunakan elektroda karbon nanopori/MIP secara potensiometri
Konsentrasi sebenarnya (M) Konsentrasi terukur (M) Akurasi (%)
10-2 0,9x10-2 98,36
10-4 1,32x10-4 132
4.6.5 Presisi
pengukuran dapat dilihat pada Tabel 4.6 dan analisis perhitungan dapat dilihat pada Lampiran 8.
Tabel 4.6 Data pengukuran koefisien variasi menggunakan elektroda karbon nanopori/MIP secara potensiometri
Konsentrasi (M) Potensial (mV) KV (%)
Replikasi 1 Replikasi 2 Replikasi 3
10-2 414 417 423 1,09
10-4 364 376 360 2,26
4.6.6 Selektivitas elektroda
Selektivitas adalah kemampuan suatu alat yang hanya dapat mengukur analit secara cermat dengan adanya komponen lain dalam sampel. Madu tidak hanya mengandung glukosa namun juga mengandung komponen lain seperti fruktosa dan sukrosa. Selektivitas elektroda dapat ditentukan melalui koefisien selektifitas.
Tabel 4.7 Koefisien selektivitas elektroda glukosa berbasis karbon nanopori/MIP secara potensiometri
Larutan penggangu Koefisien selektifitas
Fruktosa 1,786 x 10-3
Sukrosa 5,155 x 10-4
Fruktosa dan sukrosa sebagai pengganggu memiliki struktur geometri dan letak gugus hidroksil yang berbeda dengan template glukosa. Hal ini menjadikan fruktosa dan sukrosa tidak dapat terukur secara spesifik karena ukuran cetakan yang tidak sesuai dan letak ikatan hidrogennya berbeda. Koefisien selektivitas fruktosa lebih besar dibandingkan sukrosa. Hal ini terjadi karena fruktosa merupakan monosakarida yang memiliki struktur hampir mirip dengan glukosa namun siklisasinya membentuk cincin lima sedangkan sukrosa merupakan disakarida. Struktur fruktosa dan sukrosa dapat dilihat pada gambar 4.13.
Gambar 4.13 Struktur fruktosa dan Sukrosa
Elektroda karbon nanopori/MIP ini tidak akan memberikan respons yang spesifik apabila digunakan untuk mengukur monosakarida lain yang memiliki
struktur yang hampir sama dengan glukosa, contohnya galaktosa. Hal ini dikarenakan letak salah satu gugus hidroksil pada galaktosa berbeda dengan glukosa mempengaruhi terbentuknya ikatan hidrogen yang menjadikannya tidak sesuai dengan cetakan. Berdasarkan hal tersebut dapat dikatakan bahwa elektroda karbon nanopori/MIP ini memiliki sifat yang selektif dan spesifik.
4.7 Pengukuran kadar glukosa dalam madu
Untuk menentukan besarnya kadar glukosa dalam madu dilakukan pengukuran menggunakan elektroda karbon nanopori/MIP dengan komposisi optimum yaitu elektroda ketujuh (E7) pada madu. Dalam penelitian ini digunakan madu murni. Dari hasil pengukuran diperoleh kadar glukosa dalam madu sebesar 22,4% b/b. Menurut White dan Doner (1980) madu mengandung 31% glukosa. Perbedaan kadar glukosa yang relatif besar dimungkinkan karena perbedaan matriks yang terkandung dalam madu tersebut dan tidak adanya komposisi glukosa yang pasti pada madu. Perolehan kadar glukosa sebesar 22,4% ini masih masuk dalam jangkauan pengukuran elektroda (10-6M – 10-1M) yang
perhitungannya dapat dilihat pada Lampiran 11.
4.8 Mekanisme timbulnya beda potensial
MIP-C6H12O6
Karbon nanopori/MIP terjenuhkan glukosa
MIP + C6H12O6
C6H12O6 Larutan glukosa
BAB V
KESIMPULAN DAN SARAN
5.1 Kesimpulan
Dari hasil penelitian maka dapat disimpulkan :
1. Kondisi optimum dalam pembuatan dan karakterisasi elektroda selektif berbasis karbon nanopori/MIP adalah pada perbandingan 40:25 pada pH optimum larutan 7,0-8,0
2. Nilai validasi metode dalam pembuatan dan karakterisasi elektroda selektif berbasis karbon nanopori/MIP meliputi batas deteksi sebesar 6,17x10-7 M, faktor Nernst sebesar 27,8 mV/dekade, jangkauan pengukuran sebesar 10-6M-10-2M, akurasi pengukuran sebesar 93,86% untuk konsentrasi 10-2M dan sebesar 132% untuk konsentrasi 10-4M, presisi dinyatakan dengan koefisien variasi sebesar 1,09% untuk konsentrasi 10-2M dan 2,26% untuk konsentrasi 10-4M, dan koefisien selektifitas untuk larutan fruktosa dan sukrosa masing-masing sebesar 1,786x10-3 dan 5,155x10-4, serta diperoleh kadar glukosa dalam madu sebesar 22,4% b/b.
5.2 Saran
1. Diperlukan penelitian lebih lanjut untuk mengetahui masa kerja (life time) dari elektroda karbon nanopori/MIP
DAFTAR PUSTAKA
Aripin, 2007, Preparasi dan Karakterisasi Karbon Aktif Magnetik Nanopori, Jurusan Fisika FMIPA, Universitas Haluleo
Bakker, E., Buhlmann, P., Pretsch, E., 1997, Carrier-Based Ion-Selective Electrodes and Bulk Optodes (1) General Characteristics, Chem.Rev.,
97, 3083-3132
Basset, J., Denney, R.C., Jeffery, G.H., Mendham, J., 1991, Buku Ajar Vogel: Kimia Analisis Kuantitatif Anorganik, Alih Bahasa: A. Hadyana P dan Ir. L. Setiono, Buku Kedokteran EGC, Jakarta
Braun, R.D., Introduction to instrumental analysis, International Edition, McGraw Hill, New York, 703-704
Brüggemann, O., 2002, Molecularly Imprinted Materials-Receptors More Durable than Nature Can Provide, Springer-Verlag Heidelberg, Berlin, Germany
Cattral, R.W., 1997, Chemical Sensors, Oxford University Press, New York Christian, D G., 1994, Analytical Chemistry, John Willey & Sons. inc, Canada Day, R.A., Underwood, A.L., 2002, Analisis Kimia Kuantitatif, penerjemah Iis
Sopyan, Edisi keenam, Erlangga, Jakarta, 377
Evans, A., 1991, Potentiometry and Ion Selective Electrodes, John Wiley & Sons, Chichester, 304p
Fessenden, R.J.; Fessenden, J.S., 1995, Kimia Organik, Terjemahan oleh A.H. Pudjaatmaka, Jilid I dan Jilid II, edisi ketiga, cetakan keempat, Erlangga, Jakarta
Fritz, J.S., schenk, George H., 1987, Quantitative Analytical Chemistry, Prentice Hall.Inc, New Jersey, 307
Harmita, 2004, Petunjuk Pelaksanaan Validasi Metode dan Cara Perhitungannya, Majalah Ilmu Kefarmasian, Vol. I, No. 3, 117-135
Javanbakht, M., Fard, Solmaz, E., Mohammadi, A., Abdous, Majid., Ganjali, Mohammad R., Norouzi, Parvis., Safaraliee, Leila., 2002, Molecularly Imprinted Polymer Based Potentiometric Sensor The Determination Of Hydroxyzine In Tablets and Biological Fluids, Analytica Chemica Acta, 612 : 65-74
Kamal, A.M., Klein, Peter, 2011, Determination Of Sugars In Honey By Liquid Chromatography, Biomedical & Applied Sciences, Saudi Journal
of Biological Sciences 18,17-21
Komiyama, M., Takeuchi, T., Mukawa, T., Asanuma, H., 2003, Molecular Imprinting from Fundamental to Applications, Wiley-VCH Verlag GmbH & Co. KGaA, Weinheim
Mandasari, E., 2011, Sensor Potensiometri Melamin berbasis Karbon Nanopori/Molecularly Imprinted Polymer dengan Monomer Asam Metakrilat, Departemen Kimia Fakultas Sains dan Teknologi Universitas Airlangga
Maun, S., 1999, Pemalsuan Madu Dengan Sakarosa, Kimia Kedokteran Fakultas Kedokteran Trisakti, Jakarta
Merck, 2001, The Merck Index, thirteenth edition, John Wiley and Sons, New York
Mulja, M., Suharman, 1995, Analisis instrumental, Airlangga University Press, Surabaya, 312-322
Munk, P., Qin, A., Tian, M., Ramireddy, Webber, S.E., 1994, Polystyrene-Poly (methacrylic acid) Block Copolymer Micelles, Macromolecules, 27: 120-126
Odian, G., 1991, Principles of Polymeryzation, third edition, The City of University of New York, Staten Island, New York
Özcan, L., Sahin, Yücel, 2007, Determination of Paracetamol Based on Electropolymerized-molecularly Imprinted Polypirrole modified Pencil Graphite Electrode, Sensors and Actuators B, 30:30-31
Park, S., Boo, H., dan Chung, T.D., 2005, Electrochemical Non-enzymatic Glucose Sensors, Analytica Chemica Acta, 46-57
Prasad, K., Prathish, K.P., Gladis, J.M., Naidu, G.R.K., Rao, T.P., 2006,
Pyun, S., Lee, G., 2007, Synthesis and Characterization of Nanoporous Carbon and Its Electrochemical Application to Electrode Material for Supercapasitors, Modern Aspect of Electrochemistry, No 41, Springer,
New York
Qin, W., Liang, R., Zhang, R., 2009, Potentiometric Sensor based on Molecularly Imprinted Polymer for Determination of Melamine in Milk, Sensor and Actuators B, 141: 544-550
Rahmawati, Y.D., Prasetyo, I., Rochmadi, 2010, Pengaruh Penambahan Zat pendehidrasi Terhadap Struktur Mikropori Material Karbon yang Dibuat dari Pirolisis Resin Phenol-tert,buthyl phenol-formaldehid, Prosiding
Seminar Nasional Teknik kimia “kejuangan”, Yogyakarta
Ratnayani, K., Adhi S. D., Gitadewi, I G.M.A.S., Penentuan Kadar Glukosa Dan Fruktosa Pada Madu Randu Dan Madu Kelengkeng Dengan Metode Kromatografi Cair Kinerja Tinggi. Kimia FMIPA Universitas Udayana, Bukit Jimbaran
Skoog, A.D., 1992, Fundamental of Analytical Chemistry, sixth edition, saunders college publishing, New York, 399-403
SNI, 2004, Madu, Badan Standarisasi Nasional ICS 67.180.10
Soria, A.C., Gonzales, Montserrat., Lorenzo, Cristina de., Martunez-Castro, Isabel., Sanz, Jesus., Estimation of honeydew ratio in honey samples from their physicochemical data and from their volatile composition obtained by SPME and GC-MS, Society of Chemical Industry, J Sci Food Agric
Sperling, L.H., 2006, Introduction to physical Polymer Science, John Wiley & Sons, Inc.
Sudarmadji, S., Haryono, B., Suhardi, 1994, Prosedur Analisa Untuk Bahan Makanan dan Pertanian, Liberty, Yogyakarta
Suyanto, 2009, Kimia Polimer, Departemen Kimia Fakultas Sains Dan Teknologi Universitas Airlangga, Surabaya
Taylor, L.R., Papp, Richard. B., Pollard, B.D., 1994, Instrmental methods for determining elements, VCH Publishers, Inc., New York.
White, J.W., Doner, L., 1980, Bee Keeping in the USA Agriculture Handbook number 335, Eastern Regional center, Philadelphia 82-91
Yan, H., Row, K.H., 2006, Characteristic and Synthethic Approach of Molecularly Imprinted Polymer, International journal of Molecular Science, 402-751
Lampiran 12 Spesifikasi karbon nanopori Material : Bambu
1. Suhu aktivasi : 850oC 2. Steam = 90oC
3. RD KOH = 20% 4. B.A.A = 6,005 g 5. Doping = Cu (1:4)
= 18,018 gram
Range jangkauan pengukuran antara 1,8018 x 10-4 gram hingga 18,018 gram Massa glukosa yang diperoleh melalui pengukuran = 5,65 gram
Keterangan :
Lampiran 11 Perhitungan kadar glukosa dalam madu 2,5 g/100mL madu
Lampiran 10 Perhitungan koefisien selektivitas 1. Larutan fruktosa
y = 27,8x + 469,8 310 = 27,8x + 469,8 -159,8 = 27,8x
x = Log [C] = -5,7482 C = [fruktosa] = 1,786 x 10-6
݇ǡ௧=ଵǡ଼௫ଵି ଵିଷ
=1,786x10-3 2. Larutan sukrosa y = 27,8x + 469,8 295 = 27,8x + 469,8 -174,8 = 27,8x
x = Log [C] = -6,2877 C = [sukrosa] = 5,155 x 10-7
݇ǡ௧=ହǡଵହହ௫ଵି ଵିଷ
Lampiran 9 Perhitungan pembuatan larutan pengganggu 1. Larutan Fruktosa 10-1M
M = n V
10-1 = n L n = g
Mr
10-1 = ଵ଼ǡଵ଼
g = 1,8018 g/1000 mL = 0,1802 g/100 mL
2. Larutan Sukrosa 10-1M
M = n V
10-1 = n L n = g
Mr
10-1 = ଷǡଷ
SD =
ξ
ଵଷ଼ǡହ ଷିଵSD = 8,32
%KV = ௌ
X x 100%
%KV = ଼ǡଷଶ
ଷǡ x 100%
Lampiran 7 Analisis akurasi pengukuran
Persamaan regresi dari kurva standar glukosa y= 27,8x + 469.8 Untuk konsentrasi glukosa 10-2 M
y = 27,8x + 469,8 414 = 27,8x + 469,8 -55,8 = 27,8x x = Log C = -2,007 C = [glukosa] = 0,009 %akurasi = ǡଽ
ଵିଶ x 100%
= 98,36%
Untuk konsentrasi glukosa 10-4 M y = 27,8x + 469,8
362 = 27,8x + 469,8 -107,8 = 27,8x x = Log C = -3,87
C = [glukosa] = 1,32x10-4 %akurasi = ଵǡଷଶ୶ଵିସ
ଵିସ x 100%
y1 = -8415x2 -118213x -409281 Persamaan garis linier (y2) y2 = 27,8x + 469,8
Limit deteksi dihitung dengan cara y1 = y2
-8415x2 -118213x -409281 = 27,8x + 469,8 -8415x2 – 118240,8x – 409750,8 = 0
x = -b 4
2
bb ac a
r
x = -6,209