TINJAUAN PUSTAKA
Arti Penting Penyakit Antraknosa pada Buah Avokad
Antraknosa adalah penyakit utama pascapanen yang disebabkan oleh C. gloeosporioides yang menyerang buah-buahan di daerah tropis dan sub tropis (Capdeville 2007), salah satunya adalah buah avokad (Nelson 2008). Penyakit ini menyerang semua bagian tanaman, kecuali akar. Bagian yang terinfeksi berwarna cokelat karat, kemudian daun, bunga, buah/cabang tanaman yang terserang akan gugur (Rukmana 1997).
Colletotrichum sp. adalah penyebab penyakit antraknosa dan memainkan peranan penting pada ekonomi subsistem pertanian di seluruh dunia. Patogen ini menginfeksi sejumlah tanaman mulai dari monokotil hingga tanaman dikotil. Meskipun infeksi antraknosa dapat terjadi pada semua stadia tanaman, namun stadia yang harus diwaspadai adalah terjadinya infeksi pada berbagai macam buah-buahan pascapanen (Dickman 1993).
C. gloeosporioides merupakan bentuk anamorf dari Glomerella cingulata, sedangkan G. cingulata merupakan bentuk teleomorf dari cendawan patogen ini (CAB Internasional 2007). Patogen dapat menginfeksi buah dan batang avokad, mempunyai kisaran inang yang luas, merupakan patogen parasit fakultatif, mampu hidup sebagai saprofit pada bagian tanaman yang mati dan sisa-sisa tanaman sakit dan mengkolonisasi bagian tanaman avokad yang telah mati yang terkumpul di bawah tajuk tanaman atau berada di permukaan tanah. Cendawan dapat menyebabkan beberapa masalah selama musim buah (Nelson 2008).
C. gloeosporioides menyerang avokad yang belum matang di kebun buah. Spora yang berkecambah membentuk apresorium dan menembus kutikula tetapi hifa yang telah mencapai subkutikula menjadi quiescent dan tidak berkembang sampai buah dipanen dan matang. Perubahan fisiologi yang signifikan terjadi pada buah yang dapat mengaktivasi patogen quiescent. Terdapat empat dugaan yang dapat menjelaskan mengapa buah yang belum matang lebih tahan terhadap serangan patogen: (i) kurangnya nutrisi yang diperlukan oleh patogen, (ii) adanya komponen anti cendawan, (iii) adanya induksi komponen anti cendawan, dan (iv) kurangnya faktor yang mengaktivasi patogenesitas cendawan . Ketahanan avokad
yang belum matang terhadap serangan C. gloeosporioides berkaitan dengan adanya komponen anti cendawan 1-acetoxy-2-hydroxy-4-oxoheneicosa-12,15-diene (1-acetoxy-2-hydroxy-4-oxoheneicosa-12,15-diene) pada perikarp buah yang belum matang (Beno-Moualem & Prusky 2000).
Gejala Penyakit Antraknosa pada Buah Avokad
Gejala serangan penyakit antraknosa dapat muncul di seluruh bagian tanaman yang terserang. Gejala serangan pada daun adalah terjadinya bercak coklat sampai ungu dan daun cepat rontok. Gejala pada cabang dan ranting adalah terjadinya kematian ujung ranting (die back), sedangkan pada bunga adalah terjadinya perubahan warna bunga menjadi cokelat tua dan mudah rontok/berguguran (Rukmana 1997).
Gambar 1 Gejala penyakit antraknosa pada buah avokad: gejala awal (a dan b), gejala di penyimpanan (c)
Serangan cendawan C. gloeosporioides pada buah menimbulkan gejala Bercak berwarna gelap, cekung, berbentuk bulat pada kulit buah (Gambar 1) yang meluas secara cepat dan menjadi lunak, menyebabkan pembusukan (Nelson 2008). Warna gelap/coklat akibat serangan C. gloeosporioides muncul karena cendawan tersebut menghasilkan enzim selulase yang dapat menghidrolisis selulosa kulit buah sehingga kulit buah terdisintegrasi dan lunak sehingga berubah warna menjadi coklat yang dapat meluas dan akhirnya membusuk. Proses pembusukan semakin cepat ketika buah mencapai kematangan puncak (Kotzé 1978; Ippolito & Nigro 2000)
Ciri khas dari penyakit ini adalah terbentuknya massa spora lengket. Bercak memiliki ukuran yang bervariasi dan dapat terjadi di setiap bagian buah avokad yang dapat berkembang dan berwarna salmon. Gejala dapat muncul secara cepat selama 1 atau 2 hari terutama dalam kondisi penyimpanan hangat dan lembab. Bercak berbentuk bulat, berwarna gelap ini biasanya muncul dalam infeksi laten pada kulit buah setelah panen dan pematangan buah. Ukuran diameter Bercak bervariasi tergantung kultivar avokad dan berkisar antara millimeter sampai sentimeter (Nelson 2008).
Antraknosa dapat berkembang pada buah yang belum matang di pohon, menyertai luka yang disebabkan oleh serangga. Buah biasanya rontok karena serangan patogen sebelum pematangan buah. Gejala bercak pada cabai juga dapat terjadi pada avokad (CAB Internasional 2007).
Morfologi dan Daur Penyakit
Cendawan C. gloeosporioides mempunyai miselium berwarna putih hingga keabu-abuan, memiliki konidia yang berbentuk oval dengan ujung tumpul atau membulat, hialin, bersel satu, tidak bersekat, terbentuk dalam aservulus, dan berukuran 9–15 x 3–7 µm. Massa konidia berwarna merah muda seperti warna salmon (Gambar 2) (Rubert 1992; Dickman 1993; Semangun 2000). Konidiofor berukuran 18 x 3 µm, berbentuk silinder, hialin atau agak kecoklatan. Aservulus dangkal dengan diameter 90–270 µm, memiliki seta dengan konidiofor yang sederhana, pendek, dan tegak (Gambar 3). Colletorichum mempunyai stroma yang terdiri dari massa miselium yang membentuk aservulus (seperti bantalan), bersepta dengan panjang antara 30–90 µm (Bailey & Jeger 1992). Aservulus berlilin dan hanya dihasilkan dalam jaringan yang terinfeksi. Seta berwarna coklat tua, panjang 60–160 µm, sering bersekat 1 atau 2 dan teratur di tepi aservulus (Semangun 2000).
Gambar 2 Massa konidia (a) dan miselium (b) C. gloeosporioides pada media PDA (perbesaran 10 x 40)
Gambar 3 Tubuh buah C. gloeosporioides di bawah mikroskop : aservulus (a), seta (b), konidia (c) dan miselium (d) pada perbesaran 10 x 40
C. gloeosporioides merupakan cendawan yang umum terdapat di berbagai tanaman. Cendawan ini merupakan parasit lemah yang dapat menginfeksi dan berkembang pada jaringan yang telah menjadi lemah, khususnya karena proses penuaan. Cendawan ini dapat menginfeksi melalui luka atau lentisel. Konidium jamur dipencarkan oleh angin dan air hujan. Infeksi buah banyak terjadi dari konidium yang berasal dari bercak pada daun dan tangkai daun. Pada cuaca menguntungkan, cendawan membentuk konidium. Konidium dipencarkan oleh
a b
percikan air hujan dan siraman karena terbentuk dalam massa spora yang lengket (CAB International 2007).
Cendawan dapat diisolasi dari jaringan tanaman tropis yang tampak sehat dan berada baik di permukaan mikroflora maupun sebagai endofit (Gambar 4). Patogen ini menimbulkan serangan berat pada kondisi kelembaban dan suhu yang tinggi. Cendawan dapat tumbuhan pada suhu rendah 4 0C, tetapi optimum pada suhu 25–29 °C. Perkecambahan spora, infeksi dan produksi askospora memerlukan kelembaban relatif mendekati 100%, namun ekspresi penyakit akan muncul pada kondisi kering karena infeksi laten atau quiescent akan aktif pada jaringan yang rusak (CAB Internasional 2007).
Gambar 4 C. gloeosporioides pada media PDA : biakan murni (a), konidia (berwarna kuning/oranye) dan miselium (berwarna putih) (b)
Kondisi iklim yang sesuai pada saat terjadinya infeksi sangat menentukan terjadinya epidemi penyakit. Penyakit antraknosa ini dapat menimbulkan kehilangan yang signifikan pada iklim hangat dan lembab (CAB Internasional 2007). Spora hanya dapat berkecambah bila ada air bebas, atau bila kelembaban nisbi udara tidak kurang dari 95%. Infeksi tidak akan terjadi bila kelembaban udara tidak kurang dari 96%. Spora tumbuh paling baik pada suhu 25–28 oC, sedang dibawah 5 oC dan di atas 40 oC spora tidak dapat berkecambah. Bailey dan Jeger (1992) menyatakan bahwa infeksi cendawan pada percobaan di rumah kaca dan laboratorium terjadi pada kelembaban lebih dari 96% pada suhu 26–31 oC (Semangun 2000).
b a
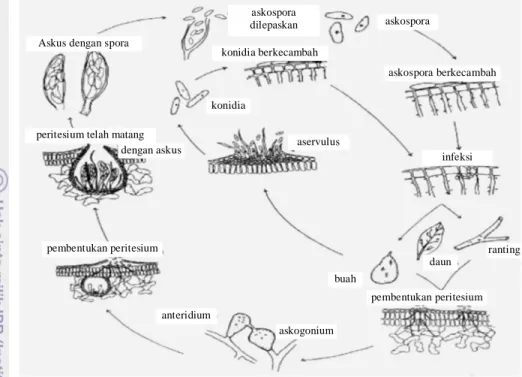
Gambar 5 Siklus hidup C. gloeosporioides pada avokad (Kotzé 1978) Patogen bertahan di dalam biji, sampah, dan gulma inang, dan dipencarkan melalui percikan air, aliran air, serangga atau benda lain yang menyentuh cendawan. C. gloeosporioides menyebabkan penyakit pada bagian daun, bunga dan buah (Gambar 5). Pada jaringan tua, perkembangan penyakit lebih lambat, seringkali quiescent atau tinggal sebagai cendawan endofit yang tidak berbahaya hingga kondisi fisiologi memungkinkan untuk perkembangan cendawan (Rukmana 1997).
Pengendalian Penyakit Pascapanen
Pembusukan buah-buahan dan sayuran pascapanen berasal dari infeksi yang terjadi baik antara pembungaan dan pematangan buah, atau selama penanganan panen, dan penyimpanan (Droby 2006). Infeksi dapat terjadi sebelum panen (preharvest) dan tetap bertahan sampai buah menjadi tua sampai pascapanen dan selama penyimpanan. Namun, sebagian besar infeksi terjadi melalui luka yang ditimbulkan permukaan komoditas pada saat panen, pascapanen dan pada penanganan selanjutnya. Kerugian akibat infeksi ini dapat ditangani dengan
askospora askospora berkecambah infeksi daun ranting buah aservulus konidia konidia berkecambah askospora dilepaskan Askus dengan spora
peritesium telah matang dengan askus
pembentukan peritesium
anteridium
askogonium
menggunakan fungisida yang diaplikasikan di lapangan atau setelah panen (Droby 2006).
Selama dekade terakhir, pengendalian penyakit komoditas hortikultura semakin sulit dilakukan (Bautista-Bañosa et al. 2006). Fungisida sintetik adalah bahan utama yang digunakan untuk mengendalikan pembusukan pascapanen (Sharma et al. 2009). Residu pestisida pada buah-buahan dan sayuran menjadi perhatian utama konsumen dalam industri buah dan sayuran. Peningkatan kesehatan dan perhatian terhadap residu pestisida pada produk segar, perkembangan strain patogen yang tahan terhadap fungisida, dan pendaftaran kembali beberapa fungisida yang lebih efektif, telah mendorong pengembangan alternatif yang lebih aman terhadap kesehatan manusia dan lingkungan (Droby 2006).
Saat ini banyak dilakukan alternatif pengendalian yang lebih aman dan aman terhadap lingkungan dalam mengendalikan pembusukan pascapanen (Sharma et al. 2009). Salah satu teknik pengendalian pascapanen yang saat ini sedang dikembangkan adalah pengendalian hayati. Strategi umum pengendalian hayati adalah penggunaan mikroorganisme hidup untuk mengendalikan mikroorganisme yang lain (Druvefors 2004). Penggunaan agen pengendali hayati perlu mempertimbangkan keamanan pangan dan penerimaan masyarakat terhadap agens pengendali hayati. Salah satu agen hayati yang digunakan untuk pengendalian penyakit pascapanen adalah khamir dan pelapis produk untuk memperpanjang masa simpan buah. Pelapis digunakan untuk memperpanjang masa simpan produk segar dan melindungi kerusakan buah dari pengaruh lingkungan yang tidak menguntungkan, misalnya serangan mikroorganisme (Sugipriatini 2009).
Penggunaan Khamir untuk Pengendalian Hayati Penyakit
Pada awal tahun 1990, berbagai mikrob antagonis dilaporkan dapat digunakan untuk mengendalikan berbagai patogen pada beberapa buah. Salah satu mikrob antagonis tersebut adalah khamir (Druvefors 2004). Khamir merupakan kelompok mikroorganisme uniseluler termasuk dalam filum Ascomycota dan Basidiomycota. Beberapa khamir dan mikroorganisme lain telah
dilaporkan dapat menghambat patogen tanaman, khususnya patogen yang berada di dalam buah dan sayuran, serta beberapa produk komersial (Janisiewicz & Korsten, 2002). Jones dan Prusky (2002) melaporkan bahwa beberapa khamir antagonis juga telah dilaporkan efektif untuk menghambat patogen pascapanen pada beberapa buah-buahan dan dapat digunakan sebagai agens pengendali hayati cendawan pascapanen penyebab busuk pada buah apel, grey dan blue mold yang disebabkan oleh Botrytis cinerea dan Penicillium italicum, dan pada buah jeruk (McLaughlin et al. 1990). Secara khusus, kehadiran khamir secara alami pada buah-buahan dan sayuran berpotensi sebagai antagonis penyakit pascapanen (Droby 2006). Khamir (Pichia guilliermondii strain US-7 dan Hanseniaspora uvarum strain 138) diketahui dapat digunakan untuk mengendalikan berbagai patogen penyebab pembusukan pada jeruk, buah pome, dan tomat (Chalutz & Wilson, 1990). Debaromyces hansenii dilaporkan dapat mengendalikan busuk buah jeruk pascapanen (Wisniewski et al. 1991) dan beberapa spesies Cryptococcus sp. dapat digunakan untuk mengendalikan pembusukan pascapanen pada buah apel dan pir (Roberts 1990). Keberadaan mikrob antagonis baik secara alami maupun buatan dapat dipertimbangkan sebagai alternatif penggunaan fungisida untuk mengendalikan penyakit pascapanen (Wisniewski & Wilson 1992). Keuntungan dari penggunaan khamir antagonis, dapat diisolasi dari alam, bersifat non patogenik terhadap tanaman dan binatang termasuk manusia, mudah dibiakkan, dan reproduksinya cepat (Payne & Bruce 2001). Khamir juga memiliki banyak kegunaan, biasanya tidak menghasilkan spora alergik atau mikotoksin seperti cendawan miselial. Sel khamir juga mengandung vitamin, mineral, dan asam amino penting yang telah dimanfaatkan dalam makanan dan pakan (Hashem & Alamri 2009).
Mekanisme agens pengendali hayati dalam mengendalikan patogen taget belum banyak diketahui (Janisiewicz & Korsten 2002). Khamir Debaryomyces sp. efektif menghambat perkembangan penyakit antraknosa yang disebabkan oleh C. gloeosporioides. Debaryomyces sp. kerusakan hifa dan konidia patogen C. gloeosporioides. Penghambatan patogen C. gloeosporioides oleh Debaryomyces sp. terjadi melalui mekanisme kompetisi dan parasitisme (Indratmi 2008). Kompetisi nutrisi diduga sebagai mode of action beberapa agens pengendali
hayati, seperti P. guilliermondii dalam mengendalikan Penicillium digitatum (Droby et al. 1989), Candida guilliermondii, Cryptococcus laurentii dan Metschnikowia pulcherima dalam mengendalikan Botrytis cinerea dan Penicillium expansum (Vero et al. 2002).
Penggunaan khamir menunda pemasakan buah saat penyimpanan. Konsentrasi suspensi khamir yang digunakan di laboratorium umumnya 107 cfu/ml. Suspensi sel khamir pada konsentrasi 106 sampai 107 cfu/ml efektif menghambat perkembangan penyakit (Droby et al. 1997).
Strain tertentu dari khamir Saccharomyces cerevisiae dilaporkan dapat memproduksi toksin yang dapat membunuh strain lain dalam spesies yang sama. Beberapa toksin yang dihasilkan oleh khamir juga dilaporkan memiliki pengaruh terhadap spesies khamir lain termasuk bakteri dan cendawan (Izgu & Altinbay 1997). Droby et al. (1991) membuktikan bahwa P. guilliermondii dapat menstimulasi produksi etilen pada anggur. Etilen pada jeruk dapat menstimulasi produksi fitoaleksin (Rodov et al. 1994). Aureobasidium pullulans dan Candida saitoana diketahui dapat menginduksi ß-1,3-glukanase, kitinase dan peroksidase pada apel (Ippolito et al. 2000). Hal ini dapat menstimulasi mekanisme pertahanan suatu tanaman (Druvefors 2004).
Saat ini terdapat tiga khamir yang dikomersialkan sebagai produk pengendali hayati dan telah dipasarkan untuk mengendalikan pembusukan pada buah. Aspire® (Ecogen, Inc., Langhorne, Pa) dengan bahan dasar khamir Candida oleophila digunakan untuk mengendalikan penyakit pascapanen pada buah pome serta jeruk dengan cara penyemprotan atau pencelupan (Janisiewicz & Korsten 2002), dan telah digunakan di Amerika Serikat pada tahun 1996. Produk komersial Yield Plus® dengan Cryptococcus albidus sebagai bahan aktifnya dipasarkan di Afrika Selatan pada tahun 1997 dan digunakan untuk pengendalian hayati Botrytis sp., Penicillium sp. dan Mucor sp. pada buah apel dan pir dan masih diteliti kemungkinannya untuk digunakan pada komoditas lain. Produk terbaru Shemer® yang diregistrasi di Israel dengan bahan dasar khamir Metschnikowia fructicola (Kurtzman & Droby 2001) diketahui efektif mengendalikan patogen pada anggur, stroberi dan ubi jalar (Druvefors 2004).