TINJAUAN PUSTAKA
Zeolit
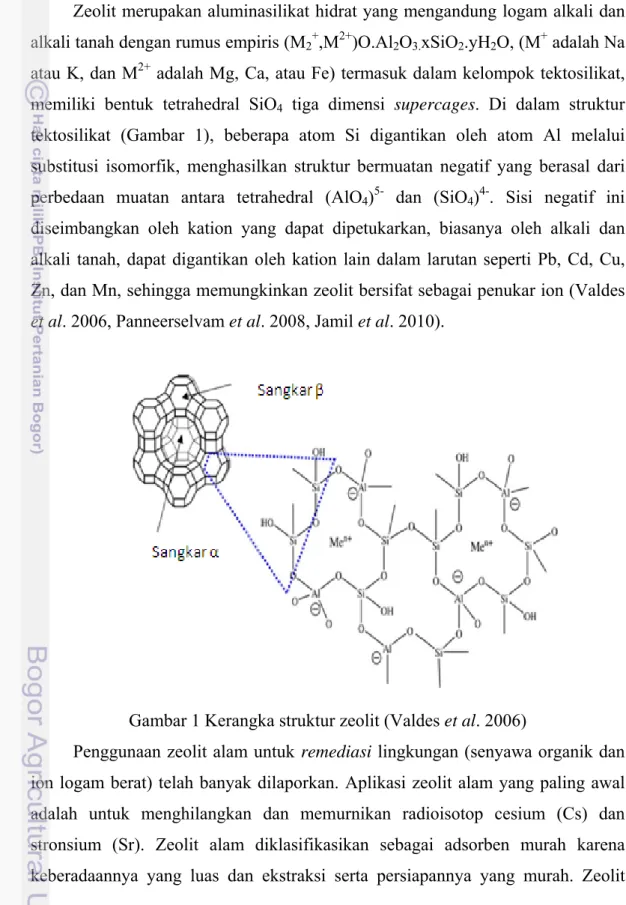
Zeolit merupakan aluminasilikat hidrat yang mengandung logam alkali dan alkali tanah dengan rumus empiris (M2+,M2+)O.Al2O3.xSiO2.yH2O, (M+ adalah Na atau K, dan M2+ adalah Mg, Ca, atau Fe) termasuk dalam kelompok tektosilikat, memiliki bentuk tetrahedral SiO4 tiga dimensi supercages. Di dalam struktur tektosilikat (Gambar 1), beberapa atom Si digantikan oleh atom Al melalui substitusi isomorfik, menghasilkan struktur bermuatan negatif yang berasal dari perbedaan muatan antara tetrahedral (AlO4)5- dan (SiO4)4-. Sisi negatif ini diseimbangkan oleh kation yang dapat dipetukarkan, biasanya oleh alkali dan alkali tanah, dapat digantikan oleh kation lain dalam larutan seperti Pb, Cd, Cu, Zn, dan Mn, sehingga memungkinkan zeolit bersifat sebagai penukar ion (Valdes
et al. 2006, Panneerselvam et al. 2008, Jamil et al. 2010).
Gambar 1 Kerangka struktur zeolit (Valdes et al. 2006)
Penggunaan zeolit alam untuk remediasi lingkungan (senyawa organik dan ion logam berat) telah banyak dilaporkan. Aplikasi zeolit alam yang paling awal adalah untuk menghilangkan dan memurnikan radioisotop cesium (Cs) dan stronsium (Sr). Zeolit alam diklasifikasikan sebagai adsorben murah karena keberadaannya yang luas dan ekstraksi serta persiapannya yang murah. Zeolit
6
alam juga memberikan ketertarikan yang tersendiri bagi kalangan ilmuwan, terutama karena sifatnya seperti kemampuan pertukaran ion dan luas permukaan yang tinggi. Zeolit menawarkan potensi untuk berbagai kegunaan seperti penyaring molekul, penukar ion, adsorben, katalis, bahan pengisi deterjen, penghilang kation dari sumber pembuangan asam dan air limbah industri. Zeolit memiliki afinitas yang kuat untuk ion logam berat (Jamil et al. 2010).
Menurut Wang & Peng (2010) zeolit mempunyai kemampuan penukar ion dengan medium eksternal, yang merupakan karakteristik zeolit. Pada umumnya reaksi pertukaran ion antara larutan yang mengandung kation AzA+ dan bentuk B zeolit (B merupakan kation dengan valensi zB) dituliskan dalam persamaan reaksi berikut:
L adalah bagian dari unit kerangka zeolit yang bermuatan negatif. Sifat pertukaran ion zeolit alam tergantung pada beberapa faktor, termasuk struktur rangka, ukuran dan bentuk ion, kerapatan muatan dari kerangka anionik, muatan ion dan konsentrasi larutan elektolit luar. Karena kondisi pembentukannya zeolit alam mempunyai komposisi kimia dan kapasitas tukar kation yang berbeda-beda.
Dalam penelitian ini digunakan zeolit alam asal Lampung dan asal Cikembar, Sukabumi. Menurut Las (2005) zeolit Lampung kemurnian dan sifat penukar ionnya lebih baik dari zeolit Tasikmalaya dan Sukabumi. Rohaeti (2007) telah melakukan karakterisasi zeolit Lampung dan Sukabumi dengan hasil tertera pada Tabel 1 dan Tabel 2.
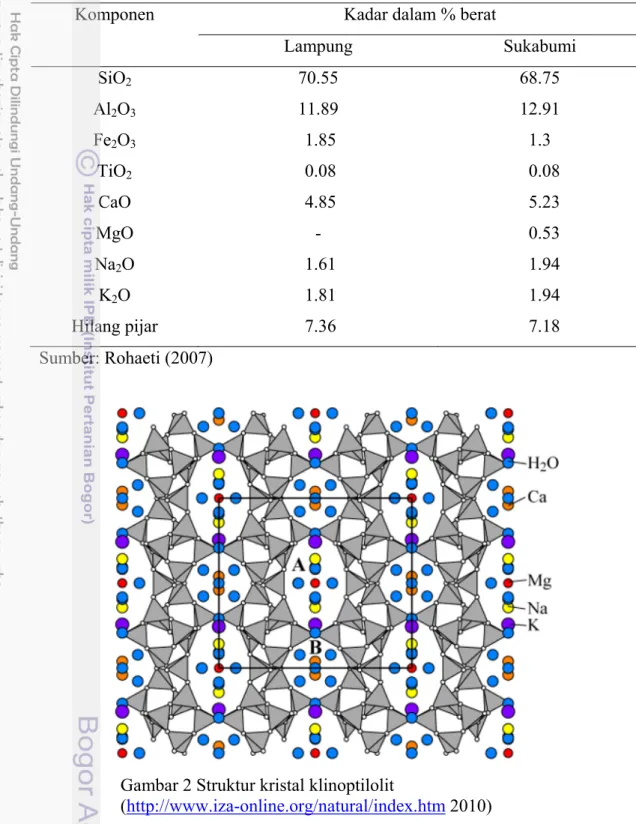
Klinoptilolit dan mordenit adalah aluminium silikat dengan kandungan silika tinggi. Struktur kristal klinoptilolit memiliki rongga 2-dimensi, yang dibentuk oleh lapisan tetrahedral. Rongga A (tersusun dari 10-unit cincin, diameter 0,44 x 0,72 nm) dan rongga B (tersusun dari 8-unit cincin, diameter 0,41 x 0,47 nm) yang sejajar satu sama lain, sementara rongga C (tersusun dari 8-unit cincin, diameter 0,40 x 0,55 nm) merupakan perpotongan rongga A dan B. Pengutuban dari 8 dan 10-unit cincin membentuk sistem saluran non polar (Korkuna et al. 2006). Menurut Ghiara et al. (1999), secara konvensional, komposisi batas klinoptilolit adalah Si/A1> 4.0 dan (Na + K)> (Ca + Sr + Ba).
7 Struktur Klinoptilolit tidak hancur setelah pemanasan selama 12 jam pada suhu 750°C. Namun, struktur Klinoptilolit yang mengandung kapur akan hancur antara suhu 450-550°C.
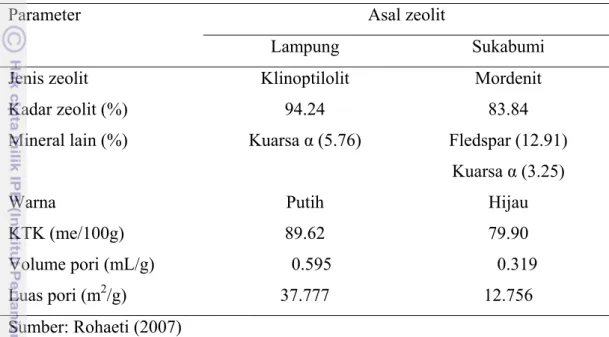
Tabel 1 Hasil Karakterisasi zeolit Lampung dan Sukabumi
Parameter Asal zeolit
Lampung Sukabumi Jenis zeolit Kadar zeolit (%) Mineral lain (%) Warna KTK (me/100g) Volume pori (mL/g) Luas pori (m2/g) Klinoptilolit 94.24 Kuarsa α (5.76) Putih 89.62 0.595 37.777 Mordenit 83.84 Fledspar (12.91) Kuarsa α (3.25) Hijau 79.90 0.319 12.756 Sumber: Rohaeti (2007)
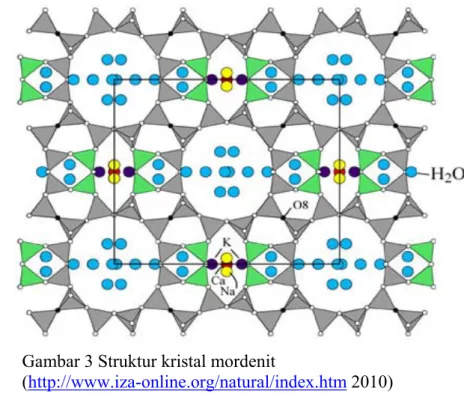
Struktur kristal mordenit lebih rumit dibandingkan klinoptilolit. Mordenit terdiri dari dua jenis rongga pori yang berbeda jenisnya dan sistem kosong. Rongga A dibentuk oleh himpunan 12-unit cincin, yang masing-masing memiliki 12 atom oksigen. Rongga B terbentuk dari 8-unit cincin di mana masing-masing memiliki 8 atom oksigen. Rongga A berbentuk elips, dengan diameter 0,65 x 0,70 nm, sedangkan diameter 8-unit cincin adalah 0,26 x 0,57 nm. Rongga A dan B saling berhubungan tegak lurus melalui rongga tabung B, dalam bentuk kantong kecil (Korkuna et al. 2006). Mordenit sering bersamaan dengan klinoptilolit, menunjukkan kondisi yang sama dalam pembentukan. Mordenit menunjukkan rasio Si/A1 berkisar 4.2-5.9, memiliki Ca 1.6-2.5, Na 2.0-5.0, dan K 0.1-0.8 atom per satuan sel. Rasio Si/A1 sangat tinggi dalam mordenit menghasilkan stabilitas termal yang tinggi. Struktur rangka menunjukkan sedikit perubahan akibat dari dehidrasi, dan mineral yang stabil sampai 900 C° (Ghiara et al. 1999). Gambar 2 dan 3, berturut-turut menunjukkan struktur kristal klinoptilolit dan mordenit.
8
Tabel 2 Komponen kimia zeolit Lampung dan Sukabumi
Komponen Kadar dalam % berat
Lampung Sukabumi SiO2 Al2O3 Fe2O3 TiO2 CaO MgO Na2O K2O Hilang pijar 70.55 11.89 1.85 0.08 4.85 - 1.61 1.81 7.36 68.75 12.91 1.3 0.08 5.23 0.53 1.94 1.94 7.18 Sumber: Rohaeti (2007)
Gambar 2 Struktur kristal klinoptilolit
9
Berbagai metode dikembangkan untuk meningkatkan selektivitas dan daya adsorpsi zeolit alam maupun sintetik. Salah satu cara yang sedang berkembang adalah dengan modifikasi permukaan zeolit. Modifikasi dapat dilakukan dengan memberikan perlakuan kimia seperti direaksikan dengan asam. Memodifikasi adsorben dengan asam paling umum dan terbukti efektif dalam meningkatkan kapasitas dan efisiensi adsorben. Selama proses perlakuan dengan asam, ion H+ akan menggantikan kation-kation yang tidak terikat secara kuat di dalam kerangka zeolit dan mengatur kembali letak atom yang dapat dipertukarkan. Modifikasi asam menyebabkan terjadinya dekationisasi yang menyebabkan bertambahnya luas permukaan zeolit karena berkurangnya pengotor yang menutupi pori-pori zeolit. Luas permukaan yang bertambah diharapkan meningkatkan kemampuan zeolit dalam proses adsorpsi (Tarlan-Yel & Onen 2010; Wang et al. 2010; Pentrak
et al. 2009).
Tarlan-Yel & Onen (2010) memodifikasi zeolit alam dengan asam nitrat untuk menghilangkan sianida bebas dan kompleks Cu-sianida dengan kapasitas adsorpsi mencapai 96%. Zeolit P termodifikasi asam hidroksamik digunakan oleh Haron et al. (2009) untuk menjerap Cu dalam larutan. Penjerapan Cu(II) mengikuti model isoterm Langmuir dengan kapasitas maksimum 33.32 mg/g pada suhu 25°C dan meningkat 48.12 mg/g pada suhu 70°C. Modifikasi zeolit alam
Gambar 3 Struktur kristal mordenit
10
jenis klinoptilolit dengan HCl untuk menyerap ion logam berat (Pb2+, Cu2+, Ni2+, dan Cd2+) dalam larutan telah diteliti oleh Sprynskyy et al. (2006). Panneerselvam
et al. 2008 memodifikasi zeolit Y dengan asam fosfat sebagai adsorben Cu dalam
larutan, dan kapasitas adsorpsi meningkat sekitar 67% dibandingkan zeolit alam tanpa modifikasi.
Timbal
Logam timbal (Pb) merupakan logam yang sangat populer dan banyak dikenal oleh masyarakat awam. Hal ini disebabkan oleh banyaknya Pb yang digunakan di industri nonpangan dan paling banyak menimbulkan keracunan pada makhluk hidup. Pb adalah sejenis logam yang lunak dan berwarna cokelat kehitaman, serta mudah dimurnikan dari pertambangan. Dalam pertambangan, logam ini berbentuk sulfida logam (PbS), yang sering disebut galena. Senyawa ini banyak ditemukan dalam pertambangan di seluruh dunia. Bahaya yang ditimbulkan oleh penggunaan Pb ini adalah sering menyebabkan keracunan (Astawan 2008).
Kadar Pb yang secara alami dapat ditemukan dalam bebatuan sekitar 13 mg/kg. Khusus Pb yang tercampur dengan batu fosfat dan terdapat didalam batu pasir kadarnya lebih besar yaitu 100 mg/kg. Pb yang terdapat di tanah berkadar sekitar 5-25 mg/kg dan di air bawah tanah berkisar antara 1-60 µg/L. Secara alami Pb juga ditemukan di air permukaan. Kadar Pb pada air telaga dan air sungai adalah sebesar 1-10 µg/liter. Dalam air laut kadar Pb lebih rendah dari dalam air tawar. Laut yang dikatakan terbebas dari pencemaran mengandung Pb sekitar 0,07 µg/L. Secara alami Pb juga ditemukan di udara yang kadarnya berkisar antara 0.0001- 0.001 µg/m3 (Sudarmaji 2006).
Logam Pb dapat masuk ke dalam tubuh melalui pernapasan, makanan, dan minuman (Astawan 2008). Logam Pb tidak dibutuhkan oleh manusia, sehingga bila makanan tercemar oleh logam tersebut, tubuh akan mengeluarkannya sebagian. Sisanya akan terakumulasi pada bagian tubuh tertentu seperti ginjal, hati, kuku, jaringan lemak, dan rambut. Pb dapat mempengaruhi sistem saraf, inteligensia, dan pertumbuhan. Pb di dalam tubuh terikat pada gugus SH dalam molekul protein dan hal ini menyebabkan hambatan pada aktivitas kerja sistem
11 enzim. Efek logam Pb pada kesehatan manusia adalah menimbulkan kerusakan otak, kejang-kejang, gangguan tingkah laku, dan bahkan kematian.
Timbal merupakan logam penting dari sudut pandang toksikologi lingkungan, logam ini sampai ke udara dan air dari banyak sumber seperti peleburan timah, produsen baterai, industri kertas dan pulp, bahan bakar perahu dan kapal, amunisi industri, dan lain-lain. Efek toksisitas timbal seperti pada sistem saraf, sistem sirkulasi darah, sistem kardiovaskular, organ vital seperti otak dan ginjal, serta mengganggu pengembangan IQ dan lain-lain telah banyak dilaporkan (Gupta & Bhattacharyya, 2008). Konsentrasi ion Pb mencapai 200-500 mg/L dalam limbah cair industri, nilai tersebut sangat tinggi untuk standar kualitas air dan harus dikurangi sampai 0.1-0.05 mg/L (Ghassabzadeh et al. 2010).
Isoterm adsorpsi
Isoterm adsorpsi menyatakan hubungan spesifik antara konsentrasi sorbent (fasa teradsorpsi) dan terdistribusinya pada permukaan adsorben pada suhu konstan. Kesetimbangan adsorpsi biasanya digambarkan dengan persamaan isoterm, di mana parameter-parameternya menunjukkan sifat permukaan dan afinitas dari adsorben. Beberapa penelitian dilakukan untuk menyelidiki isoterm adsorpsi antara ion logam pada pH optimum, jumlah adsorben dan waktu kontak dengan mengubah konsentrasi ion awal dalam larutan dalam rentang 5-50 mg/L (Gupta & Bhattacharyya, 2008; Ghassabzadeh et al. 2010). Terdapat beberapa jenis persamaan isoterm adsorpsi. Tipe isoterm adsorpsi yang sering digunakan secara luas adalah (Subramanyam & Das, 2009):
(a) Isoterm Langmuir
Isoterm adsorpsi Langmuir didasarkan atas asumsi, (1) adsorpsi hanya terjadi pada lapisan tunggal (monolayer), (2) panas adsorpsi tidak tergantung pada penutupan permukaan, (3) semua bagian dan permukaannya bersifat homogen, dan (4) sejumlah tertentu tapak aktif adsorben yang membentuk ikatan kovalen atau ion. Persamaan isoterm adsorpsi Langmuir dapat diturunkan secara teoritis dengan menganggap terjadinya kesetimbangan antara molekul-molekul yang diadsorpsi pada permukaan adsorben dangan molekul-molekul yang tidak
12
teradsorpsi. Persamaan isoterm adsorpsi Langmuir dapat dituliskan sebagai berikut (Gupta & Bhattacharyya, 2008; Ghassabzadeh et al. 2010):
= (1) dengan qe = jumlah adsorbat yang teradsorpsi per unit bobot adsorben pada kesetimbangan (mg/g), qm = kapasitas adsorpsi maksimum (mg/g), Ce = konsentrasi kesetimbangan adsorbat dalam larutan (mg/L), b = konstanta yang berhubungan dengan energi bebas adsorpsi (L/mg).
(b) Isoterm Freundlich
Persamaan isoterm adsorpsi Freundlich didasarkan pada asumsi, (1) terbentuknya adsorpsi beberapa lapisan (multilayer) dari molekul-molekul adsorbat pada adsorben, (2) bagian tapak aktif pada permukaan adsorben bersifat heterogen, dan (3) hanya melibatkan gaya Van der Waals sehingga adsorbat dapat bergerak dari satu bagian permukaan ke bagian permukaan lain dari adsorben. Persamaan isoterm adsorpsi Freundlich dapat dituliskan sebagai berikut (Gupta & Bhattacharyya, 2008; Ghassabzadeh et al. 2010):
= (2) dengan KF = konstanta, yang menggambarkan kapasitas adsorpsi relatif dari adsorben ((mgg-1)(mgl-1)n), n = konstanta yang menggambarkan intensitas adsorpsi. Gambar persamaan linear Langmuir dan Freundlich diperoleh dengan memplot berturut-turut Ce/qe vs Ce dan log qe vs log Ce, dan dengan persamaan tersebut koefisien dapat dicari.
Persamaan Langmuir juga digunakan untuk memperoleh nilai RL, yang menggambarkan dimensi parameter kesetimbangan atau faktor pemisahan dengan persamaan (Ghassabzadeh et al. 2010):
= (3) berdasarkan nilai R, bentuk isoterm dapat ditafsirkan sebagai R>1 menggambarkan adsorpsi yang kurang baik, R = 1 adsorpsi linear, 0<R<1 adsorpsi yang baik, R = 0 adsorpsi irreversible. Dalam persamaan Freudlich, nilai n dalam rentang 1-10 menggambarkan adsorpsi yang baik (Fan et al. 2008)
13 Kinetika Adsorpsi
Untuk menentukan orde kinetika adsorpsi biasanya digunakan persamaan model kinetika orde pertama semu dan orde kedua semu. Persamaan Lagergren, pertama diterapkan dengan asumsi kinetika orde pertama semu, di mana jumlah ion logam melebihi jumlah tempat adsorpsi di permukaan adsorben. Nilai konstanta rata-rata orde pertama, k1, diperoleh dari persamaan berikut (Mohan et
al. 2006; Fan et al. 2008; Gupta & Bhattacharyya, 2011) :
= ( − ) (4) Integrasi persamaan (4) dari qt = 0 pada t = 0 adalah:
= − (5) atau ( − ) = − (bentuk linear) (6)
= (1 − ) (bentuk non linear) (7) di mana nilai k1 dapat ditentukan dari slope grafik log (qe – qt) versus t. Jika validitasnya rendah, kinetika adsorpsi dapat dicoba untuk mekanisme orde dua semu dengan persamaan (Mohan et al. 2006; Fan et al. 2008; Gupta & Bhattacharyya, 2008):
= ( − ) (8) dengan k2 adalah konstanta rata-rata orde kedua. Bentuk integrasi dari persamaan (8) adalah:
= + (9) nilai k2 dapat ditentukan dengan memplot grafik t/qt versus t.
Parameter termodinamika
Dalam praktek teknik faktor entropi dan energi bebas Gibbs harus dipertimbangkan untuk menentukan apakah proses akan terjadi secara spontan. Parameter termodinamika seperti perubahan entalpi (ΔH°), energi bebas Gibbs (ΔG°) dan perubahan entropi (ΔS°) dapat diperkirakan dengan menggunakan konstanta kesetimbangan dengan perubahan suhu. Nilai-nilai perubahan energi bebas Gibbs standar untuk proses adsorpsi dievaluasi dengan menggunakan nilai yang diperoleh dari Kd model Langmuir pada suhu yang berbeda. Konstanta kesetimbangan dapat diekspresikan dalam perubahan entalpi adsorpsi dan suhu
14
sebagai berikut (Fan et al. 2008; Gupta & Bhattacharyya, 2008; Ghassabzadeh et
al. 2010):
∆ ° = − ln (10) ∆ ° = ∆ ° − ∆ ° (11) = ∆ °−∆ ° (12) dengan Kd adalah konstanta kesetimbangan (= qe/Ce), T = suhu absolut (K), R = konstanta gas = 8.314 x 10-3 kJ/K mol. Dengan memplot grafik ln Kd versus 1/T maka nilai ΔH°, ΔS° dan ΔG°dapat ditentukan.