OKSIDASI 1,2,3 –PROPANATRIOL DENGAN MOLEKUL OKSIGEN MENGGUNAKAN KATALIS Pd/γ-Al
2O
3DALAM
PELARUT AIR
SKRIPSI
HENNY THERESIA V 040802045
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS SUMATERA UTARA
MEDAN
2009
OKSIDASI 1,2,3 –PROPANATRIOL DENGAN MOLEKUL OKSIGEN MENGGUNAKAN KATALIS Pd/γ-Al
2O
3DALAM
PELARUT AIR
SKRIPSI
Diajukan untuk melengkapi tugas dan memenuhi syarat mencapai gelar Sarjana Sains
HENNY THERESIA VERANATA 040802045
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS SUMATERA UTARA
MEDAN
2009
PERSETUJUAN
Judul : OKSIDASI 1,2,3-PROPANATRIOL DENGAN
MOLEKUL OKSIGEN MENGGUNAKAN
KATALIS Pd/γAl2-O3 DALAM PELARUT AIR
Kategori : SKRIPSI
Nama : HENNY THERESIA VERANATA
Nomor Induk Mahasiswa : 040802011
Program Studi : SARJANA (S1) KIMIA
Departemen : KIMIA
Fakultas : MATEMATIKA DAN ILMU PENGETAHUAN
ALAM (FMIPA) UNIVERSITAS SUMATERA UTARA
Disetujui di Medan, Maret 2009
Komisi Pembimbing :
Pembimbing II, Pembimbing I,
Dra. Saur Lumban Raja, M.Si Andriayani,S.Pd, M.Si
NIP. 131.573.970 NIP. 132.240.153
Disetujui oleh
Departemen Kimia FMIPA USU Ketua,
Dr.Rumondang Bulan, MS NIP.131 459 466
PERNYATAAN
OKSIDASI 1,2,3-PROPANATRIOL DENGAN MOLEKUL OKSIGEN MENGGUNAKAN KATALIS Pd/γ-Al2O3
DALAM PELARUT AIR
SKRIPSI
Saya mengakui bahwa skripsi ini adalah hasil kerja saya sendiri, kecuali beberapa kutipan dan ringkasan yang masing-masing disebutkan sumbernya.
Medan, Maret 2009
HENNY THERESIA VERANATA 040802045
PENGHARGAAN
Puji dan syukur penulis panjatkan kepada Tuhan Yang Maha Esa atas berkat dan kasih setia-Nya, sehingga penulis dapat menyelesaikan penelitian dan penyusunan skripsi ini.
Dengan rasa hormat penulis mengucapkan terima kasih kepada ibu Andriayani,S.Pd,M.Si selaku pembimbing I serta ibu Dra.Saur Lumban Raja,M.Si selaku pembimbing II yang telah meluangkan waktunya selama melakukan penelitian dan penyusunan skripsi ini hingga selesai. Terima kasih kepada Ibu Dr.Rumondang Bulan,MS dan Bapak Drs.Firman Sebayang, MS selaku Ketua dan Sekretaris Departemen Kimia FMIPA-USU Medan dan seluruh Staff dan Dosen FMIPA-USU Medan yang telah membimbing penulis selama perkuliahan. Tidak lupa penulis mengucapkan terima kasih kepada asisten Laborotarium Kimia Anorganik : K’Lasma, K’Sepri, K’Dasma S.Si, B’Boy S.Si, B’Ariston S.Si, Julianto, Alexon, Catherine, Gulit, Elisa dan khususnya teman seperjuangan serta sahabatku dalam suka dan duka : Mangisi dan Rosida, terima kasih atas dukungan doa dan semangat yang selalu memacu penulis untuk menjadi lebih baik lagi . Sahabatku : Eve, dan Refanti, terima kasih buat dukungan dan semangatnya selama ini juga kepada sahabatku Briptu.Henry Pakpahan yang selalu ada untuk mendukung penulis dalam segala hal dan selalu mendukung penulis dalam doa. Penulis juga mengucapkan terima kasih kepada seluruh teman-teman Stambuk 2004 yang tidak dapat disebutkan satu per satu (kalian sudah seperti saudara bagiku) dan juga kepada Kel. Uda Tambunan dan Kel. Bapatua Purba yang selalu mendoakan penulis, juga seluruh keluarga besar, yang senantiasa memberikan dukungan dan semangat kepada penulis. Akhirnya, Penulis mengucapkan terima kasih yang tak terhingga kepada Bapak tercinta Parlin Horas Simare-mare, Mama tersayang Lindaria Siahaan serta adik-adikku terkasih (Alm.) Richi Arianto, Rony Hotman Gunawan dan Hany Devita yang selalu memberikan semangat dan dukungan doa kepada penulis ( kalian adalah anugerah terindah dan kekuatan terbesar yang pernah ku miliki dalam hidup ini ) . Penulis menyadari bahwa skripsi ini masih jauh dari sempurna karena keterbatasan penulis. Semoga Tuhan Yang Maha Esa selalu melimpahkan rahmat serta karuniaNya dan semoga skripsi ini dapat bermanfaat bagi penelitian dan kemajuan ilmu pengetahuan.
ABSTRAK
Telah dilakukan oksidasi terhadap 1,2,3-Propanatriol dengan menggunakan molekul oksigen yang dikatalisis oleh katalis heterogen Pd/γ-Al2O3 dalam pelarut air menghasilkan asam gliserat ( 32,62 % ). Asam gliserat yang terbentuk direaksikan dengan natrium hidroksida dalam pelarut metanol menghasilkan garam natrium gliserat ( 27 % ). Produk yang diperoleh dikarakterisasi dengan spektroskopi FT-IR dan 1H-NMR.
OXIDATION OF 1,2,3-PROPANETRIOL WITH MOLECULAR OXYGEN USING CATALYST Pd/γ-Al2O3 IN WATER SOLVENT
ABSTRACT
1,2,3-Propanetriol has been oxidized with molecular oxygen and catalysed by heterogeneous catalyst Pd/γ-Al2O3 in water solvent to produce glyceric acid ( 32,62
%w ). Glyceric acid was formed then reacted with sodium hydroxide in methanol to produce sodium glycerate ( 27% ). Product of reaction were characterized by FT-IR and 1H-NMR spectroscopy.
DAFTAR ISI
Halaman
Persetujuan ii
Pernyataan iii
Penghargaan iv
Abstrak v
Abstract vi
Daftar Isi vii
Daftar Gambar ix
Daftar Lampiran x
BAB 1. PENDAHULUAN
1.1. Latar Belakang 1
1.2. Permasalahan 3
1.3. Tujuan Penelitian 3
1.4. Manfaat Penelitian 3
1.5. Lokasi Penelitian 4
1.6. Metodologi Penelitian 4
BAB 2. TINJAUAN PUSTAKA
2.1. Oksidasi 5
2.2. Gliserol ( 1,2,3-Propanatriol ) 7
2.2.1. Oksidasi Gliserol 9
2.3. Katalis 11
2.3.1. Katalis Homogen 12
2.3.2. Katalis Heterogen 12
2.3.3. Katalis Palladium 14
2.3.4. Alumina 15
BAB 3. BAHAN DAN METODE PENELITIAN
3.1. Alat-alat 17
3.2. Bahan-bahan 17
3.3. Prosedur Penelitian
3.3.1. Oksidasi 1,2,3-Propanatriol 18 3.3.2. Pembuatan Garam dari Hasil Oksidasi 18 3.4. Bagan Penelitian
3.4.1. Oksidasi 1,2,3-Propanatriol 19 3.4.2. Pembuatan Garam Hasil Oksidasi 20 BAB 4. HASIL DAN PEMBAHASAN
4.1. Hasil 21
4.1.1. Oksidasi 1,2,3-Propanatriol 21 4.1.2. Pembuatan dari Garam Hasil Oksidasi 21
4.2. Pembahasan 22
4.2.1. Oksidasi 1,2,3-Propanatriol 22
BAB 5. KESIMPULAN DAN SARAN
5.1. Kesimpulan 28
5.2. Saran 28
DAFTAR PUSTAKA 29
LAMPIRAN
DAFTAR GAMBAR
Halaman
Gambar 4.1. Spektrum FT-IR Hasil Oksidasi (KBr) 23
Gambar 4.2. Spektrum 1H-NMR Hasil Oksidasi (DMSO) 24
Gambar 4.3. Spektrum FT-IR Garam Hasil Oksidasi (KBr) 25
Gambar 4.4 Spektrum 1H-NMR Garam Hasil Oksidasi (DMSO) 26
DAFTAR LAMPIRAN
Lampiran 1. Gambar Spektrum FT-IR Asam Gliserat Lampiran 2. Gambar Spektrum 1H-NMR Asam Gliserat Lampiran 3. Gambar Spektrum FT-IR Asam Tartronat Lampiran 4. Gambar Spektrum FT-IR Gliserol
Lampiran 5. Gambar Spektrum 1H-NMR Gliserol
BAB 1
PENDAHULUAN
1.1. Latar Belakang
Indonesia kaya akan sumber daya alam nabati seperti minyak kelapa sawit, kelapa, jarak pagar, kacang kedelai dan lain-lain. Seiring dengan menipisnya bahan bakar diesel yang berasal dari minyak bumi, maka kini sedang marak dikembangkan pembuatan biodisel yang berasal dari tumbuhan seperti tanaman jarak pagar dan lain- lain sebagai salah satu alternatif pengganti bahan bakar diesel.
Gliserol merupakan hasil samping dari transesterifikasi antara trigliserida dengan methanol untuk menghasilkan biodiesel (metil ester). Dengan adanya peningkatan produksi dari biodiesel, dapat dipastikan pula terjadi peningkatan produksi gliserol.
Hal ini menyebabkan jatuhnya harga gliserol di pasaran hingga turun sampai lebih dari 50% dari harga pada tahun-tahun sebelumnya.
O
H2C O C R1 R1COOCH3 H2C O H O katalis
H2C O C R2 + 3CH3OH R2COOCH3 + HC O H O
H2C O C R3 R3COOCH3 H2C O H Trigliserida Metanol Metil Ester Gliserol
Lebih lanjut lagi, gliserol dapat menjadi sebuah titik awal untuk digunakan dalam mensintesis sejumlah besar dari zat intermediet dan produk kimia lainnya, seperti hasil oksidasinya yang mempunyai potensi yang tinggi dalam sintesis organik (Cardona, 2007).
OH C
CH OH H2C OH
O
HC C
C
OH OH
OH O
O
Molekul gliserol mengandung gugus alkohol primer dan alkohol sekunder yang dapat mengalami reaksi oksidasi. Pada umumnya gugus alkohol sekunder lebih sukar dioksidasi daripada gugus alkohol primer, sehingga apabila gliserol dioksidasi, mula-mula akan terbentuk aldehida dan pada oksidasi selanjutnya akan membentuk asam karboksilat : asam gliserat atau asam tartronat .
( Asam Gliserat) ( Asam Tartronat)
Beberapa peneliti sebelumnya juga telah melakukan oksidasi gliserol dengan menggunakan katalis yang berbeda, yaitu : oksidasi gliserol menggunakan katalis Au/grafit dalam larutan NaOH menghasilkan produk natrium gliserat dengan berat katalis 1% menghasilkan yield hingga 100% ( Carrettin, 2004 ), oksidasi gliserol dengan hidrogen peroksida menggunakan silikat yang terikat pada logam (Ti, V, Fe) dan aluminophospat dengan logam ( Cr, V, Mn, Co ) menghasilkan asam formiat dan sebuah ester monoformat dan sejumlah campuran dari asetal sebagai produknya ( McMorn, 1999 ), oksidasi gliserol menggunakan katalis dua logam Au-Pd pada karbon teraktivasi dengan perbandingan yang berbeda dalam fase cair, menghasilkan asam gliserat dan asam glikolat sebagai produknya ( Villa, 2007 ).
Penggunaan katalis homogen dalam reaksi kimia telah banyak digunakan, akan tetapi kekurangan dari katalis ini adalah produk yang dihasilkan akan sulit untuk dipisahkan dari katalisnya. Sedangkan dengan penggunaan katalis heterogen produk dapat dipisahkan dari katalisnya dengan mudah.
Katalis Pd/γ-Al2O3 pernah digunakan oleh Fatimah (2006) di laboratorium Kimia Anorganik FMIPA USU untuk mengoksidasi glukosa dalam pelarut campuran aseton dan air menghasilkan campuran asam glukonat terbuka, asam glukonat berbentuk
lakton, dan glukosa yang tidak teroksidasi, digunakan oleh Siahaan (2006) untuk mengoksidasi sorbitol dalam pelarut air menghasilkan asam glukarat, dan digunakan oleh Lubis (2007) untuk mengoksidasi fruktosa dalam larutan natrium hidroksida untuk menghasilkan garam natrium 2-keto glukonat .
Berdasarkan tinjauan singkat di atas, maka peneliti tertarik untuk melakukan oksidasi terhadap kedua gugus alkohol primer dari gliserol menggunakan oksigen dan diaktivasi oleh katalis heterogen yaitu Pd/γ-Al2O3 dalam pelarut air untuk menghasilkan asam dikarboksilat.
1.2. Permasalahan
Apakah kedua gugus alkohol primer dari gliserol dapat dioksidasi dengan molekul oksigen bila menggunakan katalis heterogen Pd/γ-Al2O3 sehingga membentuk asam dikarboksilat .
1.3. Tujuan Penelitian
Penelitian ini bertujuan untuk melihat adanya fungsi katalis heterogen Pd/γ-Al2O3
terhadap reaksi oksidasi gugus alkohol primer dari gliserol dengan menggunakan oksigen sebagai oksidator
1.4. Manfaat Penelitian
Hasil penelitian ditujukan pada pengembangan pemanfaatan sistem katalis heterogen Pd/γ-Al2O3 dalam reaksi oksidasidengan menggunakan molekul oksigen yang akan menambah informasi terhadap ilmu kimia khususnya kimia organologam transisi serta untuk menambah daya guna dari gliserol.
1.5. Lokasi Penelitian
Penelitian ini dilakukan di laboratorium kimia Anorganik FMIPA-USU Medan, karakterisasi spektroskopi FT-IR dilakukan di laboratorium Bea Cukai Medan dan H- NMR dilakukan dilaboratorium kimia organik FMIPA-UGM Yogyakarta.
1.6. Metodologi Penelitian
1.6.1. Oksidasi Gliserol
Dalam penelitian ini,oksidasi gliserol dilakukan di dalam tabung autoclave yang dilengkapi dengan pengaduk magnet. Gliserol dioksidasi menggunakan gas oksigen dengan menggunakan katalis Pd/γ-Al2O3 dalam pelarut air . Lamanya reaksi dihentikan saat oksigen tidak terkonsumsi lagi. Campuran hasil reaksi kemudian disaring. Filtrat yang diperoleh diuapkan pelarutnya lalu divakum kemudian dianalisa dengan spektroskopi FT-IR dan 1H-NMR.
Selanjutnya hasil oksidasi digaramkan dengan larutan NaOH dalam metanol kemudian direfluks selama 5 jam , dan hasilnya dikarakterisasi dengan spektroskopi FT-IR dan 1H-NMR.
BAB 2
TINJAUAN PUSTAKA
2.1. Oksidasi
Proses oksidasi dapat terjadi secara alami maupun industri. Dalam kehidupan sehari-hari dapat terjadi pada proses pengkaratan, pembusukan, pernafasan dan pembakaran suatu material yang sengaja dilakukan. Sedangkan dalam industri, proses oksidasi umumnya dilakukan untuk menghasilkan suatu produk ( Parker, 1982).
Oksidasi dapat didefinisikan sebagai kehilangan elektron atau bertambahnya bilangan oksidasi oleh suatu atom dan diperolehnya atom oksigen atau kehilangan atom hidrogen dari suatu molekul ( March,1992).
Kebanyakan oksidasi dari senyawa kimia organik melibatkan bertambahnya oksigen dan atau hilangnya hidrogen. Jumlah oksigen dan hidrogen yang melekat pada karbon menyatakan derajad oksidasi senyawa tersebut. Semakin sedikit hidrogen pada ikatan karbon-karbon, maka akan semakin teroksidasi ikatan tersebut ( Wilbraham, 1992).
Oksidasi dalam kimia organik juga berkaitan dengan jumlah dan derajat oksidasi dari oksigen yang melekat pada karbon. Misalnya metana yang merupakan hidrokarbon jenuh, dapat dioksidasi secara bertahap menjadi karbondioksida dengan memperoleh oksigen dan melepas hidrogen bergantian. Metana dioksidasi menjadi metanol, kemudian menjadi formaldehida,lalu menjadi asam format dan akhirnya menjadi karbondioksida ( Wilbraham,1992).
Alkohol dengan paling sedikit satu hidrogen melekat pada karbon pembawa gugus hidroksil dapat dioksidasi menjadi senyawa-senyawa karbonil. Alkohol primer
menghasilkan aldehida yang dapat dioksidasi lebih lanjut menjadi asam karboksilat, alkohol sekunder menghasilkan keton.
R C
H
OH H
oksidator
R C O
H
oksidator
R C O
OH
alkohol primer aldehida asam
R C OH
R'
H
oksidator
R C
R' O
alkohol sekunder keton
Oksidator yang umum digunakan di laboratorium adalah asam kromat, H2CrO4, dan kromat anhidrida, CrO3 yang keduanya mengandung Cr6+ ( Hart,H, 1983).
H OH
CrO3 H+, aseton
O
sikloheksanol sikloheksanon
Oksigen merupakan suatu zat pengoksidasi yang baik dan banyak digunakan karena di samping terdapat secara melimpah dan dapat diperbaharui, harganya juga relatif murah. Namun oksidasi dengan menggunakan oksigen biasanya memerlukan suatu katalis sebagai aktivator dalam proses oksidasinya ( Backvall, 1991).
Molekul oksigen bereaksi dengan hampir semua unsur kecuali dengan halogen, beberapa logam mulia dan gas-gas mulia baik pada suhu ruangan maupun
dengan adanya kalor. Oksigen mempunyai tiga isotop yaitu 16O (99,759%),
17O (0,0374%), 18O (0,2039%). Destilasi bertingkat dari air merupakan konsentrat
yang mengandung sampai dengan 97% atom 18O atau sampai 46% atom 17O dapat dibuat. Oksigen mempunyai dua alotrop yaitu dioksigen O2, dan trioksigen (ozon) O3. Oksigen bersifat paramagnetik dalam semua keadaan dan mempunyai energi disosiasi yang agak tinggi 496 KJ mol-1. Banyak reaksi oksidasi oleh oksigen dalam larutan asam terjadi dengan lambat, namun laju oksidasi mungkin bertambah secara besar- besaran dengan sejumlah katalis dari logam transisi ( Cotton, 1989).
2.2. Gliserol (1,2,3-Propanatriol)
Gliserol mempunyai rumus kimia C3H5(OH)3. Gliserol mempunyai dua gugus alkohol primer dan satu gugus alkohol sekunder, yang merupakan lokasi potensial bagi reaksi lanjutan dan menjadikan gliserol sebagai bahan dasar kimia yang tidak beracun dan tidak menyebabkan iritasi dalam penggunaannya serta tidak mempunyai efek yang buruk bagi lingkungan.
Berikut ini merupakan sifat-sifat fisik dari gliserol ( Bonnardeaux, 2006 ) : -merupakan cairan tidak berwarna
-tidak berbau
-cairan kental dengan rasa yang manis -densitas 1,261
-titik leburnya 18,2oC -titik didihnya 290oC
Gliserol merupakan cairan kental yang tak berwarna, larut dalam air, bertitik didih tinggi dan rasanya manis. Gliserol digunakan sebagai penghalus pada krim cukur, sabun, dalam obat batuk dan sirup. Juga sering dipakai untuk pelembab tembakau ( Hart,1983).
Gliserol dapat diproduksi dari berbagai metode, beberapa diantaranya adalah : saponifikasi dari gliserida (minyak atau lemak) untuk menghasilkan sabun.
Reaksi transesterifikasi minyak dengan metanol menggunakan katalis menghasilkan gliserol dan metil ester.
O
H2C O C R1 R1COOCH3 H2C O H O katalis
H2C O C R2 + 3CH3OH R2COOCH3 + HC O H O
H2C O C R3 R3COOCH3 H2C O H Trigliserida Metanol Metil Ester Gliserol
Reaksi hidrolisis minyak dengan katalisator asam secara umum dapat dituliskan sebagai berikut : (Hart,1983).
O O H2C O C R1 H2C O H OH C R1
O H+ O H2C O C R2 + 3 H2O A- HC O H + OH C R2
O O H2C O C R3 H2C O H OH C R3
Trigliserida Gliserol Tiga ekuivalen
(Lemak atau minyak) asam lemak
Gliserol berupa cairan kental yang digunakan sebagai bahan anti beku, sebagai humektan ( bahan pelembab ) untuk tembakau, dan khususnya digunakan dalam industri peledak. Gliserol bereaksi dengan campuran dari asam nitrat dan asam sulfat untuk membentuk cairan kental gliseril trinitrat ( nama umumnya nitrogliserin) :
H2C O H H2CONO2
HC O H + 3 HONO2 H2SO4 HCONO2 + 3 H2O H2C O H H2CONO2
Nitrogliserin ini merupakan bahan peledak yang banyak digunakan pada tahun 1860 dan dapat mengakibatkan kerusakan yang besar ( Pauling, 1964).
Pada saat ini, pemakaian gliserol untuk berbagai keperluan industri sangat luas
sekali. Penggunaan gliserol untuk berbagai keperluan adalah sebagai berikut ( Bonnardeaux, 2006) :
- kosmetik : biasanya dipakai sebagai pelarut, lotion, pelembab
- peledak : digunakan untuk membuat nitrogliserin sebagai bahan dasar peledak atau dinamit
- industri makanan dan minuman : digunakan sebagai solven, emulsifier, bahan pemanis
- industri tembakau : digunakan untuk menjaga tembakau tetap lembab dan halus sebelum proses pembuatan rokok dan produk tembakau lainnya
- industri kertas : digunakan sebagai bahan pemlastis (plasticizers), bahan pelembut (softening agent)
- industri farmasi : digunakan untuk antibiotik, bahan pemlastis untuk obat kapsul, pelembab
- resin : digunakan untuk poliuretan, asam phtalat (phatlic acid) dan resin asam malat (malic acid resin).
2.2.1. Oksidasi Gliserol
Gliserol dapat menjadi sebuah titik awal untuk digunakan dalam mensintesis sejumlah besar dari zat intermediet dan produk kimia lainnya, seperti hasil oksidasinya yang mempunyai potensi yang tinggi dalam sintesis organik (Cardona, 2007).
OH HO
OH
gliserol
HO O
gliseraldehid OH
HO OH
O
asam gliserat
OH
HO OH
O O
asam tartronat OH
HO OH
OH
dihidroksiaseton
HO OH
O
O
asam hidroksipiruvat
OH OH
O
O
O
asam mesooksalat
Beberapa kegunaan dari hasil oksidasi dari gliserol ini adalah : asam gliserat dapat digunakan sebagai bahan intermediet dalam industri obat-obatan, asam tartonat dapat digunakan sebagai bahan pengkhelat, dihidroksiaseton sebagai bahan penyamak dalam kosmetik, asam tartronat sebagai bahan pengkhelat, asam hidroksipiruvat digunakan dalam keju sebagai bahan perasa dan digunakan dalam pemasakan buah dan sebagai bahan intermediet dalam asam amino dan asam mesooksalat mempunyai peranan yang potensial dalam sintesis organik ( Viinikainen, 2007 ).
Oksidasi gliserol dan 1,2-Propanadiol telah dilakukan oleh Carretin dan kawan-kawan (2004) dengan menggunakan berbagai variasi berat dari katalis emas yang tersupport ( 0,25 , 0,5 , 0,1 % berat Au/grafit ). Katalis Au/grafit dengan 1 % berat memberikan tingkat keselektifan hingga 100% menjadi produk satu asam, diambil sebagai garam Natrium, selama ada kehadiran NaOH. Katalisnya dikarakterisasi dengan TEM dan voltametri siklik.
Oksidasi gliserol menggunakan sejumlah logam yang mengandung silikat dan aluminophospat telah dilakukan oleh Mc.Morn,P dan kawan-kawan (1999). Berbagai variasi dari kondisi reaksi ( konversi, temperatur, perbandingan gliserol dan hidrogen peroksida ) atau katalis ( silikat dengan Ti, V, Fe, atau AlPO-5 dengan Cr, V, Mn, Co)
tidak menghasilkan bentuk dari oksidasi gliserol. Asam format dan sebuah ester monoformat dari gliserol diketahui sebagai produk utama dengan sejumlah campuran dari asetal.
Telah digunakan katalis dua logam Au-Pd pada karbon teraktivasi dengan perbandingan yang berbeda dalam fase cair untuk mengoksidasi gliserol dalam air menggunakan oksigen sebagai oksidator dan dibandingkan dengan katalis satu logam Au dan Pd. Asam gliserat dan asam glikolat didapat sebagai produknya ( Villa, 2007 ).
2.3. Katalis
Katalis didefinisikan sebagai zat yang mengakibatkan reaksi lebih cepat mencapai kesetimbangan. Katalis tidak akan mengubah nilai tetapan kesetimbangan. Peranan katalis adalah menurunkan energi aktivasi (Ea). Beberapa katalis berperan dengan membentuk pereaksi untuk mencapai kompleks aktif yang sama dengan bila tanpa adanya katalis, namun kebanyakan katalis tampaknya memberikan suatu mekanisme yang berbeda, yang mengikatnya secara sementara dan berenergi bebas rendah.
Hidrogenasi olefin merupakan contoh dimana kedua katalis heterogen dan homogen dapat dipergunakan secara efektif. Reaksi tanpa katalis :
R-CH=CH2 + H2 R-CH2CH3
berjalan lambat kecuali dengan suhu yang sangat tinggi yang menyebabkan timbulnya kesulitan lain seperti kesulitan mengatur suhu yang lebih tinggi dan terjadi reaksi lain yang tidak dikehendaki ( Cotton, 1989 ).
Semua katalisator mempunyai sifat yang sama, yaitu :
a) Katalisator tidak berubah selama reaksi berlangsung, namun ada kemungkinan katalisator ikut dalam reaksi tetapi setelah reaksi berakhir, katalisator tersebut diperoleh kembali.
b) Katalisator tidak mempengaruhi letak kesetimbangan, juga tidak mempengaruhi besarnya tetapan kesetimbangan. Katalisator hanya mempercepat reaksi dalam mencapai kesetimbangan, sebab semua reaksi berakhir dengan kesetimbangan.
c) Katalisator tidak dapat mengawali suatu reaksi, reaksi yang dikatalisir harus sudah berjalan walaupun sangat lambat.
d) Katalisator yang diperlukan untuk mempercepat reaksi biasanya hanya sedikit namun pada umumnya jumlah katalisator juga mempengaruhi kecepatan reaksi ( Sukardjo,1990)
Berdasarkan sifat campuran reaktan dengan katalis, maka katalis dapat dibagi menjadi 2 jenis, yaitu katalis homogen dan katalis heterogen. Jika katalis dan reaktan- reaktan berada dalam satu fase disebut katalis homogen sedangkan jika katalis berada pada fase yang berbeda dengan reaktan-reaktannya disebut katalis heterogen.
2.3.1. Katalis Homogen
Katalis homogen adalah hadir dalam fasa yang sama dengan reaktannya dan berfungsi dengan cara menggabungkan reaksi antar molekul untuk membentuk zat antara (intermediet) yang tidak stabil. Campuran senyawa zat antara ini akan bereaksi kembali dengan reaktan lain untuk menghasilkan produk yang diinginkan dan untuk meregenerasi katalis ( Moeller, 1980).
Katalis homogen biasanya merupakan kompleks logam yang larut dalam medium reaksi. Keuntungan dari katalis homogen ini yaitu bersifat spesifik,selekti dan memerlukan temperatur dan tekanan yang rendah. Sedangkan kelemahan dari katalis ini adalah adanya kesulitan dalam pemisahan katalis dari produk, terdegradasinya katalis dan harganya yang cukup mahal (Leach,1983).
2.3.2. Katalis Heterogen
Katalis heterogen merupakan jenis katalis dimana fasenya berbeda dengan reaktan, biasanya dalam fase padatan pada permukaan gas atau cairan. Reaksi berlangsung pada permukaan katalis sehingga katalis dapat dibagi menjadi padatan atau partikel-partikel yang mempunyai permukaan yang luas. Karena katalis
partikel logam H-H
H
C C
H
H H
+
permukaan adsorpsi
partikel logam H-H
H
C C
H
H H
+
aktivasi
partikel logam H H
H
C C
H
H H
+
partikel logam H
C C
H H H
partikel logam H
C C
H
H H
permukaan
H H
reaksi desorpsi
H H
heterogen tetap bentuknya dan dapat dipisahkan secara cepat dengan penyaringan, maka katalis ini lebih banyak digunakan secara luas di industri dibandingkan dengan katalis homogen (Moller,1998).
Katalis heterogen ini dapat berupa logam murni, campuran dengan katalis lain, atau terdispersi pada pendukung yang stabil. Beberapa katalis heterogen yang umum digunakan adalah logam dan oksida logam. Keuntungan dari penggunaan katalis heterogen ini adalah katalis dapat dipisahkan dengan mudah dari produknya dan dapat diadaptasikan dengan berbagai macam reaktor. Kerugiannya dari katalis ini adalah dibutuhkannya temperatur dan tekanan yang tinggi selama reaksi (Leach,1983).
Katalis heterogen memiliki paling sedikit 4 langkah : (1) Adsorbsi reaktan terhadap permukaan katalis, (2) Aktivasi reaktan yang teradsorbsi, (3) Reaksi reaktan yang teradsorbsi, dan (4) Difusi produk menjadi gas atau cairan. Di bawah ini merupakan proses hidrogenasi minyak atau lemak tidak jenuh untuk menghasilkan minyak / lemak jenuh dapat digambarkan sebagai berikut ( Holtzclaw dan Robinson, 1988) :
R CH2 Ti
tempat kosong
C2H4
R CH2 Ti
CH2
CH2
R HC Ti
CH2
CH2
Ti tempat kosong
CH2
H2C H2C
R
Sistem Ziegler-Natta adalah heterogen dan spesies logam aktif adalah bentuk serat-serat TiCl3 yang dibentuk in situ dari TiCl4 dan AlEt3, namun TiCl3 yang dibentuk kembali dapat juga digunakan. Fungsi kedua dari alkil alumunium tampaknya adalah untuk menukar salah satu ion klorida pada permukaan TiCl3 dengan sebuah radikal alkil yang diturunkan darinya ; permukaaan atom Ti mempunyai salah satu dari tempat koordinasi-6 yang kosong. Sebuah molekul etilena kemudian menjadi terikat pada tempat kosong. Gugus alkil kemudian dipindahkan ke etilena yang terkoordinasi. Molekul etilena berikutnya kemudian terikat pada tempat yang kosong dan prosesnya berulang.
Polimerisasi stereo biasa dari propena dapat timbul karena sifat tempat pada permukaan yang tersembunyi karena sterik pada kisi TiCl3 ( Cotton, 1989 )
2.3.3. Katalis Paladium
Paladium adalah logam berwarna abu-abu yang melebur pada suhu 1555oC dan sifat fisiknya yang khas adalah dapat mengabsorbsi gas hidrogen dalam jumlah yang besar pada suhu kamar (Vogel,1989).
Palladium, merupakan logam transisi dari kelompok Platina yang berwarna perak keputihan. Palladium biasanya ditemukan sebagai logam bebas, bercampur dengan golongan platinum lainnya.Palladium memiliki titik lebur yang rendah,logam ini biasanya sebagai katalis. Palladium dengan karbon digunakan pada proses kimia organik (Wikipedia, 2008).
Penggunaan katalis palladium dalam reaksi kimia umumnya dalam bentuk senyawa PdCl2 dan, Pd(CH3COO)2 misalnya pada proses Wacker yang menggunakan katalis PdCl2 dan kokatalis CuCl2 untuk mengoksidasi etilena menjadi asetaldehida.
Adapun reaksi dari proses Wacker secara sederhana ditulis sebagai berikut : H
H2C = CH2 + H2O + PdCl2 H3C C=O + Pd(O) + 2 HCl Pd(O) + 2 CuCl2 PdCl2 + 2 CuCl
2 CuCl + 2 HCl + ½ O2 2 CuCl + 2 H2O H2C = CH2 + ½ O2 H3C C = O H
2.3.4. Alumina
Secara stoikiometri, hanya ada satu oksida dari alumunium yaitu alumina (Al2O3). Ada dua bentuk dari Al2O3 anhidrat, yaitu α-Al2O3 dan γ-Al2O3. α-Al2O3
stabil pada suhu tinggi dan kurang stabil pada suhu rendah. Alumina hadir di alam sebagai mineral Corundum dan dapat dipersiapkan dengan memanaskan γ-Al2O3 atau oksida basa lain di atas 1000o. γ-Al2O3 didapat dari dehidrasi oksida basa pada suhu 450o. α-Al2O3 sangat stabil dan tahan terhadap hidrasi dan serangan oleh asam, sedangkan γ-Al2O3 secara cepat menyerap air dan larut dalam asam ( Cotton,F.A, 1980).
Corundum dan alumunium oksida anhidrat didapat dengan dehidrasi dari hidroksida alumunium, mempunyai rumus yang sama Al2O3 tetapi mempunyai struktur kristal yang berbeda dengan sifat yang berbeda pula. Corundum- bentuk oksidanya disebut α-Al2O3 yang cukup stabil.
Bentuk lain dari oksida ini, seperti hidroksidanya merupakan zat amfoter yang akan larut dalam asam atau basa. Bentuk ini dikenal sebagai γ-alumina atau γ-Al2O3. Pemanasan γ-alumina di atas 1000o akan mengubahnya menjadi α-alumina. Beberapa
kegunaan dari alumina yaitu sebagai zat penghilang air dan pendukung katalis ( Moeller, 1980).
Dari dua bentuk alumina ( Al2O3 ), α-alumina dan γ-alumina, α-alumina berstruktur korundum dan sangat keras. α-alumina tidak reaktif pada air maupun asam. Alumina merupakan komponen utama perhiasan, seperti rubi dan safir. Lebih lanjut, berbagai keramik maju ( material porcelain fungsional ) menggunakan sifat α- alumina yang telah dikembangkan. Di pihak lain, γ-alumina mempunyai struktur spinel dan alumina jenis ini mengabsorbsi air dan larut dalam asam, dan inilah yang merupakan komponen dasar alumina yang diaktivasi. Alumina ini banyak manfaatnya
termasuk sebagai katalis, pendukung katalis, dan dalam kromatografi ( http://old.inorg-phys.chem.itb.ac.id ).
BAB 3
BAHAN DAN METODE PENELITIAN
3.1. Alat-alat
- Neraca analitik digital - Mettler PM 2000
- Gelas Erlenmeyer 250 mL Pyrex
- Gelas Beaker 250 ml Pyrex
- Hot plate stirer - PMC Series 502
- Autoclave 100 mL Duragauge
- Termometer 200 oC Fisher
- Gelas ukur 25 ml Pyrex
- Pompa vakum - Wech duo_seal
- Pengaduk magnet - -
- Labu alas 50 mL Pyrex
- Termosetting - -
- Statif dan klemp - -
- Corong - Pyrex
- Pendingin liebig 24/29 Quicfit
- Spektrofotometer FT-IR - Spektrofotometer 1H-NMR
3.2. Bahan-bahan Gliserol 98%
Pd/γ-Al2O3 (s) p.a. E’Merck Gas Oksigen 99,999% PT.Aneka Gas Akuadest
NaOH (s) P.a. E’Merck
Metanol P.a. E’Merck
3.3. Prosedur Penelitian
3.3.1. Oksidasi 1,2,3-Propanatriol
Sebanyak 5 mL 1,2,3-Propanatriol (79,89 mmol) dimasukkan ke dalam tabung autoclave yang dilengkapi dengan pengaduk magnet. Dimasukkan ke dalamnya akuadest sebanyak 25 mL. Dimasukkan katalis Pd/γAl2O3 sebanyak 0,0735 g. Tabung autoclave ditutup rapat, kemudian dialirkan gas oksigen sampai tekanan 150 psi dan dipanaskan pada suhu 60oC . Waktu reaksi dihentikan saat oksigen tidak terserap lagi.
Selanjutnya hasil reaksi disaring,kemudian filtratnya diuapkan pelarutnya lalu divakum. Produk yang diperoleh dikarakterisasi dengan spektroskopi FT-IR dan
1H-NMR.
3.3.2. Pembuatan Garam dari Hasil Oksidasi Gliserol
Ke dalam labu leher dua yang telah dilengkapi dengan pengaduk magnet dimasukkan 0,3 g produk oksidasi dan ditambahkan larutan NaOH ( 0,5 g NaOH dalam 15 mL metanol). Campuran reaksi direfluks pada suhu 60oC selama 5 jam.
Endapan yang terbentuk kemudian disaring dan dibilas dengan metanol. Endapan divakum sampai kering kemudian dianalisa dengan spektroskopi FT-IR dan 1H-NMR
1,2,3-Propanatriol
Akuades
Katalis Pd/-Al2O3 Gas O2 (tekanan 150 psi)
Diaduk dan dipanaskan pada suhu 60oC Campuran reaksi
Disaring
Filtrat Endapan
Diuapkan Divakum Produk
Analisa FT-IR dan 1H-NMR 3.4. Bagan Penelitian
3.4.1. Oksidasi 1,2,3-Propanatriol
Produk oksidasi
Larutan NaOH dalam metanol
Direfluks pada suhu 60oC selama 5jam
Filtrat Endapan
Disaring
Dibilas dengan metanol Divakum
Produk
Dianalisa FT-IR dan 1H-NMR 2. Pembuatan Garam Hasil Oksidasi
BAB 4
HASIL DAN PEMBAHASAN
4.1. Hasil
4.1.1. Oksidasi 1,2,3-Propanatriol
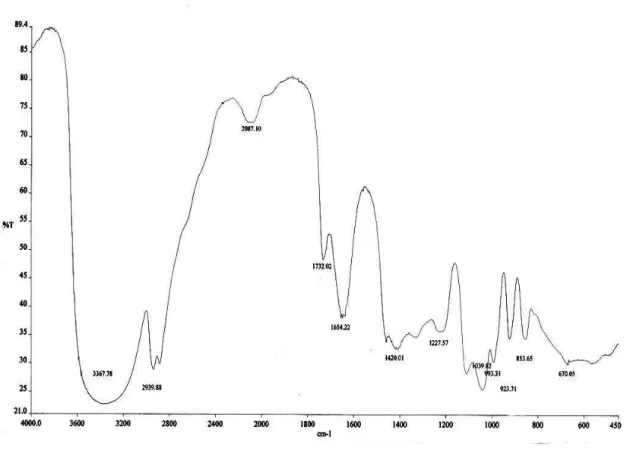
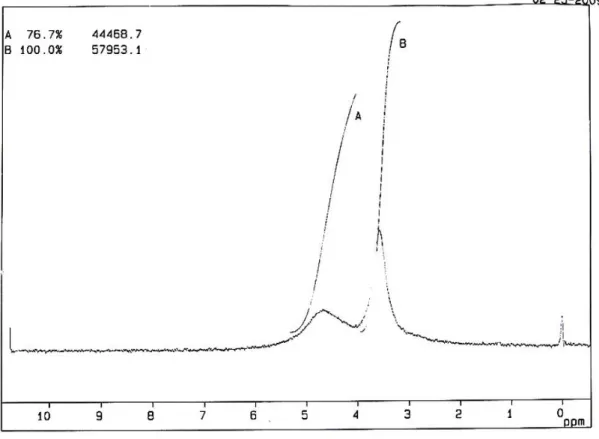
Dari reaksi oksidasi 1,2,3-Propanatriol (5 mL, 79,89 mmol) dengan molekul oksigen menggunakan katalis heterogen Pd/γ-Al2O3 dalam pelarut air yang berlangsung pada suhu 60oC dan tekanan oksigen 150 psi menghasilkan suatu larutan asam (pH=3) berwarna kehitaman. Campuran disaring untuk memisahkan padatan hitam. Filtrat kemudian diuapkan lalu divakum diperoleh larutan bening sebanyak 2,055 g (32,62%). Spektrum FT-IR (Gambar 4.1) menunjukkan pita serapan pada daerah bilangan gelombang 3367,78 cm-1, 2939,88 cm-1, , 1732, 02 cm-1, 1654,22 cm-1, 1420,01 cm-1, 1227,57 cm-1, 1039,82 cm-1, 993,31 cm-1, 923,71 cm-1. Sedangkan dari spektrum 1H-NMR (Gambar 4.2) didapatkan pergeseran kimia pada daerah δ 3,4-3,8 ppm dan δ 4,2-4,8 ppm.
4.1.2. Pembuatan Garam dari Hasil Oksidasi
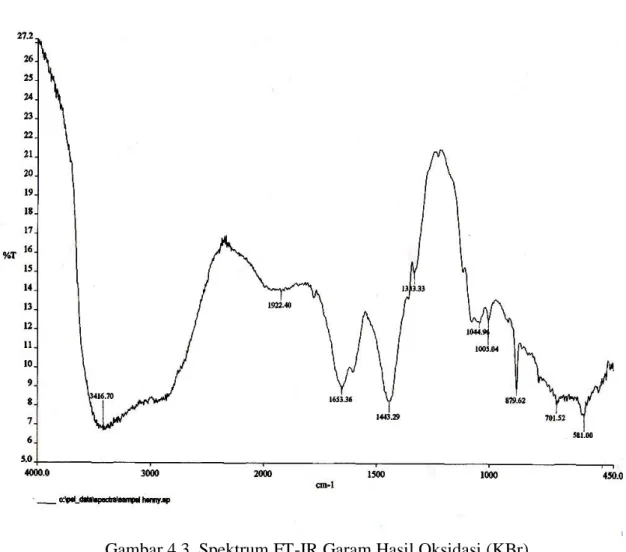
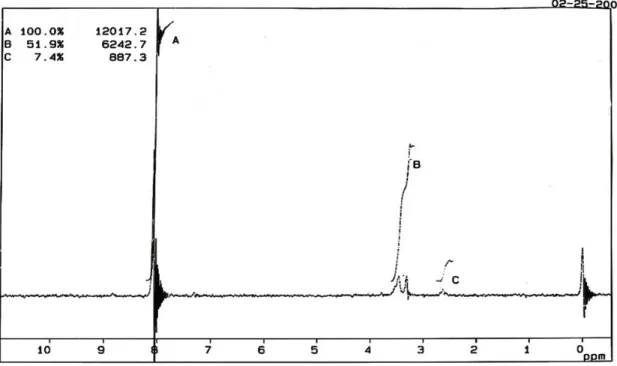
Reaksi antara hasil oksidasi dengan NaOH dalam pelarut metanol menghasilkan garam natrium gliserat sebanyak 27 %. Spektrum FT-IR (Gambar 4.3) menunjukkan pita serapan pada daerah bilangan gelombang 3416,70 cm-1, 1653,36 cm-1, 1443,29 cm-1, 1044,96 cm-1. Dan spektrum 1H-NMR (Gambar 4.4) didapatkan adanya pergeseran kimia pada δ 2,6 ppm dan δ 3,2-3,6 ppm dan δ 8 ppm.
H2C
HC
H2C
OH OH
OH
Gliserol
O2 , Pd/-Al2O3 H2O
C
HC
H2C
OH
OH O OH
Asam Gliserat 4.2. Pembahasan
4.2.1. Oksidasi 1,2,3-Propanatriol
Reaksi oksidasi 1,2,3-Propanatriol dengan molekul oksigen menggunakan katalis Pd/γ-Al2O3 dalam pelarut air menghasilkan asam gliserat. Gliserol mempunyai gugus alkohol primer dan gugus alkohol sekunder. Oleh karena zat pengoksidasi yang digunakan dalam oksidasi ini adalah molekul oksigen yang merupakan pengoksidasi lunak (mild) maka yang teroksidasi adalah gugus alkohol primernya.
.
Spektrum FT-IR dari produk hasil oksidasi ( Gambar 4.1 ) menunjukkan pita serapan yang lebar pada daerah bilangan gelombang 3367,78 cm-1, disebabkan oleh adanya gugus O-H dari OH alkohol dan asam. Adanya gugus OH alkohol ini didukung oleh pita serapan C-OH alkohol primer yang muncul pada bilangan gelombang 1039,82 cm-1 ( Pavia, 1979).
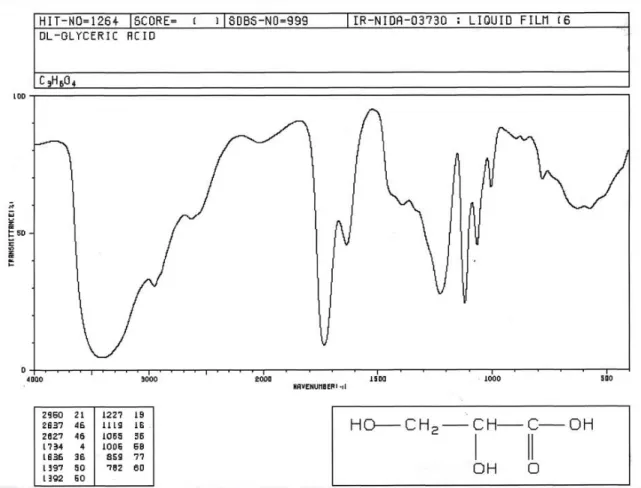
Munculnya serapan pada bilangan gelombang 2939,88 cm-1 disebabkan oleh serapan C-H sedangkan pada daerah 2850-an disebabkan oleh uluran CH2. Menurut Silverstein (1986), serapan C-H terletak pada daerah 3000-2840 cm-1 sedangkan uluran CH2 terletak di dekat 2853 cm-1. Bilangan gelombang 1732,02 cm-1 dan 1654,22 cm-1 menunjukkan telah terbentuk gugus C=O asam karboksilat. Hal ini dapat dibandingkan dengan bilangan gelombang dari asam gliserat yang didapat dari SDBS (Spectra Data Base System) (Lampiran 1), dimana gugus C=O terdapat pada bilangan gelombang 1734 cm-1 dan 1636 cm-1. Menurut Pavia, gugus C=O pada asam
karboksilat berada pada panjang gelombang 1730-1700 cm-1, dan menurut Biemann, gugus C=O pada asam karboksilat berada pada panjang gelombang 1800-1650 cm-1.
Sedangkan pita uluran C-O asam karboksilat muncul melebar pada 1227,57 cm-1 (Silverstein, 1981), dan tekukan keluar bidang dari O-H berada pada panjang gelombang 923 cm-1. Menurut Silverstein dan Pavia, tekukan keluar bidang hadir pada panjang gelombang sekitar 930 cm-1. Sehingga dari keterangan di atas diperoleh bahwa hanya ada 1 atom C primer yang teroksidasi.
Gambar 4.1. Spektrum FT-IR Hasil Oksidasi (KBr)
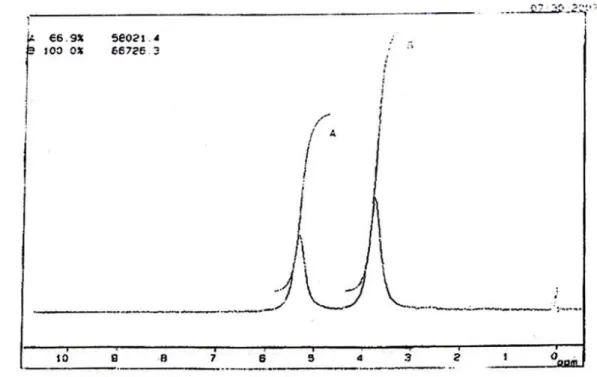
Sedangkan pada spektrum 1H-NMR dari hasil oksidasi (Gambar 4.2) dalam pelarut DMSO menunjukkan adanya pergeseran kimia pada daerah δ 3,4-3,8 ppm dan δ 4,2-4,8 ppm. Pergeseran kimia pada δ 3,4-3,8 ppm disebabkan oleh proton H yang terikat pada atom C2 dan C3. Sedangkan pergeseran pada δ 4,2-4,8 ppm disebabkan oleh proton pada gugus hidroksil. Daerah pergeseran kimia hidroksi sangat bervariasi yaitu δ 2,0-4,0 ppm; δ 3,5-5,5 ppm, dan δ 6,1 ppm. Hal ini timbul karena posisi sinyal
C
HC
H2C OH
OH O OH
Asam Gliserat
+ NaOH
CH3OH
C
HC
H2C OH
OH O ONa
Garam Natrium Gliserat
kemurnian alkohol serta ada atau tidaknya air dalam pelarut atau sampel (Pavia, 1979). Dalam hal ini 1H-NMR hanya di run antara δ 0-10 ppm, sehingga puncak proton asam yang diharapkan muncul pada δ 11-13 ppm tidak terlihat.
Gambar 4.2. Spektrum 1H-NMR Hasil Oksidasi (DMSO)
4.2.2. Pembuatan Garam dari Hasil Oksidasi
Reaksi antara hasil oksidasi dengan NaOH dalam pelarut metanol menghasilkan garam natrium gliserat.
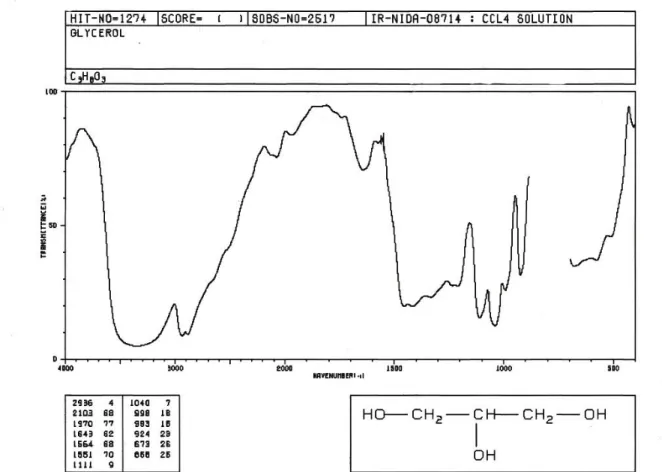
Spektrum FT-IR hasil penggaraman ( Gambar 4.3 ) menunjukkan serapan pada bilangan gelombang 2800-3500 cm -1 yang merupakan regangan dari O-H alkohol yang didukung oleh serapan C-OH alkohol primer pada 1044,96 cm-1 ( Pavia,1979).
Adanya serapan C-OH pada alkohol primer ini menunjukkan bahwa ada alkohol primer yang tidak teroksidasi. Terbentuknya garam karboksilat dapat dilihat dengan adanya regangan asimetris pada bilangan gelombang 1653,36 cm-1 yang disebabkan oleh regangan COO- yang didukung pita serapan pada pita serapan 1590 cm-1 dan regangan simetris terdapat lebih lemah lagi pada 1443,29 cm-1.
Gambar 4.3. Spektrum FT-IR Garam Hasil Oksidasi (KBr)
Spektrum 1H-NMR hasil penggaraman ( Gambar 4.4) dalam pelarut DMSO menunjukkan adanya pergeseran kimia pada δ 2,6 ppm dan δ 3,2-3,6 ppm dan δ 8 ppm. Pergeseran kimia pada δ 3,2-3,6 ppm disebabkan oleh proton H yang terikat
pengotor. Sedangkan pergeseran pada δ 2,6 ppm disebabkan oleh proton pada gugus hidroksil. Daerah pergeseran kimia hidroksi sangat bervariasi yaitu δ 2,0-4,0 ppm; δ 3,5-5,5 ppm, dan δ 6,1 ppm (Silverstein, 1981) . Hal ini timbul karena posisi sinyal OH tergantung pada kondisi seperti pelarut yang digunakan, konsentrasi, dan kemurnian alkohol serta ada atau tidaknya air dalam pelarut atau sampel (Pavia 1979).
Gambar 4.4 Spektrum 1H-NMR Garam Hasil oksidasi (DMSO)
OH
C H R1 R2
O
C H R1 R2
M
: OH2
C
O
R2 R1
C
R2 H
H2O
OH OH
C
R2
OH O
O O
+
M H
+ H3O+ M
H2O O
Adapun mekanisme reaksi katalisis oleh katalis heterogen yang diusulkan oleh Morrell ( 2003) adalah :
Alkohol teradsorbsi pada permukaan logam dan terjadi dehidrogenasi secara cepat membentuk logam-hidrida dan melepaskan karbonil. Logam-hidrida kemudian bereaksi dengan oksigen menghasilkan air dan meregenerasi kembali permukaan logam untuk bereaksi kembali dengan alkohol untuk meneruskan siklus katalitik. Jika produk adalah sebuah keton maka tidak ada reaksi lanjutan dan keton adalah satu- satunya produk. Jika produk adalah sebuah aldehid (R1 adalah H) maka dapat bereaksi secara cepat dengan air menghasilkan aldehid hidrat yang dapat dengan cepat bereaksi dengan oksigen untuk menghasilkan asam karboksilat. Di dalam sistem berair, reaksi antara aldehid hidrat dan oksigen sangat cepat sehingga menghasilkan asam karboksilat ( Morrell, 2003).
BAB 5
KESIMPULAN DAN SARAN
5.1. Kesimpulan
- Dari oksidasi 1,2,3-Propanatriol menggunakan molekul oksigen dengan katalis Pd/γ-Al2O3 dalam pelarut air diperoleh hasil oksidasi asam gliserat sebanyak 32,62 % .
- Penggaraman hasil oksidasi dilakukan dengan mereaksikannya dalam larutan NaOH dalam metanol, menghasilkan garam natrium gliserat sebanyak 27 %.
5.2. Saran
Untuk penggunaan katalis heterogen Pd/γ-Al2O3 ini perlu dipikirkan kondisi-kondisi reaksi yang tepat sehingga dapat digunakan untuk mengkatalisis reaksi oksidasi secara selektif.
DAFTAR PUSTAKA
- Backvall, J.E. 2002. Ruthenium-catalyzed aerobic oxidation of alcohols on zeolite encapsulated cobalt salophen catalyst. Hungary: University of Szeged - Biemann. 1983. Tables of Spectral Data for Structure Determination of Organic
Compounds. New York and Basel
- Bonnardeaux, J. 2006. Glycerin Overview. State of Western Australia
- Cardona,C. 2007. Use of Glycerol from Biodiesel Production : Conversion to added value product. Columbia : National University of Columbia
- Carrettin, S. 2004. Oxidation of Glycerol Using Supported Gold Catalyst. Topics in Catalysis Vol. 27. Nos.1-4
- Cotton, F. A dan Wilkinson,G. 1989. Kimia Anorganik Dasar. Jakarta: UI-Press - Fatimah,N, Andriayani. 2006. Oksidasi Glukosa Dengan Molekul Oksigen
Menggunakan Katalis Pd/ γ-Al2O3 Dalam Pelarut Campuran Aseton dan Air. Medan. Skripsi USU
- Hart,H .1983.Kimia Organik. Edisi Keenam. Bogor : Erlangga
- Holtzclaw,H.F. 1988. College Chemistry With Qualitative Analysis. Eight Edition.
USA : D.C.Heath and Company
- Leach,B.E. 1983. Applied Industrial Catalysis. Volume 2. New York : Academic Press
- Lubis, E, Saur. 2007. Oksidasi Fruktosa Dengan Molekul Oksigen Menggunakan Katalis Pd/ γ-Al2O3 Dalam Larutan Natrium Hidroksida. Medan. Skripsi USU
- March,J. 1992. Advanced Organic Chemistry. Fourth Edition. New York : John Wiley & sons,Inc
- McMorn,P. 1999. Oxidation of Glycerol with Hidrogen Peroxide Using Silicate and Aluminophosphate Catalyst. Catalyst Letters 63 (1999) 193-197 - Moller,T. 1980. Chemistry With Inorganic Qualitative Analysis. London :
Academic Press
- Morrel, D. 2003. Catalysis of Organic Reactions. USA : Marcel Dekker,Inc.
- Palladium. http://n.wikipedia.org/wiki/palladium. diakses tanggal 17 Oktober 2008
- Parker,S.P. 1982. Mc.Graw-Hill Encyclopedia of Chemistry. Second Edition.
USA : Mc.Graw-Hill,Inc
- Pavia , D.L. 1979. Introduction to Spectroscopy : A Guide for Students of Organic Chemistry. Philadelphia : Sauders Golden sunburst.
- Siahaan, R, Andriayani. 2006. Oksidasi D-Sorbitol Menggunakan Molekul Oksigen Dengan Katalis Pd/ γ-Al2O3 Dalam Pelarut Air. Medan. Skripsi USU
- Silverstein, R. M, Bassler, G. C. 1981. Spectrometric Identification Of Organic Compounds. Fourth Edition. USA: John Wiley And Sons.
- Sukardjo. 1990. Kimia Anorganik. Cetakan Kedua. Jakarta: Rineka Cipta
- Viinikainen, T, 2007. What To Do With Glycerol?. Integrated Design of Catalytic Nanomaterials of a Sustainable Production
- Villa, A. 2007. Bimetallic Gold/PalladiumCatalyst fot The Selective Liquid Phase Oxidation of Glycerol. Catalysis Letters, Volume 115, Nos. 3-4
- Vogel. 1999. Buku Teks Analisis Anorganik Kualitatif Makro dan Semimikro.
Edisi Kelima. Bagian Kedua. Jakarta : PT. Kalman Media Pusaka
- Wilbraham,A.C dan Matta,M.S. 1992. Pengantar Kimia Organik dan Hayati.
Bandung : ITB Press
Lampiran 1
Gambar Spektrum FT-IR Asam Gliserat
Lampiran 2
Gambar Spektrum FT-IR Gliserol
Lampiran 3
Gambar Spektrum 1H-NMR Gliserol