LAPORAN PRAKTIKUM
GENETIKA MOLEKULAR
DNA REKOMBINASI
KHAIRUL ANAM
P051090031/BTK
BIOTEKNOLOGI
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
2009
DNA REKOMBINASI
PendahuluanPlasmid
Plasmid adalah salah satu vektor yang biasa digunakan dalam proses pengklonan gen. Vektor adalah pembawa molekul DNA di dalam proses pengklonan gen. Plasmid adalah molekul DNA utas ganda sirkuler (tak berujung) yang berukuran kecil yang terdapat di dalam sitoplasma, dan dapat melakukan replikasi secara autonom. Karakteristik yang penting dari plasmid adalah dapat melakukan replikasi, terdapat di luar kromosom, dan secara genetik dapat ditransfer dengan stabil. Plasmid ini terdapat baik secara alami, maupun sudah mengalami modifikasi yang disesuaikan dengan keperluan di dalam manipulasi genetik. Satu sel dapat mengandung lebih dari satu kopi plasmid.
Plasmid berukuran 1 – 300 kb, sehingga dapat dibedakan dengan mudah dari kromosom bakteri yang berukuran 3000 – 5000 kb. Plasmid yang terlibat dalam proses konjugasi (plasmid F) biasanya berukuran besar. Untuk replikasi plasmid dapat berada dalam keadaan terpisah dari kromosom (non-integratif) dan terintegrasi dalam kromosom bakteri (episom).
Plasmid terdapat di dalam sitoplasma organisme prokaryot dan eukaryot sederhana uniseluler. Selain terdapat dalam bakteri, plasmid juga terdapat pada Saccharomyces
cerevisiae (plasmid 2 um). Plasmid dapat dikelompokkan berdasarkan sifat yang disandi oleh
gen yang dikandungnya, yaitu : (i) Plasmid F (fertilitas) membawa gen tra, yang bertanggung jawab terhadap proses konjugasi; (ii) Plasmid R (resistensi) mengandung gen resistensi terhadap antibiotic atau logam berat; dan (iii) Plasmid yang mengandung gen penyandi toksin dan bakteriosin seperti ColE1 dari E.coli; (iv) Plasmid degradatif yang mempunyai kemampuan untuk melakukan metabolisme molekul organic seperti toluene (TOL dari Pseudomonas putida); (v) Plasmid virulensi yang bertanggung jawab terhadap patogenitas dari sel inang (pTi pada
Agrobacterium tumefaciens)
Praktikum ini bertujuan agar praktikan mengerti prinsip dan cara mengisolasi plasmid dan memisahkannya dari insertnya, dan mengetahui cara visualisasi plasmid dengan metode elektroforesis.
Elektroforesis
Dalam kegiatan biologi molekuler, elektroforesis merupakan salah satu cara untuk memvisualisasikan keberadaan DNA, plasmid, dan produk PCR. DNA dapat dilihat secara langsung dan dapat ditentukan ukurannya berdasarkan migrasinya pada gel agarose maupun gel poliakrilamid. Migrasi DNA dalam gel disebut sebagai elektroforesis. Untuk dapat divisualisasikan, maka DNA yang terdapat di gel diwarnai dengan Ethidium Bromida (EtBr), kemudian dilihat di atas sinar ultra violet. Ethidium bromida dapat menangkap sinar ultra violet sehingga pendaran sinar UV ini dapat terlihat. Ethidium mengikat molekul DNA, sehingga molekul DNA dapat terlihat ketika dilihat di atas sinar ultra violet. DNA merupakan molekul bermuatan negatif, sehingga bila diletakkan dalam medan listrik, DNA akan bermigrasi dari kutub negatif ke kutub positif. Kecepatan migrasi ditentukan oleh : i) ukuran molekul DNA; ii) prosentase/kerapatan gel yang dilalui DNA; iii) arus listrik yang diberikan untuk memigrasikan molekul DNA. Semakin kecil ukurannya DNA akan semakin cepat migrasi DNA. Semakin rapat media yang digunakan, semakin tinggi prosentasenya, maka semakin lambat DNA bermigrasi. Semakin besar arus yang diberikan, maka semakin cepat DNA bermigrasi.
Gel elektroforesis digunakan untuk memisahkan fragmen DNA berdasarkan ukurannya. Dimana jika sentrifugasi berarti memisahkan molekul menggunakan kekuatan gravitasi sementara gel elektroforesis berarti memisahkan molekul dengan menggunakan kekuatan elektrik. Gel elektroforesis mengambil keuntungan bahwa, sebagai asam organik, DNA bermuatan negatif. Ketika diletakkan di dalam medan listrik, molekul DNA menuju ke kutub positif (anoda) dan menjauhi kutub negatif (katoda).
Sebelum dilakukan elektroforesis, suspensi DNA terlebih dahulu harus ditambahkan loading buffer (dye), yang berfungsi untuk i) menambah densitas, sehingga DNA akan selalu berada di dasar well; ii) pewarna untuk memudahkan meletakkan sampel DNA ke dalam well, iii) agar dapat bergerak ke arah anoda dengan laju yang dapat diperkirakan sehingga dapat digunakan sebagai tanda migrasi DNA. Pewarna yang biasa digunakan adalah bromophenol blue dan xylene cyanol.
Restriksi
Restriksi plasmid merupakan proses pemotongan fragmen DNA pada situs tertentu sesuai yang diinginkan dengan menggunakan enzim restriksi. Enzim restriksi adalah enzim yang bekerja untuk memotong fragmen DNA pada situs spesifik. Seperti diketahui, di dalam Bioteknologi terdapat dua kategori enzim yang berperan dalam proses rekombinasi DNA, yaitu enzim yang berperan dalam isolasi DNA dan penyiapan DNA rekombinan (di mana dua molekul
DNA dikombinasikan). DNA spesifik atau gen diisolasi/diambil dari DNA dengan memotong “sugar – phosphat backbone” DNA asalnya, dan DNA dari dua sumber yang berbeda dicampur dan dikombinasi. Molekul DNA rekombinan tidak dapat dibuat dengan mudah tanpa adanya dua jenis enzim, yaitu: enzim restriksi endonuklease yang berperan sebagai “gunting” untuk memotong DNA pada situs spesifik dan DNA ligase yang berperan sebagai lem yang merekatkan dua molekul DNA di dalam tabung reaksi. Restriksi endonuklase memotong “sugar – phosphat backbone” DNA pada kedua utasnya. Restriksi endonuklease mengenali urutan spesifik di dalam molekul DNA. Urutan yang spesifik tersebut pada umumnya terdiri dari 4 – 6 pasang basa dan bersifat palindromik (palindrom). Palindrom merupakan daerah yang memiliki urutan basa yang sama dengan utas pasangannya jika dibaca dari arah yang sama yaitu 5’ – 3’.
Setiap enzim restriksi mengenali urutan spesifik dan memotong hanya di tempat-tempat tertentu dari urutan basa tersebut. Enzim restriksi memotong DNA double strands dengan memutus ikatan kovalen di antara phosphat dari satu deoksiribonukleotida dengan gula dari deoksiribonukleotida yang berbatasan dengannya. Terdapat dua tipe hasil pemotongan, ujung rata (blunt end) dan ujung kohesif (sticky end). Ujung rata (blunt end) dihasilkan ketika dua utas molekul dipotong pada posisi yang sama, bagian akhirnya rata dan tidak ada nukleotida yang tidak berpasangan. Ujung kohesif (sticky end) dihasilkan ketika setiap molekul DNA dipotong pada posisi yang tidak sama sehingga salah satu utas (5’ atau 3’) menggantung dengan beberapa nukleotida. Akhiran single strand yang tidak rata ini dapat berpasangan secara spontan dengan basa pasangannya sehingga disebut “sticky” (mudah lengket) atau kohesif.
Enzim restriksi banyak diisolasi dalam bakteri dimana enzim tersebut memotong atau memisahkan, DNA asing bakteriofage sebelum DNA bakteriofage menyerbu ke dalam dinding sel bakteri host untuk memproduksi fage-fage yang baru. Sel bakteri resisten karena DNA mereka dimodifikasi secara kimia, terutama dengan penambahan gugus metil untuk melindungi situs pengenalan dari restriksi endonuklease sehingga mereka tidak dapat dipotong. Enzim restriksi dinamakan berdasarkan organisme dari mana enzim tersebut diisolasi. Sebagai contoh
Eco RI yang diisolasi dari Escherichia coli RY13: Eco berasal dari huruf pertama nama genus
dan dua huruf pertama nama spesies; R adalah tipe strain dan I adalah enzim pertama dari tipe tersebut. Selain itu juga terdapat BamHI enzim pertama yang diisolasi dari Bacillus
amyloliquefaciens strain H, Sau3A merupakan enzim yang diisolasi dari Staphylococcus aureus
strain 3A, TaqI dari Thermus aquaticus, HinfI merupakan enzim pertama yang diisolasi dari
Haemophilus influenzae tipe Rf, dan lain-lain.
Satu unit aktivitas enzim restriksi didefinisikan sebagai jumlah enzim yang dapat memotong 1 ug DNA fage λ selama 1 jam dalam kondisi buffer yang optimum pada suhu 37o C.
Elusi
Elusi atau isolasi fragmen tunggal DNA adalah proses pemisahan fragmen DNA target dari campuran fragmen-fragmen DNA pengotornya. Hal ini penting dalam rekayasa genetik karena fragmen tersebut dapat digunakan untuk pelacak dalam mendeteksi gen DNA lain dan dapat dicangkokkan ke fragmen DNA lainnya. Fragmen DNA yang tidak tercampur dengan fragmen DNA lainnya diperoleh melalui beberapa tahap. Tahap pertama adalah pemisahan fragmen yang ingin diisolasi dari fragmen lainnya dengan pemotongan menggunakan enzim restriksi atau hasil PCR, yang dilanjutkan dengan elektroforesis menggunakan gel agarose. Tahap selanjutnya adalah mendeteksi fragmen yang akan diisolasi dan memotong gel agarose yang mengandung fragment tersebut. Tahap terakhir adalah mengisolasi fragmen DNA dari gel agarose dengan cara melewatkannya pada membran Hybon N netral dan memberi larutan buffer elusi yang berisi Tris buffer dan Sodium Dodesil Sulfat.
Sekarang telah banyak perangkat (kit) yang digunakan untuk mengisolasi DNA dari gel agarose, antara lain : GFXTM PCR DNA dan Gel Band Purification Kit dari Amersham
Pharmacia Biotech. Pada praktikum ini dilakukan isolasi DNA dari gel agarose dengan menggunakan metode yang relatif sederhana dan murah. Selain itu juga akan digunakan kit dari gel agarose dengan GFXTM PCR DNA dan Gel Band Purification Kit dari Amersham
Pharmacia Biotech untuk memberi gambaran tentang penggunaan kit, walaupun dalam pelaksanaan praktikum ini kit yang digunakan adalah produk lain, namun prosedurnya memiliki kemiripan.
Ligasi
Ligasi adalah proses penyambungan antara satu fragmen DNA dengan fragmen DNA lainnya. Di dalam pengklonan gen, DNA insert disambungkan dengan vector pengklonan. Terdapat beberapa jenis vector, diantaranya vector untuk bakteri adalah plasmid, phage dan cosmid, serta beberapa vector lain yang digunakan untuk organisme selain bakteri, yaitu Yeast Artificial Chromosomes (YAC), Bacterial Artificial Chromosomes (BAC), Plant Cloning Vectors dan Mammalian Cell Vectors (Barnum, 2005).
Faktor yang sangat berperan dalam proses ligasi adalah Enzim Ligase. Enzim ligase adalah enzim yang berfungsi menggabungkan fragmen DNA yang telah dipotong dengan enzim restriksi dengan fragmen DNA vector. DNA insert (fragmen DNA asing) dipotong pada bagian yang sesuai dengan bagian pemotongan DNA vector, sehingga keduanya dapat saling berkomplemen. Terdapat dua jenis enzim ligase yang dihasilkan oleh Escherichia coli, diantaranya T4 DNA Ligase yaitu enzim ligase yang dihasilkan oleh bakteri E. coli yang telah
terinfeksi virus T4 dan E.coli DNA Ligase yaitu enzim ligase yang dihasilkan oleh E.coli sendiri. Kedua enzim tersebut mempunyai fungsi mensintesis pembentukan ikatan phosphodiester yang menghubungkan nukleotida yang satu dengan nukleotida di sebelahnya. Perbedaan dari kedua enzim tersebut hanya terletak pada kofaktornya, pada T4 DNA Ligase adalah ATP sedangkan pada E.coli DNA Ligase adalah NAD+ (Muladno, 2002).
Enzim ligase hanya dapat menggabungkan fragmen DNA yang mempunyai ujung tidak rata (sticky end) yang saling berkomplemen dan ujung rata (blunt end). Enzim ligase mengkatalisasi pembentukan ikatan kovalen antara gula dengan phosphate dari nukleotida yang berdekatan, yang menghendaki satu nukleotida mempunyai ujung 5’ phosphate bebas dan nukleotida yang berdekatan mempunyai ujung 3’gugus hidroksil. Enzim ligase tidak membedakan DNA-DNA dari organisme yang berbeda. Oleh karena itu, dua fragmen DNA dari organisme yang berbeda pun dapat digabungkan oleh enzim ini. Kedua fragmen ini kemudian menjadi satu molekul DNA yang disebut sebagai DNA rekombinan. DNA rekombinan ini tidak dapat dilihat keberhasilannya kecuali dengan memperbanyaknya di dalam sel inang. Proses ini disebut sebagai transformasi atau cloning gen (Barnum, 2005).
Ligasi berhasil bila kedua ujung yang akan disambungkan berkomplemen. Kecocokan yang sangat spesifik dibutuhkan bila fragmen DNA yang akan disambungkan mempunyai ujung tidak rata (sticky end), karena penyambungannya harus mengikuti kaidah Chargaff, yaitu T berpasangan dengan A dan G berpasangan dengan C. Sedangkan fragmen DNA yang mempunyai ujung rata (blunt end) dapat disambungkan dengan sembarang fragmen DNA lain yang berujung rata. Oleh karena itu untuk mengklon suatu fragmen DNA yang spesifik menggunakan ujung tidak rata sedangkan pengklonan DNA yang tidak memerlukan spesifikasi tertentu menggunakan ujung rata (Suharsono dan Widyastuti, 2006).
Transformasi
Transformasi adalah penyisipan materi genetik eksternal yang berupa fragmen DNA, baik DNA kromosom maupun DNA plasmid ke dalam sel. Transformasi bakteri mula-mula diperkenalkan oleh Frederick Griffith pada tahun 1982, berdasarkan kenyataan bahwa suatu bakteri dapat melepaskan fragmen DNA-nya ke dalam suatu medium yang kemudian akan masuk ke dalam sel bakteri yang lain dalam kultur tersebut. Di alam, fragmen DNA tersebut biasanya dilepaskan oleh sel bakteri yang mati atau mengalami autolisis. Namun, terdapat sel lain yang ternyata memang melepaskan fragmen DNA pada saat pertumbuhan karena adanya gen tra.
Pada percobaan ini, akan dilakukan transformasi pada E. coli yang sensitif terhadap ampisilin dengan plasmid yang mengandung gen resisten ampisilin. Jika transformasi yang dilakukan berhasil dengan baik, maka E. coli tersebut akan mengekspresikan gen resisten ampisilin sehingga dapat bertahan hidup pada media yang mengandung ampisilin.
Bahan dan Cara Kerja Isolasi DNA plasmid
Satu koloni bakteri E. coli yang mengandung plasmid ditumbuhkan dalam 2 ml media LB (bacto tryptone 10g/l, bacto-yeast extract 5g/l, NaCl 10 g/l) yang mengandung 100 mg/l ampisilin di dalam shaker (250 rpm) pada suhu 37°C selama semalam. Kemudian 1,5 ml kultur dipindahkan ke dalam tabung 1,5 ml lalu diendapkan dengan sentrifugasi 10.000rpm (Tomy MRX-150) 4°C selama 10 menit. Lalu endapan bakteri disuspensikan ke dalam 100 ul buffer suspensi sel (Tris HCl pH 7.5 +EDTA) dan di-vortex. Kemudian ditambah 200 ul buffer lisis (0.2M NaOH, 1% SDS). Suspensi dihomogenkan dengan membolak-balik tabung (6-8kali) lalu didiamkan 3 menit. Bufer netralisasi (1,32M Na-asetat pH 4,8) ditambahkan sebanyak 300 ul dan dihomogenkan dengan membolak-balik tabung. Setelah itu, dilakukan sentrifugasi 10.000 rpm 4°C selama 10 menit. Supernatan ditransfer ke tabung yang baru kemudian dilakukan ekstraksi dengan PCI (fenol-kloroform-isoamil alkohol) untuk memisahkan lipid-protein dengan DNA. Fase air (supernatan) yang mengandung DNA di tambah RNase dan diinkubasi pada 37C semalam. Kemudian DNA diendapkan dengan penambahan Na-asetat pH 5,2 dan etanol absolut. Setelah diinkubasi pada 30°C selama 2 jam, dilakukan sentrifugasi 10.000rpm 4°C selama 10 menit. Pelet dibilas dengan etanol 70% kemudian disentrifugasi kembali 10.000rpm selama 10 menit pada 4°C. Supernatan dibuang dan pelet dikeringkan. Selanjutnya pelet dilarutkan ke dalam TE (Tris-HCl pH 8 10 mM, EDTA 1 mM).
Analisis kemurnian DNA dan kuantifikasi DNA dengan spektrofotometer
Suspensi DNA plasmid diencerkan dengan mengambil 1 ul dalam 99 ul H2O atau TE. Suspensi DNA yang telah diencerkan dibaca absorbansinya pada panjang gelombang 260 nm dan 280 nm. Nilai absorbansi pada panjang gelombang 260 nm dikonversikan ke dalam konsentrasi, yaitu 1 OD260 = 50 ug DNA utas ganda tiap ml. Perbandingan nilai absorbansi 260 nm terhadap absorbansi 280 nm dihitung untuk mengetahui kemurnian DNA terhadap kontaminan protein. Rasio OD260/OD 280 antara 1,8-2,0 mencerminkan DNA yang relative murni dan terbebas dari kontaminan protein.
Analisis kualitatif dan kuantifikasi DNA dengan elektroforesis gel agarosa
Gel agarose 1% dibuat dengan mensuspensikan agarose ke dalam buffer TAE 1x (Tris-HCl pH 8,3 40 mM, asam asetat pekat 1,98 mM, EDTA 1 mM) atau TBE 1x (Tris-(Tris-HCl 100 mM, asam borat 83 mM, EDTA 1 mM), dipanaskan hingga jernih dengan microwave. Setelah suhu tidak terlalu panas (60°C), gel dicetak dengan menggunakan gel tray (cetakan gel) dan dipasang sisir untuk membuat sumuran, lalu dibiarkan beku. Sisir dilepas kemudian gel dipindah ke dalam electrophoresis chamber. Sebanyak 1-2 ul DNA dicampur dengan larutan pewarna (loading dye; bromofenol biru 0,25%, xylene cyanol FF 0,25%, sukrosa 40%). Kemudian sampel DNA tersebut serta penanda kuantitas (marker, λ yang dipotong dengan enzim HindIII) diaplikasikan pada gel agarosa. DNA dimigrasikan kemudian setelah selesai migrasi, direndam dengan larutan etidium bromide, dan dilihat di atas UV setelah dicuci dengan H2O. Jumlah DNA dianalisis dengan membandingkan antara pendaran pita DNA plasmid yang
dianalisis dengan pendaran pita DNA penanda kuantitas. Bentuk DNA plasmid ditentukan dengan melihat jumlah pita di dalam gel.
Restriksi
Sebanyak 5-10 ug DNA plasmid yang akan dipotong menjadi fragmen-fragmen, 5 ul larutan penyangga reaksi 10x (sesuai enzim yang digunakan), 1 ul enzim restriksi (10 unit/ul), dan H2O hingga volume larutan menjadi 50 ul dimasukkan ke dalam tabung eppendorf 500 ul (dengan urutan: H2O, penyangga, DNA plasmid, enzim). Kemudian larutan diinkubasi selama 1
jam pada suhu 37°C. Selesai inkubasi, dilakukan elektroforesis untuk mengecek apakah enzim telah memotong DNA. Bila DNA belum terpotong sempurna, waktu inkubasi dan/enzim restriksi ditambahkan lagi. Bila telah terpotong, aktivitas enzim dihentikan dengan memanaskan larutan DNA pada suhu 65-70°C. Selanjutnya, dilakukan elektroforesis kembali untuk menentukan ukuran plasmid dan fragmen-fragmennya.
Isolasi (Elusi) fragmen DNA plasmid dari gel agarosa
Gel hasil elektroforesis plasmid dipotong pada bagian yang mengandung pita DNA yang sesuai dengan yang diinginkan, pemotongan dilakukan di atas transilluminator UV. Potongan gel dimasukkan ke dalam cawan petri kemudian dipotong –potong atau dicacah. Buat corong yang terbuat dari bagian eppendorf yang dasarnya telah dilubangi dan kemudian dilapisi membran nylon hybond untuk menyaring gel. Basahi membran nylon dengan 50 ul larutan penyangga elusi. Hasil cacahan gel dimasukkan ke dalam corong yang telah dilapisi membran nylon hybond. Tambahkan 150 ul larutan penyangga elusi. Sentrifugasikan pada kecepatan 7
15000 g selama 1 menit pada suhu ruang. Tambahkan 150 ul larutan penyangga elusi. Sentrifugasikan pada kecepatan 15000 g selama 5 menit pada suhu ruang. Tambahkan 150 ul larutan penyangga elusi. Ekstraksi cairannya dengan PCI sebanyak 1x volume supernatan. Vorteks selama 1 menit. Sentrifugasikan pada kecepatan 15000 g selama 1 menit pada suhu ruang. Ambil supernatan (fase atas dari hasil sentrifugasi). Endapkan dengan menambahkan 0.1 volume sodium asetat 3 M, pH 5 dan 2-3 volume etanol absolut). Bilas dengan etanol 70%. Keringkan dengan vacuum. Suspensikan endapan dengan menambahkan 15 – 20 ul dH20.
Ligasi fragmen DNA (insert) dengan vektor
6 ul vektor P gen T easy dengan Gen 6 α sebanyak 7 ul, T4 ligase sebanyak 0,4 ul, buffer T4 ligase sebanyak 1,5 ul, dan dH2O hingga volume akhir mencapai 15 ul lalu diinkubasi
pada suhu 4 0C hingga akan dilakukan transformasi.
Pembuatan bakteri kompeten
Satu koloni bakteri E. coli (DH5α) diinokulasikan dengan menggunakan tusuk gigi steril ke dalam tabung reaksi berisi 2 ml media LB cair yang mengandung ampisilin. Bakteri diinkubasi selama satu malam pada suhu 37°C di dalam penggoyang (environmental shaker) pada 200-250 rpm. Kemudian 100 ul biakan bakteri ditumbuhkan di dalam 10 ml LB atau SOB pada kondisi lingkungan yang sama dengan sebelumnya selama 2-3 jam hingga OD600 = 0,4-0,5. Sebanyak 1,5 ml biakan bakteri lalu dipindahkan ke dalam tabung sentrifus dan diinkubasikan di dalam es selama 10 menit. Lalu dilakukan sentrifugasi pada 4000 g (3000 rpm) dengan swinging bucket rotor, 4°C, selama 10 menit. Cairan dibuang dan endapan bakteri disuspensikan dengan hati-hati dalam 16,5 ml TB (transformation buffer; 3 g Pipes 10 mM, 2,2 g CaCl2.2H2O, 18,2 g KCl 250 mM, 10,9 g MnCl2.4H2O 55 mM, 950 ml H2O, pH diatur 6.7
dengan KOH dan ditambah H2O hingga 1 l). Suspensi bakteri disimpan dalam es selama 10
menit kemudian disentrifus pada 3000 rpm (swinging bucket rotor), 4°C, selama 10 menit. Cairan dibuang, lalu endapannya disuspensikan dengan hati-hati dalam 1,4 ml TB. Kemudian ditambahkan 100 ul DMSO dan segera disimpan dalam es selama 10 menit. Dalam keadaan dingin (4°C), 50 ul suspensi bakteri dimasukkan ke eppendorf dan disimpan dalam nitrogen cair. Setelah beku, disimpan dalam freezer -70°C.
Pengecekan hasil ligasi dengan transformasi
Sebanyak 10 ul (50-100 ng) DNA plasmid dimasukkan ke dalam tabung eppendorf yang berisi 50 ul sel bakteri kompeten yang tepat mencair. Setelah dihomogenkan, suspensi bakteri dipanaskan pada 42°C (heat shock) selama 45 detik dan segera dimasukkan kembali ke dalam es. Suspensi didiamkan dalam es selama 5 menit. Tabung eppendorf dipindahkan ke suhu ruang lalu ditambah dengan 100 ul media cair 2xYT. Eppendorf diinkubasikan di alat penggoyang pada 250 rpm, suhu 37C selama 30 menit-1 jam. Setelah inkubasi, suspensi bakteri diinokulasikan secara merata di atas media LB padat yang mengandung ampisilin. Sterilisasi batang kaca dilakukan dengan mencelupkan ke dalam alkohol kemudian membakarnya dengan api Bunsen dan didinginkan. Untuk menyeleksi adanya sisipan di dalam plasmid yang mengandung gen lacZ, ditambahkan 0,1 M IPTG (10 ul/cawan) dan 2% X-gal (50 ul/cawan) pada permukaan medium. Cawan diinkubasi pada incubator pada suhu 37°C dengan meletakkan cawan petri pada posisi terbalik (media di bagian atas). Bakteri yang mengandung plasmid yang tersisipi fragmen pada situs pengklonan di daerah lacZ akan membentuk koloni berwarna putih, sedang bakteri yang mengandung plasmid yang tidak tersisipi fragmen akan menghasilkan koloni berwarna biru. Bakteri yang tidak mengandung plasmid tidak akan membentuk koloni.
Hasil dan Pembahasan
Isolasi DNA Plasmid
Dapat diketahui bahwa dalam proses mengisolasi plasmid dari suatu bakteri, ada tiga tahap penting yang perlu dilakukan, yaitu 1. Lisis membran sel bakteri, 2. Ektraksi DNA, 3. Pengendapan DNA.
Proses lisis diawali dengan adanya pemberian SDS + NaOH dimana SDS (sodium dodesil sulphate) merupakan deterjen yang berperan untuk melisis dinding atau membran sel yang terdiri dari lipid (fosfolipid) dan NaOH sebagai larutan basa berfungsi untuk denaturasi protein atau DNA (DNA double strain menjadi single strain). Terjadinya proses lisis ditandai dengan terbentuknya lendir.
Gambar 1. Lisis dinding dan membran sel bakteri
Gambar 2. Ekstraksi DNA dengan PCI
Pada suspensi ekstrak sel sebelum ekstraksi terdapat senyawa DNA plasmid, RNA, Protein, Senyawa Organik dan Komponen Lipid. Ekstraksi dilakukan dengan adanya penambahan PCI (Chloroform-Isoamyl Alcohol) dimana Phenol-Chloroform berfungsi sebagai pelarut dari senyawa organik dan komponen lipid. Dengan dilakukannya ekstraksi menggunakan PCI maka setelah disentrifugasi terbentuklah 3 fase dimana terdiri dari fase air yang ada di paling atas, protein yang terkoagulasi di fase yang ada di tengah dan fase Phenol-Chloroform yang ada di paling bawah karena sifat chloroform yang berat jenisnya besar.
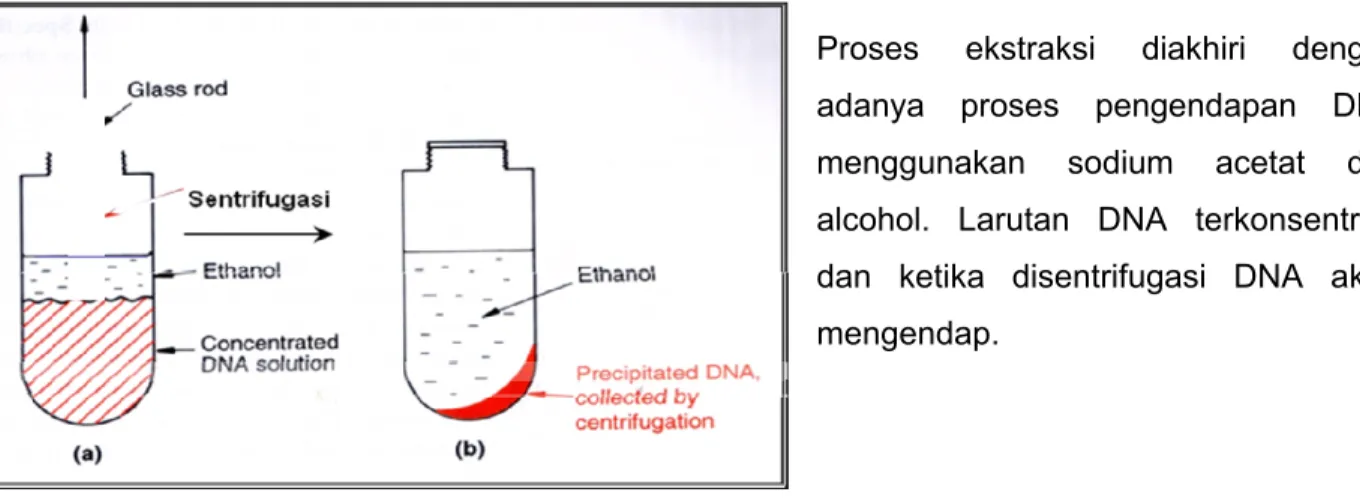
Proses ekstraksi diakhiri dengan adanya proses pengendapan DNA menggunakan sodium acetat dan alcohol. Larutan DNA terkonsentrasi dan ketika disentrifugasi DNA akan mengendap.
Gambar 3. Pemurnian DNA dengan Etanol
Pada praktikum kali ini dilakukan perbedaan prosedur terhadap tiga sampel larutan DNA. Prosedur pertama adalah semua prosedur dilakukan yaitu adanya penambahan RNA ase dan penambahan PCI. Prosedur kedua adalah adanya penambahan RNA ase tetapi ekstraksi dengan PCI tidak dilakukan. Sedangkan prosedur ketiga adalah sampel DNA dimana keduanya tidak ditambahkan baik RNA ase dan PCI. Penambahan RNA ase dilakukan dengan tujuan untuk mendapatkan DNA murni tanpa adanya RNA.
Analisis kemurnian DNA dan kuantifikasi DNA dengan spektrofotometer
Kuantitas DNA dapat dianalisis dengan menggunakan spektrofotometer. Pengukuran menggunakan spektrofotometer dilakukan dengan cara mengencerkan suspensi DNA plasmid dan membaca absorbansinya pada panjang gelombang 256 nm (pada umumnya 260 nm). TE atau H2O sebagai larutan pengencer dibaca sebagai blanko dan digunakan sebagai faktor
koreksi. Nilai absorbansi sampel (DNA) setelah dikoreksi oleh blanko, dikonversikan ke dalam konsentrasi, yaitu 1 OD260 = 50 mg DNA utas ganda tiap l (50 mg/l). Kualitas DNA dapat
dihitung dengan mengubah panjang gelombang yang digunakan untuk membaca absorbansi dari 260 nm lalu 280 nm. Perbandingan nilai absorbansi 260 nm terhadap absorbansi 280 nm mencerminkan kemurnian DNA terhadap kontaminasi protein. DNA tersebut dianggap murni dan bebas dari kontaminasi protein jika nilai rasio OD260/OD280 terletak antara 1.8 sampai
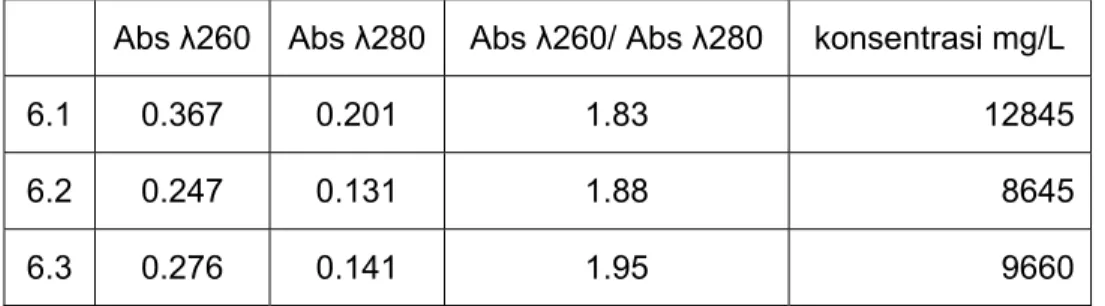
dengan 2.0. Dengan metode spektrofotometri diperoleh data sebagai berikut : Tabel 1. Nilai absorbansi larutan DNA pada panjang gelombang 260 dan 280
Abs λ260 Abs λ280 Abs λ260/ Abs λ280 konsentrasi mg/L 6.1 0.367 0.201 1.83 12845 6.2 0.247 0.131 1.88 8645 6.3 0.276 0.141 1.95 9660
Pada percobaan praktikum kali ini diketahui bahwa dengan penambahan PCI ataupun tidak, dengan penambahan RNA ase atau tidak, DNA tidak terkontaminasi protein bila dilihat dari hasil spektrofotometri, sehingga DNA tiap prosedur bisa dianggap murni. Dari konsentrasi yang diperoleh didapat bahwa DNA dengan ektraksi menggunakan PCI dan penambahan RNA ase lebih besar dari pada kedua prosedur lainnya.
Analisis kualitatif dan kuantifikasi DNA dengan elektroforesis gel agarosa
Analisis menggunakan gel agarose dilakukan dengan melakukan elektroforesis DNA sampel bersama dengan DNA penanda kuantitas. DNA penanda kuantitas pada umumnya berupa DNA lambda utuh yang pada praktikum kali ini diberikan dengan konsentrasi 10 ng/5 ul, 20 ng/5 ul, 40 ng/5 ul. Elektroforesis dilakukan sampai larutan pewarna menjauhi well. Untuk kuantifikasi, jarak migrasi yang ditempuh tidak perlu terlalu jauh dan untuk menganalisis bentuk DNA. Jarak migrasi yang ditempuh harus jauh dari well. Hal ini karena akan terjadi pemisahan DNA berdasarkan berat dan bentuk DNA. Berikut adalah foto hasil elektroforesis dari 3 prosedur yang berbeda.
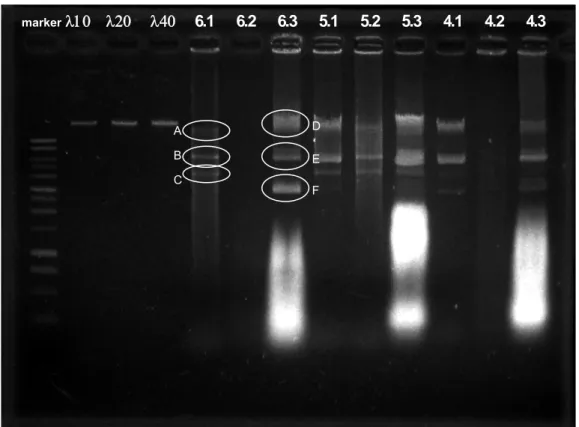
Hasil elektroforesis dapat dilihat pa gambar di baw F E D C B A marker λ10 λ20 λ40 6.1 6.2 6.3 5.1 5.2 5.3 4.1 4.2 4.3
Gambar 3. Hasil Elektrophoresis Isolasi Plasmid pada 1% Agarose gel.
Pada prosedur pertama terdapat tiga tipe pita DNA yaitu plasmid berbentuk superheliks (ccc = covalently closed circular) bermigrasi paling jauh dari well, pita DNA plasmid yang berada di tengah berbentuk linear, sedangkan yang bermigrasi paling dekat dengan well adalah pita DNA plasmid yang berbentuk open sirkuler. Semakin kompak suatu DNA maka akan bermigrasi semakin cepat sehingga pada saat yang bersamaan akan bermigrasi lebih jauh dibandingkan dengan bentuk yang kurang kompak. DNA superheliks lebih kompak dibandingkan dengan DNA plasmid dalam keadaan open sirkuler atau linier. Pada prosedur ketiga, selain ketiga pita tersebut, ada pita lain setelahnya, pita ini adalah pita RNA karena pada prosdur ketiga tidak ditambahkan RNA ase. Sedangkan pada prosedur kedua tidak terdapat pita, mungkin disebabkan kurangnya konsentrasi DNA yang dielusi.
Kuantitas DNA sampel juga dapat diketahui dengan membandingkan pendaran pita DNA sampel yang dianalisis dengan pendaran pita DNA penanda kuantitas. Berdasarkan gambar tersebut dapat dilihat bahwa pita-pita yang terbentuk apabila dibandingkan dengan pita penanda kuantitas maka pita A 5 ng/5 ul, pita B 15 ng/5 ul, pita C 5 ng/5 ul dan apabila dijumlahkan didapatkan 25 ng/5 ul atau 5 mg/l yang merupakan konsentrasi total dari prosedur pertama. Pada prosedur ketiga diperoleh, pita D 40 ng/5 ul, pita E 15 ng/5 ul, pita F 45 ng/5 ul, maka total diperoleh 100 ng/5 ul atau 20 mg/l, konsentrasi ini lebih sedikit apabila dibandingkan dengan hasil yang diperoleh dengan menggunakan metode spektrofotometri dimana prosedur
pertama menghasilkan DNA dengan konsentrasi 12845 mg/l dan prosedur ketiga sebesar 9660 mg/l. Dari hasil pada percobaan ini maka larutan DNA yang diperoleh dengan menggunakan prosedur ketiga dijadikan sebagai larutan yang akan direstriksi karena DNA yang dihasilkan konsentrasinya lebih banyak dibandingkan dengan prosedur lainnya berdasarkan DNA penanda kuantitas.
DNA adalah sesuatu yang tidak terlihat di dalam gel, sehingga perlu penambahan Ethidium Bromida yang pada umumnya digunakan untuk membuat pita DNA terlihat. Molekul Ethidium Bromida berinterkalasi di antara basa menyebabkan DNA berfluorosescens ketika gel dieluminasi dengan sinar ultraviolet akan tetapi proses tersebut akan sulit apabila proses destaining tidak dilakukan. Proses destaining ini dilakukan setelah proses staining yaitu dengan membilas gel agarose dengan akuades. Hal ini dimaksudkan untuk menghilangkan Etidium bromida yang terperangkap di dalam gel sehingga ketika dieluminasi oleh sinar UV hanya pita DNA yang terlihat karena DNA berikatan dengan Etidium Bromida melalui ikatan hidrohen. Restriksi
Hasil pemotongan DNA plasmid dengan beberapa enzim restriksi menghasilkan
pita-pita dengan ukuran basa yang berbeda dan unik sesuai dengan enzim restriksinya
masing-masing. pada praktikum diperoleh pita-pita hasil elektroforesis DNA plasmid
yang telah direstriksi.
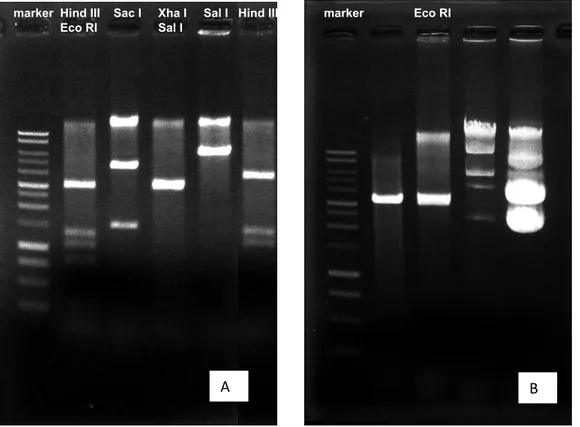
marker Eco RI marker Hind III Sac I Xha I Sal I Hind III
Eco RI Sal I
A B
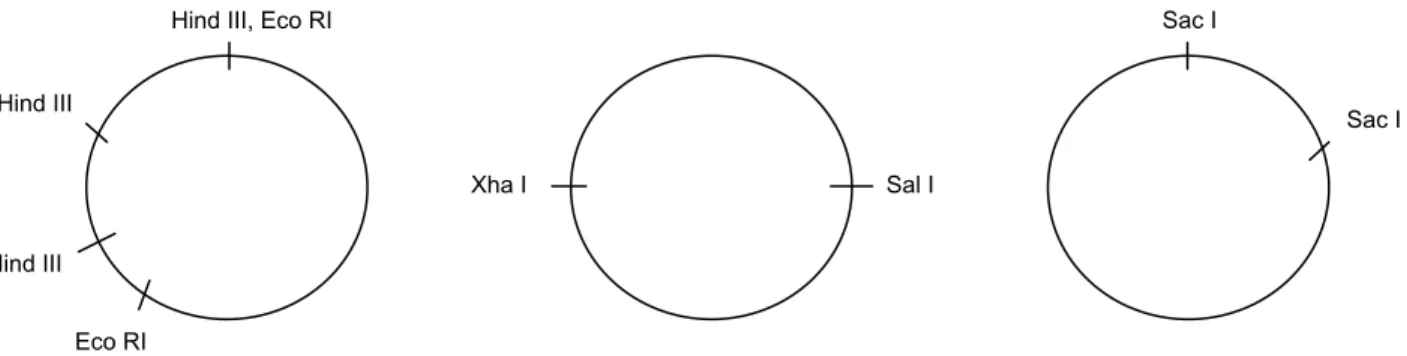
13 Gambar 4. Hasil elektroforesis restriksi plasmid menggunakan beberapa enzim restriksi
Dengan mengukur jarak migrasi pita-pita pada sumur marker maka diperoleh
persamaan yang akan digunakan untuk menentukan ukuran basa dari DNA plasmid
yang telah dipotong oleh enzim restriksi tertentu yang juga dengan menggunakan jarak
migrasi sebagai penuntun. Dari hasil penghitungan secara manual menggunakan alat
ukur penggaris, maka diperoleh data sebagai berikut:
bp log bp jarak (cm) 10000 4.00 2.4 8000 3.90 2.6 6000 3.77 2.9 5000 3.69 3.1 4000 3.60 3.3 3000 3.47 3.6 2500 3.39 3.8 2000 3.30 4.1 1500 3.17 4.5 1000 3.00 5.1 750 2.87 5.5 500 2.69 5.9 250 2.39 6.5 bp log bp jarak (cm) 10000 4.00 2.8 8000 3.90 2.95 6000 3.77 3.25 5000 3.69 3.4 4000 3.60 3.65 3000 3.47 3.95 2500 3.39 4.2 2000 3.30 4.5 1500 3.17 5 1000 3.00 5.6 750 2.87 6.1 500 2.69 6.7 250 2.39 7.5 Gambar 5. Grafik perbandingan jarak migrasi marker 1 kb ladder dengan log bp ukuran plasmid dari marker 1 kb ladder, foto A Gambar 4. Gambar 6. Grafik perbandingan jarak migrasi marker 1 kb ladder dengan log bp ukuran plasmid dari marker 1 kb ladder, foto B Gambar 4. Tabel 2. Jarak migrasi marker 1 kb ladder, foto A Gambar Tabel 3. Jarak migrasi marker 1 kb ladder, foto B Gambar 4. 4.
Dari persamaan diatas maka diperoleh ukuran plasmid dari masing-masing pita yang
direstriksi dari beberapa enzim tersebut, sebagai berikut:
Hind III + Eco RI: 3282 bp + 1238 bp + 1002 bp + 745 bp (total 6268 bp)
Sac I: 4606 bp + 1406 bp (total 6013 bp)
Xha I + Sal I: 3146 bp (total 6292 bp)
Sal I: 6197 bp (hanya memotong di satu tempat)
Hind III: 3727 bp + 1238 bp + 960 bp (total 5926 bp)
Eco RI: 3566 bp (memotong di dua tempat dimana ukuran plasmid hampir sama besar)
Apabila total ukuran plasmid diasumsikan sepanjang 6000 an bp, maka plasmid pada
percobaan restriksi ini, pemetaannya dapat digambarkan sebagai berikut:
Hind III, Eco RI
Hind III Hind III Eco RI Xha I Sal I Sac I Sac I
Gambar 7. Pemetaan plasmid pada pemotongan dengan menggunakan beberapa enzim restriksi
Elusi
Elusi dilakukan terhadap insert gen G α dari kedelai dan vektor pGEM T-Easy
yang diperoleh dari praktikum restriksi plasmid. Elektroforesis hasil elusi perlu dilakukan
untuk mengetahui ada atau tidaknya hasil elusi dan untuk menentukan konsentrasi hasil
elusi. Konsentrasi DNA hasil elusi perlu diketahui untuk menghitung volume insert yang
akan ditambahkan pada proses ligasi berdasarkan perbandingan insert dan vektor.
Jumlah insert yang ditambahkan pada reaksi ligasi menentukan peluang berhasil atau
tidaknya proses ligasi antara insert dan vektor.
Gambar elektroforesis hasil elusi pada praktikum ini dapat dilihat pada gambar di
bawah ini:
marker λ 1 2 3 4 5 6
Gambar 8. Elusi gen G α dari kedelai dan vektor pGEM T-Easy masing-masing kelompok
Ligasi
Ligasi adalah proses menghubungkan fragmen DNA yang berupa insert dan vektor dengan menggunakan enzim ligase. Cara kerja dari enzim ligase adalah dengan menghubungkan ujung 5’P dan ujung 3’OH dari fragmen lain. Pada proses ligasi, ada beberapa kemungkinan yang dapat terjadi: 1. vektor menyambung pada vektor itu sendiri, 2. vektor menyambung dengan vektor lain (terjadi ligasi antar vektor), 3. vektor menyambung dengan insert. Pada percobaan ini diharapkan yang terjadi adalah kemungkinan ketiga. Oleh karena itu pada percobaan ini dilakukan efisiensi dengan menambahkan enzim kinase yaitu alkalin fosfatase pada larutan vektor (belum dicampur dengan insert) untuk menghilangkan gugus P pada 5’P sehingga menjadi 5’OH (defosforilasi) sehingga diasumsikan kemungkinan yang pertama dan yang kedua tidak atau sedikit angka kejadiannya. Dengan berubahnya 5’P menjadi 5’OH, maka yang diharapkan terjadi vektor hanya berikatan dengan insert. 3’OH pada vektor akan menyambung pada 5’P insert, akan tetapi 3’OH insert tidak dapat menyambung ke vektor karena 5’P vektor telah berubah menjadi 5’OH sehingga terjadi nick atau celah. Meskipun terjadi celah, insert dan vektor tetap berikatan dan dapat ditransformasikan dimana celah ini nanti akan diperbaiki di dalam sel apabila berhasil ditransformasikan.
Gambar 9. Mekanisme Efisiensi Ligasi
Transformasi
E. coli dapat memasukkan DNA ekstrasel jika dinding selnya diubah sehingga DNA dapat
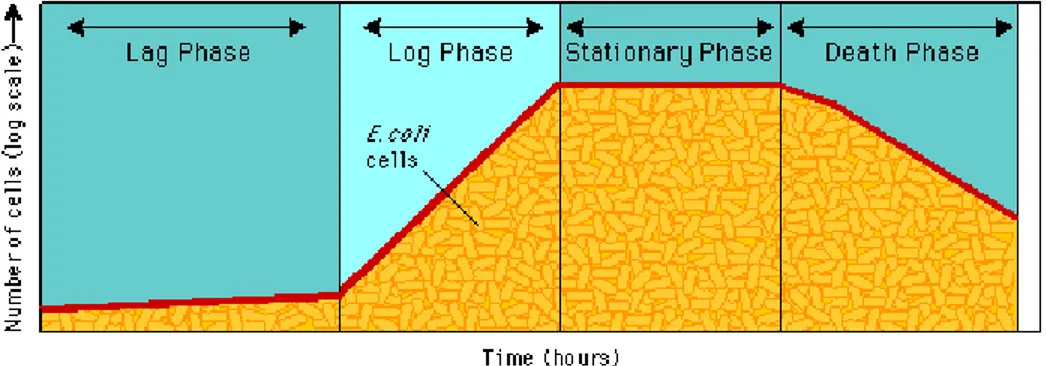
melewatinya dengan mudah. Sel dalam keadaan demikian disebut sel yang kompeten. Sel dibuat kompeten dengan suatu proses yang menggunakan kalsium klorida dan heat shock (kejutan panas). Sel yang berada pada tahap perumbuhan logaritmik lebih mudah untuk dibuat kompeten daripada sel yang berada pada tahap pertumbuhan yang lain. Laju pertumbuhan pada kultur bakteri tidaklah konstan. Pada beberapa jam pertama (lag phase), laju pertumbuhan sangat lambat karena sedikitnya jumlah bakteri awal yang membelah. Fase ini diikuti fase pertumbuhan logaritmik dimana terjadi laju pertumbuhan yang tinggi. Panjang waktu dari tiap-tiap fase pertumbuhan dipengaruhi oleh suhu inkubasi. Sel yang digunakan sebaiknya dalam fase logaritmik.
Gambar 10. Kurva yang menggambarkan fase-fase pertumbuhan bakteri; lag phase, log phase, stationary phase dan death phase.
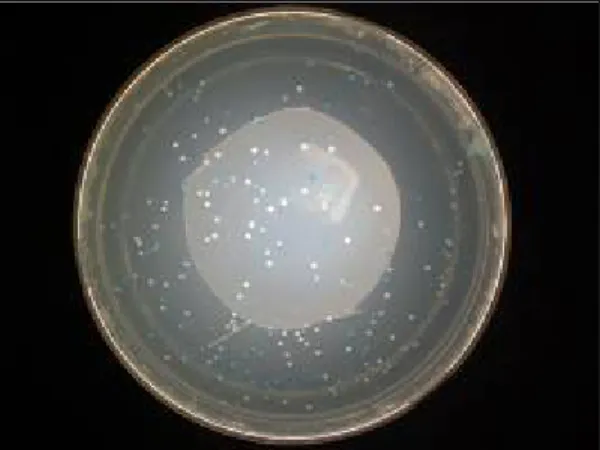
Dari hasil transformasi dapat dilihat dengan munculnya koloni putih dan biru pada media padat LA (Luria Bertani Agar) + 100 ug/ml Ampisilin + 100 ul 0,1 M IPTG + 20 ul 50 mg/ml X-Gal. Kontrol positif yang berupa sel kompeten yang diinokulasikan pada media LA saja ditumbuhi dengan koloni E. coli DH5α yang menunjukkan bahwa sel kompeten mampu tumbuh di media LA dan tidak terjadi kontaminasi. Sedangkan pada kontrol negatif yang berupa sel kompeten yang diinokulasikan pada media LA + Ampisilin tidak ditumbuhi E. coli DH5α menunjukkan bahwa sel kompeten yang belum disisipi oleh vektor PGEM T-Easy tidak dapat tumbuh pada media yang mengandung Ampisilin. Hal ini terjadi karena E. coli DH5α tipe asli tidak mempunyai gen resisten terhadap Ampisilin. Gen ini terdapat pada Vektor PGEM T-Easy yang merupakan gen spesifik yang dapat membedakan antara host yang sudah ditransformasi dan yang belum ditransformasi. Hanya E. coli DH5α yang telah disisipi DNA vektor yang dapat hidup pada media LA + Ampisilin.
Jika kedua proses berlangsung sempurna, maka tumbuhnya koloni pada media dapat dilihat seperti gambar berikut ini.
Gambar 11. Gambar Koloni Bakteri Hasil Transformasi
Pada gambar terlihat jelas terdapat koloni putih dan koloni biru. Koloni putih merupakan koloni
E. coli DH5α yang tersisipi vektor PGEM T-Easy + insert
gen G α dari kedelai
, sedangkankoloni biru merupakan koloni E. coli DH5α yang mungkin tersisipi oleh vektor PGEM T-Easy namun tidak tersisipi insert
gen G α dari kedelai
, bisa terjadi karena kemungkinan-kemungkinan yang terjadi pada proses ligasi, seperti vektor menyambung pada vektor itu sendiri atau vektor menyambung dengan vektor lain (terjadi ligasi antar vektor).Terbentuknya koloni putih-biru menggunakan prinsip kerja gen LacZ yang mengekspresikan β-galaktosidase. Pada vektor PGEM T-Easy terdapat Multiple Cloning Site (MCS) yang di antaranya terdapat gen LacZ. Pada gen LacZ terdapat lokasi pemotongan
19 enzim-enzim restriksi tertentu. Insert