commit to user
i
PEMBERIAN AUKSIN (2,4-D) DAN SITOKININ (BAP) SEBAGAI
PEMACU PEMBENTUKAN KALUS MABAI (Pongamia pinnata)
SECARA IN VITRO
Oleh
Martha Dwi Jayanti
H0708125
PROGRAM STUDI AGROTEKNOLOGI
FAKULTAS PERTANIAN UNIVERSITAS SEBELAS MARET
SURAKARTA
commit to user
ii
SECARA IN VITRO
SKRIPSI
untuk memenuhi sebagaian persyaratan guna memperoleh derajat Sarjana Pertanian
di Fakultas Pertanian Universitas Sebelas Maret
Oleh
Martha Dwi Jayanti H0708125
PROGRAM STUDI AGROTEKNOLOGI
FAKULTAS PERTANIAN UNIVERSITAS SEBELAS MARET SURAKARTA
commit to user
iii
PEMBERIAN AUKSIN (2,4-D) DAN SITOKININ (BAP) SEBAGAI PEMACU PEMBENTUKAN KALUS MABAI (Pongamia pinnata)
SECARA IN VITRO
Martha Dwi Jayanti H0708125
Pembimbing Utama: Pembimbing Pendamping
Dr. Samanhudi, SP, MSi Dr. Ir. Parjanto, MP NIP. 19680610 199503 1003 NIP. 19620323 198803 1001
Surakarta, September 2012
Dekan Fakultas Pertanian
commit to user
iv
PEMBERIAN AUKSIN (2,4-D) DAN SITOKININ (BAP) SEBAGAI PEMACU PEMBENTUKAN KALUS MABAI (Pongamia pinnata)
SECARA IN VITRO
yang dipersiapkan dan disusun oleh Martha Dwi Jayanti
H0708125
telah dipertahankan di depan Tim Penguji pada tanggal: 4 September 2012 dan dinyatakan telah memenuhi syarat untuk memperoleh gelar Sarjana Pertanian
Program Studi Agroteknologi
Susunan Tim Penguji
Ketua Anggota I Anggota II
commit to user
v
Puji syukur kehadirat Allah SWT atas segala rahmat dan karunia-Nya sehingga penulis dapat menyelesaikan skripsi dengan judul ”Pemberian Auksin (2,4-D) Dan Sitokinin (BAP) Sebagai Pemacu Pembentukan Kalus Mabai (Pongamia pinnata) Secara In Vitro”. Skripsi ini disusun untuk memenuhi persyaratan guna memperoleh gelar Sarjana Pertanian di Fakultas Pertanian Universitas Sebelas Maret Surakarta.
Dalam penulisan skripsi ini tentunya tidak lepas dari bantuan, bimbingan dan dukungan berbagai pihak, sehingga penulis tak lupa mengucapkan terima kasih kepada:
1. Prof. Dr. Ir. Bambang Pujiasmanto, MS selaku Dekan Fakultas Pertanian Universitas Sebelas Maret Surakarta.
2. Dr. Ir. Hadiwiyono, MSi selaku Ketua Program Studi Agroteknologi Fakultas Pertanian Universitas Sebelas Maret Surakarta.
3. Dr. Samanhudi, SP, MSi selaku Pembimbing Utama dan Pembimbing Akademik yang telah memberikan bimbingan, pengarahan, serta masukan untuk kelancaran penulisan skripsi ini.
4. Dr. Ir. Parjanto, MP selaku Pembimbing Pendamping yang telah memberikan masukan, pengarahan, serta saran demi lebih baiknya skripsi ini.
5. Ir. Sri Nyoto, MS selaku Dosen Pembahas yang telah memberikan saran dan masukan dalam penulisan skripsi ini.
6. Keluarga yang saya sayangi, ibunda Sri Wahyuni, ayahanda Drs. Kasidi, MSi, Erna Budhiarti, Septarini Nawangsih, dan Ainun Hidayah yang telah memberikan dukungan baik materi, semangat, maupun doa.
7. Anung Nugroho, Sekar Utami Putri, Syariffah Nur Aini, serta teman-teman Gocelu dan Solmated yang telah memberikan doa dan semangat yang luar biasa.
commit to user
vi
karena itu penulis mengharapkan kritik dan saran yang membangun untuk perbaikan dalam penyusunan skripsi ini. Akhirnya penulis berharap semoga skripsi ini dapat memberikan manfaat dan wawasan, serta pengetahuan baru bagi kita semua.
Surakarta, September 2012
commit to user xii RINGKASAN
PEMBERIAN AUKSIN (2,4 D) dan SITOKININ (BAP) SEBAGAI PEMACU PEMBENTUKAN KALUS MABAI (Pongamia pinnata) SECARA IN VITRO. Skripsi: Martha Dwi Jayanti (H0708125). Pembimbing: Samanhudi, Parjanto, Sri Nyoto. Program Studi: Agroteknologi, Fakultas Pertanian Universitas Sebelas Maret (UNS) Surakarta.
Ketergantungan masyarakat terhadap bahan bakar fosil dapat menyebabkan pemanasan global. Oleh karena itu, perlu adanya bahan bakar alternatif seperti mabai untuk mengurangi dampak buruk dari penggunaan bahan bakar fosil tersebut. Mabai memiliki keunggulan tersendiri dalam hal penyediaan bahan baku biodisel karena mudah tumbuh dan tahan kekeringan, tidak menjadi kompetitor dengan minyak makan, proses ekstraksi minyaknya mudah, serta ramah lingkungan. Penyediaan bibit dalam jumlah banyak dan waktu singkat perlu dilakukan dengan menggunakan teknik
in vitro dengan menambahkan 2,4-D dan BAP. Penelitian ini bertujuan untuk mendapatkan konsentrasi 2,4-D dan BAP yang paling tepat dalam pembentukan kalus mabai pada kultur in vitro.
Penelitian ini dilaksanakan di Laboratorium Fisiologi Tumbuhan dan Bioteknologi Fakultas Pertanian Universitas Sebelas Maret Surakarta mulai November 2011 sampai Juli 2012, menggunakan Rancangan Acak Lengkap (RAL) faktorial dengan dua faktor perlakuan dan tiga kali ulangan. Faktor pertama adalah konsentrasi 2,4-D dengan 4 taraf: 0.25, 0.5, 0.75, 1 ppm dan faktor kedua adalah konsentrasi BAP dengan 5 taraf: 0, 0.5, 1, 1.5, 2 ppm. Data hasil pengamatan dianalisis dengan uji F taraf 5%. Jika terdapat beda nyata, maka dilanjutkan dengan DMRT taraf 5%. Apabila terdapat data yang tidak dapat dihitung dengan statistik maka dianalisis secara deskriptif. Peubah yang diamati dalam penelitian ini antara lain: saat muncul kalus, tekstur kalus, warna kalus, saat muncul tunas, tinggi tunas, panjang akar, dan jumlah daun.
commit to user xiii SUMMARY
APPLICATION OF AUKSIN (2,4-D) AND CYTOKININ (BAP) AS INDUCER OF MABAI (Pongamia pinnata) CALLUS BY IN VITRO. Thesis. Martha Dwi Jayanti (H0708125). Advisers: Samanhudi, Parjanto, Sri Nyoto. Study program: Agrotechnology, Faculty of Agriculture, University of Sebelas Maret (UNS) Surakarta.
Human depends of fossil fuels can cause global warming. Therefore, the need for alternative fuels such as mabai can reduce the harm from the use of fossil fuels. Mabai has its own advantages in terms of raw material supply biodiesel because it is easy to grow and drought resistant, do not be a competitor with edible oil, the oil extraction process is easy, and good for environment. Provision of seeds in large quantities in a short time needs to be done by using the technique in vitro by adding 2,4-D and BAP. This study aims to obtain the concentration of 2,4-D and BAP that most appropriate in the formation of callus mabai in vitro culture.
This research was held in Plant Physiology and Biotechnology Laboratory of Agriculture Faculty, University of Sebelas Maret Surakarta from November 2011 until July 2012. It used factorial design with two factors and repeated for three times based on Completely Randomized Design. The first factor was 2,4-D concentrations with four levels: 0.25, 0.5, 0.75, 1 ppm and the second factor was BAP concentrations with five levels: 0, 0.5, 1, 1.5, 2 ppm. The observation data were analyzed with analysis of variance and if significant continued with DMRT test at 5% level. If there was a data that could not be calculated, it would be analyzed using descriptive statistics. Variables which are observed in this research are: when callus was induced, callus texture, callus color, induced shoot, shoot high, root length, and the total of leave.
commit to user
D. Pelaksanaan Penelitian ... 14
commit to user
viii
F. Panjang Akar ... 26
G. Jumlah Daun ... 27
V. KESIMPULAN DAN SARAN ... 30
A. Kesimpulan ... 30
B. Saran ... 30
DAFTAR PUSTAKA ... 31
commit to user
ix
DAFTAR TABEL
Nomor Judul dalam Teks Halaman
1. Pengaruh pemberian auksin (2,4-D) dan sitokinin (BAP) terhadap saat
muncul kalus (HST) pada kultur in vitro mabai ... 18
2. Pengaruh pemberian auksin (2,4-D) dan sitokinin (BAP) terhadap tekstur kalus pada kultur in vitro mabai ... 19
3. Pengaruh pemberian auksin (2,4-D) dan sitokinin (BAP) terhadap warna kalus pada kultur in vitro mabai ... 21
4. Rerata saat muncul tunas mabai pada berbagai konsentrasi 2,4-D secara in vitro ... 22 8. Hasil pengamatan saat muncul kalus (HST) ... 34
9. Hasil pengamatan tekstur kalus (60 HST) ... 35
10. Hasil pengamatan warna kalus (60 HST) ... 36
11. Hasil pengamatan saat muncul tunas (HST) ... 37
12. Hasil pengamatan tinggi tunas (60 HST) ... 38
13. Hasil pengamatan panjang akar (60 HST) ... 39
14. Hasil pengamatan jumlah daun (60 HST) ... 40
15. Hasil analisis uji F taraf 5% terhadap saat muncul kalus ... 41
16. Hasil analisis uji F taraf 5% terhadap tekstur kalus ... 41
17. Hasil analisis uji F taraf 5% terhadap warna kalus ... 41
18. Hasil analisis uji F taraf 5% terhadap saat muncul tunas ... 42
commit to user
x
21. Hasil analisis uji F taraf 5% terhadap jumlah daun ... 43
22. analisis uji DMRT 5% terhadap saat muncul tunas ... 44
23. analisis uji DMRT 5% terhadap tinggi tunas ... 44
24. analisis uji DMRT 5% terhadap panjang akar ... 44
commit to user
xi
DAFTAR GAMBAR
Nomor Judul dalam Teks Halaman
1. Kalus mabai dengan tekstur kompak ... 20 2. Kalus putih pada perlakuan 2,4-D 0,25 ppm dan BAP 0 ppm ... 22 3. Kalus hijau pada perlakuan 2,4-D 0,75 ppm dan BAP 2 ppm ... 22 4. Histogram pengaruh 2,4-D terhadap saat muncul tunas mabai (HST)
secara in vitro ... 23 5. Histogram pengaruh 2,4-D terhadap rerata tinggi tunas mabai secara in
vitro (60 HST) ... 25 6. Histogram pengaruh 2,4-D terhadap rerata panjang akar mabai secara in
vitro (60 HST) ... 27 7. Histogram pengaruh 2,4-D terhadap rerata jumlah daun mabai secara in
vitro (60 HST) ... 28 8. Daun yang mengalami kerontokan ... 29
Nomor Judul dalam Lampiran Halaman
commit to user
1
I. PENDAHULUAN
A.Latar Belakang
Kebutuhan dunia akan Bahan Bakar Minyak (BBM) saat ini terus bertambah seiring dengan pertambahan jumlah penduduk dan penggunaan barang dan alat berbahan bakar minyak. Saat ini, kebutuhan bahan bakar masyarakat masih tergantung pada bahan bakar fosil yang tidak dapat diperbaharui. Jika ketergantungan ini terus berlanjut, maka persediaan akan bahan bakar fosil semakin lama akan
semakin berkurang dan dalam kurun waktu tertentu akan habis.
Selain itu, penggunaan bahan bakar fosil yang berlebihan menyebabkan terjadinya pencemaran udara seperti timbulnya gas karbon dioksida (CO2), karbon monoksida (CO), nitrogen oksida (NOx), dan sulfur dioksida (SOx) yang dapat memacu terjadinya pemanasan global (Apriyanti 2010). Dengan adanya permasalahan-permasalahan tersebut, maka perlu adanya suatu upaya untuk mengurangi dampak-dampak yang ditimbulkan oleh penggunaan BBM yang berlebihan tersebut, salah satunya adalah dengan menggunakan bahan bakar alternatif.
Indonesia merupakan negara yang memiliki wilayah yang sangat luas dengan tanah yang subur sehingga banyak jenis tanaman yang dapat tumbuh dengan mudah disini. Selain itu, Indonesia juga kaya akan sumber daya alam hayati yang dapat dimanfaatkan sebagai bahan bakar alternatif yang ramah lingkungan dan dapat diperbaharui seperti tanaman mabai (Pongamia pinnata).
Tanaman mabai merupakan jenis tanaman dari famili Fabaceae yang toleran terhadap suhu tinggi hingga mencapai 50 oC. Tanaman ini dapat tumbuh pada ketinggian 0-1200 m dpl dengan curah hujan rata-rata 500-2500 mm/tahun. Mabai memiliki perakaran yang dalam dan memiliki kemampuan untuk memfiksasi
commit to user
penerangan. Dalam sebuah biji mabai terkandung minyak sebanyak 30-40% (Irwanto 2008). Oleh sebab itu, minyak dari biji mabai ini dapat juga digunakan sebagai bahan baku energi altenatif. Dari beberapa jenis tanaman yang digunakan sebagai bahan bakar nabati, tanaman mabai memiliki keunggulan tersendiri dalam hal penyediaan bahan baku biodisel karena mabai mudah tumbuh dan tahan kekeringan, tidak menjadi kompetitor dengan minyak makan, proses ekstraksi minyaknya mudah, serta ramah lingkungan.
Kultur jaringan merupakan salah satu cara perkembangbiakan tanaman secara
vegetatif dengan mengisolasi bagian tanaman dan menumbuhkannya pada media buatan dalam kondisi aseptik di dalam ruang yang terkontrol. Kultur jaringan tanaman merupakan alternatif budidaya pertanian yang memungkinkan peningkatan efektivitas dan produktivitas cara bertanam serta mempunyai beberapa keunggulan, antara lain bibit yang dihasilkan melalui metode ini mempunyai sifat identik dengan induknya, dapat diperbanyak dalam jumlah besar dan dalam waktu singkat, tidak membutuhkan tempat yang luas, kesehatan dan kualitas bibit lebih terjamin, serta kecepatan tumbuh bibit lebih cepat (Yunus et al. 2010).
B.Perumusan Masalah
commit to user
Berdasarkan uraian di atas, dapat dirumuskan permasalahan untuk dikaji sebagai berikut:
1. Berapakah konsentrasi auksin (2,4-D) dan sitokinin (BAP) yang paling tepat dalam pembentukan kalus mabai pada kultur in vitro?
2. Adakah interaksi penambahan auksin (2,4-D) dan sitokinin (BAP) terhadap pembentukan kalus mabai pada kultur in vitro?
C.Tujuan Penelitian
Tujuan penelitian ini adalah :
1. Mendapatkan konsentrasi auksin (2,4-D) dan sitokinin (BAP) yang paling tepat dalam pembentukan kalus mabai pada kultur in vitro.
commit to user II. TINJAUAN PUSTAKA
A.Tanaman Mabai (Pongamia pinnata)
Tanaman mabai termasuk legum karena dapat memfiksasi nitrogen dari udara. Klasifikasi tanaman mabai adalah: Domain: Eukaryota; Kingdom: Plantae; Subkingdom: Viridaeplantae; Phylum: Magnoliophyta; Subphylum: Euphyllophytina; Infraphylum: Radiatopses; Klas: Magnoliopsida; Subklas: Rosidae; Suborder: Fabanae; Order: Fabales; Famili: Fabaceae; Genus: Pongamia; Spesies: pinnata (L.)
Pierre; Nama botani: Pongamia pinnata (Bisby et al. 2008).
Mabai tumbuh alami di hutan dataran rendah pada tanah berkapur dan batu karang di pantai, sepanjang tepi hutan bakau dan sepanjang aliran dan sungai pasang surut. Pertumbuhan yang paling bagus dijumpai pada tanah liat berpasir, tetapi akan tumbuh juga pada tanah berpasir dan tanah liat yang bergumpal-gumpal. Sangat toleran pada kondisi salinitas tinggi dan alkalinitas. Mabai berperan dalam menyediakan dua sumber energi, yaitu: kayunya sebagai bahan bakar dalam memasak, sedangkan minyak yang berasal dari bijinya dimanfaatkan untuk penerangan. Kayunya juga menyediakan timber untuk lemari dan kereta beroda dan pulp kertas. Minyaknya digunakan sebagai pelumas, dimanfaatkan dalam industri penyamakan kulit tradisional di India, dan dalam pembuatan sabun, pernis dan cat (Irwanto 2008).
Mabai dideskripsikan sebagai semak atau pohon bercabang melebar. Daun menyirip gasal, merah muda saat muda, hijau tua mengkilap di atas dan hijau pudar dengan urat menonjol di bawah saat tua; anak daun membulat telur, menjorong atau melonjong. Perbungaan tandan dan berpasang-pasangan; mahkota bunga putih sampai merah muda, ungu di dalam, berurat kecoklatan di luar; membulat telur sungsang. Buahnya polong bertangkai pendek, menyerong-melonjong sampai
menjorong, tidak merekah bila masak, berbiji 1-2. Biji membulat telur (Pusat Penelitian dan Pengembangan Hutan Tanaman 2009).
commit to user
Pongamia pinnata adalah tanaman yang cepat tumbuh di lahan yang marjinal dan memiliki potensi sebagai sumber minyak yang tinggi. Hal ini dapat mendukung kesesuaian tanaman ini untuk produksi minyak nabati dalam skala besar yang diperlukan oleh industri biodiesel berkelanjutan. Keberhasilan masa depan Pongamia pinnata sebagai sumber bahan baku berkelanjutan untuk industri biofuel tergantung pada pengetahuan luas tentang genetika, fisiologi dan propagasi dari kacang-kacangan ini. Dalam penelitian khusus, harus ditargetkan untuk memaksimalkan penanaman yang berkaitan dengan biosintesis minyak (Scott 2008).
Dalam sebuah biji mabai, terkandung minyak sebanyak 30-40%. Oleh sebab itu, minyak dari biji mabai ini dapat juga digunakan sebagai bahan baku energi altenatif. Dari beberapa jenis tanaman yang digunakan sebagai bahan bakar nabati, tanaman mabai memiliki keunggulan tersendiri dalam hal penyediaan bahan baku biodisel karena mabai mudah tumbuh dan tahan kekeringan, tidak menjadi kompetitor dengan minyak makan, proses ekstraksi minyaknya mudah, kandungan minyaknya cukup tinggi, serta ramah lingkungan (Irwanto 2008).
Minyak biji mabai sebagai biofuel mempunyai sifat fisik yang hampir sama dengan diesel konvensional. Gas emisi yang dihasilkan oleh biofuel lebih bersih dibandingkan dengan diesel konvensional. Selain itu, biofuel tidak mengandung campuran polyaromatik dan mengurangi emisi dan gas beracun. Biofuel mengurangi kandungan sulfur yang dibutuhkan untuk penyulingan industri diesel. Di dalam biofuel terdapat spesifikasi penting dalam membantu pelumasan diesel yang rendah belerang. Spesifikasi titik api untuk biofuel lebih tinggi (> 550°C) dibandingkan diesel minyak bumi (350°C) (Wardiyono 2011).
B.Kultur Jaringan
Bioteknologi di bidang pertanian telah berkembang pesat, salah satu
commit to user
aseptis, penggunaan media kultur buatan dengan kandungan nutrisi lengkap, dan kondisi lingkungan kultur yang sesuai. Lingkungan yang sesuai dapat dipenuhi dengan menentukan media tumbuh yang sesuai dan penempatan pada kondisi yang terkendali berkaitan dengan intensitas dan periodisitas, cahaya, temperatur, dan kelembaban serta keharusan sterilisasi (Mattjik 2005).
Budidaya in vitro merupakan suatu budidaya di atas media dengan nutrisi dalam kondisi yang steril. Cara ini memiliki beberapa keunggulan seperti:
1. Jika suatu tanaman dewasa sulit diadakan perbanyakan in vivo, kerap kali masih
dapat diperbanyak secara in vitro.
2. Cloning in vitro dapat dikerjakan untuk memperoleh tanaman bebas pathogen (virus, jamur). Dalam kondisi ini, cloning in vitro jauh lebih capat daripada cloning in vivo.
3. Perbanyakan in vitro pada tanaman berbentuk herba dapat dijalankan sepanjang tahun dan tidak tergantung musim, sedangkan perbanyakan in vivo sangat dipengaruhi musim.
(Suryowinoto 1996).
Keberhasilan dalam teknologi serta penggunaan metode in vitro terutama disebabkan pengetahuan yang lebih baik tentang kebutuhan hara sel dan jaringan yang dikulturkan. Hara terdiri dari komponen yang utama dan komponen tambahan. Komponen utama meliputi garam mineral, sumber karbon (gula), vitamin dan pengatur tumbuh. Komponen lain seperti senyawa nitrogen organik, berbagai asam organik, metabolit dan ekstra tambahan tidak mutlak, tetapi dapat menguntungkan ketahanan sel dan perbanyakannya (Wetter 1991).
Di dalam praktek kultur jaringan tanaman dikenal 6 kelompok zat pengatur tumbuh, yaitu auksin, giberelin, sitokinin, asam absisik (ABA), etilen dan retardan (Wattimena et al. 1991). Perbandingan antara sitokinin dan auksin menentukan tipe
commit to user
akar atau tunas tidak selalu sama baik antar spesies atau genus tidak ada patokan yang sama (Wardiyati 1998).
Untuk memecahkan masalah pengadaan bibit tanaman secara besar-besaran dan penanaman secara masal dalam rangka memenuhi kebutuhan konsumen yang semakin meningkat dapat dipenuhi dengan kultur in vitro. Di Negara-negara maju seperti Jepang, Eropa, dan AS kultur aseptik telah umum digunakan sebagai sarana perbanyakan tanaman terutama untuk tanaman buah-buahan (Purbiati dan Triatminingsih 1992).
Problem utama berkaitan dengan proses pertumbuhan adalah bila eksplan yang ditanam mengalami stagnasi, dari mulai tanam hingga kurun waktu tertentu tidak mati tetapi tidak tumbuh. Untuk menghindari hal itu dapat dilakukan dengan preventif menghindari bahan tanam yang tidak juvenil atau tidak meristematik. Karena awal pertumbuhan eksplan akan dimulai dari sel-sel yang muda yang aktif membelah, atau dari sel-sel tua yang muda kembali. Media juga dapat menjadi sebab terjadinya stagnasi pertumbuhan, karena dari kondisi medialah suatu sel dapat atau tidak terdorong melakukan proses pembelahan dan pembesaran dirinya (Nugroho 1996).
C.Media MS
Keberhasilan dalam teknologi serta penggunaan metode in vitro terutama disebabkan oleh pengetahuan tentang kebutuhan hara sel dan jaringan yang dikulturkan. Kebutuhan hara tersebut dipenuhi dalam suatu media. Komposisi media yang digunakan tergantung dengan jenis tanaman yang akan diperbanyak. Media yang digunakan biasanya terdiri dari garam mineral, vitamin, dan hormon. Selain itu, diperlukan juga bahan tambahan seperti agar, gula, dan lain-lain. Zat pengatur tumbuh (hormon) yang ditambahkan juga bervariasi, baik jenisnya maupun
commit to user
Komposisi media yang digunakan dalam kultur jaringan dapat berbeda jenis bahan kimia atau konsentrasinya. Perbedaan komposisis media dapat mengakibatkan perbedaan pertumbuhan dan perkembangan eksplan yang ditumbuhkan secara in vitro. Media Murashige dan Skoog (MS) sering digunakan karena cukup memenuhi unsur hara makro, mikro dan vitamin untuk pertumbuhan tanaman (Marlina 2004).
D.Auksin dan Sitokinin
Auksin dan sitokinin merupakan zat pengatur tumbuh yang sering digunakan
dalam kultur jaringan. Sitokinin dan auksin dalam keseimbangan yang tepat berpengaruh terhadap proses organogenesis (Winarsih dan Priyono 2000). Perbandingan konsentrasi sitokinin lebih besar dari auksin, maka hal ini akan memperlihatkan stimulasi pertumbuhan tunas dan daun. Sebaliknya apabila sitokinin lebih rendah dari auksin maka hal ini akan mengakibatkan stimulasi pada pertumbuhan akar (Abidin 1990).
Sitokinin berperan sebagai perangsang pertumbuhan sel dalam jaringan yang disebut eksplan dan merangsang pertumbuhan tunas daun. Namun kadar sitokinin yang optimal untuk pertumbuhan tunas, dapat menghambat pertumbuhan serta pembentukan kalus. Sedangkan auksin berperan dalam merangsang pembelahan dan pembesaran sel yang terdapat pada pucuk tanaman dan menyebabkan pertumbuhan pucuk-pucuk baru (Wetherell 1982).
Pada penelitian Setiawan (2010) disebutkan bahwa perlakuan BAP 1 ppm pada yeast 2 g/l dan air kelapa 250 ml/l memberikan persentase kemunculan tunas yang terbanyak yaitu 66,7% dengan pertumbuhan yang lambat. Sedangakan perlakuan penggunaan BAP 0.5 ppm dengan penambahan yeast 2 g/l merupakan konsentrasi yang paling baik dalam pembentukan panjang tunas tertinggi yaitu 5 mm. Rata-rata saat muncul tunas tercepat eksplan lengkeng pada perlakuan pemberian
BAP 1 ppm dengan penambahan air kelapa 250 ml/l yaitu 29 HST.
commit to user
lebih berhasil karena sifat kimianya yang mantap dan pengaruhnya yang lebih lama. Sedangkan 2,4-D merupakan golongan auksin sintesis yang mempunyai sifat lebih stabil daripada IAA, karena tidak mudah terurai oleh enzim-enzim yang dikeluarkan oleh sel atau pemanasan pada saat proses sterilisasi (Hendaryono dan Wijayani 1994). Pengatur tumbuh dibutuhkan untuk menginduksi pembelahan sel. Senyawa yang paling sering digunakan adalah asam 2,4-diklorofenoksiasetat (2,4-D) dan asam naftalenasetat (NAA). Baik 2,4-D maupun NAA amat lambat diuraikan oleh sel tumbuhan, dan stabil pada pemanasan dengan autoklaf. Sitokinin seperti kinetin atau
benziladenin kadang-kadang dibutuhkan bersama 2,4-D atau NAA untuk mendapatkan pembentukan kalus yang baik (Wetter 1991).
Penelitian Widyarso (2010) menyebutkan bahwa penggunaan berbagai konsentrasi BAP dan IBA maupun tanpa BAP dan IBA mampu membentuk kalus pada eksplan lengkeng dengan warna putih kecoklatan, bertekstur intermediet, dan berukuran sedang, tetapi belum mampu berdiferensiasi membentuk tunas. Sedangkan perlakuan penggunaan BAP 0,5 ppm tanpa IBA merupakan konsentrasi yang paling optimal dalam pembentukan jumlah tunas terbanyak 3 buah dan panjang tunas tertinggi 8 mm.
Penambahan auksin dalam jumlah yang lebih besar, atau penambahan auksin yang lebih stabil, seperti asam 2,4-D cenderung menyebabkan terjadinya pertumbuhan kalus dari eksplan dan menghambat regenerasi pucuk tanaman. Pemakaian zat pengatur tumbuh asam 2,4-D biasanya digunakan dalam jumlah kecil dan dalam waktu yang singkat, antara 2-4 minggu karena merupakan auksin kuat, artinya auksin ini tidak dapat diuraikan di dalam tubuh tanaman (Hendaryono dan Wijayani 1994).
Pada penelitian Setyaningrum (2010) telah disebutkan bahwa konsentrasi BAP 2 ppm dan 2,4-D 0,25 ppm paling optimal untuk menginduksi kalus tanaman
commit to user
kombinasi BAP 0,5 ppm dengan penambahan 2,4-D 0,25 ppm memberikan saat muncul tunas tercepat yaitu 6 HST.
Penelitian Sitepu (2007) menyebutkan bahwa pemberian zat pengatur tumbuh BAP pada kultur tunas stroberi menunjukkan pengaruh terhadap parameter umur muncul akar dengan rataan tercepat pada B2 (3,27 hari), jumlah tunas dengan rataan terbanyak pada B3 dan B4 (1,91 hari), jumlah akar dengan rataan terbanyak pada B4 (2.31 buah), jumlah daun dengan rataan terbanyak pada B3 (3,48 buah), berat eksplan dengan rataan terberat pada B4 (1,44 g) namun tidak berpengaruh terhadap parameter
umur muncul tunas, umur muncul akar, tinggi tunas, panjang akar
E.Kalus
Kalus adalah sekumpulan sel amorphous (tidak berbentuk atau belum terdiferensiasi) yang terbentuk dari sel-sel yang membelah terus menerus secara in vitro atau di dalam tabung. Kalus dapat diperoleh dari bagian tanaman seperti akar, batang dan daun. Secara histologi, kalus berasal dari pembelahan berkali-kali sel-sel parenkim di sekitar berkas pengangkut dan beberapa elemen penyusun berkas pengangkut kecuali xilem. Dalam teknik kultur jaringan (in vitro), kalus dapat diinduksi dengan menambahkan zat pengatur tumbuh yang sesuai pada media kultur, misalnya auksin dan sitokinin yang disesuaikan. Induksi kalus dalam teknik kultur jaringan tanaman diperlukan untuk memunculkan keragaman sel somatik di dalam kultur in vitro dan meregenerasikan sel tersebut menjadi embrio somatik (Anonim 2010).
Tanaman dapat diperbanyak secara vegetatif menggunakan teknik kultur in vitro dengan teknik kultur kalus atau kultur sel. Jika suatu eksplan ditanam pada medium padat atau dalam medium cair yang sesuai, dalam waktu 2-4 minggu, tergantung spesiesnya, akan terbentuk massa kalus yaitu suatu massa amorf yang
commit to user
sebagian kalus dan memindahkannya pada medium baru. Dengan sistem induksi yang tepat kalus dapat berkembang menjadi tanaman yang utuh (planlet) (Yuwono 2008).
Beberapa kalus ada yang mengalami pembentukan lignifikasi sehingga kalus tersebut mempunyai tekstur yang keras dan kompak. Namun ada kalus yang tumbuh terpisah-pisah menjadi fragmen-fragmen yang kecil, kalus yang demikian dikenal dengan kalus remah (friable). Warna kalus dapat bermacam-macam tergantung dari jenis sumber eksplan itu diambil, seperti warna kekuning-kuningan, putih, hijau, atau kuning kejingga-jingaan (Luri 2009).
Kultur kalus memiliki potensial morfogenetik yang bervariasi. Kalus yang diperoleh dari beberapa jenis tanaman atau dari berbagai jenis eksplan seringkali gagal beregenerasi membentuk tunas, atau hanya mampu membentuk akar, namun bukan berarti tanaman tersebut tidak dapat diregenerasikan dari kalus rekalsitran, tetapi hanya memerlukan medium, zat pengatur tumbuh serta lingkungan yang memadai untuk proses regenerasinya. Kalus pada beberapa jenis tanaman menghendaki waktu yang cukup lama untuk beregenerasi (Yunus et al. 2010).
F. Hipotesis
commit to user III. METODE PENELITIAN
A.Waktu dan Tempat Penelitian
Penelitian ini dilaksanakan mulai bulan November 2011 sampai Juli 2012 di Laboratorium Fisiologi Tumbuhan dan Bioteknologi Fakultas Pertanian Universitas Sebelas Maret Surakarta.
B.Bahan dan Alat Penelitian
1. Alat Penelitian
Alat-alat yang digunakan dalam penelitian ini antara lain: botol kultur, bunsen, Laminar Air Flow Cabinet (LAFC), petridish, pinset, scalpel, timbangan analitik, plastik PP 0,3, botol semprot, karet gelang, magnetik stirer, beker glass, erlenmeyer, pH meter, autoklaf, pipet ukur, rak kultur, labu takar, dan
thermoshaker.
2. Bahan Penelitian
Bahan-bahan yang digunakan dalam penelitian ini antara lain: eksplan dari stek mikro tanaman mabai, media Murashige and Skoog (MS), aquades, chlorox, fungisida, bakterisida, spirtus, auksin (2,4-D), dan sitokinin (BAP).
C.Perancangan Penelitian dan Analisis Data
Penelitian ini menggunakan Rancangan Acak Lengkap (RAL) yang disusun secara faktorial dengan 2 faktor. Faktor ke-1 mempunyai 4 taraf perlakuan, sedangkan faktor ke-2 mempunyai 5 taraf perlakuan.
a. Faktor 1: Konsentrasi auksin (2,4-D) dengan 4 taraf perlakuan, yaitu: A1 : 0,25 ppm
A2 : 0,5 ppm
A3 : 0,75 ppm A4 : 1 ppm
commit to user
b. Faktor 2: Konsentrasi sitokinin (BAP) dengan 5 taraf perlakuan, yaitu: B0 : 0 ppm
B1 : 0,5 ppm B2 : 1 ppm B3 : 1,5 ppm B4 : 2 ppm
Pada penelitian ini diuji 20 perlakuan faktorial :
commit to user
Analisis data dilakukan menggunakan Annova (Uji F) dengan taraf nyata 5% untuk menguji pengaruh perlakuan dan Uji DMRT 5% untuk menguji perbedaan rata-rata perlakuan. Data-data yang tidak memenuhi kaidah statistika dianalisis secara deskriptif.
D.Pelaksanaan Penelitian
1. Pembuatan Larutan Stok
Larutan stok dibuat dengan menimbang bahan-bahan kimia, hara makro,
maupun hara mikro sesuai komposisi media MS untuk dibuat larutan stok. Kemudian bahan-bahan tersebut dilarutkan dengan aquades dan diaduk sampai homogen dengan magnetic stirer, kemudian dimasukkan dalam botol yang diberi label pada tiap botolnya sesuai dengan perlakuan dan disimpan dalam lemari pendingin.
2. Pembuatan Media Tanam
Pembuatan media tanam dilakukan dengan mengambil dan menakar masing-masing larutan stok sesuai dengan perlakuan dan ukuran yang telah ditentukan serta menambahkan Zat Pengatur Tumbuh sesuai perlakuan, kemudian memasukkannya ke dalam labu takar. Bahan-bahan tersebut dilarutkan dengan aquades sampai volume larutan mencapai 1 liter. Kemudian ditambahkan gula sebanyak 30 g. Larutan dimasukkan dalam beker glass dan diaduk serta dididihkan dengan menggunakan magnetic stirer dan hot plate.
Setelah itu dilakukan pengukuran pH larutan. pH media diatur pada kisaran 5,8-6,2. Apabila pH terlalu rendah ditambahkan dengan NaOH dan bila pH terlalu tinggi ditambahakan dengan HCl. Setelah pH telah sesuai, larutan ditambahkan bahan pemadat media yaitu agar-agar sebanyak 8 g. Setelah semua larutan terlarut, maka tahap selanjutnya adalah mendidihkan larutan tersebut,
commit to user
Setelah selesai, botol diangkat dari autoklaf dan ditempatkan di ruang inkubasi agar media menjadi padat. Apabila media telah memadat, maka penanaman eksplan dapat dilakukan.
3. Sterilisasi Alat
Alat-alat yang harus disterilkan diantaranya adalah botol kultur, petridish, scalpel, dan pinset. Alat-alat tersebut dicuci sampai bersih dengan menggunakan sabun cuci kemudian dikeringkan. Setelah kering dibungkus dengan kertas koran (kecuali botol kultur) lalu dimasukkan ke dalam autoklaf pada tekanan 1,5 Psi
(kg/cm2), pada suhu 121 oC selama 45 menit. 4. Sterilisasi Eksplan dan Penanaman
Bagian dari tanaman yang digunakan sebagai eksplan adalah stek mikro tanaman mabai. Eksplan diperoleh dengan memotong bagian hipokotil tanaman mabai yang telah ditumbuhkan secara in vitro dengan menggunakan bahan tanam berupa biji mabai. Pemotongan dilakukan di dalam LAFC (Laminar Air Flow Cabiner) dengan menggunakan pisau scalpel dan pinset yang steril. Selanjutnya eksplan dimasukkan dalam aquades streril, kemudian dilanjutkan dengan sterilisasi dalam larutan chlorox yang telah dicampur aquades dan dibilas aquades steril.
Penanaman eksplan juga dilakukan di dalam LAFC yang telah dibersihkan dengan alkohol 70% dan ruang LAFC disemprot formalin atau spirtus. Eksplan yang telah disterilisasi kemudian ditanam pada media tanam di dalam botol kultur, kemudian ditutup kembali dengan plastik PP. Botol-botol yang telah selesai diberi label sesuai dengan perlakuan dan tanggal penanaman. 5. Pemeliharaan
Pemeliharaan dilakukan untuk meminimalisasi risiko kontaminasi dengan menyemprotkan spirtus ke botol-botol kultur setiap 2 hari sekali, membersihkan
commit to user E.Pengamatan Peubah
1. Saat muncul kalus
Saat muncul kalus diamati dan dicatat pada saat munculnya kalus pertama kali yang dinyatakan dalam HST (hari setelah tanam).
2. Tekstur kalus
Tekstur kalus dicatat pada akhir pengamatan (60 HST) dengan mengamati tekstur kalus yang terbentuk, apakah termasuk kalus yang kompak atau remah.
3. Warna kalus
Warna kalus dicatat pada akhir pengamatan (60 HST) dengan mengamati secara visual warna kalus yang terbentuk. Penentuan warna kalus ditetapkan berdasarkan subyektivitas skoring dari pengamat.
4. Saat muncul tunas
Pengamatan munculnya tunas dilakukan setiap 2 hari pada tiap-tiap botol kultur dengan menghitung berapa hari tunas sudah mulai muncul atau tumbuh. Saat muncul tunas ditentukan dalam HST (Hari Setelah Tanam).
5. Tinggi tunas
Tinggi tunas diamati pada akhir pengamatan (60 HST). Tinggi tunas dinyatakan dalam centimeter (cm).
6. Panjang akar
Panjang akar diamati pada akhir pengamatan (60 HST) dengan mengukur dari pangkal akar yang terbentuk hingga ujung akar. Panjang akar dinyatakan dalam centimeter (cm).
7. Jumlah daun
commit to user
17
A. Saat Muncul Kalus
Kalus merupakan jaringan yang tersusun oleh sel-sel yang belum terdiferensiasi. Pada umumnya kalus dihasilkan oleh jaringan yang luka atau eksplan yang ditanam dalam kultur jaringan (Yunus et al. 2010). Pertumbuhan kalus pada eksplan ditandai dengan munculnya tonjolan-tonjolan kecil yang menyebabkan eksplan membengkak pada jaringan di sekitar luka ke bagian
tengah eksplan, kemudian jaringan membesar dan mengembang serta bertambah banyak (Hidayat 2007).
Terbentuknya kalus pada eksplan menunjukkan suatu fase awal dari pertumbuhan eksplan tersebut. Kalus pertama kali muncul dari bagian jaringan tertentu, selanjutnya berkembang membentuk gumpalan jaringan yang belum mengalami diferensiasi. Pada beberapa kultur in vitro terdapat kalus yang langsung mengalami diferensiasi membentuk organ, namun ada juga yang tidak mengalami diferensiasi sehingga perlu diberikan perlakuan yang berbeda. Adapun proses terbentuknya kalus sampai ke tahap diferensiasi berbeda-beda, bergantung macam dan bagian tanaman yang digunakan sebagai eksplan, metode kultur in vitro, serta zat-zat yang ditambahkan dalam medium dasar (Suryowinoto 1996). Saat muncul kalus diamati setiap 2 hari sekali.
commit to user
Pada tabel 1 dapat dilihat bahwa tidak semua perlakuan dapat memunculkan kalus pada akhir pengamatan (60 HST). Pada penelitian ini, tidak terdapat menginduksi kalus dengan waktu tercepat, yakni 10 HST.
Gustian (2009) mengatakan bahwa secara umum penambahan auksin pada konsentrasi rendah akan memacu pembentukan kalus. Sedangkan Pada kadar yang tinggi, auksin lebih bersifat menghambat daripada merangsang pertumbuhan. Hal ini diperkuat dengan pernyataan Karjadi (2007) yang menyatakan bahwa auksin dalam konsentrasi rendah akan menstimulasi pembesaran dan perpanjangan sel setelah terjadinya pembelahan sel yang distimulir oleh sitokinin.
Pada perlakuan A3B4 (2,4-D 0,75 ppm dan BAP 2 ppm) kalus masih dapat terbentuk pada 14 HST. Meskipun pemberian auksin dengan konsentrasi tinggi dapat menghambat pembentukan kalus, namun sitokinin yang ditambahkan dengan konsentrasi tinggi (2 ppm) diduga mampu menginduksi kalus pada Mabai. Hal ini sesuai dengan pernyataan Yusnita (2004) yang mengatakan bahwa
commit to user
Salah satu penentu yang digunakan untuk menilai kualitas suatu kalus adalah tekstur kalus. Tekstur kalus yang remah dianggap baik karena memudahkan dalam pemisahan menjadi sel-sel tunggal pada kultur suspensi dan juga dapat meningkatkan aerasi oksigen antar sel. Secara umum, tekstur kalus dapat dibedakan menjadi tiga macam, yaitu : kompak (non friable), intermediet, dan remah (friable) (Turhan 2004). Tekstur pada kalus dapat bervariasi dari kompak hingga remah bergantung pada jenis tanaman yang digunakan sebagai
eksplan, komposisi nutrisi medium, zat pengatur tumbuh, dan lingkungan tumbuh. Kalus yang dihasilkan pada media inisiasi akan mengalami kematian setelah lama berada dalam media karena nutrisi dalam media semakin lama semakin berkurang/habis.
Pada hasil analisis uji F taraf 5% terhadap tekstur kalus (Tabel 16 pada Lampiran 2) dapat dilihat bahwa tidak terdapat interaksi antara 2,4-D dengan BAP (non significant). Hal ini sesuai dengan hasil penelitian Nisa dan Rodinah (2008) yang menyatakan bahwa interaksi campuran NAA dan kinetin pada kultivar pisang tidak berpengaruh nyata terhadap saat pembentukan kalus. Hal ini terjadi kemungkinan karena pembentukan kalus pada bakal buah pisang hanya dipengaruhi oleh kandungan auksin saja. Pemberian 2,4-D maupun BAP, masing-masing juga tidak berpengaruh nyata terhadap tekstur kalus. Hasil analisis deskriptif pada variabel tekstur kalus dapat dilihat pada Tabel 2 berikut ini.
Tabel 2. Pengaruh pemberian auksin (2,4-D) dan sitokinin (BAP) terhadap tekstur kalus
pada kultur in vitro mabai
commit to user
kalus tersebut mempunyai tekstur yang keras dan kompak. Menurut Ertina et al. (2011) pembentukan kalus terjadi karena adanya pelukaan yang diberikan pada eksplan, sehingga sel-sel pada eksplan akan memperbaiki sel-sel yang rusak tersebut. Pada awalnya terjadi pembentangan dinding sel dan penyerapan air, sehingga sel akan membengkak dan selanjutnya terjadi pembelahan sel.
Gambar 1. Kalus mabai dengan tekstur kompak.
Kalus dengan tekstur kompak dicirikan oleh susunan antar sel-sel kalus yang sulit dipisahkan, disamping itu partikel-partikel yang menyusun kalus membentuk tonjolan-tonjolan padat. Sebaliknya kalus dengan tekstur remah memiliki ciri khusus seperti partikel-partikel penyusun kalus mudah sekali dipisahkan dan kelompok-kelompok selnya memiliki susunan yang renggang (Widyarso 2010).
C. Warna Kalus
commit to user
2) menunjukkan bahwa tidak terdapat interaksi antara 2,4-D dengan BAP (non significant). Selain itu, pemberian 2,4-D maupun BAP, masing-masing juga tidak berpengaruh nyata terhadap warna kalus. Sedangkan hasil analisis deskriptif pada variabel warna kalus dapat dilihat pada Tabel 3 berikut ini.
Tabel 3. Pengaruh pemberian auksin (2,4-D) dan sitokinin (BAP) terhadap warna kalus menumbuhkan kalus, terdapat 3 kombinasi perlakuan yang memiliki warna kalus putih. Sedangkan 1 kombinasi perlakuan lainnya, yaitu kombinasi perlakuan 2,4-D 0,75 ppm dengan BAP 1,5 ppm menghasilkan warna kalus hijau. Kalus yang berwarna putih merupakan jaringan embrionik yang belum mengandung kloroplas. Sedangkan kalus yang berwarna hijau dan mengandung klorofil biasanya merupakan tempat munculnya tunas (Winarni 2012).
Perbedaan warna kalus menunjukan tingkat perkembangan dari kalus. Guntur et al (2004) menyatakan bahwa morfologi kalus (warna dan tekstur kalus) dari waktu ke waktu mengalami perubahan seiring dengan berkurangnya unsur hara dan zat pengatur tumbuh yang terdapat dalam media tanam. Perubahan warna
commit to user
Gambar 2. Kalus putih pada perlakuan Gambar 3. Kalus hijau pada perlakuan 2,4-D 0,25 ppm dan BAP 0 ppm. 2,4-D 0,75 ppm dan BAP 2 ppm.
Perbedaan warna kalus menunjukkan tingkat perkembangan kalus yang berbeda-beda. Menurut Hanifah (2007), pada penambahan sitokinin dengan kosentrasi yang semakin meningkat cenderung menunjukkan warna hijau (cerah) pada kalus lebih tahan lama. Warna hijau pada kalus adalah akibat efek sitokinin dalam pembentukan klorofil. Dalam hal ini, sitokinin yang diberikan adalah BAP dengan konsentrasi 2 ppm.
D. Saat Muncul Tunas
Tunas merupakan bagian vegetatif dari tanaman yang tumbuh untuk melangsungkan keturunan pada tanaman tersebut. Terbentuknya tunas merupakan
salah satu indikator yang menunjukkan terjadinya proses pertumbuhan pada suatu tanaman. Semakin cepat tunas terbentuk mengindikasikan semakin cepatnya
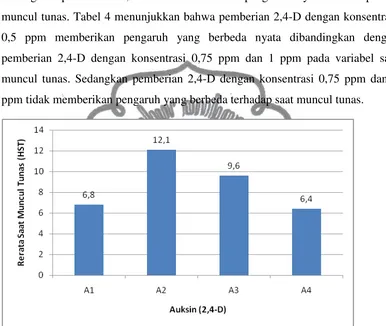
eksplan dalam menyerap unsur hara yang terdapat dalam media. Rerata saat muncul tunas dalam kultur mabai dapat dilihat pada Tabel 4 berikut.
Tabel 4. Rerata saat muncul tunas mabai pada berbagai konsentrasi 2,4-D secara in vitro
2,4-D (ppm) Rerata
0,25 5,6 ab
0,5 10,27 b
0,75 4,13 a
1 3,07 a
commit to user
bahwa pemberian BAP tidak berpengaruh nyata (non significant) terhadap saat muncul tunas. Selain itu juga tidak terdapat interaksi antara BAP dengan 2,4-D. Sedangkan pemberian 2,4-D dalam media berpengaruh nyata terhadap saat muncul tunas. Tabel 4 menunjukkan bahwa pemberian 2,4-D dengan konsentrasi 0,5 ppm memberikan pengaruh yang berbeda nyata dibandingkan dengan pemberian 2,4-D dengan konsentrasi 0,75 ppm dan 1 ppm pada variabel saat muncul tunas. Sedangkan pemberian 2,4-D dengan konsentrasi 0,75 ppm dan 1
ppm tidak memberikan pengaruh yang berbeda terhadap saat muncul tunas.
Keterangan : A1=2,4-D 0,25 ppm; A2=2,4-D 0,5 ppm; A3=2,4-D 0,75 ppm; A4=2,4-D 1
ppm; HST = hari setelah tanam; ppm = part per million.
Gambar 4. Histogram pengaruh 2,4-D terhadap saat muncul tunas mabai (HST) secara in vitro.
Pada penelitian ini, saat muncul tunas justru lebih dipengaruhi oleh pemberian 2,4-D. Hal ini dimungkinkan karena sitokinin endogen yang terdapat dalam eksplan sudah mencukupi untuk pembentukan tunas sehingga sitokinin eksogen (BAP) yang ditambahkan pada media kultur tidak berpengaruh terhadap kemunculan tunas. Pada gambar 4 dapat dilihat bahwa 2,4-D dengan konsentrasi 1 ppm mampu menginduksi kalus dengan waktu tercepat, yakni 6,4 HST.
commit to user
auksin endogen yang terdapat pada eksplan telah mampu mendorong pembentukan tunas, sehingga hanya membutuhkan auksin dengan konsentrasi yang tidak terlalu tinggi dalam pembentukan tunas tersebut. Namun pada penelitian ini, pemberian 2,4-D dengan konsentrasi yang tinggi (1 ppm) justru mampu memunculkan tunas dengan waktu yang lebih cepat (6,4 HST) dibandingkan dengan pemberian 2,4-D dengan konsentrasi yang lebih rendah (0,5 ppm) yang memunculkan tunas dalam waktu yang lebih lama (12,1 HST).
Hal ini dimungkinkan karena masing-masing eksplan yang digunakan mengandung auksin dengan kadar yang berbeda sehingga interaksi auksin eksogen (2,4-D) yang diberikan pada tanaman menghasilkan respon yang bervariasi terhadap masing-masing eksplan. Hal ini sesuai dengan pernyataan Samanhudi (2010) yang menyatakan bahwa dalam eksplan telah terkandung auksin endogen yang kadarnya tidak persis sama. Keseragaman ukuran dan cara pengambilan eksplan kemungkinan besar tidak diikuti dengan keseragaman hormon endogen tanaman sehingga penambahan auksin eksogen ke dalam media kultur akan menimbulkan respon yang bervariasi.
E. Tinggi Tunas
Tinggi tunas merupakan salah satu indikator dari pertumbuhan eksplan. Pengukuran tinggi tunas dilakukan pada akhir pengamatan (60 HST) dengan mengukur tinggi tunas yang terbentuk mulai dari pangkal hingga titik tumbuh tertinggi. Analisis uji F taraf 5% (Tabel 19 pada Lampiran 2) menunjukkan bahwa pemberian BAP tidak berpengaruh nyata (non significant) terhadap tinggi tunas. Selain itu juga tidak terdapat interaksi antara BAP dengan 2,4-D. Sedangkan pemberian 2,4-D dalam media berpengaruh nyata terhadap tinggi tunas. Rerata
commit to user
0,25 0,84 b
0,5 0,99 b
0,75 0,39 ab
1 0,09 a
Keterangan : Angka yang diikuti huruf yang sama menunjukkan tidak berbeda nyata pada DMRT 5%.
Konsentrasi 2,4-D 0,25 ppm dan 0,5 ppm memberikan pengaruh yang tidak berbeda terhadap tinggi tunas. Sementara konsentrasi 2,4-D 0,5 ppm dibandingkan dengan konsentrasi 2,4-D 1 ppm memberikan pengaruh yang berbeda terhadap tinggi tunas. Hal ini dimungkinkan karena eksplan yang digunakan sudah mengandung sitokinin dalam jumlah yang cukup untuk menginduksi tunas sehingga hanya dibutuhkan penambahan auksin (2,4-D) dalam konsentrasi yang kecil untuk pembentukan tunas tanpa penambahan sitokinin eksogen (BAP).
Keterangan : A1=2,4-D 0,25 ppm; A2=2,4-D 0,5 ppm; A3=2,4-D 0,75 ppm; A4=2,4-D 1
ppm; HST = hari setelah tanam; ppm = part per million.
Gambar 5. Histogram pengaruh 2,4-D terhadap rerata tinggi tunas mabai secara in vitro (60 HST).
commit to user
yang lebih tinggi (1 ppm) justru akan menghambat pertumbuhan tunas. Auksin (2,4-D) berperan dalam pemanjangan sel tanaman yang mengakibatkan semakin tingginya tunas yang terbentuk. Hal ini sesuai dengan pernyataan Heddy (1996) yang menyatkaan bahwa auksin dapat merangsang perpanjangan sel yang akan berakibat terhadap perpanjangan koleoptil dan batang.
F. Panjang Akar
Akar merupakan bagian dari tanaman yang berfungsi untuk menyerap nutrisi dari media tanam untuk disalurkan ke seluruh tubuh tanaman. Semakin terdapat interaksi antara BAP dengan 2,4-D. Sedangkan pemberian 2,4-D dalam media berpengaruh nyata terhadap panjang akar. Rerata panjang akar yang terbentuk dalam kultur mabai dapat dilihat pada Tabel 6 berikut.
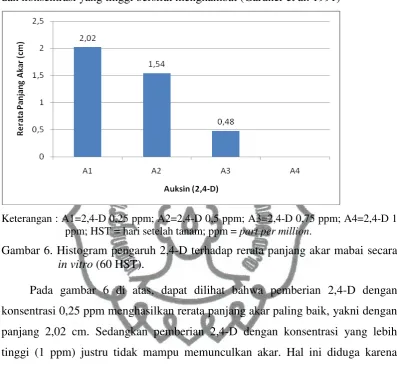
Tabel 6. Rerata panjang akar mabai pada berbagai konsentrasi 2,4-D secara in vitro
2,4-D Rerata
0,25 0,88 b
0,5 0,92 b
0,75 0,16 ab
1 0,00 a
Keterangan : Angka yang diikuti huruf yang sama menunjukkan tidak berbeda nyata pada DMRT 5%.
commit to user
dan konsentrasi yang tinggi bersifat menghambat (Gardner et al. 1991)
Keterangan : A1=2,4-D 0,25 ppm; A2=2,4-D 0,5 ppm; A3=2,4-D 0,75 ppm; A4=2,4-D 1
ppm; HST = hari setelah tanam; ppm = part per million.
Gambar 6. Histogram pengaruh 2,4-D terhadap rerata panjang akar mabai secara
in vitro (60 HST).
Pada gambar 6 di atas, dapat dilihat bahwa pemberian 2,4-D dengan konsentrasi 0,25 ppm menghasilkan rerata panjang akar paling baik, yakni dengan panjang 2,02 cm. Sedangkan pemberian 2,4-D dengan konsentrasi yang lebih tinggi (1 ppm) justru tidak mampu memunculkan akar. Hal ini diduga karena
pemberian auksin dengan konsentrasi rendah mampu mempercepat pertumbuhan akar. Sementara pemberian auksin dalam konsentrasi yang lebih tinggi justru akan menghambat pertumbuhan akar. Semakin cepat akar terbentuk, maka semakin cepat pula akar tersebut menyerap unsur hara yang terkandung dalam media sehingga daerah jangkauan akar akan semakin jauh.
G. Jumlah Daun
commit to user akhir pengamatan, yaitu pada 60 HST.
Analisis uji F taraf 5% (Tabel 21 pada Lampiran 2) menunjukkan bahwa pemberian BAP tidak berpengaruh nyata (non significant) terhadap jumlah daun. Selain itu juga tidak terdapat interaksi antara BAP dengan 2,4-D. Sedangkan pemberian 2,4-D dalam media berpengaruh nyata terhadap jumlah daun. Rerata jumlah daun pada kultur mabai dapat dilihat pada tabel 7 berikut ini.
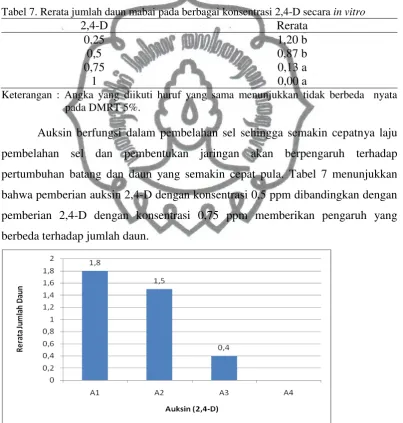
Tabel 7. Rerata jumlah daun mabai pada berbagai konsentrasi 2,4-D secara in vitro
2,4-D Rerata
0,25 1,20 b
0,5 0,87 b
0,75 0,13 a
1 0,00 a
Keterangan : Angka yang diikuti huruf yang sama menunjukkan tidak berbeda nyata pada DMRT 5%.
Auksin berfungsi dalam pembelahan sel sehingga semakin cepatnya laju pembelahan sel dan pembentukan jaringan akan berpengaruh terhadap pertumbuhan batang dan daun yang semakin cepat pula. Tabel 7 menunjukkan bahwa pemberian auksin 2,4-D dengan konsentrasi 0,5 ppm dibandingkan dengan pemberian 2,4-D dengan konsentrasi 0,75 ppm memberikan pengaruh yang berbeda terhadap jumlah daun.
Keterangan : A1=2,4-D 0,25 ppm; A2=2,4-D 0,5 ppm; A3=2,4-D 0,75 ppm; A4=2,4-D 1
ppm; HST = hari setelah tanam; ppm = part per million.
Gambar 7. Histogram pengaruh 2,4-D terhadap rerata jumlah daun mabai secara
commit to user
0,25 ppm mampu menghasilkan rerata jumlah daun tertinggi (1,8 helai). Hal ini berkaitan dengan panjang akar yang terbentuk. Pada pemberian 2,4-D dengan konsentrasi 0,25 ppm, panjang akar yang dihasilkan memiliki rerata paling tinggi, yakni 2,02 cm. Semakin panjang akar yang terbentuk akan mengakibatkan semakin luas jangkauan akar dalam menyerap nutrisi yang terdapat dalam media sehingga pertumbuhan daun juga akan semakin baik dengan menghasilkan jumlah daun yang semakin banyak. Sedangkan pada pemberian 2,4-D dengan konsentrasi
1 ppm tidak menghasilkan akar maupun daun. Hal ini diduga karena tidak adanya akar yang digunakan sebagai media penyerapan nutrisi sehingga daun juga tidak dapat terbentuk.
Gambar 8. Daun yang mengalami kerontokan.
commit to user
30
A. Kesimpulan
Berdasarkan hasil penelitian ini dapat diambil kesimpulan sebagai berikut: 1. Perlakuan yang mampu memunculkan kalus adalah 2,4-D 0,25 ppm dan BAP 0
ppm; 2,4-D 0,25 ppm dan BAP 0,5 ppm; 2,4-D 0,25 ppm dan BAP 1 ppm; serta 2,4-D 0,75 ppm dan BAP 2 ppm.
2. Saat muncul kalus tercepat ditunjukkan oleh perlakuan 2,4-D 0,25 ppm dengan
BAP 0 ppm.
3. Pemberian 2,4-D dan BAP menghasilkan tekstur kalus yang kompak.
4. Kalus terbaik diperoleh dari perlakuan 2,4-D 0,75 ppm dengan BAP 2 ppm yang menghasilkan warna kalus hijau.
5. Pemberian 2,4-D berpengaruh nyata terhadap saat muncul tunas, tinggi tunas, panjang akar, dan jumlah daun; sedangkan pemberian BAP dan interaksi antara 2,4-D dengan BAP tidak berpengaruh nyata terhadap saat muncul tunas, tinggi tunas, panjang akar, dan jumlah daun.
B. Saran
commit to user Lampiran 1. Hasil pengamatan
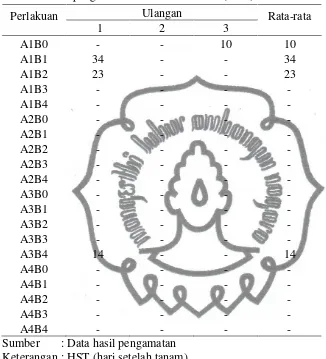
Tabel 8. Hasil pengamatan saat muncul kalus (HST)
Perlakuan Ulangan Rata-rata
1 2 3
A1B0 - - 10 10
A1B1 34 - - 34
A1B2 23 - - 23
A1B3 - - - -
A1B4 - - - -
A2B0 - - - -
A2B1 - - - -
A2B2 - - - -
A2B3 - - - -
A2B4 - - - -
A3B0 - - - -
A3B1 - - - -
A3B2 - - - -
A3B3 - - - -
A3B4 14 - - 14
A4B0 - - - -
A4B1 - - - -
A4B2 - - - -
A4B3 - - - -
A4B4 - - - -
commit to user Tabel 9. Hasil pengamatan tekstur kalus (60 HST)
Perlakuan Ulangan Rata-rata
1 2 3
A1B0 - - 1 1
A1B1 1 - - 1
A1B2 1 - - 1
A1B3 - - - -
A1B4 - - - -
A2B0 - - - -
A2B1 - - - -
A2B2 - - - -
A2B3 - - - -
A2B4 - - - -
A3B0 - - - -
A3B1 - - - -
A3B2 - - - -
A3B3 - - - -
A3B4 1 - - 1
A4B0 - - - -
A4B1 - - - -
A4B2 - - - -
A4B3 - - - -
A4B4 - - - -
Sumber : Data hasil pengamatan
commit to user Tabel 10. Hasil pengamatan warna kalus (60 HST)
Perlakuan Ulangan Rata-rata
1 2 3
A1B0 - - 1 1
A1B1 1 - - 1
A1B2 1 - - 1
A1B3 - - - -
A1B4 - - - -
A2B0 - - - -
A2B1 - - - -
A2B2 - - - -
A2B3 - - - -
A2B4 - - - -
A3B0 - - - -
A3B1 - - - -
A3B2 - - - -
A3B3 - - - -
A3B4 2 - - 2
A4B0 - - - -
A4B1 - - - -
A4B2 - - - -
A4B3 - - - -
A4B4 - - - -
Sumber : Data hasil pengamatan
commit to user Tabel 11. Hasil pengamatan saat muncul tunas (HST)
Perlakuan Ulangan Rata-rata
1 2 3
A1B0 6 6 - 6
A1B1 11 8 7 8,6
A1B2 9 18 - 13,5
A1B3 - - - -
A1B4 5 4 10 6,3
A2B0 11 - 18 14,5
A2B1 10 5 5 6,7
A2B2 - 18 8 13
A2B3 6 6 12 8
A2B4 9 25 21 18,3
A3B0 21 7 - 14
A3B1 13 - - 13
A3B2 - - - -
A3B3 - - - -
A3B4 21 - - 21
A4B0 14 - - 14
A4B1 - - - -
A4B2 - - - -
A4B3 - - - -
A4B4 - 18 - 18
commit to user Tabel 12. Hasil pengamatan tinggi tunas (60 HST)
Perlakuan Ulangan Rata-rata
1 2 3
A1B0 1,3 2 - 1,65
A1B1 1 1 1,2 1,07
A1B2 2,6 1 - 1,8
A1B3 - - - -
A1B4 0,5 0,5 1,5 0,83
A2B0 1,2 - 1,3 1,75
A2B1 0,3 0,6 4,8 2,9
A2B2 - 0,7 0,3 0,5
A2B3 1,2 1,5 0,8 1,17
A2B4 1,1 0,2 0,8 0,7
A3B0 1 1,3 - 1,15
A3B1 0,2 - - 0,2
A3B2 - - - -
A3B3 - - - -
A3B4 3,4 - - 3,4
A4B0 0,2 - - 0,2
A4B1 - - - -
A4B2 - - 0,5 0,5
A4B3 - - - -
A4B4 - 0,6 - 0,6
commit to user Tabel 13. Hasil pengamatan panjang akar (60 HST)
Perlakuan Ulangan Rata-rata
1 2 3
A1B0 1,7 4,5 - 3,1
A1B1 - 2,5 - 2,5
A1B2 4 - - 4
A1B3 - - - -
A1B4 - 0,5 - 0,5
A2B0 - - - -
A2B1 0,8 1,2 3,1 1,7
A2B2 1,8 - 3,6 2,7
A2B3 - - 1,9 1,9
A2B4 1,4 - - 1,4
A3B0 1,6 - - 1,6
A3B1 - - - -
A3B2 - 0,8 - 0,8
A3B3 - - - -
A3B4 - - - -
A4B0 - - - -
A4B1 - - - -
A4B2 - - - -
A4B3 - - - -
A4B4 - - - -
commit to user Tabel 14. Hasil pengamatan jumlah daun (60 HST)
Perlakuan Ulangan Rata-rata
1 2 3
A1B0 2 2 - 2
A1B1 1 - 3 2
A1B2 4 2 - 3
A1B3 - - - -
A1B4 1 3 - 2
A2B0 - - - -
A2B1 - 1 2 1,5
A2B2 - 3 1 2
A2B3 3 - 1 2
A2B4 - - 2 2
A3B0 - 1 - 1
A3B1 - - - -
A3B2 - - - -
A3B3 - - - -
A3B4 1 - - 1
A4B0 - - - -
A4B1 - - - -
A4B2 - - - -
A4B3 - - - -
A4B4 - - - -
commit to user Lampiran 2. Hasil analisis uji F taraf 5%
Tabel 15. Hasil analisis uji F taraf 5% terhadap saat muncul kalus.
Sumber keragaman Jumlah kuadrat
Derajat bebas
Kuadrat
tengah F hitung Signifikan Jumlah perlakuan 614,000a 19 32,316 0,828 0,664
Keterangan : Signifikan > 0,05 = tidak berpengaruh nyata (non significant)
Tabel 16. Hasil analisis uji F taraf 5% terhadap tekstur kalus.
Sumber keragaman Jumlah kuadrat
Derajat bebas
Kuadrat
tengah F hitung Signifikan
Jumlah perlakuan 1,067a 19 0,056 0,842 0,648
Keterangan : Signifikan > 0,05 = tidak berpengaruh nyata (non significant)
Tabel 17. Hasil analisis uji F taraf 5% terhadap warna kalus.
Sumber keragaman Jumlah kuadrat
Derajat bebas
Kuadrat
tengah F hitung Signifikan
Jumlah perlakuan 1,917a 19 0,101 0,865 0,624
commit to user
Tabel 18. Hasil analisis uji F taraf 5% terhadap saat muncul tunas.
Sumber keragaman Jumlah kuadrat
Derajat bebas
Kuadrat
tengah F hitung Signifikan Jumlah perlakuan 1184,067a 19 62,319 1,359 0,203
Keterangan : Signifikan > 0,05 = tidak berpengaruh nyata (non significant)
Tabel 19. Hasil analisis uji F taraf 5% terhadap tinggi tunas.
Sumber keragaman Jumlah kuadrat
Derajat bebas
Kuadrat
tengah F hitung Signifikan
Jumlah perlakuan 18,141a 19 0,955 1,277 0,251
Keterangan : Signifikan > 0,05 = tidak berpengaruh nyata (non significant)
Tabel 20. Hasil analisis uji F taraf 5% terhadap panjang akar.
Sumber keragaman Jumlah kuadrat
Derajat bebas
Kuadrat
tengah F hitung Signifikan
Jumlah perlakuan 27,221a 19 1,433 1,409 0,177
commit to user
Tabel 21. Hasil analisis uji F taraf 5% terhadap jumlah daun.
Sumber keragaman Jumlah kuadrat
Derajat bebas
Kuadrat
tengah F hitung Signifikan
Jumlah perlakuan 25,517a 19 1,343 1,520 0,131
Intersep 18,150 1 18,150 20,547 0,000
2,4-D 14,983 3 4,994 5,654 0,003
BAP 1,767 4 0,442 0,500 0,736
2,4-D * BAP 8,767 12 0,731 0,827 0,623
Galat 35,333 40 0,883
Total 60,850 59
commit to user Lampiran 3. Hasil analisis uji DMRT 5%
Tabel 22. Hasil analisis uji DMRT 5% terhadap saat muncul tunas.
2,4-D N Subset
Tabel 23. Hasil analisis uji DMRT 5% terhadap tinggi tunas.
2,4-D N Subset
Tabel 24. Hasil analisis uji DMRT 5% terhadap panjang akar.
commit to user
Tabel 25. Hasil analisis uji DMRT 5% terhadap jumlah daun
2,4-D N Subset
1 2
dimension1
1 15 0,0000
0.75 15 0,1333
0.5 15 0,8667
0.25 15 1,2000
commit to user
Lampiran 4. Perhitungan penambahan 2,4-D dan BAP dalam media
a. Penambahan 2,4-D dalam media
1) Penentuan volume 2,4-D dengan konsentrasi 0,25 ppm dalam 1 liter media : V1 x M1 = V2 x M2
V1 x 100 = 1000 ml x 0,25 ppm V1 = 2,5 ml
2) Penentuan volume 2,4-D dengan konsentrasi 0,5 ppm dalam 1 liter media : V1 x M1 = V2 x M2
V1 x 100 = 1000 ml x 0,5 ppm V1 = 5 ml
3) Penentuan volume 2,4-D dengan konsentrasi 0,75 ppm dalam 1 liter media : V1 x M1 = V2 x M2
V1 x 100 = 1000 ml x 0,75 ppm V1 = 7,5 ml
4) Penentuan volume 2,4-D dengan konsentrasi 1 ppm dalam 1 liter media : V1 x M1 = V2 x M2
V1 x 100 = 1000 ml x 1 ppm V1 = 10 ml
b. Penambahan BAP dalam media
1) Penentuan volume BAP dengan konsentrasi 0 ppm dalam 1 liter media : V1 x M1 = V2 x M2
V1 x 100 = 1000 ml x 0 ppm V1 = 0 ml
2) Penentuan volume BAP dengan konsentrasi 0,5 ppm dalam 1 liter media : V1 x M1 = V2 x M2
commit to user
3) Penentuan volume BAP dengan konsentrasi 1 ppm dalam 1 liter media : V1 x M1 = V2 x M2
V1 x 100 = 1000 ml x 1 ppm V1 = 10 ml
4) Penentuan volume BAP dengan konsentrasi 1,5 ppm dalam 1 liter media : V1 x M1 = V2 x M2
V1 x 100 = 1000 ml x 1,5 ppm V1 = 15 ml
5) Penentuan volume BAP dengan konsentrasi 2 ppm dalam 1 liter media : 6) V1 x M1 = V2 x M2
commit to user Lampiran 5. Dokumentasi penelitian mabai
Gambar 9. Foto hasil penelitian mabai
Biji mabai Pembibitan mabai
commit to user Gambar 10. Foto akhir pengamatan penelitian mabai
2,4-D 0,25 ppm+BAP 0 ppm 2,4-D 0,25 ppm+BAP 0,5 ppm 2,4-D 0,25 ppm+BAP 1 ppm
2,4-D 0,25 ppm+BAP 1,5 ppm 2,4-D 0,25 ppm+BAP 2 ppm 2,4-D 0,5 ppm+BAP 0 ppm
2,4-D 0,5 ppm+BAP 0,5 ppm 2,4-D 0,5 ppm+BAP 1 ppm 2,4-D 0,5 ppm+BAP 1,5 ppm
commit to user
2,4-D 0,75 ppm+BAP 1 ppm 2,4-D 0,75 ppm+BAP 1,5 ppm 2,4-D 0,75 ppm+BAP 2 ppm
2,4-D 1 ppm+BAP 0ppm 2,4-D 1 ppm+BAP 0,5 ppm 2,4-D 1 ppm+BAP 1ppm