i
PENGARUH HORMON ALAMI DENGAN TINGKAT KONSENTRASI
DAN LAMA PERENDAMAN TERHADAP PERTUMBUHAN
STEK BATANG TANAMAN TIN (Ficus carica L.)
PROPOSAL SKRIPSI
Diusulkan oleh:
NURUL ILMI SANTOSO NIM. 13.112.004
PROGRAM STUDI AGROTEKNOLOGI FAKULTAS PERTANIAN UNIVERSITAS MUHAMMADIYAH GRESIK
ii
HALAMAN PENGESAHAN
Judul Skripsi : Pengaruh Hormon Alami dengan Tingkat Konsentrasi dan Lama Perendaman terhadap Pertumbuhan Stek Batang Tanaman Tin (Ficus carica L.)
Nama : Nurul Ilmi Santoso
NIM : 13.112.004
Program Studi : Agroteknologi
Menyetujui, Dosen Pembimbing
Pembimbing I Pembimbing II
Ir. Suhaili, M.Si Rohmatin Agustinas, SP., MP.
NIP. 01 119 409 025 NIP. 01 111 503 170
Mengetahui,
Dekan Fakultas Pertanian Universitas Muhamadiyah Gresik
iii DAFTAR ISI
HALAMAN SAMPUL ... i
HALAMAN PENGESAHAN ... ii
DAFTAR ISI ... iii
BAB1: PENDAHULUAN……….. 1
1.1 Latar Belakang ... 1
1.2 Rumusan Masalah... 3
1.3 Tujuan ... 4
1.4 Hipotesis ... 4
BAB 2 : TINJAUAN PUSTAKA ... 5
2.1 Taksonomi Tanaman Tin ... 5
2.2 Morfologi Tanaman Tin ... 5
2.2.1 Akar ... ... 5
2.2.2 Tunas ……… 6
2.2.3 Daun…... 6
2.2.4 Batang…. ... 7
2.2.5 Buah ... 8
2.3 Syarat Tumbuh ... 9
2.4 Perbanyakan Vegetatif ……… 10
iv
2.6 Hormon... ... 11
2.6.1 Hormon Air Kelapa ... 12
2.6.2 Hormon Urine Sapi ... 13
2.7 Perendaman Hormon Stek... 15
BAB 3 : METODE PENELITIAN………16
3.1 Waktu dan tempat ... 16
3.2 Alat dan Bahan ... 16
3.3 Metode Penelitian ... 16
3.4 Pelaksanaan Penelitian ... 19
3.4.1Persiapan………..… 19
3.4.2 Penyiapan media tanam ………... 19
3.4.3Persiapan Hormon ………...… 20
3.4.4Pemilihan bahan stek………... 21
3.4.5 Pembuatan stek ……….. 21
3.4.6Penanaman ………. 21
3.4.7 Pemeliharaan ………. 22
3.4 Analisis Data.. ... 26
v
DAFTAR GAMBAR
Gambar 1: Daun Tanaman tin (Ficus carica L.)……… 7
Gambar 2: Buah tin Green jordan……… 9
Gambar 3: Mekanisme Pembentukan Akar..……….… 12
Gambar 4: Irisan membujur bagian apikal tajuk tumbuhan dikotil……… 12
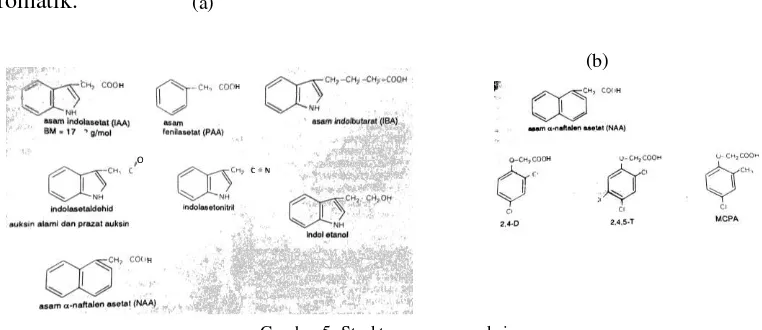
Gambar 5: Struktur Senyawa Auksin ……… 18
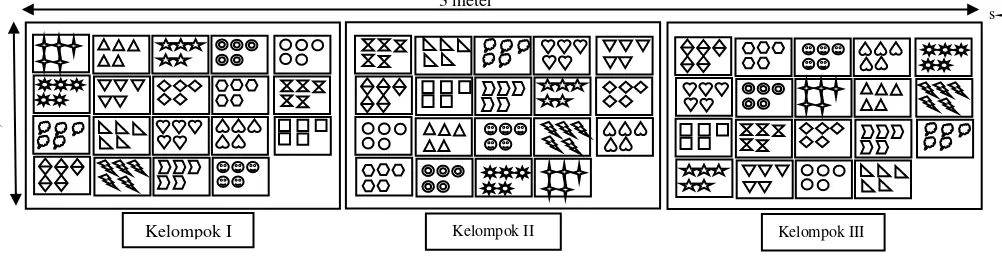
Gambar 6: Gambar Denah Percobaan ……….……….. 19
Gambar 7 : Stek Batang Pemotongan Satu Sisi ……….... 21
Gambar 8: Perendaman Stek Batang Tanaman Tin………22
vi RINGKASAN
Tanaman tin merupakan salah satu tanaman introduksi yang mulai dikenal dan berkembang di Indonesia. Tanaman tin banyak dimanfaatkan sebagai tanaman hias dan obat sehingga permintaan akan komoditi ini semakin meningkat tiap tahunnya. Perbanyakan tanaman tin salah satunya dapat dilakukan dengan stek batang. Namun pada prosesnya terdapat kendala yang dihadapi berupa pertumbuhan tunas dan akar yang lamban karena faktor internal berupa ketersediaan hormon endogen bahan stek yang sedikit kadarnya sehingga mempengaruhi pertumbuhan stek hingga berujung kematian. Oleh sebab itu perlu adanya upaya penambahan hormon dari luar. Hormon yang dipakai dapat diperoleh dari bahan alami yaitu air kelapa dan urine sapi. Penelitian dilakukan dalam green house Dsn. Menganti, Ds. Karangsemanding, Balonpanggang, Gresik dengan ketinggian tempat 21 mdpl sejak bulan Februari – Mei 2017. Varietas tin yang digunakan yaitu Green jordan. Percobaan menggunakan rancangan acak kelompok faktorial dengan tiga faktor perlakuan, yaitu: Hormon bahan alami (H) terdiri dari H1 = air kelapa dan H2 = urine sapi, konsentrasi hormon terdiri dari K1 = 0%, K2 = 25% dan K3 = 50% serta lama perendaman bahan stek yang terdiri dari W1 = 6 jam perendaman, W2 = 12 jam perendaman dan W3 = 18 jam perendaman dan pembanding yaitu P1 = hormon IBA 4000 ppm selama 12 jam. Sehingga didapatkan 19 perlakuan diulang tiga kali dengan jumlah 5 sampel per ulangan. Total didapatkan 285 stek batang tanaman tin. Variabel yang diamati meliputi saat tumbuh tunas, presentase stek bertunas, laju pertumbuhan panjang tunas, laju pertumbuhan tinggi tanaman, jumlah daun, laju pertumbuhan luas daun, panjang akar, bobot segar akar dan bobot kering akar. Analisis data dilakukan dengan Analysis Of Variance (Anova) dan polonomial ortogonal. Apabila terdapat pengaruh nyata Uji F 5%, dilanjutkan dengan Uji (DMRT) dengan taraf signifikansi 5%.
1 BAB 1 PENDAHULUAN 1.1Latar Belakang
Tanaman tin (Ficus carica L.) adalah tanaman yang istimewa karena terkandung dalam Firman Allah dalam Al-Qur’an surat At-Tin ayat pertama yang
artinya “Demi (buah) Tin dan (buah) Zaitun). Tanaman tin memiliki khasiat
sebagai pencegah kanker karena mengandung polyphenols tinggi (Vebriansyah dan Angkasa, 2016). Selain dimanfaatkan sebagai obat tanaman tin juga dijadikan
sebagai tanaman hias. Habitat asli tanaman tin yaitu di daerah beriklim subtropis (Himelrick, 1999) namun, ada beberapa varietas tanaman tin yang adaptif tumbuh
di daerah tropis (Vebriansyah dan Angkasa, 2016).
Sebelum ada Indonesia tanaman tin mulai dikenal di mediterania sebagai obat tradisional yang kemudian berkembang secara komersil di Amerika Serikat,
Chille, India, Cina dan Jepang (Tchombe dan Louajri, 2015). Kemudian sejak dua tahun terakhir tanaman tin mulai digemari masyarakat Indonesia. Harga buah tin
terbilang mahal di pasaran sehingga tanaman tin layak dibudidayakan di Indonesia. Saat ini masih sedikit pembudidaya tanaman tin, sedangkan permintaan bibit dan buah sudah berkembang pesat di Indonesia dan Malaysia
bahkan tidak menutup kemungkinan pasar global. Tanaman tin berpotensi menjadi bahan baku industri untuk berbagai olahan produk. Misalnya selai,
2
meningkat dan diprediksi akan terus bertahan dengan nilai jual yang tinggi karena
banyak diminati masyarakat perkotaan (Vebriansyah dan Angkasa, 2016).
Melihat peluang besar tanaman tin maka perlu adanya perbanyakan bibit
tanaman tin. Perbanyakan tanaman secara vegetatif merupakan salah satu cara guna mempercepat penyebaran hasil-hasil program pemuliaan dan juga akan
diperoleh tanaman yang unggul serta seragam dengan tanaman induknya. Salah satu teknik perbanyakan yang dilakukan yaitu menggunakan teknik stek. Stek dipilih karena tanaman tin memiliki morfologi batang yang berkambium (Condit,
1947) namun, perbanyakan sistem stek batang banyak ditemukan kendala dalam hal pertumbuhan bibit tanaman. Kendala yang mempengaruhi keberhasilan stek
berasal dari ketersediaan air dalam bahan stek, kandungan cadangan makanan dalam stek dan hormon endogen dalam jaringan stek. Apabila ketersediaan air, cadangan makanan dan hormon dalam bahan stek sedikit maka hal tersebut akan
mengganggu pertumbuhan tanaman sehingga stek tidak mampu menghasilkan tunas dan akar yang kemudian akan berujung pada kematian (Kusuma, 2003)
Upaya mempercepat pertumbuhan tunas dan perakaran stek dapat dilakukan dengan penambahan hormon tumbuh secara eksogen. Hormon tumbuh yang sering digunakan umumnya berasal dari bahan sintetis. Selain hormon
sintesis terdapat pula hormon yang berasal dari bahan alami. Hormon yang bersumber dari bahan alami dapat diperoleh dari air kelapa dan urine sapi. Air
3
serta senyawa lain (Bey, Syafii dan Sutrisna 2006) dan urine sapi mengandung N,
P, K dan hormon auksin (Purdyaningsih, 2008). Auksin berfungsi sebagai pendukung proses perpanjangan sel tumbuhan, pertumbuhan akar, pembentukan
kalus dan respirasi. Sebagai upaya meningkatkan pertumbuhan stek batang tanaman tin dengan menggunakan hormon alami maka perlu adanya penelitian
dengan analisa “Pengaruh Hormon Alami dengan Tingkat Konsentrasi dan Lama
Perendaman terhadap Pertumbuhan Stek Batang Tanaman Tin (Ficus carica L.)”.
1.2Rumusan Masalah
Berdasarkan uraian latar belakang penelitian, maka rumusan masalah dalam
penelitian ini adalah:
1. Apakah pemberian sumber hormon dari beberapa bahan alami berpengaruh
terhadap pertumbuhan stek batang tin (Ficus carica L)?
2. Apakah konsentrasi hormon berpengaruh terhadap pertumbuhan stek batang tin (Ficus carica L)?
3. Apakah lama perendaman hormon berpengaruh terhadap pertumbuhan stek batang tin (Ficus carica L)?
4 1.3Tujuan Penelitian
Tujuan dari penelitian ini adalah:
1. Mengetahui jenis hormone alami yang mampu meningkatkan pertumbuhan
stek batang tin (Ficus carica L)
2. Mengetahui konsentrasi yang tepat pada masing-masing hormon alami untuk
meningkatkan pertumbuhan stek batang tin (Ficus carica L)
3. Mengetahui lama perendaman yang tepat pada sumber dan konsentrasi hormon sehingga mampu meningkatkan pertumbuhan stek batang tin (Ficus
carica L)
1.4Hipotesis
5 BAB 2
TINJAUAN PUSTAKA
2.1 Taksonomi Tanaman Tin (Ficus carica L.)
Berdasarkan literatur Joseph dan Justin (2011) tanaman tin dalam
sistematika tumbuhan diklasifikasikan sebagai berikut:
Divisio : Magnoliophyta Kelas : Magnoliopsida
Ordo : Rosales Famili : Moraceae
Genus : Ficus
Species : Ficus carica L.
2.2Morfologi Tanaman Tin
Morfologi atau bagian-bagian Tanaman Tin terdiri dari: akar, tunas dan
daun, barang, dan buah.
2.2.1 Akar
Tanaman Tin mempunyai akar berserat yang menyebar hingga tiga
kali diameter tajuk tanaman dan tipenya sangat dangkal dan berakar tunjang (Condit 1947). Tanaman tin toleran terhadap tanah yang kurang
6 2.2.2Tunas
Setiap tunas terminal umumnya mengandung empat atau lima daun primordial. Menjelang dasar tunas vegetatif muncul pula primordial.
Sebuah primordial ditakdirkan untuk menjadi vegetatif memiliki tiga atau empat skala yang ditetapkan untuk menutupi sumbu tunas. Primordia
berkembang terus selama pertumbuhan pohon. Tunas memanjang dan meristem apikal berkembang menjadi tunas yang menghasilkan daun dan perbungaan baru (Condit, 1947).
2.2.3 Daun
Tanaman tin memiliki daun yang sederhana bertekstur daun kasar
dengan ukuran 6-18cm panjang dan lebar 5 – 15 cm. Kuncup daunnya di ujung ranting terlindungi oleh sepasang daun penumpu yang lekas rontok, meninggalkan bekas berupa cincin di buku-buku rantingnya. Serta, tulang
daun lateral yang pertama cenderung lurus dan menyudut terhadap ibu tulang daun di bagian pangkal daun; membentuk pola tiga-cabang (
tri-veined) yang khas. Getah putih dan sepasang daun penumpu yang meninggalkan bekas cincin juga merupakan ciri suku Moraceae (Wikipedia, 2010).
7 2.2.4 Batang
Tanaman tin dapat mencapai ketinggian 3-10 m. Tanaman tin tumbuh dengan banyak percabangan yang lebat. Batang dan cabang
sangat sensitif terhadap panas dan sinar matahari. Kerusakan yang terjadi dapat berupa bercak-bercak putih. Jika terluka, batang menghasilkan getah
yang berwarna puteh. Getah yang terhasil dari dikatakan toksik kepada manusia. Batang muda bewarna hijau muda dan bertukar menjadi kelabu apabila matang. Sesetengah varieti mempunyai batang yang berjalur-jalur
antara hijua dan kelabu (Condit 1947).
2.2.5Buah
Buah tin muncul di sumbu dekat pada daun. Dua susunan bunga di tangkai dan satu tunas vegetatif ada di posisi cabang yang sama di sumbu
dekat daun (Mederes, 2008). Periode awal pertumbuhan adalah dikarakteristikkan dengan oleh pertumbuhan ukuran diameter dan berat,
pada tahap I ni hampir tidak terdapat perbedaan terhadap akumulasi gula. Tahap kedua adalah tingkat kematangan yang ditandai dengan akumulasi gula tanpa ada perubahan ukuran dan berat. Tahap ketiga
8
2.3Syarat Tumbuh
Tanaman tin adalah tanamaan subtropis yang termasuk dalam genus
Ficus dan keluarga dari Moracea. Tanaman ini dapat tumbuh di beberapa belahan dunia termasuk wilayah Mediterania, Asia Tenggara, Amerika
Selatan, Afrika Selatan, Caucasia dan Australia (Mederes Adnan, 2008). Ketika tumbuh di area dingin, pohon tin sering terluka oleh embun yang merontokkan cabang muda dan dapat merusak pucuk tumbuhan. Tanaman tin
mampu beradaptasi pada lingkungan yang minim unsur hara serta toleran terhadap tanah basa, tanah salin dan tanah kering tetapi idealnya tumbuh pada
tanah yang memiliki drainase baik sedikitnya dengan ketinggian satu meter dengan pH antara 5-8 (Adnan, 2008). Varietas tin yang adaptif tumbuh di Indonesia yaitu brown turkey, green yordan, purple yordan, panache,
9 2.4Perbanyakan Vegetatif
Perbanyakan vegetative merupakan perbanyakan dengan mengambil bagian tanaman misalnya akar, kulit batang atau pucuk tanaman
(Purnomosidhi, at all 2012). Ada lima cara perbanyakan vegetatif buatan untuk tanaman buah yaitu cara penyambungan, okulasi, penyusuan, cangkok
dan stek (Prastowo, at all, 2006). Teknik pembibitan secara vegetatif memiliki keuntungan berupa keturunan yang didapat mempunyai sifat genetik yang sama dengan induknya, produksi bibit tidak tergantung pada ketersediaan
benih/ musim buah, bisa dibuat secara kontinyu dengan mudah sehingga dapat diperoleh bibit dalam jumlah banyak (Adinugraha, Sugeng dan Toni, 2007).
2.5Stek Batang Tanaman
Pada penerapan teknik perbanyakan secara vegetatif ada beberapa teknik yang biasa dilakukan, salah satunya yaitu stek. Stek adalah perbanyakan
tanaman dengan cara menumbuhkan akar dari potongan/bagian tanaman seperti akar dan batang sehingga menjadi tanaman baru (Purnomo, 2002).
Perbanyakan vegetatif tanaman tin dapat dilakukan dengan menggunakan bagian batang yang sering dikenal dengan stek batang. Stek batang dapat dilakukan apabila batang tanaman berkambium. Stek akan tumbuh dan
berkembang membentuk tanaman baru dengan sifat yang sama dengan pohon induknya pada kondisi yang sesuai dengan lingkungan hidupnya (Marpaung
10
Menurut Rochiman dan Harjadi (1973), penyetekan merupakan suatu
perlakuan pemisahan beberapa bagian tubuh tumbuhan seperti batang, akar, daun, dan tunas dengan maksud agar bagian-bagian tersebut akan membentuk
akar. Bahan stek diambil dari bagian pohon yang belum berkayu terlampau keras. Menurut Samsijah (1974) dalam Supriyanto dan Prakasa (2011)
menyebutkan bahwa kemampuan pembentukan akar pada suatu jenis tanaman yang distek antara lain dipengaruhi oleh kandungan karbohidrat serta keseimbangan hormon dalam bahan stek. Hormon menjadi salah satu
perlakuan yang dapat mempengaruhi pembentukan akar dan tunas pada stek (Van der leek dalam Curtis Clark dalam Samsijah dalam Sudomo, 2007). Akar
pada stek terbentuk karena pelukaan dan akar terbentuk dari jaringan parenkim (Moko, 2004).
Menurut Hidayat (2010), pembentukan akar lateral dimulai dengan
pembelahan periklinal yang terjadi pada beberapa sel perisikel. Sel yang dihasilkan membelah lagi secara periklinal atau antiklinal sehingga terjadi
himpunan sel. Pada waktu primordium akar bertambah panjang, korteks ditembus sehingga akar lateral muncul di permukaan akar induknya. Usaha untuk menumbuhkan setek perlu dilakukan pada lingkungan yang mempunyai
cahaya baur atau terpencar (diffuse light). Kelembaban udara sebaiknya tinggi, sekitar 70-90% sedangkan suhu berada mendekati suhu kamar yaitu pada suhu
11
Gambar 3: Mekanisme Pembentukan Akar
Gambar 3 bersumber dari : Salisbury, Frank B dan Cleon W Ross, (1995)
Gambar 4: Irisan membujur bagian apikal tajuk tumbuhan dikotil
2.6Hormon
Hormon tumbuhan adalah senyawa organik yang disintesis pada salah satu bagian tumbuhan pada konsentrasi tertentu yang mampu menimbulkan
suatu respon fisiologis (Salisbury dan Cleon, 1995). Salisbury dan Cleon, (1995) menerangkan bahwa hormon yang disintesis secara alami di dalam tumbuhan disebut hormon tanaman atau phytohormon sedangkan hormon
sintetik disebut zat perngatur tubuh (ZPT). Struktur senyawa yang memiliki Pembentukan kuncup
multisel, berasal lebih dari satu lapis sel (poliembrioni dari hasil pembelahan Embrio dini seluruh jaringan
bersifat meristematik
12
aktivitas auksin memiliki gugus karboksil yang menempel pada gugus lain
yang mengandung karbon kemudian berhubungan dengan sebuah cincin aromatik.
Hormon tumbuhan mengendalikan aktivitas gen dengan mentranskripsi DNA menjadi RNA-kurir (mRNA) yang diikuti oleh translasi mRNA menjadi enzim yang memiliki aktivitas katalis yang tinggi sehingga
dapat menghasilkan banyak salinan sel yang penting (Salisbury dan Cleon, 1995). Bahan alami yang dapat dijadikan hormon yaitu:
2.6.1 Air Kelapa
Air kelapa memiliki berbagai macam kandungan unsur hara mikro dan makro. Kandungan yang ada di dalam air kelapa yaitu
nitrogen, zat pengatur tumbuh (ZPT), protein, asam amino, karbohidrat, senyawa organik komplek, air dan karbon aktif. Air kelapa mengandung
hormon sitokinin 5,8 mg/l, auksin 0,07 mg/l, dan giberelin serta senyawa H
Gambar 5: Struktur senyawa auksin
a. Struktur beberapa senyawa alami yang memiliki aktivitas auksin b. Struktur senyawa lain yang merupakan auksin sintesis
(a)
13
lain (Bey, Syafii dan Sutrisna 2006). Hormon tersebut digunakan untuk
mendukung pembelahan sel embrio, proliferasi jaringan, memperlancar metabolisme dan proses respirasi, membantu proses pembelahan sel dan
deferensiasi (Tulecke et al, 2012). Oleh karena itu, air kelapa mampu menjadi perangsang pertumbuhan tanaman seperti pada penelitian yang
dilakukan Marpaung, dan Hutabarat (2015) dijelaskan bahwa air kelapa konsentrasi 50% dalam perendaman selama 12 jam mampu menghasilkan waktu bertunas lebih cepat, panjang tunas, jumlah daun,
panjang dan bobot basah akar yang tinggi pada tanaman tin (Ficus
carica L).
2.6.2 Urine Sapi
Urine Sapi merupakan limbah ternak yang mengandung N, P, K dan hormon auksin (Purdyaningsih, 2008). Auksin yang terdapat pada
urine berasal dari berbagai zat yang terkandung dalam protein hijauan dari makana hewan ternak yang tidak terurai dalam tubuh sehingga
keluar bersama urine sebagai sisa hasil ekskresi. Oleh karena itu, urine sapi mampu mendorong perakaran tanaman (Sitorus, Irmansyah dan Ezra, 2015). Berdasarkan penelitian yang dilakukan Sitorus (2015)
dinyatakan bahwa urine sapi pada konsenrasi 25% memberikan respons paling baik dalam meningkatkan pertumbuhan bibit stek tanaman buah
14
2.7 Perendaman Hormon Stek
Perendaman hormon dilakukan dengan tujuan untuk menginduksi akar pada stek batang tanaman tin ( Ficus carica L) yang akan diteliti. Perendaman
dilakukan dengan berbagai macam lama perendaman demi mengetahui efektifitas lama perendaman yang terbaik dalam perbanyakan stek batang
tanaman tin (Ficus carica L). Semakin rendah konsentrasi hormon yang diberikan maka lama perendamannya akan semakin lama pula. Sedangkan semakin banyak konsentrasi hormon yang diberikan maka lama perendaman
15 BAB 3
METODOLOGI PENELITIAN
3.1 Waktu dan Tempat
Penelitian ini akan dilaksanakan dalam Green House di Dusun Menganti,
Desa Karang Semanding, Kecamatan Balongpanggang, Kabupaten Gresik. Penelitian ini akan dilaksanakan pada bulan Februari – Mei 2017. Pada ketinggian tempat 12 meter di atas permukaan laut.
3.2 Bahan dan Alat
Bahan tanam yang digunakan adalah batang tanaman tin varietas green
jordan. Bahan hormone berasal dari air kelapa, urine sapi dan IBA yang berasal dari Perhutani Kab.Bojonegoro. Media tanam yang digunakan memakai kompos
“TULUS” dan arang sekam. Peralatan yang dibutuhkan meliputi: neraca analitik,
kawat, korek api, polibag ukuran 7cm, cutter, sprayer, cetok, plastik sungkup, plastik bening, paranet, bambu, botol, gelas ukur, digital thermo hygrometer.
3.3 Metode Penelitian
Percobaan menggunakan rancangan acak kelompok faktorial dengan tiga faktor perlakuan, yaitu:
- Bahan Alami (H), terdiri dari 2 taraf yaitu: 1. H1 = Air kelapa
16
- Faktor tingkat konsentrasi (K), terdiri dari 3 taraf yaitu: 1. K1 = konsentrasi 0 %
2. K2 = konsentrasi 25 % 3. K3 = konsentrasi 50 %
- Faktor Lama perendaman (W), terdiri dari 3 taraf yaitu: 1. W1 = 6 jam perendaman
2. W2 = 12 jam perendaman
3. W3 = 18 jam perendaman
Kontrol yaitu P1 = hormon IBA 4000 ppm perendaman 12 jam.
Sehingga didapatkan 19 kombinasi perlakuan, yaitu H1K1W1, H1K2W1, H1K3W1, H1K1W2, H1K2W2, H1K3W2, H1K1W3, H1K2W3,
H1K3W3, H2K1W1, H2K2W1, H2K3W1, H2K1W2, H2K2W2, H2K3W2, H2K1W3, H2K2W3, H2K3W3 dan P1. diulang tiga kali dengan jumlah 5
17 Keterangan :
H1K1W1 : air kelapa konsentrasi 0% perendaman 6 jam H1K2W1 : air kelapa konsentrasi 25% perendaman 6 jam H1K3W1 : air kelapa konsentrasi 50% perendaman 6 jam H1K1W2 : air kelapa konsentrasi 0% perendaman 12 jam H1K2W2 : air kelapa konsentrasi 25% perendaman 12 jam H1K3W2 : air kelapa konsentrasi 50% perendaman 12 jam H1K1W3 : air kelapa konsentrasi 0% perendaman 18 jam H1K2W3 : air kelapa konsentrasi 25% perendaman 18 jam H1K3W3 : air kelapa konsentrasi 50% perendaman 18 jam H2K1W1 : urine sapi konsentrasi 0% perendaman 6 jam H2K2W1 : urine sapi konsentrasi 25% perendaman 6 jam H2K3W1 : urine sapi konsentrasi 50% perendaman 6 jam H2K1W2 : urine sapi konsentrasi 0% perendaman 12 jam H2K2W2 : urine sapi konsentrasi 25% perendaman 12 jam H2K3W2 : urine sapi konsentrasi 50% perendaman 12 jam H2K1W3 : urine sapi konsentrasi 0% perendaman 18 jam H2K2W3 : urine sapi konsentrasi 25% perendaman 18 jam H2K3W3 : urine sapi konsentrasi 50% perendaman 18 jam P1 : kontrol hormon IBA 4000 ppm
18 3.4Pelaksanaan Penelitian
Pelaksanaan penelitian meliputi beberapa tahap kegiatan sebagai berikut:
3.4.1 Persiapan
Persiapan yang dilakukan berupa persiapan tempat, peyediaan alat, media tanam, bahan tanam yang akan digunakan serta pembuatan sungkup
berbahan plastik bening dengan kerangka bambu. Sungkup berukuran panjang 3 m, lebar 2 m dan tinggi 0,75 m.
3.4.2 Pembuatan media tanam
Media tanam yang digunakan dalam perbanyakan stek tanaman tin
adalah kompos dan arang sekam (Komar dan Dian, 2007). Kompos yang
digunakan merupakan kompos kemasan bermerk dagang “TULUS”
sedangkan arang sekam dibuat dengan membakar sekam menggunakan
kawat sebagai cerobong asap hasil pembakaran sekam. Kemudian media tanam dibuat dengan perbandingan komposisi 1:1 (kompos : arang
sekam), media yang sudah siap kemudian dimasukkan ke dalam polybag berlubang berdiameter 7,5 cm hingga memenuhi 70cm3 volume polybag dengan berat sekitar 150 gram media tanam sebagai tempat tumbuh stek
19 3.4.3 Persiapan Hormon
Hormon berasal dari 2 bahan alami yaitu; air kelapa dan urine sapi dan hormon pembanding berasal dari hormon endogen bermerk dagang
IBA (asam indolbutarat). Proses pembuatan hormon dilakukan sebagai berikut:
Pembuatan Hormon Air Kelapa
Air kelapa yang digunakan berasal dari kelapa muda berwarna hijau dengan ciri-ciri warna kulit buah mulus dan licin, bebas dari hama dan
penyakit, endospermnya masih lunak dan tipis. Endosperm yang masih lunak dan tipis diremas dengan air kelapa sehingga didapatkan
campuran endosperm dan air kelapa muda (Fanesa, 2011). Kemudian dibuat formula dengan konsentrasi 0% (100 ml air tanpa air kelapa), konsentrasi 25% (25 ml air kelapa + 75 ml air), konsentrasi 50% (50 ml
air kelapa + 50 ml air).
Pembuatan Hormon Urine Sapi
Urine sapi yang digunakan adalah urine yang diambil pada pagi hari, kemudian didiamkan minimal 12 jam (Fanesa, 2011). Setelah itu urine sapi diencerkan dengan konsentrasi 0% (100 ml air tanpa urine
20
Pembuatan Hormon IBA
Hormon IBA didapatkan dari RPH Grogolan, BKPH Pradok KPH Bojonegoro. Hormon IBA yang digunakan sebagai pembanding adalah
IBA dengan konsentrasi 4000 ppm (Siddiqui dan Syed, 2007) maka IBA yang dibutuhkan adalah seberat 4 gram. Bubuk IBA seberat 4
gram kemudian dilarutkan dalam 1 liter air.
3.4.4 Pemilihan bahan stek
Bahan stek diambil dari induk tanaman tin yang unggul. Tanaman buah yang unggul biasanya memiliki kemampuan memproduksi buah dalam
jumlah banyak dan tidak mengundang hama dan penyakit (Nugroho at all, 2006). Tanaman induk yang dijadikan bahan stek batang tanaman tin dalam penelitian ini berasal dari kolektor tanaman tin yang berlokasi di Ds.
Banjarsari Kec. Cerme. Tanaman tin yang menjadi induk ini adalah tanaman yang tumbuh dari perbanyakan menggunakan metode cangkok dan saat ini
telah berusia 2,5 tahun serta mampu berbuah banyak tanpa mengenal musim. Bahan stek diambil dari batang kayu tanaman tin yang berdiameter > 1 cm dan batang yang bersih dari hama atau jamur serta berbatang segar
(Siddiqui and Syed, 2007). Berdasarkan penelitian Marpaung dan Hutabarat (2015) menyatakan bahwa bagian batang tanaman tin tidak berpengaruh
21 3.4.5Pembuatan stek
Batang tanaman tin berasal dari varietas Green Jordan. Batang tanaman tin dipotong menggunakan cutter yang disterilkan menggunakan
alkohol 70%. Pemotongan cabang diatur kira-kira 1 cm di bawah mata tunas yang paling bawah sedangkan ujung bagian atas berjarak 1 cm dari mata tunas
yang paling atas. Pangkal bahan stek dipotong miring 450 (Nugroho at all, 2006). Batang dipotong dengan ukuran 10 cm. Bahan stek minimal harus memiliki 2 mata tunas.
Gambar 7: Stek Batang Pemotongan Satu Sisi
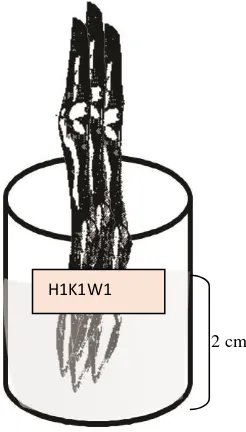
3.4.6Perendaman Stek
Bahan stek yang telah disiapkan dicelupkan dalam larutan hormon
berbagai konsentrasi dalam wadah yang telah diberi label nama hormon dan konsentrasi. Batang-batang setek yang akan direndam dalam hormon
disatukan dengan diikat menggunakan karet gelang. Selanjutnya sepanjang 2
450
10 cm
22
cm bagian pangkal stek tin dicelupkan dalam hormon sesuai waktu yang
diperlakukan (6 jam, 12 jam dan 18 jam).
Gambar 8: Perendaman Stek Batang Tanaman Tin
3.4.7 Penanaman
Penanaman dilakukan menggunakan media tanam kompos : arang sekam (1:1) yang sudah tersedia dalam polibag. Sebelum stek ditanam,
media yang sudah dimasukkan dalam polybag disiram dengan air sesuai dengan kapasitas lapang media tanam yaitu sebanyak 78 ml. Kemudian batang tanaman tin ditanam dengan posisi tegak dengan kedalaman 5 cm
masuk ke dalam media tanam. Bagian media di sekitar stek ditekan perlahan lahan agar posisi stek tidak goyah. Stek batang tanaman tin yang
telah ditanam dimasukkan dalam sungkup.
23 3.4.7 Pemeliharaan
Pemeliharaan stek batang tanaman tin hanya dengan melakukan penyiraman rutin untuk menjaga kelembapan batang tanaman.
Masing-masing stek disiram sebanyak 78 ml sesuai kapasitas lapang media tanam. Pengendalian gulma dilakukan dengan cara pengendalian mekanis.
Pengendalian hama dilakukan dengan penyemprotan dengan insektisida merk klorantranilipol dengan dosis 50 gram/liter sedangkan pengendalian jamur dilakukan dengan penyemprotan fungisida merk mancozeb dengan
dosis 80% (Marpaung dan Hutabarat, 2015)
3.4.8 Variabel Penelitian
Pengamatan dilakukan setiap minggu hingga stek berumur 3 bulan. Variabel penelitian yang diamati meliputi :
Saat Tumbuh Tunas
Saat tumbuh tunas diamati setiap hari dengan melihat munculnya kalus pada stek batang tanaman tin. Saat tumbuh tunas merupakan
indikator pertumbuhan tanaman, semakin cepat tumbuh tunas maka semakin cepat pula waktu tanaman untuk tumbuh dan berkembang. Kriteria pengamatan saat tumbuh tunas adalah sebagai berikut:
5 = sangat lambat = > 120 hari setelah tanam (HST) 4 = lambat = > 90–120 HST
3 = agak cepat = > 60 – 90 HST 2 = cepat = > 30 – 60 HST
24
Presentase Stek Bertunas (%)
Jumlah stek bertunas ditandai dengan munculnya tunas yang memiliki panjang ≥ 0.5 cm. Variabel presentase stek bertunas
dilakukan pada akhir pengamatan. Perhitungan stek bertunas yaitu: PST =
PST = Presentase stek bertunas X = jumlah stek bertunas T = jumlah seluruh stek
Laju Pertumbuhan Panjang tunas (cm/ minggu)
Panjang tunas merupakan indikator untuk mengetahui tingkat pertumbuhan stek. Kecepatan pertumbuhan diketahui dengan
menghitung pertambahan panjang tunas dimana pengukuran dilakukan setiap minggu selama 12 minggu. Pertumbuhan laju pertumbuhan relatif tunas stek didapatkan dengan formula (Alvarez-Aquino et al.
2004)
Keterangan:
RGR = nilai Pertumbuhan relatif panjang tunas (cm/minggu) X1 = panjang tunas pada akhir pengamatan
X0 = panjang tunas pada awal pengamatan
Interval pengamatan = 12 minggu waktu pengamatan
Laju Pertumbuhan Tinggi Tanaman (cm/bulan)
Perhitungan tinggi tanaman dilakukan mulai dari pangkal stek
25
MST, 8 MST dan 12 MST. Pertumbuhan laju pertumbuhan relatif
tinggi stek didapatkan dengan formula Alvarez-Aquino.
Keterangan:
RGR = nilai Pertumbuhan relatif tinggi tanaman (cm/ bulan) X1 = panjang tinggi tanaman pada akhir pengamatan X0 = panjang tinggi tanaman pada awal pengamatan Interval pengamatan = 3 kali waktu pengamatan
Jumlah Daun (daun)
Jumlah daun dihitung apabila stek batang tanaman tin menghasilkan daun yang membuka sempurna. Pengamatan dilakukan
5 MST kemudian selanjutnya dilakukan pengamatan seminggu sekali hingga umur 12 MST.
Laju Pertumbuhan Luas Daun (cm2/ minggu)
Luas daun diukur dengan cara menjiplak bagian daun dijiplak pada kertas millimeter. Berdasarkan hasil pengukuran akan
didapatkan luas daun dengan menghitung kotak yang tersedia dalam kertas millimeter . Pengamatan dilakukan setiap bulan pada 4 MST, 8
26 Keterangan:
RGR = nilai Pertumbuhan relatif luas daun (cm2 /bulan) X1 = luas daun pada akhir pengamatan
X0 = luas daun pada awal pengamatan Interval pengamatan = 3 kali waktu pengamatan
Panjang akar (cm)
Panjang akar stek diukur pada akhir penelitian. Jumlah tanaman
yang diukur panjang akar tiap perlakuan terdiri dari 3 sampel. Panjang akar diukur mulai pangkal hingga ujung akar menggunakan penggaris.
Bobot Kering Akar (gram)
Bobot kering akar diukur pada akhir penelitian. Akar yang sudah dipotong dan dibersihkan kemudian dikeringkan dengan oven pada
suhu 700C selama 48 jam. Penimbangan dilakukan menggunakan neraca analitik hingga bobot akar konstan.
3.5 Analisis Data
Analisis data dilakukan dengan menggunakan Analysis Of Variance
(Anova) dan ortogonal kontras untuk menemukan variabel independen dalam penelitian dan mengetahui interaksi antar variabel dan pengaruhnya terhadap suatu perlakuan apakah berpengauh nyata, sangat nyata atau tidak nyata. Berikut
27
Tabel 1: Sidik Ragam Percobaan Faktorial 2 x 3 x 3
Sumber keragaman Derajad bebasa Jumlah
kuadrat
Kuadrat
tengah
F
Hitung
F tabel
5% 1%
Ulangan r-1 = 2
Perlakuan hkw – 1 = 17
Hormon (H) h – 1 = 2
Konsentrasi (K) k – 1 = 2
Waktu Perendaman (W) w – 1 = 2
H x K (h-1)(k-1) = 2
H x W (h-1)(w-1) = 2
K x W (k-1)(w-1) = 4
H x K x W (h-1)(k-1)(w-1) = 4
Galat (r-1)(hkw – 1) = 34
Umum rhkw – 1 = 53
29
Apabila terdapat pengaruh nyata pada Uji F 5%, pengujian dilanjutkan
dengan Uji Duncan’s Multiple Range Test (DMRT) dengan taraf signifikansi 5%. Adapun formulasi uji Duncan adalah sebagai berikut:
DMRTα= R (ρ, v, α) .
Keterangan :
R (ρ, v, α) : tabel nilai kritis uji perbandingan berganda Duncan
ρ : jumlah perlakuan dikurangi 1 (sebanyak p -1) v : derajat bebas galat (db galat)
α : taraf nyata yang digunakan KTG : kuadrat tengah galat
30
DAFTAR PUSTAKA
Adinugraha, Sugeng Pudjiono dan Toni Herawan. 2007. “Teknik perbanyakan vegetatif jenis tanaman Acacia mangium”. Info Teknis Vol. 5 no. 2, September 2007. Balai Besar Penelitian Bioteknologi dan Pemuliaan Tanaman Hutan; Bogor
Baby Joseph, S.Justin Raj. 2011. “Pharmacognostic and phytochemical properties of
Ficus carica Linn” –An overview. International Journal of Pharm Tech. Research Vol. 3, No.1, pp 08-12. (8-12)
Bey, Y, Syafii, W & Sutrisna. 2006. “Pengaruh giberelin dan air kelapa terhadap
perkecambahan anggrek Bulan”, J.Biogenesis, vol. 2, no. 2, pp. 41-6.
Bugbee, B. 2000. Light Quality. Bugbeewwcc.usu.edu. Diakses tanggal 20 Agustus 2016.
Condit, I.J. 1947. The fig. Massachusetts: Chronica Botanica Waltham, MA.
Fanesa, Anggia. 2011. “Pengaruh Pemberian Beberapa Zat Pengatur Tumbuh terhadap Pertumbuhan Stek Pucuk Jeruk Kacang ( Citrus nobilis L.)”. Fakultas Pertanian Universitas Nangro Aceh Darussalam; Aceh
Flaishman, Mose A, Victor Radov, Ed Stofer. 20008. “The fig: botany, horticulture
and breeding”. Department of Fruit Tree Sciences, Agricultural Research
Organization; Israel. J: Horticultural Reviews, Volume 34 (113-198).
Golombek S.D., and P. LUdders. 1990. “Effects of short-term salinity on leaf gas exchange ofthe fig (Ficu.c carica L.)”. J: Plant & Soil 148:21-27. Hidayat. 2010. “Pertumbuhan akar primer, sekunder dan tersier stek batang bibit
surian (Toona sinensis Roem)”. Jurnal Volume 10 No. 2. April 2010; 1- 8. Unwim-Jatinangor-Jawa Barat.
Himelrick. David G. 1999. “Fig production guide”. Alabama A&M and Auburn
Universities. Amerika Serikat.
31
Komar, Tajudin Edi dan Dian Tita R. 2007. “Laporan Hasil Pembiakan Vegetatif Ramin (Gonystylus bancanus) dalam Pengadaan Bibit”. Departemen Kehutanan dan Internasional Tropical Timber Organization. Bogor; Jawa Barat.
Kusuma, Agung Surya. 2003. “Pengaruh zat pengatur tumbuh Rotoone- F dan NAA
terhadap keberhasilan stek maglid”. Skripsi. Institut Pertanian Bogor; Bogor.
Lawalata, Imelda Jeanette. 2011. “Pemberian beberapa kombinasi ZPT terhadap regenerasi tanaman gloxinia (Siningia speciosa) dari eksplan batang
dan daun secara in vitro”. J.Exp. Life Sci. Vol. 1 No. 2. Hal 56-110. Universitas Pattimura.
Marfirani, M, Yuni Sri Rahayu dan Evie Ratnasari. 2014. “Pengaruh pemberian
berbagai konsentrasi filtrat umbi bawang merah dan rootone-f
terhadap pertumbuhan stek melati Rato Ebu”. Lentera Bio Vol. 3 No. 1, Januari 2014: 73–76. Universitas Negeri Surabaya; Surabaya. Marpaung, AE dan Hutabarat, RC. 2015. “Respons jenis perangsang tumbuh
berbahan alami dan asal setek batang terhadap pertumbuhan bibit tin (Ficus carica L.)”. J. Hort. Vol. 25 No. 1, hal 37-43.
Mederes Adnan. 2008. “Production of fig (ficus carica l.) nursery plants by stem layering method”, J: Agriculturae Conspectus Scientifi cus | Vol. 73 (2008) No. 3 (157-160)
Moko, H. 2004. “Teknik perbanyakan tanaman hutan secara vegetative”. Informasi Teknis 2(1): 1-20.
Nurhasnin. 2010. “Penggunaan Berbagai Warna Sungkup dan Plastik dan Dosis Bokashi pada Tanaman Caisin (Brassica cinensis)”. Tesis Universitas Islam Riau; Riau.
Purnomosidhi P, Tarigan J, Surgana M, Roshetko JM. 2012. “Teknik Perbanyakan Vegetatif”. Lembar Informasi AgFor No 2. Bogor, Indonesia. World Agroforestry Centre - ICRAF, SEA Regional Offi ce. 6p.
Salisbury, Frank B dan Cleon W Ross. 1995. Fisiologi Tumbuhan Jilid 3. ITB Press; Bandung
Santoso, Budi. 2011. “Pemberian IBA dalam berbagai konsentrasi dan lama
perendaman terhadap pertumbuhan stek kepuh (Sterculia foetida
32
Setiowati. 2004. “Pengaruh ekstrak bawang merah (Allium cepa L) dan ekstrak
bawang putih (Allium sativum L) terhadap pertumbuhan stek bunga mawar (Rosa sinensis L)”. Skripsi. Universitas Muhammadiyah Malang; Malang.
Siddiqui and Syed Asghar Hussain. 2007. “Effect of Indole Butyric Acid and Types of Cuttings on Root Initiation of Ficus Hawaii”. Sarhad J. Agric. Vol. 23, No. 4, 2007. Department of Horticulture, NWFP Agriculture University Peshawar, Pakistan – Pakistan.
Siregar, Hermansyah dan teguh. 2013. “Pertumbuhan bibit lada perdu pada komposisi media tanam berbeda dengan penyungkupan”. Universitas Bengkulu; Bengkulu.
Sitorus, T. Irmansyah, Ferry Ezra T. Sitepu. 2015. “Respons pertumbuhan bibit setek tanaman buah naga merah (Hylocereus costaricencis (Web) Britton & Ross) terhadap pemberian auksin alami dengan berbagai tingkat
konsentrasi”. Jurnal Agroekoteknologi E-ISSN No. 2337- 6597 Vol.3. No.4, September 2015. (541) :1557- 1565. USU; Medan.
Sudomo, A. Sugeng Pudjiono dan Moch Na’iem. 2007. “Pengaruh jumlah mata tunas terhadap kemampuan hidup dan pertumbuhan stek empat jenis hibrid
murbei”. Jurnal Pemuliaan Tanaman Hutan Vol 1 no 1 Juli 2007. Balai Besar Penelitian Bioteknologi dan Pemuliaan Tanaman Hutan. Ciamis. Sudomo, A, Asep Rohandi dan Nina Mindawati. 2012. “Penggunaan zat pengatur
tumbuh Rootone-f pada setek pucuk manglid (Manglietia glauca )”. Jurnal Penelitian Hutan Tanaman Vol. 10 No. 2, Juni 2013: 57-63 Supriyanto, dan K.E. Prakasa. 2011. “Pengaruh Zat Pengatur Tumbuh Rootone-F
terhadap Pertumbuhan Setek Duabanga mollucana Blume”. Jurnal Silvikultur Tropika Vol. 03 No.01 Agustus 2011. Hal. 59-65. ISSN: 2086-8277.