6 II. METODELOGI PENELITIAN
2.1 Tempat Penelitian
Penelitian ini dilakukan di UPT Laboratorium Terpadu Biosain dan Bioteknologi Universitas Udayana dari tanggal 18 November 2011 sampai tanggal 18 Januari 2012.
2.2 Bahan dan Peralatan Penelitian 2.2.1 Materi Hidup
Bakteri Asam Laktat penghidrolisis garam empedu diisolasi dari feses bayi. Sampel feses diambil dari 3 orang bayi sehat yang berumur antara 1-6 bulan.
2.2.2 Bahan Penelitian
Bahan yang digunakan dalam penelitian ini adalah Isolat Bakteri Asam Laktat, Media Man Regosa and Sharpe (MRS) broth (Pronadisa), NaDC (SodiumDeoxycholate) (Sigma), 0,2% GDCA (Sodium Glycodeoxycholate Acid), HCl, NaCl 0,85%, aquadest, air steril, etanol 96% (Merck), alkohol 70%, gliserol 30%, Anaerobic Solution (komposisi : KH2PO4, K2HPO4, L-Cystein, Tween 80,
agar), Etil Asetat, Methanol, Eluent Cyclohexane, Acetic Acid, Cholic acid Sigma,
Molibdophosporic acid dan perangkat pewarna kit (Bioanalitika).
2.2.3 Alat Penelitian
Alat-alat yang digunakan dalam penelitian ini adalah cawan petri (Pirex-Iwaki), tabung reaksi (Pirex (Pirex-Iwaki), pisau, gunting, pinset, penggaris, Erlenmeyer (Pirex-Iwaki), jarum ose, inkubator, sentrifuge (Clements GS 150), autoclave (All American Model 1925X), magnetic stirer (Iwaki Stirer BS 38), oven, object glass,
cover glass, alat penjepit, freezer, spektrofotometer (Genesys 20), Laminar air flow Cabinet, tip biru, tip kuning, pipetman (Wilson), aluminium foil (Klin Park), eppendorf, lampu Bunsen, sterofoam, mikroskop dan pH meter (Toa Ion Meter
Im-7 40s), Anaerob jar, valkon cub, Chamber, Thin layer chromatography (silica gel TLC,
Emereck No. 1.05553), dan hair drayer.
2.3 Rancangan Penelitian
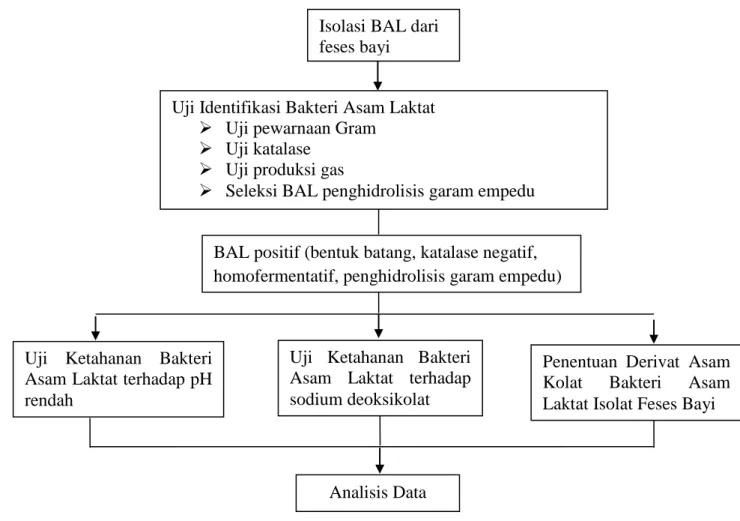
Penelitian ini dilakukan dengan metode eksperimental dengan tujuan untuk mengisolasi BAL penghidrolisis garam empedu dari feses bayi dan mengetahui tingkat ketahanannya terhadappH rendah dan sodium deoksikolat serta untuk mengetahui apakah BAL isolat feses bayi melakukan biotransformasi asam kolat menjadi asam deoksikolat, sebelum dikembangkan menjadi kandidat probiotik potensial. Secara garis besar, tahapan penelitian ini ditunjukkan pada Gambar 2.1.
Gambar 3.1 Skema Penelitian Isolasi BAL dari feses bayi
Uji Identifikasi Bakteri Asam Laktat Uji pewarnaan Gram
Uji katalase Uji produksi gas
Seleksi BAL penghidrolisis garam empedu
Uji Ketahanan Bakteri Asam Laktat terhadap pH rendah
Uji Ketahanan Bakteri Asam Laktat terhadap sodium deoksikolat
Analisis Data
Penentuan Derivat Asam Kolat Bakteri Asam Laktat Isolat Feses Bayi BAL positif (bentuk batang, katalase negatif,
8 2.4 Prosedur Penelitian
2.4.1 Pengambilan Sampel Feses Bayi
Sampel feses diambil dari 3 orang bayi sehat. Faktor ensklusi yang harus dipenuhi sampel yaitu bayi berumur 1-6 bulan, ASI eksklusif sebagai asupan nutrisinya, kelahiran normal, kondisinya sehat, dan tidak pernah mengkonsumsi antibiotik. Sebanyak kurang lebih 3-5 g feses diambil dengan menggunakan spatula yang steril, disimpan dalam valkon cub steril, dan dimasukkan ke dalam anaerob jar yang berisi anaerobpack (Mitsubhisi gas), kemudian dibawa ke laboratorium untuk dianalisis dan diisolasi bakteri asam laktatnya. Sebelum dikerjakan semua sampel disimpan di tempat yang sejuk.
2.4.2 Isolasi Bakteri Asam Laktat dari Feses Bayi
Kandidat BAL diisolasi dengan menggunakan Serial Dilution Platting
Method dan dilanjutkan dengan penumbuhan pada medium Man Regosa and Sharpe
(MRS) dengan metode spread plate. Sampel diperlakukan dengan anaerobic solution yaitu dengan cara mensuspensikan 1 g sampel ke dalam 9 mL media anaerobic
solution dan divortex hingga homogen. Kemudian 0,1 mL sampel disuspensikan ke
dalam 5 mL media MRS broth yang sudah ditambahkan dengan 20 µL NaDC 0,4 mM yang berfungsi sebagai media pengkaya, dikocok hingga homogen dan diinkubasi selama 24 jam pada suhu 370C dalam keadaan anaerob menggunakan anaerobpack (Mitsubhisi gas). Kemudian, sebanyak 50 µL sampel diambil dari hasil
inkubasi pada media MRS broth untuk disuspensikan pada 5 mL MRS broth pH 5,5 dan diinkubasi selama 24 jam pada suhu 370C dalam keadaan aerob. Setelah itu dilakukan pengenceran dengan cara mengambil sebanyak 0,1 mL sampel untuk disuspensikan ke dalam 0,9 mL larutan salin (NaCl 0,85%), sehingga didapatkan tingkat pengenceran sebesar 10 kali (10-1). Dengan cara yang sama, pengenceran dilanjutkan sampai diperoleh tingkat pengenceran 10-2-10-7. Dari seri pengenceran 10
-3,10-5, 10-7, selanjutnya dipipet masing-masing 0,1 ml, disebar merata pada
9 diinkubasi selama 48 jam pada suhu 370C dalam suasana anaerob. Koloni yang tumbuh pada plate diidentifikasi dengan uji pewarnaan Gram. Setelah dilakukan uji pewarnaan Gram, bakteri yang berbentuk batang diinokulasikan sebanyak 1 jarum ose ke dalam 5 mL MRS broth, kemudian diinkubasi selama 24jam pada suhu 370C dalam suasana aerob. Koloni yang tumbuh dalam MRS broth diambil 1 ose, distreak
for single colony pada media MRS agar yang telah ditambah BCP untuk
mendapatkan koloni tunggal,dan diinkubasi selama 48 jam pada suhu 370C dalam suasana aerob. Kemudian koloni yang terpisah diinokulasikan ke dalam 5 mL MRS broth dan diinkubasi selama 24 jam pada suhu 370C dalam suasana aerob (Sujaya et
al., 2008a; Ramona, 2003).
Koloni yang tumbuh pada media MRS broth disimpan dalam gliserol 30% sebagai stock gliserol dengan cara mensuspensikan sebanyak 1 mL kultur isolat ke dalam 9 mL gliserol 30% dan disimpan di dalam frezzer pada suhu -20oC sampai
waktu yang tidak terbatas.
2.4.3 Uji Identifikasi Bakteri Asam Laktat 2.4.3.1 Pewarnaan Gram
Isolat Bakteri Asam Laktat diambil 1 jarum ose diapuskan pada gelas objek, difiksasi di atas api Bunsen, dan ditunggu hingga kering. Preparat diwarnai dengan gentian violet selama 1,5 menit, dicuci dengan air mengalir, dikeringkan dengan kertas penghisap, ditetesi dengan larutan lugol, didiamkan selama 1 menit lalu dicuci kembali dengan air mengalir, ditetesi dengan alkohol 96% dan dibiarkan selama 5 detik, dicuci kembali dengan air mengalir, diwarnai dengan pewarna safranin selama 1 menit, dicuci kembali dengan air mengalir, dikeringkan dengan kertas hisap tanpa menggosok sediaan, dan diamati di bawah mikroskop dengan perbesaran 100 kali. Bakteri Gram positif tampak berwarna ungu, sedangkan bakteri Gram negatif berwarna merah dibawah mikroskop. Kelompok BAL merupakan bakteri Gram positif, sehingga mengikat zat warna gentian violet dengan sangat kuat dan terlihat berwarna ungu dibawah mikroskop (Lay, 1994).
10 2.4.3.2 Uji Katalase
Isolat Bakteri Asam Laktat penghidrolisis garam empedu yang diisolasi dari feses bayi diambil sebanyak 1 ose, dibuat apusan pada gelas objek, ditetesi dengan 2 tetes H2O2 10%, dan diamati gelembung gas yang terbentuk pada preparat tersebut.
Hasil positif ditunjukkan oleh terbentuknya gelembung gas oksigen yang dihasilkan dari degradasi H2O2 oleh enzim katalase (Hadioetomo, 1990; Soemarno, 2000). BAL
memberikan hasil negatif pada uji ini (Sujaya et al., 2008a).
2.4.3.3 Uji Produksi Gas dari Hasil Metabolisme Glukosa
Jarum ose panas (hoot-loop) dimasukkan ke dalam suspensi isolat BAL pada media MRS broth. Hasil positif ditunjukkan dengan terbentuknya gas karbondioksida hasil metabolisme glukosa (Sperber dan Swan, 1976). BAL homofermentatif memberikan hasil negatif pada uji ini, sedangkan BAL heterofermentatif menunjukkan hasil positif pada uji ini (Sujaya et al., 2008a).
2.4.3.4 Seleksi Bakteri Asam Laktat Penghidrolisis Garam Empedu Isolat Feses Bayi
Sebanyak 1 ose isolat bakteri Gram positif, tidak menghasilkan enzim katalase, dan tidak menghasilkan gas (homofermentatif) yang berhasil diisolasi pada penelitian ini, diinokulasikan dengan cara stab culture ke dalam MRS agar yang mengandung GDCA (Sodium Glykodeoxycholate Acid) dengan konsentrasi 0,2% dan diinkubasi selama 48 jam pada temperatur 370C dalam suasana anaerob. Koloni yang tumbuh kemudian di streak for single colony pada medium yang sama, diinkubasi selama 48 jam pada temperatur 370C dalam suasana anaerob, dan zone bening yang terbentuk diamati di bawah mikroskop (Sujaya et al., 2008a; Ramona, 2003).
2.4.4 Uji Ketahanan Bakteri Asam Laktat terhadap pH Rendah
Biakan murni BAL yang diisolasi dari feses bayi dibuat suspensinya dari
11 MRS broth dan diinkubasi pada temperatur 37oC selama 24 jam. Kemudian, sebanyak 100 µL suspensi BAL ini dimasukkan ke dalam tabung-tabung Eppendorf yang masing-masing telah berisi 900 µL media MRS broth dengan pH 2, 3 atau 4, diinkubasi selama 3 jam dalam waterbath pada suhu 37oC, disentrifugasi dengan kecepatan 7000 rpm selama 5 menit dan supernatannya dibuang. Pelet bakteri pada dasar tabung selanjutnya dicuci sebanyak dua kali dengan 300 µL larutan salin (dengan cara divortex dan disentrifugasi selama 5 menit dengan kecepatan 7000 rpm yang dilakukan sebanyak dua kali dan supernatanya dibuang). Pelet yang dihasilkan selanjutnya disuspensikan dalam 300 µL larutan salin dan sebanyak 50 µL suspensi ini diinokulasikan ke dalam5 mL media MRS broth pH netral untuk selanjutnya diinkubasi selama 24 jam pada suhu 37oC dalam suasana anaerob. Meningkatnya
kekeruhan biakan pada medium MRS broth yang diukur dengan menggunakan spektrofotometer pada panjang gelombang 660 nm (OD 660 nm) menunjukkan bahwa BAL tersebut dapat tumbuh pada pH rendah (San’t Anna dan Tores, 1998; Hyronimus et al., 2000). Untuk mendapatkan data yang representatif, maka uji ini diulang sebanyak 3 kali.
2.4.5 Uji Ketahanan Bakteri Asam Laktat terhadap Sodium Deoksikolat
Biakan murni BAL isolat feses bayi dibuat suspensinya dari stock gliserol dengan cara mensuspensikan sebanyak 50 µL kultur ke dalam 5 mL MRS broth dan diinkubasi pada temperatur 37oC selama 24 jam. Isolat yang tumbuh divortex terlebih dahulu, kemudian disiapkan 4 buah tabung yang berisi 5 mL MRS broth. Masing-masing tabung ditambahkan suspensi bakteri sebanyak 50 µL. Tabung pertama sebagai kontrol, media MRS broth tidak ditambahkan sodium deoksikolat (NaDC). Tabung kedua ditambahkan 10 µL NaDC 0.2 mM, tabung ketiga ditambahkan 20 µL NaDC 0.4 mM dan tabung keempat ditambahkan 30 µL NaDC 0.6 mM. Selanjutnya semua tabung diinkubasi pada suhu 37oC selama 24 jam secara aerob.
Ketahanan isolat BAL diukur berdasarkan tingkat kekeruhan (OD 660 nm) menggunakan spektofotometer. Bila nilai absorbansi (A)< 0,1 maka strain bakteri
12 tersebut tidak tahan terhadap NaDC, dan bila A ≥ 0,1 maka strain BAL tahan terhadap pH rendah (Sujaya et al., 2008).Untuk mendapatkan data yang representatif, maka dilakukan replikasi sebanyak 3 kali (Hyronimus et al., 2000; Pragdimurti, 2001).
2.4.6 Penentuan Derivat Asam Kolat Bakteri Asam Laktat Isolat Feses Bayi Biakan murni BAL yang diisolasi dari feses bayi dibuat suspensinya dari
stock gliserol dengan cara mensuspensikan 50 µL kultur ke dalam 5 mL MRS broth
dan diinkubasi pada temperatur 37oC selama 24 jam. Kemudian 50 µL kultur yang tumbuh pada MRS broth disuspensikan ke dalam 5 mL MRSpH 7,0 yang telah ditambahkan asam kolat (cholic acid, Sigma) sehingga konsentrasi akhirnya 25 mM (Kurdi et al., 2000 ; Yoshida, 2004), dan diinkubasi pada temperatur 37oC selama 24 jam. Selanjutnya, 1 mL kultur dalam Ca dipipet ke dalam eppendorf kemudian disentrifuge selama 5 menit dengan kecepatan 5000 rpm. Sebanyak 0,1 mL supernatan kemudian dipipet, ditambahkan dengan 500 µL etil asetat dan 20 µL HCl, disentrifuge selama 5 menit dengan kecepatan 5000 rpm, supernatannya dipipet dan diuapkan, peletnya ditambahkan dengan 500 µL etil asetat, disentrifuge selama 5 menit dengan kecepatan 5000 rpm, supernatannya dipipet dan diuapkan selama 48 jam pada suhu kamar, ditambahkan 15 µL methanol. 10 mL Cyclohexane, 15 mL
Etil Asetat dan 4 mL Acetic Acid dicampur di dalam chamber, dan didiamkan selama
30 menit sebelum dilakukan TLC pada alluminium silica gel. Setelah 30 menit, DCA, CA, dan masing-masing isolat ditotolkan sebanyak 1 µL pada aluminium
silica gel, dikeringkan dengan hairdrayer, diletakkan pada chamber yang telah berisi
larutan eluen, diamkan sampai silica menyerap larutan, dikeringkan, disemprotkan dengan pewarna Molibddophosporic acid, dikeringkan, dan dioven sampai spot dari masing-masing isolat terlihat pada silica gel. Jika isolat melakukan transformasi CA menjadi DCA, diindikasikan dengan terbentuknya bercak yang mempunyai retention
13 transformasi CA menjadi DCAdiindikasikan dengan terbentuknya bercak yang mempunyai retention time (Rt) sama dengan standar CA (Sujaya et al., 2008b).
2.5 Analisis Data
Data yang diperoleh pada penelitian ini dianalisis secara deskriptif dan kuantitatif. Jenis BAL yang tumbuh dideskripsikan berdasarkan uji-uji yang dilakukan. Sedangkan analisis data untuk uji ketahanan terhadap pH rendah dan sodium deoksikolat menggunakan metode kuantitatif. Uji ketahanan Bakteri Asam Laktat terhadap pH rendah dan sodium deoksikolat diukur dari data yang diperoleh dari masing-masing strain Bakteri Asam Laktat setelah diukur dengan spektrofotometer pada panjang gelombang (λ) 660 nm. Bila nilai absorbansi A<0,1 maka strain bakteri tersebut tidak tahan terhadap pH rendah, dan bila A≥0,1 maka strain BAL tahan terhadap pH rendah (Sujaya et al., 2008a).