1
Dasar pertimbangan pada pengembangan teknologi untuk terapi farmasetis
terdiri dari tiga faktor utama yaitu menciptakan sistem yang efektif (effectiveness), menekan efek bahaya pada sistem jika diaplikasikan (safety), dan membuat agar sistem dapat diterima dengan baik oleh pasien (acceptability (Hillery, dkk., 2001). Tiga pertimbangan ini mengantarkan usaha pengembangan teknologi penghantaran obat hingga pada kemajuan yang pesat. Pertimbangan fisikokimia
dan molekuler meliputi kesetimbangan ion-molekul, kesetimbangan
hidrofilik-lipofilik, proses biofarmasetika, metabolisme dan biodegradasi, afinitas
obat-reseptor, pertimbangan fisiologis, serta biokompatibilitas dari sistem menjadi
faktor utama yang umum diperhatikan dalam melakukan penelitian pada bidang
ini. Meskipun demikian,semakin majunya pemahaman terhadap mekanisme yang
terjadi di dalam tubuh membuat berbagai masalah yang pada mulanya kurang
diperhatikan menjadi bahan pertimbangan yang harus dicarikan solusinya
(Nevozhay, dkk., 2007).
Salah satu strategi penghantaran tertarget yang dapat dilakukan adalah
formulasi dalam bentuk nanopartikel yang dikonjugasikan dengan suatu antibodi
spesifik, untuk menghantar obat kepada sel target yang dituju (Peer, dkk., 2007).
Penelitian terdahulu telah dilakukan untuk menghasilkan suatu sistem
penghantaran obat tertarget yaitu dengan mengkonjugasikan pektin dengan BSA
perbandingan pereaksi dan waktu reaksi yang diperlukan untuk menghasilkan
konjugasi low methoxyl pektin dengan BSA menggunakan kat Jumlah BSA dan pektin divariasikan dengan perbandingan 0,7-1,6:1. Perbandingan optimum yang
diperoleh digunakan untuk melihat pengaruh waktu reaksi terhadap efektivitas
konjugasi. Variasi waktu yang digunakan antara 4-24 jam pada suhu 4 °C. Untuk
mengetahui keberhasilan konjugasi dilakukan analisis secara kualitatif
menggunakan metode poliakrilamid gel elektroforesis (PAGE) yang dapat
memisahkan BSA yang telah terkonjugasi dan BSA bebas berdasarkan bobot
molekulnya. Hasil analisis kualitatif menggunakan metode elektroforesis
non-denaturasi-PAGE menunjukkan bahwa perbandingan pektin dengan BSA untuk
dapat memberikan hasil konjugasi optimum adalah 1:1 dengan waktu reaksi 8 jam
pada suhu 4 °C (Juhariah, 2015).
Formulasi nanopartikel dengan antibodi penarget juga telah dilakukan oleh
Psycha (2014). Pada penelitian tersebut dilakukan formulasi ekstrak protein daun
M. jalapa L. (RIP-MJ) menjadi nanopartikel dengan polimer alginat-kitosan. Nanopartikel yang terbentuk kemudian dikonjugasikan dengan antibodi
anti-EpCAM menggunakan katalis EDAC untuk meningkatkan efektivitas terapi.
Konsentrasi optimum yang dapat membentuk suspensi nanopartikel adalah
RIP-MJ 0,05%; alginat 0,4%; dan kitosan 1% (b/v) (Wicaksono, 2014).
Didasarkan pada hasil penelitian- penelitian yang tersebut di atas yang
telah memodelkan penghantaran obat dengan nanopartikel yang dikonjugasikan
dengan antibodi penarget maka dikembangkan sebuah penelitian yang bertujuan
nanopartikel dengan antibodi sehingga bisa ditentukan suatu kondisi yang baik
untuk menghasilkan konjugasi antara polimer dengan antibodi yang optimum.
Proses konjugasi antibodi dengan polimer pembentuk nanopartikel merupakan
salah satu tahap penting, yang akan menentukan keberhasilan proses penghantaran
obat (Lammers, dkk., 2012; Marcucci & Lefoulon, 2004).
Pada penelitian ini dilakukan optimasi kondisi reaksi biokonjugasi yang
terjadi. Pertama dilakukan pemodelan reaksi biokonjugasi yang terjadi antara
suatu nanopartikel dengan antibodi. Pemodelan tersebut dilakukan dengan
menggunakan alginat bebas sebagai nanopartikel dan BSA (Bovine Serum Albumin) sebagai model suatu antibodi dengan menggunakan EDAC sebagai katalis. Optimasi kondisi konjugasi alginat dengan BSA dilakukan untuk
menghasilkan konjugasi yang optimum. Optimasi konjugasi yang dilakukan
adalah dengan memvariasi konsentrasi pereaksi yang digunakan dalam reaksi
konjugasi (Juhariah, 2015).
Melalui pemodelan reaksi konjugasi antara alginat dengan BSA
diharapkan dapat diketahui kondisi reaksi konjugasi yang menghasilkan konjugasi
yang optimum. Keberhasilan terjadinya reaksi biokonjugasi antara alginat dan
dengan BSA dideteksi dengan elektroforesis gel poliakrilamid native dimana sebelumnya hasil reaksi biokonjugasi telah dilakukan pemisahan dengan
menggunakan membran dialisis (50 kDa) untuk menghentikan reaksi dengan
mengeluarkan EDAC serta produk samping yang terbentuk dalam sistem reaksi
Kondisi reaksi konjugasi yang menghasilkan konjugasi antara alginat
dengan BSA yang paling optimum akan digunakan untuk tahap selanjutnya yaitu
mengkonjugasikan alginat bebas dengan antibodi anti-EpCAM. Keberhasilan
dalam optimasi ini diharapkan dapat digunakan sebagai acuan yang
mempermudah dalam pengembangan nanopartikel sebagai sistem penghantaran
obat tertarget.
B. Rumusan Masalah
1. Bagaimana kondisi optimum reaksi konjugasi antara alginat dengan BSA
menggunakan EDAC sebagai katalis reaksi?
2. Apakah antibodi anti-EpCAM dapat dikonjugasikan dengan alginat
menggunakan EDAC sebagai katalis reaksi?
C. Tujuan Penelitian 1. Tujuan Umum
Penelitian ini bertujuan untuk melakukan reaksi biokonjugasi antara
alginat dengan BSA menggunakan EDAC sebagai katalis serta untuk
melakukan reaksi biokonjugasi antara alginat dengan anti-EpCAM.
2. Tujuan Khusus
a. Untuk mengetahui kondisi optimum reaksi konjugasi yang dapat
menghasilkan konjugasi antara alginat dengan BSA menggunakan EDAC
sebagai katalis reaksi.
b. Untuk melakukan konjugasi antara alginat dengan antibodi anti-EpCAM
D. Manfaat Penelitian
1. Penelitian ini diharapkan dapat memodelkan reaksi konjugasi
nanopartikel dengan antibodi penarget yang dapat memberikan
gambaran mengenai kondisi optimum untuk memformulasikan suatu
sistem penghantaran tertarget yang dapat digunakan untuk terapi
kanker.
2. Penelitian ini diharapkan dapat memberikan informasi mengenai
metode analisis kualitatif yang tepat untuk mengevaluasi hasil
konjugasi yang dapat menjadi dasar pengembangan nanopartikel
sebagai sistem penghantaran obat untuk terapi kanker.
E. Tinjauan Pustaka
1. BSA (Bovine Serum Albumin)
Bovine serum albumin (BSA) sering digunakan sebagai model untuk
studi fisika-kimia protein karena merupakan polipeptida yang mudah tersedia
(Carter & Ho, 1994). BSA merupakan suatu protein globular yang tersusun
dari dua puluh asam amino esensial dalam struktur yang terdiri dari 583 unit
dengan asam amino terbanyak pertama yaitu leusin ( 60 unit) dan yang kedua
yaitu lisin (59 unit) (Peters, 1995). Asam amino lisin yang memiliki rantai
samping gugus amina dan N-terminal asam amino secara umum merupakan
gugus fungsional penyusun protein yang menjadi sasaran untuk modifikasi
molekul (Wong, 2000). Berat molekul BSA adalah 66500 Da (Peters, 1995;
BSA sangat mudah larut dalam air dan hanya dapat diendapkan
menggunakan garam netral yang memiliki konsentrasi tinggi seperti
ammonium sulfat. Kestabilan larutan BSA sangat baik, terlebih jika disimpan
dalam keadaan beku (Rani, 2012). Albumin akan mengalami koagulasi oleh pemanasan (Lewis, 1993). Ketika dipanaskan pada suhu 50⁰ C atau lebih, albumin akan segera membentuk agregat hidrofobik yang tidak dapat kembali
ke bentuk monomernya walaupun telah didinginkan (Carter & Ho, 1994).
Albumin memiliki rongga hidrofobik yang dapat mengikat asam
lemak, bilirubin, hormon dan obat (Putnam, 1975). BSA sering digunakan
sebagai penstabil untuk protein terlarut lainnya atau enzim yang labil. Dalam
aplikasi di bidang biokimia, BSA digunakan sebagai Enzyme-Linked Immunosorbent Assay (ELISA), Immunoblots, dan Immuno histo chemistry
(IHC) (Rani, 2012). BSA juga dapat digunakan sebagai standard pada
kalibrasi protein untuk menentukan kuantitas protein lain dengan
menggunakan metode Lowry dan Bradford protein assay, dan sebagai
blocking agent pada Western blots (Putnam, 1975 ; Rani, 2012).
2. EpCAM (Epithelial Cell Adhesion Molecule)
Epithelial cell adhesion molecule (EpCAM) adalah glikoprotein transmembran yang memediasi adesi ion Ca2+-independent homotypic di sel-sel epitelia. EpCAM juga terlibat dalam sinyaling sel-sel, migrasi, proliferasi dan
diferensiasi. EpCAM diekspresikan secara khusus pada sel epitel dan sel
sebagai penanda diagnosis untuk beberapa jenis kanker (Yemul, Leon Ja,
dkk., 1993).
EpCAM berukuran 30-40 kDa. Sekuen EpCAM diperkirakan terdiri
dari tiga potential N-linked glycosylation sites. EpCAM tersusun dari 314 asam amino yang terdiri dari sebuah domain ekstraselular ( 242 asam amino)
dengan epidermal growth factor (EGF) dan tiroglobulin yang terdiri dari sebuah domain transmembran tunggal (23 asam amino), dan sebuah domain
intraselular pendek ( 26 asam amino) (Lewis, 1993).
EpCAM yang ada pada permukaan dari sebuah sel akan mengikat
EpCAM pada sel lain dengan demikian dua sel tersebut akan saling
berikatan. Adesi yang dimediasi oleh EpCAM bersifat lemah dibandingkan
dengan beberapa adesi molekul lain (Yemul, dkk., 1993). EpCAM dipercaya
terlibat pada karsinogenesis karena kemampuannya menginduksi gen yang
terlibat dalam metabolisme dan proliferasi. EpCAM dapat memotong
molekul yang memiliki potensi onkogenik. Pada saat pemotongan, domain
ekstraselular (EPX) akan lepas ke dalam area di sekitar sel dan domain
intraseluler (EpICD) akan lepas ke dalam sitoplasma sel. Domain intraseluler
(EpICD) adalah sebuat kompleks yang terbentuk dari protein FHL2, β -catenin, dan Lef di dalam nukleus. Kompleks ini kemudian berikatan dengan
DNA dan mempromosikan transkripsi dari berbagai gen. Hal ini berefek
pada promosi pertumbuhan tumor. Apalagi EpEX yang terlepas dapat
feedback balik yang positif. Jumlah dari β-catenin di nukleus dapat memodulasi tingkat ekspresi EpCAM ( Dunns, 1989).
EpCAM terekspresi tinggi pada permukaan sel kanker sehingga
EpCAM dijadikan sebagai target yang atraktif dari imunoterapi. Peran dari
EpCAM pada sinyaling sel kanker memungkinkan EpCAM dijadikan
sebagai target dari intervensi terapetik. (Chen, dkk, 2004)
Untuk memahami EpCAM sebagai target dari terapi kanker payudara,
dilakukan analisis menggunakan PCR. Pada analisis ini dihasilkan real-time reverse transcription-PCR untuk mengkuantifikasi level ekspresi EpCAM pada sel normal payudara serta primary dan metastatic kanker payudara. Hasil yang didapatkan dari analisis ini yaitu EpCAM teroverekspresi
100-1000 lipatan pada primary dan metastatic kanker payudara. Silencing ekspresi gen EpCAM dengan EpCAM short interfering RNA (siRNA) menghasilkan penurunan kecepatan proliferasi sel sebesar 35-80% pada empat cell line
kanker payudara yang berbeda. Treatmen EpCAM siRNA menurunkan
migrasi sel sebesar 91,8% dan invasi sel sebesar 96% pada cell line kanker payudara MDA-MB secara in-vitro. Data ini membuktikan bahwa EpCAM
berpotensi sebagai target terapi gen dari kanker payudara dan memberikan
pengetahuan dalam mekanisme yang berhubungan dengan gene silencing
(Yian Chen, dkk, 2004).
Antibodi anti-EpCAM dapat ditargetkan pada molekul adhesi epitel
manusia (EpCAM) yang telah diidentifikasi sebagai protein. Antigen ini juga
Antibodi anti-EpCAM memiliki berat kira-kira molekul 150 kDa (Stahel,
dkk.,1994).
Sel-sel epitel yang normal reaktif terhadap anti-EpCAM.
Anti-EpCAM terdapat pada saluran pernapasan (ekspresinya lebih rendah); sistem
pencernaan bawah; tubulus di ginjal; epitel permukaan ovarium; eksokrin dan
pankreas endokrin; kuman sel sekunder folikel rambut telogen; dan sekresi
tubulus kelenjar keringat di kulit. Selain itu, semua sel epitel di tiroid dan
sel epitel di timus mengekspresikan EpCAM, sedangkan korteks luar dan
sel-sel Hassall memiliki ekspresi yang rendah. Dalam hati, hanya saluran-saluran
empedu tampak positif dengan antibodi anti-EpCAM. Sel non-squamous-carcinoma memiliki ekspresi EpCAM tinggi. Tumor yang timbul dari sel-sel non-epitel, seperti limfoma, mesothelioma, neuroblastoma, dan melanoma,
tidak mengekspresikan EpCAM (Stahel, dkk.,1994).
Antibodi Anti-EpCAM, clone EBA-1, berasal dari hibridisasi SP2 dari
sel myeloma tikus yang diperoleh dengan mengisolasi sel limpa dari tikus
BALB/c yang telah diimunisasi dengan agregat makromolekul yang
mengandung karsinoma payudara terkait musin BCA-225. Anti-EpCAM
yang berasal dari tikus terdiri dari IgG1 rantai berat dan rantai ringan ( Leij,
dkk., 1994). Anti-EpCAM disimpan dalam vial pada suhu 20C- 80C. Dalam
bentuk terkonjugasi tidak boleh dibekukan dan harus terlindungi dari cahaya
(Gonzalez, dkk., 2003).
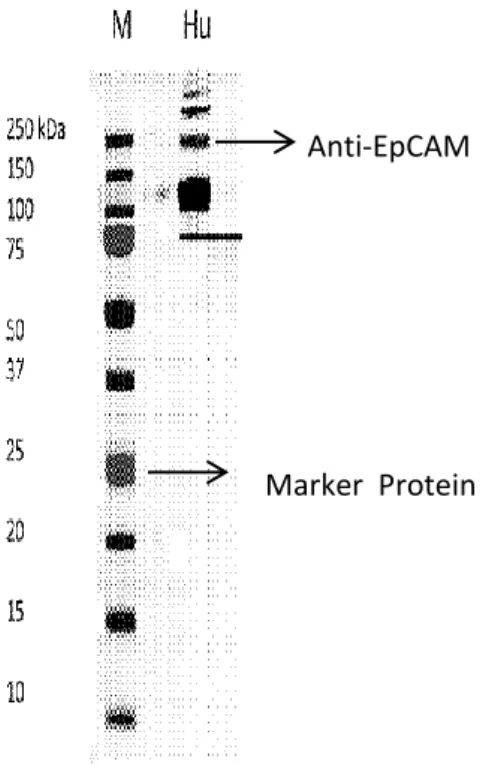
Gambar 1 adalah hasil uji kualitatif anti-EpCAM (human) menggunakan elektroforesis, yang memperlihatkan migrasi anti-EpCAM dan
berat molekulnya. Berat anti-EpCAM berdasarkan hasil uji berkisar antara
100 kDa sampai > 250kDa.
Gambar 1. Uji Kualitatif Anti-EpCAM menggunakan SDS-PAGE. (M) marker protein dan (H) Anti-EpCAM (human) (Scott, 2012)
Telah dilakukan penelitian untuk mengkarakterisasi dan validasi
konjugasi antibodi anti-EpCAM terhadap nanopartikel emas menggunakan
SDS-PAGE. Hasil yang ditunjukkan oleh Gambar 2 memperlihatkan migrasi
antibodi EpCAM terkonjugasi Aunp-PEI nanopartikel. Migrasi
anti-EpCAM antibodi diamati bersama dengan peningkatan rasio anti-EpCAMPEI (0,5
nmol / 100 nmol PEI dan seterusnya). Hasil uji menunjukkan perbedaan
migrasi anti-EpCAM terkonjugasi nanopartikel emas dengan anti-EpCAm
bebas. Migrasi anti-EpCAM tidak terkonjugasi nanopartikel emas berada
pada kisaran 150-170 kDa, sedangkan anti-EpCAM bebas menunjukkan
migrasi pada kisaran 150-170 kDa dan di bawah 43 kDa. Pada anti-EpCAM
Anti-EpCAM
tekonjugasi nanopartikel emas tidak muncul pita di bawah 43 kDa ( Johann,
2004).
Gambar 2. Karakterisasi dan validasi konjugasi Anti-EpCAM terhadap nanopartikel emas menggunakan SDS-PAGE. (1, 2, 3, 4) Konjugasi
anti-EpCAM-nanopartikel emas; (5) anti-EpCAM bebas (Johann, 2004).
3. Alginat
Alginat merupakan senyawa polisakarida hasil ekstraksi dari
kelompok alga coklat yang disebut Alginophyt, yaitu kelompok
Phaeophyceaae yang menghasilkan alginat. Alginat adalah garam dari asam alginat yang mengandung ion natrium, kalsium atau kalium. Alginat yang
banyak dikenal adalah bentuk garam dari asam alginat yang tersusun oleh
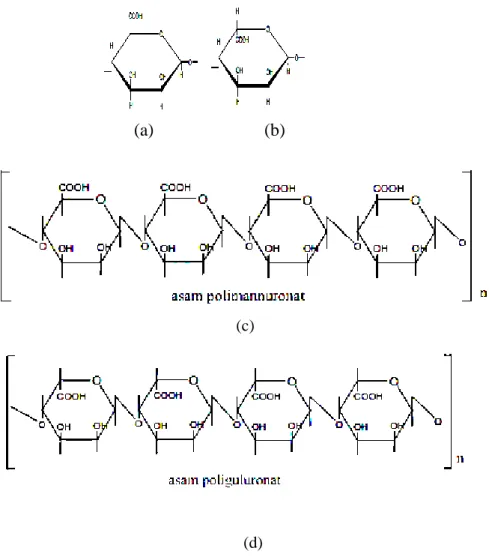
asam D- mannuronat dan asam L-guluronat ( Gambar 3) (Subaryono, 2014).
Alginat adalah istilah umum untuk senyawa dalam bentuk garam dan
turunan asam alginat (Glickman, 1983). Natrium alginat digambarkan
sebagai produk karbohidrat yang telah dipurifikasi, diekstraksi dari alga laut
coklat dengan garam alkali. Rumus molekul alginat adalah (C6H7O6Na)n.
Berat molekul alginat adalah 32–200 kDa, berhubungan erat dengan derajat
kD
polimerisasi 180–930. Nilai pK gugus karboksil adalah 3,4–4,4. Gambar 3
adalah struktur kimia dari polimerisasi alginat. Alginat merupakan poliuronat yang mengandung asam β-D-mannuronat dan asam -L-guluronat, dan kedua asam tersebut dihubungkan oleh ikatan pada C1 dan C4 (Walter, 1991).
(a) (b)
Gambar 3. Struktur Kimia Alginat. (a) Manuronat, ( b) -(,4) L-Asam Guluronat, (c) Asam Manuronat, (d) Asam Poliguluronat (Walter, 1991).
Natrium alginat larut dalam air dan mengental (larutan koloid), tidak
larut dalam alkohol dan larutan hidrokoloid dengan kandungan alkohol lebih
dari 30%, dan tidak larut dalam kloroform, eter dan asam dengan pH kurang
dari 3. Alginat yang larut dalam air membentuk gel pada larutan asam karena (c)
adanya ion kalsium dan kation logam polivalen lainnya. Penggantian kation
Na+ lebih dari 35% kation Ca2+ akan menghentikan pergeseran molekul dan
terbentuk struktur gel yang stabil (Akiyama, 1992).
Viskositas dari larutan alginat dipengaruhi oleh konsentrasi, pH, bobot
molekul, suhu, dan adanya kation logam polivalen. Semakin tinggi
konsentrasi atau bobot molekul maka semakin tinggi viskositasnya.
Viskositas larutan alginat akan menurun dengan pemanasan, meningkat lagi
bila didinginkan kembali, kecuali dengan pemanasan pada suhu tinggi dan
waktu relatif lama akan mengakibatkan degradasi molekul dan menyebabkan
penurunan viskositas (Klose,dkk., 1972). Larutan garam alginat menunjukkan
sedikit perubahan viskositas pada kisaran pH 4-10, oleh karena itu alginat
dengan kisaran pH tersebut biasa digunakan untuk industri makanan
(Glicksman, 1983).
Alginat memiliki sifat dan karakteristik yang unik dan telah digunakan
untuk carrier berbagai zat atau agen biologis seperti gen, antigen dan obat yang melindunginya selama transit ke tubuh manusia. Mikrokapsul natrium
alginat dan poly-L-lysine secara efektif melindungi jaringan endokrin dari
penolakan imun setelah transplantasi. Alginat meningkatkan stabilitas
metabolic dari ikatan anti-sense oligonukleotida dan melindunginya dari
degradasi pada bovine serum. Selain itu, alginat memiliki sifat biokompatibel,
biodegradabel, dan polimer mukoadhesif yang tidak memproduksi toksik
Dewasa ini alginat sering digunakan untuk formulasi nanopartikel.
Nanopartikel alginat telah digunakan untuk memformulasi berbagai obat dan
disiapkan dalam lingkungan berair di bawah kondisi sejuk, nanopartikel
alginat terutama cocok untuk formulasi protein, peptida dan oligonukleotida
(Jork, dkk., 2000). Selanjutnya, selain bersifat biodegradabel, alginat juga
nonimunnogenik. Untuk mengurangi tingkat pertukaran dari kation seperti
Ca2+ dengan ion monovalen dalam medium disolusi, alginat anionik sering
digabung dengan molekul kationik seperti kitosan, poly-L-lysine, atau
tripolyphosphate. Beberapa contoh dari berbagai aplikasi dari nanopartikel berbasis alginat telah dijelaskan. Nanopartikel alginat disiapkan dengan
tripolyphosphate digunakan untuk penghantaran oral. Studi dari sifat fisik
menunjukkan bahwa nanopartikel alginat-kitosan cocok untuk penghantaran
DNA. Nanopartikel alginat yang dilapisi dengan kitosan meningkatkan
stabilitas dan menurunkan pelepasan cepat dari ovalbumin. Studi melaporkan
bahwa nanopartikel alginat yang distabilkan dengan kitosan dapat
meningkatkan bioavailabilitas dan pelepasan diperpanjang dari obat antijamur
dibandingkan dengan nanopartikel PLGA (Poly-Lactic Glycolic Acid). Walaupun sebagian besar digunakan untuk pemberian oral, nanopartikel
alginat inhalasi meningkatkan bioavailabilitas dari obat antituberkulosis. In
vivo, nanopartikel alginat terakumulasi dalam sel Kupffer, sel parenkim
dalam hati dan fagosit dalam limpa dan hati (Hoefler, 2004). Nanopartikel alginat juga dilaporkan untuk diabsorbsi pada Peyer’s patches, memberi
kesan bahwa ini akan meningkatkan kemampuan target pada mukosa usus
(Kim ,dkk., 2000).
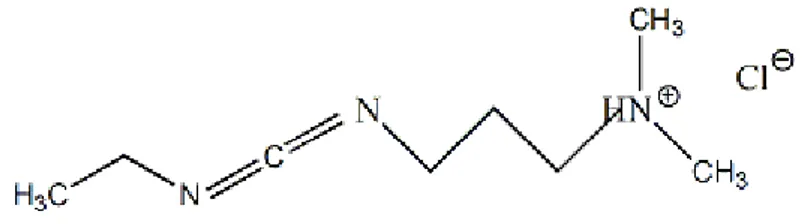
4. EDAC (1-etil-(3-dimetilpropilamin) karbodiimida hidroklorida)
Karbodimida digunakan untuk mengkatalis pembentukan ikatan amida
antara suatu karboksilat dengan amina atau ikatan fosforamidat antara fosfat
dan amina (Hermanson, 1996).
Gambar 4. Struktur Kimia EDAC ( Hermanson, 1996)
EDAC atau (1-etil-(dimetilpropilamin) karbodiimida hidroklorida)
merupakan salah satu jenis katalis. Menurut McGuire (1965), pada awalnya
EDAC mengalami protonasi sehingga terbentuk suatu karbokation reaktif
yang dapat diserang oleh suatu nukleofil. Jika tidak terdapat asam karboksilat
yang tidak terdisosiasi maka karbokation tersebut dapat terhidrolisis dengan
Gambar 5. Pembentukan Karbokation dan Hidrolisis pada Karbodiimida/EDAC (McGiure, 1965)
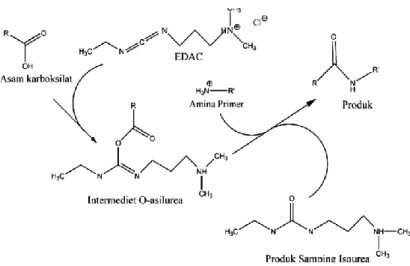
Selanjutnya atom N tersubtitusi pada karbodiimida (EDAC) dapat
bereaksi dengan asam karboksilat untuk membentuk intermediet
O-asilurea yang sangat reaktif. Sisi aktif ini dapat bereaksi dengan suatu
nukleofil seperti amina primer untuk membentuk ikatan amida (Nakajima,
dkk., 1995), Reaksi pembentukan amida menggunakan katalis EDAC
tersebut dapat dilihat pada Gambar 6.
Gambar 6. Reaksi Biokonjugasi Pembentukan Amida dengan Katalis EDAC (Hermanson, 1996) .
Reaksi pembentukan ikatan amida yang oleh carbodiimide terjadi
secara efektif antara pH 4,5 hingga 7,5 dan buffer yang umum digunakan
adalah buffer MES (4-morpholinoethanesulfonic acid) jika kondisi reaksi yang dibutuhkan dalam suasana asam, dan digunakan buffer fosfat jika reaksi
dilakukan pada pH netral (Hermanson, 1996).
Asil urea merupakan produk samping utama jika reaksi dilakukan
pada temperatur tinggi oleh karena itu dibutuhkan temperatur yang cukup rendah (misal, sekitar 0⁰C) pada saat reaksi berlangsung. Selain itu penambahan kelompok amina juga dapat mengurangi pembentukan asil urea
(Bauminger, dkk., 1980).
Suatu reaksi biokonjugasi dengan menggunakan EDAC menghasilkan
suatu produk samping isourea dimana produk samping ini dapat dipisahkan
dengan metode dialisis atau gel filtrasi (Hermanson, 1996). Sistem dialisis
yaitu suatu teknik klasik laboratorium yang berhubungan dengan difusi
selektif suatu molekul melewati membran semipermiabel untuk memisahkan
molekul berdasarkan ukurannya (Witus, 2012).
Karbodiimida dapat diaplikasikan untuk sintesis protein dan
modifikasi polisakarida. Naoki Nakajima dan Yoshito Ikada (1994)
melakukan biokonjugasi menggunakan EDAC antara suatu senyawa dengan
gugus karboksilat didalamnya (asam malat, asam poliakrilat, asam fumarat
dan polietilen glikol) dengan suatu gugus amin (etilen diamin dan
Hermanson (1996) menyebutkan bahwa reaksi biokonjugasi peptida
dengan protein dengan menggunakan EDAC dapat dilakukan dengan mengambil 200μL (10mg/mL) dalam MES pH 4,7 dicampurkan dengan 500
μL (2 mg/500 μL) dengan penambahan EDAC 10 mg. Selain itu protokol
Uptima (2005) menyebutkan bahwa 2 mg peptida direaksikan dengan 2 mg
protein dalam larutan dapar MES, 0,5-1 mg EDAC ditambahkan dalam
campuran peptida-protein (biasanya 0,5 mg BSA cocok untuk 1 mg BSA dan
1 mg protein), diinkubasi 2-4 jam pada suhu kamar yang selanjutkan
dilakukan dialisis. Suatu protokol menyebutkan bahwa peptida dan protein
yang digunakan menggunakan perbandingan 1:1 dimana 1-2
mg/mLprotein/peptida dilarutkan dalam 1 mL larutan dapar MES dengan 0,8
mg EDAC. Selanjutnya dilakukan pencampuran dengan menggunakan vortex
dan diinkubasi elama 1,5-3 jam pada suhu ruang (Carter, 1996).
5. Biokonjugasi
Konjugasi (Crosslinking) merupakan suatu proses kimia untuk menggabungkan dua atau lebih molekul dengan suatu ikatan kovalen. Teknik
ini dapat disebut sebagai biokonjugasi jika molekul yang digabungkan berupa
biomolekul (Hayworth, 2014).
Sistem biokonjugasi dapat diaplikasikan untuk membuat suatu sistem
termodifikasi berbasis protein yang berfungsi untuk deteksi, assay tracking
atau mentarget suatu molekul biologi. Biokonjugasi antara suatu molekul
sintetik dengan suatu protein memiliki peranan yang besar dalam dunia
dengan menggabungkan suatu polimer atau suatu molekul obat pada protein.
Dari banyak jenis sekuens asam amino protein, hanya beberapa gugus
fungsional saja yang menjadi target dalam biokonjugasi, misalkan amina
primer (-NH2), karboksilat (-COOH), sulfhydryl (-SH) dan karbonil (-CHO)
( Tabel 1 ).
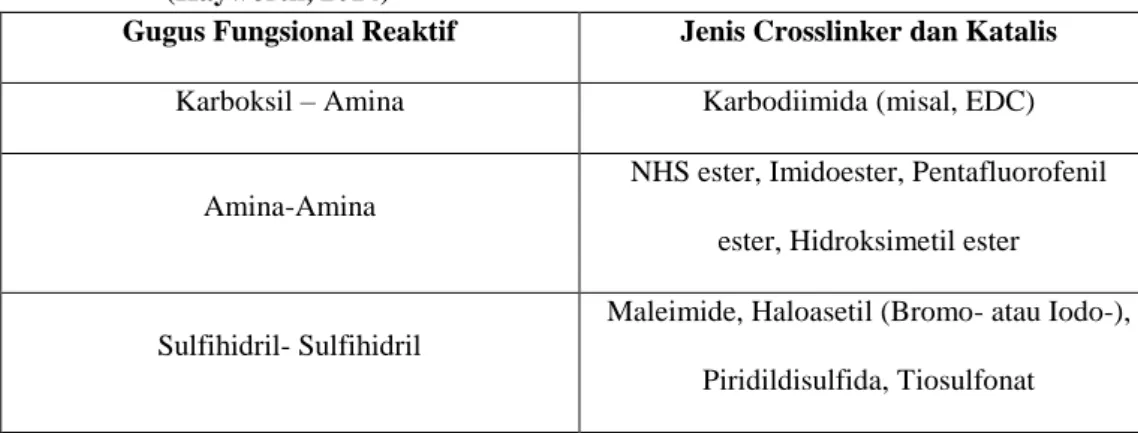
Tabel 1. Jenis-jenis Katalis dan Crosslinker berdasarkan gugus reaktif target (Hayworth, 2014)
Gugus Fungsional Reaktif Jenis Crosslinker dan Katalis
Karboksil – Amina Karbodiimida (misal, EDC)
Amina-Amina
NHS ester, Imidoester, Pentafluorofenil ester, Hidroksimetil ester
Sulfihidril- Sulfihidril
Maleimide, Haloasetil (Bromo- atau Iodo-), Piridildisulfida, Tiosulfonat
Teknik biokonjugasi tergantung pada gugus fungsional reaktif dari
reagen crosslinking maupun dari molekul target. Jika salah satu tidak memiliki gugus fungsional reaktif, atau jika keduanya tidak kompatibel maka
reaksi konjugasi tidak akan berhasil (Hermanson, 1996). Sehingga jika ingin
mendapatkan hasil reaksi yang optimal, perlu dilakukan pemilihan antara
reagen crosslinking dan molekul target yang tepat.
Reagen biokonjugat memiliki gugus fungsi yang reaktif secara
spontan dan selektif untuk terikat pada gugus fungsional spesifik molekul
target. Sebagian reagen tidak secara langsung dapat menjadi crosslinker, tetapi ada yang akan membentuk intermediet aktif yang akan berikatan
dengan molekul kedua yang memiliki komposisi kimia yang tepat untuk
melakukan reaksi (Witus, 2012).
Gugus reaktif dari crosslinker telah dikarakterisasi dan digunakan untuk melabel suatu ligand, protein, peptida, karbohidrat, polimer sintesis,
dan lain-lain (Hermanson, 1996). Crosslinker dengan dua gugus reaktif yang berbeda dapat disintesis menjadi satu bagian dengan mengkombinasikan
gugus reaktif yang berbeda tersebut dengan suatu molekul. Ketika dikombinasikan maka akan terbentuk ‘back bone’ (disebut sebagai spacer arms karena menentukan jarak antar gugus reaktif) (Hayworth, 2014). Tujuan dari konjugasi ini adalah untuk menaikkan sifat farmakokinetik dari
komponen terapinya (Witus, 2012).
6. Elektroforesis Gel Poliakrilamid
Metode elektroforesis menggunakan gel poliakrilamid dapat
digunakan untuk memisahkan protein berdasarkan perbedaan berat atau
ukuran molekulnya. Penggunaan poliakrilamid mempunyai keunggulan
dibandingkan dengan gel lainnya, karena tidak bereaksi dengan sampel dan
tidak membentuk matriks dengan sampel, sehingga tidak menghambat
pergerakan sampel yang memungkinkan pemisahan protein secara sempurna
(Leber, dkk., 1997). Selain itu, gel poliakrilamid ini mempunyai daya
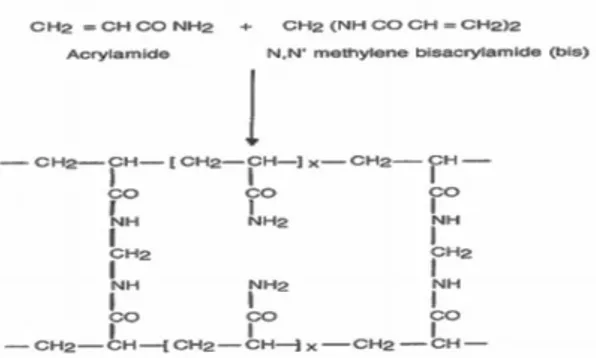
pemisahan yang cukup tinggi. Gel poliakrilamid merupakan hasil polimerasi
dari monomer akrilamid dengan adanya N, N’-methylene-bis-akrilamid (bis-akrilamid) yang berfungsi sebagai pembentuk silang, dimana keduanya akan
yang biasanya digunakan adalah amonium persulfat (APS). Untuk
mendekomposisi APS agar menjadi senyawa radikal dan menyetabilkannya,
maka ditambahkan TEMED (N,N,N’,N’-tetrametil etilendiamin). Ukuran pori gel sangat ditentukan oleh perbandingan jumlah akrilamid dan bis-akrilamid
(Walker, 2002)
Gambar 7. Polimerasi akrilamid ( Walker, 2002)
Ukuran pori-pori suatu gel poliakrilamid dapat diatur dengan mudah
dengan mengubah konsentrasi dari gel poliakrilamid itu sendiri (Klein,
2001). Apabila protein yang ingin dipisahkan memiliki ukuran ~5-50 kDa
maka pori-pori gel poliakrilamid yang dibutuhkan adalah 18%, pemisahan
protein dengan ukuran molekul ~5-60 kDa membutuhkan 16% gel
poliakrilamid. Jika ukuran protein yang ingin dipisahkan antara ~10-80 kDa,
~20-150 kDa, ~30-200 kDa, ~40-250 kDa, ~60-300 kDa dan ~100-400 kDa
maka pori gel yang dibutuhkan berturut-turut adalah 14%, 12%, 10%, 8%,
6% dan 12% (Smet, dkk., 2006).
Teknik pewarnaan pada metode elektroforesis gel poliakrilamid
(gugus asam sulfonat) secara elektrostatistika akan berinteraksi dengan
amina dari protein (Wilson,1994). Struktur Commasie blue dapat dilihat pada Gambar 8.
Gambar 8. Struktur Commasie Blue (Wilson, 1994)
Terdapat dua macam gel yang digunakan dalam pemisahan protein
menggunakan gel poliakrilamid, yaitu gel penumpuk (stacking gel) dan gel pemisah (separating gel). Gel pemisah digunakan untuk memisahkan protein berdasarkan bobot molekulnya. Ukuran pori gel pemisah dapat
berfariasi sesuai dengan range ukuran protein yang ingin dipisahkan.
Stacking gel berfungsi untuk tempat loading sampel atau ruang pembatas
antar sampel. Ukuran pori gel pada bagian ini sangat besar yaitu sekitar 4%
a. SDS-PAGE Protein
SDS-PAGE merupakan metode yang secara luas digunakan untuk
menganalisis protein secara kualitatif berdasarkan ukurannya dan dapat
digunakan pula untuk menentukan berat molekul relatif suatu protein
(Walker, 2002).
Dalam metode ini, sampel buffer yang digunakan mengandung
β-mercaptoethanol dan SDS. SDS (Sodium Dodecyl Sulphate) dengan struktur
kimia CH3-[CH2]10-CH2OSO3-Na+ merupakan suatu deterjen anionik yang
memiliki ujung hidrofobik pada bagian dodecyl, dan bagian yang sangat bermuatan pada gugus sulfatnya. SDS akan mendenaturasi protein. Protein
memiliki empat macam struktur, yaitu struktur primer, sekunder, tersier, dan
kuartener. Struktur primer tergantung dari jumlah dan jenis asam amino
yang menyusun suatu protein. Struktur sekunder tergantung pada alpha helix dan beta pleated sheet yang menentukan struktur reguler maupun pola lipatan protein. Struktur tersier protein berbicara tentang bentuk tiga
dimensi dari protein, sedangkan stuktur kuartener tergantung pada rantai
polipeptida atau subunit yang menyusun protein (Putnam, 1975). SDS akan
terikat kuat pada bagian hidrofobik asam amino yang menentukan
konformasi 3D protein. Akibat terikat oleh SDS maka struktur globular
protein akan terdenaturasi total menjadi protein yang linear (Hames, 2000).
Struktur linear ini menjadikan protein kehilangan muatan
non-denaturasi-nya dan menjadi bermuatan negatif. Akibat perlakuan tersebut tidak ada
digunakan untuk memutus ikatan disulfida yang membentuk struktur tersier
suatu protein (Walker, 2002).
Karena memiliki muatan negatif yang sama pada rantai peptidanya,
saat diberi medan listrik, ptrotein-SDS akan bermigrasi ke arah anoda pada
gel pemisah dengan kecepatan yang sama pula. Walaupun memiliki
kecepatan migrasi yang sama, namun ukuran protein juga menentukan
seberapa jauh protein tresebut dapat bermigrasi dalam gel pemisah
(Subramananiyan, 2002).
b. Non-denaturasi-PAGE Protein
Non-denaturasi-PAGE digunakan jika ingin mempertahankan bentuk
non-denaturasi protein yang dapat digunakan untuk mengidentifikasi
aktivitas biologi misal, aktivitas enzym, ikatan reseptor, ikatan antibodi dan
lain sebagainya Pada tipe non-denaturasi, tidak digunakan SDS maupun
agen pereduksi lainnya seperti merkaptoetanol pada saat preparasi gel
elektroforesis, loading buffer dan running buffer, selain itu pemanasan
sampel juga tidak diperlukan (Paech, 2002).
Migrasi protein melewati gel elektoforesis menuju anoda dipengaruhi
oleh berbagai macam faktor seperti, ukuran molekul, bentuk dan muatan
non-denaturasi dari protein itu sendiri. Oleh karena itu resolusi dari
Non-denaturasi-PAGE tidak sebaik pada SDS-PAGE, namun teknik ini sangat
bermanfaat jika ingin mempertahankan struktur non-denaturasi protein
Muatan non-denaturasi protein dapat dipengaruhi oleh pH gel. Jika
pH gel lebih kecil dari titik isoelektrik (pI) protein sampel, maka akan
menghasilkan muatan positif pada protein, dan jika di atas pI protein maka
akan memberikan muatan akhir negatif. Protein sampel harus memiliki pI <
7.0 agar memiliki muatan negatif agar dapat menuju anoda. Secara umum,
pada pH 2,0 hingga 4,0 maka protein akan bermuatan positif, dan akan
bermuatan negatif pada pH diatas 8.0. Oleh karena itu pemilihan pH yang
cocok sangat penting untuk memastikan bahwa protein yang kita inginkan
dapat bermigrasi dalam gel. pH Gel dapat kita kontrol dengan menentukan
pH larutan dapar sampel yang digunakan (Gallagher, 1999).
F. Landasan Teori
Penelitian terdahulu menyebutkan bahwa untuk menghasilkan suatu
sistem penghantaran obat tertarget maka dilakukan formulasi nanopartikel
yang dikonjugasikan dengan suatu antibodi penarget. Dalam penelitian
tersebut nanopartikel diformulasi menggunakan metode kompleks
polielektrolit dengan alginat dan kitosan viskositas rendah. Selanjutnya
nanopartikel dikonjugasikan dengan antibodi anti-EpCAM menggunakan
EDAC sebagai katalis.
Pemodelan nanopartikel menggunakan polimer pektin yang
dikonjugasikan dengan BSA menggunakan katalis EDAC juga telah diteliti.
Pektin yang memiliki gugus karboksilat dapat bereaksi dengan EDAC
menghasilkan suatu intermediet aktif yang dapat bereaksi dengan gugus
menghasilkan suatu biokonjugasi antara pektin dengan BSA. pH suatu
reaksi konjugasi dengan menggunakan EDAC berkisar antara pH 4,7 – 6.
Dapat dikatakan bahwa pH optimal suatu reaksi konjugasi berada diantara
rentang tersebut.
Penelitian terdahulu telah berhasil memodelkan konjugasi polimer
pektin dengan BSA menggunakan katalis EDAC dan menjelaskan spesifik
kondisi reaksi biokonjugasi. Keberhasilan pemodelan reaksi konjugasi
nanopartikel dengan antibodi melalui konjugasi pektin dan BSA yang
pernah dilakukan mendasari dilakukannya penelitian ini untuk memeriksa
lagi kondisi reaksi konjugasi yang optimum untuk mengkonjugasikan suatu
polimer pembentuk nanopartikel selain pektin yaitu alginat dengan antibodi
menggunakan katalis EDAC.
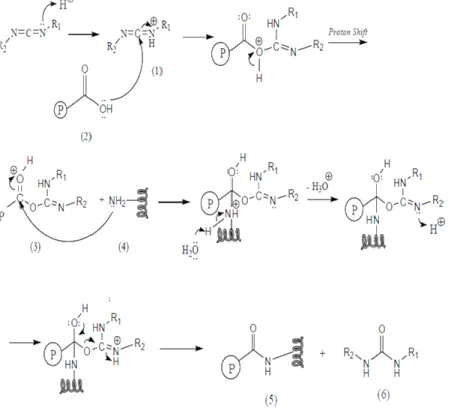
Mekanisme pembentukan ikatan amida antara alginat dengan BSA
yang diperantarai oleh EDAC terjadi dalam dua tahap. Pertama, karbonil
alginat (2) diaktivasi oleh EDAC yang telah terprotonasi (1) dan
menghasilkan senyawa intermediet aktif O-asil-isourea (3). Kedua, senyawa
intermediet aktif tersebut akan berikatan secara kovalen dengan gugus amin
primer pada protein BSA (4) dan menghasilkan alginat yang terkonjugasi
dengan BSA melalui ikatan amida (5) serta hasil samping berupa
1-etil-3-(dimetilaminopropil) urea (derivat urea) (6). Tahap pertama reaksi konjugasi
merupakan reaksi dengan laju cepat karena EDAC merupakan senyawa
Gambar 9. Mekanisme konjugasi alginat dengan Anti-EpCAM menggunakan katalis EDAC (Sheehan, Hess, 1955) .
G. Hipotesis
1. Alginat dapat dikonjugasikan dengan BSA menggunakan katalis EDAC
apabila dilakukan optimasi pada kondisi reaksi konjugasinya.
2. EDAC dapat mengkatalis reaksi konjugasi antara alginat dengan anti-EpCAM pada kondisi optimum.