(Detection of Aflatoxin B1 in Chicken Feed by The Use of Liquid Chromatography Mass Spectrometry)
Yessy Anastasia, Widiastuti R
Balai Besar Penelitian Veteriner, Jl. RE Martadinata No. 30, Bogor 16114 [email protected]
ABSTRACT
Contamination of aflatoxin B1 (AFB1) is one of the major issues that are important in the chicken industry. Confirmation of the presence of AFB1 in the feed to ensure animal health and food safety of livestock products is necessary to minimize the impact on human health. This research aimed to develop a confirmative detection of AFB1 in chicken feed using liquid chromatography mass spectrometry (LCMS). Limited monitoring of the contamination of AFB1 on the field was done on samples from the districts of Bandung, Bekasi, Sukabumi, Cianjur and Depok, West Java. Results showed that performance validation in accordance with the requirements of linearity value (R2) of 0.9996, the average recovery of 77.7% and the limit detection of 0.504 ng/g. While the results of field sample analysis showed that seven (22.58%) out of 31 corn samples were positive for AFB1 at a concentration range from 0.51 to 19.96 ng/g, 9 (16.67%) out of 54 feed samples detected at a concentration range from 1.78-71.31 ng/g AFB1 and 1 (1.85%) among them exceeded the allowable threshold of AFB1 (50 ng/g) and no samples AFB1 detected in 14 bran samples. These findings show that the samples were safe for use as feed because generally is below the maximum limit of AFB1 in the feed.
Key Words: Aflatoxin B1, Chicken Feeds, Liquid Chromatography Mass Spectrometry
ABSTRAK
Kontaminasi aflatoksin B1(AFB1) merupakan salah satu masalah utama yang penting pada industri peternakan ayam. Konfirmasi keberadaan AFB1 pada pakan diperlukan untuk menjamin kesehatan hewan dan keamanan pangan dari produk ternak dalam rangka meminimalkan dampak kesehatan pada manusia. Penelitian ini bertujuan untuk mengembangkan metode deteksi AFB1 pada pakan ayam yang konfirmatif menggunakan kromatografi cair spektrometri massa (KCSM) serta melakukan monitoring terbatas terhadap cemaran AFB1 pada sampel lapang dari Kabupaten Bandung, Bekasi, Sukabumi, Cianjur dan Kota Depok, di Jawa Barat. Hasil penelitian menunjukan performans validasi yang sesuai dengan yang dipersyaratkan yaitu nilai linieritas (R2) sebesar
0,9996, hasil uji perolehan kembali rata-rata 77,7% serta limit kuantitasi 0,504 ng/g. Sedangkan hasil analisis sampel lapang menunjukkan 7 (22,58%) dari 31 sampel jagung terdeteksi AFB1 pada kisaran konsentrasi 0,51-19,96 ng/g, 9 (16,67%) dari 54 sampel pakan terdeteksi AFB1 pada kisaran konsentrasi 1,78-71,31 ng/g dan 1 (1,85%) diantaranya melebihi ambang batas AFB1 yang diijinkan (50 ng/g) dan tidak ada sampel terdeteksi AFB1 pada 14 sampel dedak. Temuan ini menunjukkan bahwa sampel-sampel tersebut aman untuk digunakan sebagai pakan karena umumnya berada di bawah ambang batas maksimum AFB1 pada pakan.
Kata Kunci: Aflatoksin B1, Pakan, Kromatografi Cair Spektrometri Massa
PENDAHULUAN
Aflatoksin hingga saat ini tetap merupakan salah satu diantara lima jenis mikotoksin (empat lainnya adalah deoksinivalenol, zearalenon, fumonisin dan okratoksin A) yang
keberadaannya dalam pakan paling banyak mendapat perhatian (Rodrigues & Naehrer 2012). Aflatoksin merupakan senyawa metabolit yang dihasilkan terutama oleh kapang
Aspergillus flavus, namun yang paling toksik adalah aflatoksin B1 (AFB1). Aflatoksin B1
adalah mikotoksin yang paling umum dan banyak mencemari sebesar 75% dari berbagai komoditas pertanian di dunia yang digunakan untuk pangan dan pakan (Wacoo et al. 2014). Dua hal penting yang mendukung keberadaan mikotoksin adanya lingkungan panas dan lembab sebagaimana di Indonesia, dengan kisaran suhu rata-rata 28-31°C dan kelembaban 60-80%, merupakan kondisi yang kondusif untuk pertumbuhan kapang penghasil mikotoksin.
Kontaminasi AFB1 pada ayam pedaging di berbagai konsentrasi menyebabkan meningkatnya konversi pakan yang signifikan, penurunan bobot badan (Al-Shawabkeh et al. 2009). Pada ayam petelur, pemberian 894,12 ng/g AFB1 selama lima minggu menyebabkan terdeteksinya residu AFB1 di telur (0,66 ng/g) dan di hati (1,59 ng/g) (Herzallah 2013). Kajian mengenai keberadaan residu AFB1 dan metabolitnya, menunjukkan bahwa residu ditemukan pada jaringan tubuh (daging) dan hati dari ayam yang berhasil menetas maupun susu (Widiastuti 2014).
Penelitian Bahri et al. (2005) mengenai cemaran AFB1 pada sampel jagung dan pakan komersial yang dianalisis secara KCKT menunjukkan 86,7% jagung dan 70% pakan komersial asal Provinsi Lampung mengandung cemaran AFB1 dengan kadar rata-rata masing-masing 31,5 dan13,5 ng/g serta 100% jagung dan pakan komersial asal jawa Timur terdeteksi dengan kadar rata-rata 25,4 dan 30,7 ng/g. Sedangkan hasil pengujian mikotoksin pada jagung lokal maupun impor asal berbagai pabrik pakan di Indonesia (Jawa, Sumatera Utara, Lampung dan Sulawesi Selatan) yang diuji secara enzyme linked
immunosorbent assays (ELISA) oleh Tangendjaja et al. (2008) menunjukkan bahwa AFB1
terdeteksi pada kisaran konsentrasi 19,1 hingga 87,4 ng/g. Demikian pula hasil penelitian yang dilakukan Rubak (2011) pada 75 sampel jagung asal Kabupaten Kupang (NTT) yang dianalisis secara ELISA menunjukkan 95% diantaranya mengandung cemaran AFB1 <15 ng/g dan 5% sisanya >15 ng/g dengan tingkat konsentrasi tertinggi 42,3 ng/g.
Mengingat bahaya aflatoksin terhadap ternak maupun manusia, International Agency
for Research on Cancer (IARC) mengklasifikasikan aflatoksin sebagai salah satu
penyebab kanker pada manusia, dimana AFB1diklasifikasikan dalam grup 1 (bahan yang bersifat karsinogenik terhadap manusia). Oleh karenanya, banyak negara termasuk Indonesia menetapkan ambang batas aflatoksin untuk berbagai jenis pakan yang berbeda-beda sesuai dengan jenis ternaknya (ayam, sapi dan itik) melalui Standar Nasional Indonesia (SNI) (Mentan 2009) untuk menjamin keamanan pakan dan pangan dalam rangka meminimalkan dampak kesehatan yang ditimbulkan. Ambang batas AFB1 untuk pakan ayam adalah 50 ng/g dan untuk pakan ruminansia adalah 200 ng/g. Sedangkan ambang batas aflatoksin pada produk pangan yang diatur dalam SNI 7385:2009 adalah 15 ng/g untuk AFB1 dan 20 ng/g untuk aflatoksin total (SNI 2009).
Metode deteksi yang umum digunakan dalam mendeteksi AFB1 pada pakan, diantaranya adalah ELISA dan kromatografi cair kinerja tinggi (KCKT). Kuantifikasi secara ELISA adalah sebagai aflatoksin total (Leszczynska et al. 2001). Sedangkan secara KCKT mampu membedakan masing-masing jenis aflatoksin baik untuk penggunaan detektor dioda array (Zambonin et al. 2002), maupun detektor fluoresen (Jaimez et al. 2000). Namun, KCKT masih belum bersifat konfirmatif karena tidak dapat membedakan senyawa target yang memiliki waktu retensi dan struktur kimia yang sama. Oleh karena KCSM (Rajkumar et al. 2013) maupun KCSMSM (Johnston et al. 2012) mampu mengidentifikasi dan mengkuantitasi senyawa secara konfirmatif berdasarkan rasio bobot masa terhadap muatannya (m/z) secara lebih selektif dan sensitif (Grío et al. 2010), maka
Tujuan dari penelitian ini adalah melakukan pengembangan metode deteksi AFB1 pada pakan ayam berbasis jagung menggunakan KCSM yang belum pernah dilaporkan sebelumnya di Indonesia. Pada penelitian, pemurnian (clean-up) dilakukan menggunakan Oasis HLB solid phase extraction (SPE) cartridge untuk menggantikan immunoaffinity
column (IAC) SPE yang umum digunakan (McDaniel et al. 2011). Immunoaffinity column
SPE tidak digunakan pada penelitian ini karena tidak ekonomis serta mempunyai keterbatasan dengan waktu simpan singkat. Hasil pengembangan metode analisis ini diaplikasikan untuk mendeteksi sampel jagung, pakan ayam berbasis jagung dan dedak yang berasal dari lapang.
MATERI DAN METODE
Metode ekstraksi AFB1
Metode deteksi aflatoksin dengan KCSM yang meliputi ekstraksi dan deteksi dilakukan dengan mengadopsi metode yang telah dikembangkan oleh Bacaloni et al. (2008) dan Shimadzu (2002). Sejumlah 1 g sampel jagung atau pakan ayam dimasukkan ke dalam 50 ml tabung sentrifus propilen dan diekstrak dengan menambahkan 20 ml asetonitril/air (80:20 v/v), kemudian diletakkan pada alat ultrasonic bath selama 10 menit. Selanjutnya sampel dilarutkan dengan 250 ml dengan air dan dimurnikan melalui kolom Oasis HLB SPE cartridge yang telah dikondisikan dengan cara melewatkan 5 ml diklorometan/metanol (50/50 v/v), dan 2 ml metanol dan 5 ml air dengan kecepatan alir 20 ml/menit. Sampel di dalam SPE kemudian dicuci dengan 10 ml air dan kolom dibiarkan mengering. Selanjutnya analit dielusi dengan 1 ml metanol, 5 ml metanol/diklorometan (80:20 v/v) dan ditampung dan kemudian dikeringkan dengan nitrogen evaporator pada suhu 40°C.
Penetapan secara KCSM
Sampel kering dilarutkan dengan 1 ml metanol/air (40:60 v/v) dan ditempatkan ke dalam autosampler dari KCSM (Shimadzu) yang dilengkapi dengan sumber electro spray
ionization (ESI) yang dioperasikan pada positif ion mode. Pemisahan dilakukan
menggunakan kolom Sunfire C18 (3x150 mm, 5 µm ukuran partikel) serta guard column
(Sentry Guard column 3x20 mm id) dan dipisahkan dengan fasa gerak campuran metanol 10 mM amonium asetat (70:30 v/v) yang dialirkan secara binary gradient dengan kecepatan alir 0,2 ml/menit. Volume injeksi adalah 10 μL.
Parameter spektrometri massa (SM) yang digunakan voltase kapiler 3 kV, temperatur blok 200°C, temperatur CDL 250°C, aliran nebulizing gas.1,5 l/menit dan gas cone 1,5 l/menit, detector voltage 1,5 kV, cone voltage 45V. Ion-ion dimonitor pada single ion
recording yang terprotonasi menjadi [M+H]+ pada m/z 313.2 untuk AFB1.
Validasi metode
Validasi metode dilakukan untuk membuktikan kelayakan metode yang diuji sesuai dengan yang dipersyaratkan. Perlakuan validasi metode meliputi uji linearitas, limit deteksi dan uji perolehan kembali (recovery).
Pengumpulan sampel lapang
Sebanyak 31 sampel jagung, 54 sampel pakan dan 14 sampel dedak dikumpulkan dari berbagai poultry shop di Kabupaten Bandung, Bekasi, Sukabumi, Cianjur dan Kota Depok pada bulan Juli 2011. Sampel disimpan pada -20°C hingga saat analisis, dengan terlebih dahulu digiling halus hingga homogen dan dianalisis sebagaimana prosedur yang telah dijelaskan di atas.
HASIL DAN PEMBAHASAN
Hasil pengembangan metode konfirmasi KCSM
Keberadaan spektrometri massa (SM) dalam menganalisis mempunyai keunggulan dalam mengubah molekul analit menjadi bentuk terionisasi (bermuatan) dalam fasa gas dan memisahkan ion-ion tersebut berdasarkan rasio bobot masa terhadap muatannya (m/z). Ionisasi terjadi oleh adanya mekanisme evaporisasi pada voltage yang tinggi. Dengan demikian, konfirmasi identitas suatu senyawa menjadi sangat spesifik. Kelebihan KCSM dibandingkan dengan metode konvensional KCKT adalah tidak diperlukan proses derivatisasi (yang bertujuan untuk meningkatkan respon analit) (Kok 1994).
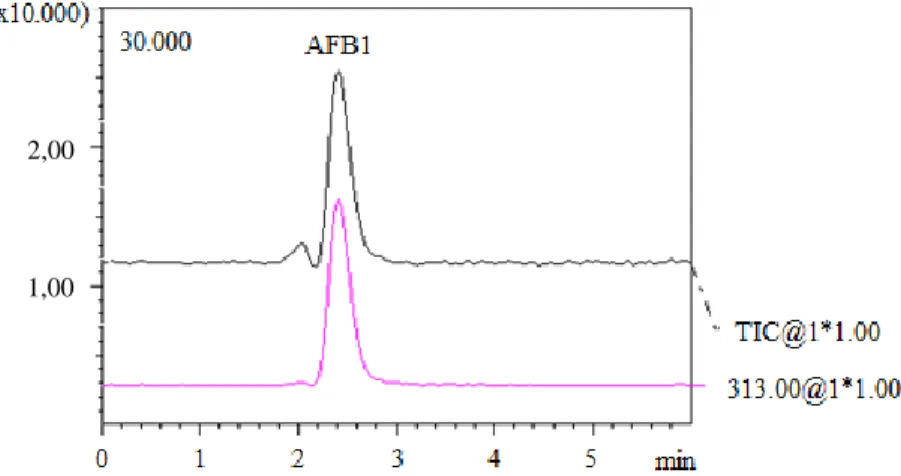
Hasil identifikasi senyawa target (AFB1) pada uji secara KCSM disajikan pada Gambar 1. Senyawa target (AFB1) dapat diketahui dari pecahan ionisasi senyawa tersebut yaitu pada m/z 313 ditandai dengan puncak (peak) dari senyawa target yang muncul pada waktu retensi. Selanjutnya kuantifikasi dilakukan seperti pada penghitungan dengan KCKT yaitu dengan membandingkan luas puncak dari kromatogram dalam sampel terhadap kromatogram dalam larutan standar.
Gambar 1. Hasil identifikasi senyawa target (AFB1) pada uji secara KCSM
Hal terpenting yang tidak dapat diabaikan dari rangkaian analisis adalah proses pemurnian (cleanup) yang umumnya menggunakan immuno affinity columns (IAC).
Immuno affinity columns berbasis mono atau poliklonal antibodi yang diimobilisasi pada
fasa padat (solid). Immuno affinity columns bersifat sangat selektif dan cepat untuk mengekstraksi mikotoksin dari pengotor yang kompleks. Sedangkan SPE umumnya berharga lebih murah, kurang spesifik dan selektif bila dibandingkan dan IAC, namun kelemahan utama dari IAC adalah harganya mahal serta penggunaan hanya untuk sekali pakai, serta keterbasan masa simpan (lifetime) (Prelle et al. 2013). Grío et al. (2010) pada penelitiannya juga mendapatkan bahwa SPE C18 memberikan hasil uji perolehan kembali
2,00
Validasi metode
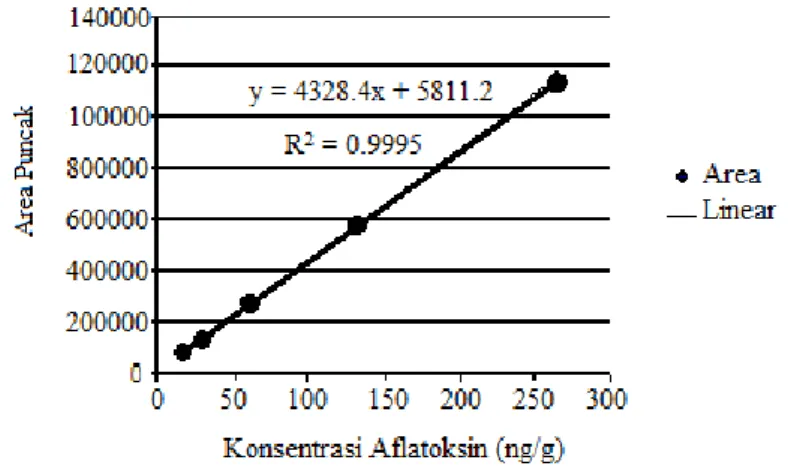
Hasil pengujian linieritas pada lima konsentrasi AFB1 yang berbeda yaitu: (1) 15,625 ng/g; (2) 31,25 ng/g; (3) 62,5 ng/g; (4) 125 ng/g; dan (5) 250 ng/g memberikan persamaan garis dengan nilai y = 4.328,4x + 5.811,2 dan linieritas (r2) sebesar 0,9995 yang mengartikan bahwa nilai tersebut memenuhi persyaratan yang dapat dilihat pada Gambar 2.
Hasil uji perolehan kembali (recovery) yang dilakukan dengan menambahkan standar AFB1 pada sampel jagung dengan konsentrasi 10 dan 20 ng/g, selanjutnya diekstrak dan dikuantifikasi konsentrasi AFB1 yang akan diperoleh kembali dengan LCMS. Hasil uji perolehan kembali dapat dilihat pada Tabel 1, dengan nilai rata-rata uji perolehan kembali adalah 69,36% untuk penambahan 10 ng/g AFB1 dan 86,09% untuk penambahan 20 ng/g AFB1atau secara keseluruhan memberi nilai rata-rata sebesar 77,7%. Nilai uji perolehan kembali ini masih lebih rendah bila dibandingkan dengan hasil yang diperoleh Grío et al. (2010) yang mendapatkan nilai uji perolehan kembali sebesar 84% pada penambahan 10 ng/g AFB1 dan dimurnikan menggunakan SPE C18.
Gambar 2. Hasil pengujian linieritas pada lima konsentrasi AFB1
Tabel 1. Hasil uji perolehan kembali AFB1 pada matrik jagung AFB1 (ng/g) yang
ditambahkan
AFB1 (ng/g) yang diperoleh
Nilai uji perolehan kembali (%)
Rata-rata nilai uji perolehan kembali (%)
10 6,833 68,33
7,038 70,38 69,36
20 16,725 83,62
17,711 88,55 86,09
Nilai keseluruhan rata-rata uji perolehan kembali 77,70
Hasil penentuan limit deteksi pada konsentrasi 0,5 ng/g, analisisnya diulang tujuh kali, kemudian dihitung menggunakan rumus limit deteksi konsentrasi AFB1yang diuji + 3 SD (simpangan), maka diperoleh nilai limit deteksi (LOD) 0,504 ng/g. Nilai LOD ini setara dengan yang diperoleh oleh Tanaka et al. (2002) dan masih lebih baik dibandingkan dengan yang diperoleh Lattanzio et al. (2007) yaitu 0,6 ng/g. Selanjutnya sampel yang memberi nilai lebih kecil dari 0,504 ng/g akan dinyatakan sebagai tidak terdeteksi (tt).
Hasil analisis sampel lapang
Metode yang telah divalidasi diaplikasikan untuk menganalisis 31 sampel jagung, 54 sampel pakan dan 14 sampel dedak pada sampel yang berasal dari Kabupaten Bandung,
Bekasi, Sukabumi, Cianjur dan Kota Depok. Hasil analisis tehadap sampel-sampel tersebut dapat dilihat pada Tabel 2 di bawah ini.
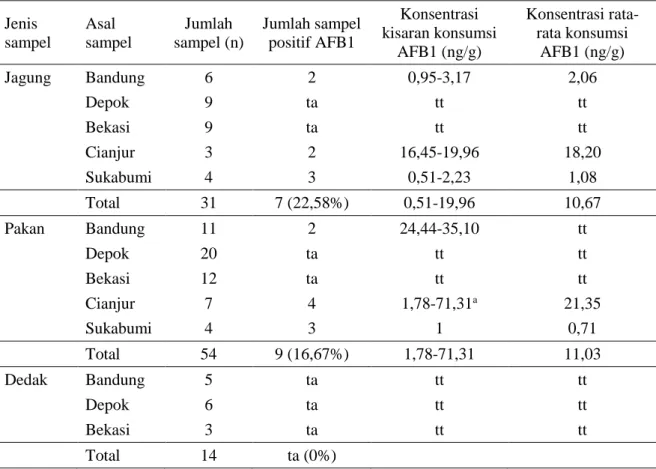
Tabel 2. Hasil analisis AFB1 secara KCSM Jenis sampel Asal sampel Jumlah sampel (n) Jumlah sampel positif AFB1 Konsentrasi kisaran konsumsi AFB1 (ng/g) Konsentrasi rata-rata konsumsi AFB1 (ng/g) Jagung Bandung 6 2 0,95-3,17 2,06 Depok 9 ta tt tt Bekasi 9 ta tt tt Cianjur 3 2 16,45-19,96 18,20 Sukabumi 4 3 0,51-2,23 1,08 Total 31 7 (22,58%) 0,51-19,96 10,67 Pakan Bandung 11 2 24,44-35,10 tt Depok 20 ta tt tt Bekasi 12 ta tt tt Cianjur 7 4 1,78-71,31a 21,35 Sukabumi 4 3 1 0,71 Total 54 9 (16,67%) 1,78-71,31 11,03 Dedak Bandung 5 ta tt tt Depok 6 ta tt tt Bekasi 3 ta tt tt Total 14 ta (0%)
a: Konsentrasi melebihi ambang batas (50 ng/g); ta: Tidak ada; tt: Tidak terdeteksi (konsentrasi ≤0,50 ng/g)
Pada sampel jagung, 7 (22,58%) diantaranya positif terdeteksi AFB1 pada kisaran konsentrasi 0,51-19,96 ng/g dan berasal dari lokasi Kabupaten Bandung, Cianjur dan Sukabumi. Jagung merupakan bahan utama penyusun pakan ayam. Produksi aflatoksin oleh A. flavus terjadi mulai dari saat tanam, pasca-panen, pemrosesan menjadi pakan, penyimpanan maupun siap diberikan kepada ternak pada kondisi lingkungan yang mendukung (Fareed et al. 2014). Temuan pada penelitian ini menunjukkan temuan yang lebih baik dibandingkan dengan temuan Tangendjaja et al. (2008) yang mendapatkan konsentrasi AFB1 pada jagung lokal asal Provinsi Sumatera Utara (19,1 ng/g), Lampung (26,0 ng/g), Jawa Timur (64,0 ng/g), Jawa Tengah (87,4 g/g) maupun Sulawesi Utara (72,6 ng/g).
Pada sampel pakan, 9 (16,67%) diantara 54 sampel yang dianalisis positif terdeteksi AFB1 pada kisaran konsentrasi 1,78-71,31 ng/g dengan rata-rata konsentrasi 0,71-21,35 ng/g dan 1 sampel diantaranya (asal Cianjur) melebihi ambang batas AFB1 yang diijinkan (50 ng/g). Kondisi tersebut masih lebih baik dibandingkan dengan rata-rata sampel yang
disurvey pada tahun 2009-2010 di kawasan Malaysia, Filipina, Thailand, Vietnam dan
Indonesia oleh Rodrigues & Naehrer (2012) yaitu pada konsentrasi rata-rata 43 ng/g. Temuan dari penelitian ini lebih baik dibandingkan dengan temuan Anjum et al. (2012) pada 410 sampel pakan ayam, 49,68% dari pakan halus mengandung rata-rata AFB1 25,12 ng/g dan 41,32% pakan crumb mengandung rata-rata AFB1 22,37 ng/g.
Sedangkan sampel dedak tidak ada yang mengandung AFB1. Tidak adanya kontaminan pada dedak sejalan dengan temuan Kajuna et al. (2013) yang menyatakan bahwa dedak mempunyai tingkat kontaminasi AFB1 terendah dibandingkan dengan bahan lainnya, karena dedak adalah produk samping dari produk pangan (beras atau jagung) yang terpilih dengan kualitas baik yang digunakan untuk pangan manusia. Zaboli et al. (2010) mendapatkan kontaminasi AFB1 sebesar 5,1 dan 6,1 ng/g pada dedak lama dan baru. Paranagama et al. (2003) menyatakan penyebab rendahnya kontaminasi AFB1 karena adanya enzim yang mencegah terbentuknya aflatoksin.
Dari hasil uji sampel lapang ini dapat disimpulkan bahwa jagung, pakan ayam dan dedak yang diuji terhadap kontaminan AFB1 masih aman untuk digunakan sebagai pakan ternak ayam. Rendahnya temuan di atas kemungkinan berkaitan dengan waktu pengambilan sampel di bulan Juli (musim kemarau) dan sejalan dengan temuan Tangendjaja et al. (2008) yang melaporkan jagung yang dipanen pada musim hujan mengandung AFB1 sebesar 66,4 ng/g yang berarti lebih tinggi dibandingkan dengan yang dipanen di musim kemarau yaitu sebesar 36,5 ng/g, maupun Anjum et al. (2012) di Pakistan memperlihatkan bahwa kejadian kontaminasi sangat signifikan terjadi di musim hujan dibandingkan dengan di bulan-bulan lainnya.
KESIMPULAN
Metode deteksi AFB1 pada jagung dan pakan ayam dan dedak menggunakan KCSM yang mudah dan cepat dan menggunakan OASIS HLB SPE untuk proses pemurnian telah dikembangkan untuk pendeteksian yang konfirmatif dan memberi hasil validasi yang memenuhi persyaratan. Aplikasi pengembangan metode pada 31 sampel jagung, 54 sampel pakan dan 14 sampel dedak yang dianalisis menujukkan bahwa sampel-sampel tersebut masih aman untuk digunakan sebagai pakan ternak ayam, terkecuali untuk satu pakan yang mengandung 71,31 ng/g AFB1. Penggunaan uji deteksi secara LCMS ini masih dapat diperluas untuk pengujian jenis-jenis aflatoksin, yaitu aflatoksin B2 (AFB2), aflatoksin G1 (AFG1) dan aflatoksin G2 (AFG2) serta jenis mikotoksin lainnya secara simultan.
UCAPAN TERIMA KASIH
Penelitian ini didanai oleh DIPA APBN 2011. Ucapan terima kasih ditujukan kepada Kepala Dinas Pertanian Kabupaten Bandung, Kepala Dinas Peternakan, Perikanan dan Kelautan Kabupaten Bekasi, Kepala Dinas Peternakan Kabupaten Sukabumi, Kepala Dinas Dinas Peternakan dan Perikanan Kabupaten Cianjur, Kepala Dinas Pertanian Kota Depok atas ijin dan kerjasamanya dalam pengumpulan sampel lapang. Ucapan terima kasih secara khusus ditujukan kepada Sdr. Rachmat Firmansyah, S.Si. yang membantu dalam menganalisis sampel.
DAFTAR PUSTAKA
Al-Shawabkeh K, Herzallah S, Al-Fataftah A, Zakaria H. 2009. Effect of aflatoxin B1 contaminated feed on broiler chickens performance and meat content of conjugated linoleic acid. Jordan J Agric Sci. 5:314-323.
Anjum MA, Khan SH, Sahota W, Sardar R. 2012. Assessment of aflatoxin B1 in commercial poultry feed and feeding ingredients. J Anim Plant Sci. 22:268-272.
Bacaloni A, Cavaliere C, Cucci F, Foglia P, Samperi R, Laganà A. 2008. Determination of aflatoxins in hazelnuts by various sample preparation methods, and liquid chromatography-tandem mass spectrometry. J Chromatogr A. 1179:182-189.
Bahri S, Maryam R, Widiastuti R. 2005. Cemaran aflatoksin pada pakan dan bahan pakan dari Provinsi Lampung dan Jawa Timur. J Ilmu Ternak dan Vet. 10:236-241.
Fareed G, Khan SH, Anjum MA, Ahmed N. 2014. Determination of aflatoxin and ochratoxin in poultry feed ingredients and finished feed in humid semi-tropical environment. J Adv Vet Anim Res. 1:201-207.
Grío SJL, Frenich AG, Vidal JLM, Romero-González R. 2010. Determination of aflatoxins B1, B2, G1, G2 and ochratoxin a in animal feed by ultra high-performance liquid chromatography-tandem mass spectrometry. J Sep Sci. 33:502-508.
Herzallah SM. 2013. Aflatoxin B1 residue in eggs and flesh of laying hens fed aflatoxin B1 contaminated diet. Am J Agric Biol Sci. 8:156-161.
Jaimez J, Fente CA, Vazquez BI, Franco CM, Cepeda A, Mahuzier G, Prognon P. 2000. Application of the assay of aflatoxins by liquid chromatography with fluorescence detection in food analysis. J Chromatogr A. 882:1-10.
Johnston CI, Singleterry RR, Reid C, Sparks D, Brown A, Baldwin B, Ward SH, Williams P. 2012. The fate of aflatoxin in corn fermentation. Nat Res.3:126-136.
Kajuna FF, Temba BA., Mosha RD. 2013. Surveillance of aflatoxin B1 contamination in chicken commercial feeds in Morogoro, Tanzania. Livest Res Rural Dev [Internet]. 25. Available from: http://www.lrrd.org/lrrd25/3/kaju25051.htm
Kok WT. 1994. Derivatization reactions for the determination of aflatoxins by liquid chromatography with fluorescence detection. J Chromatogr B Biomed Appl. 659:127-137. Lattanzio VMT, Solfrizzo M, Powers S, Visconti A. 2007. Simultaneous determination of
aflatoxins, ochratoxin A and fusarium toxins in maize by liquid chromatography/tandem mass spectrometry after multitoxin immunoaffinity cleanup. Rapid Commun Mass Spectrom. 21:3253-3261.
Leszczynska J, Maslowska J, Owczarek A, Kucharska U. 2001. Determination of aflatoxins in food products by the ELISA method. Czech J Food Sci. 19:8-12.
McDaniel A, Holmes WE, Williams P, Armbrust KL, Sparks DL, Brown AE. 2011. Effect of matrix clean-up for aflatoxin analysis in corn and dried distillers grains. Nat Resour. 2:250-257.
Mentan. 2009. Peraturan Menteri Pertanian Nomor 19/Permentan/OT.140/4/2009 tentang Syarat dan Tatacara Pendaftaran Pakan. Jakarta (Indonesia): Kementerian Pertanian.
Paranagama PA, Abeysekera KHT, Abeywickrama K, Nugaliyadde L. 2003. Fungicidal and anti-aflatoxigenic effects of the essential oil of Cymbopogon citrata (DC) Strapf (lemongrass) against Aspergillus flavus Link isolated from stored rice. Lett Appl Microbiol. 37:86-90. Prelle A, Spadaro D, Denca A, Garibaldi A, Gullino ML. 2013. Comparison of clean-up methods
for ochratoxin A on wine, beer, roasted coffee and chili commercialized in Italy. Toxins. 5:1827-44.
Rajkumar K, Venkateswaran G, Malathi R. 2013. Detection of aflatoxin B1, B2, G1 and G2 in Rhizozphere and Rhizozplane of (Zea mays) maize plants using liquid chromatography-mass spectrometry. Glob J Biosci Biotech. 2 :180-186.
Rodrigues I, Naehrer K. 2012. Prevalence of mycotoxins in feedstuffs and feed surveyed worldwide in 2009 and 2010. Phytopathol Mediterr. 51:175-192.
Shimadzu. 2002. LC-MS Application data sheet No. 050: Analysis of aflatoxins using LCMS-2010A. Tokyo (Japan): Shimadzu Corporation. International Marketing Division.
SNI. 2009. SNI 7385:2009. Batas maksimum kandungan mikotoksin dalam pangan. Jakarta (Indonesia): Badan Standardisasi Nasional.
Tanaka T, Yoneda A, Sugiura Y, Inoue S, Takino M, Tamaka A, Shinoda A, Suzuki H, Akiyama H, Toyoda M. 2002. An application of liquid chromatography and mass spectrometry for determination of aflatoxins. Mycotoxins. 52:107-112.
Tangendjaja B, Rachmawati S, Wina E. 2008. Mycotoxin contamination on corn used by feed mills in Indonesia. Indonesia J Agric. 9:68-76.
Wacoo AP, Wendiro D, Vuzi PC, Hawumba JF. 2014. Methods for detection of aflatoxins in agricultural food crops. J App Chem. 2014:1-15.
Widiastuti R. 2014. Residu aflatoksin dan metabolitnya pada berbagai peroduk pangan asal hewan dan pencegahannya. Wartazoa. 24:179-190.
Zaboli F, Khosravi AR, Gholampourazizi I, Norouzi M, Erfanmanesh A. 2010. A study of aflatoxins production in rice bran from Mazandran Province, Northern Iran. Glob Vet. 4:39-44. Zambonin C, Monaci L, Aresta A. 2002. Solid-phase microextraction high performance liquid chromatography and diode array detection for the determination of mycophenolic acid in cheese. Food Chem. 78:249-254.
DISKUSI
Pertanyaan
a. Apakah deteksi aflatoksin dalam pakan ayam menggunakan metode ini melalui proses
pengembangan metode terlebih dahulu?
b. Apakah ada pembedaan atau adakah kelebihan dari pengujian secara cepat yang saat
ini banyak digunakan, contohnya ELISA dalam identifikasi aflatoksin dalam pakan dengan metode yang digunakan dalam penelitian yaitu KCSM?
Jawaban
a. Ya, sebelum dilakukan analisis dan identifikasi terhadap sampel-sampel pakan,
dilakukan pengembangan dan validasi metode terlebih dahulu yang dilakukan dengan beberapa parameter validasi
b. Pengujian secara KCSM yang digunakan mampu mengindentifikasi dan
mengkuantitasi senyawa secara konfirmatif berdasarkan rasio bobot massa terhadap muatannya (m/z) sehingga lebih selektif serta sensitif dibandingkan dengan metode ELISA