i
KERAGAMAN GEN MHC DRB3
exon
2 (
Major Histocompatibility
Complex
) PADA POPULASI SAPI BALI DAN SAPI HASIL
PERSILANGAN
SKRIPSI
WENY DWI NINGTIYAS I 111 10 259
JURUSAN PRODUKSI TERNAK FAKULTAS PETERNAKAN UNIVERSITAS HASANUDDIN
MAKASSAR 2014
ii KERAGAMAN GEN MHC DRB3 exon 2 (Major Histocompatibility Complex)
PADA POPULASI SAPI BALI DAN SAPI HASIL PERSILANGAN
SKRIPSI
WENY DWI NINGTIYAS I 111 10 259
Sebagai Salah Satu Syarat untuk Memperoleh Gelar Sarjana pada Fakultas Peternakan Universitas Hasanuddin
FAKULTAS PETERNAKAN UNIVERSITAS HASANUDDIN
MAKASSAR 2014
iii
PERNYATAAN KEASLIAN
1. Yang bertanda tangan dibawah ini: Nama : Weny Dwi Ningtiyas NIM : I 111 10 259
Menyatakan dengan sebenarnya bahwa: a. Karya skripsi yang saya tulis adalah asli
b. Apabila sebagian atau seluruhnya dari karya skripsi, terutama dalam Bab Hasil dan Pembahasan tidak asli atau plagiasi maka bersedia dibatalkan atau dikenakan sanksi akademik yang berlaku.
2. Demikian pernyataan keaslian ini dibuat untuk dapat dipergunakan sepenuhnya.
Makassar, Juni 2014 TTD
iv
HALAMAN PENGESAHAN
Judul Penelitian : Keragaman Gen MHC DRB3 exon 2 (Major Histocompatibility Complex) pada Populasi Sapi Bali dan Sapi Hasil Persilangan
Nama : Weny Dwi Ningtiyas
No. Pokok : I 111 10 259 Program Studi : Produksi Ternak Jurusan : Produksi Ternak Fakultas : Peternakan
Skripsi ini telah diperiksa dan disetujui oleh:
Pembimbing Utama
Dr. Muh. Ihsan A.Dagong, S.Pt., M.Si. NIP. 19770526200212 1 003
Dekan Fakultas Peternakan
Prof. Dr. Ir. Syamsuddin Hasan, M.Sc. NIP. 19520923 197903 1 002
Tanggal Lulus : Juni 2014
Pembimbing Anggota
Dr. Andi Baso Lompengeng Ishak, S.Pt., M.P NIP. 19691029 199603 1 001
Ketua Jurusan Produksi Ternak
Prof. Dr. Ir. H. Sudirman Baco, M.Sc. NIP. 19641231 198903 1 025
v
ABSTRAK
WENY DWI NINGTIYAS (I 111 10 259). Keragaman Gen MHC DRB3 exon 2
(Major Histocompatibility Complex) pada Populasi Sapi Bali dan Sapi Hasil Persilangan Dibimbing oleh Muh. Ihsan A. Dagong sebagai pembimbing Utama dan Andi Baso Lompengeng Ishak sebagai pembimbing anggota.
Penelitian ini bertujuan untuk mengetahui keragaman (polimorfisme) gen MHC DRB3 (exon 2), pada populasi sapi Bali dan sapi hasil persilangan (Sapi Simmental, Limousin, Brahman, Ongole, Angus, Hereford, dan Brangus). Sampel darah diekstraksi dengan menggunakan Kit DNA ekstraksi Genjet Genomic DNA Extraction (Thermo Scientific), diamplifikasi dengan teknik PCR (Polymerase Chain Reaction), kemudian produk PCR dipotong dengan enzim restriksi HaeIII. Analisis polimorfisme meliputi frekuensi alel dan genotipe, heterozigositas pengamatan (Ho), heterozigositas harapan (He) dan kesetimbangan Hardy Weinberg. Variasi genetik diantara populasi dihitung berdasarkan frekuensi alel dan genotipnya. Sebagian besar populasi yang diteliti menunjukkan polimorfisme gen MHC dengan frekuensi masing-masing alel yang ditemukan pada sapi Bali dan sapi hasil persilangan yaitu alel A, B, C, D, E dan F. Alel C dan E adalah alel yang paling umum pada seluruh populasi sedangkan alel langka adalah alel D. Dari hasil penelitian genotipe yang ditemukan pada sapi Bali yaitu AC (0,02), BC (0,02), CC (0,10), EB (0,02), EC (0,40), EE (0,14), FA (0), FC (0,16), FE ( 0,12) dan FF (0). Sedangkan frekuensi genotipe pada sapi hasil persilangan yaitu AC (0,18), BC (0,06), CC (0,16), EB (0,06), EC (0,14), EE (0,10), FA (0,06), FC (0,08), FE ( 0,10) dan FF (0,02). Pada populasi sapi Bali diperoleh nilai (Ho) 0,755 dan nilai (He) yaitu 0,644. Pada sapi hasil persilangan nilai (Ho) 0,708, dan nilai (He) 0,734. Nilai chi- square pada sapi Bali 5,553 dan pada sapi hasil persilangan 14,395 (P< 0,05) menunjukkan bahwa MHC|HaeIII tidak berada dalam keseimbangan Hardy- Weinberg.
vi
ABSTRACT
WENY DWI NINGTIYAS (I 111 10 259). Polymorphisms of MHC DRB3 exon 2 Gene In Bali and Crossbred Cattle. Supervised by Muhammad Ihsan A Dagong as the main supervisor and Andi Baso Lompengeng Ishak as the co supervisor.
The aim of this study to analyzed the genetic polymorphisms of MHC DRB3 exon 2 genes in Bali and Crossbreds cattle. The genomic DNA was extracted by using Genomic DNA extraction Kit and then MHC DRB3 genes were amplified by PCR with predicted amplicon length 285bp. To identified allelic variation the PCR product were cut with HaeIII enzymes restriction. Genetic variation between the population were calculated based on genotypic and allelic frequencies, observed heterozygosity (Ho), expected heterozygosity (He) and the Hardy-Weinberg equilibrium. Most populations studied were polymorphic, with 6 allele found in Bali and Crossbreeds cattle A, B, C, D, E and F,were the most common allele found in all populations were C and E, while the rare allele was D. The MHC genotypes frequencies of Bali cattle were AC (0,02), BC (0,02), CC (0,10), EB (0,02), EC (0,40), EE (0,14), FA (0), FC (0,16), FE ( 0,12) and FF (0). While the MHC genotypes frequencies from Crosbreeds cattle were AC (0,18), BC (0,06), CC (0,16), EB (0,06), EC (0,14), EE (0,10), FA (0,06), FC (0,08), FE ( 0,10) and FF (0,02). In Bali cattle population the observed heterozygosity value (Ho) was
0,755 while in Crossbreds cattle, value (Ho) was 0,708. And the expected
heterozygosity in Bali population (He) was 0,644, while in the Crossbreeds (He)
was 0,734. Chi- square value in Bali cattle 5,553 and Crossbred cattle 14,395 (P< 0,05) showed that MHC|HaeIII were not Hardy- Weinberg equilibrium.
vii
KATA PENGANTAR
Bismillahirahmanirahim…..
Assalamualaikum warahmatullahi wabarakatuh
Puji syukur kita panjatkan kehadirat Allah SWT, karena rahmat dan hidayah-Nya sehingga Tugas Akhir / Skripsi ini dapat diselesaikan dengan tepat waktu. Skripsi dengan judul “Keragaman Gen MHC DRB3 exon 2 (Major Histocompatibility Complex) pada Populasi Sapi Bali dan Sapi Hasil Persilangan” Sebagai Salah Satu Syarat untuk memperoleh Gelar Sarjana pada Fakultas Peternakan Universitas Hasanuddin, Makassar.
Ucapan terima kasih dan penghargaan setinggi-tingginya penulis hanturkan dengan penuh rasa hormat kepada :
1. Dr. Muh. Ihsan A. Dagong, S.Pt., M.Si selaku Pembimbing utama dan Dr. Andi Baso Lompengeng Ishak, S.Pt., M.P selaku pembimbing Anggota, atas segala bantuan, saran, nasehat serta keikhlasannya untuk memberikan bimbingan , dari awal penelitian sampai selesainya penulisan skripsi ini. 2. Secara khusus penulis mengucapkan terima kasih yang sebesar-besarnya
dengan segenap cinta dan hormat kepada ayah tercinta Bayu Nugroho, S.Pd
dan ibu St. Hartati atas segala doa, motivasi, dan kasih sayang serta materi yang diberikan kepada penulis dan saudara saya Yuyun Wulandari S.Ip yang senantiasa memberikan arahan dan ocehan ketika penulis mengalami masalah.
viii
3. Prof. Dr. Ir. Syamsuddin Hasan, M.Sc selaku Dekan Fakultas Peternakan dan seluruh Staf Pegawai Fakultas Peternakan, terima kasih atas segala bantuan kepada penulis selama menjadi mahasiswa.
4. Prof. Dr. Ir. H. Sudirman Baco, M,Sc selaku ketua Jurusan Produksi Ternak beserta seluruh Dosen dan Staf jurusan Produksi Ternak atas segala bantuan kepada penulis selama menjadi mahasiswi.
5. Bapak Prof. Dr. Ir. H. Basit Wello, M.Sc. selaku Penasehat Akademik.
6. Ibu Dosen drh. Hj. Farida Nur Yuliati, M.Si sebagai Koordinator Laboratorium Mikrobiologi Hewan dan Prof. Dr. Ir. H. Herry Sonjaya, DEA. DES sebagai Koordinator Laboratorium Fisiologi Ternak terima kasih atas bimbingan dan arahannya selama 2 tahun.
7. Terima Kasih kepada Samsu Alam Rab selaku teman setia yang telah banyak memberikan dukungan baik berupa moril dan materi, semangat dalam aktivitas perkuliahan sampai penyusunan skripsi.
8. Teman-teman setim penelitian Tendhy, Ipha, K’endha, K’piiy, K’jaidin, dan terkhusus kepada kanda Nurul Purnomo, S.Pt., M.Si, K’Tri, K’Uya, dan Ibu
Ida atas segala bantuan sarana dan prasarana, ilmu dan doa dari awal penelitian sampai akhir penelitian
9. Sahabat-sahabat ”Manajemen Ternak Potong” – Pute, David, Ewink,
K’anjar, K’Lina’ K’abid, terima kasih atas segala canda tawa, ke-usilan, serta kebersamaan selama ini.
10 Kepada sahabat terkasih dan tersayang “Dinda_ ucy, tendhy, mhy2, inna,
ix
kebersamaan yang kalian berikan, semoga dilain waktu dan kesempatan kita dapat bertemu kembali.
11 Kepada teman seperjuangan Ciwank, Ryan, Saddank, Linda, Farid, Ibnu, Yafet, Herman, Aldes, April, Evy, Kiki, Maya, Iccank, Aidil, Yogi, Ayhi, Nawir dan sahabat “L10N” Terima kasih atas Kebersamaan dan kebaikan yang kalian berikan selama penulis kuliah di Fakultas Peternakan.
12 Seluruh staf Dosen dan Pegawai di Fakultas Peternakan Universitas Hasanuddin yang banyak memberikan ilmu, bantuan, moril dan materil sehingga penulis bisa sampai pada hari ini.
13 Terima kasih kepada kakanda Rumput 07 Bakteri 08, Merpati 09.
14 Terima kasih kepada Teman- teman KKN Gel. 85 Desa Komba Selatan dan Rantebelu : Ryan, Athi, Ancha, Akhsan, K’Wahyu, Ceky, Nita, Imha, dan
K’ Didit. Terima Kasih telah mengajarkan arti kekeluargaan dan dukungannya selama KKN.
15 Semua pihak yang tidak dapat penulis sebut satu persatu, Terimah Kasih atas bantunnya.
Penulis menyadari bahwa penyusunan skripsi ini masih terdapat kekurangan dan kesalahan. Penulis mengharapkan kritikan dan saran yang sifatnya membangun demi kesempurnaan skripsi ini.
Makassar, Juni 2014
x
DAFTAR ISI
Halaman
HALAMAN SAMPUL ... i
HALAMAN JUDUL ... ii
PERNYATAAN KEASLIAN ... iii
HALAMAN PENGESAHAN ... iv
ABSTRAK ... v
ABSTRACT ... vi
KATA PENGANTAR ... vii
DAFTAR ISI ... x
DAFTAR TABEL ... xii
DAFTAR GAMBAR ... xiii
DAFTAR LAMPIRAN ... xiv
PENDAHULUAN ... 1
TINJAUAN PUSTAKA Tinjauan Umum Sapi Bali... ... 3
Sistem Imun ... 4
Keragaman Genetik ... 6
Marker Assisted Selection (MAS) ... 8
Major Histocompatibility Complex (MHC) ... 10
Lokus DRB3 exon 2 ... 13
PCR RFLP (Polymerase Chain Reaction-Restriction Fragment Length Polymorphism) ... 15
xi METODE PENELITIAN
Waktu dan Tempat ... 18
Materi Penelitian ... 18
Tahapan Penelitian... 19
Analisa Data... 22
HASIL DAN PEMBAHASAN Amplifikasi Gen MHC DRB3 exon 2 ... ... 24
Keragaman Gen MHC DRB3 exon 2 dengan metode PCR-RFLP ... 25
Frekuensi Genotipe dan Alel ... 27
Nilai Heterozigositas Gen MHC HaeIII ... 30
PENUTUP Kesimpulan ... ... 32
Saran ... 32
xii
DAFTAR TABEL
No. Teks Halaman
1. Sekuen primer beserta enzim restriksi endonuklease untuk
PCR-RFLP ... 18
2. Potongan Pita DNA Gen MHC HaeIII ... 27
3. Frekuensi Genotipe Gen MHC HaeIII ... 27
4. Frekuensi Alel Gen MHC HaeIII ... 28
xiii
DAFTAR GAMBAR
No. Teks Halaman
1. Ilustrasi kompleks BoLA (MHC Sapi/Bovine) ... 14 2. Hasil Amplifikasi Gen MHC DRB3 exon 2 yang divisualisasi pada
Gel Agarose 1,5%... ... 24 3. Hasil Pendeteksian Keragaman Gen MHC DRB3 exon 2 ... 26 4. Letak Sequend Primer Forward dan Reverse MHC DRB3 exon 2 ... 28
xiv
DAFTAR LAMPIRAN
No. Teks Halaman
1. Data Sampel Darah Sapi Hasil Persilangan Kabupaten Bantaeng ... 39 2. Analisis Genetik Populasi Sapi Bali dan Sapi Hasil Persilangan ... 39 3. Analisis Genetik Total Populasi Sapi Bali dan Sapi Hasil Persilangan 46 4. Dokumentasi Kegiatan Laboratorium ... 49
1
PENDAHULUAN
Indonesia termasuk sebagai salah satu negara yang memiliki keanekaragaman hayati yang cukup tinggi. Salah satu dari keanekaragaman hayati yang dimiliki adalah sapi Bali. Sapi Bali sebagai sapi asli Indonesia telah tersebar di seluruh wilayah Indonesia dan dipelihara umumnya dipeternakan rakyat dan berskala kecil. Sebagai sapi asli Indonesia, sapi Bali memiliki kemampuan adaptasi yang tinggi terhadap lingkungan yang kurang baik, namun demikian sapi Bali ternyata memiliki kerentanan yang sangat tinggi terhadap beberapa jenis penyakit, antara lain penyakit jembrana, SE, antraks dan brucella. Informasi mengenai daya tahan penyakit pada sapi Bali dan molekuler biasanya digunakan untuk melakukan seleksi terhadap sapi Bali yang ada di populasi dengan menggunakan penanda molekuler.
Upaya yang dilakukan untuk memperbaiki mutu genetik sapi Bali yaitu seleksi untuk menghasilkan bibit sapi Bali unggul dan mempunyai tingkat resistensi yang tinggi terhadap penyakit. Deteksi genotipik antigen limfosit sapi adalah salah satu cara untuk mengungkapkan permasalahan dengan konsep imunogenetik, yakni suatu konsep pendekatan genetik yang mengendalikan perbedaan reaktivitas respons imun dan kerentanan tubuh terhadap suatu penyakit. Antigen limfosit sapi disebut juga Major Histocompatibility Complex (MHC) atau BoLA (Bovine Lymphocyte Antigen) adalah salah satu antigen permukaan yang terdapat pada sel berinti, terutama sel limfosit, bersifat lebih imunogenik dibandingkan dengan antigen permukaan yang lain. MHC merupakan suatu glikoprotein yang terdiri atas kumpulan gen penting
2
(major), yang dibedakan atas tiga klas yaitu MHC klas I, klas II dan klas III.MHC pada setiap spesies mempunyai sifat polimorfisme yang tinggi.
Sifat polimorphisme dari gen MHC dapat menimbulkan perubahan karakter-karakter genetik yang berbeda dengan induknya. Keragaman genetik dalam suatu populasi sapi Bali akan mengakibatkan perbedaan aktivitas imun pada setiap individu dalam suatu populasi sehingga berpengaruh terhadap ketahanan dan kerentanan individu terhadap penyakit. Berdasarkan uraian diatas maka perlu dilakukan penelitian untuk mengidentifikasi keragaman gen MHC (Major Histocompatibility Complex) pada populasi sapi Bali dan sapi hasil persilangan.
Tujuan penelitian ini yaitu untuk mengetahui keragaman (polimorfisme) gen MHC DRB3 exon 2, pada populasi sapi Bali dan sapi hasil persilangan (Sapi Simmental, Limousin, Brahman, Ongole, Angus, Hereford, dan Brangus). Kegunaan penelitian ini yaitu sebagai informasi keragaman genetik dan dapat digunakan dalam membantu program seleksi untuk mengidentifikasi ternak yang tahan terhadap penyakit, serta dapat menghasilkan ternak yang dapat mewarisi sistem imun / kekebalan kepada keturunannya.
3
TINJAUAN PUSTAKA
Tinjauan Umum Sapi Bali
Sapi Bali merupakan ternak asli Indonesia. Keaslian sapi Bali telah dibuktikan oleh Mohamad et al., (2009) menggunakan pendekatan genetika molekuler berupa analisa DNA mitokondria yang mempunyai potensi genetik dan nilai ekonomis yang cukup potensial untuk dikembangkan sebagai ternak potong. Sapi Bali adalah domestikasi dari banteng (Bibos banteng Syn. Bos sondaicus) yang telah terjadi sejak zaman prasejarah (Purwantara, 2012).Namun ada juga yang menduga bahwa sapi Bali adalah asli berasal dari pulau Bali yang dalam perkembangan selanjutnya dapat dipertahankan kemurniannya (Gunawan et al., 2004).
Sapi Bali (Bos sondaicus) merupakan sapi asli Indonesia yang diduga sebagai hasil domestikasi (penjinakan)dari Banteng liar. Sebagian ahli yakin bahwa domestikasi tersebut berlangsung di Bali sehingga disebut sapi Bali. Sebagai keturunan Banteng, sapi Bali memiliki warna dan bentuk tubuh persis seperti Banteng liar (Guntoro,2002). Sapi Bali di Indonesia hampir semuanya bermula dari sapi Bali yang ada di Bali dan hasil pembuktian lanjutan menunjukkan bahwa sapi Bali di Bali adalah yang paling murni (Namikawa et al., 1980).
Keunggulan sapi Bali dibandingkan bangsa sapi lainnya, misalnya sapi Bali akan memperlihatkan perbaikan performan pada lingkungan baru dan menunjukkan sifat-sifat yang baik bila dipindahkan dari lingkungan kurang baik ke lingkungan
4
yang lebih baik. Selain cepat beradaptasi pada lingkungan yang baru, sapi Bali juga cepat berkembang biak dengan angka kelahiran 40% - 85% (Martojo, 1988).
Salah satu sapi asli di dunia adalah sapi Bali dan merupakan sapi yang mempunyai beberapa karakteristik. Ciri khas sapi Bali (Bos sondaicus) adalah warna bulunya merah bata dan mempunyai garis belut di sepanjang punggungnya (Guntoro, 2002). Sapi Bali juga mudah beradaptasi di lingkungan yang buruk dan tidak selektif terhadap makanan. Selain itu, sapi Bali cepat beranak, jinak, mudah dikendalikan dan memiliki daya cerna terhadap makanan serat yang baik (Batan, 2006).
Sistem Imun
Imunitas adalah suatu reaksi yang dilakukan oleh individu terhadap substansi asing misalnya mikroorganisme (bakteri, virus, parasit) dan molekul substrak misalnya protein maupun polisakarida. Reaksi yang terjadi meliputi reaksi seluler dan molekul. Gabungan sel, molekul dan jaringan yang berperan dalam resistensi terhadap infeksi disebut sistem imun. Reaksi yang dikoordinasi oleh sel ataupun molekul terhadap mikroba dan bahan lainnya disebut respons imun. Pada ternak sistem imun dibutuhkan untuk mempertahankan keutuhannya terhadap bahaya yang dapat ditimbulkan dari lingkungan (Baratawidjaja, 2006). Selanjutnya Anthony et al.,(2007) menyatakan sistem imun adalah semua mekanisme yang digunakan tubuh untuk mempertahankan keutuhan tubuh, sebagai perlindungan terhadap bahaya yang dapat ditimbulkan berbagai bahan dalam lingkungan hidup. Fungsi sistem imun yaitu:
5
1. Melindungi tubuh dari invasi penyebab penyakit; menghancurkan dan menghilangkan mikroorganisme atau substansi asing (bakteri, parasit, jamur, dan virus, serta tumor) yang masuk ke dalam tubuh .
2. Menghilangkan jaringan atau sel yg mati atau rusak (debris sel) untuk perbaikan jaringan.
3. Mengenali dan menghilangkan sel yang abnormal.
Secara umum sistem imun terbagi dalam dua yaitu : alamiah dan adaptif (spesifik). Sistem imun alamiah seperti air liur, selaput lendir, serta asam lambung termasuk di dalamnya. Sedangkan pada sistem imun adaptif terdapat sistem dan struktur fungsi yang lebih kompleks dan beragam. Sistem imun adaptif terdiri dari sub sistem seluler yaitu keluarga sel limfosit T (T penolong dan T sitotoksik) dan keluarga sel mononuklear (berinti tunggal). Sub sistem kedua adalah sub sistem humoral, yang terdiri dari kelompok protein globulin terlarut yaitu: imunoglobulin. Imunoglobulin dihasilkan oleh sel limfosit B melalui suatu proses aktivasi khusus (Pandjassarame, 2009).
Keberadaan mikroba patogen dapat menimbulkan dampak-dampak yang tidak diharapkan akan memicu sistem imun untuk bereaksi dengan urutan mekanisme sebagai berikut : introduksi, persuasi, dan represi. Meskipun komplemen dapat diasosiasikan sesuai artinya, yaitu pelengkap, namun sesungguhnya fungsinya amatlah vital. Faktor komplemen bertugas untuk menganalisa masalah untuk selanjutnya mengenalkannya kepada imunoglobulin, untuk selanjutnya akan diolah dan dipecah-pecah menjadi bagian-bagian molekul yang tidak berbahaya bagi tubuh.
6
Setelah itu limfosit T bekerja dengan memakan mikroba patogen. Sel limfosit terdiri dari dua spesies besar, yaitu limfosit T dan B (Price, 2005)
Dalam kondisi yang berat akan terjadi beberapa proses berikut, sel limfosit T akan meminimalisasi efek patogenik dari mikroba patogen dengan cara bekerjasama dengan antibodi untuk mengenali dan merubah antigen dari mikroba patogen menjadi serpihan asam amino melalui sebuah mekanisme yang disebut Antibody Dependent Cell Cytotoxicity (ADCC) (Baratawidjaja, 2006).
Sedangkan Sel limfosit B bertugas untuk membangun sistem manajemen komunikasi terpadu di wilayah cairan tubuh (imunitas humoral). Bila ada antigen dari unsur asing yang masuk, maka sel limfosit B akan merespon dengan cara membentuk sel plasma yang spesifik untuk menghasilkan molekul imunoglobulin yang sesuai dengan karakteristik antigen dari unsur asing tersebut (David, 2004).
Darwin (2012) mengemukakan bahwa ada beberapa faktor yang mempengaruhi sistem imun, yaitu : faktor genetik dan fisiologis, usia, lingkungan, gaya hidup, gender, metabolis, anatomis, dan microbial.
Keragaman Genetik
Keanekaragaman hayati (biodiversitas) adalah keanekaragaman organisme yang menunjukkan keseluruhan atau totalitas variasi gen, jenis, dan ekosistem pada suatu daerah. Keseluruhan gen, jenis dan ekosistem merupakan dasar kehidupan di bumi. Keanekaragaman hayati melingkupi berbagai perbedaan atau variasi bentuk penampilan, jumlah, dan sifat-sifat yang terlihat pada berbagai tingkatan, baik
7
tingkatan gen, tingkatan spesies maupun tingkatan ekosistem. Berdasarkan hal tersebut, para pakar membedakan keanekaragaman hayati menjadi tiga tingkatan, yaitu keanekaragaman gen, keanekaragaman jenis dan keanekaragaman ekosistem (Nicholas, 1996).
Keragaman genetik terdapat dalam empat level organisasi: antar spesies, antar populasi, antar individu dalam populasi dan dalam individu. Keragaman antar spesies sebagai manifestasi dari keragaman genetik walaupun pembedaan spesies dengan mudah tanpa mengetahui komposisi gennya (Indrawan et al., 2007).
Keragaman genetik dalam sebuah populasi organisme terutama dihasilkan oleh tiga mekanisme yaitu mutasi, perpasangan alel secara bebas atau rekombinasi dan migrasi gen dari satu tempat ketempat lain (Suryanto, 2003; Elrod dan Stansfield, 2007).
Keanekaragaman gen adalah keanekaragaman individu dalam satu jenis makhluk hidup. Keanekaragaman gen mengakibatkan variasi antarindividu sejenis. Keragaman genetik di antara populasi dari suatu spesies bisa sangat besar. Demikian juga dalam populasi kebanyakan populasi alami, perbedaan genetik di antara individu sering juga besar. Akhirnya keragaman genetik terdapat di dalam suatu individu bilamana ada dua alel untuk gen yang sama merupakan perbedaan konfigurasi DNA yang menduduki lokus yang sama pada suatu kromosom (Indrawan et al., 2007).
Polimorfisme pada suatu populasi digunakan sebagai salah satu indeks keragaman genetik. Sifat polimorfik ini ditentukan dengan mengidentifikasi jumlah alel pada suatu populasi. Dengan adanya identifikasi jumlah alel maka akan dapat
8
ditentukan frekuensi alel dan nilai heterozigositas suatu populasi (Barendse et al.,
2008).
Dalam jangka panjang, keragaman genetik akan lebih lestari dalam populasi besar daripada dalam populasi kecil. Melalui efek genetik (genetic drift) yaitu perubahan dalam gen dari suatu populasi kecil yang berlangsung semata-mata karena proses kebetulan, suatu sifat genetik dapat hilang dari populasi kecil dengan cepat (Indrawan et al., 2007).
Marker Assisted Selection( MAS )
Perkembangan teknologi biologi molekuler pada dua dasawarsa belakangan ini, telah membuktikan banyaknya gen/lokus.Ilmuan kemudian menyebutnya sebagai
Quantitative Trait Loci (QTL), yaitu lokus-lokus/segmen DNA yang mempengaruhi sifat-sifat kuantitatif. QTL diidentifikasi dengan memanfaatkan fenomena bahwa jika suatu QTL terpaut pada suatu DNA marker, maka akan terdapat perbedaan pada nilai fenotipe antar kelas genotipe marker tersebut. Sehingga, keberadaan QTL yang menguntungkan pada suatu individu dapat dideteksi dengan bantuan DNA marker. Ketika QTL tersebut sudah teridentifikasi (jumlah, lokasi, aksi gen dan efeknya), maka informasi tersebut dapat digunakan untuk meningkatkan efektivitas pemuliaan konvensional. Sistem pemuliaan yang menggabungkan informasi QTL dalam pemuliaan konvensional tersebut disebut dengan Marker Assisted Selection (MAS) (Bowling, 2001).
9
Penggunaan MAS pada sapi potong dapat menunjang cara seleksi konvensional yang berdasarkan fenotip, sebab seleksi dilakukan pada arah molekuler sehingga tidak terpengaruh lingkungan. Pemarkah DNA memiliki keunggulan karena sifatnya sangat polimorfik dan beberapa pemarkah DNA antara lain Restriction Fragments Lengths Polymorphisms (RFLP), Mikrosatelit, dan sidik jari DNA (Sumadi et al., 2008).
Menurut Soller (1983) informasi tentang variasi genetik dapatdijadikan dasar dalam seleksi hewan melalui teknik yang dikenal dengan Marker Assisted Selection
(MAS) atau seleksi berdasarkan penanda gen. Variasi genetik juga dapat dijadikan dasar untuk konservasi jenis. Suatu jenis tertentu mungkin dihasilkan darisuatu proses adaptasi terhadap keadaan lingkungan yang mengarahkan pada terbentuknya kombinasi alel yang unik. Penggunaan Marker Assisted Selection (MAS) didasarkan pada gagasan bahwa terdapat gen yang memegang peranan utama dan menjadi sasaran atau target secara spesifik dalam seleksi (Van der Warf, 2000).
Beberapa sifat yang dikendalikan oleh gen tunggal seperti warna bulu merupakan pola pewarisan sifat yang sederhana, namun beberapa sifat utamanya sifat produksi yang kompleks (kuantitatif) dikontrol oleh banyak gen (polygenes) (Nicholas, 1996). MAS dapat meningkatkan efisiensi pemuliaan ternak dapat dijelaskan sebagai berikut ; (Anonymous, 2000)
1. DNA marker menyediakan informasi tambahan mengenai genotipe seekor ternak, maka dapat digunakan untuk meningkatkan akurasi seleksi. Dengan meningkatnya akurasi seleksi, maka respon seleksipun menjadi meningkat.
10
2. DNA marker dapat digunakan untuk menurunkan interval generasi dengan cara menseleksi ternak pada umur yang lebih muda. Penurunan interval generasi tersebut menyebabkan respons seleksi per tahun menjadi semakin meningkat.
3. DNA marker dapat digunakan untuk meningkatkan intensitas dan efisiensi seleksi, karena DNA marker dapat digunakan untuk menseleksi lebih banyak ternak daripada menggunakan informasi fenotipe saja. Karena intensitas seleksi berbanding lurus dengan respon seleksi, maka peningkatan intensitas seleksi akan diikuti dengan peningkatan respons seleksi.
Maka secara umum, dengan memanfaatkan informasi DNA marker, maka MAS menghasilkan respon seleksi yang lebih cepat dibandingkan dengan pemuliaan konvensional yang hanya mengandalkan informasi fenotipe.
Major Histocompatibility Complex ( MHC )
Major Histocompatibility Complex (MHC) merupakan kelompok lokus yang terdiri atas kumpulan gen penting (major) yang mengendalikan respon imun (Kuby 1997). Respon imun terutama disebabkan oleh adanya aksi limfosit yang dihasilkan dalam sel sumsum tulang. Aksi limfosit dalam sistem kekebalan dipacu oleh adanya antigen. Peranan MHC dalam sistem kekebalan seluler diawali dari masuknya antigen ke dalam tubuh melalui proses up take oleh makrofag yang kemudian memicu limfosit T untuk mematikan sel yang terinfeksi. Sementara itu, dalam sistem
11
kekebalan humoral, MHC berperan dalam membantu pembentukan antibodi oleh limfosit B (Tizard, 2000).
MHC atau antigen histokompatibilitas utama adalah antigen yang terdapat pada sel limfosit yang bersifat lebih imunogenik dibandingkan antigen lainnya. Antigen ini ditemukan pertama pada leukosit darah, nomenklatur MHC pada setiap hewan berbeda. Diawali dengan singkatan yang merujuk pada jenis hewan dan dilanjutkan dengan huruf L (Limfosit) dan A (Antigen) (Tizard, 2000).
Peranan keseluruhan MHC yang berkaitan dengan antigen adalah menentukan kemampuan individu untuk membedakan self dan non-self serta mengatur interaksi fungsi imunitas. Berkaitan dengan peranannya tersebut, MHC disebut immune response associated antigen (Nicholas 1987; Guillemot et al., 1988; Kuby 1997). MHC yang terdapat pada sapi disebut Bovine Lymphocyte Antigen (BoLA) (Lewin et al., 1999). BoLA atau antigen limfosit sapi merupakan glikoprotein. Peranan keseluruhan antigen BoLA adalah menentukan kemampuan individu untuk membedakan self dan non-self, mengatur interaksi fungsi imunitas, karena peranan tersebut maka disebut dengan immune response associated antigen.
Gen BoLA merupakan kompleks gen yang berada pada kromosom 23 sapi dan berperan penting pada penampilan reproduksi, produksi, dan ketahanan penyakit (Nascimento et al., 2006). Struktur gen BoLA sama dengan gen MHC pada manusia (Firouzamandi et al., 2010). Gen BoLA dibedakan menjadi tiga klas yaitu MHC klas I, klas II dan klas III (Bastos-Silveira et al., 2008).
12
MHC kelas I berisi beberapa gen yang berperan dalam respon imun selular. MHC kelas II merupakan gabungan gen yang berperan penting dalam respon imun selular dan humoral. MHC kelas III mengandung beberapa gen yang memiliki fungsi luas, berperan dalam pembentukan komponen protein dan sistem komplemen, hanya beberapa diantaranya yang terlibat dalam respon imun (Guillemot et al., 1988).
Menurut Caron et al., (1997), MHC berhubungan dengan kepekaan terhadap infeksi parasit. MHC kelas II menciri dengan jumlah alel yang besar pada setiap lokus dan terdapat perbedaan jumlah asam amino yang besar pada setiap alelnya. Keragaman ini berhubungan dengan keragaman reseptor pada limfosit T, yang berkontribusi pada perbedaan respon kekebalan pada individu (Sommer, 2005).
Menurut Stear et al.,(2007) beberapa keragaman yang sifatnya non-imunologi telah diketahui berhubungan dengan gen BoLA, seperti misalnya angka pertumbuhan, berat lahir, karkas, dan fertilitas. Polimorfisme pada alel gen BoLA tersebut juga berhubungan dengan produksi, persentase lemak dan protein air susu, angka pertumbuhan, kinerja reproduksi, respons imun, dan ketahanan penyakit (Nascimento
et al., 2006).
Gen BoLA mempunyai ciri khas dengan banyaknya alel dalam setiap lokus serta keragamam asam amino pada setiap alelnya. Sifat polimorfisme yang tinggi ini menimbulkan variasi ekspresi yang berbeda pada setiap individu. Keragaman alel pada gen BoLA sangat memungkinkan menggunakan keragaman ini sebagai marka untuk seleksi. Pengungkapan keragaman genetika dengan marka molekuler DNA mikrosatelit akan mampu mendeteksi variasi dan polimorfisme pada DNA di antara
13
anggota kelompok ternak. Polimorfisme inidapat digunakan untuk mengetahui perbedaan marka spesifik dengan ekspresi fenotipe pada suatu populasi (Albert et al., 1994).
Lokus DRB3 exon 2
MHC pada setiap spesies mempunyai sifat polimorfisme yang tinggi (Guillemot et al., 1988). Sifat polimorfisme pada BoLA menyebabkan kemampuan setiap individu untuk bereaksi terhadap antigen berbeda-beda dan sangat spesifik. Dengan kata lain, BoLA berperan dalam menentukan ketahanan dan kerentanan setiap individu dalam suatu populasi terhadap suatu penyakit secara spesifik. Pada sapi, kompleks BoLA terdapat pada lengan pendek kromosom 23. Sebagaimana MHC pada mamalia lainnya, BoLA dibagi menjadi tiga kelas gen. BoLA kelas I memiliki tiga gen fungsional, yaitu A, B dan C. BoLA kelas II atau disebut region D dibagi menjadi tiga subregion, yaitu DP, DQ dan DR. Beberapa peneliti juga telah mengeksplorasi keragaman genetik dari gen BoLA DRB3 exon 2pada sapi perah dengan menggunakan teknik PCR-RFLP (Wu et al., 2010)
Masing-masing subregion paling tidak memiliki dua gen fungsional, yaitu satu gen penyandi rantai α (disebut gen DPA, DQA dan DRA) dan gen lainnya penyandi rantai β (disebut gen DPB, DQB dan DRB). Sampai saat ini, telah diketahui setidaknya ada tiga lokus gen BoLA penyandi rantai β pada subregion DR, yaitu BoLA DRB1, BoLA DRB2 dan BoLA DRB3 (Gambar 1) (Nicholas 1987; Guillemot
14
Gambar 1.Ilustrasi kompleks BoLA (MHC Sapi/Bovine) (Guillemot et al., 1988) Penamaan alel BoLA mengikuti format nomenklatur alel HLA ( Human Leucocyt Antigen) yang dibuat oleh WHO Nomenclature Committee, yaitu lokus.exon*alel (Lewin et al., 1999).
DRB3 exon 2 (BoLA DRB3.2) merupakan lokus gen pada kompleks BoLA yang memiliki polimorfisme yang paling tinggi (Maillard et al., 2000; Gilliespie et al., 1999; Takeshima et al., 2002;). Berdasarkan metode PCR-RFLP, Van Eijk et al., (1992) telah mengidentifikasi 30 Alel BoLA DRB 3 exon 2 berbeda pada 10 peranakan sapi Eropa. Berdasarkan metode yang sama, Gelhaus et al. (1995) menambahkan 10 alel baru yang ditemukannya pada sapi peranakan Afrika dan FH. Alel BoLA DRB3 exon 2 yang telah diidentifikasi dengan metode PCR-RFLP hingga saat ini ada 54 tipe, dengan tambahan 14 alel baru yang ditemukan Maillard et al. (2000) pada sapi zebu Brahman.
Dietz et al. (1997) menemukan bahwa alel – alel BoLA DRB3 exon 2 berhubungan erat dengan karakter imunitas. Alel-alel BoLA DRB3 exon 2 diketahui berhubungan dengan ketahanan dan kerentanan individu sapi terhadap beberapa
15
penyakit. Beberapa penelitian telah dilakukan untuk mengetahui hubungan alel-alel BoLA DRB3 dengan sifat produksi dan imunitas, seperti Mastitis (Baltian et al., 2012), Limfositosis persisten yang disebabkan bovine leukemia virus (Lewin et al. 1999), Penyakit Kuku dan Mulut (Lewin et al. 1999), Dermatofilosis (Maillard et al. 2003), East Coast Fever (ECF) dan Penyakit yang disebabkan serangan kutu
Boophilus microplus (Martinez et al. 2006).
Selain itu,variasi alel pada BoLA DRB3 juga berhubungan dengan karakter produksi susu (Sharif et al. 1998b). Beberapa penelitian menunjukkan bahwa variasi dan distribusi alel BoLA DRB3 exon 2 berbeda untuk setiap jenis sapi, antara lain sapi Jersey (Gilliespie et al. 1999), Holstein (Dietz et al. 1997).Polimorfisme pada kompleks BoLA yang dimiliki oleh populasi sapi mungkin berhubungan dengan asal usulnya (Ellis 1999).Polimorfisme pada kompleks BoLA juga berpengaruh terhadap fitnes individu dalam populasi. Hal ini berkaitan dengan respon masing-masing gen dalam kompleks BoLA terhadap tekanan lingkungan. Polimorfisme yang tinggi dalam populasi akan memungkinkan populasi tersebut bertahan dalam berbagai kondisi lingkungan (Ellis 1999).
PCR-RFLP ( Polymerase Chain Reaction-Restriction Fragment Length Polymorphism)
Polymerase Chain Reaction (PCR) merupakan suatu reaksi invitro untuk menggandakan jumlah molekul DNA pada target tertentu dengan cara mensintesis molekul DNA baru yang berkomplemen dengan molekul DNA target tersebut dengan
16
bantuan enzim dan oligonukleotida sebagai primer dalam suatu thermocycler (Muladno, 2002). Teknik PCR dipengaruhi oleh empat komponen utama yaitu: DNA cetakan, oligonukleotida primer, deoksiribonukleotida trifosfat (dNTP) dan enzim DNA polymerase (Sambrook et al.,1989).
Prinsip kerja PCR adalah denaturasi, penempelan (annaeling), dan pemanjangan (elongasi). Proses denaturasi cetakan DNA berlangsung pada suhu tinggi (94 – 96 °C) sehingga memungkinkan rantai ganda fragmen DNA akan terpisah menjadi rantai tunggal. Proses dilanjutkan dengan penempelan (annealing) primer pada bagian cetakan DNA yang komplementer. Penempelan ini bersifat spesifik tergantung pada panjang-pendeknya primer. Suhu yang tidak tepat menyebabkan penempelan tidak terjadi atau primer menempel pada tempat yang salah. Tahapan selanjutnya adalah pemanjangan (elongasi) pada suhu 72°C. Proses dari denaturasi, penempelan, dan pemanjangan disebut satu siklus. Pada umumnya, proses PCR berlangsung dengan 25 – 40 siklus (Sambrook et al.,1989).
Perkembangan teknologi molekuler telah banyak membantu dalam menghasilkan data tentang variasi genetik pada tingkat DNA.PCR-RFLP yang merupakan teknik RFLP yang memanfaatkan amplifikasi DNA dengan PCR yang mampu mendeteksi adanya variasi genetik dalam waktu yang relatif singkat. Teknik molekuler yang biasanya digunakan untuk mempelajari molekuler ekologi adalah
Random Amplified Polymorphism DNA (RAPD), Amplified Fragment Length Polymorphism(AFLP), Resctriction Fragment Length Polymorphism (RFLP) dan perunutan DNA (DNA sequencing). Keempat teknik tersebut dikembangkan
17
berdasarkan Polymerase Chain Reaction (PCR-based), (Kusumadarma, 2011). Keuntungan menggunakan PCR dalam mengamplifikasi DNA adalah dapat menghasilkan DNA dalam jumlah yang banyak meskipun hanya dari beberapa atau bahkan satu molekul DNA saja dalam waktu yang relatif singkat (White, 1996).
RFLP merupakan teknik yang banyak digunakan dalam mempelajari variasi inter maupun antar spesies dengan memanfaatkan enzim restriksi. Teknik ini dapat mendeteksi adanya variasi genetik dengan akurat.Posisi dan besarnya variasi dapat diperkirakan dengan tepat (Sutarno, 1999).
PCR-RFLP merupakan teknik PCR yang dikembangkan untuk memvisualisasikan perbedaan runutan nukleotida DNA mengunakan enzim restriksi (Park et al., 1995). Enzim restriksi bersifat spesifik, yaitu suatu jenis enzim hanya akan memotong runutan nukleotida yang dikenalinya (situs restriksi). Profil fragmen hasil pemotongan menggambarkan variasi runutan nukleotida situs restriksi. Dengan kata lain, perbedaan runutan nukleotida pada setiap fragmen DNA akan menghasilkan pola pemotongan yang berbeda. Fragmen DNA hasil pemotongan tersebut dapat dipisahkan dengan elektroforesis melalui matriks gel yang berbentuk pita-pita dan divisualisasikan dengan gel dokumentasi. Berdasarkan perbedaan panjang pita yang dihasilkan dapat diketahui variasi genetik antar individu dan populasi (Acharya et al.
18 METODE PENELITIAN
Waktu dan Tempat
Penelitian ini dilaksanakan pada bulan Februari-Maret 2014 bertempat di Laboratorium Bioteknologi Terpadu, Fakultas Peternakan Universitas Hasanuddin, Makassar.
Materi Penelitian
Bahan utama dari penelitian ini adalah sampel darah sapi hasil persilangan yang berjumlah 23 sampel dari Kabupaten Bantaeng, 25 sampel dari Kabupaten Sidrap, dan sapi Bali 49 sampel dari Kabupaten Barru. Bahan pendukung antara lain: enzim restriksi HaeIII, bahan ekstraksi DNA (lysis buffer, proteinaseK, wash buffer I, wash buffer II, elution buffer, ethanol absolute 96%), bahan PCR (dNTP mix, MgCl2,
enzim Taq DNA polymerase), bahan elektroforesis (tris base, asam borat, agarose, Na2 EDTA, ethidium bromide, marker DNA, DNA loading dye), tissue, plastik mika
dan primer gen MHC DRB3 exon 2.
Tabel 1. Sequen primer beserta enzim restriksi endonuklease untuk PCR-RFLP Primer
Sekuen DNA Enzim
restriksi
Panjang PCR
Sumber
MHC F : 5’-TATCCCGTCTCTGCAGCACATTTC-3’
R : 5’-TCGCCGCTGCACACTGAAACTCTC-3’ HaeIII 285 bp
Ahmed, 2006
Alat yang digunakan yaitu : Kit DNA ekstraksi (Thermo Scientific), venoject, tabung vacutainer, mesin thermo cycler (sensoQuest Germany), centrifuge, alat
19
pendingin, tabung eppendorf besar dan kecil, gel dokumentasi (syngene G:BOX) , mikropipet, tip, rak tabung, elektroforesis, autoclave, timbangan, sarung tangan.
Tahapan Penelitian
Koleksi Sampel Darah
Sampel darah diperoleh dari Kabupaten Bantaeng, Sidrap dan Kabupaten Barru. Pengambilan darah melalui vena jugularis ditampung pada tabung vacutainer yang telah berisi antikoagulan EDTA untuk mencegah penggumpalan darah.
Ekstraksi DNA
DNA diisolasi dan dimurnikan dengan menggunakan Kit DNA ekstraksi (Genjet Genomic DNA Extraction Thermo Scientific) dengan mengikuti protokol ekstraksi yang disediakan. Sebanyak 200 µl sampel darah dilisis dengan menambah 400 µl larutan buffer (lysis buffer), 20 µl proitenaseK (10 mg/ml), kemudian dicampur dan diinkubasi pada suhu 56 ºC selama 60 menit pada waterbath shaker. Setelah inkubasi larutan, ditambahkan 200 µl ethanol absolute 96% dan disentrifugasi 6.000 x g selama 1 menit.
Pemurnian DNA dilakukan menggunakan spin column dengan penambahan 500 µl larutan pencuci wash buffer I yang kemudian dilanjutkan dengan sentrifugasi pada 8.000 x g selama 1 menit. Setelah supernatanya dibuang, DNA kemudian dicuci lagi dengan 500 µl wash buffer II dan disentrifugasi pada 12.000 x g selama 3 menit. Setelah supernatanya dibuang, DNA kemudian dilarutkan dalam 200 µl elution buffer
20
dan disentrifugasi pada 8.000 x g untuk selanjutnya DNA hasil ekstraksi ditampung dan disimpan pada suhu -20 ºC.
Teknik PCR-RFLP
Komposisi reaksi PCR dikondisikan pada volume reaksi 25 µl yang terdiri atas 100 ng DNA, 0.25 mM masing-masing primer, 150 µM dNTP, 2.5 mM Mg2+, 0.5µl Taq DNA polymerase dan 1x buffer. Kondisi mesin PCR dimulai dengan denaturasi awal pada suhu 94 oC x 2 menit, diikuti dengan 35 siklus berikutnya masing-masing denaturasi 94 oC x 45 detik, dengan suhu annealing yaitu : 64 oC x 60 detik, yang dilanjutkan dengan ekstensi : 72 oC x 60 detik, yang kemudian diakhiri dengan satu siklus ekstensi akhir pada suhu 72 oC selama 5 menit dengan menggunakan mesin PCR (SensoQuest, Germany). Produk PCR kemudian dielektroforesis pada gel agarose 1.5 % dengan buffer 1x TBE (89 mM Tris, 89 mM asam borat, 2 mM Na2EDTA) yang mengandung 100 ng/ml ethidium bromide.
Kemudian divisualisasi pada UV transiluminator (gel documentation system ;syngene G:BOX)).
Produk PCR yang diperoleh dari masing-masing gen target kemudian dianalisis menggunakan RFLP melalui pemotongan menggunakan enzim restriksi yang memiliki situs pemotongan pada gen MHC HaeIII (gg cc). Sebanyak 5l DNA produk PCR ditambahkan 0,3 l enzim restriksi (5U) ; 0,7 l buffer enzim dan 1l milique water sampai volume 7l, selanjutnya dilakukan inkubasi selama 18 jam
21
pada suhu 37oC. Analisis produk RFLP dilakukan dengan elektroforesis pada gel
polyacrylamide dan pewarnaan dengan perak mengikuti metode Tegelstrom (1992). Elektroforesis pada Gel Poliakrilamid
Komponen gel polyacrylamide terdiri atas campuran 30% acrylamida dan bis-acrylamida sebanyak 6 ml, 10 x TBE sebanyak 6 ml, H2O sampai mencapai volume
30 ml, temed sbanyak 20 μl, 10% APS 200 μl. Sampel DNA tersebut kemudian dimasukkan ke dalam sumur gel setelah gel diletakkan pada tangki elektroforesis yang telah berisi larutan penyangga 1 x TBE. Elektroforesis dilakukan pada voltase konstan 250 V selama 120 menit pada suhu ruang.
Silver stainning (Pewarnaan Perak)
Pewarnaan dengan perak dilakukan melalui serangkaian proses yaitu pewaraan gel dengan larutan stainning dengan merendam gel dalam larutan yang terdiri atas 0,2 g AgNO3 ; 80 μl NaOH 10 N ; 0,8 ml NH4OH ; 200 ml akuades
selama selama 15 menit. Gel kemudian dicuci kembali dengan aquades selama 20 menit sambil digoyang untuk menghilangkan perak yang tidak berikatan dengan DNA. Fragmen DNA yang berikatan dengan perak dapat dideteksi dengan merendam gel dalam larutan NaOH 0,03 g/ml dan formalin yang dipanaskan pada suhu 45 oC sampai fragmen pita DNA tampak. Setelah fragmen DNA tampak, reaksi kemudian dihentikan dengan menggunakan asam asetat glasial (200 μl / 200 ml aquades). Penentuan alel dilakukan dengan cara menginterpretasi pita (band) yang terbentuk paling jauh migrasinya ke kutub anoda sebagai alel "a", berikutnya alel "b" dan seterusnya.
22 Analisa Data
Keragaman genotipe tiap-tiap individu dapat ditentukan dari pita-pita DNA gen yang ditemukan. Masing-masing sampel dibandingkan berdasarkan ukuran (marker) yang sama dan dihitung frekuensi alelnya. Frekuensi alel bisa dihitung dengan menggunakan rumus Nei dan Kumar (2000) :
( ∑ )
Keterangan :
Xi = frekuensi alel ke -i
nii = jumlah sampel yang bergenotip ii ( homozigot)
nij = jumlah sampel yang bergenotip ij ( heterozigot)
n = jumlah sampel
Nilai heterozigositas pengamatan (Ho) dan heterozigositas harapan (He)
berdasarkan rumus heterozigositas Nei dan dihitung dengan menggunakan software
PopGene32versi 1.31 (Yeh et al., 1999).
∑ ∑
∑ ∑
Keterangan:
Ho = heterozigositas pengamatan di antara populasi, He = heterozigositas harapan di antara populasi,
23
Xkij (i≠j) = frekuensi AiAj pada populasi ke-k.
Test keseimbangan Hardy-Weinberg (HWE) dengan uji chi-square (Hartl, 1988) sebagai berikut :
∑( )
Keterangan : χ² = chi-square ,
Obs = jumlah genotipe ke-ii atau ke-ij hasil pengamatan,
24
HASIL DAN PEMBAHASAN
Amplifikasi Gen MHC DRB3 exon 2
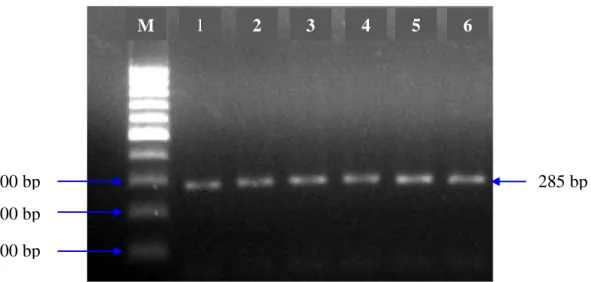
Berdasarkan penelitian yang telah dilakukan bahwa Gen MHC DRB3 exon 2 berhasil diamplifikasi dengan menggunakan mesin thermocycler SensoQuest Germany, dengan suhu annealing 64oC. Hasil amplifikasi ruas gen dapat divisualisasikan pada gel agarose 1,5% yang dapat dilihat pada Gambar 2. Panjang produk hasil amplifikasi gen MHC DRB3 exon 2 adalah 285 bp.
Gambar 2. Hasil Amplifikasi Gen MHC DRB3 exon 2 yang divisualisasi pada Gel
Agarose 1,5%. M : Marker (100 bp) ; 1-6 : sampel Sapi Hasil Persilangan dari Kabupaten Bantaeng ; bp : base pair
Panjang fragmen gen MHC DRB3 exon 2 pada penelitian yang dihasilkan yaitu 285 bp. Hal ini sesuai dengan penelitian yang dihasilkan oleh Ahmed (2006), bahwa panjang produk PCR yang dihasilkan adalah 285 bp. Sedangkan Wu et al.,
200 bp 300 bp 100 bp 285 bp 6 4 3 3 5 1 2 3 M
25
(2010); Chu et al., (2012) menghasilkan panjang produk PCR untuk BoLA yaitu 284bp dan 280 bp pada penelitian yang dilakukan oleh Gilliespie et al., (1999).
Beberapa hal yang umum dilakukan untuk optimasi PCR diantaranya adalah suhu annealing, konsentrasi MgCl2 konsentrasi primer, dan konsentrasi DNA target
Viljoen et al.,(2005). Suhu annealing sangat menentukan keberhasilan amplifikasi karena proses perpanjangan DNA dimulai dari primer. Primer merupakan bagian yang penting dalam PCR karena primer merupakan inisiator pada sintesis DNA target. Ketepatan kondisi PCR ditentukan oleh ketepatan campuran reaksi dan ketepatan kondisi suhu pada masing-masing siklus Rahayu et al., (2006).
Keragaman Gen MHC DRB3 exon 2 dengan Metode PCR-RFLP
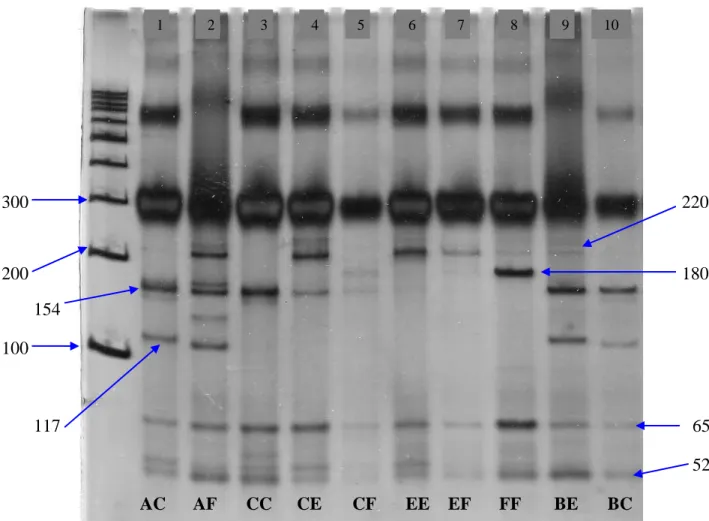
Penentuan genotip gen MHC DRB3 exon 2 pada sapi Bali dan sapi hasil persilangan dalam penelitian ini menggunakan metode PCR-RFLP yang dideteksi berdasarkan banyaknya pita yang muncul dan laju migrasi fragmen DNA, dengan
HaeIII sebagai enzim pemotong. Enzim HaeIII mengenali situs pemotongan (gg cc).
Hasil visualisasi menggunakan gel Polyacrylamide 8% dengan melihat panjang fragmen ruas gen MHC DRB3 exon 2 dan enzim HaeIII sebagai enzim pemotong menunjukkan bahwa fragmen yang didapatkan adalah 10 macam genotipe, diantaranya, AC, AF, BC, BE, CC, CE CF, EE, EF, FF. Terdapat tiga macam genotipe yang homozigot dan 7 macam genotipe yang heterozigot. Hasil tersebut menunjukkan bahwa gen MHC DRB3 exon 2 pada sapi Bali dan sapi hasil
26
persilangan yang diamati sangat beragam. Hasil pendeteksian keragaman gen MHC
HaeIII dapat dilihat pada Gambar 3.
300 220 200 180 154 100 117 65 52 AC AF CC CE CF EE EF FF BE BC
Gambar 3. Hasil pendeteksian keragaman gen MHC DRB3 exon 2; 1-10: sampel sapi Bali dan sapi hasil persilangan
Hasil yang diperoleh pada penelitian ini yaitu masing-masing genotipe dibedakan berdasakan jumlah pita yang muncul dalam gel Polyacrylamide 8%. Jumlah alel dilihat berdasarkan jumlah potongan pita dengan panjang potongan yang berbeda seperti yang ditampilkan pada Tabel 2.
27 Tabel 2. Potongan Pita DNA Gen MHC HaeIII
Alel Pita A / BoLA-DRB*0201 168/117 B / BoLA-DRB*0202 154/14/117 C / BoLA-DRB*0203 154/14/52/65 D / BoLA-DRB*0204 154/131 E / BoLA-DRB*0205 220/65 F / BoLA-DRB*0206 40/180/65 Sumber :Ahmed (2006)
Pita-pita DNA yang terdapat dalam Tabel 2. memiliki jarak laju migrasi yang berbeda-beda sehingga dapat dibedakan menjadi 6 tipe pita (alel) dengan basis pasang basa. Keenam tipe alel tersebut yaitu alel A (168/117), B (154/14/117), C (154/14/52/65), D (1544/131), E (220/65) dan F (40/180/65).Alel BoLA DRB3 exon
2 yang telah teridentifikasi dengan metode PCR-RFLP hingga saat ini ada 54 alel (Van Eijk et al., 1992; Gelhaus et al., 1995; Maillard et al., 1999).
Frekuensi Genotipe dan Alel
Hasil analisis frekuensi genotipe pada fragmen gen MHC sapi Bali dan sapi hasil persilangan dapat dilihat pada Tabel 3.
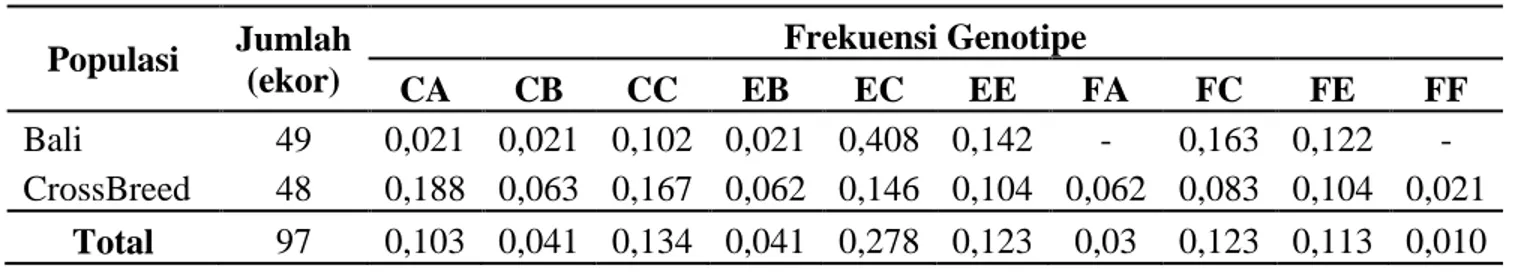
Tabel 3. Frekuensi Genotipe Gen MHC HaeIII
Populasi Jumlah (ekor) Frekuensi Genotipe CA CB CC EB EC EE FA FC FE FF Bali 49 0,021 0,021 0,102 0,021 0,408 0,142 - 0,163 0,122 - CrossBreed 48 0,188 0,063 0,167 0,062 0,146 0,104 0,062 0,083 0,104 0,021 Total 97 0,103 0,041 0,134 0,041 0,278 0,123 0,03 0,123 0,113 0,010
28
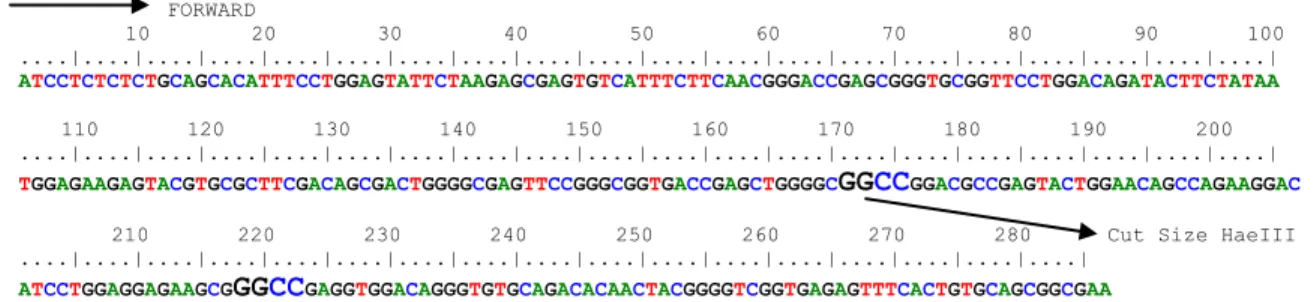
Frekuensi genotipe fragmen gen MHC pada sapi Bali memiliki 8 macam genotipe yaitu CA, CB, CC, EB, EC, EE, FC, dan FE. Sedangkan pada sapi hasil persilangan memiliki 10 macam genotipe yaitu CA, CB, CC, EB, EC, EE, FA, FC, FE, dan FF. Sapi Bali memiliki genotipe EC yang lebih tinggi (0,408), dibandingkan dengan sapi hasil persilangan (0,145) tetapi genotipe FA dan FF tidak ditemukan pada sapi Bali sedangkan pada sapi hasil persilangan ditemukan genotipe FA dan FF. Pada penelitian yang dilakukan oleh Chu et al., (2012) menemukan 7 macam genotipe dari sapi Beijing.Pendeteksian keragaman gen MHC DRB3 exon 2 dengan metode PCR-RFLP dengan HaeIII sebagai enzim pemotong (gg|cc). Runutan sequen MHC DRB3 exon 2 dapat dilihat pada Gambar 4.
FORWARD
10 20 30 40 50 60 70 80 90 100 ....|....|....|....|....|....|....|....|....|....|....|....|....|....|....|....|....|....|....|....|
ATCCTCTCTCTGCAGCACATTTCCTGGAGTATTCTAAGAGCGAGTGTCATTTCTTCAACGGGACCGAGCGGGTGCGGTTCCTGGACAGATACTTCTATAA 110 120 130 140 150 160 170 180 190 200 ....|....|....|....|....|....|....|....|....|....|....|....|....|....|....|....|....|....|....|....| TGGAGAAGAGTACGTGCGCTTCGACAGCGACTGGGGCGAGTTCCGGGCGGTGACCGAGCTGGGGCGGCCGGACGCCGAGTACTGGAACAGCCAGAAGGAC
210 220 230 240 250 260 270 280 Cut Size HaeIII ....|....|....|....|....|....|....|....|....|....|....|....|....|....|....|....|....|
ATCCTGGAGGAGAAGCGGGCCGAGGTGGACAGGGTGTGCAGACACAACTACGGGGTCGGTGAGAGTTTCACTGTGCAGCGGCGAA REVERSE
Gambar 4. Letak sequend primer forward dan reverse MHC DRB3 exon 2
Tabel 4. Frekuensi Alel Gen MHC HaeIII
Populasi Jumlah (ekor) Frekuensi Alel A B C D E F Bali 49 0,01 0,02 0,41 - 0,42 0,14 CrossBreed 48 0,13 0,06 0,40 - 0,26 0,15 Total 97 0,07 0,04 0,41 0,34 0,14
29
Frekuensi alel yang tertinggi pada sapi Bali terdapat pada alel E (0,41) dan frekuensi alel terendah terdapat pada alel A (0,01). Sedangkan pada sapi hasil persilangan frekuensi alel tertinggi C (0,40) dan frekuensi alel terendah yaitu alel B (0,06). Jumlah alel pada penelitian ini lebih sedikit dibandingkan alel yang ditemukan pada penelitian sapi bali sebelumnya oleh Puja et al.,(2011), yakni pada sapi Bali jantan asal Bali teridentifikasi sebanyak 7 alel dan pada sapi Bali jantan asal Nusa Penida sebanyak 9 alel. Sedangkan penelitian yang dilakukan oleh Trinayani et al.,
(2013) menemukan 10 alel.Jumlah alel yang ditemukan pada sapi Bali masih lebih sedikit dibandingkan pada bangsa sapi lainnya, seperti yang dilaporkan Acosta-Rodriguez et al.,(2005) yang mengidentifikasi 18 alel pada sapi persilangan antara bangsa sapi Eropa, Simmenthal, Holstein dan Zebu.
Menurut Dietz et al., (1997) bahwa teridentifikasi 22 allel pada bangsa sapi Holstein dan Baltian et al., (2012) menemukan 11 alel pada sapi perah dari Argentina. Martinezet al., (2006) mengidentifikasi 20 allel pada sapi persilangan antara Gyr dengan Holstein, 22 allel pada sapi zebu di India (Sachinandan De et al., 2011), sedangkan Nascimento et al., (2006) menemukan 37 allel pada sapi Brazilian Gyr dairy cattle (Bos indicus).
Beberapa penelitian telah dilakukan untuk mengetahui hubungan alel-alel BoLA DRB3 dengan sifat produksi dan imunitas. Dietz et al. (1997) menemukan bahwa alel – alel BoLA DRB3 exon 2 berhubungan erat dengan karakter imunitas. Alel-alel BoLA DRB3 exon 2 diketahui berhubungan dengan ketahanan dan kerentanan individu sapi terhadap beberapa penyakit seperti penyakit kuku dan mulut
30
(Lewin et al., 1999), Baltian et al., (2012) menemukan bahwa alel yang tahan terhadap penyakit mastitis yaitu alel A pada sapi perah Argentina, sedangkan Gowane (2013) menemukan bahwa alel A mempunyai tingkat ketahanan yang lebih tinggi terhadap FMD (Food and Mouth Disease) dan penyakit yang disebabkan serangan kutu/ caplak (Boophilus microplus) (Martinez et al.,2006).
Nilai Heterozigositas
Hasil analisis nilai heterozigositas pada fragmen gen MHC sapi Bali dan sapi hasil persilangan dapat dilihat pada Tabel 5.
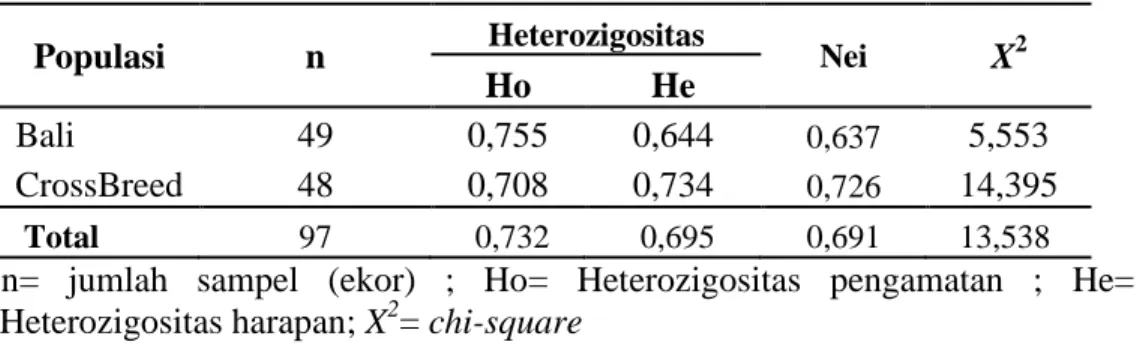
Tabel 5. Nilai Heterozigositas Gen MHC HaeIII
Populasi n Heterozigositas Nei X2
Ho He
Bali 49 0,755 0,644 0,637 5,553 CrossBreed 48 0,708 0,734 0,726 14,395
Total 97 0,732 0,695 0,691 13,538
n= jumlah sampel (ekor) ; Ho= Heterozigositas pengamatan ; He= Heterozigositas harapan; X2= chi-square
Menurut Nei dan Kumar (2000), keragaman genetik dapat diukur berdasarkan nilai heterozigositas. Nilai heterozigositas merupakan cara yang paling akurat untuk mengukur variasi genetik. Nilai heterozigositas pengamatan pada sapi Bali (0,755) dan pada sapi hasil persilangan (0,708). Sedangkan nilai heterozigositas harapan pada sapi Bali (0,644) dan pada sapi hasil persilangan (0,734). Menurut Tambasco, et al
31
heterozigositas harapan (He) dapat dijadikan indikator tidak adanya keseimbangan genotipe pada populasi yang diamati.
Pengujian keseimbangan Hukum Hardy-Weinberg pada populasi sapi Bali dan sapi hasil persilangan, dilakukan dengan menggunakan uji chi-square untuk mengetahui apakah data pengamatan diperoleh menyimpang atautidak menyimpang dari yang diharapkan. Pada Tabel 5. menunjukkan bahwa frekuensi alel gen MHC DRB3 exon 2 tidak berada dalam keseimbangan Hardy-Weinberg (P < 0,05). Hal ini mengindikasikan bahwa telah terjadi proses seleksi pada sapi Bali dan sapi hasil persilangan.
Hardy-Weinberg menyatakan bahwa frekuensi alel dan frekuensi genotipe dalam suatu populasi akan tetap konstan, yakni berada dalam keseimbangan dari satu generasi ke generasi lainnya kecuali apabila terdapat pengaruh-pengaruh tertentu yang mengganggu keseimbangan tersebut. Pengaruh-pengaruh tersebut meliputi perkawinan tak acak, mutasi, seleksi, dan ukuran populasi terbatas. Dalam suatu populasi satu atau lebih pengaruh ini akan selalu ada. Oleh karena itu, keseimbangan Hardy-Weinberg sangatlah tidak mungkin terjadi di alam. Keseimbangan genetik adalah suatu keadaan ideal yang dapat dijadikan sebagai garis dasar untuk mengukur perubahan genetik (Burns, 1980).
32
KESIMPULAN DAN SARAN
Kesimpulan
Berdasarkan penelitian yang telah dilakukan maka dapat ditarik kesimpulan sebagai berikut :
- Gen MHC DRB3 exon 2 pada populasi sapi Bali dan sapi hasil persilangan bersifat polimorfik, terdapat 8 macam genotipe pada sapi Bali dan 10 macam genotipe pada sapi hasil persilangan.
- Hasil analisis menunjukkan bahwa alel yang umum ditemukan pada sapi Bali dan sapi hasil persilangan yaitu alel C dan alel E. Hasil uji chi square
terhadap genotip MHC DRB3 exon 2| HaeIII menunjukkan bahwa frekuensi genotipe tidak berada dalam keseimbangan Hardy-Weinberg.
Saran
Berdasarkan kesimpulan penelitian ini perlu dilakukan penelitian lebih lanjut untuk mencari hubungan variasi alel-alel yang ditemukan dengan kemampuan daya tahan dan responimun dari sapi Bali dan sapi hasil persilangan terhadap penyakit.
33
DAFTAR PUSTAKA
Acharya, C.P., D.L. Pipalia, D.N. Rank, C.G. Joshi, B.P. Brahmkshtri, J.V. Solanki and R.R. Shah. 2002. BoLA-DRB3 gene polymorphism in jaffrabadi and mehsani buffaloes as revealed by PCR-RFLP. Indian Veterinary Journal 79: 652-56.
Acosta-Rodriguez, R., R. Alonso-Morales, S. Balladares, H. Flores-Aguilar, Z. Garcia-Vazquez, and C. Gorodezky. 2005. Analysis of BoLA class II microsatellites in cattle infested with Boophilus microplus ticks: class II is probably associated with susceptibility. Vet. Parasitol., 127: 313–21.
Ahmed, S. and E. Othman. 2006. A PCR-RFLP method for the analysis of Egyptian goat MHC class II DRB gene. Department of Cell Biology, National Research Center. Biotechnology 5 (1): 58-61, 2006.
Albert, B., D. Bray, J. Lewis, M.B. Raff, K. Roberts, and J.D. Watson. 1994.
Molecular Biology of the Cell. Garland Publishing, Inc., New York.
Anonymous. 2000. Kumpulan dokumen PORDASI (Komisi Peternakan dan Kesehatan Veteriner PP. PORDASI 1966 – 2000). Jakarta.
Anthony, L., DeFranco, Richard M. Locksley, Miranda Robertson (2007). Immunity: The Immune response in infectious and inflammatory disease. Oxford University Press.
Baltian, L.R., M.V. Ripoli, S. Sanfilippo, S.N. Takeshima, Y. Aida, G. Giovambattista. 2012. Association between BoLA-DRB3 and somatic cell count in Holstein cattle from Argentina. Mol Biol Rep (2012) 39:7215–7220 DOI 10.1007/s11033-012-1526.
Baratawidjaja, K.G. 2006. Imunologi Dasar. 7th ed. Balai Penerbit FKUI. Jakarta. Barendse, W., B.E. Harrison, R,J. Bunchand M.B. Thomas. 2008. Variation at the
calpain 3 gene is associated with meat tenderness in Zebu and composite breeds of cattle. BMC Genet9:41.
Bastos-Silveira C., C. Luís, C. Ginja, L.T. Gama and M.M. Oom.2008. Genetic variation in BoLA microsatellite loci in Portuguese cattle breeds. Animal Genetic40: 101-105.
34
Batan, I.W. 2006. Sapi Bali dan Penyakitnya. Fakultas Kedokteran Hewan Universitas Udayana. Denpasar.
Bowling, A.T. 2001. Historical development and application of moleculer genetic tests for horse identification and parentage control. Liv. Prod. Sci. 72: 111-116.
Burns, G.W. 1980. The Science of Genetics : Chapter 14. Macmillan Publishing Co. New York.
Caron, L.A., H. Abplanalpand R.L. Taylor.1997. Resistance, susceptibility, and immunity to Eimeria tenella in major histocompatibility (B) complex congenic lines. Poult Sci., 76: 677−682.
Chu, M.X., S.C. Ye, L. Qiao, J.X. Wang, T. Feng, D.W. Huang, G.L. Cao, R. Di, L. Fang, G.H. Chen. 2012. Polymorphism of exon 2 of BoLA-DRB3 gene and its relationshipwith somatic cell score in Beijing Holstein cows. Mol Biol Rep (2012) 39:2909–2914 DOI 10.1007/s11033-011-1052-3
David, S.W., J. WilliamBurlingham. 2004. Immunobiology of organ transplantation. Springer.
Darwin, Eryati. 2012. Dasar Imunologi. Padang: Fakultas Kedokteran Universitas Andalas
Dietz, A.B., J.C. Detilleux, A.E. Freeman, D,H. Kelley, J.R. Stabel, and M.E. Kehrli.1997. Genetic association of bovine lymphocyte antigen DRB3 alleles with immunological traits of Holstein cattle. J. Dairy Sci., 80: 400– 405.
Ellis, S.A., E.C. Holmes, K.A. Staines, K.B. Smith, M.J. Stear, D.J. McKeever, N.D. MacHugh, W.I. Morrison. 1999 Variation in the number of expressed MHC genes in different cattle class I haplotypes. Dec;50(5-6):319-28.
Elrod, S. dan W. Stansfield. 2007. Genetika. (Damaring Tyas W. Pentj). Erlangga.Jakarta.
Firouzamandi, M., J. Shoja, A. Barzegaridan E. Roshani. 2010. Study on the association of BoLA-DRB3.2 alleles with clinical mastitis in Iranian Holstein and Sarabi (Iranian native) cattle. African Journal of Biotechnology. 9(15) : 2224-2228.
35
Gelhaus, A., L. Schnittger, D. Mehlitz, R. D. Horstmann, and C. G. Meyer. 1995. Sequence and PCR-RFLP analysis of 14 novel BoLA-DRB3 alleles. Anim. Genet. 26:147–153.
Gowane, G.R. A.K. Sharma, M. Sankar, K. Narayanan, B. Das, S. Subramaniam, B. Pattnaik. 2013. Association of BoLA DRB3 alleles with variability in immune response amongthe crossbred cattle vaccinated for foot-and-mouth disease (FMD). Research in Veterinary Science 95 (2013) 156–163
Gilliespie, B.E. B.M. Jayarao, H.H. Dowlen and S.P. Oliver. 1999. Analysis and frequency of bovine lymphocyte antigen DRB3.2 Alleles in Jersey cows. Department of Animal Science, Institute of Agriculture, The University of Tennessee, Knoxville, 37996. Department of Veterinary Science. Pennsylvania State University, University Park, 16802-3500
Gunawan, D. Pamungkas, dan L. Affandhy. 2004. Sapi Bali, Potensi, Produktivitas dan Nilai Ekonomi. Cetakan keenam. Kanisius, Yogyakarta.
Guntoro, S. 2002. Membudidayakan Sapi Bali. Kanisius. Yogyakarta.
Guillemot, F., N. Fréchin, A. Billault, A.M. Chaussé, R. Zoorob, C. Auffray, J. Embo. 1988. Isolation of chicken major histocompatibility complex class II (B-L) beta chain sequences: comparison with mammalian beta chains and expression in lymphoid organs. Apr;7(4):1031-9.
Hartl, D.L. 1988. Principle of Population Genetic.Sinauer Associates, Inc. Publisher.Sunderland.
Indrawan, M., R.B. Primack dan J. Supriatna. 2007. Biologi Konservasi. Yayasan Obor Indonesia. Jakarta.
Kuby. 1997. Immunology. W.H. Freemsn Company. 3rdEdition. New York.
Kusumadarma.2011. Teknik Molekuler dalam Analisis Keragaman DNA. http://kusumadarma17.blogspot.com/2011/07/teknik-molekuler-dalam-analisis.html. Diakses Tanggal 11 Januari 2014.
Lewin, H.A., G.C. Russell, E. Glass. 1999. Comparative organization and function of the major histocompatibility complex of domesticated cattle. Immunological Revieews.Vol.167:145-158.
36
Maillard J.C., I. Chantal I, D. Berthier, I. Sidibe and H. Raza®ndraibe. 2000. BoLA-DRB/DQB haplotypes as molecular markers of genetic susceptibility and resistance to bovine dermatophilosis. ISAG 2000 (Abstract). Proceedings of the 27th International Conference on Animal Genetics. July 22±26, 2000. Minneapolis, Minnesota, p. 62.
Martojo, H. 1988. Performans Sapi Bali dan Persilanggannya. Dalam “Seminar Eksport Ternak Potong”. Jakarta.
Martinez, M.L., M.A. Machado, C.S. Nascimento, M.V.G.B. Silva, L.R. Teodoro, J. Furlong, M.C.A. Prata, A.L. Campos, M.F.M. Guimarães, A.L.S. Azevedo, M.F.A. PiresandR.S. Verneque. 2006. Association of BoLA-DRB3.2 alleles with tick (Boophilus microplus) resistance in cattle. Genetics and Molecular Research, 5 (3): 513−524.
Mohamad, K., M. Olsson, H.T.A. Van Tol, S. Mikko, B.H. Vlamings, G. Andersson, H.R. Martinez, B. Purwantara, R.W. Paling, B. Colenbranderand J. A. Lenstra. 2009. On the origin of Indonesia cattle. Plos One 4(5): e5490. Muladno. 2002. Teknologi Rekayasa Genetika. Pustaka Wirausaha Muda.Bogor. Namikawa, T., Y. Matsuda, K. Kondo, B. Pangestu, and H. Martojo. 1980. Blood
groups and blood protein polymorphisms of different type s of cattle in Indonesia. In the origin and phylogeny of Indonesia Native Livestock 33-35.In The Research Group of Overseas Scientific Survey.
Nascimento, C.S., M.A. Machado, and M.L. Martinez. 2006. Association of the bovine major histocompatibility complex (BoLA) BoLA-DRB3 gene with fat and protein production and somatic cell score in Brazilian Gyr dairy cattle (Bos indicus). Genetics Mol. Biol. 29:641-647.
Nei M, and Kumar S. 2000. Molecular Evolutian and Phylogenetics.Oxford University Press.New York.
Nicholas, F.W. 1987. Veterinary Genetics.Oxford University Press.New York. Nicholas, F.W. 1996. Introduction to Veterinary Genetics.Oxford University
Press.New York.
Pandjassarame, K. 2009. Bioinformation Discovery: Data to Knowledge in Biology. Springer.
37
Park, L. K., P. Moran, D.A. Dightman. 1995. A polymorphism in intron D of the chinook salmon growth hormone 2 gene. Animal Genetics, 26:277-285.Diakses Tanggal 11 Januari 2014
Price, Wilson. 2005. Pathophysiology Edisi 6. EGC. Jakarta.
Puja, I.K., I.N. Wandia, P. Suastika, I.N.Sulabd. 2011. Polimorfisme genetik DNA mikrosatellite gen BoLA lokus DRB3 pada sapi Bali (Bos indicus). Biota Vol. 16 (2): 336−341, Juni 2011 ISSN 0853-8670
Purwantara, B., R.R. Noor, G. Anderson, and H. Rodriguez-Martinez. 2012. Banteng and Bali cattle in Indonesia: status and forecast. Reprod Dom Anim, 47: 2-6. Rahayu S., S.B Sumitro, T. Susilawati, dan Soemarno. 2006. Identifikasi polimorfisme gen GH (Growth Hormone) sapi Bali dengan metode PCR-RFLP. Berk.Penel. Hayati: 12 (7-11).
Sachinandan De, R.K. Singh and B. Brahma. 2011. Allelic diversity of major histocompatibility complex class II DRB gene in Indian cattle and buffalo. Molecular Biology International, 17.
Sambrook, K.J., E.F. Fritsch and T. Maniatis. 1989. Molecular Cloning Laboratory manual 3rd Ed. Cold Spring Harbour Lab. Press New York
Soller, M. and J.S. Backman.1983. Genetic polymorphism varietal identification and genetic improvement. Theor. Appl. Genet., 67, 25-33.
Sommer, S. 2005. The importance of immune gene variability (MHC) in evolutionary ecology and conservation.Frontiers in Zoology, 2: 1.
Stear, M.J., T.S. Pokony, S.E. Echternkamp, and D.D. Lunstra. 2007. The influence of the BoLA-a locus on reproductive traits in cattle. Inter. J. Immunogenetics. 16(1):77-88.
Sumadi, T., E. Hartatik,Romjali, S. Subandriyo,Subandiyah dan Hartati. 2008. Identifikasi Karakteristik Genetik Sapi PO dan Silangannya di Peternakan Rakyat. Kerjasama Kemitraan Penelitian Pertanian dengan Perguruan Tinggi (KKP3T) TA 2008. Fakultas Peternakan UGM. Yogyakarta.
Suryanto, D. 2003. Melihat Keanekaragaman Organisme Melalui Beberapa Teknik Genetika Molekuler. Program Studi Biologi Fakultas Matematika Dan Ilmu Pengetahuan Alam Universitas Sumatera Utara. ©2003 Digitized By Usu Digital Library.