1
EFIKASI BAKTERI ENDOFIT DAN
PLANT GROWTH
PROMOTING RHIZOBACTERIA
DALAM MENEKAN
PERKEMBANGAN PENYAKIT LAYU BAKTERI
(
Ralstonia solanacearum
) PADA TOMAT
FITRI FATMA WARDANI
DEPARTEMEN PROTEKSI TANAMAN
FAKULTAS PERTANIAN
INSTITUT PERTANIAN BOGOR
BOGOR
2
ABSTRACT
FITRI FATMA WARDANI. Efficacy of Endophytic Bacteria and Plant Growth Promoting Rhizobacteria to Supress the Development of Bacterial Wilt Disease (Ralstonia solanacearum) of Tomato). Under the direction of; ABDJAD ASIH NAWANGSIH.
Tomato (Lycopersicum esculentum Mill.) is a popular vegetable in Indonesia, but the production levels are still fluctuated. One of the factors affected productivity is the incidence of bacterial wilt disease caused by Ralstonia solanacearum. Effective control to manage the disease which is environmentally friendly is the use of biocontrol agents. Application of endophytic bacterial (Staphylococcus epidermidis BC4) and Plant Growth Promoting Rizhobacteria (Pseudomonas fluorescens RH4003 and Bacillus subtilis AB89) as biocontrol of tomato bacterial wilt was expected to be an alternative tool. The objective of this study is to determine the efficacy of combination among endophytic bacteria and PGPR to suppress the development of bacterial wilt disease (R. solanacearum) and promote the growth of tomato. Depend on the growth test (growth rate and dry weight plant), the combination of bacteria that could promote the growth of tomato plant was combination of S. epidermidis BC4 75% with P.fluorescens
RH4003 25%. That combination gave a better effect than the other treatments and control, but did not provide better suppression than treatment of single bacterium. Based on sinergism test, the relationship between PGPR and endophytic bacteria was an antagonistic. However, there were combination treatments which were able to suppress the disease, ie. combination of S. epidermidis BC4 50% with P. fluorescens RH4003 50% and the combination of S. epidermidis BC4 50% with B. subtilis AB89 50%.
Keywords: Endophytic bacteria, PGPR, Pseudomonas fluorescens RH4003,
3
ABSTRAK
FITRI FATMA WARDANI. Efikasi bakteri endofit dan Plant Growth Promoting Rhizobacteria dalam menekan perkembangan penyakit layu bakteri (Ralstonia solanacearum) pada tomat. Dibimbing oleh; ABDJAD ASIH NAWANGSIH.
Tomat (Lycopersicum esculentum) adalah salah satu sayuran yang sangat digemari olah banyak masyarakat karena memiliki cita rasa yang khas tetapi tingkat produksinya masih berfluktuasi. Hal ini disebabkan, antara lain adanya gangguan patogen Ralstonia solanacearum yang menyebabkan penyakit layu bakteri. Oleh karena itu, dibutuhkan suatu cara yang efektif untuk mengendalikan penyakit ini. Salah satunya adalah dengan memanfaatkan bakteri endofit dan
Plant Growth Promoting Rizhobacter (PGPR). Penelitian ini bertujuan untuk mengetahui keefektifan kombinasi bakteri endofit dan PGPR dalam menekan perkembangan penyakit layu bakteri (R.solanacearum) dan meningkatkan pertumbuhan tomat sebagai alternatif pengendalian yang ramah lingkungan. Berdasarkan uji pemacuan pertumbuhan yang telah dilakukan, kombinasi bakteri yang dapat memacu pertumbuhan tanaman tomat dengan baik adalah kombinasi
Staphylococcus epidermidis BC4 75% dengan Pseudomonas fluorescens RH4003 25%, karena berdasarkan parameter yang diamati (laju pertumbuhan tinggi tanaman dan bobot kering tanaman) kombinasi tersebut memberikan pengaruh yang lebih baik dibandingkan dengan perlakuan lain maupun kontrol. Sedangkan untuk uji penekan kejadian penyakit perlakuan kombinasi tidak memberikan penekanan yang lebih baik dibandingkan dengan perlakuan tunggal. Hal ini disebabkan hubungan antara PGPR dan bakteri endofit yang digunakan bersifat antagonis. Akan tetapi, dari perlakuan kombinasi yang telah diujikan, perlakuan dengan proporsi 50:50 baik antara S. epidermidis BC4 dengan P. fluorescens
RH4003 maupun antara S.epidermidis dengan Bacillus subtilis AB89 merupakan perlakuan yang dapat memberikan penekanan terhadap tingkat kejadian penyakit layu bakteri pada tomat dibandingan dengan proporsi lainnya.
Kata kunci: Bakteri endofit, PGPR, Pseudomas fluorescens RH4003, Bacillus subtilis AB89, Staphylococcus epidermidis BC4.
EFIKASI BAKTERI ENDOFIT DAN
PLANT GROWTH
PROMOTING RHIZOBACTERIA
DALAM MENEKAN
PERKEMBANGAN PENYAKIT LAYU BAKTERI
(
Ralstonia solanacearum
) PADA TOMAT
FITRI FATMA WARDANI
A34080005
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Pertanian di Departemen Proteksi Tanaman, Fakultas Pertanian, Institut Pertanian Bogor
DEPARTEMEN PROTEKSI TANAMAN
FAKULTAS PERTANIAN
INSTITUT PERTANIAN BOGOR
BOGOR
5 Judul Skripsi :Efikasi Bakteri Endofit dan Plant Growth Promoting Rhizobacteria dalam Menekan Perkembangan Penyakit Layu Bakteri (Ralstonia solanacearum) pada Tomat Nama Mahasiswa : Fitri Fatma Wardani
NIM : A34080005
Disetujui, Dosen Pembimbing
Dr.Ir. Abdjad Asih Nawangsih, M.Si. NIP. 19650621 198910 2 001
Diketahui, Ketua Departemen
Dr.Ir. Abdjad Asih Nawangsih, M.Si. NIP. 19650621 198910 2 001
6
RIWAYAT HIDUP
Penulis dilahirkan di Pati, Jawa Tengah pada tanggal 14 April 1991. Penulis merupakan anak kedua dari tiga bersaudara pasangan Hono dan Karyatun. Ayah penulis bekerja di Departemen Pertanian Kabupaten Pati sebagai Pengamat Organisme Pengganggu Tanaman (POPT) sedangkan Ibu penulis mengurus lahan sawah dan kebun. Pendidikan formal penulis dimulai saat penulis mulai bersekolah di SDN 02 Wangunrejo pada tahun 1996. Pada tahun 2002, penulis lulus dari SDN 02 Wangunrejo dan diterima di SMPN 03 Pati. Pada tahun 2005, penulis lulus dan juga diterima di SMAN 01 Pati. Selama SMA, penulis merupakan salah satu anggota Forum Diskusi Ilmiah. Penulis juga merupakan salah satu anggota kontingen Olimpiade Biologi SMAN 01 Pati. Pada tahun 2008, penulis lulus dari SMAN 01 Pati dan diterima di Institut Pertanian Bogor (IPB) melalui jalur Undangan Seleksi Masuk IPB (USMI). Selama satu tahun penulis menempuh Tingkat Persiapan Bersama (TPB) dan kemudian pada tahun 2009, penulis menjadi mahasiswa Departemen Proteksi Tanaman, Fakultas Pertanian IPB. Selama di IPB penulis bergabung dengan UKM Gentra Kaheman, organisasi mahasiswa daerah Ikatan Keluarga Mahasiswa Pati (IKMP), organisasi Himpunan Mahasiswa Proteksi Tanaman (HIMASITA), dan Organic Farming Club. Penulis pernah menjadi asisten praktikum Biologi Patogen Tumbuhan, Ilmu Penyakit Tumbuhan Dasar dan Pemanfaatan dan Pengelolaan Pestisida. Pada tahun 2011 dan 2012, penulis merupakan salah satu Mahasiswa Berprestasi Departemen Proteksi Tanaman. Selain itu, penulis juga pernah mengikuti Program Kreativitas Mahasiswa (PKM). Pada tahun 2010, penulis menjadi anggota PKM-P yang berjudul “Uji Pemanfaatan Bakteriofage sebagai Agens Antagonis Patogen
Xanthomonas campestris Penyebab Hawar Daun Bakteri pada Padi”. Pada tahun
2011, penulis menjadi ketua sekaligus anggota dari dua PKM-P yang berbeda. Penulis menjadi ketua PKM-P yang berjudul “Keragaman Cendawan Endofit Padi pada berbagai Varietas dan Cara Budidaya di Daerah Jawa Barat dan Jawa Tengah” dan menjadi anggota dari PKM-P yang berjudul “Efikasi Bakteriofage sebagai Agens Antagonis Xanthomonas oryzae pv. oryzae Penyebab Hawar Daun Padi dengan Formulasi Liquid dan Powder”.
7
PRAKATA
Puji syukur kehadirat Allah SWT, atas seluruh rahmat dan anugerah-Nya sehingga penulis dapat menyelesaikan laporan tugas akhir yang berjudul “Efikasi Bakteri Endofit dan Plant Growth Promoting Rhizobacteria dalam Menekan Perkembangan Penyakit Layu Bakteri (Ralstonia solanacearum) pada Tomat”.
Ucapan terima kasih, penulis sampaikan kepada Dr. Ir. Abdjad Asih Nawangsih, M.Si selaku dosen pemimbing tugas akhir ini, Dr. Ir. Swastiko Priyambodo, M.Si. selaku dosen penguji tamu, Dr. Ir. Damayanti Buchori, M.Sc selaku dosen pembimbing akademik. Selain itu, penulis juga mengucapkan terima kasih kepada orang tua penulis, Bapak Hono dan Ibu Karyatun, kakak dan adik penulis (Ika Erna Wardani, Sinta Dewi Triawardani dan Maalik), keluarga besar Sastro Ras dan Sumarto, teman-teman Laboratorium Bakteriologi Tumbuhan (Novra, Riska DO, Elysa, Syaiful, Imam Khoiri, Imam Luthfi, Venny, Bu Lia, Kak Tatit, Kak Izza, Kak Vinda, Mbak Tita), teman-teman DPT 45 (Icut, Sasti, Rita, Nisa, Nuri, Dila, Nengah, Hamda, Titin, Yudia, Sylvi, Isma, dll), teman-teman Pondok Nuansa Sakinah 2 Lantai 2 (Dora, Nunu, Jejes, Eya, Azizah, Aul, Dewi, Dina, Lita, Aii, Dela, Nanda) dan pihak-pihak lain yang telah berperan dalam mendukung serta membantu pelaksanaan penelitian dan penyusunan laporan tugas akhir ini yang tidak dapat penulis sebutkan. Ucapan terima kasih juga penulis sampaikan bagi program penelitian Hibah Bersaing Direktorat Pendidikan Tinggi atas alokasi sebagian dana untuk penelitian ini.
Seperti kita ketahui bahwa tomat merupakan komotidas yang sangat diminati oleh masyarakat. Namun dalam proses budidayanya, masalah patogen, seperti R. solanacearum penyebab penyakit layu bakteri, merupakan masalah utama karena dapat mengganggu hasil panen secara signifikan. Beberapa dasawarsa terakhir, peningkatan ketahanan tanaman banyak dikembangkan setelah masalah lingkungan juga diperhatikan. Bakteri endofit dan PGPR adalah bakteri memberikan banyak manfaat pada tanaman. Selain dapat meningkatkan ketahanan tanaman terhadap penyakit, bakteri endofit dan PGPR ini dapat memacu pertumbuhan tanaman. Sifat inilah yang coba penulis teliti dalam kaitannya dengan pengendalian patogen pada tanaman tomat, yaitu
R.solanacearum.
Penulis berharap laporan tugas akhir ini dapat bermanfaat baik bagi penulis maupun bagi pembaca pada umumnya dan salah satu diantaranya adalah petani. Atas segala kesalahan, penulis memohon kebijaksanaan dari semua pihak untuk memaafkannya.
Bogor, Agustus 2012
8
DAFTAR ISI
Halaman DAFTAR TABEL ... ix DAFTAR GAMBAR ... ix DAFTAR LAMPIRAN ... x PENDAHULUAN ... 1 Latar Belakang ... 1 Tujuan Penelitian ... 4 Manfaat Penelitian ... 4 TINJAUAN PUSTAKA ... 5Tomat (Lycopersicum esculentum) ... 5
Layu Bakteri (Bacterial Wilt) ... 6
Pengendalian Penyakit ... 9
Bakteri Endofit ... 11
Plant Growth Promoting Rhizobacteria ... 13
B. subtilis AB89 ... 13
P. fluorescens RH4003 ... 14
Kombinasi Agens Biokontrol ... 15
BAHAN DAN METODE ... 17
Tempat dan Waktu ... 17
Penyiapan Tanaman Uji ... 17
Pemeliharaan dan Penyiapan Suspensi Bakteri Endofit dan PGPR .. 17
Uji Penekanan Kejadian Penyakit ... 19
Uji Pemacuan Pertumbuhan ... 23
Rancangan Percobaan dan Analisis Data ... 24
HASIL DAN PEMBAHASAN ... 25
Pengaruh Kombinasi Agens Biokontrol terhadap Kejadian Penyakit Layu Bakteri ... 25
Pengaruh Kombinasi Agens Biokontrol terhadap Masa Inkubasi Penyakit Layu Bakteri ... 28
Pengaruh Kombinasi Agens Biokontrol terhadap Laju Pertambahan Tinggi Tanaman ... 29
Pengaruh Kombinasi Agens Biokontrol terhadap Bobot Kering Tanaman ... 32
Jenis Hubungan PGPR dan Bakteri Endofit ... 34
KESIMPULAN DAN SARAN ... 36
DAFTAR PUSTAKA ... 37
9
DAFTAR TABEL
Halaman 1 Kode perlakuan dan proporsi suspensi bakteri dalam perlakuan pada
uji penekanan penyakit ... 21 2 Nilai AUDPC (Area Under Disease Progress Curve) pada berbagai
perlakuan bakteri endofit dan PGPR ... 27 3 Pengaruh perlakuan bakteri endofit dan PGPR terhadap masa inkubasi
penyakit layu bakteri pada tanaman tomat ... 28 4 Nilai AUHPGC (Area Under Height of Plant Growth Curve) pada
berbagai perlakuan bakteri endofit dan PGPR ... 31 5 Bobot kering tanaman tomat pada umur 6 minggu setelah tanam ... 33 6 Keefektifan pengendalian (index penekanan penyakit), nilai Sinergy
Factor (SF) dan jenis hubungan antara PGPR dan bakteri endofit dari
perlakuan kombinasi berdasarkan nilai AUDPC layu bakteri ... 34
DAFTAR GAMBAR
Halaman 1 Total produksi tomat di Indonesia tahun 2000-2010 ... 6 2 Gejala layu bakteri pada tanaman tomat dan gejala munculnya akar
adventif (tanda panah) pada pangkal batang tanaman tomat . ... 8 3 Biakan murni dan koloni tunggal S. epidermidis BC4, B. subtilis AB89
dan P. fluorescens RH4003 pada medium NA dan King’s B ... 18 4 Biakan murni dan koloni tunggal R. solanacearum pada medium TZC,
isolat yang virulenadalah isolat yang bagian tengah merah muda dikelilingi lendir berwarna putih (tanda panah) ... 20 5 Grafik kejadian penyakit layu bakteri pada berbagai perlakuan bakteri
endofit dan PGPR dari minggu ke-1 samapai minggu ke-7 ... 26 6 Grafik laju pertambahan tinggi tomat pada berbagai perlakuan bakteri
10
DAFTAR LAMPIRAN
Halaman 1 Kejadian penyakit dan nilai AUDPC tomat dengan berbagai perlakuan
pada minggu ke-1 sampai minggu ke-7 setelah tanam ... 42
2 Laju pertambahan tinggi dan nilai AUHPGC tomat dengan berbagai perlakuan pada minggu ke-0 sampai minggu ke-6 setelah tanam ... 42
3 Hasil analisis ragam tingkat kejadian penyakit layu bakteri di rumah kaca pada minggu 1 sampai 7 ... 43
4 Hasil analisis ragam laju pertambahan tinggi tanaman tomat di rumah kaca pada minggu 1 sampai 6 ... 44
5 Hasil analisis ragam masa inkubasi penyakit layu bakteri pada tanaman tomat di rumah kaca ... 45
6 Hasil analisis ragam nilai AUDPC tomat di rumah kaca ... 45
7 Hasil analisi ragam bobot kering tanaman tomat pada rumah kaca ... 45
8 Hasil analisis ragam nilai AUHPGC tomat di rumah kaca ... 45
9 Suspensi PGPR dan bakteri endofit yang digunakan untuk aplikasi dan pengenceran suspensi PGPR dan bakteri endofit untuk aplikasi ... 46
10 Tahapan pemeliharaan R. solanacearum ... 46
11 Keadaan tanaman tomat di dalam rumah kaca pada saat pindah tanam dan saat berumur 11 HST ... 47
12 Layout percobaan yang digunakan dalam penelitian ... 47
PENDAHULUAN
Latar Belakang
Tanaman tomat (Lycopersicum esculentum Mill.) merupakan salah satu komoditas pertanian yang bernilai ekonomi tinggi dan banyak diusahakan secara komersial di Indonesia. Tomat dapat dijadikan sayuran, minuman, bahan obat-obatan maupun bahan untuk komestik (Purwanto dan Tjahjono 2001). Berdasarkan BPS (2012), produksi tomat di Indonesia mulai tahun 2000 sampai 2010 relatif mengalami kenaikan karena jumlah permintaan yang semakin naik pula. Produksi yang meningkat ini didukung dengan meningkatnya luas lahan yang ditanami tomat. Akan tetapi, produksi tomat ini hanya terpusat di daerah Jawa saja sehingga apabila produksi di daerah Jawa ini mengalami gangguan maka kebutuhan tomat masyarakat Indonesia akan terganggu. Selain itu, menurut Jaya (1997) kendala dalam produksi tomat adalah kurang tersedianya tomat varietas unggul yang mempunyai produksi dan kualitas baik, lahan yang cukup, teknik budidaya yang tepat dan tahan terhadap gangguan hama dan penyakit.
Salah satu kendala produksi tomat adalah penyakit layu bakteri yang disebabkan oleh Ralastonia solanacearum. R. solanacearum yang menyerang tomat merupakan ras 1 yang banyak menyerang tanaman dari famili Solanaceae. Selain menyerang tanaman dari famili Solanaceae, R. solanacearum juga dapat menyerang tanaman lain, misalnya pisang, jahe, terung, tembakau, dan kacang tanah. Berdasarkan kisaran inangnya inilah, R. solanacearum dibagi menjadi 5 ras (Alvarez et al. 2010). R. solanacearum menyebabkan tanaman tomat mengalami layu mendadak dan memproduksi akar adventif dalam jumlah yang cukup banyak (Purwanto dan Tjahjono 2001). Di daerah tropika, penyakit layu bakteri dapat menyebabkan kerugian yang cukup besar, bahkan dapat menggagalkan panen. Kerugian yang disebabkan penyakit layu bakteri tergantung pada iklim mikro, tipe tanah, teknik budidaya, varietas tanaman, dan tingkat virulensi patogen yang menyerang (Alvarez et al. 2010).
Cara-cara pengendalian layu bakteri yang sering dilakukan adalah dengan menggunakan varietas tahan, kultur teknis (sanitasi dan rotasi tanaman), dan pestisida (Hartman dan Elphinstone 1994). Varietas tahan dapat mengendalikan
penyakit layu bakteri dengan baik, tetapi pengendalian ini tidak dapat digunakan secara lama. Varietas tahan akan memberikan tekanan biologi kepada patogen sehingga akan memunculkan strain-strain baru yang lebih virulen (Almoneafy et al. 2012). Cara kultur teknis dengan sanitasi dan rotasi tanaman juga merupakan cara pengendalian yang cukup efektif dan tidak menimbulkan dampak negatif pada lingkungan. Sanitasi dilakukan dengan cara membuang tanaman-tanaman yang terserang dan membersihkan sisa-sisa tanaman yang tertinggal di lahan. Hal ini akan meminimalkan tanaman tomat terinfeksi patogen karena jumlah inokulum patogen akan menjadi lebih kecil akibat sanitasi. Akan tetapi, sanitasi ini dinilai kurang efisien karena membutuhkan waktu dan tenaga yang cukup banyak. Rotasi tanaman juga dapat mengendalikan penyakit layu bakteri, akan tetapi rotasi tanaman bukan inang ini sulit untuk dilakukan karena patogen memiliki banyak ras yang dapat menginfeksi berbagai tanaman dari berbagai famili (Purwanto dan Tjahjono 2001).
Pestisida merupakan alternatif pengendalian utama yang dipilih oleh petani, tapi sampai saat ini belum ada pestisida yang praktis dan efisien untuk mengendalikan penyakit layu bakteri (Hartman dan Elphinstone 1994). Pada awalnya, aplikasi pestisida akan mengurangi jumlah tanaman yang terinfeksi dan akan menguntungkan petani. Akan tetapi, aplikasi pestisida, selain memberikan dampak positif, juga memberikan ancaman terhadap kualitas lingkungan, keseimbangan ekosistem, munculnya strain baru bakteri yang lebih tahan, matinya mikroorganisme nonsasaran dan juga dapat mengancam kesehatan manusia melalui residu yang tertinggal pada buah tomatnya. Pengendalian menggunakan bahan kimia merupakan salah satu penyebab kerusakan lingkungan dan terjadinya ketahanan bakteri (EPPO 3 Mei 2011). Oleh karena itu, dibutuhkan cara pengendalian yang tepat sehingga dapat mengendalikan layu bakteri secara optimal dan efektif tanpa menyebabkan kerusakan lingkungan.
Agens biokontrol adalah mahluk hidup yang berperan sebagai penekan perkembangan patogen dengan cara menghambat pertumbuhan dan perkembangan patogen tersebut. Agens biokontrol dapat menekan perkembangan patogen dengan satu atau beberapa mekanisme penghambatan. Mekanisme penghambatan yang terjadi antar agens biokontrol dengan patogen adalah
3 kompetisi ruang atau/dan nutrisi, antibiosis dan induksi resistensi (Lo 1998). Kemampuan suatu agens biokontrol dapat ditingkatkan dengan mengombinasikan dua atau lebih agens biokontrol (Guetsky et al. 2001, 2002). Kombinasi ini perlu diperhatikan bahwa masing-masing agens biokontrol tidak saling menghambat (Nawangsih 2006). Persyaratan agar kombinasi dua agens biokontrol atau lebih dapat bekerja secara optimal yaitu: 1) bekerja pada tempat yang berbeda misalnya pada rizosfer atau sisa-sisa bahan organik, 2) memiliki mekanisme pengendalian yang berbeda, misalnya kompetisi dan antibiosis, 3) memerlukan substrat yang berbeda, misalnya lendir tanaman untuk bakteri dan cendawan dan eksudat akar untuk bakteri kelompok pseudomonas, dan 4) kompatibel dengan lingkungan tanah serta perubahan yang terjadi karena peningkatan cara bercocok tanam (Mishra et al. 2011, Robert et al. 2005).
Agens biokontrol yang dapat digunakan sebagai alternatif pengendalian dalam rangka mewujudkan sistem pertanian yang berkelanjutan adalah bakteri endofit dan PGPR (Sutariati et al. 2006, Damayanti 2010). Kedua agens biokontrol tersebut dapat dikombinasikan. Menurut Ryan et al. (2007), bakteri endofit adalah bakteri yang mengkolonisasi jaringan tanaman sehat tanpa menyebabkan penyakit pada inangnya. Keberadaannya secara alami, dapat berasosiasi dengan tanaman dalam jangka waktu yang cukup lama, akan tetapi bukan berupa organ spesifik dari tanaman. Bakteri endofit dapat dijadikan sebagai agens pengendali hayati dan dapat memacu pertumbuhan tanaman. Sampai saat ini penelitian tentang bakteri endofit telah dilakukan dengan sampai tahap in planta oleh Damayanti (2010). Berdasarkan hasil penelitian tersebut, dinyatakan bahwa bakteri endofit yang berhasil diisolasi dari batang tanaman tomat tidak memberikan pengaruh terhadap pertumbuhan tanaman tomat. Bakteri endofit hanya dapat menekan kejadian penyakit layu bekteri serta tidak mampu memacu pertumbuhan tanaman tomat (Damayanti 2010).
Menurut Husen (2003), Plant Growth Promoting Rhizobacteria (PGPR) adalah kelompok bakteri menguntungkan yang agresif mengkolonisasi rizosfer. PGPR ini berperan penting dalam meningkatkan pertumbuhan tanaman, perlindungan hasil panen, meningkatkan kesuburan lahan, serta mempercepat pengomposan. PGPR ini berperan penting dalam meningkatkan pertumbuhan
tanaman, perlindungan hasil panen, meningkatkan kesuburan lahan, serta mempercepat pengomposan. Bakteri P.fluorescens RH4003 dan B. subtilis AB89 adalah PGPR yang telah berhasil diisolasi dari perakaran tomat. Aplikasi P. fluorescens RH4003 di rumah kaca menunjukkan bahwa isolat tersebut mampu menekan perkembangan penyakit layu bakteri. Aplikasi B. subtilis AB89 di lapangan juga mampu menekan perkembangan penyakit layu bakteri (Nawangsih 2006).
Penelitian tentang kombinasi antara bakteri endofit dan PGPR telah dilakukan di lapangan sampai dengan proporsi 50:50. Berdasarkan penelitian yang dilakukan oleh Handini (2011), aplikasi kombinasi bakteri endofit dan PGPR dengan perbandingan 50% bakteri endofit dan 50% PGPR kurang efektif dalam menekan perkembangan penyakit layu bakteri di lapangan. Aplikasi gabungan antara PGPR dan bakteri endofit juga tidak mempengaruhi pertambahan tinggi tanaman dan bobot kering tanaman. Bakteri endofit S. epidermidis BC4 bersifat antagonis jika dikombinasikan dengan bakteri PGPR P. fluorescens RH4003 dan
B. subtilis AB89 dalam perbandingan 50:50. Oleh karena itu, diperlukan proporsi perbandingan yang tepat agar kombinasi S. epidermidis BC4, P. fluorescens
RH4003 dan B. subtilis AB89 dapat menurunkan kejadian penyakit layu bakteri dan juga dapat memacu pertumbuhan tomat.
Tujuan Penelitian
Penelitian ini bertujuan menguji beberapa proporsi kombinasi bakteri endofit dan PGPR dalam meningkatkan pertumbuhan tomat dan menekan perkembangan penyakit layu bakteri (R. solanacearum).
Manfaat Penelitian
Penelitian ini diharapkan dapat menghasilkan proporsi kombinasi bakteri endofit dan PGPR yang dapat meningkatkan pertumbuhan tomat dan menekan perkembangan penyakit layu bakteri (R. solanacearum) sehingga dapat dimanfaatkan oleh petani.
5
TINJAUAN PUSTAKA
Tomat (Lycopersicum esculentum)
Tomat adalah salah satu sayuran yang sangat dikenal masyarakat. Tomat memiliki ciri khas rasa yang unik sehingga digemari banyak orang. Cita rasa yang khas ini dapat menambah kelezatan berbagai macam masakan dan minuman. Tanaman tomat tergolong dalam tanaman semusim (berumur pendek, kurang dari 1 tahun). Penanamannya perlu ditopang dengan ajir dari turus bambu agar tidak roboh dan tumbuh secara vertikal karena tanaman tomat berbentuk perdu dengan panjang mencapai kurang lebih 2 meter (Jones 2008).
Tomat memiliki akar tunggang yang tumbuh menembus ke dalam tanah dan akar serabut yang tumbuh menyebar ke samping tetapi dangkal. Berdasarkan sifat perakarannya ini, tomat akan tumbuh baik di lahan yang gembur dan porous. Batang tomat berbentuk segi empat hingga bulat, lunak tapi cukup kuat, berbulu atau berambut halus dan di antara bulu-bulu itu terdapat rambut kelenjar. Batangnya berwarna hijau, pada ruas-ruas batang mengalami penebalan dan pada ruas bagian bawah tumbuh akar-akar pendek. Daun tomat berbentuk oval, berwarna hijau dan merupakan daun majemuk ganjil yang berjumlah 5 sampai 7. Daun majemuk tumbuh berselang-seling atau tersusun spiral mengelilingi batang tanaman. Bunga tanaman tomat berukuran kecil dan berwarna kuning cerah. Bunga tomat merupakan bunga sempurna dan tumbuh dari cabang yang masih muda. Buah tomat memiliki bentuk dan ukuran yang bervariasi tergantung pada jenisnya. Buah tomat yang masih muda berwarna hijau, bila sudah matang akan berwarna merah. Tomat dapat tumbuh pada tempat dengan ketinggian 0 sampai 1250 m di atas permukaan laut, suhu optimal pada siang hari 230C dan pada malam hari 170C, menyukai tanah dengan derajat keasaman netral terutama yang mengandung humus, gembur, sarang dan berdrainase baik (Jones 2008).
Tomat sangat bermanfaat bagi tubuh karena mengandung vitamin dan mineral yang diperlukan untuk pertumbuhan dan kesehatan. Sebagai sumber vitamin, tomat kaya akan vitamin C yang berguna untuk meningkatkan kekebalan tubuh serta mengobati berbagai penyakit, seperti sariawan. Tomat juga kaya akan vitamin A yang dapat mencegah dan mengobati xeropthalmia pada mata, zat besi
6 (Fe) yang bermanfaat dalam pembentukan sel darah merah, serat yang dapat membantu penyerapan makanan dalam pencernaan serta kaya akan kalium (K) yang dapat menurunkan tekanan darah tinggi (Jones 2008).
Gambar 1 Total produksi tomat di Indonesia tahun 2000-2010 Sumber: Badan Pusat Statistik (www.bps.go.id)
Tanaman tomat merupakan salah satu komoditas pertanian yang bernilai ekonomi tinggi dan banyak diusahakan secara komersial di Indonesia. Sampai saat ini produksi tomat di Indonesia masih reIatif rendah yaitu 6,30 ton/ha dan pengembangannya masih terpusat di Pulau Jawa (BPS 2012). Jaya (1997) menyebutkan bahwa penyebab menurunnya produksi adalah kurang tersedianya tomat varietas unggul yang mempunyai produksi tinggi, buah berkualitas baik, lahan yang cukup, teknik budidaya yang tepat dan tahan terhadap gangguan hama dan penyakit.
Layu Bakteri (Bacterial Wilt)
Layu bakteri adalah penyakit yang paling merusak pada tomat. Penyakit ini tersebar luas di daerah tropis. Berdasarkan penelitian yang dilakukan oleh Purwanto dan Tjahjono (2001), gejala layu bakteri adalah tanaman muda yang terinfeksi akan segera mati, sedangkan tanaman tua menunjukkan daun layu, menguning, kerdil dan akhirnya mati (Gambar 2a). Tanaman tomat yang
0 200000 400000 600000 800000 1000000 20002001200220032004200520062007200820092010 P rod u k si tot al tom at (t on /tahu n ) Tahun
7 terinfeksi akan membentuk akar adventif di sekitar pangkal batang (Gambar 2b). Akar adventif akan lebih banyak muncul apabila penyakit berkembang pada lingkungan yang kurang mendukung, yaitu suhu rendah, virulensi rendah, resistensi tanaman yang kurang (McCarter 2006). Jaringan pembuluh batang dan akar akan mengalami pembusukan, berwarna coklat tua sampai hitam. Akar juga akan berwarna coklat bila tanaman sudah mengalami layu permanen (McCarter 2006).
Apabila bagian batang dipotong, dari jaringan pembuluh akan keluar massa bakteri seperti lendir berwarna putih susu dan lendir lebih banyak keluar bila potongan batang diletakkan di tempat lembab. Jika potongan batang sakit dimasukkan ke dalam gelas berisi air jernih, selama beberapa menit akan terlihat benang-benang putih halus yang akan putus bila gelas digoyang dan air berubah menjadi keruh. Benang putih tersebut merupakan massa bakteri yang biasa disebut dengan oose (Purwanto dan Tjahjono 2001, McCarter 2006). Oose inilah yang membedakan tanaman yang tersinfeksi layu bakteri dengan layu akibat cendawan maupun layu akibat gangguan fisiologis (McCarter 2006).
Berdasarkan McCarter (2006) gejala penyakit layu bakteri diawali dengan layunya daun yang paling muda. Layu ini terjadi pada hari yang panas. Layu pada seluruh bagian tanaman akan terjadi bila keadaan lingkungan mendukung perkembangan penyakit. Layu akan terjadi lebih lama bila lingkungan kurang mendukung perkembangan patogen di dalam tanaman. Faktor utama yang mempengaruhi perkembangan penyakit layu bakteri adalah kelembaban tanah. Kelembaban tanah ini sangat berpengaruh terhadap tingkat reproduksi dan ketahanan patogen di dalam tanah. Patogen akan berkembang dengan baik pada kelembaban tanah yang tinggi. Di lapangan, kelembaban tanah ini selalu dihubungkan dengan periode musim hujan yang terjadi pada musim tanam. Periode musim hujan yang tinggi akan menyebabkan kelembaban tanah yang tinggi pula. Selain itu, penyakit akan menjadi lebih parah pada suhu 24 - 350C. Kerdil dapat terjadi pada beberapa tanaman, akan tetapi kerdil jarang sekali terjadi (EPPO 3 Mei 2011).
8
Gambar 2 a. Gejala layu bakteri pada tanaman tomat; b. Gejala munculnya akar adventif (tanda panah) pada pangkal batang tanaman tomat
Patogen penyebab layu bakteri adalah Ralstonia solanacearum. Bakteri ini merupakan bakteri patogen tular tanah. R. solanacearum tersebar luas di daerah tropis, sub tropis, dan beberapa daerah hangat lainnya. Spesies ini juga memiliki kisaran inang luas dan dapat menginfeksi ratusan spesies pada banyak famili. Berdasarkan kisaran inangnya, R. solanacearum dikelompokkan menjadi 5 ras. Ras 1 menyerang tanaman tembakau, tomat dan famili Solanaceae lainnya, ras 2 menyerang tanaman pisang, ras 3 menyerang tanaman kentang, ras 4 menyerang tanaman jahe, dan ras 5 menyerang tanaman mulberry (Hayward dan Elphinstone 1994). R. solanacearum memiliki banyak ras sehingga pengendalian penyakit layu bakteri ini sulit dilakukan (Suryadi dan Mahmud 2002).
Patogen masuk ke dalam tanaman melalui luka pada akar, luka pada batang maupun melalui stomata yang menjadi lubang masuk. Patogen kemudian menuju ke sistem pembuluh tanaman. Proses pencapaian sistem pembuluh akan menjadi lebih cepat bila suhu pada saat infeksi tinggi. Setelah mencapai sistem pembuluh kemudian patogen mengkolonisasi xilem. Pada xilem, patogen bereproduksi dengan sangat cepat sehingga memblok saluran xilem. Xilem yang terblok akan menyebabkan tanaman sulit menyalurkan air dan nutrisi sehingga
9 tanaman menjadi layu (EPPO 3 Mei 2011, McCarter 2006). Patogen dapat menyebar melalui air irigasi, tanah yang terinfestasi, dan sisa tanaman yang telah terinfeksi (McCarter 2006).
Pengendalian Penyakit
Pengendalian penyakit layu bakteri sulit untuk dilakukan terutama layu bakteri akibat infeksi R. solanacearum ras 1. Ras 1 sulit dikendalikan karena memiliki kisaran inang yang luas. Teknik pengendalian yang pernah dilakukan adalah rotasi tanaman dengan tanaman bukan inang (Hartman dan Elphinstone 1994). Di Peru, rotasi tanaman dengan jagung dapat mengurangi infeksi patogen dengan cepat. Rotasi tanaman selama 3 tahun dengan padi dapat menurunkan tingkat kejadian penyakit layu bakteri dari 85% menjadi 1.5% di China. Di Indonesia juga pernah dilakukan penelitian tentang pengendalian layu bakteri dengan rotasi tanaman bukan inang dengan menggunakan padi dan jagung selama 2 tahun. Rotasi tanaman tersebut juga dapat menurunkan tingkat kejadian penyakit layu bakteri (Hartman dan Elphinstone 1994). Rotasi tanaman memerlukan waktu yang lama meskipun dapat mengurangi tingkat kejadian penyakit.
Pengendalian secara kimiawi biasanya dilakukan dengan menggunakan bakterisida. Bahan kimia komersil, misalnya, antibiotik, pupuk maupun bakterisida telah diuji akan tetapi tidak menghasilkan hasil yang memuaskan. Perlakuan tanah dengan fumigan (kloropikrin) telah diuji dan dapat mengurangi kejadian penyakit akan tetapi pengendalian ini terlalu mahal untuk dilakukan (Hartman dan Elphinstone 1994, McCarter 2006). Antibiotik juga dapat mengurangi kejadian penyakit akan tetapi antibiotik ini dapat mempengaruhi tingkat resistensi patogen sehingga hanya efektif diawal aplikasi saja. Hal ini terbukti dengan meningkatnya kejadian penyakit layu bakteri pada tomat di Mesir yang diaplikasi dengan antibiotik Streptomycin (EPPO 3 Mei 2011). Selain itu, penggunaan bahan kimia dalam pengendalian juga dapat memberikan ancaman terhadap kualitas lingkungan, menyebabkan fitotoksisitas terhadap tanaman inang, menimbulkan patogen yang mempunyai tingkat resistensi yang tinggi, dan hanya
10 dapat digunakan untuk mengendalikan penyakit yang berada di jaringan luar tanaman (Sige 1993).
Penggunanan tanaman resisten merupakan salah satu pengendalian penyakit layu bakteri yang efektif (Hartman dan Elphinstone 1994). Akan tetapi, menurut Almoneafy et al. (2012), tingkat resistensi dari tanaman resisten tidak dapat menghasilkan hasil yang stabil dan tidak dapat bertahan lama. Selain itu, pengembangan varietas resisten juga memerlukan biaya yang mahal sehingga sulit untuk dilaksanakan (Hartmana dan Elphinstone 1994).
Salah satu pengendalian yang efektif serta ramah lingkungan adalah pengendalian biologi. Pengendalian biologi adalah pengendalian dengan menggunakan agen biokontrol untuk berkompetisi dalam mengkolonisasi inang dan untuk menghasilkan antiobiotik dalam rangka menginduksi tanaman agar tumbuh dengan baik atau untuk menghambat perkembangan patogen (Hartman dan Elphinstone 1994). Menurut Sige (1993), mekanisme pengendalian biologi dapat dilakukan dengan dua cara, yaitu memproduksi bahan anti mikroba (antibiosis) dan persaingan ruang dan nutrisi di tempat yang spesifik pada permukaan tanaman.
Berdasarkan bahan anti mikroba yang dihasilkan, aktivitas anti mikroba dan deteksi secara in vitro, bahan anti mikroba yang dihasilkan oleh agens biokontrol dapat dibedakan menjadi tiga yaitu antibiotik, bakteriosin, dan siderofor (Sige 1993). Antibiotik merupakan senyawa organik metabolit sekunder yang dihasilkan oleh mikroba yang mempunyai berat molekul yang rendah dan bersifat toksin bagi mikroba lain (Lo 1998). Antibiotik dalam konsentrasi rendah sangat berbahaya bagi pertumbuhan dan keefektifan metabolisme patogen. Antibiotik memiliki aktivitas dengan kisaran yang lebih luas dibandingkan dengan bahan anti mikroba lain. Adanya antibiotik ini dapat dilihat pada media yang mengandung protease. Kebanyakan antibiotik resisten terhadap protease (Sige 1993).
Bakteriosin merupakan substansi bakteri yang tidak bereplikasi dan dapat memberikan efek penghambatan terhadap organisme yang dekat kekerabatannya. Bakteriosin dapat membunuh sel patogen dengan cara melekat pada sel patogen. Setiap patogen hanya dapat ditempeli oleh bakteriosin yang tertentu saja karena
11 bakteriosin hanya dapat menempel pada sel patogen yang memiliki reseptor saja. Karena cara kerja yang spesifik inilah maka penggunaan bakteriosin ini dapat digunakan dalam pengendalian biologi (Sige 1993).
Siderofor adalah senyawa yang diproduksi agens biokontrol pada lingkungan yang stress besi dan berperan sebagai agen pengkhelat ion besi yang spesifik dari lingkungan. Siderofor ini dapat menghindarkan ion besi dari patogen sehingga pertumbuhan patogen dapat terhambat (Villegas et al. 2002). Agens biokontrol dapat menghasilkan siderofor bila ditumbuhkan dalam media yang rendah besi (media King’s B). Produksi siderofor dapat dilihat dengan produksi pigmen fluorescens dan demonstrasi aktivitas antagonistik terhadap bakteri lain. Sebagai bahan anti mikroba yang dapat digunakan dalam pengendalian biologi, siderofor dapat diproduksi oleh agens biokontrol dan berperan aktif pada daerah rhizosfer tanaman (Sige 1993).
Pengendalian biologi telah banyak dilakukan untuk mengendalikan penyakit layu bakteri. Agens biokontrol yang biasanya digunakan antara lain adalah R.solanacearum avirulen, Pseudomonas fluorescens, dan Bacillus subtilis.
R. solanacearum avirulen yang memproduksi bakteriosin dapat mengurangi kejadian penyakit layu bakteri tomat di rumah kaca (Hartman dan Elphinstone 1994). Mutan avirulen dari R. solanacearum yang mengkolonisasi akar tanaman tomat dapat mencegah kolonisasi R. solanacearum virulen (Hartman dan Elphinstone 1994). P.fluorescens dan B. subtilis juga merupakan agens antagonis yang dapat mengendalikan penyakit layu bakteri tomat dengan efektif (Trigalet et al. 1994).
Bakteri Endofit
Bakteri endofit adalah bakteri yang hidup di dalam jaringan tanaman (xilem dan floem), daun, akar, buah dan batang. Bakteri ini hidup di dalam tanaman dengan simbiosis yang saling menguntungkan. Bakteri endofit mendapatkan nutrisi dari hasil metabolisme tanaman dan memproteksi tanaman dari hama dan penyakit. Tanaman mendapatkan derivat nutrisi dan senyawa aktif yang diperlukan selama hidupnya. Bakteri endofit yang diperoleh dari bagian
12 dalam tanaman dapat menghasilkan sejumlah senyawa bioaktif spesifik yang sama dengan senyawa bioaktif tanaman (Ryan et al. 2007).
Penggunaan bakteri endofit dalam pengendalian biologi lebih menguntungkan dibandingkan dengan agens biokontrol lainnya. Bakteri endofit hidup di dalam tanaman inang sehingga dapat bertahan seiring dengan pertumbuhan dan perkembangan inang. Pertahanan ini dapat menghasilkan perlindungan yang berkelanjutan terhadap tanaman inang (Trigalet et al. 1994).
Damayanti (2010) melakukan isolasi bakteri endofit dari tanaman tomat yang berasal dari tiga tempat yaitu Bogor, Cipanas, dan Lembang. Dari hasil isolasi diperoleh sebanyak 49 isolat, 17 diisolasi dari tanaman asal Bogor, 18 isolat dari Cipanas, dan 14 isolat dari Lembang. Masing-masing bakteri endofit memiliki karakter yang berbeda satu sama lain. Berdasarkan uji reaksi hipersensitif (HR) diketahui bahwa terdapat sejumlah bakteri endofit yang menimbulkan reaksi negatif pada uji tersebut, seperti BC4, BC10, dan BL10. Isolat dengan kode BC4 memberikan penekanan terhadap perkembangan R. solanacearum sebesar 66,67% secara in vitro. Penekanan ini merupakan penekanan yang terbaik bila dibandingkan dengan isolat bakteri lain.
Berdasarkan hasil identifikasi dengan sekuen 16s rDNA, isolat dengan kode BC4 memiliki kedekatan dengan bakteri Staphylococcus epidermidis
(Nawangsih et al. 2011). Karakter biokimia dan fisiologi dari isolat ini yaitu: 1) karakter biokimia; memiliki reaksi positif terhadap uji katalase, strach, glukosa, manitol, laktosa, maltosa, dan salicin, 2) karakter fisiologi; gram negatif, bentuk batang, tidak berspora, non motil, dapat tumbuh dalam suhu anaerob dan anaerob fakultatif, katalase positif, oksidase positif. Karakter morfologi dari BC4 yaitu: permukaan cembung, tepian rata, bentuk bulat licin, ukuran sedang, dan ciri lain yaitu tidak lengket serta pertumbuhannya cepat pada medium King’s B (Damayanti 2010). Berdasarkan uji in planta yang telah dilakukan oleh Damayanti (2010), S. epidermidis BC4 dapat menekan kejadian penyakit layu bakteri sebanyak 60% tetapi tidak dapat memacu pertumbuhan tanaman. Sedangkan, berdasarkan penelitian yang dilakukan oleh Handini (2011) di lapangan, aplikasi tungggal S. epidermidis BC4 dapat menekan kejadian penyakit sebesar 10% dan tidak dapat memacu pertumbuhan tanaman.
13 Plant Growth Promoting Rhizobacteria
Plant Growth Promoting Rhizobacteria (PGPR) adalah bakteri yang hidup di daerah rhizosfer tanaman dan dapat memacu pertumbuhan tanaman (Khalimi dan Wirya et al. (2010). Menurut Khalimi dan Wirya et al. (2010), mekanisme PGPR dalam memacu pertumbuhan yaitu: (a) mampu menghasilkan atau mengubah konsentrasi fitohormon asam indolasetat (IAA), asam giberalat, sitokinin, dan etilen atau prekursornya (1-aminosiklopropena; ACC diaminase) di dalam tanaman, (b) antagonisme terhadap mikroba fitopatogen melalui produksi siderofor, glukanase, kitinase, selulase, antibiotika, dan sianida, c) pelarut fosfat mineral dan nutrisi lainnya, d) mengatur produksi etilen pada perakaran, e) menurunkan ketoksinan logam berat. Keaktifan PGPR dipengaruhi oleh beberapa faktor diantaranya yaitu: potensi kelembaban, tekanan oksigen, suhu, pH, kandungan lempung, daya larut ion, dan tahap organik tanah (Khalimi dan Wirya
et al. (2010).
Menurut Glick dan Pasternak (1998) keuntungan dari mekanisme PGPR dibedakan menjadi dua yaitu secara langsung dan tidak langsung. Keuntungan secara langsung pada tanaman mencakup mampu memfiksasi nitrogen dan memberikannya pada tanaman; meningkatkan ketersediaan atau menyimpan besi dan fosfor dari tanah, menyediakan mineral-mineral tersebut dalam bentuk yang dapat digunakan oleh tanaman; mensintesis enzim yang dapat mengatur tingkat hormon etilen tanaman; dan mensintesis fitohormon seperti auksin, sitokinin, atau giberelin yang memicu perkembangbiakan sel tanaman. Keuntungan PGPR secara tidak langsung terjadi ketika PGPR dapat mencegah pertumbuhan patogen dalam tanah yang dapat mengganggu pertumbuhan dan perkembangan normal tanaman. PGPR menghasilkan siderofor yang dapat menghambat pertumbuhan patogen (Glick dan Pasternak 1998).
B. subtilis AB89
Isolat B. subtilis AB89 merupakan isolat bakteri koleksi Laboratorium Bakteriologi Tumbuhan, Departemen Proteksi Tanaman, Fakultas Pertanian, IPB. Isolat ini digunakan untuk menghambat perkembangan bakteri patogen R. solanacearum pada tomat. Aplikasi agens biokontrol di lapangan menunjukkan
14 bahwa isolat AB89 mampu menekan perkembangan penyakit layu bakteri.
Bacillus subtilis AB89 positif menghasilkan siderofor setelah diinkubasi selama 3 hari (Nawangsih 2006).
Menurut Nawangsih (2006) B. subtilis AB89 memiliki kelebihan dibandingkan dengan agens biokontrol lain yang digunakan dalam pengujian antara lain yaitu: menghasilkan zone hambatan dengan diameter paling besar, menghasilkan penekanan paling tinggi terhadap keparahan penyakit di lapangan meskipun kemampuan mengkolonisasi perakaran bibit lebih rendah, mampu menginduksi aktifitas peroxidase paling tinggi, serta menghasilkan siderofor dan protease. Enzim peroksidase merupakan salah satu enzim yang berperan dalam proses ketahanan tanaman terhadap patogen (Brimecombe et al. 2001 dalam
Nawangsih 2006).
P. fluorescens RH4003
Isolat P. fluorescens RH4003 merupakan isolat PGPR yang diisolasi oleh Nawangsih (2006) dan merupakan koleksi Laboratorium Bakteriologi Tumbuhan, Departemen Proteksi Tanaman, Fakultas Pertanian, IPB. Isolat ini tidak menghasilkan zona hambatan pada media NA tetapi pada media King’s B dan CPMA –Ca2+ menunjukkan adanya zona hambatan. Luas zona hambatan dipengaruhi oleh jenis media. Media King’s B merupakan media yang memiliki kandungan Fe yang sangat rendah, hal tersebut sangat cocok bagi pembentukan siderofor oleh P. fluorescens. Isolat RH4003 membentuk zona hambatan pada media yang mengandung glukosa tetapi tidak pada media yang mengandung mannitol maupun dextrose. Pengujian di rumah kaca menunjukkan bahwa isolat RH4003 mampu menekan perkembangan penyakit layu bakteri, indeks penekanan oleh isolat RH4003 yaitu sebesar 62%.
Karakter fisiologi isolat P. fluorescens RH4003 yaitu gram negatif, tidak membentuk spora, menghasilkan senyawa floresen pada medium King’s B agar, Levan negatif, reaksi oksidase positif, Arginine dihydrolase positif, tidak menghasilkan reaksi hipersensitif pada tembakau, tidak tumbuh pada 41 0C, tidak mencairkan gelatin, dan pertumbuhannya positif pada L-arabinosa, D-galaktosa
15 serta sorbitol. Produksi asam dari xylose positif, lactose negatif, glukosa positif, maltosa negatif, dan sukrosa positif lemah (Nawangsih 2006).
Kombinasi Agens Biokontrol
Agens biokontrol dapat menekan perkembangan patogen dengan satu atau beberapa mekanisme penghambatan (Lo 1998). Kemampuan suatu agens biokontrol dapat ditingkatkan dengan mengombinasikan dua atau lebih agens biokontrol. Kombinasi ini perlu diperhatikan bahwa masing-masing agens biokontrol tidak saling menghambat (Nawangsih 2006). Persyaratan agar kombinasi dua agens biokontrol atau lebih dapat bekerja secara optimal yaitu: 1) bekerja pada tempat yang berbeda misalnya pada rizosfer atau sisa-sisa bahan organik, 2) memiliki mekanisme pengendalian yang berbeda, misalnya kompetisi dan antibiosis, 3) memerlukan substrat yang berbeda, misalnya lendir tanaman dan bakteri untuk cendawan dan eksudat akar untuk bakteri kelompok pseudomonas, dan 4) kompatibel dengan lingkungan tanah serta perubahan yang terjadi karena peningkatan cara bercocok tanam (Mishra et al. 2011).
Berdasarkan penelitian yang dilakukan oleh Nurbaya et al. (2011), kombinasi isolat NS01+S06+G06 dapat menurunkan tingkat kejadian penyakit layu bakteri pada kentang sebesar 68% bila dibandingkan dengan kontrol. Penurunan tingkat kejadian penyakit ini karena kombinasi agens biokontrol tersebut bersifat sinergis satu sama lain. Selain dapat menurunkan tingkat kejadian penyakit perlakuan kombinasi agens biokontrol juga dapat meningkatkan tingkat produktivitas tanaman dengan menghasilkan jumlah dan berat umbi yang lebih besar bila dibandingkan dengan kontrol.
Kombinasi P. fluorescens dengan Trichoderma harzianum juga pernah diaplikasikan untuk mengendalikan penyakit busuk batang pada kacang polong oleh Mishra et al. (2011). Kombinasi agens biokontrol tersebut menunjukkan bahwa aplikasi kombinasi memberikan penekanan yang lebih tinggi bila dibandingkan dengan aplikasi secara tunggal. Selain itu, aplikasi kombinasi juga lebih konsisten dalam menekan perkembangan penyakit. Hal ini juga sesuai dengan hasil penelitian yang dilakukan oleh Guetsky et al. (2001, 2002). Aplikasi
16 kombinasi antara Pichia guilermondii dengan Bacillus mycoides menunjukkan penekanan terhadap Botrytis cinerea yang lebih baik dibandingkan dengan aplikasi tunggal. Kombinasi kedua agens biokontrol tersebut juga dapat mengurangi hasil pengendalian penyakit yang bervariasi.
Aplikasi kombinasi juga tidak selalu menghasilkan hasil yang lebih bagus bila dibandingkan dengan aplikasi tunggal. Menurut Felde et al. (2006), aplikasi kombinasi juga dapat memberikan efek yang negatif terhadap pengendalian penyakit. Hal ini dapat terjadi karena mekanisme dari masing-masing agens biokontrol tidak secara langsung mempengaruhi metabolisme patogen tetapi juga mempengaruhi mekanisme sesama agens biokontrol. Misalnya, kombinasi
Trichoderma dan Fusarium spp. yang tidak memberikan penekanan yang baik terhadap layu Fusarium pada pisang. Aplikasi kombinasi yang tidak memberikan hasil yang lebih bagus dari aplikasi tunggal dapat disiasati dengan aplikasi rotasi agens biokontrol yang dilakukan secara simultan (Janousek et al. 2009).
17
BAHAN DAN METODE
Tempat dan Waktu
Penelitian dilakukan di Laboratorium Bakteriologi Tumbuhan Departemen Proteksi Tanaman, Fakultas Pertanian, Institut Pertanian Bogor dan di Rumah Kaca, University Farm, Institut Pertanian Bogor pada bulan Oktober 2011 sampai bulan Mei 2012.
Penyiapan Tanaman Uji
Benih yang digunakan dalam pengujian adalah varietas Arthaloka. Varietas ini dipilih karena banyak digunakan oleh petani. Sebelum dilakukan penyemaian, dipilih terlebih dahulu benih yang sehat dan tidak memiliki cacat secara morfologi. Benih yang telah dipilih kemudian ditanam pada nampan berukuran 25 cm x 35 cm. Pada setiap nampan ditanami 15 sampai 20 benih sehingga dibutuhkan masing-masing 10 nampan untuk uji penekanan kejadian penyakit dan uji pemacuan pertumbuhan. Media tanam yang digunakan dalam persemaian adalah tanah steril dan pupuk kandang dengan perbandingan 1:1. Persemaian dilakukan selama 3 minggu dengan dilakukan penyiraman sesuai dengan kebutuhan bibit dan dilihat dari tingkat kelembaban tanah.
Pemeliharaan dan Penyiapan Suspensi Bakteri Endofit dan PGPR
Bakteri endofit dan PGPR yang digunakan dalam penelitian merupakan koleksi Laboratorium Bakteriologi Tumbuhan, Fakultas Pertanian, IPB. Bakteri endofit yang digunakan adalah bakteri endofit dengan kode BC4 dan berdasarkan penelitian Damayanti (2010), isolat dengan kode BC4 adalah isolat yang memberikan penekanan yang paling efektif terhadap kejadian penyakit secara in vitro maupun in planta. Hasil identifikasi berdasarkan sekuen 16 rDNA menunjukkan bahwa BC4 merupakan bakteri Staphylococcus epidermidis
18
Pseudomonas fluorescens RH4003 (P1) dan Bacillus subtilis AB89 (B12). PGPR tersebut merupakan hasil isolasi Nawangsih (2006) dari perakaran tomat.
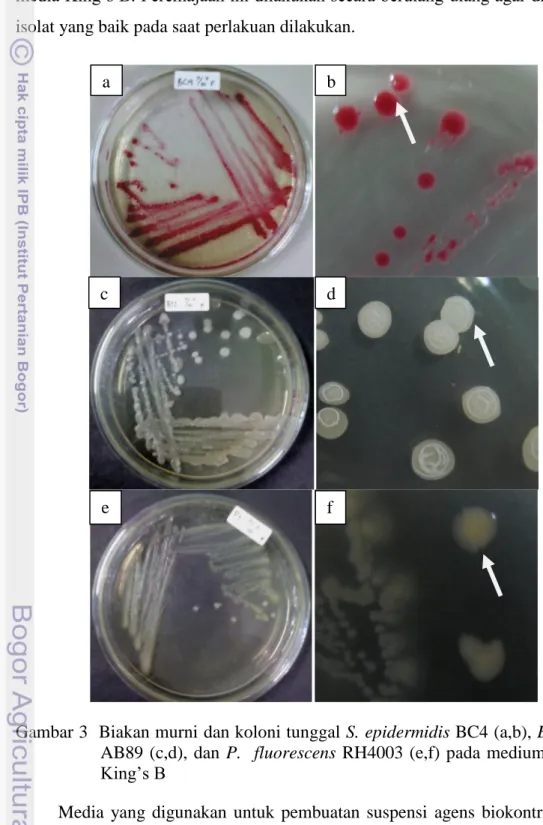
Peremajaan dilakukan dengan metode kuadran pada media Nutrient Agar
(NA). Setalah didapatkan koloni tunggal kemudian digores secara merata pada media King’s B. Peremajaan ini dilakukan secara berulang-ulang agar didapatkan isolat yang baik pada saat perlakuan dilakukan.
Gambar 3 Biakan murni dan koloni tunggal S. epidermidis BC4 (a,b), B. subtilis
AB89 (c,d), dan P. fluorescens RH4003 (e,f) pada medium NA dan King’s B
Media yang digunakan untuk pembuatan suspensi agens biokontrol adalah
Nutrient Broth (NB). Suspensi S.epidermidis BC4, B. subtilis AB89, dan
a b
c d
19
P.fluorescens RH4003 yang digunakan untuk perlakuan memiliki kerapatan 109 sampai 1010 cfu/ml. Proporsi kombinasi bakteri endofit dan PGPR yang digunakan untuk penyiraman tanaman uji ada 6 yaitu 0:0, 0:100, 25:75, 50:50, 75:25, 100:0. Terdapat 2 kombinasi yaitu S. epidermidis BC4 dengan B.subtilis
AB89 dan S. epidermidis BC4 dengan P. fluorescens RH4003.
Pembuatan suspensi dilakukan dengan cara menyiapkan isolat bakteri pada media agar (King’s B). Koloni tunggal bakteri diambil dengan menggunakan jarum ose kemudian digores secara merata pada media King’s B dan diinkubasi selama 24 sampai 48 jam. Setelah koloni bakteri tumbuh, dimasukkan 5 ml air steril ke dalam media King’s B dan di-scrub hingga koloni bakteri pada permukaan media lepas dan larut dalam air steril sehingga membentuk suspensi. Suspensi diambil 1 ml dan dimasukkan ke dalam 250 ml NB serta diinkubasi pada inkubator bergoyang selama 72 jam pada kecepatan 100 rpm. Suspensi yang sudah siap kemudian ditambah dengan air dengan perbandingan 1:9 sehingga untuk 250 ml suspensi bakteri ditambahkan 2250 ml air.
Uji Penekanan Kejadian Penyakit
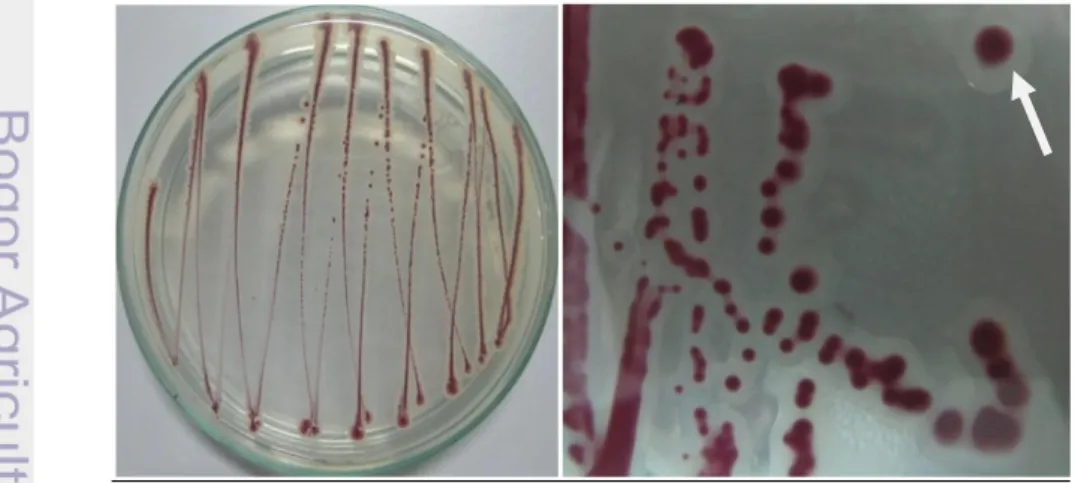
Inokulum patogen yang digunakan dalam penelitian berasal dari tanah pada areal pertanaman tanaman sakit dan dari tanaman tomat yang sakit. Pengecekan tanaman sakit dilakukan dengan cara memotong bagian pangkal batang tanaman sakit kemudian direndam di dalam air. Apabila oose (massa bakteri) keluar dari pangkal batang yang dipotong maka tanaman tomat tersebut terserang oleh R. solanacearum. Oose hasil rendaman pangkal batang dapat digoreskan pada media Tetrazolium Chloride (TZC) dan setelah diinkubasi pada suhu kamar selama 48 jam, koloni tunggal bakteri akan tumbuh. Koloni bakteri yang masih memiliki tingkat virulensi yang tinggi berwarna merah muda dan dikelilingi lendir yang berwarna keputihan seperti pada Gambar 1.
Perbanyakan inokulum patogen dilakukan dengan cara memotong-motong tanaman sakit kemudian ditambahkan dengan air. Penambahan air ini bertujuan agar oose yang ada di dalam tanaman tomat dapat keluar. Setelah itu ditambahkan dengan tanah steril. Tanah campuran tanaman sakit dimasukkan ke dalam pot dan
20 ditanami tomat. Tomat yang layu dipotong-potong, ditambah air, dan dicampur dengan tanah steril lagi dan dilakukan berulang kali hingga didapatkan tanah yang mencukupi untuk infestasi. Perbanyakan dengan cara ini dilakukan untuk menjaga tingkat virulensi R. solanacearum pada saat pengujian karena tingkat virulensi R. solanacearum cepat menurun bila tidak terdapat inang.
Media tanam yang digunakan dalam uji penekanan kejadian penyakit adalah tanah steril, pupuk kandang dan tanah yang telah diinfestasi R. solanacearum. Tanah steril dan pupuk kandang dengan perbandingan 1:1 dicampur secara merata. Polybag yang digunakan dalam uji ini berukuran 30 cm X 30 cm. Isi
polybag dibagi menjadi 3 bagian yaitu bagian bawah diisi dengan campuran tanah steril dan pupuk kandang, bagian tengah diisi dengan tanah yang diinfestasi R. solanacearum dan bagian atas diisi kembali dengan campuran tanah steril dan pupuk kandang.
Setelah media tanam siap, bibit yang telah disiram dengan suspensi kombinasi sehari sebelum pindah tanam, ditanam pada media tersebut. Pada saat pindah tanam dilakukan pula penyiraman dengan suspensi kombinasi. Pemeliharaan dilakukan dengan menyiram tanaman 2 hari sekali dengan air. Namun, bila tanah masih lembab, maka tanaman tidak disiram. Pemeliharaan juga dilakukan dengan memasang ajir pada waktu tanaman tomat berumur 2 minggu setelah pindah tanam. Jumlah perlakuan pada uji ini adalah 10 perlakuan dengan 5 tanaman per perlakuan dan ditanam pada 3 blok yang berbeda sehingga didapatkan 50 tanaman per blok.
Gambar 4 Biakan murni dan koloni tunggal R. solanacearum pada medium TZC, isolat yang virulen adalah isolat yang bagian tengah merah muda dikelilingi lendir berwarna putih (tanda panah).
21 Tanaman uji disiram dengan kombinasi PGPR dan bakteri endofit dua kali yaitu sehari sebelum pindah tanam dan dihari saat pindah tanam. Untuk penyiraman bibit sebelum maupun setelah pindah tanam diperlukan volume kombinasi 50 ml. Misal untuk proporsi kombinasi 25:75 maka disiapkan 12.5 ml bakteri endofit dan 37.5 ml PGPR. Untuk perbandingan 0:0 (kontrol) kombinasi hanya berisi 50 ml air untuk penyiraman bibit dan 50 ml air untuk penyiraman bibit setelah pindah tanam. Penyiraman suspensi bakteri sebelum pindah tanam diharapkan dapat memberi kesempatan bakteri endofit memasuki jaringan tanaman (bibit) sebelum dilakukan pindah tanam. Penyiraman saat pindah tanam dilakukan untuk menambah jumlah PGPR dan bakteri endofit dalam tanaman uji karena pada saat penyiraman sebelum pindah tanam PGPR dan bakteri endofit belum mengkolonisasi akar tanaman uji dengan baik (Nawangsih 2006).
Tabel 1 Kode perlakuan dan proporsi suspensi bakteri dalam perlakuan pada uji penekanan penyakit
Kode perlakuan Proporsi suspensi bakteri dalam perlakuan (%)
S. epidermidis B. subtilis P. fluorescens
Kontrol 0 0 0 BC0P100a 0 0 100 BC25P75 25 0 75 BC50P50 50 0 50 BC75P25 75 0 25 BC100P0 100 0 0 BC0B100 0 100 0 BC25B75 25 75 0 BC50B50 50 50 0 BC75B25 75 25 0
a Kode isolat bakteri: P= Pseudomonas fluorescens RH4003, B= Bacillus subtilis AB89, BC=
Staphylococcus epidermidis.
Pengamatan terhadap masa inkubasi penyakit dilakukan dan dihitung mulai bibit ditanam sampai munculnya gejala pertama. Setelah itu, dilakukan pengamatan kejadian penyakit (KP) setiap minggunya. Kejadian penyakit dapat dihitung dengan rumus (Cooke 1998):
Keterangan: KP = Kejadian penyakit
n = jumlah tanaman yang terserang patogen N = jumlah tanaman yang diamati
22 Setelah kejadian penyakit diketahui kemudian dihitung pula nilai AUDPC (Area Under Disease Progress Curve). AUDPC adalah total tingkat kejadian penyakit pada perlakuan dari minggu pertama pengamatan sampai minggu terakhir pengamatan. AUPDC dapat dihitung dengan rumus yang dinyatakan oleh Van der Plank (1963 dalam Cooke 1998) sebagai berikut:
Keterangan: y = persentase kejadian penyakit t = hari
Nilai AUDPC yang telah diketahui kemudian digunakan untuk menghitung indeks penekanan penyakit. Indeks penekenan penyakit adalah suatu angka yang dapat menyatakan tingkat keefektifan pengendalian suatu agens biokontrol terhadap patogen. Indeks penekanan penyakit dapat dihitung dengan rumus:
Keterangan: DIc = AUDPC pada kontrol
DIb = AUDPC pada perlakuan agens biokontrol
Agens biokontrol yang digunakan dalam penelitian merupakan dua agens biokontrol yang dikokmbinasikan dengan berbagai proporsi. Untuk mengetahui tingkat sinergisme antara dua agens biokontrol tersebut digunakan rumus Abbott’s (Guetsky et al. 2002), yaitu:
( ) ( ) dan ( ) ( ) Keterangan: SF = Synergy Factor
a = keefektifan pengendalian oleh agens biokontrol I b = keefektifan pengendalian oleh agens biokontrol II E(exp) = keefektifan pengendalian dugaan oleh campuran agens
biokontrol
E(obs) = keefektifan pengendalian oleh campuran berdasarkan
23 Nilai SF yang telah diketahui akan dapat menunjukkan hubungan dua agens biokontrol dalam tanaman. Hubungan interaksi kedua agens biokontrol dapat ditentukan dengan ketentuan bila SF = 1 maka interaksi antar agens biokontrol bersifat additif, bila SF<1 maka interaksi antar agens biokontrol bersifat antagonis, bila SF>1 maka interaksi antar agens biokontrol bersifat sinergis (Guetsky et al. 2002).
Uji Pemacuan Pertumbuhan
Media tanam yang digunakan adalah tanah steril dan pupuk kandang dengan perbandingan 1:1. Setelah media tanam steril siap, media tanam dimasukkan ke dalam polybag dengan ukuran 30 cm 30 cm dan kemudian ditanami bibit tomat yang telah disiram dengan suspensi kombinasi bakteri endofit dan PGPR sehari sebelum pindah tanam. Kemudian tanaman disiram kembali dengan kombinasi yang sama saat pindah tanam. Pemeliharaan dilakukan dengan menyiram tanaman 2 hari sekali. Namun, bila tanah masih lembab, maka tanaman tidak disiram. Pemeliharaan juga dilakukan dengan memasang ajir setelah tanaman tomat berumur 2 minggu setelah pindah tanam.
Terdapat 10 perlakuan pada uji ini dan jumlah tanaman yang digunakan adalah 5 tanaman per perlakuan dengan 3 blok. Sehingga terdapat 50 tanaman pada 3 blok. Perlakuan yang diberikan sama dengan perlakuan pada uji penekanan penyakit (Tabel 1). Sama halnya dengan uji penekanan kejadian penyakit, pada uji pemacuan pertumbuhan juga dilakukan penyiraman kombinasi bakteri endofit dan PGPR sebanyak dua kali. Penyiraman ini dilakukan sesuai dengan perlakuan masing-masing tanaman uji.
Pengamatan terhadap vigor tanaman dilakukan dengan mengukur tinggi tanaman dan bobot kering tanaman. Pengamatan terhadap tinggi tanaman dilakukan sampai tanaman berumur 42 hst setiap dua hari sekali. Bobot kering tanaman dihitung pada saat tanaman berumur 42 hst, kemudian tanaman dijemur selama 2 minggu dan dioven selama 24 jam. Pengeringan ini dilakukan agar tanaman tomat benar-benar kering dan didapatkan bobot kering yang konstan.
24 Data tinggi tanaman yang diperoleh kemudian digunakan dalam penghitungan nilai Area Under Height of Plant Growth Curve (AUHPGC). AUHPGC adalah total laju pertumbuhan tanaman. Nilai AUHPGC dapat dihitung menggunakan rumus yang dinyatakan oleh Van der Plank (1963 dalam Cooke 1998) sebagai berikut:
Keterangan: y = laju pertambahan tinggi tanaman t = hari
Rancangan Percobaan dan Analisis Data
Penelitian dilakukan dengan melakukan 2 uji yaitu uji pemacu pertumbuhan dan uji penekanan kejadian penyakit dengan rancangan percobaan yang sama yaitu Rancangan Acak Kelompok (RAK). Data yang diperoleh akan dianalisis menggunakan analisis ragam (anova) dengan menggunakan program
Statistical Analysis System (SAS) versi 9.1 dan dilanjutkan dengan uji Duncan dengan taraf 5%.
HASIL DAN PEMBAHASAN
Pengaruh Kombinasi Agens Biokontrol terhadap Kejadian Penyakit Layu Bakteri
Kejadian penyakit adalah angka yang menunjukkan jumlah tanaman sakit dibandingkan dengan jumlah tanaman yang diamati dalam suatu petak lahan. Pada penelitian ini, kejadian penyakit layu bakteri diamati selama 7 minggu. Pengamatan terhadap kejadian penyakit dilakukan dua hari sekali meskipun data yang disajikan per minggu. Secara umum, tingkat kejadian penyakit layu bakteri pada penelitian ini adalah tinggi yaitu sebesar 29.78%. Hal ini terjadi karena pemeliharaan R. solanacearum yang telah dilakukan dengan benar sehingga tingkat virulensi R. solanacearum masih tinggi. Hal ini jauh berbeda dengan penelitian yang dilakukan oleh Handini (2011). Pada penelitian tersebut, tingkat kejadian penyakit layu bakteri yang juga dilakukan di dalam rumah kaca rendah.
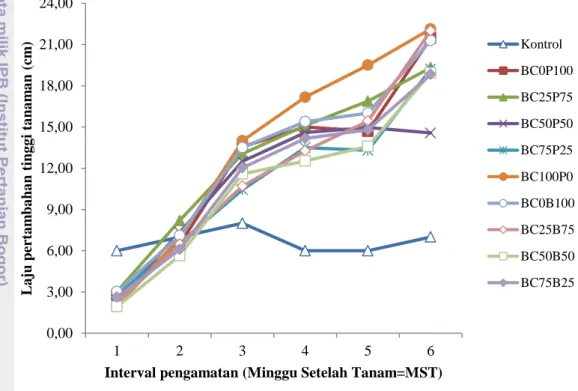
Pada minggu pertama terdapat empat perlakuan yang telah menunjukkan kejadian penyakit layu bakteri yaitu perlakuan BC25B75, BC75B25, BC50P50 dan BC75P25 dengan tingkat kejadian penyakit tertinggi pada perlakuan BC0P100 sebesar 13.33±11.55%. Berdasarkan analisis ragam (α=5%), antar perlakuan tidak berpengaruh nyata terhadap tingkat kejadian penyakit layu bakteri. Hal yang sama juga terjadi pada minggu ke-2 pengamatan. Pada minggu ke-3 pengamatan, antar perlakuan terjadi perbedaan yang nyata terhadap tingkat kejadian penyakit pada tanaman. Tingkat kejadian penyakit tertinggi terjadi pada tanaman dengan perlakuan BC25P75 yaitu sebesar 33.33±23.79% sedangkan tingkat kejadian penyakit terendah terjadi pada tanaman dengan perlakuan BC100P0 yaitu sebesar 0.00±0.00%.
Pada minggu ke-4 dan ke-5 pengamatan, berdasarkan analisis ragam, antar perlakuan tidak berpengaruh nyata terhadap tingkat kejadian penyakit. Tingkat kejadian penyakit tertinggi sebesar 66.67±11.55% terjadi pada perlakuan BC75B25 sedangkan tingkat kejadian penyakit terendah sebesar 20.00±0.00% terjadi pada perlakuan kontrol. Hasil yang berbeda ditunjukkan pada minggu ke-6 pengamatan. Berdasarkan analisis ragam yang telah dilakukan perlakuan memberikan pengaruh yang berbeda terhadap tingkat kejadian penyakit di rumah
26 kaca. Tingkat kejadian penyakit tertinggi terjadi pada tanaman dengan perlakuan BC75B25 yaitu sebesar 86.67±11.55% sedangkan tingkat kejadian penyakit terendah terjadi pada tanaman dengan perlakuan BC0P100 yaitu sebesar 33.33±23.79%. Tingkat kejadian penyakit pada minggu ke-6 ini sama hasilnya dengan tingkat kejadian penyakit pada minggu ke-3. Tingkat kejadian penyakit pada minggu ke-7, sebenarnya tidak jauh berbeda dengan tingkat kejadian penyakit pada minggu ke-6. Akan tetapi, berdasarkan hasil analisis ragam, tingkat kejadian penyakit pada perlakuan BC50B50, BC100P0, BC0P100, BC25P75, BC50P50,dan kontrol adalah tidak berbeda nyata berdasarkan uji Duncan (α=5%).
Gambar 5 Grafik kejadian penyakit layu bakteri pada berbagai perlakuan bakteri endofit dan PGPR dari minggu ke-1 sampai minggu ke-7
Setelah pengamatan terhadap kejadian penyakit selesai dilakukan kemudian dilakukan perhitungan terhadap nilai AUDPC. Sesuai dengan tingkat kejadian penyakit, nilai AUDPC tertinggi juga terjadi pada tanaman dengan perlakuan kombinasi S. epidermidis BC4 75% dan B. subtilis AB89 25% (BC75B25). Sedangkan nilai AUDPC terendah terjadi pada tanaman dengan perlakuan
P.fluorescens RH4003 yang diaplikasikan secara tunggal. Hal ini menunjukkan bahwa aplikasi P. fluorescens RH4003 secara tunggal dapat menekan tingkat kejadian penyakit layu bakteri lebih baik dibandingkan dengan perlakuan
0,00 20,00 40,00 60,00 80,00 100,00 120,00 1 2 3 4 5 6 7 K ej a d ia n pen y a k it la y u b a k teri (%)
Interval pengamatan (Minggu Setelah Tanam=MST)
Kontrol BC100P0 BC0P100 BC25P75 BC50P50 BC75P25 BC0B100 BC25B75 BC50B50 BC75B25
27 kombinasi. Nilai AUDPC perlakuan P. fluorescens RH4003 secara tunggal ini juga lebih rendah dari kontrol.
Berdasarkan uji lanjut Duncan (α=5%), perlakuan kombinasi antara
S.epidermidis BC4 dengan B. subtilis AB89 menghasilkan tingkat kejadian penyakit yang lebih besar bila dibandingkan dengan kontrol, kecuali pada perlakuan kombinasi dengan proporsi 50:50. Hal ini menunjukkan bahwa kedua agens biokontrol yang digunakan tidak bersifat sinergis, bahkan meningkatkan tingkat kejadian penyakit. Perlakuan kombinasi antara S. epidermidis BC4 dengan
P.fluorescens RH4003 juga menghasilkan tingkat kejadian penyakit yang tidak berbeda nyata. Perlakuan kombinasi antara bakteri endofit dan PGPR dengan proporsi 50:50 menghasilkan tingkat kejadian penyakit yang lebih rendah bila dibandingkan dengan kontrol. Hal ini tidak sesuai dengan penelitian Handini (2011). Pada penelitian tersebut, kombinasi agens biokontrol dengan proporsi 50:50 tidak menunjukkan tingkat kejadian penyakit yang lebih rendah bila dibandingkan dengan kontrol.
Tabel 2 Nilai Area Under Disease Progress Curve (AUDPC) pada berbagai perlakuan bakteri endofit dan PGPR
Perlakuan AUDPC (%hari)a Perlakuan AUDPC(%hari) Kontrol 340± 36.64 ab BC100P0 280±34.64 b BC0P100 220±124.89 b BC0B100 400±124.89 ab BC25P75 340±227.15 ab BC25B75 380±173.21 ab BC50P50 300±103.92 b BC50B50 280±173.21 b BC75P25 380±124.89 ab BC75B25 560± 36.64 a a
Angka yang diikuti huruf yang sama pada kolom yang sama tidak berbeda nyata berdasarkan uji Duncan pada taraf 5%.
Handini (2011) menyatakan bahwa perlakuan kombinasi antara PGPR dan bakteri endofit maupun perlakuan tunggal PGPR dan bakteri endofit tidak dapat menghambat kejadian penyakit layu bakteri. Meskipun begitu, perlakuan tersebut tidak memberikan pengaruh yang negatif terhadap tanaman karena perkembangan dan pertumbuhan tanaman tidak terganggu. Berdasarkan hasil tersebut, terlihat bahwa pengaruh bakteri S. epidermidis BC4 dan P. fluorescens RH4003 serta
B.subtilis AB89 masih belum konsisten. Untuk itu masih perlu dilakukan pengujian-pengujian lebih lanjut terutama di lapangan.