42
UJI SITOTOKSIK DAN AKTIVITAS ANTIBAKTERI EKSTRAK
DAUN PANDAN LAUT (Pandanus Odorifer) TERHADAP BAKTERI
Staphylococcus aureus
Shinta Puspasari*
1, Nurhamidah
2, Hermansyah Amir
31,2,3
Program Studi Pendidikan Kimia Jurusan PMIPA FKIP Universitas Bengkulu
*E-mail : shintapuspa59 @gmail.com
ABSTRACT
This study aims to determine the activity of marine pandanus extract(Pandanus odorifer) as cytotoxic and antibacterial to Staphylococcus aureus bacteria. This research begins with phytochemical test conducted to find out the secondary metabolite compounds contained in the leaves of P. odorifer. Cytotoxic testing was performed using BSLT method. An antibacterial test was performed against the activity in inhibiting the growth of S. aureus bacteria using a modified disc diffusion method. The results of phytochemical tests showed that ethanol extract of pandanus leaves contain saponin, flavonoids, tannin and terpenoid compounds. The results of cytotoxic test of sea pandan have a very strong toxic level with LC50 value of 4.3557 ppm.The result of measurement of the highest inhibiting zone diameter was obtained at the concentration of 5x104 ppm is 6 mm with the power of inhibitory that is medium. Based on the results of this study can be concluded that the leaves of sea pandan are cytotoxic and have activity as antibacterial.
Keywords: Antibacterial, Cytotoxic, PandanLaut Leaf, Pandanus odorifer, Staphylococcus aureus
ABSTRAK
Penelitian ini bertujuan untuk mengetahui aktivitas ekstrak pandan laut (Pandanus odorifer) sebagai sitotoksik dan antibakteri terhadap bakteri Staphylococcus aureus. Penelitian ini diawali dengan uji fitokimia yang dilakukan untuk mengetahui senyawa metabolit sekunder yang terdapat di dalam daun P. odorifer. Pengujian sitotoksik dilakukan menggunakan metode BSLT. Uji antibakteri dilakukan terhadap aktivitas dalam menghambat pertumbuhan bakteri S. aureus menggunakan metode difusi cakram yang dimodifikasi. Hasil uji fitokimia menunjukkan ekstrak etanol daun pandan laut mengandung senyawa saponin, flavonoid, tanin dan terpenoid. Hasil uji sitotoksik pandan laut memiliki tingkat toksik yang sangat kuat dengan nilai LC50 yaitu 4,3557 ppm. Hasil pengukuran diameter zona hambat tertinggi diperoleh pada konsentrasi 5x104 ppm yaitu 6 mm dengan kekuatan daya hambat yaitu sedang. Berdasarkan hasil penelitian ini dapat disimpulkan bahwa daun pandan laut bersifat sitotoksik dan memiliki aktivitas sebagai antibakteri.
Kata Kunci : Antibakteri, Daun Pandan Laut, Pandanus odorifer, Sitotoksik, Staphylococcus aureus
PENDAHULUAN
Infeksi merupakan penyebab paling utama timbulnya suatu penyakit yang dapat berujung pada kematian, terutama pada negara-negara berkembang seperti halnya Indonesia. Penyakit infeksi merupakan suatu penyakit yang disebabkan karena adanya mikroba patogen salah satunya adalah bakteri [1].Salah satu contoh bakteri Gram positif yang bersifat patogen ialah Staphylococcus aureus [2], yang merupakan bakteri yang hidup dipermukaan tubuh individu sehat tanpa membahayakan, terutama sekitar hidung, mulut, alat kelamin dan rectum [3]. Ketika kulit kita mengalami luka atau tusukan, bakteri ini akan masuk melalui luka dan dapat menyebabkan terjadinya infeksi kulit [4].
Saat ini pengobatan untuk mengatasi infeksi yang disebabkan oleh bakteri dilakukan secara medis menggunakan antibiotik [5] Tetrasiklin merupakan antibiotik sintesis yang berspektrum luas artinya dapat menghambat bakteri gram positif maupun gram negatif, dan sering digunakan untuk menanggulangi penyakit-penyakit infeksi kulit [6]. Penggunaan
antibiotik yang tidak benar akan membuat bakteri menjadi bersifat resisten dan tetap memperbanyak diri dalam inangnya [7].
Pemanfaatan tanaman alami yang kurang termanfaatkan diharapkan berpotensi sebagai antibiotik alami [8]. Produk bahan alam misalnya metabolit sekunder, baik senyawa murni maupun dalam bentuk ekstrak, memiliki peluang untuk dikembangkan dalam dunia pengobatan [9], karena memiliki efek terapis yang signifikan terhadap bakteri, jamur, maupun virus yang bersifat patogen terhadap hewan dan manusia [10]. Agar pengobatan secara tradisional dapat di pertanggungjawabkan maka diperlukan penelitian ilmiah seperti penelitian di bidang farmakologi, toksikologi, identifikasi, dan isolasi zat kimia aktif yang terdapat dalam tumbuhan.
Pandanus adalah kelompok tumbuhan yang anggotanya memiliki manfaat yang besar dalam kehidupan masyarakat, antara lain digunakan sebagai bahan makanan, pewangi, zat pewarna, bahan anyaman, atap, tikar, obat-obatan, tanaman hias dan lain-lain [11]. Beberapa penelitian terhadap
43 genus Pandanus telah dilakukan diantaranya yaitu
potensi biologis Pandanus tectorius dilaporkan sebagai antiradang, antioksidan, antikanker, antitumor, antivirus, antidiabetes dan aktivitas penurun kolesterol [12]. Namun penelitian mengenai kandungan senyawa kimia daun Pandan Laut spesies Pandanus Odorifer yang di duga dapat digunakan sebagai sitotoksik dan antibakteri belum dilakukan. .
Pandan Laut (Pandanus Odorifer) merupakan tumbuhan liar terutama dengan vegetasi di habitat pesisir seminatural seluruh tropis dan subtropis Pasifik dimana ia dapat menahan kekeringan, dan angin kencang [13]. Pandan laut tumbuh di daerah pesisir terutama daerah pesisir Pantai Bengkulu, namun masyarakat setempat masih banyak yang belum mengetahui manfaat dari tumbuhan ini.
Peneliti tertarik untuk melakukan penelitian mengenai uji fitokimia ekstrak daun P.odorifer, serta melakukan uji sitotoksik terhadap larva Artemia Salina Leach dengan menggunakan metode Brine Shrimp Lethality Test (BSLT) dan uji antibakteri ekstrak daun pandan laut terhadap pertumbuhan bakteri Staphylococcus aeurus.
METODE PENELITIAN
Sampel yang digunakan yaitu daun Pandanus. Odorifer yang diambil di Sungai Suci Kabupaten Bengkulu Tengah, daun dibersihkan dan dipotong kecil dan dikeringkan dengan diangin-anginkan selama beberapa hari tanpa sinar matahari langsung. Setelah kering, sampel dihaluskan dengan blender karena akan memperluas permukaan sampel, sehingga kontak antara sampel dan pelarut semakin besar dan senyawa yang terkandung didalam sampel dapat terlarut sebanyak mungkin [14].
Untuk mengetahui senyawa metabolit sekunder yang terkandung didalam daun P. odorifer dilakukan uji fitokimia. Uji positif alkaloid dengan menambah pereaksi Mayer akan terbentuk endapan [15]. Uji terpenoid dan steroid menggunakan plat KLT diaktivasi pada oven suhu >100C selama ± 1 jam, kemudian plat dipotong menggunakan cutter sepanjang 5 cm dan diberi tanda atas dan tanda bawah dengan jarak masing-masing 1 cm. Sampel yang akan diuji di totolkan pada plat KLT yang dielusikan dengan fase gerak n-heksana : etil asetat dengan perbandingan 6 :4, dan diberi asam sulfat setelah kering. Kemudian dilakukan pemanasan dengan oven. Uji positif terpenoid dengan terbentuknya warna pink atau merah muda, sedangkan untuk uji steroid akan terbentuk warna ungu [16].
Uji flavanoid dilakukan dengan mereaksikan sampel dengan 5 ml etanol dan dipanaskan 5 menit, diberi beberapa tetes HCl pekat dan ditambahkan 0,2 g bubuk Mg. Hasil positif ditunjukkan dengan timbulnya
warna merah magenta dalam waktu 3 menit [17]. Uji saponin dilakukan dengan melarukan sampel ke dalam 10 mL aquades yang mendidih, kemudian disaring. Filtrat dikocok selama 15 menit. Hasil positif ditunjukkan dengan terbentuknya buih yang stabil [18]. Uji tanin dilakukan dengan melarutkan sampel dalam 10 mL aquades, ditambahkan beberapa tetes larutan Besi (III) klorida 1%. Warna biru tua atau hitam kehijauan menunjukkan adanya tanin [19].
Maserasi dilakukan dengan melarutkan daun pandan laut sebanyak 530 gramkedalam pelarut etanol 7 L, dibiarkan selama 3x24 jam sambil sesekali diaduk. Hasil filtrat yang telah diperoleh dikumpulkan dan dipekatkan dengan menggunakan rotary evaporator pada suhu 40C sehingga diperoleh ekstrak kental .
Pembuatan konsentrasi ekstrak yang efektif untuk membunuh larva Artemia salina Leach. Ekstrak kental etanol daun pandan laut ditimbang 0,1 g daun, dilarutkan dengan etanol 10 mL sehingga diperoleh kosentrasi larutan induk 1x104 ppm dari daun pandan laut. Kemudian dari larutan induk dilakukan pengenceran untuk ekstrak yang akan diuji dalam konsentrasi 10 , 100 dan 1000 ppm.
Penetasan Telur Artenia Salina Leach dilakukan di dalam aquarium yang dibagi menjadi dua bagian yaitu bagian gelap dan terang. Pada bagian terang diberi aerasi dan penerangan dengan cahaya lampu pijar 5 watt untuk menghangatkan suhu dalam penetasan agar merangsang proses penetasan. Pada bagian gelap yang telah dilapisi lakban dimasukkan air laut hingga menutupi lubang kaca kemudian dimasukkan telur udang dan biarkan selama 2x24 jam sampai menetas menjadi benur (nauplius) yang matang dan siap digunakan dalam percobaan. Telur akan menetas dalam 18-48 jam. Setelah berumur 48 jam larva udang siap dijadikan hewan uji [20].
Uji aktivitas sitotoksik dilakukan dengan metode BSLT menggunakan larva udang Artemia salina Leach. Setelah telur menetas disiapkan larutan uji dengan konsentrasi 10 , 100 dan 1000 ppm yang dilakukan pengulangan sebanyak 3 kali.
Diambil 5 ml masing-masing konsentrasi dimasukkan kedalam botol vial diuapkan hingga kering dan ditambahkan DMSO 1% sebanyak 2-3 tetes dan air laut 1ml. Penambahan DMSO dilakukan untuk membantu melarutkan sampel di botol vial yang sudah kering. Setelah larut dimasukkan 10 ekor larva udang Artemia salina L. dan ditambahkan air laut sampai volume 5 mL. Vial-vial diletakkan dibawah lampu pijar selama 24 jam dan dihitung jumlah larva yang mati, hasilnya dianalisis untuk menentukan nilai LC50. Persen larva udang yang mati dihitung menurut persamaan:
44 Harga LC50 ditentukan dengan kurva persen
larva yang mati terhadap konsentrasi ekstrak. Harga LC50 didefinisikan sebagai konsentrasi ekstrak yang dapat mengakibatkan 50% larva udang mati [21].
Setelah diperoleh presentase kematian, maka dapat di cari nilai probit dari tiap kelompok hewan uji melalui tabel probit. Nilai LC50 dapat dihitung dengan persamaan garis lurus tersebut dengan memasukkan nilai 5 (probit 50% kematian hewan uji) sebagai y sehingga dihasilkan x sebagai nilai log konsentrasi. Antilog dari nilai x tersebut merupakan nilai LC50[22].
Uji antibakteri dilakukan sterilasasi alat dalam oven pada suhu 170oC selama ± 2 jam, jarum ose dan pinset dibakar dengan pembakaran diatas api langsung dan media disterilkan dalam autoklaf pada suhu 121oC selama 15 menit. Media NA dibuat dari 1,68 gram NA dilarutkan 60 mL aquades kemudian diaduk hingga homogen (warna larutan jernih) dan didiamkan hingga mengental NB dibuat dengan cara melarutkan 5 gram bubuk media NB dalam 250 mL. Larutan media dipanaskan sampai bubuk NB larut dan homogen, dan dimasukkan dalam erlenmeyer, disterilisasi menggunakan autoklaf selama 15 menit pada tekanan 1 atm, suhu 121°C [23].
Bakteri yang digunakan dalam penelitian ini adalah Staphylococcus aureus. Mikroba uji dari biakan diinokulasi sebanyak satu ke dalam medium 100 mL NB dan inkubasi pada suhu 37°C selama 24 jam. Peremajaan dilakukan dalam kondisi steril didalam Laminar Air Flow (LAF)[24].
Larutan uji dibuat dengan melarutkan ekstrak kasar etanol daun pandan laut sebanyak 0,5 g dengan aquades 10 mL sehingga diperoleh konsentrasi larutan induk 5x104 ppm. Kemudian dari larutan induk dilakukan pengenceran untuk membuat larutan yang akan diuji dengan berbagai konsentrasi yaitu 5 , 50, 500 dan 5000ppm.Tetrasiklin sebagai kontrol positif dibuat dengan cara ditimbang sebanyak 0,1 gram Tetrasiklin tablet, kemudian dilarutkan ke dalam aquades sebanyak 10 ml. Kontrol negatif yang digunakan yaitu aquades.
Penentuan Aktivitas Antibakteri Daun
P.odorifer dengan metode difusi cakram yang
dimodifikasi dengan menggunakan kapas dari
cotton bud. Kapas ditanam pada media padat
sebanyak 3 titik dengan diameter 6 dan 7 mm,
setiap titik merupakan pengulangan. Selanjutnya
ekstrak etanol sampel dengan berbagai konsentrasi
(yaitu 5 , 50, 500 dan 5000, 50.000
ppm) dan
kontrol positif, di teteskan pada kapas yang telah
ditanam pada sampel uji sebanyak 3 tetes dengan
pipet mikro pada tiap-tiap titik. Kemudian cawan
petri diinkubasi dalam inkubator pada suhu 37
oC
selama 2x24 jam. Setelah itu, dilakukan
pengamatan dan pengukuran zona hambat, yaitu
daerah jernih di sekitar kapas [25].
Pengamatan dilakukan setelah 2x24 jam masa inkubasi. Daerah bening merupakan petunjuk kepekaan bakteri terhadap antibiotik atau bahan antibakteri lainnya yang digunakan sebagai bahan uji yang dinyatakan dengan lebar diameter zona hambat [26]. Diameter zona hambat diukur dalam satuan milimeter (mm) menggunakan mistar berskala dengan cara diameter ruhan dikurangi diameter kapas. Diameter zona hambat yang diperoleh dikategorikan kekuatan daya anti bakterinya berdasarkan penggolongan [27], dapat dilihat pada tabel 1 :
Tabel 1. Kategori diameter zona hambat
Zona hambat lemah : < 5 mm Zona hambat sedang : 5-10 mm Zona hambat kuat : 10-20 mm Zona hambat sangat kuat : > 20 mm
HASIL DAN PEMBAHASAN
Sampel daun P.odorifer diambil di Sungai Suci Kabupaten Bengkulu Tengah (343”10” LS dan 10214”08” BT) sebanyak 3 kg, Setelah dikeringkan didapat sampel kering sebanyak 1,7 kg sehingga kadar air yang terdapat di dalam daun pandan laut adalah sebesar 43,33%.
Hasil maserasi dengan etanol 96 %, dari 530 g serbuk daun , diperoleh ekstrak sebesar 7 L dan kemudian dipekatkan dengan menggunakan rotary evaporator pada suhu 40 ˚C dan diperoleh ekstrak kental sebanyak 25 g, sehingga diperoleh rendemen sebesar 4,71 %.
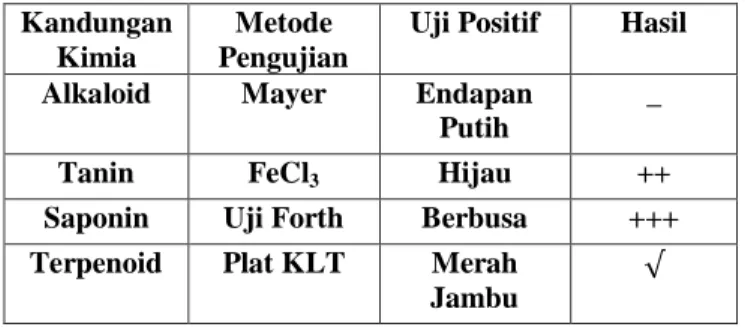
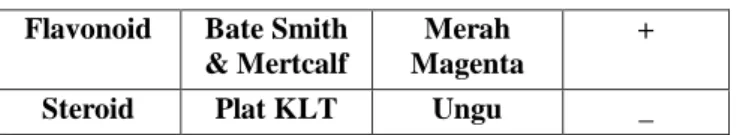
Hasil uji fitokimia yang telah dilakukan pada ekstrak daun P.odorifer menunjukkan hasil positif pada uji flavonoid, tanin, saponin, dan terpenoid yang bisa dilihat pada tabel 2. dibawah ini.
Tabel 2.Hasil Skrinning Fitokimia Daun Pandan Laut (Pandanus odorifer).
Kandungan Kimia
Metode Pengujian
Uji Positif Hasil Alkaloid Mayer Endapan
Putih
_ Tanin FeCl3 Hijau ++
Saponin Uji Forth Berbusa +++ Terpenoid Plat KLT Merah
Jambu
45 Flavonoid Bate Smith
& Mertcalf
Merah Magenta
+ Steroid Plat KLT Ungu _ Keterangan : (+) = sangat sedikit, (++)= sedikit, (+++)= sedang, (++++) = banyak
Senyawa alkaloid tidak terdeteksi (-) pada proses pengujian fitokimia, karena pada uji pereaksi Mayer tidak menunjukkan adanya kekeruhan atau endapan putih. Alkaloid mengandung atom nitrogen dimana atom ini memiliki pasangan elektron bebas yang dapat membentuk ikatan kovalen koordinasi dengan ion logam, reaksi yang terjadi saat menggunakan pereaksi Mayer sehingga terbentuk endapan putih yaitu ion logam K+ akan membentuk ikatan kovalen dengan atom nitrogen sehingga dapat membentuk senyawa yang kompleks [28].
Pada uji tanin diperoleh hasil positif namun sedikit, adanya tanin akan mengendapkan protein pada gelatin. Tanin bereaksi dengan gelatin membentuk kopolimer mantap yang tidak larut dalam air. Hasil uji tanin dari sampel P.odorifer dengan pereaksi FeCl3 1 % menunjukkan warna larutan menjadi cokelat kehijauan. Hal ini terjadi karena adanya reaksi reduksi. Tanin merupakan golongan senyawa polifenol, polifenol mampu mereduksi besi (III) menjadi besi (II). Hal ini juga merupakan cara klasik untuk mendeteksi senyawa fenol yang akan menimbulkan warna hijau, merah, ungu, biru atau hitam [29].
Uji fitokimia selanjutnya yaitu saponin yang menunjukkan bahwa P.odorifer positif mengandung saponin dengan kategori sedang. Saponin bersifat polar sehingga dapat larut dalam pelarut seperti air dan saponin juga dapat bersifat non polar karena memiliki gugus hidrofob yaitu aglikon (sapogenin)). Timbulnya busa pada uji Forth menunjukkan adanya glikosida yang mempunyai kemampuan membentuk buih dalam air yang terhidrolisis menjadi glukosa dan senyawa lainnya [30].
Untuk uji fitokimia senyawa terpenoid dan steroid, menggunakan analisis KLT pada ekstrak. Pada pengujian ini warna yang terlihat yaitu hanya warna pink atau merah muda, ini menunjukan adanya senyawa terpenoid. Pada uji flavonoid terjadi perubahan warna menjadi coklat orange yang menunjukkan sangat sedikitnya kandungan flavonoid pada pandan laut ini. Flavonoid bereaksi dengan serbuk Mg dan HCl membentuk warna merah atau jingga akibat reduksi flavonoid[31].
Pengujian aktivitas sitotoksik dapat dilakukan dengan metode BSLT (Brine Shrimp Lethality Test) menggunakan larva udang Artemia salina Leach. Ekstrak dari sampel akan dilihat toksisitasnya dalam mematikan larva udang yang telah diberi perlakuan
dengan konsentrasi 0 ppm (sebagai kontrol), 10 , 100 dan 1000 ppm dengan 3 kali pengulangan. Setiap pengulangan pada masing-masing konsentrasi di hitung persentase kematian larva.
Berdasarkan nilai persentase kematian pada Tabel 3. terlihat bahwa semakin besar konsentrasi sampel, maka kematian pada larva udang Artemia juga semakin besar. Dengan kata lain, meningkatnya kematian larva udang Artemia disebabkan oleh peningkatan konsentrasi dalam sampel [32].
Hasil presentase kematian larva pada konsentrasi 1000 ppm merupakan konsentrasi kematian larva tertinggi. Sedangkan pada konsentrasi 10 ppm merupakan konsentrasi dimana kematian larva terendah. Pada larutan kontrol negatif, tidak terdapat kematian larva karena larutan kontrol negatif hanya mengandung air laut dan DMSO dengan konsentrasi 1%. Larutan kontrol negatif berfungsi untuk menghilangkan pengaruh lain diluar ekstrak uji yang dapat menyebabkan kematian larva udang sehingga kematian larva murni hanya dipengaruhi ekstrak. Tabel 3. Hasil Uji Toksisitas Ekstrak Daun
P.odorifer Dengan Metode Brine Shrimp
Lethality Test (BSLT)
Tabung vial
Angka Kematian Larva Udang Artemia
salina Leach dari 10 larva
Kontrol Konsentrasi Ekstrak Uji Daun Pandanus
odorifer (ppm) 10 100 1000 P1 7 9 10 0 P2 7 8 10 0 P3 6 9 10 0 Jumlah total mati 20 26 30 0 Rata-rata kematian 6,667 8,667 10 0 % Kematian ± SD 66,67 ± 0,5773 86,67 ± 0,5773 100± 0 0 Probit 5,44 6,13 7,37 -
Beberapa kandungan kimia dalam ekstrak daun P.odorifer yang kemungkinan bersifat toksik yaitu saponin, tanin, terpenoid dan flavonoid yang pada kadar tertentu memiliki potensi toksisitas serta dapat menyebabkan kematian larva. Cara kerja senyawa-senyawa tersebut adalah dengan bertindak sebagai stomach poisoning atau racun perut [33]. Oleh karena itu bila senyawa-senyawa ini masuk ke dalam tubuh larva, alat pencernaannya terganggu. Selain itu
46 senyawa ini juga menghambat reseptor perasa pada
daerah mulut larva. Hal ini mengakibatkan larva gagal mendapatkan stimulus rasa sehingga tidak mampu mengenali makanannya sehingga larva mati kelaparan [34].
Senyawa saponin merupakan senyawa yang mengandung glikosida dalam tanaman yang sifatnya menyerupai sabun dan dapat larut dalam air [35]. Saponin dapat menurunkan aktivitas enzim pencernaan dan penyerapan makanan[36]. Senyawa Flavonoid merupakan senyawa pertahanan tumbuhan yang dapat bersifat menghambat makan serangga dan juga bersifat toksik[37]. Senyawa terpenoid dikenal pula sebagai salah satu golongan senyawa kimia dalam tanaman yang memiiiki aktivitas antikanker dan antioksidan[38].
Dari hasil analisis probit diperoleh persamaan linier y= 0,965x + 4,3833 sehingga didapat nilai LC50 yaitu 4,3557 ppm (Gambar 1).. Menurut Meyer melaporkan bahwa nilai toksisitas dalam senyawa dari tumbuhan jika LC50 ≤ 30 ppm maka bersifat sangat toksik, ketika konsentrasi ekstrak 31 ppm ≤ LC50 ≤ 1000 ppm bersifat toksik jika LC50 >1000 ppm maka bersifat tidak toksik [39]. Berdasarkan dari pernyataan tersebut maka ekstrak daun pandan laut bersifat toksik, yang ditunjukkan dari nilai LC50 yang diperoleh yaitu pada konsentrasi 4,3557 ppm.
Gambar 1. Grafik Nilai Probit Artemia salina.
Leach terhadap Log konsentrasi
ekstrak etanol Pandanus odorifer
Selanjutnya dicari standar deviasi dari rata-rata setiap pengulangan dari masing-masing konsentrasi. Semakin tinggi nilai standar devisi maka semakin besar penyimpangan data dari rata-rata hitungnya, sehingga dikatakan data memiliki variabelitas tinggi dan sebaliknya [40]. Dengan menggunakan rumus standar deviasi yang telah ditentukan diperoleh nilai standar deviasi untuk rata-rata pengulangan pada konsentrasi 10 dan 100 ppm yaitu sebesar 0,57735 danpada konsentrasi 1000 ppm yaitu 0 yang menunjukkan variabelitas rendah atau rendahnya penyimpangan data dari rata-rata hitungnya.
Uji antibakteri dilakukan dengan menggunakan metode sumuran terhadap dua bakteri yaitu gram positif dan gram negatif, namun dari hasil penelitian tidak menunjukkan adanya zona bening yang terbentuk. Hal ini disebabkan banyak faktor yaitu pelarut DMSO 1% yang digunakan telah terkontaminasi dengan mikroorganisme lain, alat bor yang digunakan kurang steril dan LAF yang digunakan sudah tidak berfungsi dengan baik. Sehingga uji aktivitas antibakteri dilakukan pengujian ulang terhadap bakteri Staphylococcus aureus dengan metode difusi cakram yang dimodifikasi. Pada penelitian ini tidak menggunakan kertas cakram melainkan dengan penanaman kapas dari cotton bud sebagai media untuk meletakkan sampel. Digunakan kapas dari cotton bud mengandung selulosa dan daya serapnya terhadap ekstrak hampir sama dengan kertas cakram.
Senyawa yang terdapat dalam sampel yang memiliki sifat sebagai antibakteri akan berdifusi ke dalam media yang telah ditumbuhi bakteri dan disekitar daerah kapas tidak akan ditumbuhi bakteri ditunjukkan dengan adanya zona bening. Sebelum dilakukan uji antibakteri alat-alat serta bahan yang akan digunakan disterilkan terlebih dahulu pada autoklaf untuk menghindari tumbuhnya atau terkontaminasi dengan mikroorganisme yang tidak diinginkan.
Sampel yang akan diuji diencerkan terlebih dahulu agar diketahui lebih jelas pada konsentrasi berapa ekstrak mampu aktif sebagai antibakteri. Konsentrasi yang dibuat yaitu 5 , 50, 500, 5000 dan 50.000 ppm. Untuk kontrol negatif yang digunakan yaitu aquades dan untuk kontrol positif yang digunakan yaitu tetrasiklin dengan konsentrasi 50.000 ppm. Tetrasiklin digunakan sebagai kontrol positif karena merupakan antibiotik berspektrum luas sehingga dapat digunakan untuk bakteri S. Aureus yang merupakan jenis bakteri Gram positif. Hal ini antara lain karena struktur dinding bakteri Gram positif diketahui relatif sederhana sehingga akan memudahkan senyawa antibakteri dalam menemukan sasaran untuk bekerja [41].
Pengamatan dan pengukuran uji aktivitas antibakteri dilakukan setelah 2x24 jam, dengan tujuan untuk melihat kemampuan optimum senyawa dalam sampel berdifusi pada media tumbuh yang telah ditumbuhi bakteri. Diukur zona hambat yang terbentuk dengan mengguanakan penggaris. Pengukuran dilakukan dengan cara mengurangi diameter keseluruhan (kapas + zona bening) dengan diameter kapas.
y = 0.965x + 4.3833
R² = 0.9736
0 2 4 6 8 0 1 2 3 4N
ila
i Pr
o
b
it
NILAI PROBIT
47 Pada konsentrasi terendah 5 ppm, zona bening
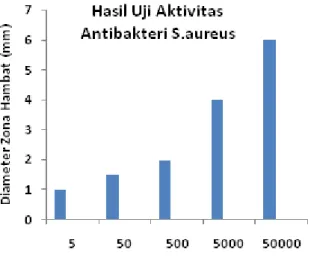
yang terbentuk tidak terlalu terlihat karena zona bening yang diperoleh sangat kecil yaitu 1 mm. Pada konsentrasi 50.000 ppm zona bening yang terbentuk terlihat samar-samar dan tidak telalu bening yaitu sebesar 6 mm. Pada kontrol positif dari tetrasiklin, zona bening yang terbentuk benar-benar terlihat dengan jelas dan sangat besar yaitu 30 mm dan kontrol negatif aquades yaitu 0 mm. Penggunaan kapas sebagai media untuk meletakkan sampel sebenarnya kurang efektif, karena pada dasarnya kertas cakram tidak boleh di ganti dengan yang lain, karena kertas cakram memiliki kerapatannya sendiri dan telah teruji dapat digunakan sebagai media untuk uji antibakteri.
Pada Gambar 2. dapat dilihat bahwa hubungan variasi konsentrasi ekstrak pandan laut berbanding lurus dengan diameter zona hambat, dengan meningkatnya konsentrasi ekstrak maka kemampuan menghambat pertumbuhan bakteri S. aureus juga semakin besar.
Dengan hasil yang di peroleh dapat dilihat bahwa daun P.odorifer memiliki pengaruh antibakteri yang sedang terhadap bakteri S. Aureus. Hal ini didukung oleh senyawa metabolit sekunder yang terkandung pada daun pandan laut yaitu flavonoid, terpenoid, tanin dan saponin[42].
Gambar 2. Hasil Diameter Zona Hambat
Antibakteri
VS
Konsentrasi
(ppm) selama 2x24 jam
Senyawa flavonoid disintesis oleh tanaman sebagai respon terhadap infeksi mikroba sehingga efektif sebagai zat antibakteri yang ampuh melawan berbagai mikroorganisme [43]. Hal ini kemungkinan disebabkan oleh kemampuan flavonoid untuk membentuk kompleks dengan protein ekstraseluler dan protein terlarut dan membentuk kompleks dengan
dinding sel bakteri. Flavonoid lipofilik juga dapat mengganggu membran mikroba. Flavonoid menyebabkan terjadinya kerusakan permeabilitas dinding sel bakteri, mikrosom, dan lisosom sebagai hasil interaksi antara flavonoid dengan DNA bakteri [44].
Senyawa terpenoid sebagai zat antibakteri diduga melibatkan kerusakan membran oleh senyawa lipofilik. Terpenoid dapat bereaksi dengan porin (protein transmembran) pada membran luar dinding sel bakteri, membentuk ikatan polimer yang kuat dan merusak porin, mengurangi permeabilitas dinding sel bakteri sehingga sel bakteri kekurangan nutrisi, pertumbuhan bakteri terhambat atau mati [45].
Senyawa tanin mempunyai daya antibakteri dengan cara memprepitasi protein. Tanin mampu menghambat enzim reverse transkriptase dan DNA topoisomerase sehingga sel bakteri tidak terbentuk [46]. Senyawa saponin sebagai antibakteri adalah menurunkan tegangan permukaan sehingga naiknya permiabelitisa atau kebocoran sel sehingga mengakibatkan senyawa intraseluler akan keluar berdifusi melalui membran luar dan dinding sel yang rentan kemudian mengikat membran sitoplasma sehingga menggangu dan mengurangi kestabilan membran sel. Hal ini meyebabkan sitoplasma bocor keluar dari sel yang mengakibatkan kematian sel [47]. SIMPULAN
Hasil uji fitokimia ekstrak etanol daun Pandan Laut (Pandanus odorifer) positif mengandung golongan senyawa kimia berupa adanya terpenoid, flavonoid, tanin, dan saponin.
Hasil pengujian toksisitas menggunakan metode BSLT pada ekstrak daun P. odorifer terhadap larva udang Artemia salina Leach diperoleh nilai LC50 sebesar 4,3557 ppm yang mememiliki tingkat toksik yang sangat kuat.
Aktivitas antibakteri ekstrak daun P.odorifer tertinggi diperoleh zona hambat yaitu 6 mm pada konsentrasi 50.000 ppm yang memiliki daya kekuatan dalam menghambat bakteri Staphylococcus aureus yaitu sedang.
SARAN
Dari hasil penelitian perlu dilakukan penelitian lebih lanjut yaitu isolasi dan identifikasi senyawa murni ekstrak daun Pandanus odorifer untuk mengetahui senyawa aktif yang berpotensi sebagai obat.
DAFTAR PUSTAKA
[1]
Ayen, R,Y., Rahmawati, Mukarlina,
48
Daun Sembung Rambat (Mikania
micrantha H.B.K) Terhadap
Pertumbuhan Bakteri IHB B 379 dan
Shigella flexneri, Protobiont,2017: 6(3):
123 –129
[2]
Agustina, W., Sumpono, Rina Elvia,
Aktivitas Asap Cair Cangkang Buah
Hevea Brazilensis sebagai Anti Bakteri
Staphylococcus aureus, Alotrop, 2017:
1(1): 6-9.
[3]
Misna., Khusnul Diana, Aktivitas Anti
Bakteri Ekstrak Kulit Bawang Merah
(Allium cepa L.) Terhadap Bakteri
Staphylococcus
aureus,
Galenika
Journal of Pharmacy , 2016: 2
(2):138-144
[4]
Sachwiver,B., Leny Sang Surya,Dewi
Elianora, Identifikasi Bakteri Pada 3
Permukaan Dental Unit (Bowl Rinse,
Dental Chair, Instrument Table) Di
RSGM Universitas Baiturrahmah Tahun
2018, Jurnal B-Dent, 2018: 5(1): 65-71
[5]
Suardi, H.N., Antibiotik Dalam Dunia
Kedokteran Gigi, Cakradonya Dent J ,
2014: 6(2): 678-744
[6]
Fatimah, S.,Fitri Nadifah, Islamiati
Burhanudin, Uji Daya Hambat Ekstrak
Etanol Kubis (Brassica oleracea var.
capitata f. alba) Terhadap Bakteri
Staphylococcus aureus Secara In Vitro,
Biogenesis, 2016: 4 (2): 102-106
[7]
Pratiwi, R.H,Mekanisme Pertahanan
Bakteri Patogen Terhadap Antibiotik,
Jurnal Pro-Life , 2017: 4 (3): 418-429.
[8]
Tria, G., Nurhamidah , Hermansyah
Amir, Potensi Ekstrak Metabolit
Sekunder Eugenia uniflora L. Sebagai
Bahan Pengawet Tahu, Alotrop, 2018:
2(1): 39-44.
[9] Putri, H,D., Sumpono, Nurhamidah., Uji Aktivitas Asap Cair Cangkang Buah Karet (Hevea brassiliensis) Dan Aplikasinya Dalam Penghambatan Ketengikan Daging Sapi , Alotrop, 2018 : 2(2): 97-105
[10]
Pribadi, A., Nurhamidah., Elvinawati.,
Pemanfaatan
Ekstrak
Air
Buah
Flacourtia inermis Roxb. (Lobi-Lobi)
Sebagai Pengawet Ikan Laut, Alotrop,
2018: 2(1): 1-7.
[11]
Marpaung,D.R.A.K.,Nursahara
Pasaribu,T.Alief Aththorick,
Taxonomic
Study
Of
Pandanus
(Pandanaceae) In Swamp Area, Aceh
Singkil, Jurnal Natural, 2013: 13( 2) :
55-63.
[12]
Yosie
Andriani,
Nadiah
Madihah
Ramli, Desy Fitrya Syamsumir. Murni
Islamiah Kassim, Jasmin Jaafar, Nur
Azniza, Aziz, Leni Marlina, Noor
Suryani Musa, Habsah Mohamad.
Phytochemical analysis, antioxidant,
antibacterial and cytotoxicity properties
of keys and cores part of Pandanus
tectorius fruits. Arabian Journal of
Chemistry. 2019 :12(8):3555-3564
[13]
Rochmadi,I., Siti Rohmah, Pemanfaatan
Buah Pandan Laut Sebagai Pangan
Olahan Pada Masyarakat Pesisir, Jurnal
Riset Ekonomi Pembangunan , 2019: 4 (
2): 161-173.
[14]
Mohamad, H., Y. Andriani., K. Bakar.,
C.C. Siang., D.F. Syamsumir., A. Alias
et al ,Effect of drying method on anti –
microbial, anti-oxidant activities and
isolation of bioactive compounds from
Peperomia pellucida (L) Hbk. Journal
of
Chemical
and
Pharmaceutical
Research , 2015: 7(8): 578-584.
[15]
Hammado,N., Ilmiati Illing, Identifikasi
Senyawa Bahan Aktif Alkaloid Pada
Tanaman Lahuna (Eupatorium
odoratum), Jurnal Dinamika, 2013: 4 (2)
: 1-18.
[16]
Fajriaty, I., Hariyanto I.H., Irfan Rian
Saputra, Monica Silitonga, Skrining
Fitokimia Dan Analisis Kromatografi
Lapis Tipis Dari Ekstrak Etanol Buah
Lerak
(Sapindus
rarak),
Jurnal
Pendidikan Informatika dan Sains, 2017
: 6(2): 243-256.
[17]
Malik, A., Ferawati Edward, Risda
Waris,
Skrining
Fitokimia
Dan
Penetapan Kandungan Flavonoid Total
Ekstrak
Metanolik
Herba
Boroco
(Celosia argentea L.), Jurnal
Fitofarmaka Indonesia, 2014: 1(1):1-5.
[18]
Ningsih, D.R., Zusfahair, Dwi Kartika,
Identifikasi
Senyawa
Metabolit
Sekunder Serta Uji Aktivitas Ekstrak
Daun Sirsak Sebagai Anti Bakteri,
Molekul: 2016: 11 (1): 101-111
49 [19]
Lisan., F.R., Penentuan Jenis Tanin
Secara Kualitatif Dan Penetapan Kadar
Tanin Dari Serabut Kelapa (Cocos
nucifera L.) Secara Permanganometri ,
Calyptra: Jurnal Ilmiah Mahasiswa
Universitas Surabaya, 2015 : 4(1): 1-16
[20]
Lestari, D, Rudi Kartika, Eva Marliana,
Uji Brine Shrimp Lethality Test (BSLT)
Umbi Bawang Tiwai (Eleutherine
bulbosa (Mill.) Urb) Dan Uji Toksisitas
Akut
Fraksi
Aktif,
Jurnal
Riset
Kefarmasian Indonesia, 2019,1(1): 1-10
[21]
Muaja, A.D., Harry S. J. Koleangan,
Max R. J. Runtuwene, Uji Toksisitas
dengan Metode BSLT dan Analisis
Kandungan Fitokimia Ekstrak Daun
Soyogik (Saurauia bracteosa DC)
dengan Metode Soxhletasi, Jurnal
MIPA Unsrat Online, 2013: 2(2):
115-118
[22]
Hendri, M, Gusti Diansyah, dan Jetun
Tampubolon, Konsentrasi Letal
(LC50-48 jam) Logam Tembaga (Cu) dan
LogamKadmium
(Cd)
Terhadap
Tingkat Mortalitas Juwana Kuda Laut
(Hippocampus spp), Jurnal Penelitian
Sains , 2013 , 13 (1 ): 26-30
[23]
Syah,I.S.K.,
Penentuan
Tingkatan
Jaminan
Sterilitas
Pada
Autoklaf
Dengan Indikator Biologi Spore Strip,
Farmaka, 2016: 14 (1) : 59-69
[24]
Harjanto, S., Raharjo, Peran Laminar
Air
Flow
Cabinet
Dalam
Uji
Mikroorganisme
Untuk
Menunjang
Keselamatan Kerja Mahasiswa Di
Laboratorium Mikrobiologi, METANA,
2017 : 13(2):55-57
[25]
Katrin, D., Nora Idiawati, Berlian
Sitorus, Uji Aktivitas Anti Bakteri Dari
Ekstrak Daun Malek (Litsea graciae
Vidal) Terhadap Bakteri Stapylococcus
aureus Dan Escherichia coli, JKK,
2015 : 4(1) : 7-12
[26]
Ismail,Y.S., Cut Yulvizar, Putriani,
Isolasi, karakterisasi dan uji aktivitas
antimikroba bakteri asam laktat dari
fermentasi biji kakao (Theobroma
cacao L.), Bioleuser, 2017: 1(2): 45-53
[27]
Oktasila,
D.,
Nurhamidah,
Dewi
Handayani, Uji Aktivitas Antibakteri
Daun Jeruk Kalamansi (Citrofortunella
microcarpa)
Terhadap
Bakteri
Staphylococcus aureus Dan Escherichia
coli, Alotrop, 2019: 3(2): 158-169
[28]
Safitri,O.M., Nurhamidah, Hermansyah
Amir,
Potensi
Sitotoksik
Dan
Antibakteri Ekstrak Daun Laportea
interrupta (L.) Chew (Jelatang Ayam )
Terhadap
Staphylococcus
aureus,
Alotrop, 2018: 2(2): 175-183.
[29]
Ergina, Siti Nuryanti , Indarini Dwi
Pursitasari, Uji Kualitatif Senyawa
Metabolit Sekunder Pada Daun Palado
(Agave angustifolia) Yang Diekstraksi
Dengan Pelarut Air Dan Etanol, J.Akad
. Kim, 2014: 3(3): 165-172.
[30]
Prayoga,
D.G.E.,Komang
Ayu
Nocianitri, Ni Nyoman Puspawati,
Identifikasi Senyawa Fitokimia Dan
Aktivitas Antioksidan Ekstrak Kasar
Daun Pepe (Gymnema reticulatum Br.)
Pada Berbagai Jenis Pelarut, Jurnal
Ilmu dan Teknologi Pangan ,2019:8( 2):
111-121
[31]
Agustina,W.,Nurhamidah,Dewi
Handayani, Skrining Fitokimia dan
Aktivitas Antioksidan Beberapa Fraksi
Kulit Batang Jarak (Ricinus communis
L.).Alotrop, 2017: 1(2) : 117-122.
[32]
Karundeng, G.W., Herny E. Simbala,
Imam Jayanto, Identifikasi Fitokimia,
Uji Aktivitas Antioksidan Dengan
Metode 1.1-diphenyl-2-picrylhydrazyl
(DPPH),
Dan
Toksisitas
Dengan
Metode Brine Shrimp Lethality Test
(BSLT) Dari Ekstrak Etanol Tangkai
Buah Pinang YakI (Areca vestiaria
Giseke), Pharmacon , 2019: 8 (3):
619-628
[33]
Rahmawati, Sitti Amirah,Andi Sulfika,
Uji Toksisitas Fraksi n-Heksan Daun
Beruwas
Laut
(Scaevola
taccada
(Gaertn.) Roxb.) Dengan Metode Brine
Shrimp Lethality Test, As-Syifaa , 2012:
4 (2) : 196-202
[34]
Vitalia,N., Ahmad Najib, Aktsar
roskiana Ahmad, Uji Toksisitas Ekstrak
Daun Pletekan (Ruelliatuberosa L.)
Dengan Menggunakan Metode Brine
Shrimp Lethality Test (BSLT) , Jurnal
50
Fitofarmaka Indonesia, 2016:3(1):
124-129
[35]
Illing, I, Wulan Safitri , Erfiana, Uji
Fitokimia Ekstrak Buah Dengen, Jurnal
Dinamika, 2017 :8(1): 66-84
[36]
Chintihia, T., Efek Larvasida Ekstrak
Daun Cengkeh (Syzygium aromaticum
L.) terhadap Aedes aegypti, J Agromed
Unila, 2015: 2 (4): 510-515
[37]
Koneri, R, Hanny Hesky Pontororing,
Uji Ekstrak Biji Mahoni (Swietenia
macrophylla) Terhadap Larva Aedes
aegypti
Vektor
Penyakit
Demam
Berdarah, Jurnal MKMI, 2016: 12 (4):
216-223
[38]
Andriani, Y, Habsah Mohamad, M.N.I,
Kassim.,N.D.Rosnan.,D.F. Syamsumir.,
J.Saidin., et al , Evaluation on
Hydnophytum formicarum Tuber from
Setiu Wetland (Malaysia) and Muara
Rupit (Indonesia) for Anti bacterial and
Antioxidant activities and anti-cancer
Potency against MCF-7 and HeLa Cell.
Journal of Applied Pharmaceutical
Science, 2017: 7(9):30-37.
[39]
Ningdyah,A.W, Andi Hairil Alimuddin,
Afghani Jayuska, Uji Toksisitas Dengan
Metode BSLT (Brine Shrimp Lethality
Test) Terhadap Hasil Fraksinasi Ekstrak
Kulit
Buah
Tampoi
(Baccaurea
macrocarpa) , JKK, 2015: 4(1): 75-83
[40]
Afifah, A.N.,Akhmad Rifa’i, Pengaruh
Senam
Diabetes
Melitus
(DM)
Terhadap Perubahan Tekanan Darah
Pada Pasien DM Tipe 2 Di Persadia
Unit RSUD Dr. Moewardi Di Surakarta
Tahun 2015, Jurnal Keperawatan
Global, 2017, 2(2): 70-78
[41]
Muharni, Fitrya, Sofa Farida, Uji
Aktivitas Antibakteri Ekstrak Etanol
Tanaman Obat Suku Musi di Kabupaten
Musi Banyuasin, Sumatera Selatan,
Jurnal Kefarmasian Indonesia 2017: 7
(2): 127-135
[42]
Fauzan , M.R.,Ade Zuhrotun, Review
Artikel:
Beberapa
Tanaman
Yang
Memiliki Aktivitas Analgesik Secara In
Vivo, Farmaka , 2019: 17(1): 123-133
[43]
Parubak, A.S,Senyawa Flavonoid Yang
Bersifat
Antibakteri
Dari
Akway
(Drimys becariana.Gibbs) , Chem.
Prog. 2013: 6(1): 34-37.
[44]
Sabir,A., Aktivitas antibakteri flavonoid
propolis Trigona sp terhadap bakteri
Streptococcus mutans (in vitro), Maj.
Ked. Gigi. (Dent. J.), 2005: 38(3): 135–
141
[45]
Widowati,R.,Sri Handayani, Iqba Lasdi,
Aktivitas Antibakteri Minyak Nilam
(Pogostemon cablin) Terhadap
Beberapa Spesies Bakteri Uji, Jurnal
Pro-Life , 2019: 6 (3): 237-249
[46]
Anggraeni, D.H,Evi Liviawaty, Rusky
Intan Pratama, Iis Rostini, Pengaruh
Konsentrasi Ekstrak Daun Jambu Biji
Terhadap Masa Simpan Filet Patin
Berdasarkan Jumlah Mikroba, Jurnal
Perikanan dan Kelautan 2017: 8(2):
145-151
[47]