BAB VI
PEMBAHASAN
6.1 Isolasi Minyak Atsiri dengan Destilasi Uap
Rimpang temu putih yang sudah dipotong kecil-kecil didestilasi dengan menggunakan destilasi uap. Pemotongan sampel dengan ukuran kecil bertujuan untuk memperluas permukaan sampel sehingga memudahkan untuk memperoleh minyak atsiri. Sampel yang sudah dipotong ini selanjutnya dimasukkan ke dalam dandang yang telah berisi air, dimana dandang yang digunakan untuk destilasi ini sudah dilengkapi dengan kondensor. Destilat yang diperoleh selanjutnya ditambahkan dengan CaCl2 anhidrat.Penambahan CaCl2 anhidrat berfungsi untuk
membebaskan sisa-sisa air yang masih tercampur dengan minyak. Setelah diperoleh minyak atsiri murni (tidak bercampur lagi dengan air) selanjutnya dilakukan uji toksisitas terhadap larva Artemia salina L.
6.2 Uji Toksisitas Minyak Atsiri terhadap Larva Artemia salina L
Uji toksisitas minyak atsiri terhadap larva Artemia salina L. dilakukan
dengan cara pemberian minyak atsiri dengan berbagai konsentrasi terhadap larva
Artemia salina L., kemudian dihitung jumlah larva Artemia salina L yang hidup
dan yang mati, selanjutnya dilakukan perhitungan untuk mengetahui nilai LC50.
LC50 merupakan konsentrasi yang menyebabkan kematian 50% larva. Dari hasil
perhitungan LC50 (lampiran 5) diperoleh nilai LC50 sebesar 19,96 ppm, sehingga
dapat dikatakan minyak atsiri rimpang temu putih bersifat toksik terhadap larva
Artemia salina L. Jika suatu sampel mempunyai nilai LC50 di bawah 1000 ppm
maka sampel tersebut dikatakan bersifat sitotoksik (toksik terhadap sel) (Meyer, 1982). Hasil penelitian yang dilakukan oleh Anisa, 2010 diperoleh nilai LC50 dari
ekstrak kloroform rimpang temu putih sebesar 29,51 ppm. Jika dibandingkan dengan minyak atsiri, minyak atsiri rimpang temu putih memberikan efek toksik yang lebih baik dari pada ekstrak kloroform rimpang temu putih.
6.3 Uji Antikanker Secara In Vitro terhadap Sel Mieloma Mencit
Berdasarkan penelitian yang telah dilakukan diperoleh jumlah sel sebanyak 5.105 sel/mL. Jumlah sel ini dianggap telah mencukupi untuk uji sel mieloma menggunakan larutan uji. Setiap perlakuan dimasukkan ke dalam vial kemudian diambil 1mL, ditambahkan dengan pewarna tripan blue 0,4% sebanyak 1 mL. Dengan menggunakan teknik penghitungan cara Thoma di bawah mikroskop dihitung persentase viabilitas selnya yaitu jumlah sel yang hidup dibagi dengan jumlah sel keseluruhan (sel hidup dan sel mati) dikalikan 100% (Meyer and Harvey, 2003). Jarak antara pewarnaan dengan penghitungan sel dilakukan tidak kurang dari 3 menit dan maksimum selama 10 menit hal ini untuk menghindari hasil positif palsu (Freshney, 1987).
Pewarnaan sel dengan menggunakan larutan trypan blue bertujuan untuk membedakan sel yang hidup dan yang mati. Sel yang mati akan terlihat berwarna biru, karena mengalami lisis sehingga protein dalam plasmanya akan berikatan dengan trypan blue sehingga sel menjadi berwarna biru. Selain itu, sel yang mati akan terlihat berwarna lebih gelap dan bentuknya tidak bulat lagi atau menyusut karena isi sel (sitoplasmanya) keluar. Hal ini tidak terjadi pada sel yang hidup
karena tidak mengalami kerusakan pada membran selnya, sehingga sel yang hidup masih terlihat berbentuk bulat, lebih terang dan jernih (Djajanegara, 2009).
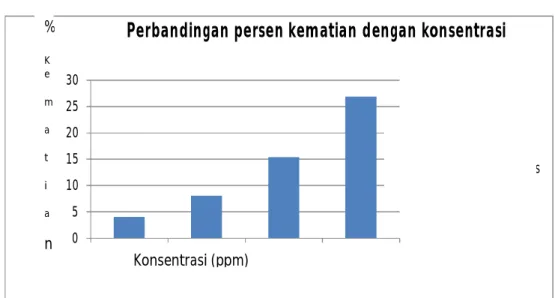
Adapun grafik yang menggambar perbandingan antara persen viabilitas dengan konsentrasi dapat dilihat pada Gambar 6.1
0 5 10 15 20 25 30 1 10 100 1000
Perbandingan persen kematian dengan konsentrasi
Perbandingan % viabilitas dengan konsentrasi
Gambar 6.1 Grafik perbandingan persen kematian dengan konsentrasi Berdasarkan grafik di atas dan Tabel 5.2 diketahui dengan meningkatnya konsentrasi larutan uji akan diikuti dengan kenaikan persen kematian sel mieloma. Perbedaan efek antar kelompok larutan uji dianggap sebagai perbedaan perlakuan yang diberikan, dimana perbedaan konsentrasi larutan uji secara bertingkat menyebabkan perbedaan persen viabilitas sel mieloma. Semakin besar konsentrasi larutan uji semakin kecil persen viabilitas sel yang hidup, begitupun sebaliknya semakin kecil konsentrasi larutan uji, semakin besar persen viabilitas sel yang hidup. Hal ini diperkuat oleh penelitian yang dilakukan oleh Verlianara, 2002 yang menyatakan bahwa meningkatnya konsentrasi minyak atsiri temu mangga dapat menyebabkan meningkatnya persen kematian atau menurunnya persen viabilitas sel mieloma yang hidup.Oleh karena itu, dapat dikatakan bahwa
% K e m a t i a n Konsentrasi (ppm)
kelompok larutan uji memiliki aktivitas hambatan pertumbuhan terhadap kultur sel mieloma mencit, namun belum dapat diikatakan bersifat antikanker karena nilai LC50nya yang terlalu tinggi.
6.4 Uji Antikanker secara Invitro terhadap Sel HeLa
Aktivitas antikanker terhadap sel HeLa ditentukan dengan menggunakan MTT ((3,[4,5-dimetilthiazol-2yl]-2,5-difenil tetrazolium bromida)). Pengujian dengan menggunakan MTT didasarkan pada pemecahan garam tetrazolium yang berwarna kuning dan larut dalam air menjadi kristal biru keunguan formazan yang tidak larut dalam air. Pemecahan MTT terjadi pada mitokondria sel yang hidup oleh enzim suksinat hidrogenaseReaksi menggunakan MTT ini melibatkan piridin nukleotida kofaktor NADH dan NADPH yang hanya dikatalisis oleh sel hidup, sehingga jumlah formazan yang terbentuk proporsional dengan jumlah sel yang hidup. Semakin banyak sel yang hidup, semakin banyak kristal formazan yang terbentuk. Selanjutnya diukur absorbansinya dengan menggunakan ELISA Reader pada panjang gelombang 550 nm. Semakin tinggi nilai absorbansi yang diperoleh mengindikasikan mortalitas (kematian) yang rendah (Fajarningsih, 2006). Absorbansi tersebut menggambarkan jumlah sel hidup. Semakin kuat intensitas warna ungu yang terbentuk, absorbansi akan semakin tinggi. Hal ini menunjukkan bahwa semakin banyak MTT yang diabsorbsi ke dalam sel hidup dan dipecah melalui reaksi reduksi oleh enzim reduktase dalam rantai respirasi mitokondria, sehingga formazan yang terbentuk juga semakin banyak. Absorbansi ini yang akan digunakan untuk menghitung persentase sel hidup sebagai respon. Intensitas
warna ungu yang terbentuk berbanding langsung dengan jumlah sel yang aktif melakukan metabolisme (Anggrianti, 2008).
Berdasarkan absorbansi yang diperoleh, maka dapat dihitung persen kematian sel HeLa (Tabel 5.6). Untuk mengetahui nilai LC50nya maka dibuat
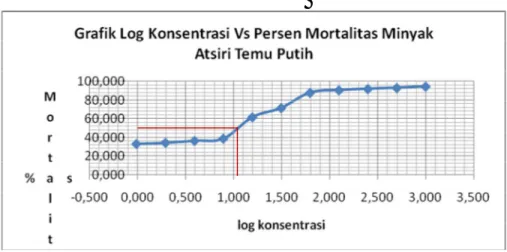
grafik persen mortalitas Vs log konsentrasi. Adapun grafik penentuan nilai LC50
digambarkan pada Gambar 6.2.
Gambar 6.2 Grafik penentuan nilai LC50 minyak atsiri temu putih
terhadap sel HeLa
Berdasarkan grafik di atas dengan meningkatnya konsentrasi menyebabkan peningkatan kematian sel. Kematian sel tertinggi yaitu pada konsentrasi 1000 ppm dengan persen kematian sebesar 94,51% sedangkan kematian terendah pada konsentrasi 0,06 ppm dengan persen kematian sebesar 16,50%. Dari grafik tersebut diperoleh nilai LC50 sebesar 13,80 ppm. Hal ini
berarti bahwa dengan pemberian minyak atsiri dengan konsentrasi sebesar 13,80 ppm, dapat membunuh sel HeLa sebanyak 50%. Sehingga dapat dikatakan minyak atsiri rimpang temu putih bersifat sebagai antikanker karena nilai LC50nya
< 20 µg/mL (Hidayat, 2002). Perbedaan persentase kematian setiap kelompok larutan uji dianggap sebagai perbedaan perlakuan terhadap efek, dimana
perbedaan konsentrasi larutan uji secara bertingkat menyebabkan perbedaan persen mortalitas pada sel HeLa atau meningkatnya persen kemataian sel HeLa. Penelitian ini juga didukung oleh penelitian yang dilakukan oleh Verlianara, 2002 yang menyatakan bahwa meningkatnya konsentrasi minyak atsiri temu mangga maka % kematian sel HeLa akan meningkat pula.
6.5 Identifikasi Senyawa Antikanker pada Minyak Atsiri Rimpang temu Putih dengan Kromatografi Gas-Spektroskopi Massa (GC-MS).
Identifikasi minyak atsiri rimpang temu putih yang aktif antikanker dengan menggunakan Kromatografi Gas-Spektroskopi Massa (KG-SM) diperoleh 16 puncak, namun hanya 8 puncak (puncak 1, 2, 3, 5, 8, 10, 14, dan 16) yang diidentifikasi berdasarkan fragmentasinya yang dibandingkan dengan fragmentasi senyawa pada database. Sedangkan puncak yang lainnya (puncak 4,6, 7, 9, 11, 12, 13 dan 15) belum dapat diidentifikasi karena masih memerlukan data pendukung dari spektrometer yang lain sehingga dapat diidentifikasi.
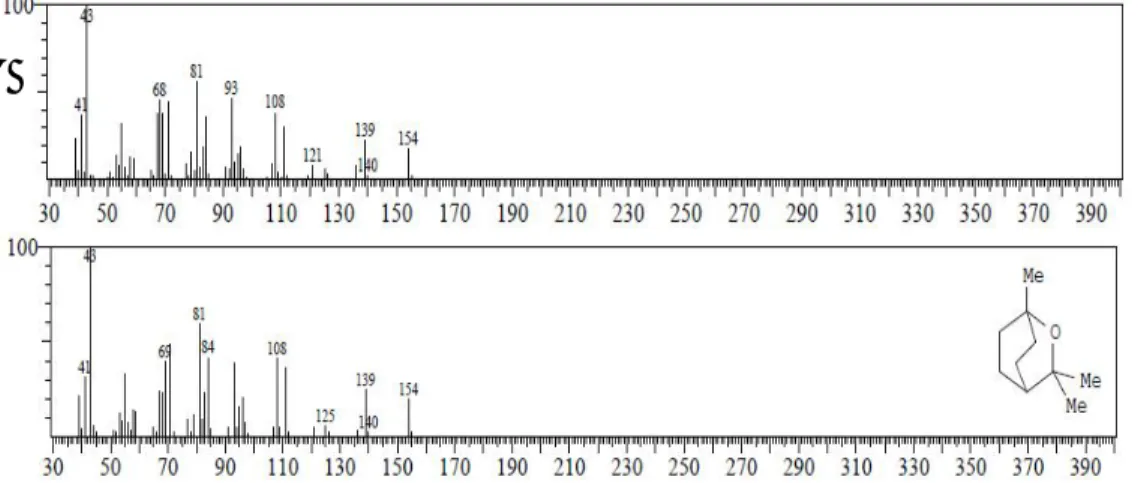
A. Identifikasi senyawa pada puncak 1 tR 6,442 menit (4,77%)
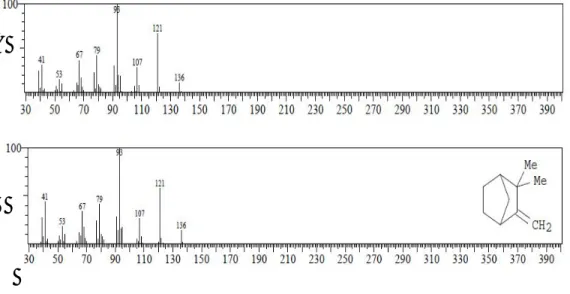
Spektrum massa senyawa pada puncak 1 identik dengan spektrum massa senyawa alpha pinen yang ditampilkan pada Gambar 6.3.
A
Gambar 6.3 (A). Spektrum massa senyawa puncak 1 (B). Spektrum massa senyawa alpha pinen
Berdasarkan data dari library WILEY229.LIB alpha pinen mempunyai rumus molekul C10H16 dan berat molekul senyawa alpha pinen adalah 136. Oleh
karena itu ion molekul (M+) senyawa pada puncak 1 adalah m/z 136 dengan puncak dasar pada m/z 93. Pola pemenggalan spektrum massa senyawa puncak 1 seperti terlihat pada Tabel 6.1
Tabel 6.1 Kemungkinan fragmen yang hilang dari senyawa alpha pinen. No m/z Kemungkinan fragmen yang hilang Penggalan
1 136 M+ C10H16
2 121 M+ - 15 -CH3. C9H13+
3 93 (M+ - 15) -28 -C2H4 C7H9+
4 77 [(M+ - 15)-28]-16 - CH4 C6H5+
Berdasarkan berat molekul dan pola fragmentasi dari pendekatan WILEY229.LIB, maka diduga senyawa puncak 1 identik dengan senyawa alpha pinen yang strukturnya terlihat pada Gambar 6.4.
Gambar 6.4 Struktur senyawa alpha pinen
Fragmentasi yang terjadi pada senyawa alpha pinen sesuai dengan spektrum massa di atas dapat diperkirakan sebagai berikut:
Fragmentasi
B. Identifikasi senyawa pada puncak 2 tR 6,884 menit (4,16%)
Spektrum massa senyawa pada puncak 2 identik dengan spektrum massa senyawa kamfen yang ditampilkan pada Gambar 6.5.
CH3 CH3 H3C - e CH3 CH3 H3C - CH3 CH3 CH2 H m/z 136 m/z 121 rH CH3 H H2C CH3 H H2C H - C2H4 - 28 -15 CH3 m/z 93 CH3 H CH3 H - CH4 - 16 m/z 77 m/z 77
Gambar 6.5 (A). Spektrum massa senyawa puncak 2 (B). Spektrum massa senyawa kamfen
Berdasarkan data dari library WILEY229.LIB kamfen mempunyai rumus molekul C10H16 dan berat molekul sebesar 136. Oleh karena itu ion molekul (M+)
senyawa pada puncak 2 adalah m/z 136 dengan puncak dasar pada m/z 93. Pola pemenggalan spektrum massa senyawa puncak 2 seperti terlihat pada Tabel 6.2. Tabel 6.2 Kemungkinan fragmen yang hilang dari senyawa kamfen
No m/z Kemungkinan fragmen yang hilang Penggalan
1 136 M+ C10H16
2 121 M+ - 15 -CH3. C9H13+
3 107 M+ - 15-14 -CH2 C8H11+
4 93 M+ - 15-14-14 - CH2 C7H9+
Berdasarkan berat molekul dan pola fragmentasi dari pendekatan WILEY 7, maka diduga senyawa puncak 2 identik dengan senyawa kamfen (2,2-dimetil-3-metilenbicyclo-heptana) yang strukturnya terlihat seperti pada Gambar 6.6. A
Gambar 6.6 Struktur senyawa kamfen
Fragmentasi yang terjadi pada senyawa kamfen sesuai dengan spektrum massa di atas dapat diperkirakan sebagai berikut:
Fragmentasi CH3 CH3 CH2 m/z 136 -e CH3 CH3 CH2 - CH3 CH3 CH2 m/z 121 C H2 CH2 H CH2 -15 -CH2 -14 m/z 107 CH2 -CH2 -14 m/z 93 CH3 CH3 CH2
C. Identifikasi senyawa pada puncak 3 tR 8,906 menit (4,82%)
Spektrum massa senyawa pada puncak 3 identik dengan spektrum massa senyawa kamfen yang ditampilkan pada Gambar 6.7.
Gambar 6.7 (A). Spektrum massa senyawa puncak 3 (B). Spektrum massa senyawa 1,8 sineol
Berdasarkan data dari library WILEY229.LIB senyawa 1,8 sineol mempunyai rumus molekul C10H18O dan mempunyai berat molekul sebesar 154.
Oleh karena itu ion molekul (M+) senyawa pada puncak 3 adalah m/z 154 dengan puncak dasar pada m/z 43. Pola pemenggalan spektrum massa senyawa puncak 3 seperti terlihat pada Tabel 6.3.
Tabel 6.3 Kemungkinan fragmen yang hilang dari senyawa 1,8 sineol. No m/z Kemungkinan fragmen yang hilang Penggalan
1 154 M+ C10H18O 2 139 M+ - 15 -CH3. C9H15O+ 3 4 81 43 (M+ -15)-58 (M+ -15)-58-38 -CH3COCH3 -C3H2 C6H9+ C3H7+ A B
Berdasarkan berat molekul dan pola fragmentasi dari pendekatan WILEY229.LIB, maka diduga senyawa puncak 3 identik dengan 1,8 sineol yang struktur senyawanya terlihat pada Gambar 6.8
O
CH3
CH3 CH3
Gambar 6.8 Struktur senyawa 1,8 sineol
Fragmentasi yang terjadi pada senyawa beta pinen sesuai dengan spektrum massa di atas dapat diperkirakan sebagai berikut:
O H3C CH3 CH3 O CH3 CH3 CH3 m/z 154 - e - CH3 -15 O CH3 CH3 m/z 139 - 58 - C=O(CH3)2 m/z 81 H H H H H H CH3 -38 C3H2 CH3-CH2-CH2 m/z 43
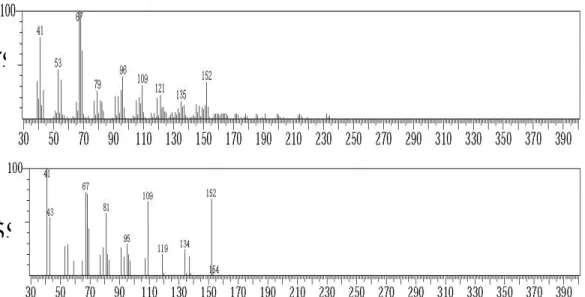
D. Identifikasi senyawa pada puncak 4 tR 10, 46 menit (2,03%)
Spektrum massa senyawa pada puncak 4 tidak identik dengan spektrum massa senyawa yang terdapat pada database. Adapun gambar spektrum massanya ditampilkan pada Gambar 6.9.
Gambar 6.9 (A). Spektrum massa senyawa puncak 4 (B). Spektrum massa senyawa pada database Berdasarkan data dari library WILEY229.LIB senyawa pada puncak 4 mempunyai berat molekul sebesar 152. Oleh karena itu ion molekul (M+) senyawa pada puncak 4 adalah m/z 152 dengan puncak dasar pada m/z 67. Pola pemenggalan spektrum massa senyawa puncak 4 seperti terlihat pada Tabel 6.4. Tabel 6.4 Kemungkinan fragmen yang hilang dari senyawa puncak 4
No m/z Kemungkinan fragmen yang hilang
1 152 2 109 M+-C3H7 3 96 M+-C3H7-CH3 4 67 M+-C3H7-CH3-CHO 5 53 M+-C3H7-CH3-CHO-CH2 A B
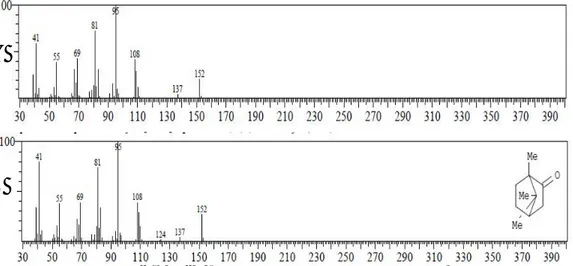
E. Identifikasi senyawa pada puncak 5 tR 11,403 menit (8,27%)
Spektrum massa senyawa pada puncak 5 identik dengan spektrum massa senyawa kamfor yang ditampilkan pada Gambar 6.10.
Gambar 6.10 (A). Spektrum massa senyawa puncak 5 (B). Spektrum massa senyawa kamfor
Berdasarkan data dari library WILEY229.LIB senyawa kamfor mempunyai rumus molekul C10H16O dan berat molekul sebesar 152. Oleh karena
itu ion molekul (M+) senyawa pada puncak 5 adalah m/z 152 dengan puncak dasar pada m/z 95. Pola pemenggalan spektrum massa senyawa puncak 5 seperti terlihat pada Tabel 6.5.
Tabel 6.5 Kemungkinan fragmen yang hilang dari senyawa kamfor.
No m/z Kemungkinan fragmen yang hilang Penggalan
1 152 M+ C10H16O
2 108 M+ - 43 -CH(CH3)2 C7H9O+
3 95 M+ - 43-14 - CH2 C6H7O+
A
Berdasarkan berat molekul dan pola fragmentasi dari pendekatan WILEY229.LIB, maka diduga senyawa puncak 5 identik dengan kamfor yang strukturnya terlihat pada Gambar 6.11
CH3
H3C
H3C
O
Gambar 6.11 Struktur senyawa kamfor
Fragmentasi yang terjadi pada senyawa kamfor sesuai dengan spektrum massa di atas dapat diperkirakan sebagai berikut :
Fragmentasi O H3C H3C H CH3 O CH3 CH(CH3)2 - CH(CH3)2 - 43 O CH2 m/z 108 - CH2 - 14 O m/z 95 m/z 152 -e H
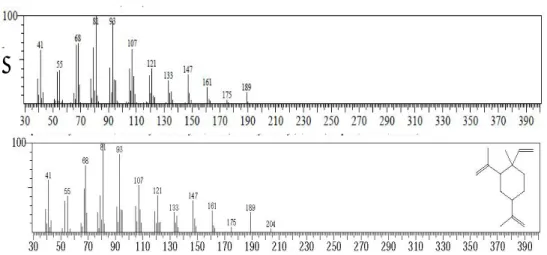
F. Identifikasi senyawa pada puncak 8 tR 15,460 menit (4,35%)
Spektrum massa senyawa pada puncak 8 identik dengan spektrum massa senyawa kamfor yang ditampilkan pada Gambar 6.12.
Gambar 6.12 (A). Gambar spektrum massa senyawa puncak 8 (B). Gambar spektrum massa senyawa 1-etenil-1-metil
2,4bis(1-metiletenil) sikloheksana
Berdasarkan data dari library WILEY229.LIB senyawa 1-etenil-1-metil 2,4bis(1-metiletenil) sikloheksana mempunyai rumus molekul C15H24 dan berat
molekul sebesar 189. Oleh karena itu ion molekul (M+) senyawa pada puncak 8 adalah m/z 189 dengan puncak dasar pada m/z 81. Pola pemenggalan spektrum massa senyawa puncak 8 seperti terlihat pada Tabel 6.6.
A B
Tabel 6.6 Kemungkinan fragmen yang hilang dari senyawa 1-etenil-1-metil-2,4-bis(1-metiletenil) sikloheksana.
No m/z Kemungkinan fragmen yang hilang Penggalan
1 189 M+ C14H21 2 175 M+ - 14 -CH2. C13H19+ 3 161 M+ - 14-14 -CH2 C12H17+ 4 147 M+ - 14-14-14 -CH2 C11H15+ 5 6 7 133 107 81 M+ - 14-14-14-14 M+ - 14-14-14-14-26 M+ - 14-14-14-14-26-26 -CH2 -C2H2 -C2H2 C10H13+ C8H11+ C6H10+
Berdasarkan berat molekul dan pola fragmentasi dari pendekatan WILEY 7, maka diduga senyawa puncak 8 identik denngan 1-etenil-1-metil-2,4-bis(1-metiletenil) sikloheksana yang strukturnya terllihat pada Gambar 6.13.
Gambar 6.13 Struktur senyawa 1-etenil-1-metil-2,4-bis(1-metiletenil) sikloheksana
Fragmentasi yang terjadi pada senyawa 1-etenil-1-metil-2,4-bis(1-metiletenil) sikloheksana sesuai dengan spektrum massa di atas dapat diperkirakan sebagai berikut :
Fragmentasi m/z 189 -e C H H H C -14 -CH2 H H H m/z 175 -14 -CH2 H m/z161 CH2 -14 CH2 CH2 H H m/z 147 H H -14 -CH2 HC H -26 -C2H2 m/z133 C H m/z 107 H -26 -C2H2 m/z 81
G. Identifikasi senyawa pada puncak 9 tR 16, 210 menit (2,34%)
Spektrum massa senyawa pada puncak 9 tidak identik dengan spektrum massa senyawa yang terdapat pada database. Adapun gambar spektrum massanya ditampilkan pada Gambar 6.14.
Gambar 6.14 (A). Spektrum massa senyawa puncak 9 (B). Spektrum massa senyawa pada database
Berdasarkan data dari library WILEY229.LIB senyawa pada puncak 9 mempunyai berat molekul sebesar 204. Oleh karena itu ion molekul (M+) senyawa pada puncak 9 adalah m/z 204 dengan puncak dasar pada m/z 107. Pola pemenggalan spektrum massa senyawa puncak 9 seperti terlihat pada Tabel 6.7. Tabel 6.7 Kemungkinan fragmen yang hilang dari senyawa puncak 9
No m/z Kemunngkinan fragmen yanng hilang
1 204 2 189 M+-CH3 3 175 M+-CH3-CH2 4 147 M+-CH3-CH2-C2H4 5 121 M+-CH3-CH2-C2H4-C2H2 6 107 M+-CH3-CH2-C2H4-C2H2-CH2 A B
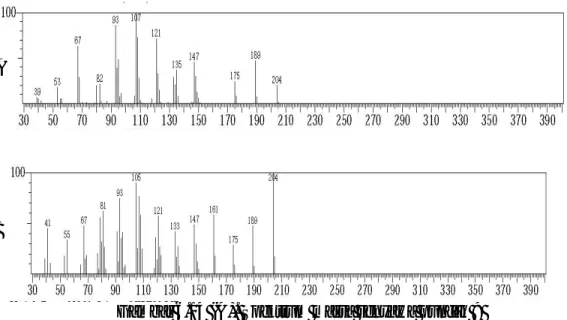
H. Identifikasi senyawa pada puncak 10 tR 16,988 menit (91,85%)
Spektrum massa senyawa pada puncak 10 identik dengan spektrum massa senyawa furanodiena yang ditampilkan pada Gambar 6.15.
Gambar 6.15 (A). Spektrum massa senyawa puncak 10 (B). Spektrum massa senyawa furanodiena
Berdasarkan data dari library WILEY229.LIB senyawa furanodiena mempunyai rumus molekul C15H20O dan berat molekul sebesar 216. Oleh karena
itu ion molekul (M+) senyawa pada puncak 10 adalah m/z 216 dengan puncak dasar pada m/z 108. Pola pemenggalan spektrum massa senyawa puncak 8 seperti terlihat pada Tabel 6.8.
Tabel 6.8 Kemungkinan fragmen yang hilang dari senyawa furanodiena.
No m/z Kemungkinan fragmen yang hilang Penggalan
1 216 M+ C15H20O 2 201 M+ - 15 -CH3. C14H17O+ 3 187 (M+ - 15)- 14 -CH2 C13H15O+ 4 173 (M+ - 15) – 14 - 14 -CH2 C12H13O+ 5 159 (M+ - 15) – 14 – 14 - 14 -CH2 C11H11O+ 6 133 (M+ - 15) – 14 – 14 – 14 - 26 -C2H2 C9H9O+ A B
Berdasarkan berat molekul dan pola fragmentasi dari pendekatan WILEY229.LIB, maka diduga senyawa puncak 10 identik dengan furanodiena yang strukturnya dapat dilihat pada Gambar 6.16
.
Gambar 6.16. Struktur senyawa furanodiena
Fragmentasi yang terjadi pada senyawa furanodiena sesuai dengan spektrum massa di atas dapat diperkirakan sebagai berikut
O CH3 CH3 CH3 m/z 216 -15 CH3 O CH3 H2 C m/z 201 H H O H CH3 CH2 O H CH3 - CH2 -14 -14 -CH2 m/z 187 O H CH3 m/z 173 O H CH3 m/z 159 -14 -CH2 O CH3 H O CH3 -26 -C2H2 m/z 133 O CH3 CH3 CH3
I. Identifikasi senyawa pada puncak 14 tR 19,624menit (89,37%)
Spektrum massa senyawa pada puncak 14 identik dengan spektrum massa senyawa germakron yang ditampilkan pada Gambar 6.17.
Gambar 6.17 (A). Spektrum massa senyawa puncak 14 (B). Spektrum massa senyawa germakron
Berdasarkan data dari library WILEY229.LIB senyawa germakron mempunyai rumus molekul C15H22O dan berat molekul sebesar 218. Oleh karena
itu ion molekul (M+) senyawa pada puncak 14 adalah m/z 218 dengan puncak dasar pada m/z 107. Pola pemenggalan spektrum massa senyawa puncak 14 seperti terlihat pada Tabel 6.9.
Tabel 6.9.Kemungkinan fragmen yang hilang dari senyawa germakron. No m/z Kemungkinan fragmen yang hilang Penggalan
1 218 M+ C15H22O 2 203 M+ - 15 -CH3. C14H19O+ 3 175 (M+ - 15)-28 -C2H4 C12H15O+ 4 161 (M+ - 15)-28]-14 -CH2 C11H17O+ 5 135 (M+ - 15)-28]-14]-26 -C2H2 C9H15O+ 6 107 (M+ - 15)-28]-14]-26]-28 -C2H4 C7H11O+ 7 67 (M+ - 15)-28]-14]-26]-28]-40 -C3H4 C4H7O+ A B
Berdasarkan berat molekul dan pola fragmentasi dari pendekatan WILEY229.LIB, maka diduga senyawa puncak 14 identik dengan germakron yang strukturnya dapat dilihat pada Gambar 6.18.
Gambar 6.18 Struktur senyawa germakron
Fragmentasi yang terjadi pada senyawa germakron sesuai dengan spektrum massa di atas dapat diperkirakan sebagai berikut :
Fragmentasi 1 CMe O Me Me H3C H3C C O CH3 CH3 -e H3C H3C C O CH3 CH3 -CH3 H3C H3C C O CH3 m/z 218 m/z 203 H3C H3C C O CH3 H H H3C H3C H C O CH3 H -C2H4 H3C CH2 O H m/z 175 -28 H -CH2 -14 H3C O -CHCH -26 O H3C m/z 135 m/z 161 -CH2CH2 -28 H3C O m/z 107 -CH3CCH -40 O HC C C C O H H HC HC C CH O m/z 67 C O HC m/z 41 -CHCH -26
H. Identifikasi senyawa pada puncak 16 tR 20,776menit (8,19%)
Spektrum massa senyawa pada puncak 16 identik dengan spektrum massa senyawa velleral yang ditampilkan pada Gambar 6.19.
Gambar 6.19 (A). Spektrum massa senyawa puncak 16 (B). Spektrum massa senyawa velleral
Berdasarkan data dari library WILEY229.LIB senyawa velleral mempunyai berat molekul sebesar 232. Oleh karena itu ion molekul (M+) senyawa pada puncak 16 adalah m/z 232 dengan puncak dasar pada m/z 135. Pola pemenggalan spektrum massa senyawa puncak 16 seperti terlihat pada Tabel 6.10. Tabel 6.10 Kemungkinan fragmen yang hilang dari senyawa velleral.
No m/z Kemungkinan fragmen yang hilang
1 232 M+ 2 217 M+ - 15 -CH3. 3 4 189 147 M+ - 15-28 M+ - 15-28-42 -C2H4 -C2H2O A B
Berdasarkan berat molekul dan pola fragmentasi dari pendekatan WILEY229.LIB maka diduga senyawa puncak 16 identik denngan senyawa velleral yang strukturnya dapat dilihat pada Gambar 6.20
Gambar 6.20. Struktur senyawa velleral
Fragmentasi yang terjadi pada senyawa velleral sesuai dengan spektrum massa di atas dapat diperkirakan sebagai berikut
CH3 CH3 CH3 HC HC O O C H3 C H3 C H3 O = C H O = C H C H3 C H3 C H3 O = C H O = C H - C H3 -1 5 C H3 C H3 O = C H O = C H m / z 23 2 m / z 21 7 C H2 C H3 O = C H O = C H H H H H C C H2 C H3 O = C H O = C H H H H H - C2H4 -2 8 C H3 O = C H O = C H H m / z 1 8 9 C H2 O = C H O = C H H H C H2 H O = C H H O C H C H2 H O = C H H O C H C H H O = C H H O C H C2H3O -4 2 H O = C H H m /z 1 4 7