DETEKSI LIPID
AbstrakLipid atau lebih dikenal sebagai lemak, terdapat dalam banyak makanan. Kandungan lipid bisa diidentifikasi ada atau tidaknya dari suatu sampel menggunakan berbagai macam metode. Ekstraksi pelarut adalah cara mendeteksi lipid dengan memisahkan lipid
menggunakan pelarut organik. Ekstraksi Non Pelarut adalah ekstraksi lipid langsung dari sampelnya tanpa perlu melarutkan lipid dalam suatu zat organik. Metode instrumen adalah cara mendeteksi lipid menggunakan instrumen-instrumen laboratorium.
Kata kunci: Ekstraksi Pelarut, Batch Solvent Extraction, Semi-Continuous Solvent Extraction, Continuous Solvent Extraction, Accelerated Solvent Extraction, Supercritical Fluid Extraction, Babcock, Gerber, Titrasi, TLC, Lipid, Akrolein, Liebermann-Burchard, Salkowski.
Deteksi/Analisis Lipid berdasarkan Prinsip Fisikokimia(Analisis Kuantitatif)
Prinsip fisikokimia untuk karakteristik lipid digunakan untuk membedakan/memisahkan lipid dari komponen lain dalam makanan berdasarkan adalah kelarutannya dalam pelarut organik, immiscibility dengan air, karakteristik fisik (misalnya, kepadatan relatif rendah) dan spektroskopi. Teknik analisis berdasarkan prinsip-prinsip ini dapat dengan mudah dikategorikan menjadi tiga jenis: (A) ekstraksi pelarut; (B) ekstraksi non-pelarut dan (C) metode instrumental.
A. Ekstraksi Pelarut
Fakta bahwa lipid yang larut dalam pelarut organik, tetapi tidak larut dalam air, memberikan kemudahan bagi para analis makanan dengan metode yang memisahkan komponen lipid dalam makanan dari komponen yang terlarut dalam air, seperti protein, karbohidrat dan mineral. Bahkan, teknik ekstraksi pelarut adalah salah satu metode yang paling umum digunakan mengisolasi lipid dari makanan dan menentukan kadar lemak total makanan.
A. 1. Preparasi Sampel untuk Ekstraksi Pelarut
Penyusunan sampel untuk ekstraksi pelarut biasanya melibatkan beberapa langkah:
a) Pengeringan sampel. Hal ini diperlukan untuk sampel kering sebelum ekstraksi pelarut, karena banyak pelarut organik tidak dapat dengan mudah menembus ke makanan yang mengandung air, dan oleh karena itu ekstraksi akan menjadi tidak efisien.
b) Pengurangan ukuran partikel. Sampel kering biasanya digiling halus sebelum pelarut ekstraksi untuk menghasilkan sampel yang lebih homogen dan untuk meningkatkan luas permukaan lipid terkena pelarut. Grinding/penggilingan sering dilakukan pada suhu rendah untuk mengurangi kecenderungan untuk oksidasi lipid terjadi.
c) Hidrolisis asam. Beberapa makanan mengandung lipid yang kompleks dengan protein (lipoprotein) atau polisakarida (glikolipid). Untuk menentukan konsentrasi komponen ini diperlukan untuk melepas ikatan yang memegang lipid dan komponen non-lipid bersama-sama sebelum ekstraksi pelarut. Hidrolisis asam umumnya digunakan untuk melepaskan lipid terikat ke dalam bentuk mudah diekstrak, misalnya sampel dicerna oleh pemanasan selama 1 jam di hadapan asam HCl 3N.
d) Pemilihan pelarut. Pelarut yang ideal untuk ekstraksi lipid benar-benar akan mengekstrak semua komponen lipid dari makanan, sementara meninggalkan semua komponen lain di belakang. Dalam prakteknya, efisiensi ekstraksi pelarut tergantung pada polaritas lipid dibandingkan dengan polaritas pelarut. Lipid polar (seperti glikolipid atau fosfolipid) lebih larut dalam pelarut polar (seperti alkohol), dibandingkan dalam pelarut polar (seperti heksana). Di sisi lain, lipid
non-polar (seperti trigliserida) lebih larut dalam pelarut non-non-polar daripada yang non-polar. Fakta bahwa lipid yang berbeda memiliki polaritas yang berbeda berarti bahwa tidak mungkin untuk memilih pelarut organik tunggal untuk mengekstrak semua jenis lipid. Dengan demikian kadar lemak total yang ditentukan oleh ekstraksi pelarut tergantung pada sifat dari pelarut organik yang digunakan untuk melakukan ekstraksi. Kadar lemak total yang ditentukan dengan menggunakan satu pelarut mungkin berbeda dari yang ditentukan dengan menggunakan pelarut lain. Selain pertimbangan di atas, pelarut juga harus murah, memiliki titik didih yang relatif rendah (sehingga dapat dengan mudah dihilangkan dengan penguapan), tidak beracun dan tidak mudah terbakar (untuk alasan keamanan). Sulit untuk menemukan pelarut tunggal yang memenuhi semua persyaratan ini. Etil eter dan petroleum eter adalah pelarut yang paling umum digunakan, tetapi pentana dan heksana juga digunakan untuk beberapa makanan.
A.2. Batch Solvent Extraction
Metode ini didasarkan pada pencampuran sampel dan pelarut dalam wadah yang cocok, misalnya pada sebuah corong pemisah. Wadah dikocok dengan kuat sehingga pelarut organik dan fase cair mampu memisahkan (baik oleh gravitasi atau sentrifugasi). Fasa berair kemudian dituang, dan konsentrasi lipid dalam pelarut ditentukan oleh penguapan pelarut dan mengukur massa lemak yang tersisa dengan cara :
% Lipid = 100 ( Mlipid / Msample )
Prosedur ini mungkin harus diulang beberapa kali untuk meningkatkan efisiensi dari proses ekstraksi. Dalam hal ini fase berair akan menjalani ekstraksi lebih lanjut menggunakan pelarut baru, maka semua fraksi pelarut akan dikumpulkan bersama-sama dan berat lipid ditentukan setelah pelarut mengalami penguapan. Efisiensi ekstraksi jenis tertentu dari lipid oleh jenis tertentu dari pelarut dapat diukur oleh koefisien partisi kesetimbangan:
K = csolvent / caqueous
di mana csolvent dan caqueous adalah konsentrasi lipid dalam fase pelarut dan air, masing-masing. Semakin tinggi koefisien partisi maka proses ekstraksi semakin efisien.
A.3. Semi-Continuous Solvent Extraction
Metode ekstraksi pelarut semi-kontinyu biasanya digunakan untuk meningkatkan efisiensi ekstraksi lipid dari makanan. Metode Soxhlet adalah contoh yang paling umum digunakan metode semi- kontinyu. Dalam metode Soxhlet sampel dikeringkan, digiling menjadi partikel kecil dan ditempatkan di bidal berpori. Bidal ditempatkan dalam ruang ekstraksi, yang tergantung di atas labu mengandung pelarut dan di bawah kondensor. Labu dipanaskan untuk menguapkan pelarut dan pelarut bergerak naik ke kondensor di mana ia diubah menjadi cairan yang menetes ke dalam ruang ekstraksi yang mengandung sampel. Akhirnya, pelarut menumpuk di ruang ekstraksi dan benar-benar mengelilingi sampel. Ruang ekstraksi dirancang sehingga ketika pelarut sekitar sampel melebihi tingkat tertentu, meluap dan menetes kembali ke dalam labu didih. Sebagai pelarut melewati sampel itu ekstrak lipid dan membawa mereka ke dalam termos. Lipid kemudian tetap dalam labu karena volatilitasnya rendah. Pada akhir proses ekstraksi, yang biasanya berlangsung beberapa jam, di dalam labu terdapat pelarut dan lipid dihapus, pelarut diuapkan dan massa sisa lipid diukur (Mlipid). Persentase lipid dalam sampel awal (Msample) kemudian dapat dihitung
:
Sejumlah produsen alat telah merancang versi modifikasi dari metode Soxhlet yang dapat digunakan untuk menentukan kadar lemak total yang lebih mudah dan cepat (misalnya Soxtec).
A.4.Continuous Solvent Extraction
Metode Goldfish yang menjadi metode Continuous Solvent Extraction mirip dengan metode Soxhlet kecuali bahwa ruang ekstraksi dirancang sehingga pelarut hanya menetes melalui sampel. Hal ini mengurangi jumlah waktu yang diperlukan untuk melaksanakan ekstraksi, tetapi memiliki kelemahan bahwa penyaluran pelarut dapat terjadi, yaitu, pelarut dapat mengambil rute tertentu melalui sampel(kembali melarutkan sampel) dan karena itu ekstraksi tipe ini tidak efisien.
A.5.Accelerated Solvent Extraction
Efisiensi ekstraksi pelarut dapat ditingkatkan dengan melakukan ekstraksi pada suhu dan tekanan tinggi daripada yang biasanya digunakan. Efektivitas pelarut pada ekstraksi lipid dari makanan meningkat dengan meningkatnya suhu, tetapi tekanan juga harus ditingkatkan untuk menjaga pelarut dalam keadaan cair. Hal ini akan mengurangi jumlah pelarut yang diperlukan untuk melaksanakan analisis, yang bermanfaat dari sudut pandang biaya dan lingkungan. Instrumen khusus tersedia untuk melakukan ekstraksi pelarut pada temperatur tinggi dan tekanan.
A.6.Supercritical Fluid Extraction
Ekstraksi pelarut dapat dilakukan dengan menggunakan instrumen khusus yang menggunakan karbon dioksida superkritis (bukan cairan organik) sebagai pelarut. Instrumen ini menemukan penggunaan yang lebih besar karena masalah biaya dan lingkungan yang terkait dengan penggunaan dan pembuangan pelarut organik. Ketika CO2 yang
dikompres(compressed CO2) dipanaskan di atas suhu kritis tertentu itu menjadi fluida
superkritis, yang memiliki beberapa sifat dari gas dan beberapa cairan. Fakta bahwa fluida CO2 itu berperilaku seperti gas berarti bahwa hal itu dapat dengan mudah menembus ke
dalam sampel dan ekstrak lipid, sedangkan fakta bahwa compressed CO2 itu berperilaku seperti fluida berarti bahwa hal itu dapat melarutkan sejumlah besar lipid (terutama pada tekanan yang lebih tinggi).
CO2 mengekstrak lipid, dan membentuk lapisan pelarut yang terpisah, yang
dipisahkan dari komponen air. Tekanan dan suhu pelarut kemudian berkurang sehingga menyebabkan CO2 beralih ke gas, meninggalkan fraksi lipid yang tersisa. Kadar lemak
makanan ditentukan dengan menimbang persentase lipid yang diekstraksi dari sampel asli. B. Ekstraksi Non Pelarut
Sejumlah metode ekstraksi cair tidak bergantung pada pelarut organik, tetapi menggunakan bahan kimia lainnya untuk memisahkan lipid dari sisa makanan. Metode Babcock, Gerber, dan Deterjen adalah contoh metode ekstraksi non pelarut untuk menentukan kadar lemak susu dan beberapa produk susu lainnya.
B.1.Metode Babcock
Kunci untuk proses ini adalah bahwa segala sesuatu dalam susu kecuali lemak larut dalam asam sulfat. Lemak mengapung ke atas setelah zat-zat lain larut dalam asam sulfat. Centrifuge menjamin pemisahan lengkap tanpa gelembung lemak, dan kandungan lemak dapat diukur dengan menggunakan volume pada tabung reaksi untuk mengetahui jumlah
awal susu yang digunakan. Berikut adalah alat-bahan serta prosedur yang diperlukan untuk melaksanakan metode Babcock:
Alat dan Bahan
1. Centrifuge Babcock
2. Air hangat pada suhu 55°C
3. Torsi keseimbangan dengan 9 dan 18 g bobot. 4. Pengocok Babcock.
5. Glassware: botol susu 8%, 50% botol krim, 50% botol Paley, 17,5 ml silinder, dan pipet 17,6 ml
6 Reagen: - Asam Sulfat (sp. Gr 1,82-1,83.) - N-butil alkohol
- Glymol
Gambar 1. Alat Sentrifugasi untuk Metode Babcock(sumber: www.rs.ky.edu) Prosedur untuk Deteksi Lemak pada Susu
1 . Sample dinaikkan suhunya sampai 20°C dan campurkan dengan menuangkan secara perlahan dari wadah asli ke gelas dengan kapasitas yang sama 4-5 kali penuangan.
2 . Memindahkan 17,6 ml ( 18.0g ) susu sampai mengisi botol sebanyak 8 % dengan 17,6 ml pipet. Biarkan pipet untuk menguras kemudian meniup drop tersisa ke dalam botol. 3 . Tambahkan 17,5 ml asam sulfat ( sp. Gr . 1,82-1,83 ) dalam setidaknya tiga tahap menggunakan silinder khusus. Putar botol antara ibu jari dan jari sambil menambahkan asam untuk mencuci susu dari leher. Aduk minimal 2 menit setelah setiap penambahan asam dengan memindahkan bola dari botol dalam gerakan melingkar cepat. Warna akhir campuran harus cokelat .
4 . Masukkan sampel ke centrifuge selama 5 menit .
5 . Tambahkan air suling pada 60°C untuk membawa konten ke dalam satu - seperempat inci dari pangkal leher. Jangan dicampurkan.
6 . Sentrifugasi selama 2 menit.
7 . Tambahkan air 60°C pada lemak yang mengapung di leher botol 8 . Sentrifugasi selama 1 menit.
9 . Botol dihangatkan dalam wadah berisi air pada 55°C selama 5 menit .
10 . Ukur panjang kolom lemak dengan pembagi dari meniskus atas ke bawah meniskus yang lebih rendah. Tempatkan satu titik pembagi nol dan baca persentase lemak berat langsung di mana titik lain menyentuh skala.
B.2. Metode Gerber
Metode ini mirip dengan metode Babcock kecuali bahwa campuran asam sulfat dan isoamil alkohol, dan botol yang digunakan berbentuk sedikit berbeda. Metode ini lebih cepat dan lebih sederhana untuk dilaksanakan daripada metode Babcock. Alkohol Theisoamyl
digunakan untuk mencegah charring dari gula dan asam sulfat oleh panas yang dapat menjadi masalah dalam metode Babcock karena itu membuat sulit untuk membaca kandungan lemak. Metode ini digunakan terutama di Eropa, sementara metode Babcock digunakan terutama di Amerika Serikat. Sama dengan metode Babcock, metode ini tidak menentukan bisa menentukan lipid jenis fosfolipid. Lemak adalah fraksi massa zat ditentukan sesuai dengan prosedur ini dan dinyatakan sebagai persentase massa. Metode ini berlaku untuk susu mentah dan pasteurisasi.
Prinsip atau mekanisme uji dari metode Gerber ini adalah baik susu dan asam sulfat dicampur untuk menghasilkan reaksi eksotermis yang menghancurkan struktur emulsi dalam susu (yaitu asam menghasilkan panas yang diperlukan untuk menyelesaikan pencernaan bahan lemak non). Reaksi eksotermik kombinasi alkohol isoamil melepaskan lemak cair untuk pengukuran dan mencegah hangus/rusaknya lemak susu. Lemak yang telah dibebaskan dari susu dikumpulkan di bagian atas dari leher botol Gerber. Reaksi pada metode Gerber bisa dituliskan demikian:
* Asam Sulfat Gerber + sampel susu reaksi eksotermis dan pencernaan bahan non lemak padat
* Reaksi eksotermik + isoamil alkohol lemak susu yang cari dan mencegah hangus/rusaknya lemak
Prosedur Deteksi Lemak pada Susu dengan Metode Gerber
1. Tambahkan 10 ml asam sulfat Gerber: (berat jenis 1,823) pada 15-21°C ke Butyrometer. 2. Tambahkan 1ml isoamil alkohol dan memasukkan stopper kunci pegang botol uji pada kolom dan kocok sampai dadih sudah benar-benar dicerna.
3. Mengatur suhu sampel susu 22-21°C.
4. Memindahkan sampel susu 11ml untuk dicampur ke botol uji Gerber.
5. Tempatkan mereka dalam centrifuge Gerber lalu tutup centrifuge. Mengatur centrifuge sampai kecepatan 1500 rpm selama 5 menit.
B.3. Metode Detergent
Metode ini dikembangkan untuk mengatasi ketidaknyamanan dan kekhawatiran keamanan yang terkait dengan penggunaan asam yang sangat korosif. Sampel dicampur dengan kombinasi surfaktan dalam botol Babcock. Surfaktan menggantikan membran globul lemak yang mengelilingi tetesan emulsi dalam susu dan menyebabkan mereka untuk menyatu dan terpisah. Sampel disentrifugasi sehingga memungkinkan lemak untuk pindah ke leher botol, di mana konsentrasi kemudian dapat ditentukan.
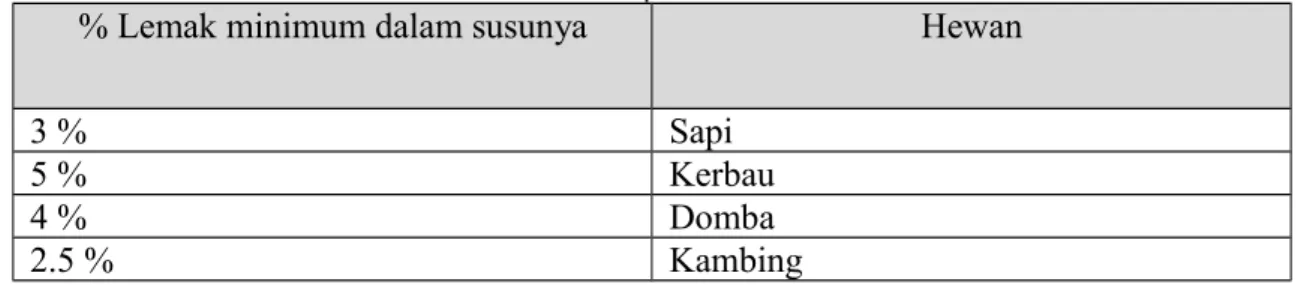
Tabel 1. Tabel Persentase Lemak pada Susu Hewan Tertentu
% Lemak minimum dalam susunya
Hewan
3 %
Sapi
5 %
Kerbau
4 %
Domba
2.5 %
Kambing
C. Metode Instrumental
Berbagai metode instrumental yang berbeda tersedia untuk menentukan kadar lemak total bahan makanan. Ini dapat dibagi menjadi tiga kategori yang berbeda sesuai dengan prinsip-prinsip fisikokimia mereka: (i) pengukuran sifat fisik massal, (ii) pengukuran adsorpsi radiasi, (iii) pengukuran hamburan radiasi, dan titrasi(iv). Setiap metode instrumental memiliki kelebihan dan kekurangan, dan berbagai makanan yang dapat diterapkan.
C.1. Pengukuran Sifat Fisik Massal
• Kepadatan/densitas: Kepadatan minyak cair kurang dari sebagian besar komponen makanan lainnya sehingga ada penurunan kepadatan makanan dengan meningkatnya kandungan lemaknya. Dengan demikian kadar lemak makanan dapat ditentukan dengan mengukur kepadatan mereka.
• Konduktivitas Listrik: Konduktivitas listrik dari lipid jauh lebih kecil dibandingkan dengan zat cair, sehingga konduktivitas makanan menurun seiring dengan meningkatnya konsentrasi lipid. Pengukuran konduktivitas listrik secara keseluruhan pada makanan dapat digunakan untuk menentukan isi lemak.
• Kecepatan ultrasonic: Kecepatan di mana gelombang ultrasonik berjalan melalui materi tergantung pada konsentrasi lemak dalam makanan. Dengan demikian kadar lemak dapat ditentukan dengan mengukur kecepatan ultrasoniknya. Teknik ini mampu berlangsung cepat, tanpa merusak lipid itu sendiri.
C.2. Pengukuran Adsorpsi dari Radiasi
• UV-Visible: Konsentrasi lipid tertentu dapat ditentukan dengan mengukur absorbansi radiasi ultraviolet - terlihat. Lipid biasanya harus diekstraksi dan dilarutkan dalam pelarut yang cocok sebelum analisis, sehingga teknik ini bisa sangat memakan waktu dan tenaga. • Infrared : Metode ini didasarkan pada absorbansi energi IR pada panjang gelombang 5,73 mm karena getaran molekul atau rotasi yang berhubungan dengan molekul lemak : semakin besar absorbansi hadir lebih banyak lemak. IR sangat berguna untuk analisis cepat dan on-line konten lipid sekali kurva kalibrasi yang sesuai telah dikembangkan.
• Nuclear Magnetic Resonance: spektroskopi NMR secara rutin digunakan untuk menentukan konsentrasi lipid total makanan. Isi lipid ditentukan dengan mengukur daerah di bawah puncak dalam NMR pergeseran kimia spektrum yang sesuai dengan fraksi lipid. Isi Lipid sering dapat ditentukan dalam beberapa detik tanpa perlu persiapan sampel menggunakan instrumen yang tersedia secara komersial.
• Penyerapan sinar-X : Daging tanpa lemak menyerap sinar - X lebih kuat daripada lemak , sehingga absorbansi X - ray menurun sebagai konsentrasi meningkat lipid. Instrumen komersial telah dikembangkan yang memanfaatkan fenomena ini untuk menentukan kadar lemak daging dan produk daging.
Gambar 2. Alat FTIR untuk deteksi senyawa organik(sumber:www.andersonmaterials.com) C.3. Pengukuran Hamburan Radiasi
• Hamburan cahaya: Konsentrasi tetesan minyak dalam emulsi makanan encer dapat ditentukan dengan menggunakan teknik hamburan cahaya karena kekeruhan emulsi berbanding lurus dengan konsentrasi tetesan minyak saat ini.
• Hamburan ultrasonic: Konsentrasi tetesan minyak dalam emulsi makanan terkonsentrasi dapat ditentukan dengan menggunakan teknik hamburan ultrasonik karena kecepatan ultrasonik dan penyerapan USG oleh emulsi berkaitan dengan konsentrasi tetesan minyak saat ini.
Sejumlah metode ini berperan memiliki kelebihan utama dibandingkan teknik ekstraksi yang disebutkan di atas karena mereka tak rusak, memerlukan sedikit atau tidak ada persiapan sampel, dan pengukuran biasanya cepat, tepat dan sederhana.
Kelemahan utama dari teknik yang mengandalkan pengukuran sifat fisik sebagian besar makanan adalah bahwa kurva kalibrasi harus dipersiapkan antara sifat fisik dari bunga dan kadar lemak total, dan ini mungkin tergantung pada jenis lipid hadir dan makanan matriks yang termuat masuk Selain itu, teknik ini hanya dapat digunakan untuk menganalisis makanan dengan komposisi yang relatif sederhana. Dalam makanan yang mengandung banyak komponen yang berbeda yang konsentrasi dapat bervariasi, sulit untuk menguraikan kontribusi yang gemuk membuat untuk pengukuran keseluruhan dari yang dari komponen lainnya.
C.4. Titrasi
Deteksi atau analisis lipid secara kuantitatif dapat dilakukan dengan metode titrasi. Titrasi dilakukan dengan berbagai macam cara(zat pentiter) untuk mentitrasi lipid. Titrasi yang digunakan antara lain menggunkan iodin, agen pengoksidasi, asam, peroksida, dan agen penyabunan.
C.4.1. Titrasi Lipid dengan Iodin
Nilai Iodine (IV) memberikan ukuran tingkat rata-rata jenuh dari lipid: semakin tinggi nilai iodium, semakin besar jumlah ikatan rangkap C = C. Menurut definisi nilai iodine dinyatakan sebagai gram iodium yang diserap per 100g lipid. Salah satu metode yang paling umum digunakan untuk menentukan nilai iodine lipid adalah "metode Wijs". Lipid yang akan dianalisis ditimbang dan dilarutkan dalam pelarut organik yang sesuai, yang lebih dikenal sebagai Iodium Klorida. Beberapa ICL bereaksi dengan ikatan ganda dalam lipid tak jenuh, sedangkan sisanya tetap:
R-CH=CH-R + IClexcess R-CHI-CHCl-R + IClremaining
Jumlah ICL yang telah bereaksi ditentukan dengan mengukur jumlah ICL yang tersisa setelah reaksi telah selesai (IClreacted = IClexcess - IClremaining). Jumlah ICL yang tersisa ditentukan dengan menambahkan kelebihan kalium iodida ke dalam larutan untuk membebaskan iodine, dan kemudian titrasi dengan larutan natrium tiosulfat (Na2S2O3) dari
zat pati yang ada untuk menentukan konsentrasi iodine yang dihasilkan: IClremaining + 2KI KCl + KI + I2
I2 + Zat Pati + 2Na2S2O3 (biru) 2NaI + starch + Na2S4O6(tak berwarna)
Iodine sendiri memiliki warna coklat kemerahan, tetapi hal ini sering tidak cukup kuat untuk digunakan sebagai indikasi yang baik dari titik akhir reaksi. Untuk alasan ini, pati biasanya digunakan sebagai indikator karena membentuk molekul kompleks dengan iodine yang memiliki warna biru tua. Awalnya, pati ditambahkan ke dalam larutan yang mengandung iodine dan larutan berubah warna menjadi biru tua. Lalu, larutan tersebut dititrasi dengan larutan Natrium Tiosulfat dengan molaritas yang telah ditentukan. Sementara I2 yang tersisa
dalam larutan tetap biru, tetapi setelah semua I2 dikonversi ke I-, ternyata larutan tidak
menghasilkan warna. Dengan demikian, perubahan warna larutan dari biru menjadi tidak berwarna dapat digunakan sebagai titik akhir titrasi.
Gambar 3. Warna coklat yang menunjukkan keberadaan iodin pada sampel lipid
C.4.2. Titrasi Lipid dengan Agen Pengoksidasi
Oksidasi lipid tergantung pada reaksi antara asam lemak tak jenuh dan oksigen. Sangat mungkin untuk memantau tingkat di mana itu terjadi dengan mengukur penyerapan oksigen oleh sampel sebagai hasil reaksi. Biasanya, lipid ditempatkan dalam wadah tertutup dan jumlah oksigen yang harus masukan ke dalam wadah untuk menjaga konsentrasi oksigen di kepala-ruang di atas sampel konstan diukur. Semakin banyak oksigen yang harus dimasukkan ke dalam wadah, semakin cepat laju oksidasi lipid. Oleh karena itu, teknik ini adalah contoh dari pengukuran pengurangan konsentrasi reaktan.
C.4.3. Titrasi Lipid Menggunakan Asam
Titrasi Lipid menggunakan Asam mendasarkan perolehan data pada nilai asam. Nilai asam adalah ukuran dari jumlah asam bebas yang hadir dalam jumlah tertentu lemak. Lipid yang diambil dari sampel makanan dan kemudian dilarutkan dalam larutan etanol yang mengandung indikator. Larutan ini kemudian dititrasi dengan alkali (KOH) sampai warna merah muda muncul. Nilai asam didefinisikan sebagai mg KOH yang diperlukan untuk menetralkan asam lemak yang muncul dalam 1 gram lipid. Nilai asam dapat berlebihan jika komponen asam lainnya hadir dalam sistem, misalnya asam amino atau asam fosfat. Nilai asam sering menjadi ukuran yang baik dari penguraian triacylglycerol menjadi asam lemak bebas.
C.4.4. Titrasi Lipid dengan Peroksida
Peroksida (R-OOH) adalah produk reaksi primer yang terbentuk pada tahap awal oksidasi, dan karena itu memberikan indikasi kemajuan oksidasi lipid. Salah satu metode yang paling umum digunakan untuk menentukan nilai peroksida adalah dengan memanfaatkan kemampuan peroksida untuk membebaskan Iodine dari Kalium Iodida(KI). Lipid dilarutkan dalam pelarut organik yang sesuai dan kelebihan KI ditambahkan sehingga timbul reaksi:
ROOH + KIberlebih ROH + KOH + I2
Setelah reaksi telah selesai, jumlah ROOH yang telah bereaksi dapat ditentukan dengan mengukur jumlah Iodine yang terbentuk. Hal ini dilakukan dengan titrasi dengan natrium tiosulfat dan indikator pati, reaksi sebagai berikut:
I2 + Zat Pati + 2Na2S2O3 (biru) 2NaI + Zat Pati + Na2S4O6(tak berwarna)
Jumlah natrium tiosulfat yang dibutuhkan untuk reaksi titrasi berhubungan dengan konsentrasi peroksida dalam sampel asli (seperti yang dijelaskan sebelumnya untuk nilai iodine). Ada beberapa masalah dengan penggunaan nilai peroksida sebagai indikasi oksidasi lipid. Pertama, peroksida adalah produk utama yang dipecah dalam tahap terakhir dari oksidasi lipid. Dengan demikian, nilai yang rendah dari PV dapat mewakili baik tahap awal atau akhir dari oksidasi. Kedua, hasil dari prosedur sangat sensitif terhadap kondisi
yang digunakan untuk melakukan percobaan, dan jadi tes harus selalu standar. Teknik ini adalah contoh dari pengukuran peningkatan konsentrasi produk reaksi primer.
C.4.5. Titrasi Lipid Menggunakan Agen Penyabunan(Saponifikasi)
Nilai saponifikasi adalah ukuran berat molekul rata-rata trigliserida dalam sampel. Saponifikasi adalah proses penguraian lemak netral menjadi gliserol dan asam lemak dengan ditambahkan alkali sehingga timbul reaksi sebagai berikut:
Triacylglycerol + 3 KOH Glycerol + 3 Garam Asam Lemak dengan Kalium
Nilai saponifikasi didefinisikan sebagai mg KOH yang dibutuhkan untuk mengurai satu gram lemak. Lipid ini pertama diekstraksi dan kemudian dilarutkan dalam larutan etanol yang mengandung KOH. Solusi ini kemudian dipanaskan sehingga reaksi berjalan sampai selesai. KOH yang bereaksi kemudian ditentukan dengan menambahkan indikator dan titrasi sampel dengan HCl. Jumlah saponifikasi kemudian dihitung dari berat sampel dan jumlah KOH yang bereaksi. Semakin kecil angka penyabunan maka semakin besar berat molekul rata-rata dari trigliserida yang dihasilkan.
C.5. Separasi dan Analisis Lipid secara Kromatografi
Kromatografi adalah salah satu prosedur analitis yang paling kuat untuk memisahkan dan menganalisis sifat-sifat lipid, terutama bila dikombinasikan dengan teknik yang dapat digunakan untuk mengidentifikasi struktur kimia dari puncak, misalnya, spektrometri massa atau NMR. Sebuah analisis kromatografi melibatkan melewati campuran molekul untuk dipisahkan melalui kolom yang berisi matriks yang mampu selektif menghambat aliran molekul. Molekul dalam campuran dipisahkan karena afinitas yang berbeda-beda mereka untuk matriks dalam kolom. Semakin kuat afinitas antara molekul spesifik dan matriks, semakin pergerakannya terhamba , dan lambat melewati kolom. Dengan demikian molekul yang berbeda dapat dipisahkan atas dasar kekuatan interaksi mereka dengan matriks.
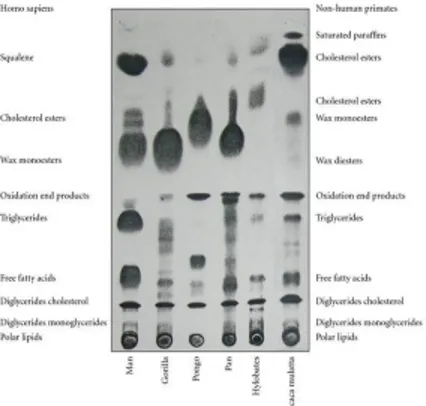
Gambar 4. Hasil Kromatografi Pemisahan Lipid(sumber: hindawi.com)
Setelah dipisahkan dengan kolom, konsentrasi dari masing-masing molekul ditentukan saat melewati detektor yang sesuai (misalnya ,UV-visible, fluoresensi, atau ionisasi nyala). Kromatografi dapat digunakan untuk menentukan profil lengkap molekul hadir dalam lipid. Informasi ini dapat digunakan untuk : menghitung jumlah jenuh, tak jenuh, lemak tak jenuh ganda dan kolesterol; tingkat oksidasi lipid; tingkat panas atau radiasi kerusakan; mendeteksi pemalsuan; menentukan adanya antioksidan. Berbagai bentuk kromatografi yang tersedia untuk menganalisis lipid dalam makanan, misalnya kromatografi lapis tipis (TLC), kromatografi gas (GC), dan kromatografi cair tekanan tinggi (HPLC).
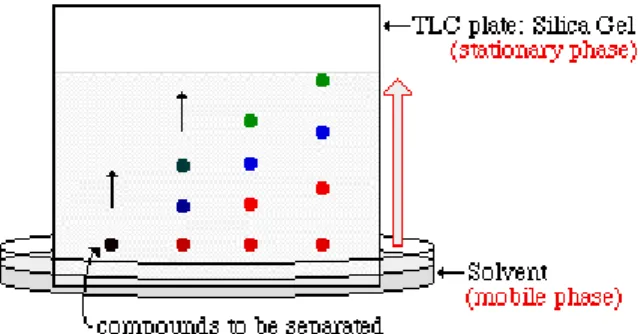
TLC digunakan terutama untuk memisahkan dan menentukan konsentrasi dari berbagai jenis kelompok lipid dalam makanan, misalnya trigliserida, diacylglycerols, monoacylglycerols, kolesterol, kolesterol dan fosfolipid oksida. Sebuah pelat TLC dilapisi dengan bahan yang menyerap cocok dan ditempatkan ke dalam pelarut yang sesuai. Sejumlah kecil sampel lipid yang akan dianalisis adalah melihat ke piring TLC. Dengan waktu pelarut bergerak naik piring karena gaya kapiler dan memisahkan fraksi lipid yang berbeda atas dasar afinitas mereka untuk bahan yang menyerap.
Gambar 5. Thin layer chromatography untuk lipid(sumber: www.aquaculture.ugent.be)
Pada akhir pemisahan piring disemprot dengan pewarna sehingga membuat tempat yang terlihat. Dengan membandingkan jarak yang tempat bergerak dengan standar komposisi dikenal adalah mungkin untuk mengidentifikasi lipid hadir. Spots dapat dikerok dan dianalisis lebih lanjut menggunakan teknik, seperti GC, NMR atau spektrometri massa. Prosedur ini murah dan memungkinkan analisis cepat lipid dalam makanan berlemak.
C.5.2. Asam Lemak Metil Ester dengan GC
Trigliserida utuh dan asam lemak bebas yang tidak mudah menguap dan karena itu sulit untuk menganalisis menggunakan GC (yang mensyaratkan bahwa lipid mampu menjadi volatil dalam instrumen tersebut). Trigliserida pertama kali disaponifikasi yang memecah mereka ke gliserol dan asam lemak bebas, dan kemudian alkohol.
Triacylglycerol Fatty acid methyl esters (FAMEs) + methylated glycerol Saponifikasi mengurangi berat molekul dan metilasi mengurangi polaritas, yang keduanya meningkatkan volatilitas lipid. Konsentrasi yang berbeda ester asam lemak volatil metil (FAMEs) hadir dalam sampel ini kemudian dianalisa dengan GC. FAMEs dilarutkan dalam pelarut organik yang sesuai yang kemudian disuntikkan ke dalam ruang injeksi GC. Sampel dipanaskan dalam ruang injeksi untuk menguapkan FAMEs dan kemudian dibawa ke dalam kolom pemisahan dengan gas pembawa dipanaskan. FAMEs melewati kolom dan dipisahkan menjadi beberapa puncak didasarkan pada perbedaan berat molekul dan polaritas, yang dihitung menggunakan detektor yang cocok. Penentuan profil jumlah asam lemak memungkinkan seseorang untuk menghitung jenis dan konsentrasi asam lemak hadir dalam sampel lipid asli.
D. Deteksi dan Analisis Lipid secara Kualitatif D.1. Uji Akrolein
Uji akrolein adalah suatu uji untuk menentukan ada/tidaknya kandungan lemak/gliserin dalam suatu sampel. Prinsip dari uji ini adalah ketika lipid dipanaskan pada suhu tinggi dengan agen pendehidrasi seperti KHSO, maka gliserol dari molekul lipid akan terdehidrasi membentuk aldehid tak jenuh(akrolein dengan rumus molekul( CH2=CH-CHO).
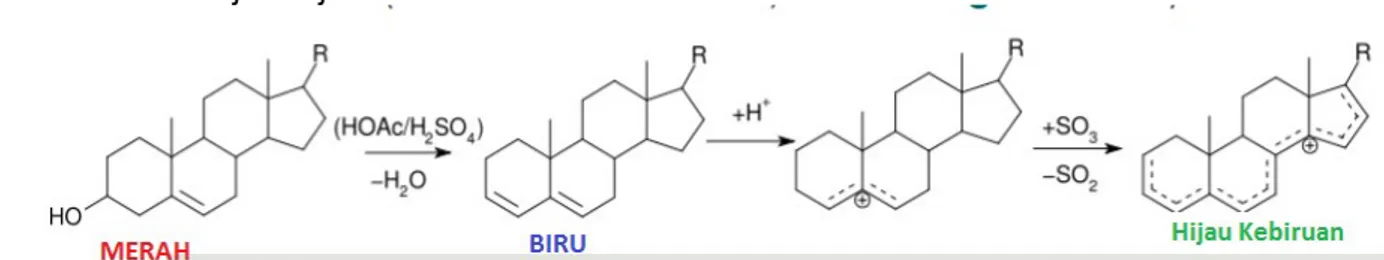
Gambar 6. Reaksi yang terjadi pada uji akrolein(sumber:http://fac.ksu.edu.sa/) D.2. Uji Liebermann-Burchard
Uji Liebermann-Burchard adalah uji untuk mendeteksi kandungan kolesterol. Kolesterol direaksikan sebagai alkohol dengan asam kuat sehingga menghasilkan produk berwarna. Anhidrida Asetat digunakan sebagai pelarut dan agen pendehidrasi. Asam sulfat digunakan sebagai agen pengoksidasi dan agen pendehidrasi. Hasil positif terdapat kolesterol ditunjukkan dengan warna merah dari reaktan yang berubah menjadi biru, lalu berubah menjadi hijau kebiruan.
Gambar 7. Reaksi dan warna yang ditimbulkan dari Uji Liebermann-Burchard(sumber: :
http://fac.ksu.edu.sa/) D.3. Uji Ketidak Jenuhan
Uji ini bertujuan untuk mendeteksi ikatan rangkap pada suatu sampel yang mengandung lipid. Pada umumnya, lipid/lemak terdiri dari gliserin dan asam lemak lainnya. Lemak yang memiliki ikatan rangkap akan menjadi lemak jenuh(membongkar ikatan rangkap) jika berikatan dengan iodin. Semakin banyak iodin yang diikat, menunjukkan bahwa ikatan rangkap(asam lemak tak jenuh) dari suatu sampel lemak semakin banyak.
Gambar 8. Reaksi asam lemak tak jenuh dengan Iodine(sumber: http://fac.ksu.edu.sa/) D.4. Uji Salkowski
Uji Salkowski adalah uji kolesterol menggunakan chloroform dan H2SO4. Warna
kuning hingga merah bata yang ditimbulkan setelah penambahan chloroform dan H2SO4 ke
sampel menunjukkan bahwa sampel tersebut mengandung kolesterol. Kesimpulan
Lipid yang terkandung dalam sampel makanan dapat diuji dengan beragai macam cara. Ekstraksi pelarut berarti lipid dipisahkan dengan pelarut organik dari sampel yang ada. Ekstraksi non pelarut berarti memisahkan lipid tanpa harus mengikatnya dengan pelarut. Metode instrumen bisa digunakan untuk mendeteksi ada/tidaknya lipid dalam suatu sampe makanan menggunakan peralatan laboratorium. Uji dengan instrumen bisa dilakukan dengan FTIR, GCMS, HPLC, juga dengan pemisahan kromatografi oleh TLC. Uji kualitatif bisa juga dilakukan untuk mendeteksi lipid tanpa perlu mengetahui berapa jumlah kandungannya. Uji kualitatif dapat dilakukan dengan metode uji Akrolein, Liebermann-Burchard, Uji Ketidak Jenuhan, dan Uji Salkowski. Setiap jenis metode dari uji kualitatif menunjukkan indikator adanya kandungan lemak(asam lemak/kolesterol/gliserin) dengan perubahan warna.
Karp. 2010. Cell and Molecular Biology 6th Edition. USA: John Wiley&Sons Inc. Lehninger. Principles of Biochemistry 5th Edition. USA: WH Freeman and Company
http://fac.ksu.edu.sa/sites/default/files/Qualitative%20test%20of%20Lipids%20II.pdf diakses pada 20 April 2014
http://people.umass.edu/~mcclemen/581Lipids.html diakses pada 21 April 2014
http://shodhganga.inflibnet.ac.in/bitstream/10603/6935/12/12_appendix.pdf diakses pada 21 April 2014