M I L DAN PEMBAHASAN
Percobaan
L
EvaluasiKeefelrtifan
Formuhsi Bakteri BiokontroI dan Identifikasi Senyawa Penghambst terhadap Penyakit PustulBakteri
L1.
bohsi
dan IdentifikasiPen
ye bab
PustulKedelai
IsoIasi
patogen
dari
potongandam
tanamankedelai
berumur35
HST yang kgejalapustul
(@a medium agar Yeast Dextrose Carbonate)dan
h i 1uji
ptogenisitasd e u p
metode bioasar'kotiledon kedelai
(Gambar 3) menunjubnpen*
pustd
adalah bakteri
X.
a. pv. glycines. Isolasi m e m p b h sahis&
. .
F.2:5&
. . . --
- 'b.! K . . , i 4 . . -- - - + , p-
LC-,,---
g-:.
-- . --------
r m c--
a _
I - ! C-1
-&&
@: .-
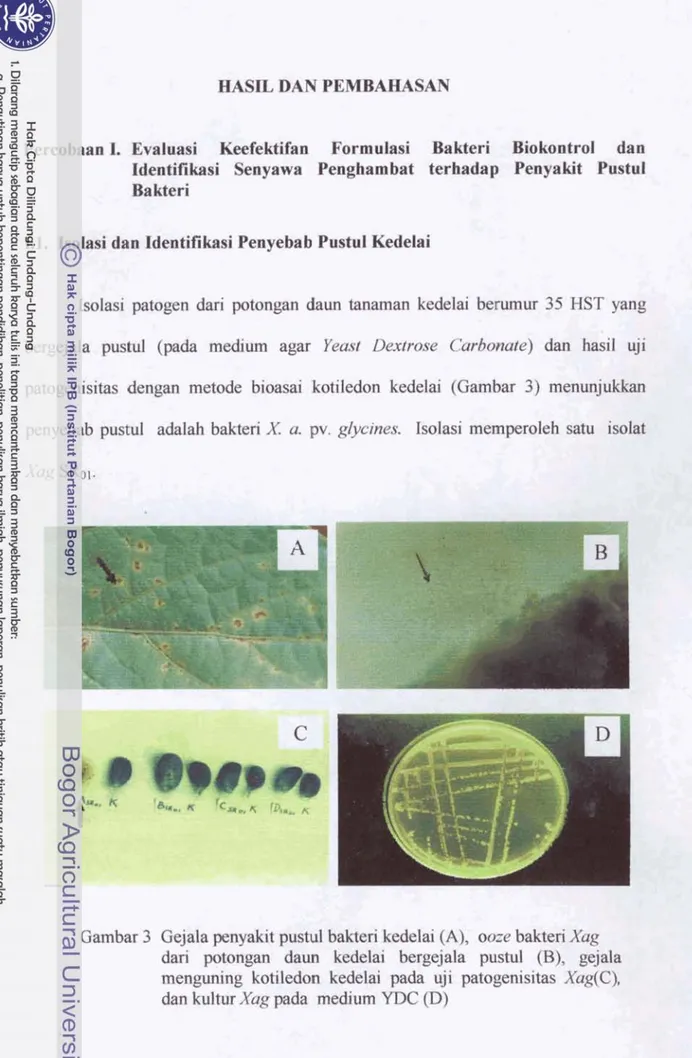
Gambar 3 Gejala penyakit pustul bakhi
kedelai
(A), oozebakteri
Xagdari
p o t o n edam
kedelai
bergejala pustul (B), gejda menguningkotiledon
kedelai
pada uji patogenisitasXuAC),
dan
kultur Xag pada medium YDC @)L2. b o h i
danIdentititikasi
Bakteri Calon BiokontroIHasil
isolasi
dm
identifikasi
bakteri
d o n
biobntrol
dari
rizbsfer tanaman
kedelai
menghasikan
8iwlat W
bewarm
kuaing kehijaum
ymg berpendardi
hwah
h p uultraviolet
(pmjang gelombang 266nm)
dan
2
isolat
bakteri berwama putih. &hjuhya 8isalat
h k r i berwamakuning
kehijauan
dibiakkan
ddam
medium selektif-
K&s
B
dan
2 isolat
W t m i b w a m putihdibiakkan
dalam
agardamh 0,4
% (Gambar 4).Sepuluh
isolat
bakteri
dari rizosfer
kedelai
h s m a -sama
den-
20isoIat
bakteri
yangdiisolasi
dwi
rizosfer tomat diujisifat
fisik
clan
k h b y a .
-bar
4Koloni
bdcterip d a
medium
agar
dmah
0,4 % (A),koloai
bdckriberwama
kuning kehijauan pada medium agar King'sB
@)Diantam isulat balrteri
be-
putih yangd i i i a k h
dalamagardarah 0,4 %tedapt
isolatBBOl
yangmembentuk
zone bening
di
sekelilhg
koloni.
P m t a n t e k h ppembentukan
zone
bening
merupakm &kt&
identi-
cepat
yaagd i g m a h
uutuk
mendeteksi k e ~ ~ ~ p u 8 nbakteri memproduksi
bomfabm
Telolik
i d e n t i h i
cept yangd i g u d m ini adalah metode Mulligan
dan
Gibbs
(1 993) yang meneliti surfaktin (diproduksi oleh B. subtilis ATCC-2 1332). Surfaktin merupakan biosurfaktan lipopeptida siklik yang melisis sel darah merah
Identifikasi isolat bakteri calon biokontrol yang benvarna putih berdasarkan uji karakteristik fisik kimianya (Leary dan Chun 1988, Cowan 1974) menunjukkan bahwa isolat SBOl, SB02, dan BBOl adalah bakteri B.subtilis. Karakteristik fisik kimia yang diperoleh antara lain Gram positif, sel berbentuk batang, endospora pada sentral sel, penggunaan sitrat sebagai sumber karbon, hidrolisis pati, produksi asentoin, dan pembentukan asam dari silosa, manitol, dan arabinosa.
Isolat bakteri calon biokontrol benvarna kuning bersifat Gram negatif, berfluoresensi pada medium King's B, memproduksi asam dari produk akhlr fermentasi galaktosa, arabinosa, trehalosa, sorbitol, dan inositol serta mencairkan gelatin (Hildebrand 1988) menunjukkan bahwa isolat GI 1 1-44, SL 0 1-08, C3 14-3 17 adalah P. .fluorescens. Beberapa hasil uji sifat fisik kimia bakteri biokontrol disajikan pada Lampiran 2.
1.3. Pengujian Inaktivasi Xag oleh Filtrat dan Suspensi Bakteri Calon Biokontrol
Kemampuan inaktivasi Xug oleh bakteri calon biokontrol ditunjukkan dengan terbentuknya zone inaktivasi berupa daerah bening di sekeliling bakteri calon biokontrol. Hasil uji antagonisme bakteri calon biokontrol terhadap Xug menunjukkan bahwa belum terbentuk zone inaktivasi 6 jam setelah inkubasi (jsi). Zone inaktivasi terbentuk 24 jsi pada inaktivasi oleh filtrat bakteri calon biokontrol atau 48 jsi pada inaktivasi oleh sel bakteri calon biokontrol. Gambar 5 menunjukkan
p e m b m t u h zone hktivasi p d a
waktu inkubasi
ymgb e r m
yaitu 24 jsi untukzone
bktivasi
yangdibentuk
oleh
film dan
48 jsi untuk zone W v &oleh
suspensi bakteri
d o n
biokontrol.
Giimbar
5Ti&
tdmtuk
mne hktivasi
Xag
oleh suspensi sel
bakteri.
biokdmI
6 jsi(A),
zone hktivasiXag
oleh suspensi
bakteribiokontrol
48j&
(B),
zone ~ v w s i
Xag01eh filtmt
bakteribiokontfol24 jsi.
@isolat
PfG134,
isolstBs
BBOI,
")isolat
Pf
43119, *)isolat
Pf
-3, ') M a i r d e s t i l a t aPerklam
wstktu prigdiperlukan
untuk pembenhtkan zone
iddivasi oleh
film
atau
sel
hakterid o n bio-1
bergan-
kepada
waktu ymgdiperlukan
untuk fhse
tumbub
W
d mbiokdml.
Menurut
Suolstuti (1998), prtumbuhan &rciIImspp.
dimulai pdah e
a d a m
(fase
lag) yang merupakanpenvesuaian
ba.kteri
khdqproses
perphdahanke
medium
tumbuh
buuWaktu yang
diperlukan bakteri
untuk fase
adaptasi berkisar 6bhgga I2
jsipula
suhu
inkubasi
2 f C. Fase Iogaritmik atauekspensial
menrpakaa
fapep t m b u h a n
sel W t e r i
yang memerlukan nutrisi tinggidalam
substrat. Waktup g
diperlukan bakteri
u t u kmelavati fhse
eksponensial b e r k
aa~ara12 hinm
30 jsi.Fase deselarasi dan stasioner merupakan fase penurunan jumlah populasi yang berkisar 33 hingga 72 jsi. Pada fase stasioner, bakteri membentuk metabolit yang dapat menghambat perturnbuhan mikroorganisme lain. Bakteri P. JIuorescens memerlukan waktu 3 hingga 6 jsi untuk fase lag, 9 hingga 24 jsi untuk fase eksponensial, dan 30 hingga 48 jsi untuk fase stasioner.
Berdasarkan perkembangan persen inaktivasi selama 10 hari inkubasi maka diantara isolat bakteri calon biokontrol(10 isolat diisolasi dari pertanaman kedelai, 20 isolat dari pertanaman tomat, dan 1 isolat dari laboratorium FMIPA IPB asal daun kedelai) yang diuji melalui filtrat dan suspensi menunjukkan bahwa kemampuan inaktivasi Xug tertinggi dimiliki oleh P. fluorescens GI 34 dan B. subtilis BBO 1.
Inaktivasi Xug oleh filtrat bakteri lebih cepat terbentuk dibandingkan dengan inaktivasi oleh suspensi bakteri P. fluorescens GI 34 maupun B. subtilis BBO 1 . Zone inaktivasi Xug oleh filtrat bakteri terbentuk pada 1 hari inkubasi, sedangkan oleh suspensi bakteri pada 2 hari inkubasi. Waktu yang digunakan oleh filtrat bakteri calon biokontrol untuk berdifusi ke dalam agar lebih singkat dibandingkan dengan waktu yang digunakan untuk difusi metabolit toksik yang diproduksi langsung dari sel bakteri calon biokontrol. Gambar 6 menunjukkan bahwa persen inaktivasi Xug yang ditunjukkan oleh pertambahan diameter zone inaktivasi yang disebabkan oleh filtrat bakteri biokontrol PfGI34 maupun Bs BBOl berlangsung 1 hingga 4 hari inkubasi.
Ombar
6 Persen inaktiwiXug
yang diimmkoleh film
m q msmpui
bdcteribiokonlml.
h t m m p :GU4
=Pf
GiI34, BBO I=
Bs
BBO 1,
dan B29
=PfB29
.
Wektu
& g u n a h
oleh
film
belded
lmtukm-w
Xag
lebih
singkst
d
i
dmgan
suppeasi~
sel
beLteri
~
(2
hiaBga
lObari hkuWi).
F@$at&
* b iI
bakteri calon
biokmtmI
yrengdalam
Ldas
c&tm~ lm
m
kdifwi
ke
Zone
Wmi
Xag
yang d i ioIeh
sel
bakterid o n
biokmtd
Iebib
lamb&
d i b a d h q hd e n p
yangdibentuk
oleh
fiIm bakteri.Sel
W
masih
memerIukm
waktu
tmtuk
penyestmian hidupterlebih
dahulu
p d a
kern
cakram
yang..
d u d b h d m
dab medium agar. B&ribiokontrol
yang tejerappath
katas
d m m
dm
dihkstasilran dalammedium agar
YDC memperoleh nutrisi dari mediumYDC. Setelah 1 hingga 3 hari infestasi, bakteri calon biokontrol memproduksi metabolit toksik yang didifusikan ke dalam agar YDC.
Suastuti (1998) menyatakan bahwa waktu yang diperlukan oleh bakteri Bacillus spp. maupun Pseudomonas spp. melewati fase pertumbuhan berkisar antara 33 hingga 72 jsi. Pada akhir fase eksponensial, bakteri memproduksi metabolit yang berguna untuk pertahanan diri bakteri produsen, tetapi toksik terhadap bakteri lain. Informasi ini menjelaskan mekanisme metabolit toksik yang diproduksi oleh bakteri Pf GI34 maupun Bs BBOl yang mematikan bakteri Xug yang telah diinfestasikan pada medium YDC 4 jam sebelumnya.
Menurut Goto (1992), antibiotik, lisosim, dan metabolit toksik yang diproduksi oleh bakteri biokontrol merupakan mekanisme antagonisme terhadap bakteri lain. Metabolit yang dihasilkan oleh bakteri tidak toksik terhadap bakteri produsen karena metabolit tersebut merupakan mekanisme untuk mempertahankan diri. Metabolit toksik diantaranya biosurfaktan, hidrogen sianida, dan siderofor. Menurut Hommel dan Ratledge (1993) serta Desai dan Desai (1993), biosurfaktan yang merupakan substansi protein bersifat toksik terhadap mikroorganisme lain. Matzanke (199 1) menyatakan bahwa kromoforpeptida siderofor yang diproduksi oleh Pseudomonas spp. merupakan senyawa Tris N metilformohidroksamat yang toksik terhadap bakteri maupun cendawan.
1.4. Analisis Senyawa Inaktivasi Xag dalam Filtrat Bakteri Biokontrol
Identifikasi senyawa inaktivasi Xag dalam filtrat bakteri B. subtilis BBO 1 menunjukkan terdapat senyawa mirip dengan surfaktin pada filtrat tersebut. Biosurfaktan yang dihasilkan oleh B. subtilis BBOl dibandingkan dengan 100 ppm surfaktin (produksi B. subtilis ATCC-2 1332, Sigma Laboratories). Gambar 7 menunjukkan bahwa surfaktin standar (produksi B. subtilis ATCC-2 1332) 100 ppm terdeteksi pada 5 puncak absorbansi dengan waktu retensi 6,04, 7,85, 10,77, 1 1,82, dan 14,70 menit.
Tiga puncak absorbansi surfaktin standar dominan pada waktu retensi antara 7 hingga 11 menit. Demikian juga isolat bakteri BBOl menunjukkan 5 puncak absorbansi dengan waktu retensi 4,38, 6,28, 7,66, 9,46, dan 10,53 menit. Tiga puncak absorbansi dominan terdeteksi pada waktu retensi antara 6 sampai 1 1 menit.
Analisis surfaktin dengan metode kromatografi cair bertekanan tinggi menggunakan kolom ODs-5 serta eluen asetonitril dan asam asetat, menurut Lin et al. (1993) menunjukkan 5 puncak absorbansi dan 3 diantaranya dominan dengan waktu retensi antara 6 hingga 15 menit. Desai dan Desai (1993) menyatakan bahwa surfaktin yang terdeteksi pada puncak absorbansi dengan waktu retensi antara 6 hingga 15 menit tergolong lipopeptida siklik.
. .
- A .
%unbar
7
Absorbansi y a n g m t m n j m
s w f d h
dslsm
film
B. subttlfki&@21332
(A),
a h b i
y m g m e m m j ~ s w f a k t h ~
filtratB. srrbtilisBBO
1 (B),&sorbansi
film
P*
fltdo~mcemGI34
yangti&
mengandung
surfalrtin
(C),
absorbami
f 3 h tP.
f l u o r a m
SLO3 yangti&
mengandung surfbktin (D). =absorbansi
swfikh
Kemiripan absorbansi surfaktin BBO 1 dengan B. subtilis ATCC-2 1332 mengindikasikan bahwa surfaktin dalam filtrat BBOl kemungkinan berupa lipopeptida yang sama dengan surfaktin B. subtilis ATCC-2 1332. Menurut Desai dan Desai (1993), struktur serta sifat fisik kimia surfaktin yang diproduksi oleh B. subtilis ATCC-2 1332 sama dengan surfaktin yang diproduksi B. subtilis QMB atau likenisin yang diproduksi oleh R. lichenlformis JFz atau BL 86. Dengan menggunakan metode kromatografi cair bertekanan tinggi, ketiga senyawa biosurfaktan dilaporkan terdeteksi dalam puncak absorbansi dengan waktu retensi yang berdekatan.
Senyawa surfaktin yang terdeteksi dalarn filtrat B. subtilis BBO 1 mirip dengan surfaktin R. subtilis ATCC-21322. Tidak demikian halnya dengan filtrat P. fluorescens GI 34 dan SL03 Filtrat bakteri P. Jluorescens GI 34 dan SL03 menunjukkan tidak ada absorbansi senyawa surfaktin yang mirip senyawa standar yang diproduksi B. subtilis ATCC-2 1322. Hal ini mengindikasikan bahwa biosurfaktan yang dihasilkan P. Jluorescens GI 34 dan SL 03 bukan surfaktin dan bukan lipopeptida seperti standar yang digunakan.
Dengan menggunakan uji kromatografi terhadap P. fluorescens GI34 dan SL03 tidak dapat ditunjukkan absorbansi senyawa surfaktin, tetapi dengan menggunakan metode pengukuran tegangan permukaan diindikasikan terdapat penurunan tegangan permukaan formulasi cair bakteri P. fluorescens GI34. Cooper dan Zajic (1980) menyatakan bahwa teknik pemantauan biosurfaktan dalam suatu cairan diantaranya dengan pengukuran penurunan tegangan perrnukaan cairan kultivasi. Penurunan tegangan permukaan formulasi cair P. f7uore.scens GI 34 dan
SL03 menunjukkan bahwa bakteri menghasilkan biosurfaktan. Berdasarkan penurunan tegangan permukaan fonnulasi cair yang mengandung P. fluorescens GI34 dan SL03 diduga bahwa biosurfaktan yang dihasilkan merupakan senyawa yang berbeda dengan lipopeptida B. subtzlis. Hal ini sesuai dengan pernyataan Desai dan Desai (1993) bahwa biosurfaktan P. Jluorescens berupa kompleks karbohidrat- protein-lipid.
Lang dan Wagner (1993) menyatakan bahwa surfaktin yang merupakan lipopeptida siklik selain berfungsi menurunkan tegangan permukaan zat cair juga merusak sferoplas serta protoplas bakteri. Surfaktin dengan konsentrasi minimum 5pgIl dilaporkan dapat menghambat perturnbuhan Mycobacterium spp. Fungsi biosurfaktan sebagai antimikroba berkaitan dengan kemampuannya mengikat molekul hidrofobik membran mikroorganisme. Menurut Hommel dan Ratledge (1993), keefektifan biosurfaktan sebagai senyawa antimikroba bergantung kepada konsentrasi biosurfaktan dan ketahanan membran mikroorganisme target.
Bakteri P. fluorescens GI34 selain menghasilkan biosurfaktan juga menghasilkan siderofor untuk menginaktivasi Xag. Hasil analisis filtrat bakteri calon biokontrol dengan spektrofotometer menunjukkan bahwa senyawa penghambat yang diproduksi isolat GI19, G134, SLO1, dan SL03 adalah siderofor. Senyawa siderofor P. fluorescens GI19, GI34, SLOl, dan SL03 terdeteksi pada puncak absorbansi dengan panjang gelombang 410 nm (Gambar 8). Menurut Scher dan Baker (1982) serta Abdallah (1991), senyawa siderofor yang diproduksi oleh bakteri Pseudomonas spp. dan terdeteksi pada panjang gelombang 410 nm merupakan gabungan katekol dengan hidroksamat.
Vidhyasehran
(1988)menyatdm
bahwabtekol
senyamfenolik
yang
h i &
antibakri.
Mantake
(1991)r
n
bahw9 i h f b r
~
~
yang berupa &mpn
katekol clan
hihksamat
selain
mmgkelat
senyawaW
juga
rnenghmbstt
prtmbuhan
~
r
~
s
lain.
m
e
380 410 440 470 600 P m n j m n g Oolombmtg (nm)
Selain
amyawtisiderofor,
senyawa
pengham'bat
Iain yang
terdapt
dalam
fillrat- isolat
P.
flwresmwGI
34, C314, C316,dm
C317ialrth
hidrogen
sianida.
Kditas
hihagenshida
P.
flmres-
dhdisismeMui
met&
asampibat
Gtrmbm 9menmjukb
b a h i ~P.
flmresm
GI34
menghasilb
hidmgen
s k i &Mount
dmLacy
(1982) rnengemubh bahwahidrogen sianida
dipPoduksi
oleh
P.
fluoremnr
psdalinglnmgm
yangkIimpah ion
Fe
'',
sedan*siderofbr
dipraduksi
pada k a h n
ion
Fc
"y m g
terbatas.Menurut
Pelcm
dan
Chan
(1988)hidrogen
sianida
berfungsi
menghambatkerja
enzim
s i t o h moksidase
mikroba
.
Gambar
9 T3drogensianida
yang diprod&oleh
P.
frzdorescensGI34
(A)mengubah
astun p i h t b e ~ f a m akmhg
p d a
kerbs w i n gmenjwdi
kecokloltom,
a m m p k a t ~ ~ ~ k e r t a s ~ g @ )
di
1 - e hhsadmQb p d a
p y $ d W m Xagtertinggi
(Ian- 3 4)-
=w=
-
- .
Tabel
3menunjuklrsn
jenismemproduksi s u m myawa
penghmbat
ymg
stabil
dma
di
pyimpanm k s t d d mhidup
dan
a k t i f h =yaw8pengbmbatnya
dipemleh
bila
bakteri
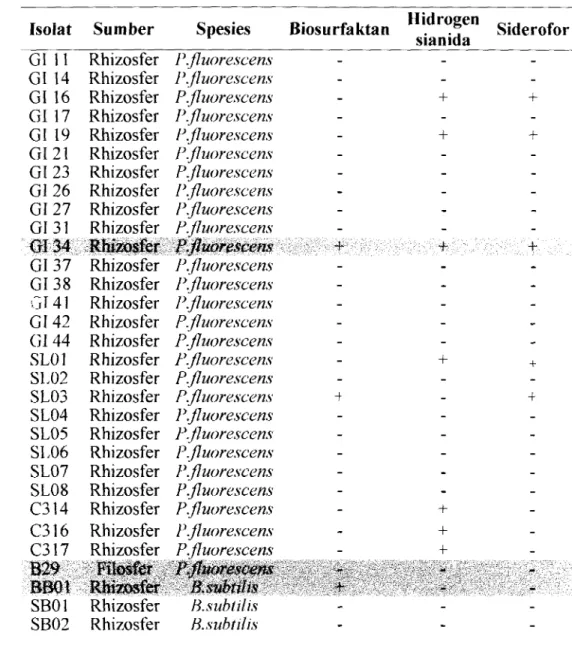
Tabel 3 Jenis senyawa antimikroba yang menginaktivasi .xic!,v lsoiat Sum ber Spesies Biosurfaktan Hidrogen Siderofor
sianida GI I 1 Rhizosfer t'.fluorescens - - - GI 14 Rhizosfer 1'. f1uorescen.s - GI 16 Rhizosfer P. jluore.scens
-
+
+
GI 17 Rhizosfer I'.fluorarcens - GI 19 Rhizosfer 1'Lfluorescens -+
+
GI 2 1 Rhizosfer P.Jluc>rescens - - - GI 23 Rhizosfer P.fluorescens --
GI 26 Rhizosfer PLfluorescens-
--
-
-
GI 3 8 Rhizosfer P.fluorescens --
-
.7 7 4 1 Rhizosfer P.Jluorescens - --
G I 42 Rhizosfer P.fluoresmns-
-
GI 44 Rhizosfer I'.fluorescens - --
SLO 1 Rhizos fer t'.fluorescens-
+
+ SL02 Rhizosfer P.fluorescens-
-
-
SL03 Rhizosfer P.fluorescens 4- -+
SL04 Rhizos fer P.fluorescens - - - SL05 Rhizosfer P.Jluorescen.s-
-
-
SL06 Rhizosfer P.fluorescens --
- SL07 Rhizosfer P.fluorescens-
-
SL08 Rhizosfer P,fluorescens-
-
-
C3 14 Rhizosfer Plfluorescens-
+
- C3 1 6 Rhizosfer Y . fluorescens-
+
- C317 Khizosfer l'.jluorc..scens-
r -B29
FiXwfer
Piflzaresccm
..
,.-
BEM 1
afrizosfer
R.s.ubtilis+
-
-
SBO 1 Rhizosfer H.subti1i.s
-
- SB02 Rhizosfer H.suhtilz.s-
Keterangan + = isolat biokontrol menghasilkan metabolit yang toksik terhadap ,la$; - = isolat biokontrol tidak menghasilkan metabolit yang toksik terhadap Xag
Komponen organik tersebut dapat berfungsi sebagai pelembab, perata, pelekat, dan pengemulsi yang kompatibel dengan agens biokontrol. Duvnjak el ul.
aplikasi bakteri biokontrol sehingga menurunkan tegangan permukaan media cair dan menurunkan tegangan antar muka sistein cairan-cairan atau cairan-padatan.
1.5. Forrnulasi Bakteri Biokontrol selama Penyirnpanan
Bakteri yang terpilih sebagai biokontrol yaitu B. .suhtrlzs BBOl dapat menghasilkan senyawa biosurfaktan dan P. ,f/uorescens GI34 dapat menghasilkan biosurfaktan, siderofor, serta hidrogen sianida. Jumlah senyawa biosurfaktan yang dihasilkan oleh bakteri biokontrol dalam formulasi cair dievaluasi dengan kromatografi cair bertekanan tinggi dan metode penumnan tegangan permukaan formulasi cair. Pengukuran jumlah senyawa biosurfaktan selama penyimpanan (kromatografi cair bertekanan tinggi) menunjukkan bahwa jumlah biosurfaktan yang diproduksi H. suhtrlw BBOl dalam formulasi molase 1% selama 7 hari penyimpanan sebanyak 0,4 10 g/l. Jumlah biosurfaktan berkurang menjadi 0,034g/I setelah 60 hari penyimpanan (Gambar 10).
Analisis biosurfaktan dengan mengukur penumnan tegangan permukaan formulasi cair biokontrol menunjukkan bahwa tegangan permukaan fonnulasi molase I % dengan inokulan P. fluorescens GI34 50,9 mN/m dan R. .subtzlr,s BBO 1 50,l mN/m. Tegangan permukaan formulasi limbah cair tahu dengan inokulan I-'. fluorescens GI34 54,O mN/m dan H. .suhtzlz.s BBOl 52,5 mN/m setelah 7 hari penyimpanan.
Ciambac10 Yunoak z l h a b - r ~ ~ ~ b r m ~ i
tnomdhlmuB. ssarbtifis B M 1 nalwn hnmhsimohw 1 % setuIah
7haripqbpmm(A), W t a s d a a ~ ~ ~
B. subn'Zis BBDl dahm h m h i m o b 1 %
~~
60 htrri penyimpanan(B), * = a b s d m S i *Tegangan
permukaan formdasi
cair y m g
dii-
dengan
bakkri biokontro1 lebih rendahdibandingh
den-
tegangan prmdaanm o b
1% attsulimbah cair
tahutanpa
bakteri. T e g a n w permukaanmolase
1 % 58,5 mN/md m
l i dcair tahu
59,O mN/m. S e wpembanding
diukur
tegangan perm-air
& s W steril yaitu 62,l m N h .+ M I 3 4 Mdase
+BsBBOl Mdass
*BsBBOl LCT
G a m h 11
Pmgmuh
lama
penrimpanan padasuhu
2 7 0 ~ dankelernbaban
80%terhadap
m g a u permukaanfomulasi
qens
biokontrol.
K e t e m :
PfGT34=Ppfr~resce~
GI34,
BsBBO 1 =B. subtil isB M
1,LCT=IimM
cairtahu
T e g a q p
pemmbma
f~mulasi
biokontrol
yang mengandwngte- permukaan
cairan
fomulasi
7
hhgga
60hari
pmyhpmmT e p g m
ko&m
padsr
180hhgga
360hari penyimpanm
(Gambar
11).Hal
ini
menunjufrlranbahwa molotse 1 %
m u p
limbah
cair
tahu
yangd i g m d m
sewpembentuk
formulasi
cab menmuW
biokontrol
untuk
r nw w w abiosurfaktan
~ ~hinge
60hari
~~
Setelah
60 hwi, pertumbub bakteribiakontml
dan senyawabiosmhkkn
yang
dipraduksinya
menurun.
Waiaupun potensi biosurfaktan biokontrol untuk menurunkan tegangan permukaan cairan tidak sebesar surfaktan sintetik, tetapi aplikasi biosurfaktan tidak membahayakan lingkungan. Menurut Mulligan dan Gibbs (1 993), biosurfaktan lebih mudah terurai secara biologis sehingga tidak terakumulasi di lingkungan.
Tegangan permukaan formulasi molase 1 % yang berisi B. subtilis BBOl dan P. Jluorescens GI34 lebih rendah dibandingkan dengan limbah cair tahu. Hal ini mengindikasikan bahwa molase 1 % merupakan pembentuk formulasi sekaligus
substrat Voodbase) bakteri biokontrol yang lebih sesuai untuk produksi senyawa biosurfaktan dan peningkatan populasi biokontrol dibandingkan dengan limbah cair tahu. Menurut Field dan Dastgheib (1996), formulasi bakteri biokontrol berfungsi menjaga agar bakteri biokontrol sebagai bahan aktif tetap stabil dan memberikan komponen tambahan yang bersinergi terhadap aktivitas kerja bakteri tersebut.
Molase dan limbah cair tahu yang digunakan dalam percobaan ini mengandung total nitrogen berturutan sebanyak 0,45 dan 2,27 gll. Sumber karbon dalam molase berupa sukrosa 37,6 g/l, glukosa 9,O gll, dan fruktosa 9,O g/l serta dalam limbah cair tahu berupa glukosa 1,60 g/l (Lampiran 5).
Mulligan dan Gibbs (1993) menyatakan bahwa bakteri B. subtilis dapat memproduksi surfaktin dalam medium molase maupun limbah cair tahu yang mengandung total nitrogen sebanyak 1,5 g/l. Menurut Cooper et al. (1981), glukosa 4 g/l merupakan substrat paling baik bagi produksi biosurfaktan pada B. subtilis dan P. aeruginosu. Lehninger (1 982) menyatakan bahwa glukosa dapat langsung digunakan dalam lintasan glikolisis. Berdasarkan ha1 ini molase lebih sesuai untuk
pertumbuhan B. subtrlrs BBO 1 maupun P. Jluorescens GI34 dibandingkan dengan limbah cair tahu.
Selain karbon dan nitrogen, Mulligan dan Gibbs (1993) menyatakan bahwa kultur turnbuh yang optimum untuk bakteri penghasil biosurfaktan memerlukan komposisi garam-garam mineral m N 0 3 , KH2P04, FeS04.7H20 dan MgS04.H20. Untuk pertumbuhan dan produksi biosurfaktan, bakteri biokontrol menggunakan garam mineral diantaranya yang mengandung ion ~ e ~ + . Konsentrasi minimum garam mineral yang mengandung Fe
'+
untuk pembentukan biosurfaktan adalah 2,O ppm 1 1 kultur cair. Pada percobaan ini, molase dan limbah cair tahu yang digunakan sebagai medium pertumbuhan sekaligus bahan pembawa bakteri biokontrol mengandung Fez03 dengan konsentrasi masing-masing 2,9 1 ppm dan 1,63 ppm.Pembentukan biosurfaktan, memerlukan mineral besi dan mangan. Molase dan limbah cair tahu yang digunakan dalam percobaan ini mengandung mineral mangan berturut-turut 0,55 ppm dan 0,46 ppm. Sheppard dan Cooper (1991) mengemukakan bahwa mineral besi dan mangan merupakan kofaktor enzim yang digunakan untuk metabolisme glutamat, amonia, dan pembentukan enzim glutamin sintetase yang memicu pembentukan biosurfaktan. Jika tersedia amonia dan glutamin tetapi tidak tersedia kofaktor besi dan mangan, maka pembentukan enzim glutamin sintetase tertekan dan biosurfaktan tidak terbentuk.
Menurut Mulligan dan Gibbs (1993), senyawa biosurfaktan merupakan bagian membran sel bakteri yang terbentuk selama fase hidup logaritmik hingga stasioner. Biosurfaktan berfungsi untuk menurunkan tegangan permukaan substrat yang ditempati bakteri penghasilnya jika substratnya tidak larut dalam air. Dengan adanya
kemampuan ini, bakteri mudah menyerap nutrisi dalam substrat yang tidak larut dalam air. Berdasarkan ha1 ini dapat dimengerti bahwa inaktivasi Xag oleh suspensi bakteri biokontrol akan terbentuk setelah fase stasioner, setelah 48 jsi. Hommel dan Ratledge (1993) serta Desai dan Desai (1993) menyatakan bahwa biosurfaktan merupakan bakteriosin yaitu toksin terhadap mikroorganisme di sekitarnya.
Berkaitan dengan jurnlah biosurfaktan produksi bakteri biokontrol yang berkurang setelah 60 hari penyimpanan, ha1 ini disebabkan oleh penurunan populasi bakteri B. subtilis BBO 1 dan P. fluorescens GI 34 hidup setelah 60 hari penyimpanan. Populasi bakteri biokontrol setelah 60 hari penyimpanan lebih sedikit dibandingkan dengan awal infestasi atau pada 7 hari penyimpanan.
Gambar 12 menunjukkan populasi P. fluorescens GI34 dalam formulasi molase 1% mula-mula meningkat dari lo6 CFUIml pada awal infestasi menjadi 28,60 x 10 7 ~ ~ ~ / m l pada 7 hari penyimpanan. Demikian juga populasi awal B. subtilis BBOl (sama dengan P. fluorescens GI34) meningkat menjadi 35,30 x lo7 CFUlml setelah 7 hari penyimpanan.
Penurunan populasi bakteri biokontrol yang hidup dalam formulasi cair terjadi setelah 60 hari, 180 hari, dan 360 hari penyimpanan. Populasi bakteri P. fluorescens GI34 menurun berturut-turut 21,70 x107; 1,7 x lo7, dan 0,09 x lo7
CFUlml, sedangkan populasi B. subtilis BBOl menjadi 24,6 x lo7; 10,5 x lo7, dan 4,2 x lo7 CFUIml.
Jumhh
+i
dm
m w a biosurfaktaP yang d h d k a n.
.
aleh
bakteribiokontrol
dip&mhi
oleh
pRmedium
pmtumb&an
MenurutJavaheri
etd.
(1985),kisaran
pH
medium yrtngctiperluh
oleh
hkteriP s e u h m m
spp. untuk
mempd&i
bitmrfddm
addah 4,6h g g a
7,O.Bakki
3. subtilisspp.
memproduhi
bias*
padrr kisaranpH
medium
4,Oh g g a
73.
Kmawmn
fomulasi
b a k k ibiokoml
dahmm o b
1%
maupun limbahcair tabu
menurun
sejakdiprodubi
hhgga
360hari
penyimpnan, yaitudari
6,7menjadi
3,9 padsmedium
prtumbuhanP.
fluorescemGI34
dm
dari
6,6
mmjadi
-
PfG134 LCTSsBBOl
0 7 30 80 90 1 2 0 1 8 0 3 H l
Lama Pgnyimpanan (Harl)
Gambar
13Pengamh
Lama peayhhpam~terkdap
pH
fomulasi
W
biokontrol
padasuhu
270 C dmIrelembahan
80%K-W:
mu4
=p . p ~ m s m
GIN,
BsBBO
1 = B.sarbfilisBBO 1,
LCT = h b a hcair
tahu
Kwbtbilan
hidup
bkkribiobntral
ctipmgmhioleh
produk
m&Iisme
b&ri
biokontrol
yang
tmkmulasi
dahm
fofmuhsi
Ahmulasi
&Litmen@
kemolsamaafimubi,
Senyawmetablit yang
b e q a ttsamkwbIGSilat
brdisosiasi
dalam
airr n e n g b s b
ion
H+
d@ga
menunmkan
pH
(Jones
dan
Burges
1998).hadam
formulasi
cairbatrteri
biokcmlml
~~
di
penyimpanan
d q a t digunakan mtuk menghhikan k e s t d i h
k m a m p w
W
biokdml
r
n
-
pertmbuhmXag.
h p i m
6mmuqjukkan
keadaan
formulasi
cair
b&ei
biokontrol
s&ma 7hi-
360
hari
penyimpamn.kryawa
biomfakh
yangdihasilkotn
oleh
bttErteribiokontrol
d a m
fbmubi
dbtamga
berfungsi
untuk
(1)
rneningbhn
kontak
antamko1oni
balrtwi
bioh?ml
p m h
daun, (2)menjaga
kelembaban
balrteribiokontrol
di
m u k a a n
clam, (3') b a b r ibiokorrtrol
mampu me1ewatipengbhg
e k s t e ddam
biokontrol didaerah dinding sel daun sehingga mencapai patogen target (Field dan Dastgheib 1996).
Percobaan 11. Evaluasi Keefektifan Bakterisida Botani Asal Enam Jenis Tanaman dan Analisis Senyawa Penghambat terhadap Penyakit Pustul Bakteri
Bahan tanaman yang diekstraksi menjadi bakterisida botani diantaranya adalah bagian daun kipaht (Pierasma javanica), daun paku papila (Lygodium scandens), daun matoa (Pometia pinnata), dan buah kelapa sawit (Elaeis guineensis) seperti yang ditunjukkan pada Gambar 14. Selain itu juga diuji ekstrak rimpang lengkuas merah (Alpinia galanga) dan daun sereh wangi (Andropogon nardus L. var genuinus).
Hasil inaktivasi Xag in vitro menunjukkan bahwa di sekeliling kertas cakram yang telah dicelupkan terlebih dahulu ke dalam ekstrak daun matoa, daun kipahit, daun paku papila, rimpang lengkuas merah, daun sereh wangi, dan buah kelapa sawit konsentrasi 20 % terbentuk zone bening pada 48 jsi. Pada 48 jsi tersebut, zone inaktivasi belurn terbentuk di sekitar kertas cakram yang telah dicelupkan terlebih dahulu ke dalam ekstrak daun lengkuas merah, pelepah sereh wangi, dan daun kelapa sawit. Perbedaan waktu terbentuknya zone inaktivasi Xag oleh ekstrak bagian yang berbeda dari suatu tanaman menunjukkan bahwa senyawa antimikroba diproduksi di bagian yang berbeda dari suatu jenis tanaman.
Marm
(1987)men-
k t d t a s
bioaktif
bqmhmgk e p h
b a g h Wwmmt & p t
sayamdipduhi,
Menurut
Hahome
(1987), asam galat yrtngmenu-
senyamb l i k
tebih
banyak
tenlapat
dalm
dam, d i i m b a g i a a 1 a i n a j # n a m s u , - * d a l l n y a n gmembetLtutrligaia Asamgalatmempkm
~ y t m g ~ d a l a m ~ l .
Uenzuut
W t t o (1991),m t a s
asam galatlekh
h y a kt d e n b k
M a m dammaupun
jaringanlain
yangmembentuk punr
hi-fi
wl.
Bdmm
etal.
(1991)meayatabn
bahwasenyawa
holik
yang
h i b a nd e n p
gulalebih
banyak
path
daun
buncis d i W n g k m dengm
p d a
polong buncis. Sebalilmya
Buttery
dm
Ling (1993)men-
bahwasenyaw
lrarbon voMl
turuarmn
lemkIebih banyak
ber&
p d a
buah
tomatdibmdinglm
b g mdi dam
Daun tomatrnedmtuk
terpoid
hidmhbon.
Oleh karena
itu
dapat dimengerti Wwaehtrak
uji yangdiperoleh
dari
jenktamman
s a m m u nbagiaa
tanamanberbeda
a h
mengandung
lmantitas
senyawabioaktif
yang bmbeda.Perbedotan
kuantitas senyawbiaaktifmenyebabkrtn
tingleat bktivasiXag
ymg berhedapula
Zone
h k t i v ~ l s iXag
oleh
e Wrimpang
lengkuas
merah
(Alpinlagalanga),
daun
sereh
wangi
( A h o p g o n
mr& 1;.var
genarhw),dam
pdcu
papila (Lygodium scadem),bmh
kelapa sawit
(Elaeis guineemis),damn
kiphit
(P i e r a m
jmanica),dan
dam matm(Pometia
pintslrta)bnsmtmi
20 % ( t a h t u ksetelah
2hari
idahsi)
melebar
dm
bmghng antmamm
yangberdektan
pada
4hari
h h h s i
(Gambar 15).Gunbar
15Uji hktivasi Xag
pada
24jsi
(A),uji
W m s iXag
pala 96jsi (B).
dam kiphit,
b,daun
paku papila,a
rhnpanglengkuas
merah, ') damsereh
m g i ,"
daun
ma-
')buah
kelspa
sawit, B,air
destilata sterilTtibel
4dan
Gambar
16 menunjukbbahw ptambahm
zone bald&Xag -pat
dan
terlebar terbentukdi sekelihg
eksb.ak
dam
matoadan
daun
kipbit
konsentmsi 20 %. Pertambahan
lebar
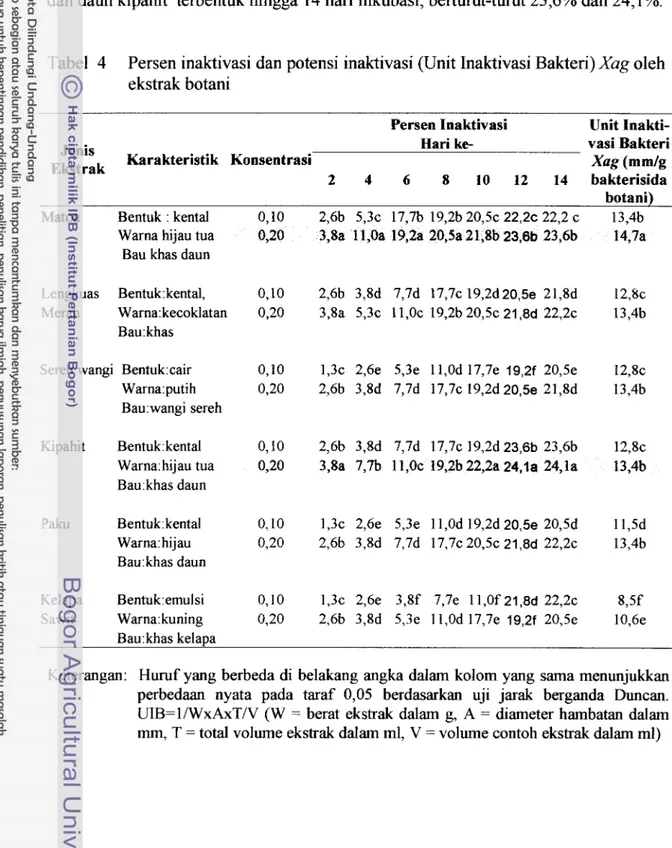
diameter zone imktivwsi tmhtuk mulai 4Xug) yang dibentuk oleh ekstrak daun matoa clan daun kipahit pada 4 hari inkubasi masing-masing 11,O % dan 7,7 %. Persen inaktivasi Xug oleh ekstrak daun matoa dan daun kipahit terbentuk hingga 14 hari inkubasi, berturut-turut 23,6% dan 24,1%.
Tabel 4 Persen inaktivasi dan potensi inaktivasi (Unit Inaktivasi Bakteri) Xug oleh ekstrak botani
Persen Inaktivasi Unit Inakti-
Jenis Hari ke- vasi Bakteri
Ekstrak Karakteristik Konsentrasi Xag (mm/g 2 4 6 8 10 12 14 bakterisida
botani)
Matoa Bentuk : kental 0,10 2,6b 5,3c 17,7b 19,2b 20,5c 22,2c 22,2 c 13,4b Warna hijau tua 0,20 3,8a 1 1,Oa 19,2a 20,Sa 21,8b 23,eb 23,6b 14,7a
Bau khas daun
Lengkuas Bentuk: kental, 0,10 2,6b 3,8d 7,7d 17,7c 19,2d20,5e 21,8d 12,8c Merah Warna:kecoklatan 0,20 3,8a 5,3c 1 1,Oc 19,2b 20,5c 21,8d 22,2c 13,4b
Bau: khas
Sereh wangi Bentuk:cair 0,10 1,3c 2,6e 5,3e 11,Od 17,7e 19,2f 20,5e 12,8c Warna:putih 0,20 2,6b 3,8d 7,7d 17,7~19,2d20,5e21,8d 13,4b Bau:wangi sereh
Kipahit Bentuk kental 0,10 2,6b 3,8d 7,7d 17,7c 19,2d 23,6b 23,6b 12,8c Warna. hijau tua 0,20 3,8a 7,7b 11,0~19,2b22,2a24,?a24,la 13,4b Bau khas daun
Paku Bentuk:kental 0.10 1,3c 2,6e 5,3e 11,Od 19,2d 20,5e 20,5d 11,5d Warna: hijau 0,20 2,6b 3,8d 7,7d 17,7c20,5c 21,8d 22,2c 13,4b Bau:khas daun
Kelapa Bentuk:emulsi 0,10 1,3c 2,6e 3,8f 7,7e 11,Of 21,8d 22,2c 8,5f Sawit Warna: kuning 0,20 2,6b 3,8d 5,3e 11,Od 17,7e 19,2f 20,5e 10,6e
Bau:khas kelapa
Keterangan: Huruf yang berbeda di belakang angka dalam kolom yang sama menunjukkan
perbedaan nyata pada taraf 0,05 berdasarkan uji jarak baganda Duncan. UIB=l/WxAxT/V (W = berat ekstrak dalam g, A = &meter hambatan dalam mrn, T = total volume ekstrak dalam ml, V = volume contoh ekstrak dalam ml)
6.
Potmi
bktivasi
baktffiXag
oleh
e h a kbataai
( d g ekstrak-1
Diameter
m e
W v a s i
debar
14,7m
d i Wuleh
semp gekstrak
dam
ma- Unit inaktiwi
W
Xag
k r b d
B
W
i
aleh
e h a kbu&
kelap
sawit,PerbedaEtn unit
imktivasi bakteri
Xag
ymg ditunj-oleh
msing-masing
Tabel 5 Kuantitas asam galat dalam ekstrak botani yang menginaktivasi Xug (mg/g bahan tanaman)
Ekstrak Botani Kuantitas Asam Galat (mg/g bahan tanaman)
Daun Matoa 8,22a
Daun Mimba 5,95b
Daun Sereh wangi 4,84c
Daun Kipahit Daun Paku papila
Rirnpang Lengkuas merah 2,32d
Buah Kelapa Sawit l,88e
Keterangan : Huruf yang berbeda di belakang angka dalam kolom yang sarna menunjukkan perbedaan nyata (0,05) berdasarkan uji jarak berganda Duncan
Menurut Pelczar dan Chan ( 1988), asam galat menginaktivasi bakteri melalui perusakan permeabilitas membran sel bakteri sehingga terjadi kebocoran metabolit. Asam galat merupakan salah satu senyawa fenolik yang dapat dianalisis karena terdapat dalam jumlah besar pada jaringan tanaman terutama di bagian daun.
Percobaan 111. Analisis Keefektifan Pengendalian Pustul Bakteri dengan Kombinasi Pola Tumpangsari atau Monokultur dan Aplikasi Bakterisida Biokontrol atau Bakterisida Botani.
Selama penanaman kedelai di lapangan diamati kondisi cuaca yang terdiri atas intensitas matahari, curah hujan, suhu udara, dan kelembaban udara relatif serta sifat kimia dan fisik tanah tempat kedelai ditanam (Lampiran 7 dan 8). Intensitas inatahari pada saat penanaman kedelai di musim kemarau (bulan Juli 2000 dan Juli 200 1) dan musim penghujan ( bulan Januari 2001 dan Januari 2002) berturut-turut
236-293 dan 202-282 kalori/cm2/hari. Menurut Baharsyah et a/. (1988), intensitas matahari yang diperlukan untuk pertumbuhan vegetatif dan generatif kedelai optimum adalah 2 16-576 kalori/cm2/hari.
Curah hujan yang terjadi berkisar 186-225 mm di musim kemarau dan 382- 528 mm di musim penghujan. Suhu udara rata-rata dan kelembaban udara relatif masing-masing 28-29,5' C dan 84-89 %. Menurut Sumarno dan Widiati (1985),
kondisi cuaca optimum untuk pertumbuhan kedelai meliputi curah hujan antara 100- 300 mm, suhu udara 2g°C, dan kelembaban udara relatif 85 %.
Suhu dan kelembaban relatif udara di lapangan yang optimum untuk pertumbuhan kedelai ternyata juga mendukung perkembangan penyakit pustul bakteri. Menurut Dirrnawati (1996), penyakit pustul bakteri berkembang pada suhu 29 'C dan kelembaban udara relatif 89 %.
Keparahan penyakit pustul tinggi pada curah hujan lebih dari 300 mm. Laju infeksi penyakit pustul bakteri tinggi pada tanaman kedelai yang ditanam di musim penghujan. Musim penghujan dengan curah hujan antara 382-528 mm bertepatan dengan masa pembungaan kedelai yang merupakan fase kritis tanaman kedelai terhadap pustul bakteri.
Laju infeksi pustul bakteri pada pola monokultur kedelai di musim penghujan adalah 0,10 unitlhari, sedangkan di musim kemarau hanya 0,09 unitlhari. Demikian juga laju infeksi pustul bakteri pada pola tumpangsari kedelai- jagung di musim penghujan lebih tinggi (0,13 unitlhari) dibandingkan dengan musim kemarau (0,ll unitlhari).
Laju infeksi pustul bakteri selain dipengaruhi oleh perbedaan musim tanam, dipengaruhi juga oleh perbedaan pola tanam kedelai, jenis agens pengendalian yang diaplikasikan (biokontrol tunggal atau campuran, bakterisida botani, streptomisin sulfat, dan tanpa pengendalian), interaksi pola tanam kedelai dengan jenis agens pengendalian, serta cara aplikasi agens pengendalian (perlakuan benih dan penyemprotan daun) (Lampiran 9, 10, 11, 12, 13, dan 14).
Komponen pengendalian tunggal (pola tumpangsari kedelai-jagung) tidak menurunkan laju infeksi pustul bakteri. Laju infeksi pustul bakteri pada komponen pengendalian tunggal yaitu pola tanam turnpangsari kedelai-jagung O,11 unit/hari di musim kemarau dan 0,13 unit/hari di musim penghujan. Laju infeksi pustul bakteri pada pertanaman kedelai monokultur 0,09 unit/hari di musim kemarau dan 0,10 unitlhari di musim penghujan. Laju infeksi pustul bakteri pada pola tumpangsari kedelai-jagung lebih tinggi dibandingkan dengan monokultur kedelai di musim kemarau maupun penghujan.
Laju infeksi pustul bakteri menurun pada kombinasi pola tanam tumpangsari kedelai-jagung dengan penggunaan jenis bakteri biokontrol, bakterisida botani, atau streptomisin sulfat. Laju infeksi pustul bakteri pada kombinasi pola tanam tumpangsari kedelai-jagung dengan aplikasi bakteri biokontrol tunggal adalah 0,06 unit/hari di musim kemarau dan 0,07 unit/hari di musim penghujan. Jika pola tumpangsari dikombinasikan dengan aplikasi biokontrol campuran yang terdiri atas dua atau tiga jenis bakteri maka laju infeksi pustul bakteri lebih rendah dibandingkan dengan biokontrol tunggal yaitu 0,04 unit/ hari di musim kemarau dan 0,06 unitlhari di musim penghujan.
Pengaruh aplikasi bakteri biokontrol campuran terhadap pustul bakteri berbeda dengan aplikasi bakteri tunggal. Aplikasi bakteri campuran lebih menurunkan laju infeksi pustul bakteri dibandingkan bakteri tunggal. Hal ini sesuai dengan laporan Raupach dan Kloepper (1998) bahwa bakteri biokontrol campuran yang terdiri atas bakteri B. pumrlus INR7, B. subtilrs GB03, dan Curtobucterrum flaccumfuclens ME1 lebih efektif mengendalikan penyakit-penyakit yang terdapat pada tanaman ketimun (penyakit antraknosa, penyakit bercak daun bersudut, dan penyakit layu). Lebih lanjut dinyatakannya bahwa campuran bakteri biokontrol mempunyai kemampuan sinergi yang lebih tinggi untuk menguasai habitat barunya dibandingkan dengan bakteri biokontrol tunggal.
Bakteri P. jluorescens GI34 yang digunakan sebagai biokontrol dapat memproduksi senyawa biosurfaktan, siderofor, dan hidrogen sianida. Informasi mengenai kemampuan pembentukan suatu senyawa oleh bakteri biokontrol pada keadaan lingkungan dengan jumlah nutrisi terbatas penting untuk mengetahui mekanisme bakteri biokontrol menghambat Xag di permukaan daun. Bakteri P. .fluorescens GI34 memproduksi biosurfaktan dan hidrogensianida di dalam formulasi
molase 1% yang mengandung cukup mineral besi dan mangan, tetapi tidak memproduksi siderofor.
Di permukaan daun kedelai, biosurfaktan yang merupakan bagian membran sel P. jluorescens GI34 berfungsi untuk mempertahankan diri di lingkungan daun yang terbatas medium cairnya. Selanjutnya kemampuan P. jluorescens GI34 membentuk siderofor terekspresi jika jumlah mineral besi terbatas seperti halnya di permukaan daun kedelai.
Tukey (1971) menyatakan bahwa eksudat daun mengandung lo4 ppm ion besi. Eksudat daun muda lebih sedikit mengandung ion besi (karena ion besi sulit ditranslokasikan dari daun tua ke daun muda). Berdasarkan ha1 ini maka dapat dimengerti bahwa bakteri P. Jluorescens GI34 yang disemprotkan ke permukaan daun kedelai lebih mampu bertahan di daun muda dibandingkan dengan daun tua. Daun muda yang disemprot dengan Y . fluorescens GI34 menunjukkan laju infeksi pustul yang lebih rendah dibandingkan dengan daun muda yang tidak dikendalikan. Kemampuan P.Jluorescens GI34 membentuk siderofor di permukaan daun muda yang terbatas jumlah mineral besinya menyebabkan laju infeksi pustul menurun.
Bakteri B. subtzlzs BBO 1 memproduksi biosurfaktan dalam formulasi molase. Biosurfaktan yang diproduksi B. subtzlzs BBO 1 bermanfaat untuk memudahkan pengambilan nutrisi di permukaan daun yang relatif tidak mengandung air. Selanjutnya kemampuan B. subtzlzs BBOl membentuk spora dalam sentral sel berguna untuk mempertahankan diri dari lingkungan permukaan daun kedelai yang kering.
Mekanisme penghambatan Xag oleh P.jZuorescens GI34 dan B. subtzlzs BBO 1 di permukaan daun sesuai dengan pernyataan Pusey (1999) bahwa mengintroduksikan bakteri biokontrol yang memproduksi metabolit inaktivasi mikroorganisme lebih efektif dibandingkan biokontrol yang tidak memproduksi metabolit penghambat. Namun demikian Spurr dan Knudsen (1985) menyatakan bahwa keberhasilan bakteri biokontrol mengendalikan penyakit di bagian permukaan atas tanaman tidak hanya bergantung kepada kemampuan bakteri biokontrol
Maaf, Halaman Ini Pada Sumber Aslinya Memang Tidak Ada Sorry, This Page Is Not Available In The Original Source
kernmu serta
0,M u n i Mdi
musim pghujaaDemikian
juga
Iajuinfeksi
pustuIpads kombinasi pola monokuitur
lredelai
dmbiokontrol c m p m
atau streptomisin sdfat s m a yaitu 0,05unitmsui
di m u s h k m m u
dan 0,07unithari di m u s h
penghujan. Hal inimenlmjukkan
bahwahju hfeksi
pustul b a h r i yangdikendalikan
oleh
campuranbakteri
biokontxol
smadengm streptomisin
sulfat.Efek
h k t a ibiokontrol campwan (mas&-mashg b k t h
mernpmhbi
senyawmetabolit
ymgberbeda-beda)
dapat
mmggmtkm
peran
streptomiin dhtdalam
menghambatpersen
Iajuinf&
Xag.
M 1 S K P S W T P
Laju infeksi pustul bakteri dengan aplikasi bakterisida botani lebih rendah dibandingkan dengan tanpa pengendalian di musim kemarau maupun penghujan. Diantara enam jenis ekstrak tanaman yang digunakan sebagai bakterisida, ternyata lekstrak daun matoa menurunkan laju infeksi pustul bakteri paling besar. Ekstrak daun matoa dengan kandungan asam galat 8,2 mglg daun matoa dapat menurunkan laju infeksi pustul dari O,11 unit/hari menjadi 0,06 unit/hari di musim kemarau atau dari 0,14 unitlhari menjadi 0,06 unit/hari di musim penghujan.
Bakteri biokontrol yang diaplikasikan ke permukaan daun kedelai umur 30 hingga 42 HST yang ditumpangsarikan dengan jagung lebih banyak bertahan hidup dibandingkan dengan di permukaan daun kedelai monokultur. Gambar 19 dan Lampiran 16 menunjukkan bahwa bakteri biokontrol masih dapat bertahan hingga 10 hari setelah diaplikasikan ke daun kedelai. Jagung yang ditanam tiga minggu setelah penanaman kedelai dengan jarak tanam antar baris jagung 100 x 80 cm menaungi kedelai 30% (diukur dengan tabung solarimeter). Naungan tanaman jagung terhadap permukaan daun kedelai pada pola tumpangsari kedelai-jagung meningkatkan ketahanan hidup bakteri biokontrol di permukaan daun kedelai. Populasi bakteri biokontrol hldup di permukaan daun kedelai yang ditumpangsarikan dengan jagung lebih banyak dibandingkan dengan di perrnukaan kedelai monokultur.
Laju infeksi pustul bakteri rendah bukan hanya dipengaruhi oleh komponen pola tanam tumpangsari tetapi oleh kombinasi pola tanam tumpangsari dengan aplikasi bakteri biokontrol atau bakterisida botani. Penurunan laju infeksi pustul bakteri pada kombinasi pola tumpangsari kedelai-jagung dengan aplikasi bakteri
biokontrol
disebabkan
oleh h k k r i
biokontrol
yang
dam
batahandi
pemukozandam
kedelai
hingger
10hari
setelah
d i a p ~ ~ .Penurunan laju
infeksi pustul
b&eripa&
ko-i
pola
tmpmgsari dengan baktetisida botanidisebabkan oleh
kan-
olsam@at
ekstrak
botani
yang
d i g u d m
sebaga.~ bkrisida. Hasilanalisis
asam a tdam
k&hi
yang disemprot dengan e&mkbakterisida
botani menunjukkan
bolhwatelah
terjadi p r u h hrndabolbe
di
a m daunkedelai.
Perubahan
metabo1isme dam kedelai dhtaranyapeninmtm
laantitas a s m gahtdam
kedelai. Seblum
disemprd denganekstrak
bkhisida
botani
botani,
kandungan
asam galatdam
kedelai
sehat sebesar 2,58 mglgdam
kedelai.
Asam
galat
meningkat menjadi 3,59 mglgdaun
kedelai
pada daunkedelai
solkityang
Kandungan asam galat daun kedelai yang disemprot dengan ekstrak daun matoa 5,5 mg/ g daun kedelai. Asam galat daun kedelai yang disemprot dengan ekstrak rimpang lengkuas 6,19 mg/g daun kedelai. Hal ini menjadi suatu kajian lebih lanjut karena ternyata kuantitas asam galat daun kedelai yang disemprot dengan daun matoa (kandungan asam galat 8,2 mg/g daun matoa) lebih rendah dibandingkan dengan daun kedelai yang disemprot dengan rimpang lengkuas merah (kandungan asam galat 2,32 mg/ g rimpang lengkuas merah) (Tabel 6).
Tabel 6 Kuantitas asam galat daun kedelai sehat, daun kedelai sakit bergejala pustul, daun kedelai sakit yang dikendalikan dengan ekstrak botani
Ekstrak Daun Kuantitas asam galat (mglg bahan tanaman)
Daun kedelai sehat 2,58a Daun kedelai sakit bergejala pustul bakteri 3,59b Daun kedelai sakit (disemprot dengan ekstrak matoa) 5,55c Daun kedelai sakit (disemprot dengan ekstrak rimpang lengkuas) 6,19d
Keterangan : Huruf yang berbeda di belakang angka dalam kolom yang sama menunjukkan perbedaan nyata (0,05) berdasarkan uji jarak berganda Duncan
Ekstrak bakterisida botani yang diaplikasikan ke daun kedelai selain berperan langsung merusak permeabilitas membran bakteri sehingga terjadi kebocoran metabolit, diduga juga penginduksi peningkatan asam galat daun kedelai. Deverall dan Dann (1995) serta Steiner dan Schonbeck (1995) mengemukakan bahwa metabolit yang terkandung dalam ekstrak kasar tumbuhan dapat menginduksi ketahanan tanaman gandum terhadap penyakit embun tepung. Pengurangan
k e p r a h
penyakit embun tepung pada tammangandum
mencapai90
%dalam
k i m
waktu tip
hari sebelah
q l h i
ehErak
kasar tumbuhrmn.Laju
Wlrsi pustulbalaeri
d i p q p h oleh
caraa p l i h i
agens
pengendalim(Gambar
20dan
Lampiran
17).h j u
infeksi
pustulbakteri
dengan campencampwan
agem
pengendah
p d a
benih
kedek dilmjutkan denpn
penyemprotandi
permukaan daun
benmur 30dm
40
HST
lebih
tinggid i b d h g k m
dengan
carap e n y m p t m
c9i p m h m dam kedehi.Tiga
Mi
pnyemprotm b&mibi&onlml,
babisida botmi,drepmh
sulfat,
&u
moIasedi
permuhimdam
WIsi
padsm w
28,35,dan
42HST lebih mmurunkom laju hfeksi
penyakitp a .
Hd h
i
men-
. .
.
bahwa b a k
biokontrol,Wrisida
botani,m a u p
streptomisintidak
sistemilr
ke
dab jaiqpnbiji
paddm1 bakteriXag
i n d i p u s
bmdadi
Ralrunjarhgan
bijibdelai
(w
dm
Sinclair
1996).-bar
20Laju infeksi
pustulbakteri karena
pmgamh capsa p W
dipengaruhi oleh laju infeksi (r) yang tinggi. Penyakit berkembang dengan cepat, walaupun telah dilakukan perlakuan benih untuk mengurangi inokulum awal (Xo). Dengan demikian perlakuan benih dengan bakteri biokontrol, bakterisida botani, streptomisin sulfat tidak efektif untuk mengurangi bakteri inokulurn di dalam jaringan biji kedelai.
Menurut Robinson (1981), menurunkan laju infeksi penyakit berbunga majemuk lebih tepat menggunakan cara penanaman varietas yang resisten secara horisontal dan menyemprotkan protektan ke permukaan tanaman. Oleh karena itu pustul bakteri sebagai penyakit berbunga majemuk dapat dikendalikan dengan penyemprotan bakteri biokontrol, bakterisida botani, maupun streptomisin sulfat pada saat umur kntis tanaman kedelai. Umur kritis tanaman kedelai terhadap serangan bakteri pustul yaitu pada akhir fase vegetatif dan awal generatif yaitu 28 HST.
Komponen tunggal pola tanam tumpangsari kedelai-jagung tidak menurunkan keparahan penyakit pustul bakteri. Hal ini sesuai dengan Msuku dan Edje (1982) yang menyatakan bahwa keparahan penyakit bercak daun bersegi pada pola tanam tumpangsari jagung-buncis meningkat. Jarak tanam tanaman jagung dengan buncis 45 x 15 cm dan tidak dilakukan taktik pengendalian lain. Menurut Schoonhoven et al. (1998) tidak semua jenis tanaman dapat dikombinasikan pada pola turnpangsari, apalagi jika tujuannya untuk mengurangi keparahan penyakit tanaman. Lebih lanjut dijelaskan bahwa pola turnpangsari lebih unggul dibandingkan dengan monokultur apabila pemilihan keragaman jenis tanaman dan waktu penanaman tepat. Selanjutnya dinyatakan bahwa pengurangan keparahan penyakit tanaman dalam pola tumpangsari lebih disebabkan oleh faktor biotik seperti pengaruh agens biokontrol yang
diaplikasikan atau musuh alami yang diinundasikan serta faktor abiotik yang berupa kerapatan tanaman atau bentuk daun yang mempengaruhi iklim mikro tanaman.
Pola tumpangsari kedelai-jagung lebih berperan untuk peningkatan produktivitas lahan. Hisjam (1988) menyatakan bahwa produksi kedelai pada pola tumpangsari kedelai-jagung (jarak tanam antara tanaman kedelai 40 x 20 cm, jarak tanam jagung dan kedelai 120 x 20 cm, dan jagung ditanam 30 hari setelah penanaman kedelai) sama dengan produksi kedelai yang ditanam monokultur, bahkan terdapat tambahan produksi jagung. Jarak tanam pola tumpangsari kedelai- jagung lebih dari 75 x 40 cm dengan waktu penanaman jagung paling cepat 10 hari setelah penanaman kedelai dapat memenuhi kebutuhan radiasi matahari untuk pertanaman kedelai yaitu intensitas matahari sebesar 86-96 %.
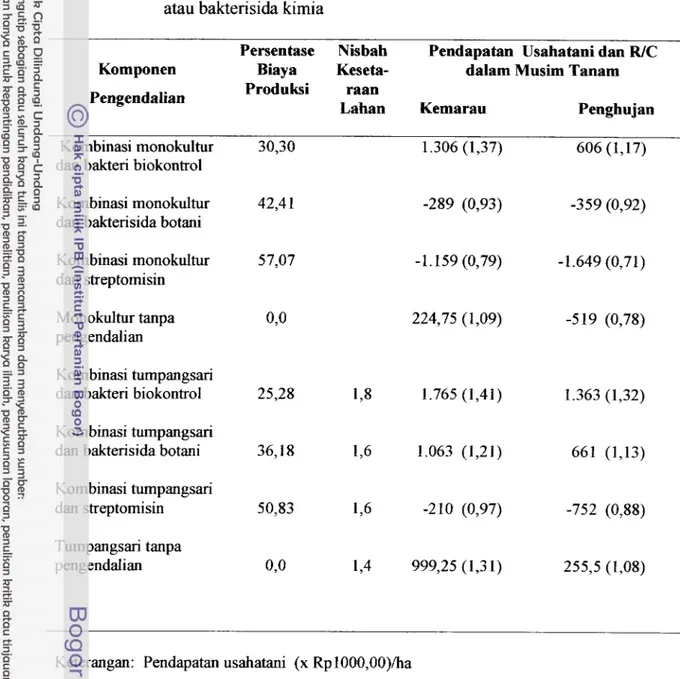
Selain jarak tanam yang tepat, Runtunuwu (1990) melaporkan bahwa waktu penanaman jagung dan kedelai mempengaruhi produksi. Kedelai yang ditanam pada waktu yang bersamaan dengan jagung menurun produksinya hingga 40,42%, tetapi jagung yang ditanam paling cepat 10 hari setelah penanaman kedelai akan meningkatkan produksi kedelai sebesar 15,15 %. Gambar 2 1 serta Lampiran 18 menunjukkan bahwa produksi biji kedelai yang dikendalikan dengan bakteri biokontrol, bakterisida botani, streptomisin sulfat lebih tinggi dan persen polong hampa lebih rendah dibandingkan dengan tanpa pengendalian.
Keefisienan
pengemMan nunahlingkungm
penyakit pwtdbakteri
dianalisis
d e n p
menilai
keduduh
ekonomi
dari
mas@ymshgkonpmn
pengendalian.
K e d u d u h ekommi
dhdisis
dmgmWC
mio
komptmen
pgmdalian
menunjukh
bahwa padaptan
yang
d i t a h
mtuk
setiaprupmh
yang
dikeluarkan
untukm m p m h h i
W l a i
den*
memggmdm
k m p e n
p p d d i a n
peny&t
Pengel-
mahatadmeliputi
u p h
t e q a
kerja
(ti&
&
i
atntara tenagakerja
ke1-
ataudi
luar
bluarga),
hmga
sovana
produksi
pertanian (biaya J i h ttkndogi pembuatan bakteribiokontrol
atau
bakterisida
bani), dmbiaya
lain
yangd k l u a r h
untuZr
&hi W l a i seprtisewa alat
penymprothama
dm
peqdat.
PendapaEan usahatani kedehi
addahpdapatm kerja
petani (opatm's fmwtlabour
-me)
yaitup e n e r h m
dari penjuah
k i l
k&lai. Produksi kedehi
yang dikonsumsi oleh keluarga tidak diperhitungkan dalam pendapatan ini (Tim IPB 1979).
Upah tenaga kerja penanaman kedelai hingga pasca panen Rp20000,00/hari kerja pria, harga benih kedelai Rp6000,00/kg, dan harga rata-rata pupuk buatan Rp2000,00/kg. Pengendalian penyakit pustul bakteri memerlukan 27 1 formulasi bakteri biokontrolha dengan harga Rp40000,00/1.
Komponen harga bakteri biokontrol terdiri atas biaya pembuatan 500 g agar nutrien untuk membiakkan bakteri biokontrol stater (digunakan untuk 20 1 forrnulasi) dan tambahan biaya transpor dari lokasi pengambilan limbah pabrik gula atau tahu sebesar Rp600,00/1 limbah. Pengendalian pustul bakteri dengan bakterisida botani memerlukan 1 12 g ekstrakha. Harga bakterisida botani Rp 16000,00/g ekstrak. Harga bakterisida botani terdiri atas harga etanol95% (Merck) untuk ekstraksi bahan tanaman dan tambahan biaya transpor dari lokasi tumbuh bahan tanaman Rp400,00/kg bahan tanaman. Analisis pendapatan usahatani kedelai disajikan pada Lampiran 19,20,21,22,23, dan 24.
Tabel 7 menunjukkan pendapatan usahatani, R/C rasio, persen biaya komponen pengendalian terhadap biaya produksi total. R/C rasio penggunaan bakteri biokontrol yang dikombinasikan dengan pola tanam tumpangsari paling tinggi diantara komponen pengendalian ramah lingkungan lainnya, yaitu 1,41 di musim kemarau dan 1,32 di musim penghujan. Setiap rupiah yang diinvestasikan pada kombinasi pola turnpangsari kedelai-jagung dengan penggunaan bakteri biokontrol memberikan penerimaan sebesar Rp 1,4 1 di musim kemarau dan Rp1,32 di musim penghujan.