PENGOLAHAN ZAT WARNA TEKSTIL JINGGA METIL MENGGUNAKAN BENTONIT TERPILAR TiO2
SKRIPSI
IKE SILVIYANTI
DEPARTEMEN KIMIA
FAKULTAS SAINS DAN TEKNOLOGI UNIVERSITAS AIRLANGGA
PENGOLAHAN ZAT WARNA TEKSTIL JINGGA METIL MENGGUNAKAN BENTONIT TERPILAR TiO2
SKRIPSI
Sebagai Salah Satu Syarat Untuk Memperoleh Gelar Sarjana Sains Bidang Kimia Pada Fakultas Sains dan Teknologi
Universitas Airlangga
Oleh :
IKE SILVIYANTI NIM. 080810118
Tanggal lulus : 18 Juli 2012
Disetujui oleh :
Pembimbing I,
Dr. Muji Harsini, M.Si NIP. 19640502 198903 2 002
Pembimbing II,
LEMBAR PENGESAHAN NASKAH SKRIPSI
Judul : Pengolahan Zat Warna Tekstil Jingga Metil Menggunakan Bentonit Terpilar TiO2
Penyusun : Ike Silviyanti
NIM : 080810118
Tanggal Sidang : 18 Juli 2012
Disetujui oleh :
Pembimbing I,
Dr. Muji Harsini, M.Si NIP. 19640502 198903 2 002
Pembimbing II,
Yanuardi Raharjo, S.Si., M.Sc NIK. 139 090 961
Mengetahui,
Kepala Departemen Kimia Fakultas Sains dan Teknologi
Universitas Airlangga
Dr. Alfinda Novi Kristianti, DEA NIP. 19671115 199102 2 001
Skripsi ini tidak dipublikasikan, namun tersedia di perpustakaan dalam
lingkungan Universitas Airlangga. Diperkenankan untuk dipakai sebagai referensi
kepustakaan, tetapi pengutipan seijin penulis dan harus menyebutkan sumbernya
sesuai kebiasaan ilmiah.
KATA PENGANTAR
Alhamdulillahirabbil’alamin, segala puji syukur senantiasa penyusun
panjatkan kepada Allah SWT atas segala rahmat dan hidayah-Nya, sehingga
penyusun dapat menyelesaikan skripsi dengan judul “Pengolahan Zat Warna
Tekstil Jingga Metil Menggunakan Bentonit Terpilar TiO2” dengan tepat waktu.
Penulisan skripsi ini tidak akan selesai tanpa bantuan dan dukungan dari berbagai pihak.
Oleh karena itu, penyusun ingin mengucapkan terima kasih kepada:
1. Ibu Dr. Muji Harsini, M.Si selaku dosen pembimbing I dan Bapak Yanuardi Raharjo, S.Si., M.Sc selaku dosen pembimbing II yang telah memberikan waktu, saran, dan bimbingan kepada penyusun hingga terselesaikan skripsi
ini.
2. Bapak Drs. Yusuf Syah, MS. dan Ibu Dr. Alfinda Novi Kristianti, DEA
selaku penguji skripsi ini, terima kasih atas kritik dan saran yang telah diberikan sehingga penyusun dapat menyempurnakan penulisan skripsi ini.
3. Ibu Dr. Sri Sumarsih, M.Si serta Ibu Dr. Afaf Baktir selaku dosen wali yang senantiasa memberikan banyak informasi dan membimbing penyusun dalam menyelesaikan permasalahahan akademik.
4. Ibu Dr. Alfinda Novi Kristianti, DEA selaku Ketua Departemen Kimia yang
senantiasa memberikan ilmu dan saran yang sangat bermanfaat.
5. Bapak dan Ibu penyusun yang selalu memberikan kasih sayang, doa,
6. Serta pihak – pihak yang tidak dapat disebutkan satu persatu yang banyak
memberikan saran, masukan dan pengalamannya.
Penyusun menyadari bahwa dalam penulisan proposal skripsi ini masih
banyak kekurangan, sehingga penyusun mengharapkan kritik dan saran yang
membangun demi perbaikan proposal skripsi ini selanjutnya. Penyusun berharap
proposal skripsi ini dapat bermanfaat bagi perkembangan ilmu pengetahuan.
Surabaya, Juli 2012
Penyusun
DAFTAR ISI
2.5.1 Mekanisme fotokatalisis semikonduktor TiO2... 13
2.6 Zat Warna Azo ... 15
2.7 Jingga Metil ... 16
BAB III METODE PENELITIAN... 17
3.1 Tempat dan Waktu Penelitian... 17
3.2 Bahan dan Alat Penelitian... 17
3.2.1 Bahan-bahan ... 17
3.2.2 Alat-alat ... 17
3.3 Diagram Alir Penelitian ... 18
3.4 Prosedur Penelitian ... 19
3.4.1 Pembuatan larutan HCl 0,1 M ... 19
3.4.2 Pembuatan larutan HCl 6,0 M ... 19
3.4.3 Pembuatan larutan TiCl40,1 M ... 19
3.4.4 Pembuatan larutan induk jingga metil 1000 ppm... 19
3.4.7 Pembuatan larutan jingga metil pada berbagai
3.4.11 Pembuatan kurva kalibrasi jingga metil... 22
3.4.12 Penentuan waktu optimum degradasi zat warna jingga metil ... 22
3.4.13 Penentuan pH optimum degradasi zat warna jingga metil ... 23
3.4.14 Karakteristik degradasi zat warna jingga metil pada berbagai variasi konsentrasi terhadap kapasitas degradasi bentonit terpilar TiO2... 24
3.4.15 Degradasi jingga metil menggunakan sinar UV... 25
3.4.16 Degradasi jingga metil menggunakan bentonit/UV ... 25
3.4.17 Degradasi jingga metil menggunakan TiO2/UV ... 26
3.4.18 Degradasi jingga metil menggunakan bentonit terpilar TiO2 ... 27
3.4.19 Degradasi jingga metil menggunakan bentonit terpilar TiO2/UV ... 27
BAB IV HASIL DAN PEMBAHASAN ... 29
4.1 Pembuatan Bentonit Terpilar TiO2 ... 29
4.2 Karakterisasi Menggunakan X-Ray Diffraction ... 31
4.3 Penentuan Panjang Gelombang Maksimum Larutan Jingga Metil ... 34
4.4 Pembuatan Kurva Kalibrasi Jingga Metil ... 35
4.5 Penentuan Waktu Optimum Degradasi Larutan Jingga Metil ... 37
4.6 Penentuan pH Optimum Degradasi Jingga Metil ... 39
4.7 Karakteristik Degradasi Zat Warna Jingga Metil pada Berbagai Variasi Konsentrasi terhadap Kapasitas Degradasi Bentonit Terpilar TiO2 ... 41
DAFTAR TABEL
Nomor Judul Tabel Halaman
2.1 Karakteristik senyawa azo ... 16
4.1 Panjang gelombang maksimum larutan jingga metil ... 35
DAFTAR GAMBAR
Nomor Judul Gambar Halaman
2.1 Struktur kelompok smektit ... 7
2.2 Skema struktur bentonit . ... 8
2.3 Struktur kristal Rutile (A), Anatase (B), dan Brookite (C) ...13
2.4 Mekanisme fotokatalitik pada TiO2...13
2.5 Struktur kimia jingga metil ... 16
3.1 Reaktor fotokatalitik ...17
4.1 (a) Analisa XRD bentonit alam (b) Analisa XRD bentonit terinterkalasi Ti4+ (c) Analisa XRD bentonit terpilar TiO2 ...32
4.2 Kurva kalibrasi jingga metil pada pH 2; 3,5; dan 6 ... 26
4.3 Grafik hubungan antara % degradasi terhadap waktu degradasi larutan jingga metil 50 ppm pada pH 2; 3,5; dan 6 menggunakan 0,5000 g bentonit terpilar TiO2dan lampu UV 3 x 8 watt ...38
4.4 Grafik hubungan antara pH dengan % degradasi larutan jingga
4.7 Grafik perbandingan hasil degradasi larutan jingga metil 50 ppm pada pH 2 dan pH 6 dengan menggunakan sinar UV, TiO2/UV, bentonit/UV, TiO2/bentonit, serta TiO2/bentonit/UV ...44
DAFTAR LAMPIRAN
Nomor Judul
1. Hasil karakterisasi menggunakan X-Ray Diffraction
2. Tabel JCPDS untuk harga jarak antarbidang, d-spacing dengan intensitas terkuat untuk beberapa mineral
3. Tabel JCPDS untuk harga jarak antarbidang, d-spacing dengan intensitas terkuat untuk titanium dioksida anatase
4. Spektrum panjang gelombang jingga metil pada pH 2; 3,5; dan 6 5. Perhitungan persen degradasi jingga metil menggunakan
TiO2/bentonit/UV pada optimasi waktu pH 2; 3,5; dan 6
6. Perhitungan persen degradasi jingga metil menggunakan TiO2/bentonit/UV pada optimasi pH
7. Perhitungan kapasitas degradasi jingga metil pada konsentrasi 25, 50, 75, 100, 150, 200, dan 250 ppm menggunakan TiO2/Bentonit/UV
Bentonit Terpilar TiO2, Skripsi ini di bawah bimbingan Dr. Muji Harsini, M.Si.
dan Yanuardi Raharjo, S.Si., M.Sc., Departemen Kimia, Fakultas Sains dan Teknologi, Universitas Airlangga, Surabaya.
ABSTRAK
Telah dilakukan penelitian pengolahan zat warna tekstil jingga metil menggunakan bentonit terpilar TiO2. Tujuan penelitian ini adalah menentukan
waktu dan pH yang optimum pada degradasi jingga metil, mengetahui karakteristik degradasi jingga metil pada berbagai variasi konsentrasi terhadap kapasitas degradasi bentonit terpilar TiO2, serta mempelajari pengaruh UV,
TiO2/UV, bentonit/UV, TiO2/bentonit, dan TiO2/bentonit/UV terhadap degradasi
zat warna jingga metil. Pembuatan TiO2/bentonit dilakukan dengan
mendispersikan larutan pemilar dalam bentuk oligokation titanium ke dalam bentonit alam. Campuran diaduk selama 5 jam kemudian dicuci hingga terbebas dari ion klorida. Bentonit terinterkalasi Ti4+ kemudian dikalsinasi pada suhu 450oC selama 4 jam untuk membentuk pilar TiO2. Bentonit alam, bentonit
terinterkalasi, dan TiO2/bentonit dikarakterisasi menggunakan X-Ray Diffraction
untuk mengetahui perubahan basal spacing. Larutan jingga metil 50 ppm dicampur dengan TiO2/bentonit kemudian disinari dengan lampu UV 3 x 8 watt di
dalam reaktor tertutup selama waktu optimum 3 jam pada pH 2 dan 3,5 sedangkan pada pH 6 waktu optimumnya adalah 1 jam. Konsentrasi sisa jingga metil diukur dengan spektrofotometer UV-Vis. Hasil karakterisasi XRD TiO2/bentonit
menunjukkan runtuhnya bidang d001= 15,5 Ao monmorilonit serta munculnya
beberapa puncak difraktogram TiO2 anatase. Hasil optimasi pH pada degradasi
jingga metil menggunakan TiO2/bentonit adalah pH 2 dengan persen degradasi
sebesar 71,886 %. Pengaruh variasi konsentrasi awal menunjukkan tercapainya kesetimbangan pada konsentrasi 200 ppm dengan kapasitas degradasi sebesar 144,540 mg/g. Perbandingan hasil degradasi pada keadaan optimum menggunakan UV, TiO2/UV, bentonit/UV, TiO2/bentonit, dan TiO2/bentonit/UV
menunjukkan persen degradasi masing-masing sebesar 2,757 %, 23,264 %, 90,757 %, 67,361 %, dan 71,886 %.
Pillared Bentonite. Script was under consulted by Dr. Muji Harsini, M.Si. and
Yanuardi Raharjo, S.Si., M.Sc., Chemistry Department, Faculty of Science and Technology of Universitas Airlangga, Surabaya.
ABSTRACT
The research of methyl orange textile dyes treatment using TiO2pillared bentonite
has been studied. The purposes of this research were to determine the optimum time and pH value, knowing the degradation characteristics between methyl orange degradation at concentrations variety of the degradation capacity using TiO2 pillared bentonite, and studying the effects of UV, TiO2/UV, bentonite/UV,
TiO2/bentonite, and TiO2/bentonite/UV to degrade methyl orange dye.
TiO2/bentonit made by dispersing of pillaring solution (in form oligocations of
titanium) into the natural bentonite. The mixture was stirred for 5 hours and then washed until free of chloride ion and then calcined at 450oC for 4 hours to form the pillars of TiO2. Natural bentonite, intercalated bentonite, and TiO2/bentonite
were characterized using X-Ray Diffraction to determine the changes in basal spacing. Methyl orange solution 50 ppm was mixed with TiO2/bentonit then
irradiated with UV light 3 x 8 watts in closed reactor for 3 hours as the optimum time at pH value 2 and 3.5 while at pH value 6 it irradiated for 1 hour. Residual concentration of methyl orange was measured by spectrophotometer UV-Vis. The results of TiO2/bentonit XRD characterization was indicated the disappearance of
the field's d001= 15.5 Aoof montmorillonite and the appearance of multiple peaks
of anatase TiO2 difractogram. The result of pH value optimization on the methyl
orange degradation using TiO2/bentonit is pH 2. The effect of initial dye
concentration variations indicate the achievement of equilibrium at a concentration of 200 ppm. Comparison study of degradation results in optimum condition using UV, TiO2/UV, bentonite/UV, TiO2/bentonite, and
TiO2/bentonite/UV shows degradation percent amounting to 2.757%, 23. 264 %,
90.757%, 67.361% and 71.886%, respectively.
BAB 1 PENDAHULUAN
1.1 Latar Belakang Masalah
Sebagai negara yang sedang berkembang, Indonesia mengandalkan sektor
industri, salah satunya adalah industri tekstil. Industri dan produk tekstil
memberikan efek multiplier dalam kehidupan masyarakat baik dari sisi tenaga
kerja, pendapatan maupun terhadap output industri itu sendiri. Perkembangan
sektor industri tekstil dan produk tekstil di Indonesia menjadikan industri ini
sebagai salah satu industri terpenting dan menjadi ujung tombak dalam
meningkatkan perekonomian di Indonesia (Maryadi, 2007).
Seiring dengan perkembangan industri tekstil di Indonesia, produksi
limbah cair zat warna tekstil pun semakin meningkat. Kehadiran limbah tersebut
memberikan suatu permasalahan yang dominan terhadap lingkungan. Proses
pencelupan pada industri tekstil memberikan kontribusi yang besar pada
pencemaran air apabila limbah dibuang ke selokan atau sungai tanpa diolah
terlebih dahulu (Suwarsa,1998). Selama proses pencelupan berlangsung, sekitar 10-15% zat warna dihasilkan sebagai limbah (Fang et al., 2004).
Zat warna azo adalah senyawa yang paling banyak terdapat dalam limbah
tekstil, yaitu sekitar lebih dari 50 % (Blackburn dan Burkinshaw., 2002). Limbah
zat warna azo merupakan penggambaran dari kelas polutan organik yang
berpotensi karsinogenik (Garcia et al., 2006). Walaupun toksisitas akut zat warna
penetrasi sinar matahari ke dalam air sehingga mengganggu aktivitas fotosintesis
mikroalga. Dampak lanjutannya adalah pasokan oksigen dalam air menjadi
berkurang dan akhirnya memicu aktivitas mikroorganisme anoksik-anaerobik
yang menghasilkan produk berbau tak sedap. Di samping itu, perombakan zat
warna azo secara anaerobik pada dasar perairan menghasilkan senyawa amina
aromatik yang kemungkinan lebih toksik dibandingkan dengan zat warna azo itu
sendiri (Zee, 2002).
Air limbah tekstil umumnya memiliki intensitas warna berkisar 50-100
mg/L dengan nilai parameter BOD dan COD berturut-turut 80-6.000 mg/L dan
150-12.000 mg/L (Pandey et al., 2007). Nilai parameter COD dan BOD tersebut
berada jauh di atas nilai ambang batas baku mutu limbah cair industri tekstil yang
terdapat pada KepMen LH No. 51/MENLH/10/1995 yaitu masing-masing
sebesar 300 dan 150 mg/L. Metode alternatif secara fisika, kimia dan biologi telah
banyak dilakukan untuk mereduksi zat warna dan senyawa organik dalam limbah
cair industri tekstil (Lucas dan Peres, 2009).
Supriyati (2007) melakukan penelitian mengenai degradasi zat warna
dengan menggunakan ozon yang diproduksi dengan menggunakan plasma.
Namun, penelitian ini kurang efisien karena menggunakan sumber energi yang
sangat besar dalam jumlah kilovolt. Penghilangan warna secara kimia
menggunakan koagulan akan menghasilkan lumpur (sludge) dalam jumlah yang
relatif besar. Menurut Peraturan Pemerintah No. 19 tahun 1994, lumpur yang
Dengan adanya penanganan lanjutan ini akan menaikkan biaya operasional unit
pengolahan limbah (Manurung dkk., 2004). Pengolahan limbah cair dengan
menggunakan proses biologi juga banyak diterapkan untuk mereduksi senyawa
organik limbah cair industri. Namun, berbagai penelitian menunjukkan bahwa
proses biologi konvensional kurang efektif dalam mereduksi zat warna. Hal
tersebut karena zat warna cenderung mempunyai sifat tahan terhadap degradasi
biologi (recalcitrance)(Manurung dkk., 2004).
Untuk mengatasi masalah di atas diperlukan alternatif baru untuk
mengolah limbah cair indutri tekstil yang efektif dan efisien dalam menurunkan
konsentrasi zat warna. Fotokatalitik heterogen merupakan salah satu metode yang
digunakan untuk pengolahan limbah cair. Proses ini dapat juga disebut proses
oksidasi berkelanjutan yang cocok untuk mengoksidasi zat warna. Proses oksidasi
berkelanjutan ini berdasarkan pada pembentukan radikal hidroksi (HO•), yang
merupakan oksidator kuat (E°=2.8 eV) yang dapat mempromosikan mineralisasi
total pada polutan organik (Faisal et al., 2007; Saquib et al., 2008; Singh et al.,
2008).
Titanium oksida merupakan fotokatalis yang paling banyak diteliti untuk
proses degradasi polutan organik pada limbah cair. Katalis ini sangat
menguntungkan jika dibandingkan dengan semikonduktor yang lain karena
kestabilan kimianya, tidak beracun, harganya murah dan tersedia secara komersial
(Li et al., 2008; Suwanchawalit dan Wongnawa, 2008; Wang et al., 2008; Yang et
al., 2008). Pada proses fotokatalitik menggunakan TiO2 akan dihasilkan radikal
mengoksidasi senyawa organik (Barkaet al., 2010). Radikal hidroksil merupakan
radikal yang paling reaktif di antara jenis-jenis radikal yang lain (Stephanson et
al., 2003).
Efektivitas TiO2 bergantung pada struktur kristal, ukuran partikel,
permukaan area, dan porositas. Serbuk TiO2 ultrafine menunjukkan aktivitas
katalitik yang baik. Akan tetapi dapat terjadi penggumpalan yang menghasilkan
partikel yang lebih besar sehingga dapat menyebabkan reduksi atau hilangnya
efektivitas katalitik (Valverde et al., 2003; Suwanchawalit dan Wongnawa, 2008).
Cara yang dapat digunakan untuk memaksimalkan kerja TiO2 adalah dengan
menjadikannya pemilar dalam lempung terpilar TiO2, dimana TiO2dapat berperan
sebagai pemilar sekaligus sebagai katalis dalam reaksi fotokatalisis (Ding et al.,
1999)
Bentonit merupakan salah satu jenis lempung yang mempunyai kandungan
utama mineral montmorillonit (85% – 95%) dengan rumus kimia secara umum
Mx(Al4-xMgx)Si8O20(OH)4.nH2O. Montmorillonit merupakan kelompok mineral
lempung yang unik karena memiliki kemampuan mengembang (swelling),
memiliki kation-kation yang dapat dipertukarkan (exchangeable cations), dan
dapat diinterkalasi (Pinnavaia, 1983).
Berdasarkan uraian di atas, akan dilakukan pilarisasi bentonit dengan TiO2
untuk mendegradasi zat warna azo. Pembuatan bentonit terpilar TiO2 dilakukan
dengan merendam bentonit pada larutan TiCl4kemudian dilakukan kalsinasi pada
Karakterisasi struktur kristal bentonit dan bentonit terpilar TiO2dilakukan dengan
XRD (X-Ray Diffraction). Sedangkan uji aktivitas fotokatalitik dianalisis
menggunakan spektrofotometer UV-Vis. Penggunaan sinar ultraviolet selama
proses pengolahan zat warna tekstil menggunakan bentonit terpilar TiO2 dapat
meningkatkan kinerja fotokatalis TiO2 yang terpilar pada ruang interlamelar
bentonit dengan menghasilkan radikal hidroksil yang mampu mendegradasi zat
warna. Optimasi pH perlu dilakukan pada penelitian ini karena perubahan pH
mampu mempengaruhi perubahan struktur dari zat warna serta dapat
mempengaruhi kemampuan bentonit terpilar TiO2untuk mendegradasi zat warna.
1.2 Rumusan Masalah
Berdasarkan uraian latar belakang tersebut, maka dapat dirumuskan
permasalahan sebagai berikut.
1. Berapakah waktu serta pH yang optimum untuk mendegradasi zat warna
jingga metil menggunakan bentonit terpilar TiO2?
2. Bagaimana karakteristik degradasi zat warna jingga metil pada berbagai
variasi konsentrasi terhadap kapasitas degradasi bentonit terpilar TiO2?
3. Bagaimana pengaruh sinar UV, TiO2/UV, bentonit/UV, TiO2/bentonit, serta
TiO2/bentonit/UV terhadap degradasi zat warna jingga metil?
1.3 Tujuan Penelitian
1. Menentukan waktu serta pH yang optimum untuk mendegradasi zat warna
2. Mengetahui karakteristik zat warna jingga metil pada berbagai variasi
konsentrasi terhadap kapasitas degradasi bentonit terpilar TiO2.
3. Mempelajari pengaruh sinar UV, TiO2/UV, bentonit/UV, TiO2/bentonit, serta
TiO2/bentonit/UV terhadap degradasi zat warna jingga metil.
1.4 Manfaat Penelitian
Manfaat penelitian ini adalah memberikan informasi mengenai
penggunaan bentonit terpilar TiO2 dengan bantuan sinar UV untuk mendegradasi
BAB II
TINJAUAN PUSTAKA
2.1 Bentonit
Bentonit adalah mineral lempung yang mengandung monmorilonit di atas
75%, sejumlah kuarsa, serta sedikit campuran illit, kalsit, mika, dan klorit.
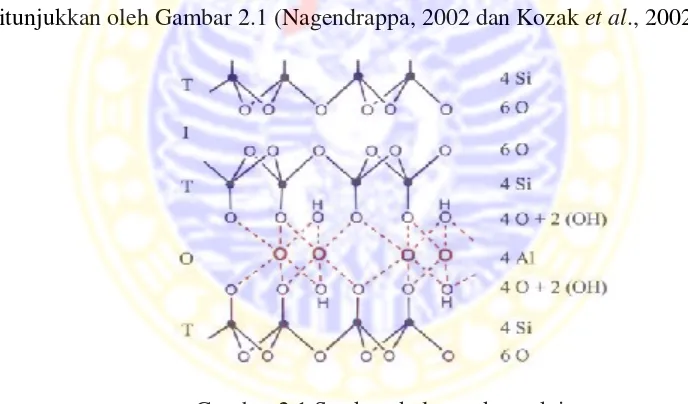
Bentonit termasuk dalam kelompok smektit dalam golongan phyllosilicate
berstruktur 2:1 yang tersusun dari dua lembar tetrahedral [SiO4]4- (T) dan satu
lembar oktahedral alumina Al2(OH)6 (O) serta memiliki ruang interlamelar (I),
ditunjukkan oleh Gambar 2.1 (Nagendrappa, 2002 dan Kozak et al., 2002).
Gambar 2.1 Struktur kelompok smektit
Berdasarkan struktur tersebut, komposisi ideal monmorilonit adalah
HAlSi2O6 dan permukaan lapisannya bersifat netral, tetapi di alam komposisi
tersebut berubah menjadi tidak menentu, yaitu
Mn+x/n[Al4xMgx][Si8]O20(OH)4.nH2O dan permukaan lapisannya bermuatan
negatif. Kation Mn+ adalah kation penyeimbang muatan. Perubahan tersebut
Al3+oleh Mg2+atau ruang kosong (vacancy) pada lembar oktahedral (Bergaya et
al., 2006). Jumlah muatan negatif pada lapisan (layer charge) bentonit tergolong
rendah yaitu 0.25 – 0.60 per unit formula. Hal ini menyebabkan ikatan
interlamelarnya lemah, sehingga molekul-molekul polar, seperti air dapat masuk
pada daerah interlamelar menyebabkan mineral monmorilonit dapat mengembang
atau mengalami swelling karena bidang basal lapisan bentonit akan bergerak
saling menjauh (Yerima dan Van Ranst, 2005). Masuknya air juga akan
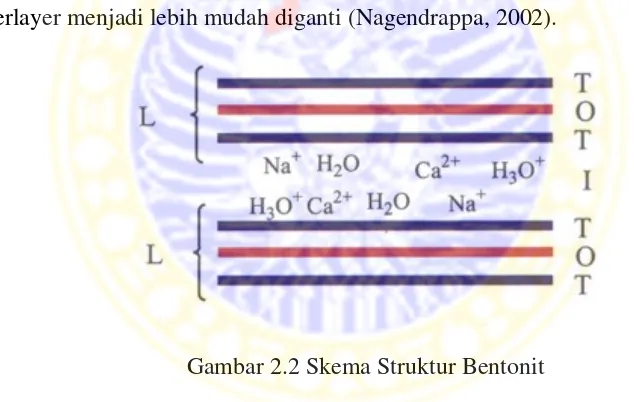
menimbulkan terbentuknya kation hidrat pada daerah interlamelar, ditunjukkan
oleh Gambar 2.2. Semakin banyak air yang masuk, kation-kation yang ada pada
interlayer menjadi lebih mudah diganti (Nagendrappa, 2002).
Gambar 2.2 Skema Struktur Bentonit
Berdasarkan sifat-sifat tersebut, bentonit banyak dimanfaatkan sebagai
adsorben, penghilang warna (decoloration agent), penukar ion (ion exchange),
dan katalis. Daya guna bentonit berasal dari grup Si – O – Si, Al – OH – Al , dan
situs asam. Grup Si – O – Si pada permukaan bidang basal dapat mengadsorpsi
basal, karena difusi muatan negatif yang ditimbulkan oleh substitusi isomorfis
Si4+ oleh Al3+, sehingga kation logam dapat terperangkap oleh rongga di trigonal
pada siloksan. Situs-situs pada tepi bentonit cenderung lebih reaktif untuk
adsorpsi ion, karena terdapat gugus silanol, Si(IV) OH dan aluminol, Al(III).H2O
(Maurice et al.,2009).
2.2 Fotokatalisis
Fotokatalisis adalah reaksi perpaduan antara fotokimia dan katalis. Proses
reaksi fotokimia melibatkan suatu cahaya (foto). Fotokatalisis sendiri adalah suatu
proses yang dibantu oleh adanya cahaya dan material katalis. Katalis adalah suatu
zat yang mempengaruhi proses laju reaksi tanpa ikut berubah secara kimia.
Katalis dapat mempercepat fotoreaksi melalui interaksinya dengan substrat baik
keadaan dasar maupun tereksitasi atau dengan fotoproduk utamanya, tergantung
pada mekanisme fotoreaksi tersebut (Otmer dan Kirk, 1994).
Berdasarkan fasanya, fotokatalisis dibagi menjadi dua, yaitu fotokatalisis
homogen dan fotokatalisis heterogen.
1. Fotokatalisis homogen, merupakan suatu proses fotokatalisis satu fasa
antara subtrat dengan katalis. Pada umumnya katalis berupa oksidator
seperti ozon (O3) dan hidrogen peroksida (H2O2).
2. Fotokatalisis heterogen, merupakan suatu proses fotokatalisis dua fasa
yang dilakukan dengan bantuan semikonduktor. Semikonduktor yang
dipakai dalam proses ini adalah titanium dioksida (TiO2), seng oksida
2.3 Fotodegradasi
Fotodegradasi adalah proses peruraian suatu senyawa (biasanya senyawa
organik) dengan bantuan energi foton. Proses fotodegradasi memerlukan suatu
fotokatalis, yang umumnya merupakan bahan semikonduktor. Prinsip
fotodegradasi adalah adanya loncatan elektron dari pita valensi ke pita konduksi
pada logam semikonduktor jika dikenai suatu energi foton. Loncatan elektron ini
menyebabkan timbulnya hole (lubang elektron) yang dapat berinteraksi dengan
pelarut (air) membentuk radikal •OH. Radikal bersifat aktif dan dapat berlanjut
untuk menguraikan senyawa organik target (Malldotti et al., 2000 dan Ranjit et
al., 1998).
2.4 Titanium Tetraklorida
Titanium tetraklorida merupakan cairan tidak berwarna yang dapat larut
pada air dengan penambahan panas serta larut pada asam hidroklorit encer.
Rumus kimia untuk titanium tetraklorida adalah TiCl4 dengan berat molekul
189,68 g/mol. Titanium tetraklorida memiliki aroma asam yang sangat kuat
(O’Neil, 2001). Tekanan uap titanium tetraklorida adalah 10.0 mm Hg pada suhu
20° C (ATSDR, 1997). Titanium tetraklorida memiliki sifat korosif, tidak mudah
terbakar, merupakan cairan yang stabil dan tidak dapat terdekomposisi secara
termal di bawah lapisan udara inert pada suhu kamar (Lewis, 2001). Titanium
tetraklorida dihidrolisis sempurna oleh udara lembab (Greenwood dan Earnshaw,
Titanium tetraklorida dapat digunakan sebagai senyawa intermediete pada
pembuatan logam titanium, titanium dioksida, pigmen titanium pada industri
gelas warna-warni dan mutiara imitasi, sebagai katalis polimerisasi serta untuk
menghasilkan layar asap. Titanium tetraklorida jika direaksikan dengan potassium
bitartrat dapat digunakan sebagai pengikat zat warna pada industri tekstil serta
direaksikan dengan zat warna kayu dalam pewarnaan kulit (O’Neil, 2001).
Titanium tetraklorida dapat menyebabkan iritasi pada kulit, mata, dan
membran selaput lendir pada manusia. Dampak akut jangka pendek akan terlihat
pada permukaan kulit yang terbakar, hidung tersumbat, dan sesak pada beberapa
bagian jalur pernapasan atas pada manusia. Dampak jangka pendek juga dapat
menimpa mata. Penyakit paru-paru merupakan dampak akut dalam jangka
panjang dari penggunaan titanium klorida pada pekerja produksi logam titanium
(ATSDR, 1997).
2.5 Titanium Dioksida
Titanium dioksida (TiO2) merupakan oksida logam Ti (Titanium) yang
paling banyak dijumpai (Greenwood dan Earnshaw, 1997). Titanium dioksida
dikenal sebagai senyawa dioksida berwarna putih yang tahan karat dan tidak
beracun. Berdasarkan sifatnya ini TiO2 telah lama digunakan sebagai bahan
pemberi warna (pigmen) putih pada makanan maupun produk kosmetik.
Konfigurasi elektron atom titanium (22Ti) adalah 1s2,2s2,2p6,3s2,3p6,4s2,3d2.
Sementara atom oksigen (8O) yaitu 1s2,2s2,2p4. Secara sederhana orbital molekul
energi kulit 3d menjadi daerah konduktif molekul sedangkan kulit 2p menjadi area
valensi molekul.
Titanium dioksida (TiO2) secara mikroskopis memiliki dua bentuk utama
yaitu kristal dan amorf (Gunlazuardi, 2001). Titanium dioksida (TiO2) amorf
seperti layaknya senyawa amorf lain tidak memiliki keteraturan susunan atom
sehingga bahan tersebut tidak memiliki keteraturan pita konduksi dan valensi.
Titanium dioksida amorf juga dikenal memiliki kemampuan untuk mendegradasi
polutan dalam waktu yang singkat.
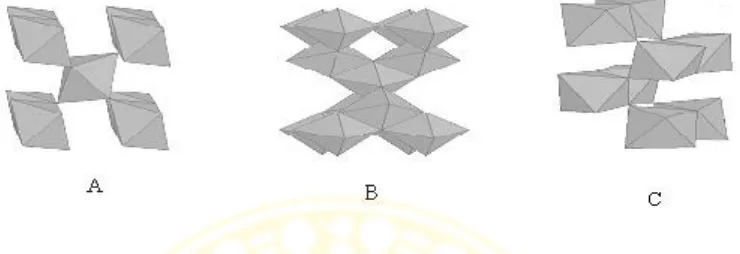
Titanium dioksida bentuk kristal diketahui memiliki tiga fase kristal yang
berbeda yaitu rutile, anatase, dan brookite. Rutile merupakan bentuk kristal yang
paling stabil dibandingkan dua fase lainnya, oleh karena itu kristal jenis ini lebih
mudah ditemukan dalam bentuk yang paling murni (bijih). Anatase dikenal
sebagai fase kristal yang paling reaktif terhadap cahaya, eksitasi elektron ke pita
konduksi dapat dengan mudah terjadi apabila kristal ini dikenai cahaya dengan
energi yang lebih besar dari pada celah energinya. Kristal ini juga dapat terbentuk
akibat pemanasan TiO2 amorf pada suhu 400oC hingga 600oC. Sedangkan
pemanasan hingga 700oC akan menyebabkan kristal anatase bertransformasi
menjadi rutile. Brookite merupakan jenis kristal yang paling sulit diamati karena
sifatnya yang tidak mudah dimurnikan.
Rutile adalah bentuk kristal TiO2 yang paling umum dihasilkan di alam
dan diproduksi secara komersial di pasaran. Struktur Rutile berbentuk oktahedral
kubik (Greenwood dan Earnshaw, 1997). Struktur kristal TiO2 rutile, anatase, dan
brookite dapat dilihat pada Gambar 2.3.
Gambar 2.3 Struktur kristal Rutile (A), Anatase (B), dan Brookite (C)
2.5.1 Mekanisme fotokatalisis semikonduktor TiO2
Proses fotokatalitik pada TiO2 terjadi bila semikonduktor TiO2 menyerap
cahaya yang berenergi sama atau lebih besar dari energi celah yang dimilikinya
sehingga elektron (e-) pada pita valensi (pv) tereksitasi ke pita konduksi (pk) dan
meninggalkan holepositif (h+) pada pita valensi.
Semikonduktor + hvh+pv+ e-pk (2.1)
Proses fotokatalitik pada semikonduktor TiO2 dapat dijelaskan pada
Gambar 2.4.
1. Pembentukan pasangan pembawa muatan (e-dan h+) oleh foton
TiO2+ hvTiO2(h+pv+ e-pk)
2. Rekombinasi kedua pembawa muatan dengan membebaskan energi panas
e-pk+ (>Ti(IV)OH•)+>Ti(IV)OH
h+pv+ (>Ti(III)OH) >Ti(IV)OH
3. Inisiasi reaksi oksidasi oleh holepositif pada pita valensi
(>Ti(IV)OH•)++ red Ti(IV)OH + red•+
4. Inisiasi reaksi reduksi oleh elektron pada pita konduksi
e-tr+ oks >Ti(IV)OH + oks•+
5. Reaksi fotkatalitik menghasilkan radikal pendegradasi senyawa organik dan
sel bakteri.
Keterangan :
>TiOH : permukaan TiO2yang terhidrat primer
e-pk : elektron pada pita konduksi
h+pv : holepositif pada pita valensi
(>Ti(IV)OH•)+ : holepositif pita valensi yang terjebak di permukaan (>Ti(III)OH)= e-tr : elektron pita konduksi yang terjebak di permukaan
Red : donor elektron, mengalami oksidasi
Oks : akseptor elektron, mengalami reduksi
Hole positif ini dapat bereaksi baik dengan H2O yang teradsorpsi secara
fisik sehingga mampu menguraikan molekul H2O dan O2 menjadi radikal •OH
bakteri sehingga menyebabkan inaktivasi dan kematian pada sel bakteri
(Sirimahachai et al., 2009).
2.6 Zat Warna Azo
Penggolongan zat warna menurut "Colours Index" volume 3, terutama
menggolongkan zat warna atas dasar sistem kromofor yang berbeda misalnya zat
warna Azo, Antrakuinon, Ftalosia, Nitroso, Indigo, Benzodifuran, Okazin,
Polimetil, Di- dan Tri-Aril Karbonium, Poliksilik, Aromatik Karbonil,
Quionftalen, Sulfer, Nitro, Nitrosol dan lain-lain (Heaton, 1994).
Zat warna azo adalah kelas terbesar dan terpenting pada golongan zat
warna. Jumlah zat warna azo mencapai ribuan (Fessenden dan Fessenden, 1986).
Senyawa azo memiliki struktur umum R─N═N─R’, dengan R dan R’ adalah
rantai organik yang sama atau berbeda. Senyawa ini memiliki gugus ─N═N─
yang dinamakan struktur azo. Nama azo berasal dari kata azote, merupakan
penamaan untuk nitrogen yang berasal dari bahasa Yunani a (bukan) + zoe
(hidup). Senyawa azo digunakan sebagai bahan celup, yang dinamakan azo dyes.
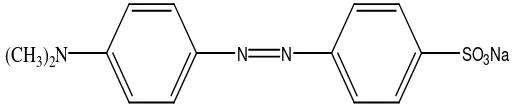
Salah satu contoh senyawa azo adalah jingga metil (Mirkhani, 2009).
Tabel 2.1 Karakterisitik senyawa azo (Mirkhani, 2009)
2.7 Jingga Metil
Dalam dunia industri jingga metil digunakan sebagai zat pewarna tekstil,
sementara itu di laboratorium jingga metil digunakan untuk menentukan kadar
alkalinitas air serta sebagai indikator pada proses titrasi, khususnya titrasi asam
mineral dan basa kuat. Senyawa azo seperti jingga metil, dapat digunakan sebagai
indikator asam, karena dapat berfungsi sebagai asam lemah yang berbeda warna
antara asam dan garamnya. Trayek pH jingga metil berada di antara pH 3,1
(berwarna merah) sampai dengan pH 4,4 (berwarna kuning) (O’Neil, 2001).
Struktur senyawa jingga metil dapat dilihat pada Gambar 2.5.
BAB III
METODE PENELITIAN
3.1 Tempat dan Waktu Penelitian
Penelitian ini dilakukan di Laboratorium Kimia Analitik dan Laboratorium
Penelitian Departemen Kimia Fakultas Sains dan Teknologi Universitas
Airlangga, mulai bulan Februari 2012 sampai Juni 2012.
3.2 Bahan dan Alat Penelitian 3.2.1 Bahan-bahan
Bahan-bahan kimia yang digunakan pada penelitian ini adalah bentonit
alam Turen Malang, TiCl4, TiO2, HCl, jingga metil, AgNO3, dan akuadem.
3.2.2 Alat-alat
Alat yang digunakan dalam penelitian ini adalah spektrofotometer
UV-Vis, centrifuge, neraca analitik, reaktor fotokatalitik, Lampu UV 8 watt (Yumiko
T8) sebanyak 3 buah, pengaduk magnet, oven, furnace, buret, pH meter, X-Ray
Diffraction, serta peralatan gelas yang biasa digunakan dalam laboratorium.
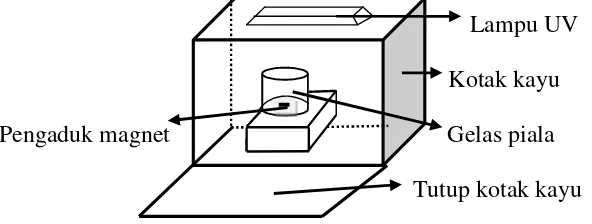
Lampu UV
Kotak kayu
Pengaduk magnet Gelas piala
Tutup kotak kayu
3.3 Diagram Alir Penelitian 120oC, dan lolos ayakan 100 mesh
3.4 Prosedur Penelitian
3.4.1 Pembuatan larutan HCl 0,1 M
Diambil 4,2 ml larutan HCl 37 % dengan massa jenis sebesar 1,18 g/cc
dan dimasukkan ke dalam gelas beaker 500 ml yang telah berisi 100 ml akuadem.
Selanjutnya ditambahkan akuadem hingga volume larutan menjadi 500 ml.
3.4.2 Pembuatan larutan HCl 6,0 M
Diambil 50 ml larutan HCl 37 % dan dimasukkan ke dalam gelas beaker
250 ml yang telah berisi 50 ml akuadem. Selanjutnya ditambahkan akuadem
hingga volume larutan menjadi 100 ml.
3.4.3 Pembuatan larutan TiCl40,1 M
Diambil 5,6 ml larutan TiCl4 99 % dengan massa jenis sebesar 1,728
g/cc dituangkan ke dalam 4 ml larutan HCl 6,0 M. Larutan diencerkan dengan
akuadem hingga volume 500 ml kemudian larutan pemilar didiamkan (aging)
selama 2 jam agar hidrolisis menjadi sempurna.
3.4.4 Pembuatan larutan induk jingga metil 1000 ppm
Ditimbang 1,0000 g jingga metil yang dilarutkan dengan 100 ml
akuadem dalam gelas beaker. Kemudian dipindahkan ke dalam labu ukur 1000 ml
secara kuantitatif dan diencerkan dengan akuadem sampai tanda batas.
3.4.5 Pembuatan larutan standar jingga metil
Diambil larutan induk 1000 ppm secara kuantitatif menggunakan pipet
sehingga diperoleh larutan kerja jingga metil 100 ppm. Kemudian diambil
masing-masing 2, 3, 4, 5, 6, 7, 8, 9, dan 11 ml larutan kerja jingga metil 100 ppm
menggunakan buret lalu ditambahkan akuadem hingga tanda batas dalam labu
ukur 100 ml untuk menghasilkan larutan standar jingga metil dengan konsentrasi
2, 3, 4, 5, 6, 7, 8, 9, dan 11 ppm pada pH 6. Larutan standar tersebut diukur
pHnya menggunakan pH meter. Pembuatan larutan standar pada keadaan yang
lebih asam, yaitu pada pH 2 dan 3,5 sama dengan pembuatan larutan standar pada
pH 6 hanya saja sebelum diencerkan dengan akuadem, masing-masing larutan
standar diatur pada pH 2 dan 3,5 menggunakan HCl 0,1 M dan diukur pHnya
menggunakan pH meter.
3.4.6 Pembuatan larutan jingga metil 50 ppm
Diambil larutan induk jingga metil 1000 ppm secara kuantitatif
menggunakan pipet volume 25,0 ml dimasukkan ke dalam labu ukur 500 ml.
Selanjutnya larutan diencerkan dengan akuadem hingga tanda batas. Larutan
dihomogenkan sehingga diperoleh larutan jingga metil dengan konsentrasi 50
ppm.
3.4.7 Pembuatan larutan jingga metil pada berbagai variasi konsentrasi
Diambil larutan induk jingga metil 1000 ppm secara kuantitatif
menggunakan buret sebanyak 12,50; 37,50; 50,00; 75,00; 100,00; dan 125,00 ml
dimasukkan ke dalam labu ukur 500 ml. Selanjutnya larutan diencerkan dengan
jingga metil dengan konsentrasi masing-masing 25, 75, 100, 150, 200, dan 250
ppm.
3.4.8 Pembuatan bentonit terpilar TiO2
Bentonit alam dicuci beberapa kali menggunakan akuadem kemudian
disentrifugasi dan dipisahkan dengan pasir. Selanjutnya, bentonit dikeringkan
dalam oven pada temperatur 120o C selama 5 jam. Setelah kering lempung
bentonit digerus sampai halus dan diayak menggunakan ayakan 100 mesh.
Ditimbang 150 gram lempung bentonit alam yang telah dipreparasi
Kemudian dituangkan sedikit demi sedikit larutan 450 ml TiCl4 0,1 M sambil
diaduk dengan pengaduk magnet selama 5 jam. Hasil interkalasi dipisahkan
dengan penyaring vakum kemudian dicuci beberapa kali dengan akuadem sampai
terbebas dari ion klorida. Pencucian dihentikan jika filtrat diuji dengan perak
nitrat tidak menghasilkan endapan putih. Bentonit yang telah diinterkalasi dengan
TiCl4dikeringkan dalam oven pada suhu 120oC selama 5 jam.
Bentonit yang telah diinterkalasi dengan TiCl4 dan telah dikeringkan
kemudian digerus sampai halus dan diayak dengan ayakan 100 mesh. Bentonit
selanjutnya dikalsinasi menggunakan furnace pada suhu 450oC selama 4 jam.
3.4.9 Karakterisasi menggunakan X-Ray Diffraction (XRD)
Diambil 1 gram bentonit alam yang telah dipreparasi, bentonit yang
terinterkalasi Ti4+, dan bentonit terpilar TiO2 untuk diuji karakterisasi
menggunakan X-Ray Diffraction. Uji karakterisasi menggunakan XRD bertujuan
3.4.10 Penentuan panjang gelombang maksimum
Larutan jingga metil 10 ppm masing-masing pada pH 2; 3,5; dan 6
diukur absorbansinya menggunakan spektrofotometer UV-Vis pada daerah visible
300-700 nm. Blangko yang digunakan untuk larutan standar pH 6 adalah akuadem
sedangkan blangko untuk larutan standar pH 2 dan 3,5 adalah akuadem ditambah
HCl.
3.4.11 Pembuatan kurva kalibrasi jingga metil
Masing-masing larutan standar jingga metil pada pH 2; 3,5; dan 6 yang
telah dibuat pada bagian 3.4.5 diukur absorbansinya dengan spektrofotometer
UV-Vis pada panjang gelombang maksimum menggunakan blangko seperti pada
bagian 3.4.10. Dari data absorbansi yang diperoleh dibuat kurva kalibrasi yang
kemudian ditentukan persamaan garis regresi linier. Persamaan regresi linier
secara umum adalah:
y = a + bx (3.1)
dimana sumbu y adalah absorbansi dan sumbu x sebagai konsentrasi zat warna
jingga metil dalam ppm.
3.4.12 Penentuan waktu optimum degradasi zat warna jingga metil
Sebanyak 500 ml larutan jingga metil dengan konsentrasi 50 ppm
dimasukkan ke dalam gelas beaker 1000 ml kemudian diatur pada pH 2; 3,5; dan
6. Pengaturan pH tersebut dilakukan dengan menambahan HCl 0,1 M
diatur pHnya lalu dicampur dengan 0,5000 g bentonit terpilar TiO2. Sebelum
diradiasi, campuran diaduk dengan pengaduk magnet selama 15 menit agar
larutan jingga metil dan katalis menjadi homogen. Campuran diradiasi dengan
lampu UV 3 x 8 watt selama 240 menit. Hasil degradasi pada menit ke-5, 10, 20,
30, 45, 60, 90, 120, 180, dan 240 diambil 5,0 ml kemudian disentrifugasi dan
disaring dengan kertas saring untuk memisahkan larutan jingga metil dengan
bentonit terpilar TiO2. Larutan tersebut kemudian diambil 2,0 ml dan diencerkan
pada labu ukur 10 ml menggunakan akuadem lalu diukur absorbansinya dengan
spektrofotometer UV-Vis. Blangko yang digunakan untuk pH 6 adalah akuadem
sedangkan untuk pH 2 dan 3,5 adalah akuadem ditambah HCl. Data absorbansi
yang diperoleh dimasukkan dalam persamaan kurva kalibrasi jingga metil untuk
mengetahui konsentrasi jingga metil yang tersisa. Selanjutnya dibuat kurva
hubungan antara % degradasi terhadap waktu degradasi.
3.4.13 Penentuan pH optimum degradasi zat warna jingga metil
Sebanyak 500 ml larutan jingga metil dengan konsentrasi 50 ppm
dimasukkan ke dalam gelas beaker 1000 ml kemudian diatur pada pH 2; 3,5; dan
6. Pengaturan pH 2 dan 3,5 dilakukan dengan menambahan HCl 0,1 M
menggunakan buret dan dihentikan hingga tercapai pH yang sesuai, sedangkan
pH 6 merupakan pH larutan jingga metil tanpa penambahan asam atau basa.
Pengukuran pH dilakukan dengan menggunakan pH meter. Larutan jingga metil
yang telah diatur pHnya lalu dicampur dengan 0,5000 g bentonit terpilar TiO2.
Sebelum diradiasi, campuran tersebut diaduk dengan pengaduk magnet selama 15
dengan lampu UV 3 x 8 watt sesuai dengan waktu optimum yang telah diperoleh
pada bagian 3.4.12. Larutan yang telah didegradasi diambil 5,0 ml kemudian
disentrifugasi dan disaring dengan kertas saring untuk memisahkan larutan jingga
metil dengan bentonit terpilar TiO2. Larutan tersebut kemudian diambil 2,0 ml
dan diencerkan pada labu ukur 10 ml menggunakan akuadem lalu diukur
absorbansinya dengan spektrofotometer UV-Vis. Blangko yang digunakan untuk
pH 6 adalah akuadem sedangkan untuk pH 2 dan 3,5 adalah akuadem ditambah
HCl. Nilai absorbansi yang diperoleh dimasukkan ke dalam kurva kalibrasi jingga
metil untuk mengetahui konsentrasi jingga metil yang tersisa.
3.4.14 Karakteristik degradasi zat warna jingga metil pada berbagai variasi konsentrasi terhadap kapasitas degradasi bentonit terpilar TiO2
Larutan jingga metil yang telah dibuat dengan konsentrasi 25, 50, 75,
100, 150, 200, dan 250 ppm sebanyak 500 ml masing-masing dimasukkan ke
dalam gelas beaker 1000 ml kemudian diatur pada pH optimum yang telah
diperoleh pada bagian 3.4.13. Larutan tersebut kemudian dicampur dengan
0,5000 g bentonit terpilar TiO2. Sebelum diradiasi, campuran tersebut diaduk
dengan pengaduk magnet selama 15 menit agar larutan jingga metil dan katalis
homogen kemudian diradiasi dengan lampu UV 3 x 8 watt sesuai dengan waktu
optimum yang telah diperoleh pada bagian 3.4.12. Hasil degradasi diambil 5,0 ml
kemudian disentrifugasi dan disaring dengan kertas saring untuk memisahkan
larutan jingga metil dengan bentonit terpilar TiO2. Larutan tersebut kemudian
yang sesuai dengan pH optimum pada bagian 3.4.13. Nilai absorbansi yang
diperoleh dimasukkan ke dalam kurva kalibrasi jingga metil untuk mengetahui
konsentrasi jingga metil yang tersisa.
3.4.15 Degradasi jingga metil menggunakan sinar UV
Sebanyak 500 ml larutan jingga metil dengan konsentrasi 50 ppm
dimasukkan ke dalam gelas beaker 1000 ml. Larutan diatur pada pH 6 dan pada
pH optimum yang diperoleh pada bagian 3.4.13. Larutan tersebut diaduk dengan
pengaduk magnet dan diradiasi menggunakan sinar UV selama waktu optimum
yang telah diperoleh pada bagian 3.4.12. Campuran hasil degradasi diambil 2,0
ml dan diencerkan pada labu ukur 10 ml menggunakan akuadem. Larutan tersebut
diukur absorbansinya dengan spektrofotometer UV-Vis menggunakan blangko
akuadem untuk pH 6 sedangkan untuk pH optimum digunakan blangko akuadem
yang diatur pada pH optimum menggunakan HCl. Nilai absorbansi yang diperoleh
dimasukkan ke dalam kurva kalibrasi jingga metil untuk mengetahui konsentrasi
jingga metil yang tersisa.
3.4.16 Degradasi jingga metil menggunakan bentonit/UV
Sebanyak 500 ml larutan jingga metil dengan konsentrasi 50 ppm
dimasukkan ke dalam gelas beaker 1000 ml. Larutan diatur pada pH 6 dan pada
pH optimum yang diperoleh pada bagian 3.4.13. Larutan tersebut kemudian
dicampur dengan 0,5000 g bentonit. Sebelum diradiasi, campuran tersebut diaduk
dengan pengaduk magnet selama 15 menit agar larutan jingga metil dan bentonit
selama waktu optimum yang telah diperoleh pada bagian 3.4.12. Hasil degradasi
diambil 5,0 ml kemudian disentrifugasi dan disaring dengan kertas saring untuk
memisahkan larutan jingga metil dengan bentonit. Larutan tersebut kemudian
diambil 2,0 ml dan diencerkan pada labu ukur 10 ml menggunakan akuadem lalu
diukur absorbansinya dengan spektrofotometer UV-Vis menggunakan blangko
akuadem untuk pH 6 sedangkan untuk pH optimum digunakan blangko akuadem
yang diatur pada pH optimum menggunakan HCl. Nilai absorbansi yang diperoleh
dimasukkan ke dalam kurva kalibrasi jingga metil untuk mengetahui konsentrasi
jingga metil yang tersisa.
3.4.17 Degradasi jingga metil menggunakan TiO2/UV
Sebanyak 500 ml larutan jingga metil dengan konsentrasi 50 ppm
dimasukkan ke dalam gelas beaker 1000 ml. Larutan diatur pada pH 6 dan pada
pH optimum yang diperoleh pada bagian 3.4.13. Larutan tersebut kemudian
dicampur dengan 0,5000 g TiO2. Sebelum diradiasi, campuran tersebut diaduk
dengan pengaduk magnet selama 15 menit agar larutan jingga metil dan TiO2
homogen. Setelah homogen kemudian diradiasi dengan lampu UV 3 x 8 watt
selama waktu optimum yang telah diperoleh pada bagian 3.4.12. Hasil degradasi
diambil 5,0 ml kemudian disentrifugasi dan disaring dengan kertas saring untuk
memisahkan larutan jingga metil dengan TiO2. Larutan tersebut kemudian diambil
2,0 ml dan diencerkan pada labu ukur 10 ml menggunakan akuadem lalu diukur
absorbansinya dengan spektrofotometer UV-Vis menggunakan blangko akuadem
dimasukkan ke dalam kurva kalibrasi jingga metil untuk mengetahui konsentrasi
jingga metil yang tersisa.
3.4.18 Degradasi jingga metil menggunakan bentonit terpilar TiO2
Sebanyak 500 ml larutan jingga metil dengan konsentrasi 50 ppm
dimasukkan ke dalam gelas beaker 1000 ml. Larutan diatur pada pH 6 dan pada
pH optimum yang diperoleh pada bagian 3.4.13. Larutan tersebut kemudian
dicampur dengan 0,5000 g bentonit terpilar TiO2 dan diaduk dengan pengaduk
magnet selama waktu optimum yang telah diperoleh pada bagian 3.4.13 tanpa
diradiasi sinar UV. Hasil degradasi diambil 5,0 ml kemudian disentrifugasi dan
disaring dengan kertas saring untuk memisahkan larutan jingga metil dengan
bentonit terpilar TiO2. Larutan tersebut kemudian diambil 2,0 ml dan diencerkan
pada labu ukur 10 ml menggunakan akuadem lalu diukur absorbansinya dengan
spektrofotometer UV-Vis menggunakan blangko akuadem untuk pH 6 sedangkan
untuk pH optimum digunakan blangko akuadem yang diatur pada pH optimum
menggunakan HCl. Nilai absorbansi yang diperoleh dimasukkan ke dalam kurva
kalibrasi jingga metil untuk mengetahui konsentrasi jingga metil yang tersisa.
3.4.19 Degradasi jingga metil menggunakan bentonit terpilar TiO2/UV
Sebanyak 500 ml larutan jingga metil dengan konsentrasi 50 ppm
dimasukkan ke dalam gelas beaker 1000 ml. Larutan diatur pada pH 6 dan pada
pH optimum yang diperoleh pada bagian 3.4.13. Larutan tersebut kemudian
dicampur dengan 0,5000 g bentonit terpilar TiO2. Sebelum diradiasi, campuran
metil dan TiO2/bentonit homogen. Setelah homogen kemudian diradiasi dengan
lampu UV 3 x 8 watt selama waktu optimum yang telah diperoleh pada bagian
3.4.12. Hasil degradasi diambil 5,0 ml kemudian disentrifugasi dan disaring
dengan kertas saring untuk memisahkan larutan jingga metil dengan bentonit
terpilar TiO2. Larutan tersebut kemudian diambil 2,0 ml dan diencerkan pada labu
ukur 10 ml menggunakan akuadem lalu diukur absorbansinya dengan
spektrofotometer UV-Vis menggunakan blangko akuadem untuk pH 6 sedangkan
untuk pH optimum digunakan blangko akuadem yang diatur pada pH optimum
menggunakan HCl. Nilai absorbansi yang diperoleh dimasukkan ke dalam kurva
29
BAB IV
HASIL DAN PEMBAHASAN
4.1 Pembuatan Bentonit Terpilar TiO2
Bentonit alam yang digunakan terlebih dahulu dicuci beberapa kali menggunakan akuadem untuk menghilangkan pengotor – pengotor larut air yang terdapat pada permukaan bentonit. Bentonit yang telah dicuci kemudian dibuat menjadi bubur dan disentrifugasi untuk memisahkan lempung bentonit dengan pasir. Lempung bentonit yang telah terpisah dari pengotor dan pasir kemudian dikeringkan di dalam oven pada suhu 120oC selama 5 jam. Bentonit yang telah kering kemudian digerus dan diayak menggunakan ayakan 100 mesh.
Larutan pemilar dibuat dengan menambahkan 5,6 mL TiCl
dengan berubahnya warna larutan dari tidak berwarna menjadi berwarna kuning sesuai dengan penelitian Suzuki Eichiro dkk. (1997).
Sebanyak 150 g bentonit yang telah dipreparasi didispersikan ke dalam 450 ml larutan kompleks titan. Larutan tersebut diaduk menggunakan pengaduk magnet selama 5 jam. Pada proses ini terjadi interkalasi agen pemilar berupa titan polihidroksi ke dalam antarlapis bentonit. Titan polihidroksi tersebut akan menggantikan kation-kation Na+, Ca2+, Mg2+, dan kation lain yang ada pada permukaan antarlapis bentonit. Interkalasi kompleks titan pada antarlapis bentonit dapat berlangsung pada suhu kamar secara spontan yang ditunjukkan dengan dihasilkannya cairan kental yang berwarna keabuan pada saat penambahan larutan pemilar. Hal tersebut dinyatakan pula pada penelitian serupa oleh Kwon (2001).
bentonit sehingga bentonit menjadi lebih kuat dan stabil, sedangkan proton menjaga keseimbangan muatan asal dari substitusi Al3+ dan Mg2+ pada lembaran oktahedral (Tennakoon dkk., 1986). Dengan mengacu pada reaksi pembuatan titan dioksida dari oligokation dalam Cotton et al., (1999), maka pembentukan TiO
2 pada permukaan bentonit dari oligokation titan mengikuti persamaan reaksi sebagai berikut:
[(TiO)
8(OH)12] 4+
8 TiO
2 + 4 H2O + 4 H +
……… (4.1)
4.2 Karakterisasi Menggunakan X-Ray Diffraction
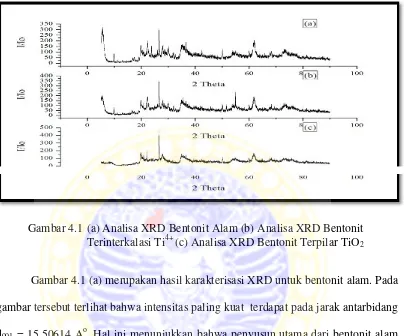
Gambar 4.1 (a) Analisa XRD Bentonit Alam (b) Analisa XRD Bentonit Terinterkalasi Ti4+(c) Analisa XRD Bentonit Terpilar TiO2
Gambar 4.1 (b) merupakan hasil karakterisasi XRD untuk bentonit terinterkalasi Ti4+. Berdasarkan gambar tersebut diketahui bahwa terjadi pergeseran jarak antarbidang, terutama pada perubahan jarak antarbidang d001 bergeser menjadi 15,91499 Ao, d=4,48237 Aobergeser menjadi d=5,11114 Ao, sedangkan d=3,0719 Ao bergeser menjadi 3,42574 Ao. Meningkatnya jarak antarbidang ini terjadi karena kemampuanswelling monmorilonit pada saat interkalasi. Lapisan-lapisan silikat pada monmorilonit dapat terbuka semakin lebar ketika kation-kation Na+, Ca2+, Mg2+, dan kation lain yang ada pada ruang antarlapis monmorilonit tertukar oleh spesies pemilar berupa kation polihidroksi Ti4+yang ukurannya lebih besar (Cool dan Vansant, 1998).
pada Lampiran 3. Berdasarkan hasil karakterisasi tersebut, diketahui bahwa terdapat TiO2 pada antarlapis bentonit. Pilar TiO2 yang terbentuk pada antarlapis bentonit tersebut dapat membuat bentonit menjadi lebih stabil dan dapat digunakan sebagai fotokatalis pada pengolahan zat warna.
4.3 Penentuan Panjang Gelombang Maksimum Larutan Jingga Metil
Panjang gelombang maksimum larutan jingga metil ditentukan dengan mengukur absorbansi larutan standar jingga metil 10 ppm menggunakan spektrofotometer UV-Vis pada daerah visibel antara 300 nm sampai 700 nm. Pada tahapan selanjutnya akan dilakukan degradasi dengan menggunakan variasi pH sehingga perlu juga ditentukan panjang gelombang maksimum larutan jingga untuk masing-masing variasi pH, yaitu pH 2; 3,5; dan 6. Dasar pemilihan variasi pH pada pH 2; 3,5; dan 6 adalah dengan memperhatikan rentang pH jingga metil yaitu 3,1 -4,4. Dengan memilih pH 2 yaitu ketika jingga metil berwarna merah, pH 3,5 ketika jingga metil berwarna jingga, serta pH 6 ketika jingga metil berwarna kuning maka dapat dilihat perbedaan pengaruh perubahan struktur jingga metil akibat pengaturan pH terhadap efektivitas degradasi jingga metil menggunakan bentonit terpilar TiO2.
Tabel 4.1 Panjang gelombang maksimum larutan jingga metil pH larutan jingga metil Panjang gelombang
maksimum (nm)
2 506
3.5 496
6 464
Pada suasana asam terjadi penambahan ion H+pada struktur jingga metil yang menyebabkan semakin banyaknya ikatan rangkap terkonjugasi. Semakin banyak ikatan rangkap terkonjugasi pada jingga metil akan menyebabkan terjadinya pergeseran ke arah panjang gelombang yang lebih panjang yang disebut dengan pergesaran batokromik atau pergeseran merah (red shift) (Fessenden dan Fessenden, 1986; Bruice, 1995).
4.4 Pembuatan Kurva Kalibrasi Jingga Metil
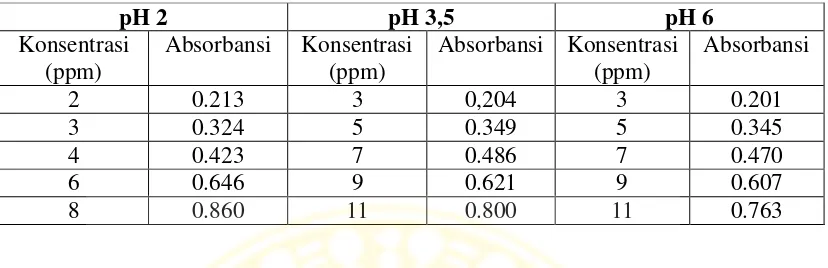
Tabel 4.2 Data absorbansi larutan standar jingga metil
Setelah diperoleh nilai absorbansi larutan standar jingga metil maka dapat dibuat grafik hubungan antara konsentrasi terhadap absorbansi larutan standar jingga metil. Dari kurva kalibrasi tersebut akan diperoleh persamaan regresi kurva kalibrasi larutan jingga metil yang dinyatakan dengan persamaan y = a + bx dengan ketentuan y adalah absorbansi (A) dan x adalah konsentrasi larutan jingga metil (ppm).
Dari gambar kurva kalibrasi jingga metil diperoleh persamaan garis regresi jingga metil untuk pH 2; 3,5; dan 6 masing-masing adalah y = 0,107x – 0,003; y=0,073x – 0,020; y = 0,069x – 0,007 dan koefisien korelasi (R² = 0,999; R² = 0,997; R²= 0,998). Koefisien korelasi ini menunjukkan linearitas kurva, nilai R2 pada kurva semakin mendekati 1 yang berarti kurva hampir linear. Persamaan regresi ini digunakan untuk menentukan konsentrasi sisa larutan jingga metil setelah mengalami proses degradasi.
4.5 Penentuan Waktu Optimum Degradasi Larutan Jingga Metil
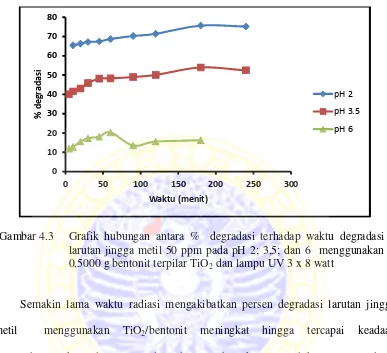
Gambar 4.3 Grafik hubungan antara % degradasi terhadap waktu degradasi larutan jingga metil 50 ppm pada pH 2; 3,5; dan 6 menggunakan 0,5000 g bentonit terpilar TiO2dan lampu UV 3 x 8 watt
Semakin lama waktu radiasi mengakibatkan persen degradasi larutan jingga metil menggunakan TiO2/bentonit meningkat hingga tercapai keadaan kesetimbangan kemudian persen degradasi tersebut akan menjadi konstan atau dapat juga mengalami penurunan. Pada pH 2 dan 3,5 terjadi penurun persen degradasi pada menit ke-240 sedangkan pada pH 6 terjadi penurunan pada menit ke-90. Berdasarkan data tersebut dapat dikatakan bahwa pada menit sebelum terjadi penurunan persen degradasi, larutan jingga metil berada dalam keadaan kesetimbangan. Pada saat terjadi penurunan persen degradasi terjadi ketidakstabilan pada multilayer akibat adanya daya tolakan antarmolekul yang diserap sehingga menyebabkan lapisan adsorpsi terlepas kembali ke larutan (desorpsi). Oleh karena hal yang disebutkan di atas, maka waktu optimum untuk degradasi larutan jingga metil menggunakan
bentonit terpilar TiO2 pada pH 2 dan 3,5 adalah 180 menit sedangkan pada pH 6 adalah 60 menit.
4.6 Penentuan pH Optimum Degradasi Jingga Metil
Penentuan pH optimum bertujuan untuk mengetahui besarnya pH pada efektivitas degradasi jingga metil. Sebanyak 500 ml larutan jingga metil 50 ppm diatur pada variasi pH 2; 3,5; dan 6. Larutan tersebut kemudian ditambah dengan 0,5000 g bentonit terpilar TiO2dan disinari dengan sinar UV 3 x 8 watt selama waktu optimum yang telah diperoleh pada bagian 4.5, yaitu 1 jam untuk pH 6 sedangkan unuk pH 2 dan 3,5 adalah 3 jam. Pengaturan pH 2 dan 3,5 dilakukan dengan penambahan HCl 0,1M sedangkan untuk pH 6 tanpa penambahan larutan pH.
Larutan HCl digunakan dalam pengaturan pH karena larutan ini relatif stabil terhadap proses degradasi fotokatalitik dengan TiO2. Apabila menggunakan larutan bufer untuk pengaturan pH maka larutan bufer dapat terdegradasi oleh TiO2sehingga mempengaruhi proses degradasi jingga metil.
degradasi larutan jingga metil. Selanjutnya dibuat grafik hubungan antara pH larutan terhadap persen degradasi larutan jingga metil yang dapat dilihat pada Gambar 4.4.
Gambar 4.4 Grafik hubungan antara pH dengan % degradasi larutan jingga metil 50 ppm pada pH 2; 3,5; dan 6 menggunakan 0,5000 g bentonit terpilar TiO2dan lampu UV 3 x 8 watt
Dari grafik diketahui bahwa persen degradasi untuk pH 2; 3,5; dan 6 masing-masing adalah 71,886 %, 54,640 %, dan 15,508 %. Keadaan maksimum ditunjukkan pada degradasi larutan jingga metil pH 2 dengan persen degradasi sebanyak 71,886 %. Dari hasil tersebut diketahui bahwa larutan jingga metil pada suasana asam akan lebih mudah mengalami degradasi dengan menggunakan bentonit terpilar TiO2. Pada keadaan asam ion H+ akan melakukan protonasi pada ikatan rangkap N yang ada pada struktur jingga metil, kemudian akan terjadi resonansi yang mengakibatkan jingga metil bermuatan positif (Fessenden dan Fessenden, 1986). Muatan positif pada jingga metil mengakibatkan bentonit yang mempunyai muatan permukaan negatif
lebih mudah untuk mengadsorpsi jingga metil pada keadaan asam. Sedangkan pada keadaan basa, jingga metil akan bermuatan negatif karena mengikat gugus sulfonat (SO3-) yang mengakibatkan jingga metil bermuatan negatif tersebut lebih susah teradsorpsi oleh permukaan bentonit yang juga bermuatan negatif. Struktur jingga metil pada keadaan asam (pH < 3,1) dan pada keadaan basa (pH > 4,4) dapat dilihat pada Gambar 4.5 (Coutinho et al., 2009).
-O3S NH N N+
4.7 Karakteristik Degradasi Zat Warna Jingga Metil pada Berbagai Variasi Konsentrasi terhadap Kapasitas Degradasi Bentonit Terpilar TiO2
menggunakan spektrofotometer UV-Vis. Dari pengukuran tersebut akan diperoleh absorbansi larutan jingga metil yang kemudian digunakan untuk menentukan konsentrasi sisa serta kapasitas degradasi zat warna jingga metil. Selanjutnya dibuat grafik hubungan antara konsentrasi awal larutan jingga metil terhadap kapasitas degradasi bentonit terpilar TiO2yang dapat dilihat pada Gambar 4.6.
Gambar 4.6 Grafik hubungan antara konsentrasi awal jingga metil dengan kapasitas degradasi larutan jingga metil 25, 50, 75, 100, 150, 200, dan 250 ppm menggunakan 0,5000 g bentonit terpilar TiO2 serta sinar UV 3 x 8 watt
tersebut mengakibatkan interaksi antara molekul jingga metil dan bentonit akan meningkat.
Kenaikan konsentrasi akan diikuti dengan meningkatnya jumlah zat yang terdegradasi oleh bentonit terpilar TiO2hingga tercapai keadaan kesetimbangan, yaitu pada konsentrasi 200 ppm dengan kapasitas degradasi sebesar 144,540 mg/g. Setelah mencapai konsentrasi kesetimbangan, kapasitas degradasi akan cenderung konstan atau dapat pula terjadi penurunan kapasitas degradasi seperti yang terlihat pada Gambar 4.6. Penurunan kapasitas degradasi terjadi pada saat konsentrasi 250 ppm yaitu menjadi 133,171 mg/g.
4.8 Mempelajari Pengaruh Sinar UV, TiO2/UV, Bentonit/UV, TiO2/Bentonit,
serta TiO2/Bentonit/UV Terhadap Degradasi Zat Warna Jingga Metil
Pada penelitian ini dilakukan perbandingan hasil pengolahan zat warna jingga metil dengan menggunakan sinar UV 3 x 8 watt tanpa penambahan katalis, penambahan 0,5000 gram TiO2 dengan disinari UV, penambahan 0,5000 gram bentonit dengan disinari UV, penambahan 0,5000 gram bentonit terpilar TiO2 tanpa disinari UV, serta penambahan 0,5000 gram bentonit terpilar TiO2 dengan disinari UV. Penelitian ini dilakukan pada keadaan pH 6 selama waktu optimum yang diperoleh pada bagian 4.5 yaitu 60 menit serta pada pH 2 selama 180 menit. Data hasil perbandingan dapat dilihat pada Gambar 4.7.
Gambar 4.7 Grafik perbandingan hasil degradasi larutan jingga metil 50 ppm pada pH 2 dan pH 6 dengan menggunakan sinar UV, TiO2/UV, bentonit/UV, TiO2/bentonit, serta TiO2/bentonit/UV
UV TiO2/UV Bentonit/
pH 6 1,652 5,798 3,334 10,29 15,508
pH 2 2,757 23,264 90,757 67,361 71,886
Berdasarkan grafik tersebut diketahui bahwa semua perlakuan dapat memberikan pengaruh terhadap proses degradasi jingga metil. Sinar ultravioletsaja dapat memberikan pengaruh pada proses degradasi larutan jingga metil. Dengan pencahayaan ultraviolet kebanyakan polutan organik dapat dioksidasi menjadi CO2 dan H2O (Chen et al., 2003). Dengan hanya menggunakan sinar UV saja hasil degradasi tidak terlalu baik yang ditunjukkan dengan persen degradasi sebesar 1,652 % pada keadaan netral dan 2,757 % pada keadaan optimum. Hal ini terjadi karena tidak adanya dukungan dari katalis ataupun material pendegradasi.
Penambahan fotokatalis TiO2 dapat meningkatkan persen degradasi karena TiO2 merupakan semikonduktor yang memiliki celah energi sehingga mampu mengabsorpsi radiasi elektromagnetik pada daerah ultraviolet. Berdasarkan Gambar 4.7 adanya penambahan TiO2 meningkatkan persen degradasi sebesar 5,798 % pada keadaan netral dan 23,264 % pada keadaan optimum. Pada keadaan optimum, yaitu pada pH 2 akan terjadi protonasi oleh H+ terhadap struktur jingga metil, sehingga struktur jingga metil menjadi lebih mudah diputus oleh sinar UV yang dikatalis TiO2.
Proses fotodegradasi TiO2 terhadap jingga metil terjadi setelah TiO2 mengabsorpsi radiasi sinar UV sehingga terjadi eksitasi elektron dari pita valensi ke
pita konduksi dan menyebabkan adanya kekosongan atau hole (h+
vb) yang dapat berperan sebagai muatan positif. Selanjutnya hole (h+
mengoksidasi jingga metil. Untuk elektron yang ada pada permukaan semikonduktor akan terjebak dalam hidroksida logam dan dapat bereaksi dengan penangkap elektron
yang ada dalam larutan misalnya H
) yang akan mengoksidasi zat warna jingga metil dalam larutan
(Lacheb et al., 2002).
Jika intensitas penyinaran konstan maka radikal hidroksil akan meningkat seiring dengan lamanya waktu radiasi. Selama waktu radiasi cukup panjang, senyawa organik seperti jingga metil dapat terdegradasi dengan sempurna menjadi H2O, CO2 dan asam mineral (Lian, 2002). Reaksi fotodegradasi jingga metil menggunakan TiO2dapat dituliskan sebagai berikut:
Sesuai dengan Gambar 4.7, penggunaan bentonit terpilar TiO2 memberikan kenaikan efektivitas degradasi yang cukup tinggi. Proses adsorpsi dan proses fotodegradasi akan berjalan bersamaan (sequential). Karena perubahan sifat fisikokimia TiO2/bentonit, maka jingga metil akan teradsorp lebih dulu ke dalam antarlapis bentonit kemudian mengadakan kontak dengan fotokatalis TiO2 yang ada dalam struktur bentonit sehingga reaksi fotodegradasi dapat berlangsung. Berdasarkan kenaikan persen degradasi larutan jingga metil pada keadaan optimum, dengan menggunakan TiO2/bentonit tanpa penyinaran persen degradasi sebesar 67,361 % mengalami kenaikan menjadi 71,886 % ketika menggunakan TiO2/bentonit dengan bantuan sinar ultraviolet. Hal tersebut menunjukkan bahwa sinar ultraviolet cukup berperan besar dalam mengaktivasi semikonduktor TiO2 yang berada pada antarlapis bentonit.
BAB V
KESIMPULAN DAN SARAN
5.1 Kesimpulan
1. Waktu optimum untuk degradasi zat warna jingga metil menggunakan
bentonit terpilar TiO2 adalah 180 menit dengan pH optimum adalah
pH 2.
2. Karakteristik degradasi zat warna jingga metil menunjukkan
peningkatan kapasitas degradasi TiO2/bentonit seiring dengan
kenaikan konsentrasi awal larutan jingga metil hingga tercapai
kesetimbangan pada konsentrasi 200 ppm.
3. Sinar UV, TiO2/UV, bentonit/UV, TiO2/bentonit, dan
TiO2/bentonit/UV dapat memberikan pengaruh terhadap degradasi zat
warna jingga metil yang ditunjukkan oleh masing-masing persen
degradasi pada keadaan optimum yaitu 2,757 %, 23,264 %, 90,757 %,
67,361 %, dan 71,886 % .
5.2 Saran
1. Pada penelitian lebih lanjut sebaiknya dilakukan proses identifikasi
terhadap produk hasil degradasi sehingga mekanisme yang terjadi
antara zat warna dengan TiO2/bentonit benar-benar diketahui.
2. Bentonit terpilar TiO2dapat dimanfaatkan pada pengolahan limbah zat
DAFTAR PUSTAKA
ATSDR (Agency for Toxic Substances and Disease Registry), 1997, Toxicological Profile for Titanium Tetrachloride, Public Health Service, U.S. Department of Health and Human Services, Atlanta.
Barka, N., Qourzal, S., Assabbane, A., Ait-Ichou, Y., 2010, Kinetic Modeling of the Photocatalytic Degradation of Methyl Orange by Supported TiO2, J. of Environ. Sci. and Eng., Vol. 4, No.5, pp. 2.
Bergaya, F., Theng, B.K.G., Lagaly, G., 2006, Handbook of Clay Science, 1st ed. Elsevier, Amsterdam.
Blackburn, R.S., dan Burkinshaw, S.M., 2002, A Greener to Cotton Dyeing With Excellent Wash Fastness, Green Chemistry, 4, pp. 47-52.
Bruice, P.Y., 1995, Organic Chemistry, Prentice Hall, Inc, New Jersey, pp. 680-681.
Chen, J.P., Hausladen, M.C., Yang, R.T. 1995, Delaminated Fe2O3-Pillared Clay: Its Preparation, Characterization, and Activities for Selective Catalytic Reduction of NO by NH3+, J. of Catal., 151, pp. 135-146. Chen, J., Liu, M., Zhang, L., Zhang, J., Jin, L. 2003, Application of Nano TiO2
Towards Polluted Water Treatment Combined with Electro-Photochemical Method, Water Research, 37, pp. 3815–3820.
Cool, P. dan Vansant, E. F., 1998, Pillared Clays : Preparation, Characterization and Applications, Catal. Rev., Sci. Eng., 3 : 265-285. Cotton, F.A., Wilkinson, G., and Gaus, P.L., 1999, Basic Inorganic Chemistry,
John Wiley and Sons, Inc., New York.
Coutinho, C.A., Gupta, V. K., 2009, Photocatalytic Degradation of Methyl Orange using polymer-titania Microcomposites, J. of Coll. and Int. Sci. 333(2), pp. 457-64
Ding, Z., Zhu, H. Y., Lu, G. Q., Greenfield, 1999, Photocatalytic Properties of Titania Pillared Clays by Different Drying Methods, J. Colloid and Interface Sci., 209, pp.193-199.