PENETAPAN KADAR LIDOKAIN HCl DALAM SEDIAAN INJEKSI SECARA SPEKTROFOTOMETRI SERAPAN ATOM
TIDAK LANGSUNG
SKRIPSI
Diajukan untuk Memenuhi Salah Satu Syarat Memperoleh Gelar Sarjana Farmasi (S.Farm.)
Program Studi Ilmu Farmasi
Oleh:
Octaviana Manuhutu NIM : 048114001
FAKULTAS FARMASI
UNIVERSITAS SANATA DHARMA YOGYAKARTA
2009
i
PENETAPAN KADAR LIDOKAIN HCl DALAM SEDIAAN INJEKSI SECARA SPEKTROFOTOMETRI SERAPAN ATOM
TIDAK LANGSUNG
SKRIPSI
Diajukan untuk Memenuhi Salah Satu Syarat Memperoleh Gelar Sarjana Farmasi (S.Farm.)
Program Studi Ilmu Farmasi
Oleh:
Octaviana Manuhutu NIM : 048114001
FAKULTAS FARMASI
UNIVERSITAS SANATA DHARMA YOGYAKARTA
ii
Skripsi
PENETAPAN KADAR LIDOKAIN HCl DALAM SEDIAAN INJEKSI SECARA SPEKTROFOTOMETRI SERAPAN ATOM
TIDAK LANGSUNG
Yang diajukan oleh: Octaviana Manuhutu
NIM : 048114001
telah disetujui oleh :
Pembimbing,
Prof. Dr. Sudibyo Martono, M.S., Apt. Tanggal 23 Mei 2009
iii
Skripsi
PENETAPAN KADAR LIDOKAIN HCl DALAM SEDIAAN INJEKSI SECARA SPEKTROFOTOMETRI SERAPAN ATOM
TIDAK LANGSUNG
Dipersiapkan dan disusun oleh : Nama : Octaviana Manuhutu NIM : 048114001
Telah dipertahankan di depan panitia penguji pada tanggal 7 April 2009
dan dinyatakan memenuhi syarat
Susunan Panitia Penguji :
Nama Lengkap Tanda Tangan
Prof. Dr. Sudibyo Martono, M.S., Apt. ...
Christine Patramurti, M.Si., Apt. ... Lucia Wiwid Wijayanti, M.Si. ...
Yogyakarta, 25 Mei 2009 Fakultas Farmasi
Universitas Sanata Dharma Dekan,
iv
HALAMAN PERSEMBAHAN
My Lord Christ Jesus
All My Lovely Family
All My Friends
My Almamater
My Truly Love
v
HALAMAN MOTTO
Love is my live and live is my love
“Tetapi aku, kepada kasih setia-Mu aku percaya,
hatiku bersorak-sorak karena penyelamatan-Mu.
Aku mau menyanyi untuk Tuhan
karena Ia telah berbuat baik kepadaku”
vi
LEMBAR PERNYATAAN PERSETUJUAN
PUBLIKASI KARYA ILMIAH UNTUK KEPENTINGAN AKADEMIS
Yang bertandatangan di bawah ini, saya mahasiswa Universitas Sanata Dharma: Nama : Octaviana Manuhutu
Nomor Mahasiswa : 048114001
Demi pengembangan ilmu pengetahuan, saya memberikan kepada Perpustakaan Universitas Sanata Dharma karya ilmiah saya yang berjudul:
Penetapan Kadar Lidokain HCl Dalam Sediaan Injeksi Secara Spektrofotometri Serapan Atom Tidak Langsung
Beserta perangkat yang diperlukan (bila ada). Dengan demikian, saya memberikan kepada Perpustakaan Universitas Sanata Dharma hak untuk menyimpan, mengalihkan dalam bentuk media lain, mengelolanya dalam bentuk pangkalan data, mendistribusikan secara terbatas, dan mempublikasikan di internet atau media lain untuk kepentingan akademis tanpa perlu meminta ijin dari saya maupun memberikan royalti kepada saya selama tetap mencantumkan nama saya sebagai penulis.
Demikian pernyataan ini yang saya buat dengan sebenarnya.
Yogyakarta, 25 Mei 2009 Yang menyatakan,
(Octaviana Manuhutu)
vii
PERNYATAAN KEASLIAN KARYA
Saya menyatakan bahwa sesungguhnya bahwa skripsi yang saya tulis ini tidak memuat karya atau bagian karya orang lain, kecuali yang telah disebutkan dalam kutipan dan daftar pustaka, sebagai layaknya karya ilmiah.
Yogyakarta, 25 Mei 2009 Penulis
viii
KATA PENGANTAR
Puji dan syukur kepada Tuhan Yang Maha Kuasa karena berkat, rahmat serta karunia-Nya yang berlimpah sehingga penulis dapat menyelesaikan skripsi yang berjudul PENETAPAN KADAR LIDOKAIN HCl DALAM SEDIAAN INJEKSI SECARA SPEKTROFOTOMETRI SERAPAN ATOM TIDAK LANGSUNG ini dengan baik. Skripsi ini diajukan sebagai pemenuhan salah satu syarat memperoleh gelar Sarjana Farmasi Jurusan Farmasi Universitas Sanata Dharma Yogyakarta.
Proses penyusunan skripsi ini juga tidak mungkin terlaksana tanpa bimbingan, dukungan, petunjuk, kritik, saran serta kerjasama dari berbagai pihak, baik secara langsung maupun secara tidak langsung. Pada kesempatan ini, penulis secara khusus menyampaikan terima kasih yang sebesar-besarnya atas segala bentuk bantuan moril dan materiil kepada :
1. Ibu Rita Suhadi, M.Si., Apt., selaku Dekan Fakultas Farmasi Universitas Sanata Dharma Yogyakarta.
2. Bapak Prof. Dr. Sudibyo Martono, M.S., Apt., selaku Dosen Pembimbing yang selalu memberikan bantuan dan pengarahan selama penyusunan skripsi ini.
3. Ibu Christine Patramurti, M.Si., Apt., selaku Dosen Penguji yang telah memberikan masukan yang berarti bagi penulis.
4. Ibu Lucia Wiwid Wijayanti, M.Si., selaku Dosen Penguji yang telah memberikan masukan yang berarti bagi penulis.
ix
5. Ibu Astuti selaku teknisi instrumentasi SSA di LPPT UGM yang telah banyak membantu penulis selama penelitian.
6. Seluruh Laboran-laboran (Mas Bimo, Pak Parlan, dan Pak Kunto) di Laboratorium Lantai 4 Fakultas Farmasi Universitas Sanata Dharma yang telah banyak membantu penulis selama penelitian.
7. Teman-teman seperjuangan skripsi; Pipit, Adit, Rike yang selalu memberikan dukungan yang berarti bagi penulis.
8. Semua keluarga di Banyuwangi (Oma, Oom Weni, Oom Jerry, Oom Xavier, Tante Yo, Andi dan Erwin), di Jember (Papa, Mama dan Vina), di Nederland (Tante Dina dan Oom Hans) dan di Pontianak (Oom Djonis, Tante Kristin, Eko dan Ita) yang selalu memberi semangat dan doa.
9. Benidiktus Bens. Terima kasih untuk semangat, doa dan suka duka dalam hidupku dan hari-hari yang sangat berarti.
10.Teman-teman kost “Green House” Dini, Fani, Lesty, Luci, Mega, Evi, Linda, Mbak Lini, Mbak Pritty, Prapti, Eni, Nita, Kristin, Agata, Cat, Sisil dan Ita. Kristin dan Candra buat dukungannya.
11.Teman-Teman Angkatan 2004 FST (Wiwid, Retry, Sapi, Yoyo, Rian, Tika, Novi, Robby dan teman-teman lainnya) dan angkatan 2004 FKK (Atin, Made, Rina, Novi, Reni dan Manda).
12.Pihak lain yang tidak dapat disebutkan satu-persatu, penulis mohon maaf dan terima kasih sebesar-besarnya.
x
Semoga skripsi ini dapat membantu dan bermanfaat terutama dalam bidang ilmu pengetahuan.
Yogyakarta, 25 Mei 2009
Hormat Penulis
Octaviana Manuhutu
xi
INTI SARI
Lidokain HCl merupakan obat golongan anestetik yang banyak digunakan sebagai sediaan injeksi. Beberapa metode penetapan kadar (langsung) lidokain HCl antara lain: spektrofotometri, kromatografi gas, kromatografi cair kinerja tinggi, disamping metode konvensional secara titrimetri. Pada penelitian ini, dilakukan penetapkan kadar Lidokain HCl dalam sediaan injeksi secara spektrofotometri serapan atom (SSA) tidak langsung.
Jenis penelitian ini merupakan penelitian non eksperimental deskriptif. Pada penelitian ini, lidokain HCl yang bereaksi dengan tetrathiocyanatocobaltate (CoTC) berlebih tertentu dan menghasilkan endapan lidokain-CoTC yang merupakan ion-associates. Kelebihan ion logam kobalt ditetapkan secara SSA. Sisa ion logam kobalt yang bervariasi didapat dari seri kadar lidokain HCl yang bereaksi dengan CoTC berlebih tertentu. Hasil pengukuran sisa ion logam kobalt secara SSA akan menunjukkan korelasi negatif dengan kadar lidokain HCl.
Dari hasil penelitian ini diperoleh persamaan kurva baku 6138
, 0 2989 ,
1 +
−
= x
y dengan koefisien korelasi r = −0,992 dan pada aplikasi metode tersebut diatas pada penetapan lidokain HCl dalam sediaan injeksi diperoleh kadar rata-rata 21,59 mg/mL dengan CV sebesar 3,57% dan persen perolehan kembali yaitu 95-99%.
xii
ABSTRACT
Lidocaine HCl is one of anesthetic category medicine that is commonly used as injection pharmaceutical. Some kind of determination methods for Lidocaine HCl are spectrophotometry, gas chromatography, high performance liquid chromatography beside titrimetry as conventional method. In this research, concentration of Lidocaine HCl was determined in injection pharmaceutical using indirect Atomic Absorption Spetrofotometry (AAS).
This type of research is a non experiment descriptive research. Lidocaine HCl reacted with an excess tetrathiocyanatocobaltate (CoTC) and the result was lidocaine-CoTC known as ion-associates. The excess of cobalt metal ion will determined by AAS. Residue of variated metal cobalt ion can be got by creating series of Lidocaine HCl that reacted with an excess COTC. The Result of AAS measurement from metal cobalt ion will show negative corelation with Lidocaine HCl.
From this research result, the regression line was y=−1.2989x+0.6138 with corelation coefisien r = −0.992 and on application method mentioned above, the average concentration of Lidocaine HCl in injection pharmaceutical is 21.59 mg/mL with coefficient variation is 3.57 % and percent of recovery between 95-99%.
Keyword : Lidocaine HCl, injection pharmaceutical, CoTC, excess metal, atomic absorption spectrophotometry
xiii
DAFTAR ISI
HALAMAN JUDUL ... i
HALAMAN PERSETUJUAN PEMBIMBING ... ii
HALAMAN PENGESAHAN ... iii
HALAMAN PERSEMBAHAN ... iv
HALAMAN MOTTO ... v
LEMBAR PERNYATAAN PERSETUJUAN ... vi
PUBLIKASI KARYA ILMIAH UNTUK KEPENTINGAN AKADEMIS ... vi
PERNYATAAN KEASLIAN KARYA ... vii
KATA PENGANTAR ... viii
INTI SARI ... xi
ABSTRACT ... xii
DAFTAR ISI ... xiii
DAFTAR TABEL ... xvii
DAFTAR GAMBAR ... xviii
DAFTAR LAMPIRAN ... xix
BAB I PENGANTAR ... 1
A. Latar Belakang... 1
B. Permasalahan ... 3
C. Keaslian Penelitian ... 3
D. Manfaat Penelitian ... 4
xiv
2. Manfaat praktis ... 4
E. Tujuan Penelitian ... 4
BAB II PENELAAHAN PUSTAKA ... 5
A. Lidokain HCl ... 5
B. Injeksi ... 7
C. Kobalt ... 7
D. Kompleksometri ... 8
E. Ion Association ... 10
F. Spektrofotometri Serapan Atom ( SAA ) ... 11
1. Pengukuran serapan pada spektrofotometri serapan atom ... 13
2. Instrumentasi Spektrofotometer Serapan Atom ... 13
3. Kelebihan dan Kekurangan Spektrofotometri Serapan Atom ... 19
G. Parameter Validitas dan Kategori Metode Analisis... 20
1. Parameter validitas metode analisis ... 20
2. Kategori metode analisis menurut USP 28 NF 23 Vol. 2 ... 22
H. Landasan Teori ... 23
I. Hipotesis ... 24
BAB III METODOLOGI PENELITIAN ... 25
A. Jenis dan Rancangan Penelitian... 25
B. Definisi Operasional ... 25
C. Alat-alat Penelitian ... 25
xv
D. Bahan-bahan Penelitian... 26
E. Tata Cara Penelitian ... 26
1. Pembuatan larutan stok ... 26
2. Optimasi kondisi percobaan ... 27
3. Kondisi instrumentasi spektrofotometer serapan atom ... 27
4. Pembuatan persamaan kurva baku ... 28
5. Pemilihan sampel ... 29
6. Uji kualitatif ... 29
7. Keseragaman Volume sediaan injeksi ... 30
8. Penetapan kadar lidokain HCl ... 30
9. Pembuatan larutan baku untuk recovery ... 30
10. Recovery (perolehan kembali) ... 30
F. Analisis Hasil ... 31
BAB IV HASIL DAN PEMBAHASAN ... 33
A. Pemilihan Sampel ... 33
B. Uji Kualitatif Lidokain HCl ... 33
C. Optimasi Waktu Penggojogan ... 35
D. Pembuatan Kurva Baku ... 36
E. Penetapan Keseragaman Volume Sediaan Injeksi... 39
F. Penetapan Kadar Lidokain HCl Pada Sediaan Injeksi ... 40
G. Hasil Uji perolehan kembali ... 42
xvi BAB V
KESIMPULAN DAN SARAN ... 45
A. Kesimpulan... 45
B. Saran ... 45
DAFTAR PUSTAKA ... 46
LAMPIRAN ... 48
BIOGRAFI PENULIS ... 66
xvii
DAFTAR TABEL
Tabel III.1. Kondisi instrumental kobalt ... 28
Tabel IV.1. Hasil optimasi waktu penggojogan ... 35
Tabel IV.2. Paired sampel test ... 36
Tabel IV.3. Persamaan kurva baku I ... 37
Tabel IV.4. Persamaan kurva baku II ... 38
Tabel IV.5. Data keseragaman volume sediaan injeksi lidokain HCl ... 39
Tabel IV.6. Hasil penetapan kadar lidokain HCl dalam sediaan injeksi merk “X” ... 42
xviii
DAFTAR GAMBAR
Gambar 2.1. Lidokain Hidroklorida ... 5
Gambar 2.2. Prinsip Kerja Spektrofotometri Serapan Atom ... 14
Gambar 2.3. Instrumen Spektrofotometri Serapan Atom ... 14
Gambar 2.4. Hollow Cathode Lamp ... 15
Gambar 2.5. Atomisasi... 17
Gambar 2.6. Tungku Masmann ... 17
Gambar 4.1. Persamaan kurva baku replikasi III ... 38
xix
DAFTAR LAMPIRAN
Lampiran 1. Sertifikat analisis Lidokain Hidroklorida ... 48
Lampiran 2. Komposisi sampel sediaan injeksi Lidokain HCl merk “X” ... 49
Lampiran 3. Optimasi waktu penggojogan ... 51
Lampiran 4. Data hasil pembuatan kurva baku ... 55
Lampiran 5. Data keseragaman volume sediaan injeksi lidokain HCl ... 60
Lampiran 6. Hasil penetapan kadar lidokain HCl dalam sediaan injeksi ... 61
Lampiran 7. Penimbangan baku perolehan kembali ... 62
1
BAB I
PENGANTAR A. Latar Belakang
Anestetik lokal merupakan obat penghambat hantaran saraf bila dikenakan secara lokal pada jaringan saraf dengan kadar cukup. Zat anestetik lokal juga harus larut dalam air, stabil dalam larutan, dapat disterilkan tanpa mengalami perubahan (Ganiswara, 2002). Anestetik lokal biasanya dalam bentuk basa lemah dan diformulasikan sebagai garam hidroklorida agar dapat larut dalam air (Anonim, 2007).
Anestetik lokal yang tergolong dalam senyawaan amida adalah dibukain, lidokain, mepivakain dan prilokain (Ganiswara, 2002). Lidokain yang banyak dikenal yaitu lidokain HCl dalam berbagai macam bentuk sediaan dan yang paling sering digunakan dalam bidang kesehatan pada umumnya adalah bentuk sediaan larutan injeksi yang mengandung tidak lebih dari 2% lidokain HCl. Menurut Ansel (1989) lidokain HCl 2% untuk injeksi diberikan secara intravena sebagai antiarrhythmia.
Telah dikenal berbagai macam cara untuk menganalisis lidokain HCl yaitu dengan menggunakan metode konvensional secara titrimetri dengan asam sulfat dan larutan baku NaOH (Anonim, 1979). Metode penetapan kadar yang lain yaitu metode kromatografi cair kinerja tinggi dengan fase gerak asam asetat glasial dan air (Anonim, 1995) dan aplikasi metode ini pada sediaan farmasetika dengan sistem kromatografi kolom silika C18 dan fase gerak SDS dan 1-propanol
memiliki kelebihan yaitu cepat, dapat dipercaya dan bebas dari gangguan namun menghasilkan resolusi yang kurang baik (Gilabert dkk., 2006). Metode kromatografi gas merupakan salah satu metode yang lain untuk penetapan kadar lidokain HCl. Aplikasi dari metode ini adalah analisis lidokain HCl pada cairan tubuh yaitu dengan Solid Phase Extraction yang diikuti dengan Capillary Gas Chromatographic (Baniceru dkk., 2004
3
dalam hal ini setiap logam yang diukur mempunyai panjang gelombang tertentu, sehingga serapan yang dihasilkan berasal dari serapan logam tersebut tanpa ada serapan dari logam lain (Khopkar, 1990).
Penelitian ini mengadopsi penelitian cinchocaine HCl dengan metode spektrofotometri dan spektrofotometri serapan atom (Gani dkk., 2005) dan belum pernah dikembangkan suatu metode penetapan kadar lidokain HCl secara spektrofotometri serapan atom tidak langsung. Oleh karena itu, diperlukan validasi metode penetapan kadar lidokain HCl secara spektrofotometri serapan atom tidak langsung dengan melihat akurasi, presisi dan linearitas sehingga metode ini diharapkan dapat digunakan pada penetapan kadar lidokain HCl pada sediaan injeksi.
B. Permasalahan
Berdasarkan latar belakang di atas, maka dapat disusun permasalahan berikut: 1. Apakah metode spektrofotometri serapan atom tidak langsung yang didahului
dengan kompleksometri ini menghasilkan akurasi, presisi dan linearitas yang baik pada penetapan kadar lidokain HCl ?
2. Berapakah kadar lidokain HCl dalam sediaan injeksi pada penetapan lidokain HCl secara spektrofotometri serapan atom tidak langsung ini?
C. Keaslian Penelitian
Sejauh penelusuran pustaka dan jurnal yang dilakukan penulis belum pernah dilakukan penelitian tentang validasi metode penetapan kadar lidokain HCl secara spektrofotometri serapan atom tidak langsung menggunakan agen
pengkelat tetrathiocyanatocobaltate sebagai tahap awal dan dilanjutkan dengan pengukuran sisa ion logam kobalt yang tidak bereaksi sebagai reprensentasi kadar lidokain HCl.
D. Manfaat Penelitian
1. Manfaat metodologis
Manfaat metodologis penelitian ini untuk mengetahui validitas metode spektrofotometri serapan atom tidak langsung dengan agen pengkelat tetrathiocyanatocobaltate dan mengetahui kadar lidokain HCl dalam sediaan
injeksi dengan metode spektrofotometri serapan atom tidak langsung.
2. Manfaat praktis
Manfaat praktis penelitian ini adalah untuk memberikan sumbangan ilmiah di dunia kefarmasian khususnya dalam bidang industri.
E. Tujuan Penelitian
1. Melakukan validasi metode spektrofotometri serapan atom tidak langsung yang didahului dengan kompleksometri pada penetapan kadar lidokain HCl.
5
BAB II
PENELAAHAN PUSTAKA A. Lidokain HCl
CH3
NHCOCH2N(C2H5)2
CH3
. HCl
Gambar 2.1. Lidokain Hidroklorida (Anonim, 1989)
Lidokain HCl (gambar 2.1) adalah tipe anestesi lokal amida yang biasanya digunakan sebagai antiarrhythmic agent. Obat ini berwarna putih, berbentuk serbuk kristal dan mempunyai rasa sangat pahit, sangat larut dalam air dan alkohol. pKa lidokain HCl adalah 7,86. Natrium hidroksida atau asam hidroklorida digunakan untuk mengatur pH sediaan injeksi hingga 6-7. Dalam perdagangan, cairan yang tersedia adalah lidokain hidroklorida dalam 5% dekstrosa dengan pH 3,5-6. Suhu penyimpanan kurang dari 400C (15-300
Nama kimianya adalah 2-(Dietilamino)-2’,6-asetoksilidida monohidro-klorida monohidrat. Lidokain HCl mengandung tidak kurang dari 97,5% dan tidak lebih dari 102,5% C
C) (Anonim, 1989).
11H22N2O. HCl, dihitung terhadap zat anhidrat. Lidokain HCl
sangat mudah larut dalam air dan dalam etanol, larut dalam kloroform dan tidak larut dalam eter (Anonim, 1995).
7
B. Injeksi
Injeksi adalah penyemprotan larutan (atau suspensi) ke dalam tubuh untuk tujuan terapetik atau dianogstik. Larutan tersebut dapat bereaksi dalam aliran darah tetapi juga dalam jaringan dan dalam organ. Jika larutan hanya sejumlah relatif kecil dimasukkan (misalnya 1, 2, 5, sampai 20 mL) dalam organisme, dihubungkan dengan injeksi (injectio = membuang ke dalam, injectabilia), sebaliknya jika terjadi sejumlah besar untuk pemakaian (misalnya 1 atau beberapa liter), dikatakan infusi (infusio = penuangan ke dalam, infundibilia). Bentuk ini dinyatakan sebagai pemasukan parenteral suatu obat (par enteron = di luar usus) dalam kebalikannya terhadap penerapan enteral, yang berlangsung melalui lambung-usus (Voight, 1994).
C. Kobalt
Kobalt mempunyai titik leleh 14930C, bersifat keras, tahan korosi dan berwarna kebiruan. Dalam larutan air, kobalt secara normal terdapat sebagai ion kobalt (II) Co2+. Dalam larutan air senyawa-senyawa kobalt (II) terdapat ion Co2+ yang berwarna merah (Vogel, 1979). Kobalt (III) relatif tidak stabil dalam senyawaan sederhana, namun kompleks spin rendah sangat beragam dan stabil, khususnya dimana atom-atom donor (biasanya N) membuat sumbangan energi yang besar kepada medan ligan. Kobalt relatif tidak reaktif, meskipun ia larut lambat dalam asam mineral encer (Cotton, 1989).
Panjang gelombang Kobalt untuk analisis SSA adalah 240,7 nm dengan tipe nyala UA (udara-asetilen). Kobalt memiliki sensitivitas 0,053 μg/mL, range kerja 3-12 μg/mL dan batas deteksi 0,007 μg/mL (Khopkar, 1990).
D. Kompleksometri
Senyawa kompleks adalah senyawa yang terbentuk karena penggabungan dua atau lebih senyawa sederhana, yang masing-masing dapat berdiri sendiri. Misalnya, dalam proses penggabungan seperti berikut:
A + B AB
(2-1)
Senyawa AB dapat dianggap sebagai senyawa kompleks (Rivai, 1995).
Semua hasil reaksi kimia dapat dianggap sebagai senyawa kompleks, namun yang paling penting untuk analisis kimia adalah senyawa kompleks koordinasi. Dalam menjelaskan proses pembentukan dan susunan koordinasi senyawa-senyawa kompleks, telah dirumuskan tiga dalil (teori koordinasi Werner), yaitu:
1. Beberapa ion logam mempunyai dua jenis valensi, yaitu valensi utama dan valensi tambahan atau valensi koordinasi. Valensi utama berkaitan dengan keadaan oksidasi ion logam, sedangkan valensi tambahan berkaitan dengan bilangan koordinasi ion logam.
9
3. Valensi koordinasi mengarah ke dalam ruangan mengelilingi ion logam pusat.
(Rivai, 1995)
Beberapa ion logam cenderung berikatan koordinasi dengan zat-zat tertentu membentuk senyawa kompleks yang mantap. Zat-zat tertentu itu disebut ligan. Ikatan kovalen antara ion logam pusat dan ligan membedakan senyawa kompleks koordinasi sebagai golongan tersendiri senyawa kimia yang mempunyai susunan dan bangun tertentu. Selain itu, ligan adalah zat yang memiliki satu atau lebih pasangan elektron bebas (Rivai, 1995). Atom dalam suatu ligan yang terikat langsung dengan atom logam dikenal sebagai atom donor. Ligan bidentat dan polidentat juga disebut agen pengkhelat (chelating agent) karena kemampuannya
mengikat atom logam seperti sepit (dari Yunani chele, berarti ”sepit” atau ”cakar”) (Chang, 2004). Jadi, ligan bertindak sebagai pemberi elektron dan ion logam sebagai penerima elektron. Proses pembentukan ikatan pemberi-penerima elektron tersebut dapat dilukiskan dengan persamaan sebagai berikut:
M + :L M:L
(2-2)
Di sini M adalah ion logam dan L adalah ligan yang mempunyai pasangan elektron. Jumlah ligan yang dapat diikat oleh ion logam itu disebut bilangan koordinasi senyawa kompleks. Dengan demikian, persamaan (2-2) dapat ditulis dalam bentuk umum (persamaan 2-3) sebagai berikut:
M + nL MLn
(2-3)
Di sini n adalah bilangan koordinasi senyawa kompleks yang terbentuk. Bilangan koordinasi ini lazimnya 2, 4 dan 6 (Rivai, 1995).
Logam transisi memiliki keunikan yaitu cenderung membentuk ion kompleks. Ciri logam transisi adalah memiliki subkulit d yang tidak terisi penuh atau mudah menghasilkan ion-ion dengan subkulit d yang tidak terisi penuh. Ciri ini menyebabkan beberapa sifat khas, meliputi warna yang unik, pembentukan senyawa paramagnetik, aktivitas katalitik dan terutama kecenderungan besar untuk membentuk ion kompleks. Logam transisi yang paling lazim adalah logam transisi baris pertama (Sc, Ti, V, Cr, Mn, Fe, Co, Ni dan Cu) (Chang, 2004).
Metode yang didasarkan pada terbentuknya kompleks melalui reaksi pembentukan ion-ion kompleks ataupun pembentukan molekul netral yang terdisosiasi dalam larutan adalah metode kompleksometri (Khopkar, 1990). Metode ini juga didasarkan pada kemampuan ion-ion logam membentuk senyawa kompleks yang mantap dan dapat larut air (Rivai, 1995).
E. Ion Association
Ion association sering dikenal sebagai bentuk pasangan ion. Ion
association adalah interaksi antara ion yang bermuatan negatif dengan ion
bermuatan positif (kation dengan anion atau anion dengan kation). Dalam larutan biasanya dijumpai dalam bentuk presipitan atau endapan (Anonim, 2009).
11
menyebabkan ion-ion tersebut kehilangan muatannya. Contoh kesetimbangan penggabungan kation dan anion (persamaan 2-4):
K+ + A- K+A
(2-4)
Salah satu sifat khas gabungan-ion adalah adanya momen dwikutub yang besar. Contohnya pada gabungan ion K+Br
-2 [C20H30N3O2]+ + [Co(SCN)4]2- 2[C20H30N3O2]+[Co(SCN)4]
2-, harga momen dwikutubnya2-, µ = 92-,1D (Rivai, 1995). Contoh lain adalah pada penggabungan antara chincocaine dengan CoTC (persamaan 2-5) dan chincocaine dengan CrTC (persamaan 2-6) (Gani dkk., 2005):
(2-5)
3 [C20H30N3O2]+ + [Cr(SCN)4]3- 3[C20H30N3O2]+[Cr(SCN)4]
(2-6)
F. Spektrofotometri Serapan Atom ( SAA )
Peristiwa serapan atom pertama kali diamati oleh Fraunhofer, ketika mengamati garis-garis hitam pada spektrum matahari. Spektrofotometri serapan atom pertama kali digunakan pada tahun 1955 oleh Walsh. Spektrofotometri serapan atom digunakan untuk analisis kuantitatif unsur-unsur logam dalam jumlah kelumit (trace) dan sangat kelumit (ultratrace). Cara analisis ini memberikan kadar total unsur logam dalam suatu sampel dan tidak tergantung pada bentuk molekul logam dalam sampel tersebut. Cara ini cocok untuk analisis kelumit logam karena mempunyai kepekaan yang tinggi (batas deteksi kurang dari 1 ppm), pelaksanaannya relatif sederhana, dan interferensinya sedikit.
Spektrofotometri serapan atom didasarkan pada penyerapan energi sinar tampak atau ultraviolet (Rohman, 2007).
Metode spektrofotometri serapan atom (SSA) berprinsip pada absorpsi cahaya oleh atom. Pada metode ini, atom-atom akan menyerap cahaya tersebut pada panjang gelombang tertentu, tergantung sifat unsurnya. Kobalt menyerap pada λ 240,7 nm. Cahaya pada panjang gelombang ini mempunyai cukup energi untuk menguraikan tingkat elektronik suatu atom. Transisi elektronik suatu unsur bersifat spesifik. Dengan absorpsi energi, berarti memperoleh energi lebih banyak, sehingga suatu atom pada keadaan dasar akan dinaikkan energinya ke tingkat eksitasi. Dengan peristiwa ini, dapat memilih diantara panjang gelombang unsur yang menghasilkan garis spektrum yang tajam dan dengan intensitas maksimum. Garis inilah yang dikenal dengan garis resonansi (Khopkar, 1990).
Keberhasilan analisis ini tergantung pada proses eksitasi dan cara memperoleh garis resonansi yang tepat. Suhu nyala harus sangat tinggi dan dapat diterangkan dari persamaan distribusi Boltzman (persamaan 2-7)
T : Temperatur absolut (Kelvin)
Ej : Perbedaan energi tingkat eksitasi dan tingkat dasar Nj : Jumlah atom pada keadaan tereksitasi
No : Jumlah atom pada keadaan dasar
13
Po : Jumlah keadaan kuantum dengan energi yang sama pada keadaan dasar
(Khopkar, 1990)
1. Pengukuran serapan pada spektrofotometri serapan atom
Oleh karena garis-garis spektrum atom sangat sempit dan juga energi-energi transisi atom itu khas (untuk masing-masing unsur) maka metode analisis yang berdasarkan pengukuran serapan (absorbansi) atom juga mempunyai sifat spesifik yang tinggi. Kecilnya lebar garis spektrum serapan atom menimbulkan masalah pada pengukuran serapannya. Ditinjau dari hubungan antara konsentrasi dengan serapan, maka hukum Lambert-Beer dapat digunakan jika sumbernya adalah sinar monokromatis. Pada SSA, panjang gelombang garis absorpsi resonansi identik dengan garis-garis emisinya. Hal ini disebabkan karena serasinya proses transisi. Untuk bekerja pada panjang gelombang ini, diperlukan suatu monokromator celah yang dapat menghasilkan lebar puncak sekitar 0,002-0,005 nm. Jelaslah bahwa SSA diperlukan suatu sumber radiasi yang mengemisikan sinar pada panjang gelombang yang tepat sama dengan panjang gelombang emisinya, yakni menggunakan sumber sinar lampu katoda berongga (Rohman, 2007).
2. Instrumentasi Spektrofotometer Serapan Atom
Prinsip kerja dan instrumentasi spektrofotometer serapan atom dapat dilihat pada gambar 2.2 dan gambar 2.3 berikut ini:
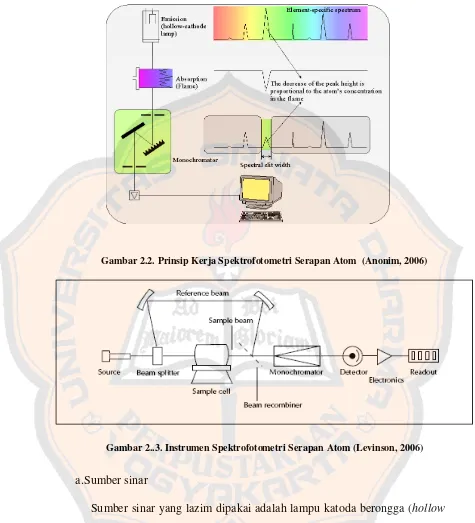
Gambar 2.2.Prinsip Kerja Spektrofotometri Serapan Atom (Anonim, 2006)
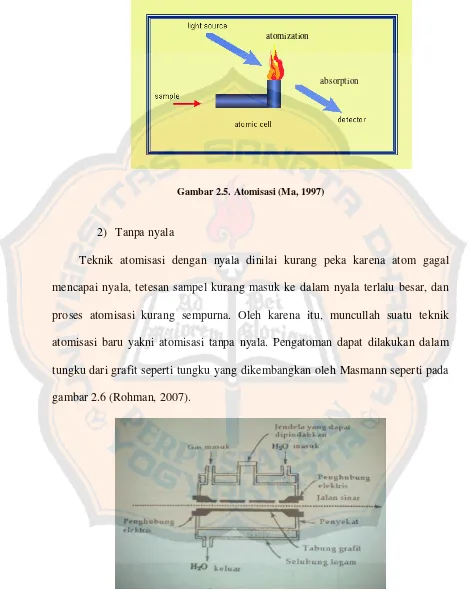
Gambar 2..3. Instrumen Spektrofotometri Serapan Atom (Levinson, 2006)
a.Sumber sinar
Sumber sinar yang lazim dipakai adalah lampu katoda berongga (hollow cathode lamp). Lampu ini terdiri atas tabung kaca tertutup yang mengandung
15
antara anoda dan katoda diberi selisih tegangan yang tinggi (600 volt), maka katoda akan memancarkan berkas-berkas elektron yang bergerak menuju anoda yang mana kecepatan dan energinya sangat tinggi. Elektron-elektron dengan energi tinggi ini dalam perjalanannya menuju ke anoda akan bertabrakan dengan gas-gas mulia yang diisikan tadi (Rohman, 2007).
Akibat dari tabrakan-tabarakan ini membuat unsur-unsur gas mulia akan kehilangan elektron dan menjadi ion bermuatan positif. Ion-ion gas mulia yang bermuatan positif ini selanjutnya akan bergerak ke katoda dengan kecepatan yang tinggi pula. Sebagaimana disebutkan di atas, pada katoda terdapat unsur-unsur yang sesuai dengan unsur yang akan dianalisis. Unsur-unsur ini akan ditabrak oleh ion-ion positif gas mulia. Akibat tabrakan ini, unsur-unsur akan terlempar ke luar dari pemukaan katoda. Atom-atom unsur dari katoda ini kemudian akan mengalami eksitasi ke tingkat energi-energi elektron yang lebih tinggi dan akan memancarkan spektrum pancaran dari unsur yang sama dengan unsur yang akan dianalisis (Rohman, 2007).
Gambar 2.4. Hollow Cathode Lamp (Levinson, 2006)
b. Tempat Sampel
Dalam analisis dengan spektrometri serapan atom, sampel yang akan dianalisis harus diuraikan menjadi atom-atom netral yang masih dalam keadaan dasar. Ada berbagai macam alat yang dapat digunakan untuk mengubah suatu sampel menjadi uap atom-atom yaitu: dengan nyala (flame) dan tanpa nyala (flameless) (Rohman, 2007).
1) Nyala
17
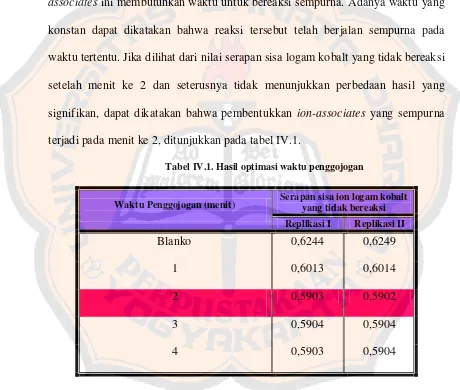
Gambar 2.5. Atomisasi (Ma, 1997)
2) Tanpa nyala
Teknik atomisasi dengan nyala dinilai kurang peka karena atom gagal mencapai nyala, tetesan sampel kurang masuk ke dalam nyala terlalu besar, dan proses atomisasi kurang sempurna. Oleh karena itu, muncullah suatu teknik atomisasi baru yakni atomisasi tanpa nyala. Pengatoman dapat dilakukan dalam tungku dari grafit seperti tungku yang dikembangkan oleh Masmann seperti pada gambar 2.6 (Rohman, 2007).
Gambar 2.6. Tungku Masmann (Rohman, 2007)
atomization
absorption
Atomisasi dapat dilakukan baik dengan nyala maupun dengan tungku. Untuk mengubah unsur metalik menjadi uap atau hasil disosiasi diperlukan energi panas. Suhu harus benar-benar terkendali dengan sangat hati-hati agar proses atomisasinya sempurna. Ionisasi harus dihindarkan dan ini dapat terjadi pada suhu yang terlalu tinggi (Khopkar, 1990).
c.Monokromator
Pada spektrofotometer serapan atom, monokromator yang dimaksudkan untuk memisahkan dan memilih panjang gelombang yang digunakan dalam analisis. Disamping optik, dalam monokromator juga terdapat suatu alat yang digunakan untuk memisahkan radiasi resonansi dan kontinyu yang disebut dengan chopper (Rohman, 2007).
d.Detektor
Detektor digunakan untuk mengukur intensitas cahaya yang melalui tempat pengatoman. Biasanya digunakan tabung pengganda foton (photomultiplier tube). Ada 2 cara yang dapat digunakan dalam sistem deteksi yaitu: (a) yang memberikan respon terhadap radiasi resonansi dan radiasi kontinyu; dan (b) yang memberikan respon terhadap radiasi resonansi (Rohman, 2007).
19
kedua, output berasal dari radiasi resonan dan radiasi kontinyu yang dipisahkan. Dalam hal ini, sistem penguat harus cukup selektif untuk dapat membedakan radiasi. Cara terbaik adalah dengan menggunakan detektor yang hanya peka terhadap radiasi resonan yang termodulasi (Rohman, 2007).
e.Readout
Readout merupakan suatu alat penunjuk atau dapat juga diartikan sebagai
sistem pencatat hasil. Pencatatan hasil dilakukan dengan suatu alat yang telah terkalibrasi untuk pembacaan suatu transmisi atau absorpsi. Hasil pembacaan dapat berupa angka atau berupa kurva suatu recorder yang menggambarkan serapan atau intensitas emisi (Rohman, 2007).
3. Kelebihan dan Kekurangan Spektrofotometri Serapan Atom
Kelebihan spektrofotometri serapan atom adalah kecepatan analisisnya; dapat digunakan untuk menentukan konsentrasi semua unsur pada konsentrasi runut (ketelitiannya sampai tingkat runut/trace); dan sebelum pengukuran tidak perlu memisahkan unsur yang ditentukan karena kemungkinan penentuan satu unsur dengan kehadiran unsur lain dapat dilakukan asalkan lampu katoda berongga yang diperlukan tersedia. Kekurangan spektrofotometri serapan atom adalah kurang sensitif untuk pengukuran sampel bukan logam dan adanya gangguan-gangguan (interference) adalah peristiwa-peristiwa yang menyebabkan pembacaan serapan unsur yang dianalisis menjadi lebih kecil atau lebih besar dari
nilai yang sesuai dengan konsentrasinya dalam sampel. Gangguan-gangguan yang dapat terjadi dalam SSA adalah sebagai berikut:
1) Gangguan yang berasal dari matriks sampel yang mana dapat mempengaruhi banyaknya sampel yang mencapai nyala.
2) Gangguan kimia yang dapat mempengaruhi jumlah/banyaknya atom yang terjadi di dalam nyala akibat disosiasi senyawa-senyawa yang tidak sempurna dan ionisasi atom-atom di dalam nyala.
3) Gangguan oleh serapan yang disebabkan bukan oleh serapan atom yang dianalisis; yakni serapan oleh molekul-molekul yang tidak terdisosiasi di dalam nyala.
4) Gangguan oleh penyerapan non-atomik (non-atomic absorption) (Khopkar, 1990)
G. Parameter Validitas dan Kategori Metode Analisis
1. Parameter validitas metode analisis
Validasi metode analisis adalah suatu prosedur yang digunakan untuk membuktikan apakah suatu metode analisis memenuhi persyaratan yang ditentukan atau tidak (Anonim, 2005b). Parameter analisis yang harus dipertimbangkan dalam validasi metode analisis antara lain:
21
analit yang ditambahkan (Anonim, 2005b). Akurasi yang baik untuk bahan baku adalah 90-110% (Anonim, 2004).
b. Presisi merupakan derajat kesesuaian antara hasil uji individual, diukur melalui penyebaran hasil individual dari rata-rata jika prosedur diterapkan secara berulang dari suatu sampel yang homogen dengan menggunakan suatu metode analisis (Anonim, 2005b). Kriteria presisi diberikan jika metode memberikan coefficient of variation (koefisien variasi) atau relative standard deviation (simpangan baku relatif) ≤ 5% (Anonim, 2004).
c. Spesifisitas merupakan kemampuan suatu metode untuk mengukur dengan akurat respon analit diantara seluruh komponen sampel potensial yang ada dalam matrik sampel (Anonim, 2005b).
d. Detection limit merupakan konsentrasi terkecil analit dalam sampel yang dapat dideteksi (Anonim, 2005b).
e. Quantitation limit merupakan pengukuran secara kuantitatif untuk konsentrasi terkecil yang diukur dengan presisi dan akurasi yang dapat diterima di bawah kondisi percobaan yang ditetapkan dengan metode tersebut (Anonim, 2005b).
f. Linearitas merupakan kemampuan metode analisis memberikan respon yang secara langsung atau dengan bantuan transformasi matematik yang baik, proporsional terhadap konsentrasi analit dalam sampel dengan rentang yang ada (Anonim, 2005b).
g. Range (kisaran) merupakan interval antara kadar terendah sampai tertinggi analit yang dapat diukur secara kuantitaif menggunakan metode analisis tertentu dan menghasilkan ketelitian, ketepatan dan linearitas yang mencukupi (Anonim, 2005b). Suatu strategi yang baik adalah mengukur baku dengan kisaran 25, 50, 75, 100, 125, dan 150% dari konsentrasi analit yang diharapkan (Rohman, 2007).
2. Kategori metode analisis menurut USP 28 NF 23 Vol. 2
a. Kategori I, meliputi metode analisis untuk kuantifikasi komponen mayor substansi baku obat atau bahan aktif (termasuk pengawet) dalam sediaan obat jadi.
b. Kategori II, meliputi metode analisis untuk penentuan pengotor dalam substansi bahan baku obat atau senyawa degradasi dalam sediaan obat jadi, termasuk pengukuran kuantitatif dan uji batas (limit test).
c. Kategori III, meliputi metode analisis untuk penentuan sifat-sifat fisik lain obat seperti uji disolusi dan uji pelepasan.
d. Kategori IV, meliputi metode analisis untuk uji identifikasi.
23
H. Landasan Teori
Anestetik lokal yang sering digunakan dalam bidang kesehatan adalah lidokain HCl 2% dalam bentuk sediaan injeksi (Ganiswara, 2002). Berbagai cara untuk menganalisis lidokain HCl baik dalam sediaan farmasetika maupun dalam cairan tubuh diantaranya dengan menggunakan metode kromatografi kinerja tinggi (Gilabert dkk., 2006) dan kromatografi gas (Baniceru dkk., 2004
Pada penelitian ini akan dilakukan analisis terhadap lidokain HCl dalam sediaan injeksi dengan menggunakan metode spektrofotometri serapan atom tidak langsung yang sebelumnya dilakukan kompleksometri yaitu pengkompleksan antara kobalt (II) klorida dan amonium tiosianat yang bertujuan untuk pembentukan ion negatif (tetrathiocyanatocobaltate) yang akan berinteraksi dengan ion positif yaitu lidokain yang telah terprotonasi dalam suasana asam. Hasil interaksi kedua ion yang berbeda muatan ini adalah pembentukan suatu ion-associates yang ditunjukkan dengan endapan berwarna biru. Pengukuran secara
spektrofotometri serapan atom tidak langsung terhadap sisa ion logam kobalt berlebih yang tidak bereaksi dimana hasil pengukuran dari serapan sisa ion logam kobalt yang tidak bereaksi sebagai reprensentasi kadar lidokain HCl. Metode tidak langsung ini merupakan metode alternatif dalam analisis lidokain HCl selain metode penetapan kadar lidokain HCl secara langsung. Penelitian ini mengadopsi kepada penelitian analisis cinchocaine HCl dengan metode spektrofotometri dan spektrofotometri serapan atom (Gani dkk., 2005). Lidokain HCl sendiri
), metode titrimetri (Anonim, 1979) dan metode spektrofotometri UV (Gilabert dkk., 2006).
merupakan senyawa yang tidak mengandung logam. Adanya kesamaan gugus amina pada cinchocaine dan lidokain yang bermuatan positif karena mengalami protonasi pada suasana asam dapat membentuk suatu ion-associates dengan agen pengkelat tetrathiocyanatocobaltate yang bermuatan negatif. Metode penetapan kadar lidokain HCl secara spektrofotometri serapan atom tidak langsung merupakan suatu metode pengembangan, maka dari itu pada penelitian ini perlu dilakukan validasi metode dengan melihat akurasi, presisi dan linearitas.
I. Hipotesis
25
BAB III
METODOLOGI PENELITIAN
A. Jenis dan Rancangan Penelitian
Penelitian penetapan kadar lidokain HCl dalam sediaan injeksi secara spektrofotometri serapan atom tidak langsung merupakan jenis penelitian non eksperimental deskriptif.
B. Definisi Operasional
1. Metode analisis penelitian ini termasuk dalam kategori I, yaitu suatu metode yang digunakan untuk analisis kuantitatif komponen mayor zat aktif dalam suatu sediaan (Anonim, 2005b).
2. Validasi metode analisis merupakan serangkaian prosedur untuk menentukan apakah metode analisis dengan spektrofotometri serapan atom ini yang digunakan memenuhi parameter akurasi, presisi dan linearitas (Harmita, 2004).
3. Sampel lidokain HCl yang digunakan adalah sediaan injeksi merk “X” yang mengandung lidokain HCl dengan konsentrasi 20 mg/mL.
4. Kadar obat dalam lidokain HCl dinyatakan dalam satuan mg/mL.
C. Alat-alat Penelitian
Peralatan yang digunakan dalam penelitian ini antara lain: spektrofotometer serapan atom (Hitachi Polarized Zeeman Atomic Absorption
Spectrofotometer Z100) dengan hallow cathode lamp untuk kobalt, slit width 0,2 nm, current lamp 10,0 mA; tipe nyala udara-asetilen; pH meter (pH Tester 30); neraca analitik Scalttorus dan Scaltec; kertas Whatman no 42; pipet mikro (Boithic); dan alat-alat gelas yang lazim digunakan di laboratorium analisis.
D. Bahan-bahan Penelitian
Bahan yang digunakan dalam penelitian ini meliputi sediaan injeksi lidokain HCl dengan konsentrasi 20 mg/mL (buatan pabrik tertentu, dengan merk X); Standar lidokain HCl (kualitas farmasetis Brataco Chemical); Aquabides (Laboratorium Kimia Instrumen Fakultas Farmasi Universitas Sanata Dharma); kobalt klorida, amonium thiosianat, Asam nitrat kualitas p.a. (E. Merck)
E. Tata Cara Penelitian
1. Pembuatan larutan stok
a.
Sejumlah 2,34790 g baku lidokain HCl ditimbang seksama kemudian larutkan dengan aquabides dalam labu 100 mL.
Larutan baku Lidokain HCl 0,08 M
b.
Sejumlah 2,37930 g kobalt klorida (CoCl
Larutan agen pengkelat tetrathiocyanatocobaltate 0,1 M
2.6H2O) ditimbang seksama dan
27
tersebut dicampur dan larutkan dengan aquabides dalam labu 100 mL. Larutan tetrathiocyanatocobaltate harus selalu dibuat baru.
2. Optimasi kondisi percobaan
Optimasi waktu penggojogan
3.
Pemilihan waktu yang optimum untuk pembentukan ion associates dilakukan dengan pengukuran dari menit 1-4. Ambil 6,0 mL larutan Lidokain HCl 0,08 M ke dalam 8 flakon yang berbeda kemudian tambahkan 10 mL larutan tetrathiocyanatocobaltate 0,1 M. Larutan tersebut digojog hingga terbentuk endapan pada menit 1-4 dan disaring dengan menggunakan kertas saring Whatman No.42. Tambahkan 1,0 mL asam nitrat encer pada filtrat, encerkan dengan aquabides hingga tanda. Larutan blanko juga dilakukan dengan cara yang sama. Ukur serapan sisa ion logam kobalt yang tidak bereaksi dengan spektrofotometri serapan atom dan dicari waktu penggojogan optimum yang menunjukkan serapan yang konstan dari logam kobalt yang tidak bereaksi. Lakukan 2 kali replikasi.
Kondisi instrumentasi spektrofotometer serapan atom
Optimasi instrumentasi spektrofotometer serapan atom dilakukan oleh pihak LPPT UGM dan didapatkan data instrumentasi spektrofotometer serapan atom untuk pengukuran logam kobalt disajikan pada tabel III.1 sebagai berikut:
Tabel III.1. Kondisi instrumental kobalt
Kondisi Instrumen Lamp Current 10.0 mA Wavelength 240.7 nm
Slit 0.2 nm
Atomizer STD Burner
Oxidant Air
Oxidant Pressure 1.60 kg/cm 2
(9.5 l/min)
Fuel C2H2
Fuel Pressure 0.35 kg/cm 2
(2.5 l/min) Burner Height 10.0 mm
4.
a.
Pembuatan persamaan kurva baku
Pembuatan seri konsentrasi larutan baku
b.
Masukkan ke dalam labu ukur 10 mL sejumlah 1,5; 2,0; 2,5; 3,0 dan 3,5 mL larutan stok lidokain HCl 0,08 M. Tambahkan 5,0 mL larutan tetrathiocyanatocobaltate 0,1 M. Larutan tersebut digojog hingga
terbentuk endapan selama 2 menit. Saring larutan tersebut dengan kertas saring Whatman No.42. Tambahkan 1,0 mL asam nitrat encer pada filtrat dan encerkan dengan aquabides hingga tanda. Ukur serapan sisa ion logam kobalt pada panjang gelombang 240,7 nm dengan menggunakan setting kondisi instrumental yang optimal. Lakukan 3 kali replikasi.
Pembuatan blanko
29
kobalt pada panjang gelombang 240,7 nm dengan menggunakan setting kondisi instrumental yang optimal.
5.
Sampel yang digunakan dalam penelitian ini adalah sediaan injeksi lidokain HCl dengan konsentrasi 20 mg/mL. Pengambilan 1 macam sediaan injeksi lidokain HCl dengan konsentrasi 20 mg/mL merk “X” berdasarkan atas 20% dari jumlah sediaan injeksi yang beredar dipasaran.
Pemilihan sampel
6.
a.
Uji kualitatif
Ambil volume yang ekuivalen dengan 0,1 g lidokain HCl, tambahkan NaOH untuk membuat menjadi basa. Kemudian saring dengan kertas saring, cuci residu dengan air dan larutkan residu dalam alkohol 95%. Lakukan uji kualitatif pada sediaan injeksi lidokain HCl tersebut dengan cara menambahkan 0,5 mL larutan CoCl2
b.
, gojog selama 2 menit dan lihat hasilnya. Jika hasil positif maka akan terbentuk warna biru atau bisa berubah menjadi hijau dengan endapan halus.
c.
Ambil 2 mL larutan injeksi lidokain HCl, tambahkan 3 tetes iodium. Jika hasil positif maka akan terbentuk endapan coklat.
Ambil 2 mL larutan injeksi lidokain HCl, tambahkan 1 mL asam nitrat dan 1 mL perak nitrat. Jika hasil positif maka akan terbentuk endapan putih.
7. Keseragaman Volume sediaan injeksi
8.
Membandingkan volume 20 ampul sediaan injeksi dengan volume isi netto tiap wadah harus berlebih dari volume yang ditetapkan. Pada volume pada etiket sebanyak 2,0 mL, volume tambahan yang dianjurkan untuk cairan encer sebanyak 0,15 mL.
Penetapan kadar lidokain HCl
9. Pembuatan larutan baku untuk recovery
Pipet 2,0 mL sampel injeksi yang telah dihomogenkan terlebih dahulu dengan cara digojog dalam Erlenmeyer tertutup, masukkan ke dalam labu 10 mL kemudian tambahkan larutan tetrathiocyanatocobaltate 0,1 M 5,0 mL. Gojog larutan tersebut hingga terbentuk endapan selama 2 menit. Saring larutan menggunakan kertas saring Whatman No.42, tambahkan 1,0 mL asam nitrat encer pada filtrat dan encerkan dengan aquabides hingga tanda. Ukur serapan sisa ion logam kobalt pada panjang gelombang 240,7 nm dengan menggunakan setting kondisi instrumental yang optimal. Lakukan 5 kali replikasi.
Sejumlah 1,17395 g baku lidokain HCl ditimbang seksama kemudian larutkan dengan aquabides ad 50,0 mL.
10. Recovery (perolehan kembali)
31
dengan cara digojog dalam Erlenmeyer tertutup, kemudian masukkan ke dalam labu 10 mL, tambahkan 1,7 mL dan 2,4 mL larutan baku lidokain HCl untuk recovery, kemudian tambahkan larutan tetrathiocyanatocobaltate 0,1 M 5,0 mL. Gojog larutan tersebut hingga terbentuk endapan selama 2 menit. Saring larutan menggunakan kertas saring Whatman No.42., tambahkan 1,0 mL asam nitrat encer pada filtrat dan encerkan dengan aquabides hingga tanda. Ukur serapan sisa ion logam kobalt pada panjang gelombang 240,7 nm dengan menggunakan setting kondisi instrumental yang optimal. Lakukan 6 kali replikasi.
F. Analisis Hasil
a. Penentuan linearitas
Nilai r dapat diperoleh dengan memasukkan data konsentrasi lidokain HCl dan serapan dari data penentuan kurva baku ke dalam program regresi linear pada kalkulator. Nilai r ini selanjutnya dibandingkan dengan nilai r tabel pada taraf kepercayaan tertentu. rhitung > rtabel,
b.
pada derajat bebas = n-2, dan taraf kepercayaan 99% (De Muth, 1999).
Penentuan kadar sampel
Dari hasil pengukuran kadar sampel ditentukan besarnya kadar terukur (x) dengan memasukkan nilai serapan yang dihasilkan (y) pada persamaan linear kurva baku (y = bx+a).
c. Penentuan presisi
d.
Dari nilai kadar pada penetapan kadar lidokain HCl pada sediaan injeksi ditentukan nilai CV untuk masing-masing replikasi. Ditentukan nilai CV rata-rata keseluruhan replikasi. Metode yang memiliki nilai presisi yang baik jika CV nya kurang dari 5% (Anonim, 2004).
Penentuan akurasi
% Perolehan kembali =
Dari nilai hasil uji perolehan kembali
Kadar terukur
x100% Kadar diketahui
33
BAB IV
HASIL DAN PEMBAHASAN A. Pemilihan Sampel
Pada penelitian ini dilakukan validasi metode spektrofotometri serapan atom tidak langsung untuk penetapan kadar lidokain HCl pada sediaan injeksi dengan mengunakan suatu agen pengkelat yaitu tetrathiocyanatocobaltate. Kemudahan sediaan injeksi lidokain HCl yang mudah didapat dan minimalnya kandungan selain zat aktif pada sediaan injeksi maka yang dipilih sebagai sampel adalah sediaan injeksi lidokain HCl. Sediaan injeksi lidokain HCl yang banyak dijumpai dan yang paling sering digunakan adalah sediaan injeksi lidokain HCl dengan konsentrasi 20 mg/mL (sesuai dengan kadar yang tertera pada label kemasan). Berdasarkan penelusuran di beberapa apotik di daerah Yogyakarta, didapatkan hanya beredar 1 sediaan injeksi lidokain HCl merk “X”, maka untuk jumlah populasi yang sangat sedikit, pengambilan sampelnya yaitu 20% dari populasi sehingga didapatkan 1 sediaan injeksi lidokain HCl merk “X”.
B.Uji Kualitatif Lidokain HCl
Uji kualitatif bertujuan untuk memastikan apakah di dalam sampel terdapat lidokain HCl. Ada banyak macam uji kualitatif yaitu menggunakan iodium, perak nitrat dan kobalt klorida (Anonim, 1991). Uji kualitatif yang pertama adalah dengan menggunakan kobalt klorida. Sampel yang mengandung lidokain HCl dibuat menjadi basa dengan NaOH. Pada lidokain yang basa, atom nitrogen menjadi bermuatan negatif karena adanya lone pair electron. Lidokain
akan bereaksi dengan ion logam kobalt yang bermuatan positif membentuk suatu kompleks warna (hijau) dan endapan halus. Hasil yang didapatkan pada uji ini adalah positif bahwa dalam sampel mengandung lidokain ditunjukkan dengan adanya endapan halus berwarna hijau yaitu kompleks lidokain-kobalt. Reaksinya (persamaan 4-1):
C14H22N2O.HCl + NaOH C14H22N2O + NaCl + H2O
Co2+ + 2 C14H22N2O kompleks Co[C14H22N2O]2
(4-1) Uji kualitatif yang kedua adalah dengan menggunakan iodium. Sampel yang mengandung lidokain HCl ketika ditambahkan iodium akan menghasilkan endapan yang berwarna coklat. Endapan tersebut adalah lidokain dan warna coklat merupakan iodium yang sedikit larut dalam air (I2
C14H22N2O.HCl + I3- C14H22N2O + HI + I2 + Cl
-). Hasil yang didapatkan pada uji ini adalah positif bahwa dalam sampel mengandung lidokain HCl ditunjukkan dengan adanya endapan coklat (lidokain dan iodium). Reaksinya (persamaan 4-2):
(4-2)
35
Ag+ + [C14H23N2O]+ + 4H+ + NO3- + Cl- AgCl + [C14H23N2O]+ + NO + 2H2O
(4-3)
C. Optimasi Waktu Penggojogan
Waktu penggojogan adalah waktu optimal pembentukkan ion-associates. Optimasi waktu penggojogan ini sangat penting karena pembentukan ion-associates ini membutuhkan waktu untuk bereaksi sempurna. Adanya waktu yang
konstan dapat dikatakan bahwa reaksi tersebut telah berjalan sempurna pada waktu tertentu. Jika dilihat dari nilai serapan sisa logam kobalt yang tidak bereaksi setelah menit ke 2 dan seterusnya tidak menunjukkan perbedaan hasil yang signifikan, dapat dikatakan bahwa pembentukkan ion-associates yang sempurna terjadi pada menit ke 2, ditunjukkan pada tabel IV.1.
Tabel IV.1. Hasil optimasi waktu penggojogan
Waktu Penggojogan (menit) Serapan sisa ion logam kobalt yang tidak bereaksi
Replikasi I Replikasi II
Blanko 0,6244 0,6249
1 0,6013 0,6014
2 0,5903 0,5902
3 0,5904 0,5904
4 0,5903 0,5904
Hal ini juga dibuktikan menggunakan T-Test dengan perbandingan nilai serapan antar menit. Hasil pengujian secara statistik ditunjukkan pada tabel IV.2
Tabel IV.2. Paired sampel test
Keterangan:
Waktu penggojogan menit 1 dengan menit 2 berbeda [karena nilai sig.(2-tailed)nya adalah 0,006<0,05] Waktu penggojogan menit 1 dengan menit 3 berbeda [karena nilai sig.(2-tailed)nya adalah 0,003<0,05]
Waktu penggojogan menit 2 dengan menit 3 sama [karena nilai sig.(2-tailed)nya adalah 0,205>0,05] Waktu penggojogan menit 2 dengan menit 4 sama [karena nilai sig.(2-tailed)nya adalah 0,500>0,05]
Waktu penggojogan menit 3 dengan menit 4 sama [karena nilai sig.(2-tailed)nya adalah 0,500>0,05]
Hasil pengujian statistika dengan T-Test pada taraf kepercayaan 95% dapat dilihat bahwa ada perbedaan yang cukup signifikan antara menit 1 dengan menit 2, 3, 4 dan tidak ada perbedaan yang signifikan antara menit 2, 3 dan 4.
D. Pembuatan Kurva Baku
Pada penelitian ini dilakukan pembuatan kurva baku yang bertujuan untuk mendapatkan persamaan regresi linier yang digunakan untuk menghitung
Paired Differences t df Interval of the
37
kadar lidokain HCl dalam sampel. Kurva baku yang dibuat dalam 5 konsentrasi lidokain HCl yang berbeda yaitu: 35,211; 46,958; 58,685; 70,422 dan 82,159 mg/mL. Replikasi pada kurva baku dilakukan tiga kali.
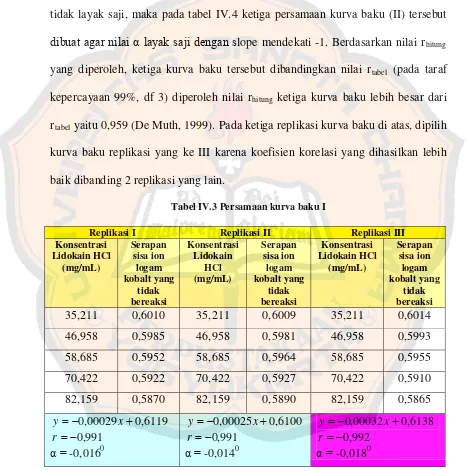
Ketiga persamaan kurva baku (I) pada tabel IV.3 memiliki nilai α yang tidak layak saji, maka pada tabel IV.4 ketiga persamaan kurva baku (II) tersebut
dibuat agar nilai α layak saji dengan slope mendekati -1. Berdasarkan nilai rhitung yang diperoleh, ketiga kurva baku tersebut dibandingkan nilai rtabel (pada taraf kepercayaan 99%, df 3) diperoleh nilai rhitung ketiga kurva baku lebih besar dari rtabel
Tabel IV.3 Persamaan kurva baku I
yaitu 0,959 (De Muth, 1999). Pada ketiga replikasi kurva baku di atas, dipilih kurva baku replikasi yang ke III karena koefisien korelasi yang dihasilkan lebih baik dibanding 2 replikasi yang lain.
Replikasi I Replikasi II Replikasi III
Konsentrasi
Tabel IV.4. Persamaan kurva baku II
Replikasi I Replikasi II Replikasi III
Konsentrasi
Persamaan kurva baku replikasi III yang didapat akan digunakan untuk penetapan kadar dan penetapan perolehan kembali lidokain HCl selanjutnya. Persamaan kurva baku replikasi III disajikan pada gambar 4.1.
0,584
0 0,005 0,01 0,015 0,02 0,025
Kadar Lidokain HCl (mg/2,5x10 mL)
S
Gambar 4.1. Persamaan kurva baku replikasi III
39
E. Penetapan Keseragaman Volume Sediaan Injeksi
Keseragaman volume untuk sediaan injeksi dimaksudkan untuk memastikan bahwa sediaan injeksi lidokain HCl yang akan ditetapkan kadarnya tersebut mempunyai kandungan volume yang seragam antara satu dengan yang lain. Penetapan keseragaman volume pada sediaan injeksi tersebut mengikuti cara yang tertera pada Farmakope Indonesia edisi III (1979).
Pada tabel IV.5 dapat dilihat bahwa sediaan injeksi merk “X” memenuhi persyaratan untuk keseragaman volume menurut Farmakope Indonesia edisi III yaitu tidak melebihi volume tambahan pada cairan encer sebanyak 0,15 mL.
Tabel IV.5. Data keseragaman volume sediaan injeksi lidokain HCl
Nomor Volume Injeksi
(mL) Nomor
Penyimpangan dari penambahan volume > 0,15 mL = tidak ada
Sediaan injeksi yang telah ditetapkan keseragaman volumenya selanjutnya akan digunakan sebagai sampel dalam penetapan kadar lidokain HCl.
F. Penetapan Kadar Lidokain HCl Pada Sediaan Injeksi
Sampel yang digunakan adalah sediaan injeksi, sebanyak 20 buah sediaan injeksi sebelumnya telah diuji keseragaman volumenya, dihomogenkan pada Erlenmeyer bertutup. Pengambilan sampel dari kemasan dengan nomor batch yang sama dan dilakukan secara acak agar setiap sediaan injeksi memiliki
peluang untuk terambil menjadi sampel.
Penetapan kadar lidokain HCl dilakukan dengan cara mengambil sebanyak 5 cuplikan sampel yang telah dihomogenkan untuk dilakukan penetapan kadar dengan 5 kali replikasi. Penetapan kadar dilakukan sebanyak 5 kali replikasi agar hasilnya representatif.
Sampel diambil sejumlah 2,0 mL kemudian dimasukkan ke dalam labu ukur 10 mL. Agen pengkelat yaitu tetrathiocyanatocobaltate ditambahkan ke dalam labu ukur sejumlah 5,0 mL, larutan tersebut digojog selama 2 menit kemudian larutan diencerkan hingga tanda dengan aquabides..
41
menggunakan spektrofotometri serapan atom dapat memberikan hasil yang optimal.
Pembentukkan ion-associates ditandai dengan adanya endapan yang berwarna biru muda. Agen pengkelat tetrathiocyanatocobaltate (persamaan 4-4) merupakan hasil pengkompleksan antara kobalt klorida dengan amonium tiosianat (Vogel, 1979).
Co2+ + 4SCN- Co(SCN)4
(4-4)
Pada penelitian ini agen pengkelat tetrathiocyanatocobaltate selalu dibuat baru untuk mencegah pembentukan kobalt oksida, sulfur dioksida dan nitrogen oksida (Anonim, 2005a) yang dapat mengganggu hasil pada penetapan kadar lidokain HCl. Reaksi dekomposisi dari tetrathiocyanatocobaltate (persamaan 4-5):
[Co(SCN)4]2- + H2O + 11O2 4SO2 + 4NO + CoO + 2-OH + 4CO2
(4-5)
Pada suasana asam, gugus amina pada lidokain HCl mengalami protonasi sehingga atom N pada gugus tersebut bermuatan positif sedangkan agen pengkelat tetrathiocyanatocobaltate bermuatan negatif. Adanya interaksi pada antara
muatan positif pada lidokain dengan muatan negatif pada ion tetrathiocyanatocobaltate membentuk suatu ion-associates. Pembentukkan ion-associates antara lidokain HCl dengan agen pengkelat tetrathiocyanatocobaltate
ditunjukkan dengan endapan berwarna biru muda, reaksinya dapat dilihat pada persamaan 4-6.
Co
Tabel IV.6 .Hasil penetapan kadar lidokain HCl dalam sediaan injeksi merk “X”
Replikasi
Volume sampel
(mL)
Serapan sisa ion logam kobalt
Hasil kadar rata-rata lidokain HCl pada sediaan injeksi yaitu 21,59 mg/mL dengan nilai SD sebesar 0,76 (tabel IV.6). Larutan yang diujikan memiliki kadar yaitu 2% (sesuai dengan kadar yang tercantum pada label kemasan) dimana nilai CV untuk kadar 1-10% ≤ 5% (Anonim, 2004), maka larutan dengan kadar tersebut memenuhi persyaratan dengan nilai CV yaitu 3,57% (n = 5).
G. Hasil Uji perolehan kembali
43
lidokain HCl teoritis dalam sampel dan kadar baku lidokain HCl yang ditambahkan ke sampel).
Tabel IV.7. Hasil uji perolehan kembali lidokain HCl dalam sediaan injeksi merk “X”
Replikasi
Hasil uji perolehan kembali (tabel IV.7) sediaan injeksi yaitu 95-99%. Persyaratan untuk persen perolehan kembali kandungan bahan aktif ≥ 1% yaitu 90-110% (Anonim, 2004). Larutan yang diujikan memiliki kadar 2% (sesuai dengan kadar yang tercantum pada label kemasan) dengan persen perolehan kembali yaitu 95-99% maka dapat dikatakan metode ini memiliki nilai akurasi yang baik.
H. Analisis Hasil
Pada label kemasan sediaan injeksi lidokain HCl tercantum keterangan bahwa sediaan injeksi tersebut mengandung bahan aktif lidokain HCl dengan
konsentrasi 20 mg/mL (2%), maka metode ini dikatakan memiliki presisi yang baik jika nilai CV nya ≤ 5% (Anonim, 2004). Pada hasil penetapan kadar lidokain HCl memiliki nilai CV yaitu 3,57% (n = 5), oleh karena itu metode penetapan kadar ini memiliki presisi yang baik.
Metode ini dikatakan memiliki akurasi yang baik jika memenuhi rentang nilai persen perolehan kembali yaitu 90-110% untuk kadar analit 1-10% (Anonim, 2004). Pada penelitian ini hasil uji perolehan kembali yaitu 95-99%, maka metode ini memiliki nilai akurasi yang baik.
Pada penelitian ini memiliki koefisien korelasi (r) yaitu −0,991; −0,991 dan −0,992 dari 3 replikasi pada rentang kadar lidokain HCl 35,211-82,159 mg/mL. Nilai-nilai tersebut lebih besar dibandingkan dengan nilai rtabel
45
BAB V
KESIMPULAN DAN SARAN A. Kesimpulan
1. Metode spektrofotometri serapan atom tidak langsung yang didahului dengan kompleksometri ini menghasilkan akurasi, presisi dan linearitas yang baik pada penetapan kadar lidokain HCl dilihat dari nilai CV yaitu 3,57% (n = 5) (memenuhi persyaratan nilai CV ≤ 5%); dengan persen perolehan kembali yaitu 95-99% (memenuhi rentang nilai persen perolehan kembali yaitu 90-110% untuk kadar analit 1-10%) dan koefisien korelasi −0,992 (Nilai tersebut lebih besar dibandingkan dengan nilai rtabel
2. Metode spektrofotometri serapan atom tidak langsung ini yang dikembangkan pada penelitian dapat digunakan pada penetapan kadar lidokain HCl dengan hasil kadar rata-rata lidokain HCl dalam sediaan injeksi lidokain HCl yaitu 21,59 mg/mL, dengan nilai CV yaitu 3,57% (n = 5).
yaitu 0,959 pada taraf kepercayaan 99%, df 3) pada rentang kadar 35,211-82,159 mg/mL.
B. Saran
Pengembangan aplikasi metode pada bentuk sediaan lain seperti salep lidokain HCl dan sediaan yang lainnya.
46
DAFTAR PUSTAKA
Anonim, 1979, Farmakope Indonesia Ed.III, Departemen Kesehatan Republik Indonesia, Jakarta
Anonim, 1989, AHFS (American Hospital Formulary Service), 697, The American Society of Hospital Pharmacists. Inc, United States.
Anonim, 1991, Basic Test For Pharmaceutical Dosage Forms, 71, A. I. T. B. S. Publisher and Distributors, Delhi.
Anonim, 1995, Farmakope Indonesia Ed.IV, Departemen Kesehatan Republik Indonesia, Jakarta.
Anonim, 2004, Guidelines for the Validation of Analytical Methods for Active Constituent, Agricultural and Veterinary Chemical Products, 4-5, diakses pada tanggal 2 Januari 2009.
Anonim, 2005a, Material Safety Data Sheet,
pada tanggal 17 Maret 2009.
Anonim, 2005b, USP 28 NF 23 Volume 2, 2749-2751, USP Convention , Inc.
Anonim, 2006, Atomic Absorption Spectroscopy,
Anonim, 2007, Lokal Anesthetic, http//:en.wikipedia.org/wiki/lokalanesthetic, diakses tanggal 4 September 2007.
Anonim, 2009, Analytical Chemistry,
diakses tanggal 12 Maret 2009.
Ansel, H., 1989, Pengantar Bentuk Sediaan Farmasi, diterjemahkan oleh Ibrahim Farida, 437, Penerbit Universitas Indonesia, Jakarta.
Baniceru, M. O., Croitoru, S., Popescu, M., 2004, Determination of some local anesthetics in human serum by gas chromatography with solid-phase extraction
47
Cotton, F. A., 1989, Kimia Anorganik Dasar, penerjemah Sahati Suharto, pendamping Yanti. R. A. Koestoer, cetakan I, 440, 452-458, 467-472, Penerbit UI Press, Jakarta.
De Muth, J. E., 1999, Basic Statistics and Pharmaceutical Statistical Applications, 585, Marcel Dekker. Inc., New York.
Foye, W., 1995, Prinsip–prinsip Kimia Medisinal, diterjemahkan oleh Rasyid , Salim, 638, Gadjah Mada University Press, Yogyakarta.
Gani, N. T. A., Yousef, A. F. A., Awady, M. A., 2005, Chincocaine Hydrochloride Determination by atomic Absorption Spectrometry and Spectrophotometry, II Farmaco 60, 419–424.
Ganiswara, 2002, Farmakologi dan Terapi edisi 4, 240, Bagian Farmakologi Kedokteran Universitas Indonesia, Jakarta.
Gilabert, L. E., Sagrado, S., Villanueva-Camaa, R. M., and Hernandez, M. J. M., 2006, Analysis of pharmaceutical preparations containing local anesthetics by micellar liquid chromatography and spectrophotometric detection, J. Chromatogr. A., 89-90.
Harmita, 2004, Petunjuk Pelaksanaan Validasi Metode dan Cara Perhitungan-nya, 11-21, Departemen Farmasi FMIPA UI, Jakarta.
Khopkar, 1990, Konsep Dasar Kimia Analitik diterjemahkan oleh Saptorahardjo, 71, 274-287, Airlangga Press, Surabaya.
Levinson, R., 2006, Modern Chemical Techniques, The Royal Society of Chemistry, Atomic Absorption Spectrometry,
Ma, G., 1997, Flame Atomic Absorption Spectrometry diakses tanggal 24 November 2007.
Rivai, H., 1995, Asas Pemeriksaan Kimia, 182-197, 229, UI Press, Jakarta.
Rohman, A., 2007, Kimia Farmasi Analisis, 298-322, 463-472, Pustaka Pelajar, Yogyakarta.
Vogel, A. I., 1979, A Text Book of Qualitative Chemical Analysis; fifth edition, 260, 570, 573, 589, Longman Inc., New York.
Voight, R., 1994, Buku Teknologi Farmasi, diterjemahkan oleh Noerono, Soedani, 461, Gadjah Mada University Press, Yogyakarta.
48
LAMPIRAN
49
Lampiran 2. Komposisi sampel sediaan injeksi Lidokain HCl merk “X”
LIDOKAIN HCl KOMPOSISI :
Lidokain HCl 1% injeksi, tiap mL mengandung 10 mg Lidokain HCl Lidokain HCl 2% injeksi, tiap mL mengandung 20 mg Lidokain HCl Lidokain HCl 4% injeksi, tiap mL mengandung 40 mg Lidokain HCl
KHASIAT:
Sebagai local anesthetica
INDIKASI : Local anesthetica
KONTRAINDIKASI : Hypotensi
EFEK SAMPING :
Local iritasi, tapi jarang terjadi.
Overdosis menyebabkan hypotensi, mual, muntah, kejang, respirasi collaps
PERINGATAN DAN PERHATIAN :
Penderita dengan hypovolaemia, heart blook, bradycardia
DOSIS :
1 – 2 mL i.m / Intra Subcutan
KEMASAN :
Lidokain HCl 1% injeksi Dus. 100 Ampul @ 2mL No.Reg. GKL8302300243B1
Lidokain HCl 2% injeksi Dus. 100 Ampul @ 2mL No.Reg. GKL8102300243A1
Lidokain HCl 4% injeksi Dus. 25 Vial @ 15mL No.Reg. GKL8502300243C1
SIMPAN PADA SUHU KAMAR ( 25 – 30 )0C DAN TEMPAT KERING, HINDARKAN DARI CAHAYA
51
Lampiran 3. Optimasi waktu penggojogan
Pembuatan larutan stok Lidokain HCl 0,08 M dalam 100 mL
Bobot molekul Lidokain HCl (C14H22N2O.HCl) menurut IUPAC yaitu 270,79822
Data Penimbangan Lidokain HCl
Penimbangan Replikasi I Replikasi II
Bobot cawan 37,40601 g 18,72201 g Bobot cawan + zat 39,75383 g 21,06983 g Bobot cawan + sisa 37,40603 g 18,72202 g
Zat 2,34780 g 2,34781 g
O H CoCl2.6 2
Pembentukan larutan stok agen pengkelat tetrathiocyanatocobaltate 0,1 M dalam 100 mL.
Bobot molekul kobalt klorida ( ) menurut IUPAC yaitu 237,930875 Bobot molekul amonium tiosianat (NH4SCN ) menurut IUPAC yaitu 76,12086
Data Penimbangan Kobalt Klorida
Penimbangan Replikasi I Replikasi II
Bobot cawan 26,99736 g 19,95619 g Bobot cawan + zat 29,37666 g 22,33549 g Bobot cawan + sisa 26,99739 g 19,95617 g
Zat 2,37927 g 2,37932 g
Data Penimbangan ammonium tiosianat
Penimbangan Replikasi I Replikasi II
Bobot cawan 37,40752 g 36,14554 g Bobot cawan + zat 40,45235 g 39,19037 g Bobot cawan + sisa 37,40755 g 36,14558 g
Zat 3,04480 g 3,04479 g
Hasil Optimasi waktu penggojogan
Waktu Penggojogan (menit) Serapan sisa ion logam kobalt yang tidak bereaksi
Replikasi I Replikasi II
Blanko 0,6244 0,6249
1 0,6013 0,6014
2 0,5903 0,5902
3 0,5904 0,5904
4 0,5903 0,5904
Pengujian Statistik T-Test dengan SPSS dengan taraf kepercayaan 95%
Paired Samples Statistics
Mean N Std. Deviation
Std. Error Mean
Pair 1 menit1 ,601350 2 ,0000707 ,0000500
menit2 ,590250 2 ,0000707 ,0000500
Pair 2 menit1 ,601350 2 ,0000707 ,0000500
menit3 ,590400 2 ,0000000 ,0000000
Pair 3 menit1 ,601350(a) 2 ,0000707 ,0000500
menit4 ,590350(a) 2 ,0000707 ,0000500
Pair 4 menit2 ,590250 2 ,0000707 ,0000500
menit3 ,590400 2 ,0000000 ,0000000
Pair 5 menit2 ,590250 2 ,0000707 ,0000500
menit4 ,590350 2 ,0000707 ,0000500
Pair 6 menit3 ,590400 2 ,0000000 ,0000000
menit4 ,590350 2 ,0000707 ,0000500
53
Paired Samples Correlations
N Correlation Sig.
Paired Samples Test
Paired Differences Interval of the
Difference
,0001500 ,0000707 ,0000500
-,0007853 ,0004853 -3,000 1 ,205 Pair 5 menit2 -
menit4
-,0001000 ,0001414 ,0001000
-,0013706 ,0011706 -1,000 1 ,500 Pair 6 menit3 -
menit4 ,0000500 ,0000707 ,0000500
-,0005853 ,0006853 1,000 1 ,500
Keterangan:
H0 : rata-rata kedua sampel sama (tidak berbeda)
waktu penggojogan antar menit sama / tidak berbeda secara nyata H1 : rata-rata kedua sampel berbeda
waktu penggojogan antar menit berbeda secara nyata Kesimpulan :
waktu penggojogan menit 1 dengan menit 2 berbeda [H1 diterima karena nilai sig.(2-tailed)nya adalah 0,006<0,05]
waktu penggojogan menit 1 dengan menit 3 berbeda [H1 diterima karena nilai sig.(2-tailed)nya adalah 0,003<0,05]