BAB 2
G A S
Zat dapat berbentuk 3 wujud, yaitu gas, cair, dan padat. Dari ketiga wujud ini, gas paling mudah dipelajari karena sangat sensitif terhadap perubahan suhu dan tekanan. Gas mudah ditekan dan dikembangkan, dan dapat mengisi seluruh ruangan yang ditempati.
Tekanan didefinisikan sebagai gaya yang bekerja tegak lurus pada satuan luas permukaan.
usi terdistrib tersebut
gaya tempat permukaan
luas
permukaan suatu
pada lurus tegak bekerja yang
gaya tekanan
persegi) meter
(dalam permukaan
luas
newton) (dalam
gaya paskal)
(dalam
tekanan
Satuan internasional untuk tekanan adalah paskal: 1 Pa=1 N/m2.
Tekanan juga sering dinyatakan dengan tinggi kolom fluida sebagai berikut.
Tekanan = tinggi
rapat fluida
percepatan grafitasiTekanan (dalam Pa) =
tinggi (dalam m)
rapat (dalam kg/m3
9,80665 m/s2.Tekanan atmosfer.
Udara mempunyai berat sehingga memberikan tekanan. Tekanan atmosferis adalah tekanan yang disebabkan oleh udara di atas permukaan. Satu atmosfer standar ( 1 atm) didefinisikan tekanan yang besarnya tepat sama dengan 101.325 Pa. Nilai ini kira-kira sama dengan tekanan rata-rata pada permukaan air laut. Satu atmosfer standar kira-kira sama dengan tekanan yang disebabkan oleh merkuri setinggi 760 mm, pada suhu 0 oC di
permukaan air laut. Satuan tekanan yang lain misalnya torr didefinisikan 760 torr = 1 atm, sehingga 1 torr dapat dikatakan sama dengan 1 mmHg.
Karena sifat gas yang sensitif terhadap perubahan, maka mudah diamati. Oleh karena itu, sejak lama sudah dapat disusun hukum-hukum gas.
2.1. Hukum-hukum Gas
Berdasarkan penelitian yang berulang-ulang, akhirnya dapat disusun pernyataan mengenai sifat-sifat umum gas yang dikenal dengan hukum-hukum gas. Hukum-hukum gas menyatakan hubungan antara jumlah, volume, tekanan, dan suhu suatu gas.
Berikut ini akan diuraikan beberapa hukum gas yang penting.
Hukum Boyle
Hukum gas yang pertama didapatkan oleh Robert Boyle pada tahun 1661. Hukum ini menjelaskan hubungan volume dan tekanan sejumlah tertentu gas pada suhu tetap. Pernyataan hukum Boyle adalah: Pada suhu tetap, volume sejumlah tertentu gas berbanding terbalik dengan tekanannya dapat pula ditulis sebagai:
untuk sejumlah tertentu gas pada suhu yang tetap, hasil kali tekanan gas dengan volume selalu tetap.
Dengan persamaan matematika hukum Boyle dapat ditulis:
1 P
2 P
2 V
1 V
(2-1)
P1V1 = P2V2 = C (2-2)
Dengan V dan P berturut-turut adalah volume dan tekanan gas, dan C tetapan.
Hukum Boyle hanya berlaku untuk gas ideal. Gas ideal sendiri tidak ada. Namun, gas ini dapat didekati oleh gas inert seperti He atau gas umum yang terdapat di alam seperti CO2 pada
tekanan rendah atau suhu yang tinggi di atas suhu kritisnya.
Hukum Charles & Amonton menjelaskan pengaruh suhu terhadap volume atau tekanan sejumlah tertentu gas. Pernyataan hukum Charles adalah: untuk sejumlah tertentu gas pada tekanan tetap, volume gas berbanding lurus dengan suhu mutlaknya atau dapat pula ditulis: untuk sejumlah tertentu gas pada volume tetap, tekanan gas berbanding lurus dengan suhu mutlaknya.
Dengan persamaan matematik hukum Charles dapat ditulis:
2 T
1 T
2 V
1 V
(2-3)
2 T
1 T
2 P
1 P
(2-4)
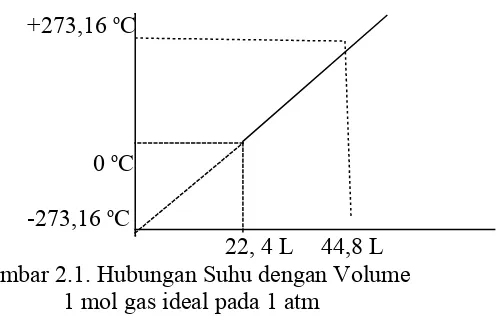
Secara grafis hukum ini dapat ditunjukkan oleh Gambar 2.1.
+273,16 oC
0 oC
-273,16 oC
22, 4 L 44,8 L Gambar 2.1. Hubungan Suhu dengan Volume
1 mol gas ideal pada 1 atm
Apabila suhu sejumlah tertentu gas diturunkan pada tekanan tetap, volume gas akan berkurang sebesar 1/273,16 L setiap derajat. Bila demikian, volume gas menjadi 0. Suhu ini disebut suhu nol mutlak atau 0 K. Suhu ini belum pernah dicapai. Secara praktis gas sudah mencair bahkan memadat jauh di atas suhu itu.
Karena volume gas sangat dipengaruhi oleh suhu dan tekanan, maka untuk membandingkan volume gas-gas suhu dan tekanan harus diambil sama. Suhu dan Tekanan /Standart Temperature and Pressure (STP) untuk gas disepakati 1 atm dan 0
Berdasarkan eksperimen, volume 1 mol gas pada keadaan standar. Volume 1 mol gas ideal pada keadaan standar adalah 22,414 L
Contoh 1.
Suatu cuplikan gas pada 101,3 kPa menempati volume 1,2 L pada suhu 100 oC. Hitunglah volumenya jika suhunya menjadi 0 oC pada
tekanan tetap.
Penyelesaian:
Vi = 1,2L Vf = ?
Ti = 100oC = 100 + 273 = 373K Tf = 0oC = 0 + 273 =273K
1,2/373 = Vf/273 3,22 x 10-3 = Vf/273
Vf = 3,22 x 10-3 x 273 = 0,88L (880mL)
Contoh 2.
Sebuah balon menempati volume 75 L pada suhu 25 oC. Berapa
suhu yang harus dicapai agar volumenya menjadi 100 L pada tekanan yang sama.
Penyelesaian
Vi = 75L Vf = 100L Ti = 25oC = 25 + 273 = 298K Tf = ? (K)
Vi/Ti= Vf/Tf 75/298 = 100/Tf 0.2517 = 100/Tf
Tf = 100/0.2517 = 397K (397-273 = 124oC)
Hukum Avogadro
tekanan sama berisi jumlah molekul yang sama pula. Secara matematis dapat dinyatakan dengan:
V : : n (P,T tetap) dengan n jumlah mol gas.
Hukum Gas Ideal
Berdasarkan hukum Boyle, Charles, dan Avogadro dapat dikombinasikan menjadi:
V : : n.TP
2 2
2 2
1 1
1 1
.T n
.V P .T n
.V P
(2-5)
R n.T P.V
(2-6)
dengan R adalah tetapan.
Persamaan yang lebih umum adalah:
P.V = n.R.T (2-7)
Persamaan (2-7) dinamakan persamaan gas ideal, dan hanya berlaku untuk gas ideal. Untuk gas sejati persamaan itu dapat dipakai jika tekanannya rendah atau suhu tinggi.
Nilai R dapat ditentukan dengan mengukur volume sejumlah tertentu gas pada suhu dan tekanan tertentu.
n.T P.V
R (2-8)
Sudah diketahui bahwa 1 mol gas keadaan standar volumenya 22,414 L. Dengan demikian dapatlah dihitung nilai R:
R = 11molatm273,1622,414KL
R = 0,08205 L. atm/mol K.
Dalam perhitungan-perhitungan sering diambil suhu mutlak 273 K. Persamaan dapat dimodifikasi dengan memasukkan faktor berat sehingga untuk n tetap diperoleh:
P = ρRTM
VM WRT
(2-9) Dengan W adalah berat, M berat molekul, dan rapat gas.
Hukum Graham
Pada suhu dan tekanan yang sama kecepatan difusi dua jenis gas berbanding terbalik dengan akar rapatnya. Persamaan matematika hukum ini dapat ditulis:
1
dengan c adalah kecepatan difusi, dan rapat gas.
Di samping kecepatan dapat pula ditulis dalam bentuk waktu, t, yang diperlukan untuk difusi.
2
dengan t adalah waktu difusi.
Karena rapat gas berbanding lurus dengan berat molekul, maka persamaan juga dapat ditulis:
1 maka tekanan total gas sama dengan jumlah tekanan parsielnya. Tekanan parsiel gas adalah tekanan bila gas itu sendirian ada dalam ruangan.
P = Pa + Pb+Pc + ….. (2-13)
Dengan P adalah tekanan total dan Pa, Pb, Pc, … adalah tekanan
parsiel masing-masing gas penyusun.
Gas di atas Permukaan Cairan
Jika dikumpulkan di atas permukaan cairan volatil, misalnya air, perlu dilakukan koreksi akibat uap air yang ada bersama-sama gas. Gas yang terdapat di atas permukaan air itu jenuh dengan uap air, yang menempati volume ruangan gas itu sehingga ada tekanan parsial. Tekanan parsial uap air bernilai tetap pada suatu suhu dan tidak tergantung pada tekanan. Nilai tekanan uap air sebagai fungsi suhu dapat dilihat pada tabel yang dapat ditemukan dalam hand book misalnya ”Hand Book of Chemistry and Physics”. Jika tekanan total dapat diukur, tekanan gas adalah tekanan total dikurangi dengan tekanan uap.
Tekanan gas = tekanan total – tekanan uap.
Jika gas terkumpul di atas permukan merkuri atau cairan non volatil lainnya pada suhu yang tidak terlalu tinggi, tekanan uap dapat diabaikan.
2.2. Teori Kinetik Gas
Hukum-hukum Gas yang sudah dipelajari merupakan hasil eksperimen, sehingga hukum-hukum itu merupakan persamaan empiris. Sifat-sifat gas juga dapat dijelaskan secara teori, yaitu teori kinetik gas, ternyata sesuai dengan persamaan empiris. Teori Kinetik Gas berdasarkan anggapan atau postulat sebagai berikut.
1. Gas terdiri atas partikel-partikel diskrit yang disebut molekul dan selalu bergerak cepat, random, dan gerakannya melalui jalan yang lurus;
4. Gaya tarik menarik antara molekul-molekul yang satu dengan yang lain dianggap tidak ada;
5. Tekanan gas adalah hasil tumbukan molekul terhadap dinding bejana.
Persamaan Gas Turunan Dari Teori Kinetik
Berdasarkan anggapan-anggapan di atas dapat dijabarkan persamaan yang menyatakan hubungan P, V, T, dan n gas.
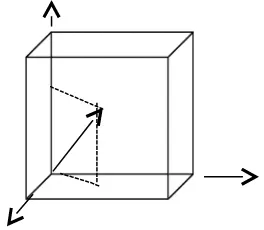
Bila ada n’ molekul gas yang masing-masing bermassa m terdapat di dalam kubus dengan rusuk l pada suhu tertentu, kecepatan molekul-molekul gas sangat bervariasi, mempunyai kecepatan rata C, maka C ini dinamakan kecepatan akar rata-rata kuadrat.
Gambar 2.2. Gerakan molekul gas dalam kubus
Jika diambil 1 molekul yang mempunyai kecepatan C, maka gerakan molekul ini dapat diurai menjadi 3 komponen yang saling tegak lurus, sesuai dengan koordinat kartesian. Kecepatan pada masing-masing koordinat atau arah x, y, dan z, mempunyai hubungan dengan C sebagai berikut.
C2 = C
x2 + Cy2 + Cz2 (2-16)
Dengan Cx, Cy, dan Cz adalah kecepatan pada masing-masing arah.
Untuk molekul yang bergerak sepanjang sumbu X, akan menumbuk dinding kanan (Cx/2 l) kali tiap detik, karena tiap detik
berjalan sepanjang Cx, dan untuk menumbuk sekali harus berjalan
sejauh 2 l.
Momen sebelum tumbukan adalah mCx dan sesudah
Dengan demikian kecepatan perubahan momen, yaitu perubahan momen kali jumlah tumbukan tiap detik adalah:
2mCx x (Cx/2 l) = mCx2/l (2-17)
pada dinding kiri juga mengalami kecepatan perubahan momen yang sama hanya berlawanan arah, sehingga kecepatan perubahan momen ke arah sumbu X adalah 2 mCx2/l.
Dengan cara yang sama diperoleh kecepatan perubahan momen ke arah sumbu Y dan Z masing-masing sebesar 2 mCy2/l
dan 2 mCz2/l.
Kecepatan perubahan momen merupakan gaya yang bekerja pada dinding-dinding kubus. Dengan demikian dapat ditulis persamaan:
Gaya = 2 mCx2/l + 2 mCy2/l + 2 mCz2/l
Gaya = 2 mC2/l (I-18)
Tekanan adalah gaya per luas. Dalam hal ini luas adalah luas ke 6 dinding kubus, sehingga:
Tekanan = (2 mC2/l)/ (6 l2)
P = 1/3 m C2 / l3
P = 1/3 m C2 / V (2-19)
Untuk semua molekul didapat :
P = 1/3 m n’ C2 / V (2-20)
PV = 1/3 m n’ C2 (2-21)
Persamaan ini identik dengan yang diperoleh secara empiris yaitu PV = nRT.
Hukum gas berdasarkan teori kinetik itu dapat dibandingkan dengan hukum gas yang diperoleh secara percobaan sebagai berikut.
Hukum Boyle
PV = 1/3 m n’ C2 (2-22)
Pada suhu tetap, C tetap pula, sehingga: PV = K (tetap)
Hukum Charles
Kecepatan gas berbanding lurus dengan T
PV = 1/3 m n’ C2; C2 : : T; PV : : T; V : : T (P tetap)
Hukum Graham
C = 3PVmn' = ρn'3P (2-23)
pada P tetap C : : 1ρ
Kecepatan molekul
Besarnya kecepatan akar rata-rata kuadrat dapat dicari dari persamaan-persamaan di atas.
PV = 1/3 m n’ C2 persamaan (I-24) menjadi:
C = 3RTmL 3RTM (2-25) dengan M adalah berat molekul gas.
Kuantitas mC2 /2 adalah energi kinetik rata-rata sebuah molekul
tunggal. Suhu merupakan parameter yang menentukan besarnya energi kinetik suatu gas. Jika dimasukkan tetapan Boltzman yaitu R/L = 1,381 10-23 J/K, maka kecepatan akar rata-rata kuadrat
molekul, urms, dapat ditulis dengan :
2
Kecepatan difusi berbanding lurus dengan kecepatan gas. Dengan demikian, jika ada dua gas dengan berat molekul M1 dan
M2 :
Pada P dan T sama, volume molekular gas besarnya sama (Vm), sehingga berlaku:
2.3. Penyimpangan dari Gas Ideal
Persamaan gas PV = nRT hanya berlaku untuk gas ideal. Untuk gas sejati hanya berlaku jika tekanannya rendah atau suhunya tinggi.
Untuk 1 mol gas ideal:
PV = RT PV/RT = 1
Untuk 1 mol gas sejati:
PV = Z RT PV/RT =Z (2-28)
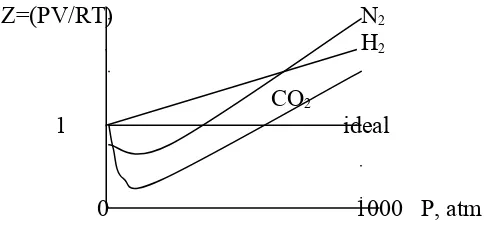
Z dinamakan faktor kompresibilitas. Bila digambarkan grafik hubungan Z dengan P, maka untuk gas ideal diperoleh garis lurus, sedangkan untuk gas sejati tergantung pada jenis gas.
Z=(PV/RT) N2
H2
CO2
1 ideal
0 1000 P, atm
Gambar 2.3. Faktor kompresibilitas beberapa gas pada 0 oC
Untuk gas CO2 di bawah tekanan 600 atm, grafik CO2 selalu
di bawah gas ideal. Hal seperti ini dikatakan bahwa CO2 lebih
kompresibel dari pada gas ideal. Grafik H2 selalu berada di atas
grafik gas ideal, ini berarti gas H2 kurang kompresibel
dibandingkan gas ideal.
Berdasarkan percobaan diketahui bahwa jika suhu gas diturunkan, maka gas semakin kompresibel bila dibandingkan gas ideal. Gambar I-4. adalah pengaruh suhu gas terhadap faktor kompresibilitas.
-50oC 0oC
300oC
ideal
0 1000 P, atm
Gambar 2.4. Pengaruh suhu terhadap faktor kompresibilitas gas N2
Persamaan van der Waals
Adanya penyimpangan terhadap Hukum Gas ideal menimbulkan ide untuk memodifikasi hukum itu agar bisa berlaku lebih luas. Salah satu koreksi terhadap persamaan gas ideal diajukan oleh van der Waals.
Dalam persamaan van der Waals diadakan koreksi terhadap tekanan dan volume yang ada dalam persamaan gas ideal PV = nRT. Faktor koreksi terhadap tekanan dari penjabaran persamaan gas ideal, dianggap tidak ada tarik menarik antara molekul-molekul. Dengan demikian tekanan lebih kecil dari yang seharusnya. Oleh van der Waals tekanan dikoreksi sebesar an2/V2
dengan a adalah tetapan yang tergantung pada jenis gas.
Koreksi terhadap volume diperlukan karena pada persamaan gas ideal, masing-masing molekul dianggap sebagai titik bermassa, mempunyai massa tetapi tidak mempunyai volume. Volume V, dalam PV=nRT adalah volume ruangan yang tidak ditempati molekul. Sesungguhnya masing-masing molekul mempunyai volume, maka V harus lebih kecil. Bila b adalah volume efektif tiap mol, maka faktor koreksi besarnya nb dengan b adalah tetapan yang juga tergantung pada jenis gas.
Dengan koreksi tekanan dan volume itu persamaan gas ideal oleh van der Waals diubah menjadi:
nRT nb)
)(V V
a n (P 2
2
(2-29)
RT
Persamaan van der Waals juga dapat ditulis dalam bentuk sebagai berikut:
satuan b adalah volume mol-1, misalnya L/mol.
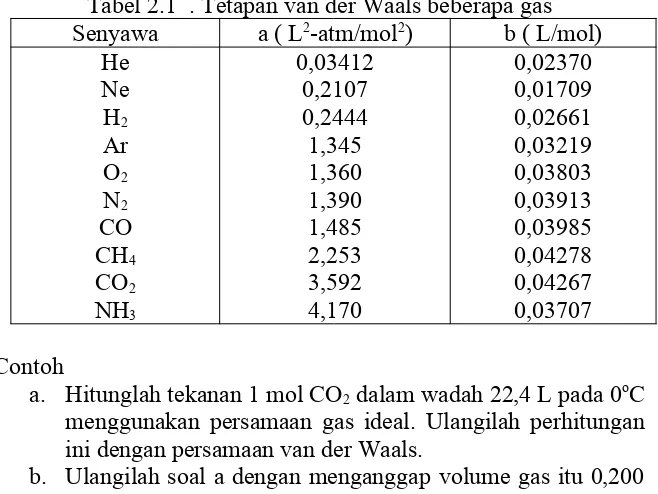
Tabel 2.1 berikut ini menunjukkan tetapan van der Waals beberapa gas.
Tabel 2.1 . Tetapan van der Waals beberapa gas Senyawa a ( L2-atm/mol2) b ( L/mol)
menggunakan persamaan gas ideal. Ulangilah perhitungan ini dengan persamaan van der Waals.
b. Ulangilah soal a dengan menganggap volume gas itu 0,200 L.
c. Ulangi sekali lagi dengan menganggap volume gas itu 0,0500 L
Persamaan vdW: 2
V a b) (V
RT
P
Untuk gas CO2: a =3,592 ( L2-atm/mol2); b = 0,04267 L/mol
a. dengan gas ideal P= 1,00 atm, dengan persamaan van der Waals P=0,995 atm.
b. dengan gas ideal P= 112 atm, dengan persamaan van der Waals P=52,6 atm.
c. dengan gas ideal P= 448 atm, dengan persamaan van der Waals P=1620 atm.
Ulangi soal di atas jika gasnya adalah NH3 dengan a= 4,170 ( L2
-atm/mol2dan b= 0,03707 L/mol.
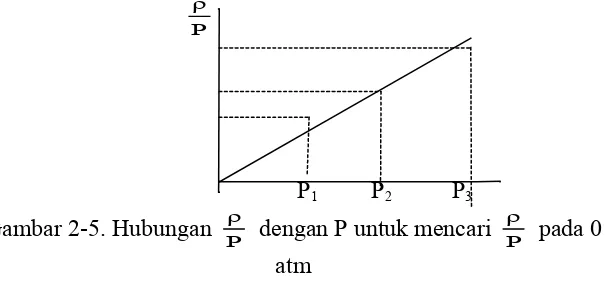
Menentukan Berat Molekul gas secara limiting density
Cara limiting density dapat menentukan berat molekul gas secara teliti. Dasar yang digunakan adalah pada tekanan nol semua gas mengikuti gas ideal, sehingga pada tekanan nol berlaku:
.RT P ρ P RT . V W
M (2-33)
Prosedur yang dilakukan adalah mengukur rapat gas pada beberapa tekanan, lalu dibuat grafik hubungan Pρ dengan P. Dengan cara
ekstrapolasi, diperoleh Pρ pada tekanan 0. Berat molekul gas dapat dihitung menggunakan persamaan (2-32).
P ρ
P1 P2 P3
Gambar 2-5. Hubungan Pρ dengan P untuk mencari Pρ pada 0 atm
Tekanan
1. Hitunglah beda tekanan antara pada permukaan atas dan pada dasar bejana yang dalamnya 76 cm pada 25 oC jika terisi
penuh dengan:
a. air yang rapatnya 0,997 g/mL b. air raksa yang rapatnya 13,53 g/mL. Percepatan grafitasi (g) = 9,81 m/s2.
Penyelesaian:
a. tekanan = tinggi
rapat
percepatan grafitasi = 0,76 m
997 kg/m3
9,81 m/s2= 7,43
103 Pa atau 7,43 kPa.b. tekanan = tinggi
rapat
percepatan grafitasi = 0,76 m
13.530 kg/m3
9,81 m/s2= 1.009
105 Pa atau 100,9 kPa.2. Berapakah tinggi udara diperlukan agar barometer menunjukkan 76 cmHg, jika atmosfer memilki rapat yang seragam 1,2 kg/m3? Rapat merkuri= 13,6
103 kg/m3.Penyelesaian:
Tekanan merkuri = tekanan udara
tinggi Hg x rapat Hg
g = tinggi udara
rapat udara
g 0,76 m
13.600 kg/m3 = h
1,2 kg/m3km m
m kg
m kg m
h 8.600.000 8,6
/ 2 , 1
) / 600 . 13 )( 76 , 0 (
3 3
Hukum Gas
3. Satu mol gas ideal menempati volume 12 L pada 25 oC.
Berapakah tekanannya dalam Paskal.
Penyelesaian:
T = 273,15 + 25 = 298,15 K
4. Sejumlah tertentu gas nitrogen menempati volume 20 L pada suhu 5 oC dan tekanan 760 torr. Tentukan volumenya pada suhu 30 oC dan tekanan 800 tor.
Penyelesaian:
5. Volume sejumlah gas argon tertentu pada 18 oC dan 1500 torr adalah 5 ft3. Hitunglah tekanannya pada suhu dan tekanan standar.
Penyelesaian
Suhu dan tekanan standar berarti 0 oC dan 760 torr. Oleh
Rapat Gas
6. Rapat gas helium pada suhu dan tekanan standar adalah 0,1784 kg/m3. Jika sejumlah tertentu gas helium dibiarkan berekspansi menjadi 1500 kali keadaan mula-mula dengan cara mengubah suhu dan tekanannya, hitunglah rapat akhir gas itu.
1,43 . Tentukan rapatnya pada suhu 27 oC dan tekanan
700 torr.
8. Sebuah labu volume 2 L berisi oksigen dengan tekanan 2 atm dan 3 L labu berisi nitrogen dengan tekanan 1 atm. Kedua labu itu kemudian dihubungkan sehingga kedua gas mengisi ke seluruh labu sampai terjadi kesetimbangan. Jika tidak ada perubahan suhu, hitunglah tekanan parsial masing-masing gas dan tekanan total pada keadaan akhir.
Volume akhir = 5 L, maka:
Tekanan parsial oksigen:
atm 0,8 L
5 L 2 atm) (2
pO2(f)
atm 0,6 L
5 L 3 atm) (1 p
2(f)
N
9. Suatu cuplikan PCl5 yang beratnya 2,69 g ditempatkan dalam
1 L labu. Setelah dipanaskan pada suhu 250 oC semua
cuplikan itu menguap. Pada kondisi itu tekanannya terbaca 1 atm. Ada kemungkinan bahwa PCl5 mengalami disosiasi
menurut persamaan:
PCl5 (g) PCl3 + Cl2
Berapakah tekanan parsial PCl5, PCl3, dan Cl2 pada kondisi
itu.
Penyelesaian:
Untuk mengetahui apakah PCl5 (g) mengalami disosiasi
atau tidak, pertama-tama dihitung dulu tekanannya jika PCl5
tidak terdisosiasi. Ini bisa dilakukan dari jumlah mol PCl5
yang digunakan, Volume dan suhu labu. Karena berat molekul PCl5 adalah 208, maka jumlah mol PCl5 adalah
sebagai berikut.
n = 2,69 g /208 g/mol = 0,0129 mol
Tekanan dapat dihitung dengan persamaan gas ideal:
1
) 523 )( 082 , 0 )( 0129 , 0 (
V nRT
P = 0,553 atm.
Karena tekanan yang teramati lebih dari 0,553 atm yakni 1 atm, maka PCl5 telah mengalami disosiasi.
Dengan hukum tekanan parsial gas dapat ditulis:
atm P
P P
PPCl5 PCl3 Cl2 t 1
Dari persamaan stoikiometri yaitu setiap mol PCl5
terdisosiasi akan menghasilkan satu mol PCl3, dan satu mol
3 dalam kasus ini dapat ditulis:
00
Ulangi contoh soal nomor 9 tetapi tekanan yang terbaca = 0,9 atm.
10. Tepat 100 mL oksigen dapat dikumpulkan di atas permukaan air pada suhu 23 oC dan tekanan 800 tor. Hitunglah volume
oksigen kering, jika tekanan uap air pada suhu itu adalah 21 torr.
Penyelesaian
Gas yang dikumpulkan itu merupakan campuran oksigen dan uap air. Karena tekanan uap air pada suhu itu adalah 21 torr maka:
Tekanan oksigen kering = tekanan total – tekanan uap air = 800 torr – 21 torr = 779 torr.
Dengan demikian oksigen keringnya adalah:
V1 = 100 mL, T1 = 23 + 273 = 296 K, p1 = 779 torr, jika
diubah ke suhu dan tekanan standar adalah:
Berat molekul gas
11. Tentukan perkiraan berat molekul suatu gas jika pada keadaan suhu dan tekanan standar menempati volume 560 mL dan beratnya 1,55 g.
Penyelesaian:
RT M
m
PV
62g/mol 60L)
(1atm)(0,5
)(273K) K
ol 082L.atm.m (1,55g)(0,
PV mRT M
1 1
Cara lain:
Berat molekul = berat 1 L pada keadaan suhu dan tekanan standar Volume dalam L pada keadaan suhu dan tekanan
standar per mol
l
62,0g/mo 22,4L/mol
0,560L 1,55g
Reaksi gas
12. Hitunglah volume O2 pada keadaan suhu dan tekanan standar
diperlukan untuk membakar sempurna satu mol CS2!. Hitung
juga volume CO2 dan SO2 dihasilkan jika diukur pada
keadaan standar.
Penyelesaian:
Persamaan reaksi yang terjadi:
CS2 (l)+ 3O2 (g) CO2 (g) + 2 SO2 (g)
1 mol 3 mol 1 mol 2 mol
Dari persamaan reaksi dapat diketahui bahwa 1 mol CS2 (l)
(g) dan 2 mol SO2 (g). Karena 1 mol gas pada keadaan
standar menempati volume 22,4 L maka:
Volume 3 mol O2 pada keadaan standar = 3 mol 22,4 L/mol
= 67,2 L
Volume 1 mol CO2 pada keadaan standar = 1 22,4 = 22,4 L
Volume 2 mol SO2 pada keadaan standar = 2 22,4 = 44,8 L
13. Berapa liter oksigen pada keadaan standar dapat diperoleh dari 100 g kalium klorat M = 122,6 ?.
Persamaan reaksi:
2KClO3 (s) 2KCl + 3O2 (g)
2 mol 3 mol
Dari persamaan reaksi dapat diketahui bahwa 2 mol KClO3
dapat menghasilkan 3 mol O2. Berat molekul, M, KClO3 =
122,6 g/mol, maka:
n (KClO3) = 100 g/122,6 g/mol = 0,816 mol KClO3
n (O2) = (3/2) n(KClO3) = (3/2)(0,816) = 1,224 mol O2
Volume 1,224 mol O2 pada keadaan standar = (1,224 mol O2)
(22,4 L/mol) = 27,4 L O2.
Teori Kinetik
14. (a) Tunjukkan bahwa nilai tetapan gas umum, R, dalam L.atm.K-1.mol-1. dapat diturunkan dari nilai dalam satuan
internasional. (b)Nyatakan R dalam kalori.
Penyelesaian:
a. Nilai R dalam satuan internasional = 8,314 J.K-1.mol-1.
R=(8,314J.K-1.mol-1)
3 3
3 3 2
5 dm
1L 1m
dm 10 N.m
10 1,013
= 0,0821 L.atm. K-1.mol-1.
15. Hitunglah kecepatan akar rata-rata kuadrat (urms), H2 pada 0 oC.
rms (2,016sma)(1,66 10 kg/sma)
/J
16. Hitunglah kecepatan relatif efusi H2 dengan CO2.
Penyelesaian:
1. Bagaimana isi hukum: Boyle, Charles, Avogadro, Dalton, dan Graham. Nyatakan dengan kalimat dan persamaan.
3. Cuplikan gas O2 yang volumenya 425 mL tekanannya 742,3
mmHg. Hitunglah tekanan gas itu bila berekspansi pada suhu tetap sehingga volumenya menjadi 975 mL !.
4. Suatu gas mempunyai volume 600 mL pada suhu 70 oC dan
tekanan 500 mmHg. Hitunglah volumenya pada keadaan standar, dan jika gas itu oksigen, hitunglah beratnya serta jumlah molekul yang ada dalam sistem itu.
5. Hitunglah volume 4 g H2 pada tekanan 250 mmHg pada
suhu 27 oC. Berapakah volumenya jika suhu dinaikkan
menjadi 50 oC pada tekanan yang sama.
6. Suatu bejana berisi campuran gas oksigen dan hidrogen tekanan totalnya 1,5 atm dengan suhu 25 oC. Bila oksigen
diambil, tekanannya turun menjadi 0,5 atm berat bejana dan isinya turun 16 g. Hitunglah volume bejana, berat hidrogen yang ada serta fraksi mol gas yang ada mula-mula.
8. Hitunglah kecepatan akar rata-rata kuadrat gas hidrogen pada suhu 0oC dan ulangilah perhitungan yang sama untuk
suhu 27 oC.
9. Hitunglah tekanan 1 mol gas He pada 25 oC bila volumenya
2 L dengan persamaan gas ideal dan dengan persamaan van der Waals.
10. Kecepatan akar rata-rata kuadrat suatu gas adalah 5,16 x 104
cm/detik pada 27 oC. Hitunglah berat molekul, volume 10 g
itu pada 0,5 atm, dan jumlah molekul 10 mL gas itu pada keadaan standar.
11. Hitunglah kecepatan akar rata-rata kuadrat gas He pada suhu 27 oC !. Hitunglah kecepatan gas NO
2 pada suhu yang