LAPORAN PRAKTIKUM KIMIA ANALISIS III
PENGGUNAAN METODE POTENSIOMETRI UNTUK MENGUKUR KADAR N (NITRAT DAN AMONIA) PADA TANAH UNIVERSITAS
JEMBER DENGAN EKSTRAKTAN
oleh :
Wiwit Puji Lestari 121810301052 Lubabah Putri Dhuha 121810301061 Winda Intan Novalia 121810301062 Octavianti Nuryani 121810301067
Yulia Agustin 121810301073
LABORATORIUM KIMIA ANALITIK JURUSAN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS JEMBER
2015
1.1 Latar Belakang
Tanah merupakan hasil evolusi dan mempunyai susunan teratur yang unik yang terdiri dari lapisan-lapisan atau horizon-horizon yang berkembang secara genetik (Henry, 1998). Medium tanah dimanapun keberadaannya sering digunakan sebagai medium pertumbuhan tanaman. Tanah dipilih sebagai medium karena merupakan penyedia hara, air dan lingkungan bagi akar dan batang tanaman dalam melakukan aktifitas fisiologinya. Tanah sebagai medium pertumbuhan haruslah memiliki kesuburan yang tinggi. Kesuburan tanah ialah kemampuan yang memungkinkan tanah untuk menyediakan unsur hara yang memadai, baik dalam jumlah maupun keseimbangannya bagi pertumbuhan tanaman dan produksi.
Unsur hara merupakan zat-zat penting yang tersedia di alam yang dapat mempengaruhi pertumbuhan tanaman. Unsur-unsur yang pada umumnya dibutuhkan tanaman dibagi dalam dua kelompok, berdasarkan pada jumlah yang dibutuhkan tanaman. Unsur hara makro diperlukan relatif dalam jumlah besar, biasanya diatas 500 ppm dalam tanaman. Unsur hara mikro diperlukan hanya dalam jumlah sangat kecil, biasanya kurang dari 50 ppm dalam tanaman (Henry, 1998). Unsur hara utama yang banyak dibutuhkan tanaman adalah unsur nitrogen (nitrat: NO3- dan ammonium: NH4+), Phosporus (phosphate : PO43-,
hydrophosphate : HPO42-, dihydrophosphate : H2PO4-) dan Potasium (potash : K+) adalah elemen yang paling penting (Lin J, et al., 2 2008). Tidak terpenuhinya salah satu maka akan menurunkan kualitas dan kuantitas hasil produksi tanaman.
Pada percobaan ini akan dilakukan analisis potensiometri untuk mengukur kadar K, NO3-, dan NH4+ dalam tanah menggunakan ISE. ESI (elektroda selektif ion) dengan metode potensiometri umumnya digunakan untuk uji liquid, namun berdasarkan selektifitas, sensitifitas keakuratan, dan ketepatan yang relatif tinggi. Keefektifan ESI dikarenakan gangguan terhadap kerja ESI umumnya hanya sedikit dan mudah diatasi. Contoh larutan keruh (berwarna sampat batas tertentu) tidak menyulitkan pengukuran dan prosedur analisisnya sederhana, sehingga pengukuran hanya memerlukan waktu singkat, alat-alat sederhana dan mudah dilakukan. Detektor potensiometri juga selektif dan sensitif terutama untuk penentuan senyawa-senyawa organik. ESI dapat digunakan untuk pengukuran analisis ini dengan cara FIA(Agustiani W, 2007). Oleh karena itu penentuan unsur nitrogen dan Kalium pada tanah didaerah kampus antara lain tanah dekat sumur FMIPA, tanah FP, dan tanah FISIP akan dilakukan menggunakan ESI dengan metode FIA potensiometri.
1.2 Rumusan Masalah
Rumusan masalah yang diambil untuk percobaan ini adalah sebagai berikut:
1.2.1 Bagaimana variasi kandungan NO3-, dan NH4+ dalam masing-masing sampel?
1.2.2 Mengapa kandungan unsur NO3-, dan NH4+ yang didapat demikian?
1.3 Batasan Masalah
Adapun batasan masalah dalam percobaan ini adalah:
1.3.1 Sampel tanah yang digunakan diambil dari tanah Agroteknopark Universitas Jember.
1.3.2 Pengambilan sampel tanah tidak memperhatikan musim.
1.3 Tujuan
Tujuan dari percobaan ini adalah sebagai berikut:
1.3.1 Mahasisawa dapat menerapkan metode potensiometri pada FIA dalam menetukan kadar N (nitrat dan amonia) dalam sampel tanah.
BAB 2. TINJAUAN PUSTAKA
2.1 Tanah
Tanah merupakan lapisan kerak bumi yang melapuk yang terdiri dari bahan mineral dan bahan organik yang terletak di permukaan sampai kedalaman tertentu yang dipengaruhi oleh faktor-faktor genetis lingkungan (Winarso, 2005). Komponen tanah terdiri dari 4 macam yaitu mineral (45%), organik (5%), air (20-30%), udara (20-30%). Mineral tanah berasal dari hasil pelapukan bahan induk tanah (berupa batuan baik yang terkonsolidasi maupun tidak terkonsolidasi setelah mengalami proses pelapukan) (Sutanto, 2005).
Kerangka penyusun tanah tidak hanya mineral saja (tubuh tanah mineral), ada juga bahan organik tanah yang didefinisikan sebagai sisa-sisa tanaman dan hewan di dalam tanah pada berbagai pelapukan baik masih hidup maupun mati (Winarso, 2005). Bahan organik juga mempunyai kontribusi (tubuh tanah organik) terhadap tanah sebagai tubuh alam yaitu sumber N tanah dan unsur hara lainnya, terutama S dan P; berperan penting dalam pembentukan struktur tanah; mempengaruhi keadaan air, udara dan tempertur tanah; serta mempengaruhi tingkat kesuburan tanah (Sutanto, 2005). Bahan organik terdiri dari:75% air dan 25% padatan yang terdiri dari unsur C, H, O, N, S, P, Ca, K, Mg dll (Wijaya, 2011).
Unsur hara pertama-tama dibebaskan ke dalam larutan tanah (air tanah) sebelum dipindahkan ke dalam sistem perakaran tanaman (Rao, 1994). Fungsi tanah dalam bidang pertanian adalah sebagai tempat tumbuh, penyedia hara, air dan lingkungan bagi akar dan batang tanaman dalam melakukan aktifitas fisiologinya. Pertumbuhan tanaman yang baik memerlukan kualitas tanah tertentu, berupa kesuburan tanah baik berupa fisik, kimia maupun biologis (Ajud, 2002).
Unsur hara utama yang banyak dibutuhkan tanaman adalah unsur Nitrogen (nitrat: NO3- dan amonium: NH4+), Phosporus (phosphate : PO43-, hydrophosphate : HPO42-, dihydrophosphate : H2PO4-) dan Potasium (potash : K+) adalah elemen yang paling penting (Lin J, et al., 2008). Tidak terpenuhinya salah satu maka akan menurunkan kualitas dan kuantitas hasil produksi tanaman.
2.2 Unsur Nitrogen dalam Tanah
Nitrogen merupakan unsur hara utama bagi pertumbuhan tanaman, yang pada umumnya sangat diperlukan untuk pembentukan atau pertumbuhan bagian-bagian vegetatif tanaman, seperti daun, batang dan akar (Sutedjo, 2002). Unsur N banyak tersedia atau berlimpah di dalam udara dalam bentuk N2 , tetapi bentuk tersebut tidak bisa diserap atau dimanfaatkan oleh tanaman dan agar bisa dimanfaatkan tanaman maka unsur N yang ada di udara tersebut terlebih dahulu harus berfiksasi dengan unsur hidrogen ataupun oksigen dan air.
Nitrogen diserap perakaran tanaman dalam bentuk ion nitrat dan ammonium (Tisdale et al., 1975). Nitrogen memegang peranan penting sebagai penyusun klorofil, yang menjadikan daun berwarna hijau. Peran utama nitrogen dalam tanaman adalah merangsang pertumbuhan batang, cabang, dan daun (Lingga, 2001). Fungsi nitrogen yang lain adalah dorongan pertumbuhan vegetatif. Pertumbuhan itu tidak dapat berlangsung kecuali ada unsur hara fosfor, kalium, dan unsur-unsur hara lainnya yang tersedia secara cukup (Foth, 1994).
2.3 Transformasi N dalam tanah
Menurut Havlin et al. (1999), proses mineralisasi melibatkan dua reaksi yaitu reaksi aminisasi dan amonifikasi yang terjadi melalui aktivitas mikroorganisme heterotrofik. Aminisasi merupakan proses perubahan protein dan senyawa serupa yang merupakan sebagian besar nitrogen dari tanah menjadi senyawa amino. Prosesnya dapat digambarkan sebagai berikut (Soepardi, 1983):
Protein → R–NH2 + CO2 + Energi
Mineralisasi disebut juga dengan amonifikasi, karena hasil akhirnya adalah ammonia, sebagian besar amonia cepat menghasilkan bentuk NH4+. Kecenderungan NH4+ terbentuk karena kehadiran ion-ion hidrogen dalam tanah, dan ikatan yang kuat terbentuk antara amonia dan hidrogen dari penyatuan elektron. Amino dan asam amino yang dihasilkan melalui proses aminisasi didekomposisi oleh bakteri heterotrof dan membebaskan NH4+. Proses ini disebut dengan amonifikasi nitrogen. Prosesnya dapat digambarkan sebagai berikut (Foth, 1998):
R–NH2 + H2O→NH3 + R - OH + Energi NH3 + H+ → NH4+
Amonium yang terbentuk pada proses ini akan diubah menjadi N-NO3 -melalui nitrifikasi kemudian diserap oleh tanaman dan digunakan langsung oleh mikroorganisme heterotrof dalam dekomposisi C-organik untuk proses selanjutnya yaitu fiksasi dalam kisi-kisi mineral liat dan diubah menjadi N2 dan dilepaskan perlahan kembali ke atmosfer (Havlin et al., 1999).
2.4 Nitrifikasi
Nitrifikasi adalah suatu proses oksidasi N-NH4+ menjadi N-NO3-. Nitrifikasi merupakan proses dua tahap dengan N-NO2- sebagai hasil antara. Proses pertama dalam nitrifikasi, yaitu perubahan N-NH4+ menjadi N-NO2- dan selanjutnya diubah menjadi N-NO3-. Oksidasi secara biologis N-NH4+ menjadi N-NO2- dapat digambarkan sebagai berikut (Foth, 1998):
2NH4+ + 3 O2 → 2 NO2- + 2H2O +4 H+
nitrospira dan nitrosovibrio) dan beberapa bakteri heterotrofik juga dapat mengoksidasi N-NH4+ menjadi N-NO2-. Pada reaksi yang kedua N-NO2 -dioksidasi menjadi N-NO3- melalui reaksi:
2 NO2 - + O2 → 2 NO3
-Oksidasi N-NO2- dilakukan oleh bakteri autotrofik yang dikenal dengan nama
Nitrobacter. Intensitas proses ini terutama bergantung pada jumlah N-NH4+ yang tersedia untuk bakteri penitrifikasi (Sanchez et al., 2001).
Menurut Havlin et al. (1999), faktorfaktor yang mempengaruhi nitrifikasi dalam tanah adalah jumlah amonium dalam tanah, populasi bakteri, reaksi tanah, aerasi tanah, kelembaban tanah, dan suhu.
Bentuk nitrogen yang tersedia bagi tanaman dan mikroorganisme, yaitu N-NH4+ dan N-NO3-. Penggunaannya berakibat dalam perubahan bentuk mineral nitrogen ke dalam bentuk organik dan prosesnya disebut imobilisasi nitrogen. Imobilisasi nitrogen tidak berbahaya dalam tanah. Hal ini merupakan subyek untuk mengulangi siklus nitrogen dalam tanah yang meliputi mineralisasi, nitrifikasi dan imobilisasi (Foth 1998).
Pencucian nitrat (leaching) merupakan salah satu proses hilangnya nitrat di dalam tanah. Kehilangan nitrat merupakan kejadian fisika disebabkan oleh perkolasi air melalui tanah. Nitrat mudah larut dan bergerak dengan tanah yang airnya berlebih di bawah zona akar. Standar yang ditetapkan untuk jumlah nitrat yang diperbolehkan dalam air minum adalah 50 mg/l (Foth 1998).
2.5 Metode Penetapan Senyawa Nitrogen
Penetapan nitrogen total dalam tanah dapat ditentukan dengan metode Kjeldahl yang didasarkan ketetapan bahwa senyawa nitrogen organik dan anorganik dapat dioksidasi dalam lingkungan asam sulfat membentuk amonium sulfat. Amonium sulfat yang terbentuk disuling dengan penambahan NaOH yang akan membebaskan NH3. NH3 yang tersuling akan diikat oleh asam borat dan dapat dititrasi dengan H2SO4 dengan menggunakan indikator conway (Widjik & Hardjono 1996). Reaksi yang terjadi sebagai berikut:
( NH 4)2SO4+2NaOH→2NH3+Na2SO4+2H2O NH3 + H3BO3 → NH4H2BO3
2 NH 4H2BO3+H2SO4→(NH4)2SO4 +2H3BO3
Nitrogen yang tersedia dalam tanah dapat ditetapkan dengan metode KCl. Dasar metode ektraksi dengan KCl pada penetapan senyawa nitrogen (NH4+ dan NO3-) dalam tanah dapat dibebaskan oleh KCl 1N menjadi amonium klorida dan kalium nitrat (Bertrand, 2006). Metode ekstraksi CaCl2 yang digunakan pada penentuan nitrat telah memberikan hasil yang tidak berbeda nyata dengan metode ekstraksi KCl (Umariah 2007). Nitrat dapat juga diekstrak dengan menggunakan CaCl 2 (Suhardi, 2005).
Sementara N-organik tidak terekstrak. NH 3+ dan NO 3- yang dibebaskan dari dalam tanah dapat diukur dengan spektrofotometer (Widjik & Hardjono, 1996). Panjang gelombang yang digunakan pada penentuan konsentrasi amonium tanah adalah 636 nm, sedangkan pada penentuan nitrat digunakan panjang gelombang 210 nm dan 275 nm. Panjang gelombang tersebut digunakan karena memberikan nilai serapan yang maksimum. Panjang gelombang 275 nm digunakan sebagai pengoreksi dari serapan bahan organic (Norman et al., 1985).
2.6 Ion Nitrat
Nitrat adalah bentuk utama nitrogen di perairan alami dan merupakan nutrien utama bagi pertumbuhan tanaman dan alga. Nitrogen sangat mudah larut dalam air dan bersifat stabil. Senyawa ini dihasilkan dari proses oksidasi sempurna senyawa nitrogen di perairan. Nitrifikasi yang merupakan proses oksidasi amonia menjadi nitrit dan nitrat adalah proses yang penting dalam siklus nitrogen dan berlangsung pada kondisi anaerob. Oksidasi amonia menjadi nitrit oleh bakteri Nitrosomonas, sedangkan oksidasi nitrit menjadi nitrat oleh bakteri Nitrobacter. Kedua jenis bakteri tersebut merupakan bakteri kemoterafik, yaitu bakteri yang mendapatkan energi dari proses kimiawi. Nitrat dan amonium adalah sumber utama nitrogen di perairan. Kadar nitrat–nitrogen
dari aktivitas manusia dan tinja hewan. Kadar nitrat- nitrogen yang lebih dari 0,2 mg/L dapat menyebabkan terjadinya eutrofikasi (pengayaan perairan), yang selanjutnya menstimulir pertumbuhan alga dan tumbuhan air secara pesat. Kadar nitrat dalam air tanah dapat mencapai 100 mg/L. Air hujan memiliki kadar nitrat sekitar 0,2 mg/L. Kadar nitrat untuk keperluan air minum sebaiknya tidak melebihi 10 mg/L. (Effendy, 2003).
2.7 Amonium
Amonium adalah suatu ion hasil hidrolisis amonia, dimana amonia merupakan hasil hidrolisis dari urea yang ada dalam urin. Amonium adalah ion NH4+ yang bersifat tidak berwarna, berbau menyengat dan berbahaya bagi kesehatan. Garam - garam amonium umumnya adalah senyawa-senyawa yang mudah larut dalam air, melalui pemanasan, semua garam amonium terurai menjadi amonia dan asam yang sesuai, kecuali jika asamnya tak mudah menguap. Gas amonia akan dilepaskan ketika campuran senyawa dipanaskan (Svehla, 1985).
NH4+ + OH- → NH3 ↑+ H2O
Amonium bersifat basa sebagai “substansi bergabung dengan ion hidrogen (protons)”. Amonium dalam larutan berada dalam kesetimbangan seperti berikut :
NH3 + H2O ↔ NH4+ + OH-
tinggi. Sedangkan pada pH yang rendah sebagian besar dari amonia akan terionisasi menjadi ion amonium (NH4+) (Brigden dan Stringer, 2000).
Amonium bereaksi sebagai basa karena adanya pasangan bebas yang aktif dari nitrogen. Nitrogen lebih elektronegatif dari hidrogen sehingga menarik ikatan elekton pada molekul amonia kearahnya. Atau dengan kata lain dengan adanya pasangan bebas terjadi muatan negatif sekitar atom nitrogen. Kombinasi dari negatifitas ekstra tersebut dan daya tarik pasangan bebas, menarik hydrogen dari air. Dalam hubungannya dengan urin, sifat fisika bau (amonia) tidak berwarna dan dalam sifat kimia amonia mempunyai dua reaksi yaitu :
1). Reaksi subtitusi : masuknya ion H+ (dari molekul H2O) dalam amonia, misal : NH3 + H2O → NH4OH →NH4+ + OH
-2). Reaksi oksidasi : reaksi Amonia dengan Oksigen membentuk Nitrogen dan Air. reaksinya :
4 NH3 + 3 O2 → 2 N2 + 6 H2O (Svehla, 1985).
2.8 Elektroda Selektif Ion
Potensiometri merupakan salah satu teknik analisis elektrokimia yang didasarkan pada hubungan antara potensial sel dengan konsentrasi spesi kimia dari potensial antara dua elektroda. Metode ini didasarkan pada pengukuran arus listrik sebagai fungsi perubahan potensial listrik yang diterapkan pada sel elektrolisis. Sel elektrolisis terdiri atas elektroda kerja, elektroda pembanding dan elektroda pendukung (Agustiani W, 2007).
Elektroda pembanding merupakan elektroda yang harga potensial selnya diketahui, konstan dan sama sekali tidak peka terhadap komposisi larutan yang sedang diselidiki. Elektroda indikator merupakan pasangan elektroda pembanding yang potensialnya tergantung pada konsentrasi zat yang sedang diteliti (Underwood, 1986).
elektroda indikator membran sering disebut elektroda selektif ion (ISE) (Khopkar, 1990).
Elektroda Selektif Ion (ISE) merupakan setengah sel elektrokimia, yang terdiri dari sebuah membran selektif ion, larutan pengisi internal, dan sebuah elektroda referensi internal atau terdiri dari membran selektif ion dan sebuah solid contact. Elektroda Selektif Ion (ESI) merupakan suatu sensor elektrokimia yang banyak digunakan karena memiliki selektivitas, sensitifitas, keakuratan, dan ketepatan yang relative besar. Keefektifan ESI dikarenakan gangguan terhadap kerja ESI umumnya hanya sedikit dan mudah diatasi. Contoh larutan keruh (berwarna sampat batas tertentu) tidak menyulitkan pengukuran dan prosedur analisisnya sederhana, sehingga pengukuran hanya memerlukan waktu singkat, alat-alat sederhana dan mudah dilakukan. Oleh karena itu ESI dapat digunakan untuk pengukuran analisis rutin (Agustiani W, 2007).
Metode potensiometri dengan ion selektif elektroda dapat digunakan untuk menganalisis ion nitrat dan amonium. Elektroda selektif Ion ini memiliki membran polimer matriks PVC yang dirancang untuk mendeteksi ion nitrat dan ammonium dalam larutan air dan cocok untuk lapangan dan aplikasi laboratorium (Nico, tanpa tahun).
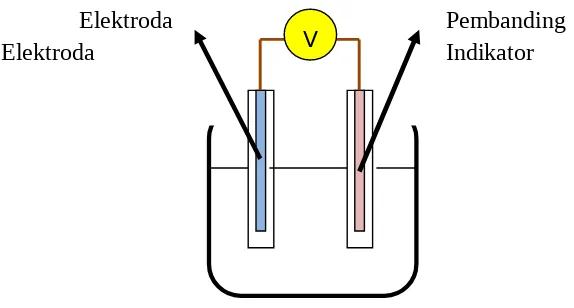
V
Elektroda Pembanding
Elektroda Indikator
Gambar 2. Pengukuran Potensiometri
Elektroda selektif ion yang digunakan pada penelitian ini merupakan elektroda komersial yang dikombinasikan dengan elektroda reference dan dialirkan pada volt meter. Beda potensial akan terukur karena inner solution atau membrane electrode spesifik dengan analit yang diukur sehingga ion analit akan berdifusi ke membran dan menyebabkan adanya perubahan kesetimbangan antara elektroda
reference dan elektroda kerja yang diterjemahkan sebagai beda potensial pengukuran (Khopkar, 1990).
Metoda elektroda selektif ion nitrat merupakan salah satu metode analisis elektrokimia yang dapat digunakan untuk analisis kuantitatif, penentuan kandungan nitrat dalam air. Penggunaan elektroda selektif ion (ESI) dalam analisis kimia sangat luas karena selektivitasnya tinggi, relatif murah, cepat, tidak memerlukan perlakuan awal yang rumit dan dapat digunakan untuk pengujian anion maupun kation. Beberapa aplikasi metode ESI menjadi alternatif pengganti metode analisis yang telah ada dengan nilai kelebihan dalam hal efisiensi dan kesederhanaan dalam pengukurannya, akan tetapi kelemahan metode ESI ini kestabilannya rendah (Anonim, 2003).
Elektroda selektif ion berdasarkan jenis ion sensitif membran yang digunakan dalam konstruksinya digolongkan menjadi 3, yaitu : elektroda membran padat (solid-state) membran cair (liquid) dan membran gelas. Elektroda ion selektip nitrat termasuk dalam elektroda membran cair (liquid) ion-exchange
(immisible) dengan pelarut organik yang mengandung garam anorganik dari ion yang diukur (Atikah, 2005).
Respon dari suatu elektroda selektif ion adalah potensial sebagai fungsi dari aktivitas ion atau konsentrasi dalam larutan. Bila aktivitas naik maka potensial elektroda menjadi lebih positip bila elektrodanya adalah sensor kation, menjadi lebih negatif jika elektroda sensor untuk anion. Bila potensial elektroda dari suatu elektroda diukur terhadap elektroda pembanding, diperoleh harga potensial sebanding dengan logaritma aktivitas atau konsentrasi ion. Hubungan antara potensial elektroda dengan aktivitas ion ditunjukkan dengan persamaan Nernst sebagai berikut :
Dimana : E : total potensial dari sistem yang diukur
Ea : bagian dari total potensial terhadap elektroda pembanding dalam larutan
R : konstante gas umum (8,314 J.K-1.mol-1 ) T : derajat Kelvin, n muatan ion
F : bilangan Faraday (96,485 C.mol-1) a : aktivitas ion dalam larutan cuplikan
Untuk sepuluh kali perubahan dalam aktivitas ion, potensial elektroda (pada 25 0C) berubah dengan 59,2 mV jika ion yang diukur adalah monovalen dan 29,6 mV jika yang diukur adalah divalent, akan tetapi dalam prakteknya sering diperoleh slope elektroda yang lebih kecil atau kurang dari teori dan hal ini menyebabkan kesalahan pengukuran jika kompensasi tidak dipenuhi (Anonim, 2003).
2.9 Spektrometri
berinteraksi dengan spesies analit yang dapat melalui proses absorpsi, emisi, fluoresensi atau proses lainnya (Siswoyo, 2007).
Metode spektrometri, larutan sampel menyerap radiasi elektromagnetik dari sumber yang tepat, dan jumlah yang diserap terkait dengan konsentrasi analit dalam larutan. Transisi elektronik yang terjadi di daerah tampak dan ultraviolet dari spektrum adalah karena penyerapan radiasi oleh jenis tertentu dari kelompok, obligasi, dan kelompok fungsional dalam molekul. Panjang gelombang penyerapan dan intensitas tergantung pada jenis. Panjang gelombang serapan adalah ukuran dari energi yang dibutuhkan untuk transisi. Intensitasnya tergantung pada probabilitas transisi yang terjadi ketika sistem elektronik dan radiasi berinteraksi dan pada polaritas keadaan tereksitasi ( Christian, 1994). 2.9.1 Spektrfotometri UV-Vis
Spektrofotometri sinar tampak adalah salah satu teknik analisis spektroskopik yang memakai sumber radiasi elektromagnetik sinar tampak dengan menggunakan instrument spektrofotometer (Mulja dan Suharman, 1995).
Spektrofotometer UV-Vis adalah sejenis peralatan yang digunakan untuk mengukur serapan molekul organik atau anorganik yang diberikan sumber cahaya dengan rentang panjang gelombang di daerah UV-Vis (180-770 nm) (Siswoyo, 2007).
Semua molekul dapat menyerap radiasi dalam daerah UV-Vis karena mereka mengandung electron, baik sekutu maupun menyendiri, yang dapat dieksitasikan ke tingkst energi yang lebih tinggi (Underwood, 1999).
Adsorbsi cahaya oleh suatu molekul merupakan bentuk interaksi antara gelombang cahaya (foton) dan atom/molekul. Energi cahaya diserap oleh ataom/molekul dan digunakan oleh elektron di dalam atom/molekul tersebut untuk bertransisi ke tingkat energi elektronik yang lebih tinggi. Proses absorbsi cahaya UV-Vis berkaitan dengan promosi elektron dari suatu orbital molekul dengan tingkat energi elektronik tertentu ke orbital molekul lain dengan tingkat nergi elektronik yang lebih tinggi (Siswoyo, 2007).
Skema 1. Komponen Spektrofotometer
1. Suatu sumber energi cahaya yang berkesinambungan yang meliputi daerah spektrum dalam mana instrument itu dirancang untuk beroperasi.
2. Suatu monokromator, yakni suatu piranti untuk memencilkan pita sempit panjang-panjang gelombang dari spectrum lebar yang dipancarkan oleh sumber cahaya.
3. Suatu wadah untuk sampel.
4. Suatu detector, yang berupa transduser yang mengubah energy cahaya menjadi suatu isyarat listrik.
5. Suatu pengganda (amplifier) dan rangkaian yang berkaitan yang membuat isyarat listrik itu memadai untuk dibaca.
6. Suatu sistem baca yang diperagakan besarnya isyarat listrik (Underwood, 1999).
2.10 Metode FIA
Konsep analisis injeksi alir (FIA) diperkenalkan pada pertengahan tahun tujuh puluhan yang didahului oleh keberhasilan analisis aliran tersegmentasi, terutama dalam analisis klinis dan lingkungan. Ini kemajuan, serta pengembangan monitor terus menerus untuk pengendalian proses dan monitor lingkungan, memastikan keberhasilan metodologi FIA. Sebagai sarana yang sangat efektif mekanisasi untuk berbagai prosedur analisis kimia basah, metodologi FIA, digunakan dengan persenjataan seluruh metode deteksi kimia analisis modern, terbukti menjadi perhatian besar bagi banyak orang.
dalam detektor flow-through dan on-line menjalankan operasi pemisahan yang sulit, prekonsentrasi atau konversi fisikokimia analit menjadi spesies terdeteksi.
Dua puluh tahun penelitian oleh sejumlah kelompok peneliti di seluruh dunia telah memberikan kemajuan yang signifikan dalam deskripsi teoritis fenomena dispersi dalam operasi FIA dan berbagai pengobatan fisikokimia analit. Volume ini dikhususkan untuk penyajian status pengembangan instrumentasi untuk FIA dan banyak bidang aplikasi praktis, berdasarkan bibliografi ekstensif publikasi riset asli. Injeksi alir analisis (FIA) adalah sebuah pendekatan untuk analisis kimia yang dilakukan dengan menyuntikkan sebuah plug sampel ke dalam aliran pembawa mengalir. Prinsipnya mirip dengan analisis aliran tersegmentasi (SFA), tetapi tidak ada udara yang disuntikkan ke dalam sampel atau aliran reagen (Trojanowicz, 2000).
Arus analisis injeksi tidak harus dijelaskan. Hal ini harus ditunjukkan. FIA meliputi dalam manipulasi mikofluida sampel dan reagen. Sampel yang disuntikkan ke dalam larutan pembawa / reagen, yang mengangkut zona sampel ke detektor sementara diinginkan reaksi biokimia terjadi. Respon Detector menghasilkan kurva kalibrasi mengukur analit sasaran. Dengan demikian, FIA didasarkan pada tiga prinsip:
1) Sampel direproduksi suntikan atau penyisipan menjadi pembawa mengalir stream.
2) Controlled dispersi dari sampel zone
3) Direproduksi waktu gerakan dari titik sampel injeksi dengan sistem deteksi. (M.C.Biurrun, 2009).
2.11 Ekstraksi
Berdasarkan fase yang terlibat, terdapat dua jenis ekstraksi, yaitu ekstraksi cair-cair dan ekstraksi padat-cair. Pemindahan komponen dari padatan ke pelarut pada ekstraksi padat-cair melalui tiga tahapan, yaitu difusi pelarut ke pori-pori padatan atau ke dinding sel, di dalam dinding sel terjadi pelarutan padatan oleh pelarut, dan tahapan terakhir adalah pemindahan larutan dari pori-pori menjadi larutan ekstrak. Tingkat ekstraksi bahan ditentukan oleh ukuran partikel bahan tersebut. Bahan yang diekstrak sebaiknya berukuran seragam untuk mempermudah kontak antara bahan dan pelarut sehingga ekstraksi berlangsung dengan baik (Sudarmadji et al., 1984).
2.11.1 Ekstraksi Cair-cair
Ekstraksi cair-cair (ekstraksi pelarut) merupakan suatu teknik dalam suatu larutan (biasanya dalam air) dibuat bersentuhan dengan suatu pelarut kedua (biasanya organik), yang pada hakekatnya tak tercampurkan dengan pelarut pertama, dan menimbulkan perpindahan satu atau lebih zat terlarut (solute) ke dalam pelarut dua itu. Ekstraksi pelarut umumnya digunakan dalam analisis untuk memisahkan suatu zat terlarut (atau zat-zat terlarut) yang dianggap penting dari zat yang mengganggu dalam analisis kuantitatif terakhir terhadap bahan tersebut, kadang justru zat terlarut pengganggu tidak diekstraksi secara selektif. Ekstraksi pelarut juga digunakan untuk memekatkan suatu spesi, yang dalam larutan air adalah terlalu encer untuk dianalisis. Pemilihan pelarut untuk ekstraksi ditentukan oleh pertimbangan-pertimbangan berikut :
1. Kelarutan yang rendah dalam fase air
2. Viskositas yang cukup rendah, dan perbedaan rapatan yang cukup besar dari fase airnya, untuk mencegah terbentuknya emulsi.
3. Toksisitas yang rendah dan tidak mudah terbakar.
4. Mudah mengambil kembali zat terlarut dari pelarut untuk proses proses analisis berikutnya
(Basset et al., 1994).
Ekstraksi padat-cair (leaching) adalah proses pemisahan zat padat yang terlarut dari campurannya dengan pelarut yang tidak saling larut. Pemisahan umumnya melibatkan pemutusan yang selektif, dengan atau tanpa difusi. Tetapi pada kasus yang ekstrim dari simple washing terdiri dari pertukaran (dengan pengadukan) dari satu cairan interstitial dengan yang lainnya, di mana terjadi pencampuran (Perry, 1997).
Leaching merupakan proses peluruhan bagian yang mudah terlarut (solute) dari suatu padatan dengan menggunakan suatu larutan (pelarut) pada temperatur dan proses alir tertentu. Proses ini dilakukan untuk mendapatkan bagian yang mudah terlarut karena lebih berharga dari padatannya, misalnya bahan tambang, minyak nabati, dan lain-lain, ataupun untuk menghilangkan bahan kontaminan yang mudah terlarut dari padatan yang lebih berharga, misalnya pigmen dari kontaminan kimiawi yang bisa atau mudah dilarutkan (Treybal, 1980).
BAB 3. METODOLOGI PRAKTIKUM
- Scoop
- Wadah sampel - Cawan porselen - Oven
- Desikator - Neraca
- Beaker glass 50 mL, 100 mL, 1 L - Batang pengaduk
- Labu ukur 50 mL - Pipet tetes
- Pipet mohr 10 mL
- Gelas ukur 10 mL, 50 mL - 1 set FIA Potensiometer - Ayakan
3.1.2 Bahan
- Tanah Agroteknopark Universitas Jember - Aquademin
- CaCl2 0,01 M - NaNO3 anhidrat - (NH4)2SO4 2,00 M - NH4Cl
- CuSO4 1,00 M
3.2 Diagram Alir Percobaan
Pengambilan Sampel Tanah
3.3 Prosedur Kerja
3.3.1 Pengambilan Sampel
- diambil dengan scoop pada kedalaman ± 20 cm - dimasukkan ke dalam wadah
- disimpan pada tempat yang bebas kontaminasi dan yang terlindung dari sinar matahari
- diayak sampel menggunakan ayakan
-3.3.2 Penetapan Kadar Air
- diambil 5,00 g sampel tanah Ekstraksi Tanah
Filtrat
Analisis Potensiometri
Data Hasil
Tanah Agroteknopark Univ. Jember
Hasil
- dimasukkan ke dalam cawan porselen yang telah ditimbang massanya
- dikeringkan di dalam oven pada suhu 105oC selama 4 jam - dimasukkan ke dalam desikator selama 15 menit
- ditimbang massa sampel
- dihitung kadar air yang diperoleh
-3.3.3 Ekstraksi Tanah
3.3.3.1 Ekstrak Tanah dengan CaCl2 0,01 M
- diambil 20,00 g sampel tanah
- diamasukkan ke dalam beaker glass 100 mL - dilarutkan dengan 50 mL CaCl2 0,01 M - diaduk selama 45 menit
- disaring menggunakan kertas sehingga didapatkan ekstrak tanah
-3.3.3.1 Ekstrak Tanah dengan Air
- diambil 20,00 g sampel tanah Hasil
sampel tanah
Hasil
- diamasukkan ke dalam beaker glass 100 mL - dilarutkan dengan 50 mL Aquademin
- diaduk selama 45 menit
- disaring menggunakan kertas saring sehingga didapatkan ekstrak tanah
-3.3.4 Larutan Standar Potensiometri a. Nitrat
- dilarutkan dengan 1 L aquademin
- divariasikan konsentrasi menjadi 0,01; 0,10; 1,00; 10,00; 100,00 mg/L
- dimasukkan ke dalam beaker glass 50 mL
- ditambahkan 1 ml larutan ISA ((NH4)2SO4 2,00 M) - dianalisa nitrat dengan FIA potensiometer
-b. Amonium
- dilarutkan dengan 1 L aquademin 1,37 g NaNO3 anhidrat
Hasil
- divariasikan konsentrasi menjadi 0,01; 0,10; 1,00; 10,00; 100,00 mg/L
- dimasukkan ke dalam beaker glass 50 mL - ditambahkan 1 ml larutan ISA (CuSO4 1,00 M) - dianalisa amonia dengan FIA potensiometer
-3.3.5 Penentuan Sampel
- dilarutkan dengan 1 L aquademin
- dianalisa nitrat, ammonia dan kalium dengan FIA potensiometer
BAB 4. HASIL DAN PEMBAHASAN
4.1 Hasil
10 mL ekstrak
4.1.1 Beda potensial dengan Metode Simultan dan Single
Metode Kadar NO3 (ppm) Kadar NH4+ (ppm) Simultan Tidak masuk range Tidak masuk range
Single 1089,1 1082,6
4.1.3 Range Larutan standard
Larutan Standar NO3 Larutan Standar NH4+ Konsentrasi
Analisis potensiometri merupakan metode analisis kimia berdasarkan hubungan antara potensial elektroda relatif dengan konsentrasi larutan dalam suatu sel kimia. Potensiometri berupa pemerikasaan fisik kimia yang menggunakan peralatan listrik untuk mengukur potensial elektroda, dimana besarnya potensial elektroda tergantung padakepekatan ion-ion tertentu dalam larutan. Metode ini menggunakan elektroda ion selektif (ISE) yang dapat memberikan respon selektif terhadap ion tertentu.
Percobaan yang dilakukan pertama yaitu penetapan kadar air dalam tanah. Sampel tanah diambil sebanyak 5 g. Cawan porselen sebagai wadah sampel di timbang terlebih dahulu dan massanya sebesar 72, 262 g. Selanjutnya diletakkan sampel tanah pada cawan porselen ditimbang keduanya, diperoleh massa keduanya sebesar 77,287 g. Setelah penimbangan, cawan porselen dimasukkan pada oven dengan suhu 105oC selama 4 jam untuk menguapkan air dalam tanah karena air akan mempengaruhi kondisi analisa pada sampel. Proses selanjutnya, cawan porselen dimasukkan ke dalam desikator supaya sampel tanah menjadi kering dan kelembaban lingkungan (uap air) tidak kembali masuk dalam tanah. Cawan porselen dan tanah tersebut selanjutnya ditimbang kembali dan diperoleh massa sebesar 76,000 g. Hasil kadar air yang terkandung dalam tanah diperoleh sebesar 25,612%. Kandungan air yang sangat banyak dibuktikan dengan pengambilan sampel pada esok hari dan malam hari sebelum pengambilansampel tanah telah terjadi hujan.
dalam 100 mL aquademin. Selanjutnya campuran sampel dengan 50 mL CaCl2 diaduk selama 45 menit. Kemudian disaring menggunakan kertas saring, barulah diperoleh ekstrak tanah CaCl2.
Percobaan ketiga yaitu pembuatan tanah dengan air. Sampel tanah ditimbang sebanyak 20 g. Sampel tanah lalu dilarutkan dalam 50 mL aquademin. Aquademin digunakan sebagai pelarut karena aquademin merupakan hasil destilasi dimana kandungan mineral didalam aquademin sangat sedikit (hampir tidak mengandung mineral). Selanjutnya dilarutkan sampel tanah dalam aquademin dan diaduk selama 45 menit. Hal ini bertujuan untuk menghomogenkan campuran. Selanjutnya campuran didekantasi agar diperoleh ekstrak tanah.
Sebelum dilakukan pengukuran ekstraktan sampel tanah dibuat suatu larutan standar. Larutan standar ini berfungsi sebagai nilai pembanding yang dihasilkan dari sampel. Nilai yang dihasilkan dari sampel dibandingkan dengan nilai yang dihasilkan dari standart. Larutan standar ini dibuat dalam beberapa konsentrasi, hal ini dapat digunakan dalam penentuan konsentrasi sampel yang diukur. Larutan standar pada pengukuran FIA elektro dengan elektroda potensiometri yaitu larutan standar Nitrat dan Amonium. Kedua larutan standart tersebut digunakan untuk mengetahui kadar senyawa N dalam bentuk nitrat dan ammonium dalam sampel ekstraktan tanah yang akan diukur. Masing-masing larutan standar tersebut dibuat dengan konsentrasi 100 ppm; 10,0 ppm; 1,00 ppm; 0,10 ppm dan 0,01 ppm.
mengambil 10 mL larutan standar 0.10 ppm diencerkan kedalam labu ukur 100 mL dengan menggunakan akuademin. Hasil beda potensial yang dihasilkan dapat dilihat di tabel 4.1.3 yaitu berkisar antara 324,1 - 455 mV.
Larutan standar Amonium (NH4Cl) dibuat dengan mengencerkan 0,297 g padatan ammonium klorida dalam 100 mL akuademin. Kosentrasi yang diperoleh dari pengenceran tersebut yaitu 100 ppm. Selanjutnya untuk membuat larutan standar nitrat dengan konsentrasi 10, 0 ppm; 1,00 ppm; 0,10 ppm; dan 0,01 ppm. Konsentrasi 10,0 ppm dibuat dengan mengambil 10 mL larutan standar 100 ppm diencerkan kedalam labu ukur 100 mL dengan menggunakan akuademin. Konsentrasi 1,00 ppm dibuat dengan mengambil 10 mL larutan standar 10,0 ppm diencerkan kedalam labu ukur 100 mL dengan menggunakan akuademin. Konsentrasi 0,10 ppm dibuat dengan mengambil 10 mL larutan standar 1,00 ppm diencerkan kedalam labu ukur 100 mL dengan menggunakan akuademin. Konsentrasi 0,01 ppm dibuat dengan mengambil 10 mL larutan standar 0.10 ppm diencerkan kedalam labu ukur 100 mL dengan menggunakan akuademin. Hasil beda potensial yang dihasilkan dapat dilihat di tabel 4.1.3 yaitu berkisar antara 370.1 - 402.5 mV.
nilai beda potensial nitrat. Beda potensial NO3 rata-rata yang dihasilkan pada metode single ini adalah 430,7 mV. Hal ini membuktikan bahwa beda potensial yang dihasilkan masuk ke dalam range larutan standard. Kadar NO3 metode single yang diperoleh yaitu sebesar 1089,1 ppm.
Penentuan konsentrasi amonium ini dilakukan dengan metode single elektroda dan metode simultan. Metode single elektroda amonium dilakukan dengan hasil ekstrak tanah CaCl2 yang diperoleh kemudian diuji dengan metode FIA potensiometri, dimana ekstrak tanah dialirkan menggunakan FIA kemudian digunakan elektroda kerja amonium dan elektroda referen pH. Sehigga selain didapat nilai potensial dari ammonium juga diperoleh nilai pH. Sebelum dialirkan dalam FIA potensiometri ditambahkan dulu ISA CuSO4 2 M. Fungsi penambahan larutan ISA adalah untuk mengurangi jumlah kesalahan dalam solut dikarenakan adanya variasi kadar ion. Selain itu larutan ISA disini berfungsi untuk menaikkan kekuatan ion dalam ekstraktan tanah. Hal ini diperlukan karena elektroda ISE nantinya akan mengukur aktifitas analit. Selanjutnya campuran diaduk menggunakan stirrer magnetic supaya homogen. Baru larutan ekstrak tanahnya diuji dengan FIA potensiometri sehingga diperoleh nilai beda potensial ammonium. Beda potensial NH4+ rata-rata yang dihasilkan pada metode single ini adalah 380,04 mV. Hal ini membuktikan bahwa beda potensial yang dihasilkan masuk ke dalam range larutan standard. Kadar NH4+ metode single yang diperoleh yaitu sebesar 1082,6 ppm.
BAB 5. PENUTUP
5.1 Kesimpulan
Kesimpulan yang dapat diambil dari percobaan tentang Penggunaan Metode Potensiometri Untuk Mengukur Kadar N (Nitrat Dan Amonia) Pada Tanah Universitas Jember Dengan Ekstraktan adalah :
1. Kadar NO3 dan NH4+ metode simultan tidak masuk range standard, berbeda dengan metode single untuk NO3 dan NH4+ masuk range standard
2. Jika dibandingkan hasil keduanya, metode yang lebih efektif adalah metode single
5.2 Saran
DAFTAR PUSTAKA
Anonim. 2012. Flow Injection Analysis. www.en.wikipedia.org. Diakses pada tanggal 24-12-2012 pukul 19.15 WIB.
Biurrun, Yebra, M.C. 2009. Flow Injection Analysis of Marine. New York : Nova Science Publishers Inc.
Bohn HL, McNeal BL, O’Connor GA. 1979. Soil Chemistry. New York: J Wiley. Buckman OH, Brady NC. 1982. Ilmu Tanah. Terjemahan dari The Nature and
Properties of Soils. Jakarta : Penerbit Bhatara Karya Aksara.
Crohn D. 2004. Nitrogen Mineralization and Its Importance in Organic Waste Recycling. [terhubung berkala]. http://alfalfa.ucdavis.edu.pdf. [Agustus 2008].
Darmawijaya. 1990. Klasifikasi Tanah. Yogyakarta: Gajah Mada University. Gardiner DT, Miller RW. 2004. Soils In Our Environment. Tenth Edition. New
Jersay: Pearson Education.
Goldman E, Jacobs R. 1991. Determination of nitrates by ultraviolets absopstion.
J. Amer. Water Works Assoc 53:187.
Hardjowigeno S. 2003. llmu Tanah. Jakarta: Akademika Pressindo.
Harjadi W. 1993. Ilmu Kimia Analitik Dasar. Jakarta: Gramedia Pustaka Utama. Havlin JL, Beaton JD, Tisdale SL, Nelsen WL. 1999. Soil Fertility and
Fertilizers, 6th Edition. Prentice Hall, New Jersey.
Puslittanah. 2005. Penuntun Analisis Kimia Tanah dan Tanaman. Bogor: Balai Penelitian Tanah.
Sanchez PA. 1992. Sifat dan Pengelolaan Tanah Tropika. Bandung: ITB. Sarwono, H. 2007. Ilmu Tanah. Ed ke-4. Jakarta: Akademika Pressindo. Soepardi G. 1983. Dasar-dasar Ilmu Tanah. Bogor : IPB.
Soepardi G. 1996. Sifat dan Ciri Tanah. Bogor: IPB.
Soil Survey Staff. 1999. Soil Taxonomy. United States : Departement of Agriculture. Natural Resources Conservation Service.
Tejoyuwono N. 1998. Tanah & Lingkungan. Jakarta: Direktorat Jendral Pendidikan Tinggi Departemen Pendidikan dan Kebudayaan.
Trojanowicz, Marek. 2000. Arus Injeksi Analisis: Instrumentasi dan Aplikasi. Singapura: Dunia Ilmiah.
Umariah S. 2007. Perbandingan Metode Analisis Senyawa Nitrogen Dengan KCl dan CaCl2 di Beberapa Kedalaman Tanah Yang Ditanami Bawang Daun
[skripsi]. Bogor: Fakultas Matematika dan Ilmu Pengetahuan Alam, IPB.
PERHITUNGAN
2. Penentuan Kadar Air pada Sampel Tanah Massa cawan porselen = 72,262 g
Massa (cawan porselen + tanah)awal = 77,287 g Massa (cawan porselen + tanah)akhir = 76 g Massa tanah awal = 5,025 g
Massa tanah akhir = 3,738
Kadar air = massa awalmassa awal−massa akhirx100
= 5,0255,025−3,738x100=25,612 3. Perhitungan Konsentrasi NO3 metode simultan
y = 7,83x – 266,8 478,51= 7,83x – 266,8
x = 478,51 + 266,8 : 7,83 x = 95,2
x = log [C] 95,2 = log [C] [C] = 1095,2
4. Perhitungan Konsentrasi NH4+ metode simultan y = 7,83x – 266,8
314,72= 7,83x – 266,8
x = 314,72 + 266,8 : 7,83 x = 74,3
x = log [C] 74,3 = log [C] [C] = 1074,3
5. Perhitungan Konsentrasi NO3 metode single y = 7,83x – 266,8
430,7 = 7,83x – 266,8 x = 430,7 + 266,8 : 7,83 x = 89,1
[C] = 1089,1
6. Perhitungan Konsentrasi NH4+ metode single y = 7,83x – 266,8
7. Hasil Bedapotensial (mV) dengan Metode Simultan dari Sampel NO3 Beda Potensial (mV) Sampel NO3
432.6 434.7 434.5 444.7 515.8 563.9 488.9 508.7 428.2 432.2 435.5 445.1 529.6 563.9 491.4 507.8 428.2 427.4 438.6 445.4 555.2 476.6 495
427.9 425.2 444.4 445.4 567.5 476.6 498.1 427.3 425.3 446.4 525.9 565.7 474.8 503.8
427.3 425.3 447.9 525.9 564.8 473 507
427.5 434.1 446.9 525.9 565.4 472.1 508.8 429.6 434.1 445.4 515.5 566 472.9 510.3 432.6 434.1 445 505.8 566.4 480.1 510.4 433.8 434 444.5 501.2 566.3 484.6 509.7
Nilai Rata-rata 478.51
8. Hasil Bedapotensial (mV) dengan Metode Simultan dari Sampel NH4+ Beda Potensial (mV) Sampel NH4+
294.2 304 193.7 335.1 -238.7 -240.4 205.1 325.3 -408.8 300.6 322.3 335.2 -239.7 -240.4 323.1 324.8 -408.8 291.9 326.3 335.1 -242 -306.4 318.9
-269.6 286.8 333.5 335.1 -243 -306.4 318.2 8.9 216.5 336.3 -237.6 -242.3 -304 324.3 287.5 216.5 338.6 -237.6 -241.7 -301.5 327.6 287.6 -314.7 338 -237.6 -240.5 -293.3 328.3 290 -314.7 337.1 -238 -239.8 -287.5 328 294.5 -187.8 336.4 -238.1 -239.4 -159.3 327.2
298.4 66 335.3 -238 -239.3 -34.4 325.8
9. Hasil Bedapotensial (mV) dengan Metode Single dari Sampel NO3
10. Hasil Bedapotensial (mV) dengan Metode Simultan dari Sampel NH4+ Beda Potensial (mV) Sampel NH4+
270.7 388.8 391.7 388.4
11. Hasil Bedapotensial (mV) Larutan Standar NO3 dan NH4+
Lampiran