PENGUKURAN SUHU NOL MUTLAK BERDASAR HUKUM GAY LUSSAC
SKRIPSI
Diajukan Untuk Memenuhi Salah Satu Syarat Memperoleh Gelar Sarjana Pendidikan
Program Studi Pendidikan Fisika
Oleh : Elsa Anggelina NIM : 171424007
PROGRAM STUDI PENDIDIKAN FISIKA
JURUSAN PENDIDIKAN MATEMATIKA DAN ILMU PENGETAHUAN ALAM FAKULTAS KEGURUAN DAN ILMU PENDIDIKAN
UNIVERSITAS SANATA DHARMA 2021
i
PENGUKURAN SUHU NOL MUTLAK BERDASAR HUKUM GAY LUSSAC
SKRIPSI
Diajukan Untuk Memenuhi Salah Satu Syarat Memperoleh Gelar Sarjana Pendidikan
Program Studi Pendidikan Fisika
Oleh : Elsa Anggelina NIM : 171424007
PROGRAM STUDI PENDIDIKAN FISIKA
JURUSAN PENDIDIKAN MATEMATIKA DAN ILMU PENGETAHUAN ALAM FAKULTAS KEGURUAN DAN ILMU PENDIDIKAN
UNIVERSITAS SANATA DHARMA 2021
ii SKRIPSI
PENGUKURAN SUHU NOL MUTLAK BERDASAR HUKUM GAY LUSSAC
Oleh : Elsa Anggelina NIM : 171424007
Telah disetujui oleh : Pembimbing
Dr. Ign. Edi Santosa, M.S. Tanggal 17 November 2021
iii SKRIPSI
PENGUKURAN SUHU NOL MUTLAK BERDASAR HUKUM GAY LUSSAC
Dipersiapkan dan ditulis oleh Elsa Anggelina
NIM : 171424007
Telah dipertahankan di depan panitia penguji Pada tanggal 30 November 2021 dan dinyatakan memenuhi syarat
Susunan Panitia Penguji
Nama Lengkap Tanda Tangan
Ketua : Dr. Marcellinus Andy Rudhito, S.Pd.
...
Anggota : Dr. Ign. Edi Santosa, M.S.
...
Anggota : Prof. Dr. Paulus Suparno, SJ., M.S.T.
...
Anggota : Elisabeth Dian Atmajati, S.Pd., M.Si.
...
Yogyakarta, 30 November 2021
Fakultas Keguruan dan Ilmu Pendidikan Universitas Sanata Dharma
Dekan,
Dr. Yohanes Harsoyo, S.Pd., M.Si.
...
Sekretaris : Dr. Ign. Edi Santosa, M.S.
iv
HALAMAN PERSEMBAHAN
hati yang senantiasa dibentuk dan langkah yang senantiasa disertai.
I am endlessly grateful.
v
PERNYATAAN KEASLIAN KARYA
Saya menyatakan dengan sesungguhnya bahwa skripsi yang saya tulis ini tidak memuat karya atas bagian karya orang lain kecuali yang telah disebutkan dalam kutipan dan daftar pustaka, layaknya karya ilmiah.
Yogyakarta, 30 November 2021 Penulis,
Elsa Anggelina
vi
LEMBAR PERNYATAAN PERSETUJUAN PUBLIKASI KARYA ILMIAH UNTUK KEPERLUAN AKADEMIS
Yang bertanda tangan di bawah ini, saya mahasiswa Universitas Sanata Dharma : Nama : Elsa Anggelina
NIM : 171424007
Demi pengembangan ilmu pengetahuan, saya memberikan kepada Perpustakaan Universitas Sanata Dharma untuk menyimpan karya ilmiah saya yang berjudul :
PENGUKURAN SUHU NOL MUTLAK BERDASAR HUKUM GAY LUSSAC
Dengan demikian saya memberikan kepada Perpustakaan Universitas Sanata Dharma untuk menyimpan, mengalihkan dalam bentuk media lain, mengolahnya dalam bentuk pangkalan data, mendistribusikannya secara terbatas, dan mempublikasikan di internet atau media lain untuk kepentingan akademis tanpa perlu meminta izin dari saya maupun memberikan royalti kepada saya selama tetap mencantumkan nama saya sebagai penulis.
Demikian pernyataan ini saya buat dengan sebenarnya.
Dibuat di Yogyakarta
Pada tanggal : 30 November 2021 Yang menyatakan
Elsa Anggelina
vii ABSTRAK
PENGUKURAN SUHU NOL MUTLAK BERDASAR HUKUM GAY LUSSAC
Elsa Anggelina Universitas Sanata Dharma
Yogyakarta 2021
Telah dilakukan penelitian mengenai pengukuran suhu nol mutlak berdasar Hukum Gay Lussac. Hukum Gay Lussac menyatakan jika volume gas pada sistem tertutup dibuat konstan, maka tekanan gas berbanding lurus dengan suhu gas. Apabila suhu gas semakin tinggi maka tekanan gas akan semakin besar demikian juga sebaliknya.
Dalam penelitian ini, pengukuran suhu gas dan tekanan gas dilakukan dengan menggunakan sensor suhu dan sensor tekanan pada sistem tertutup yang dipanaskan. Melalui pengukuran, perubahan suhu gas mengakibatkan perubahan tekanan gas sehingga diperoleh hubungan tekanan gas terhadap suhu gas. Suhu nol mutlak tidak secara langsung dapat diperoleh melalui pengukuran. Hasil pengukuran suhu gas dan tekanan gas dianalisis melalui perhitungan sehingga diperoleh nilai suhu nol mutlak. Analisis grafik menggunakan aplikasi Logger Pro.
Nilai suhu nol mutlak yang diperoleh melalui percobaan menggunakan satu labu erlenmeyer yang dianalisis dengan persamaan Hukum Gay Lussac adalah (- 322 ± 2 °C), dengan memperhitungkan nilai suhu ruangan adalah (- 310 ± 1 °C). Nilai yang diperoleh dari pengukuran suhu nol mutlak menggunakan dua labu erlenmeyer sangatlah besar, hal ini dipengaruhi oleh ketidakseragaman suhu di dalam sistem. Melalui percobaan dapat ditunjukkan bahwa dengan memperhitungkan nilai suhu ruangan dapat menghasilkan nilai suhu nol mutlak yang lebih mendekati nilai secara teori.
Kata kunci ; suhu nol mutlak, hukum Gay Lussac, sensor suhu, dan sensor tekanan.
viii ABSTRACT
MEASUREMENT ABSOLUTE ZERO TEMPERATURE BASED ON GAY LUSSAC LAW
Elsa Anggelina Sanata Dharma University
Yogyakarta 2021
Research has been done on absolute zero temperature measurement based on Gay Lussac's Law. Gay Lussac's law states that if the volume of a gas in a closed system is held constant, the pressure of the gas is directly proportional to the temperature of the gas. The higher the gas temperature, the higher the gas pressure and vice versa. In this study, the measurement of gas temperature and gas pressure was carried out using a temperature sensor and a pressure sensor in a heated closed system. Through measurement, changes in gas temperature result in changes in gas pressure so that the relationship between gas pressure and gas temperature is obtained. Absolute zero temperature cannot be directly obtained by measurement.
The results of gas temperature and gas pressure measurements were analyzed through calculations so that the absolute zero temperature value was obtained.
Graph analysis using the application Logger Pro. The absolute zero temperature value obtained by experiment using an Erlenmeyer flask analyzed by the Gay Lussac's Law equation is (- 322 ± 2 °C), taking into account the room temperature value is (- 310 ± 1 °C). The value obtained from measuring absolute zero temperature using two Erlenmeyer flasks is very large, this is influenced by the temperature uniformity in the system. Through experiments, it can be shown that taking into account the value of room temperature can produce an absolute zero temperature value that is closer to the theoretical value.
Keywords ; absolute zero temperature, Gay Lussac's law, temperature sensor, and pressure sensor.
ix
KATA PENGANTAR
Puji syukur penulis haturkan kehadirat Tuhan Yesus Kristus untuk setiap cinta dan kasihNya yang tanpa batas, penyusunan skripsi ini dapat terselesaikan dengan baik tepat pada waktuNya. Berkat tuntunan dan pemeliharaanNya, skripsi yang berjudul “Pengukuran Suhu Nol Mutlak Berdasar Hukum Gay Lussac” dapat menjadi sebuah karya penuh arti bagi penulis sekalipun penyelesaiannya penuh tantangan dan perjuangan. Penyusunan skripsi ini merupakan salah satu syarat untuk memperoleh gelar sarjana pendidikan pada Program Studi Pendidikan Fisika Fakultas Keguruan dan Ilmu Pendidikan Universitas Sanata Dharma.
Penulisan dan penelitian ini dapat terselesaikan dengan baik bukan karena kuat dan hebat penulis semata, melainkan banyak pihak yang dengan tulus hati membantu dan mendukung penulis dalam menyelesaikannya. Dengan kerendahan hati, terima kasih yang mendalam penulis ucapkan kepada :
1. Bapak Dr. Ign. Edi Santosa, M.S. selaku dosen pembimbing skripsi yang dengan baik hatinya meluangkan waktu untuk mendengar keluh kesah, membimbing, memotivasi, dan memberikan solusi terbaiknya dalam mengartikan hal-hal sederhana sampai luar biasa dalam menyelesaikan penelitian.
2. Bapak Albertus Hariwangsa Panuluh M.Sc. selaku dosen pembimbing akademik yang selalu ada untuk mendukung dan memberikan solusi terbaik bagi permasalahan mahasiswanya.
3. Bapak dan Ibu dosen Pendidikan Fisika yang mendidik dan membimbing selama proses belajar dari awal hingga akhir perkuliahan.
4. Bapak Petrus Ngadiono selaku laboran yang membantu dalam pengadaan alat dan memberi saran dalam pemilihan alat yang sesuai untuk penelitian.
5. Ibu Tari selaku karyawati Sekretariat JPMIPA yang membantu mengurus pendaftaran sidang skripsi sehingga penulis dapat mendaftar tepat waktu.
6. Kakek dan nenek terkasih, I Nyoman Astra Susila dan Ni Wayan Suryati.
Opa dan oma terkasih, Fredrick Bembe dan Marlina Datu Pasau, yang selalu penuh harap untuk sukses dan bahagiaku di perantauan.
x
7. Bapak Ibu terkasih, Doni Dominggus, S.Pd. dan Ni Luh Mulawati, S.Pd.
selaku orang tua luar biasa yang selalu mendoakan, mengasihi, mendukung dan mengusahakan yang terbaik bagi penulis. Terima kasih karena selalu percaya dan bangga pada setiap proses yang boleh dilalui penulis.
8. Saudari kekasih, Chika Fransisca dan Murtiani Kumontoy yang selalu menjadi inspirasi dan penguat untuk tetap berjuang dan menjadi hebat.
9. Keluarga besar di Bali dan Sulawesi yang selalu mendukung perjuanganku dan menyambut hangat kepulanganku.
10. Syukur Rahmat Gulo yang dengan penuh kesabaran senantiasa mendengar, mendukung, dan mengingatkan untuk selalu berjuang bersama dan memberikan yang terbaik dalam hidup.
11. Sahabat luar biasa, Zefanya Agatha Koyoh, Fransisca Anggie Sukma Sasmitha, Natalie Yessy Christy, Angela Gusti Ayu Gita Sukmadewi, Agung Kristiono, Chatarina Abi Sulistiawati, Magdalena Ferlina Rere Djogo, Helita Efrasia Dorasta Upa, Angela Rose Noviryanti Baut, Patrisia Yohanista Muda Lake, Rafaela Reinha Rena Novia, Lusia Inviolata, Hironima Dairo Wangga, Franciscia Grecimii Djapa, Reni Patabang, Bernadin Bali Adelta Ayu, Putri Zulaicha Novaloq, Cornelia Sundari Kusumaningtyas, dan Marfuah Suryanti yang menjadi kawan seperjalanan terbaik untuk berjuang bersama.
12. Sahabat INSADHA, Anastasia Tri Lestari, Marssy Diana Sampe, Veronica Riza Arditta, Michelle B L Diyan Lakonawa yang senantiasa mendengar, mendukung, dan mengingatkan untuk selalu berjuang bersama.
13. Teman seperjuanganku, Frater Nathanael Bruno Taus, Ferdinand Saktianus Himat B, dan Yoakim Redo Bage yang selalu membantu dalam mencari dan menemukan solusi selama bimbingan skripsi.
14. Seluruh handai taulan Pendidikan Fisika 2017, yang sedari awal bersama untuk memulai perjuangan, saling pinjamkan kekuatan, dan mengakhirinya dengan sukacita. Sukses menyertai kita.
15. Keluarga besar RM Bang Rindu yang mendukung secara penuh agar skripsi ini dapat terselesaikan dengan tepat waktu. Khususnya tim server yang
xi
selalu kuat dan hebat untuk saling back up, menemukan solusi baik dari setiap masalah dalam pekerjaan, dan berbagi cerita yang selalu penuh dengan maknanya.
16. Last but not least, I wanna thank me, I wanna thank me for believing in me, I wanna thank me for doing all this hard work, I wanna thank me for never giving up, I wanna thank me for never quitting, for just being me at all times.
Peneliti menyadari bahwa penulisan skripsi dan penelitian ini belum mencapai tahap sempurna. Maka dari itu untuk menyempurnakan skripsi sebagai tugas akhir ini, peneliti dengan senang hati menerima kritik dan saran yang bersifat membangun. Peneliti berharap semoga skripsi ini memberikan manfaat bagi pembaca.
Yogyakarta, 30 November 2021 Penulis
Elsa Anggelina
xii
DAFTAR ISI
HALAMAN JUDUL ... i
HALAMAN PERSETUJUAN PEMBIMBING ... ii
HALAMAN PENGESAHAN OLEH PENGUJI ... iii
HALAMAN PERSEMBAHAN ... iv
HALAMAN PERNYATAAN KEASLIAN KARYA ... v
HALAMAN PERNYATAAN PUBLIKASI HASIL KARYA ... vi
ABSTRAK ... vii
ABSTRACT ... viii
KATA PENGANTAR ... ix
DAFTAR ISI ... xii
DAFTAR TABEL ... xiv
DAFTAR GAMBAR ... xv
BAB 1 PENDAHULUAN ... 1
1.1 Latar Belakang ... 1
1.2 Rumusan Masalah ... 5
1.3 Batasan Masalah ... 5
1.4 Tujuan Penelitian ... 5
1.5 Manfaat Penelitian ... 6
1.6 Sistematika Penulisan ... 6
BAB 2 DASAR TEORI ... 8
2.1 Pengukuran Suhu ... 8
2.2 Persamaan Gas Ideal ... 10
2.3 Suhu Nol Mutlak ... 16
BAB 3 METODOLOGI PENELITIAN ... 21
3.1 Tempat dan Waktu Penelitian ... 21
3.2 Tahapan Penelitian ... 21
3.2.1 Persiapan Alat dan Bahan ... 21
3.2.2 Prosedur dan Pengambilan Data ... 25
3.2.3 Analisis Data ... 31
BAB 4 HASIL DAN PEMBAHASAN ... 33
xiii
4.1 Hasil Penelitian ... 33
4.1.1 Menghitung Nilai Suhu Nol Mutlak Satu Labu Erlenmeyer ... 39
4.1.2 Menghitung Nilai Suhu Nol Mutlak Dua Labu Erlenmeyer ... 41
4.2 Pembahasan Penelitian ... 44
BAB 5 PENUTUP ... 49
5.1 Kesimpulan ... 49
5.2 Saran ... 49
DAFTAR PUSTAKA ... 50
LAMPIRAN ... 52
xiv
DAFTAR TABEL
Tabel 3.1 Suhu Gas terhadap Tekanan Gas ... 29
Tabel 4.1 Hasil Pengukuran Volume Selang Pertama ... 30
Tabel 4.2 Hasil Pengukuran Volume Selang Kedua ... 34
Tabel 4.3 Hasil Pengukuran Volume Labu Erlenmeyer ... 35
Tabel 4.4 Hasil Pengukuran Volume Labu Erlenmeyer Pertama ... 36
Tabel 4.5 Hasil Pengukuran Volume Labu Erlenmeyer Kedua ... 37 Tabel 4.6 Suhu, Volume, Suhu Nol Mutlak Percobaan Hukum Gay Lussac . 38
xv
DAFTAR GAMBAR
Gambar 2.1 Konversi Celcius, Fahrenheit, Kelvin, Reamur, dan Rankie ... 10
Gambar 2.2 Percobaan Boyle ... 11
Gambar 2.3 Grafik hubungan tekanan terhadap volume pada suhu konstan ... 12
Gambar 2.4 Percobaan Charles ... 13
Gambar 2.5 Grafik hubungan volume terhadap suhu pada tekanan konstan ... 14
Gambar 2.6 Pecobaan Gay Lussac ... 14
Gambar 2.7 Grafik hubungan tekanan terhadap suhu pada volume konstan ... 15
Gambar 2.8 Skema percobaan Gay Lussac ... 17
Gambar 3.1 Labu erlenmeyer ... 22
Gambar 3.2 Sensor tekanan... 23
Gambar 3.3 Sensor suhu ... 23
Gambar 3.4 Lab Pro ... 24
Gambar 3.5 Beaker glass ... 24
Gambar 3.6 Pemanas Listrik ... 25
Gambar 3.7 Susunan alat eksperimen satu volume ... 25
Gambar 3.8 Tampilan aplikasi software Logger Pro ... 27
Gambar 3.9 Tampilan waktu pengambilan data dan jumlah sampel ... 28
Gambar 3.10 Susunan alat eksperimen dua volume ... 29
Gambar 4.1 Grafik Hubungan Suhu Gas Terhadap Tekanan Gas ... 40
Gambar 4.2 Grafik Hubungan Suhu Gas Terhadap Tekanan Gas ... 42
1
BAB 1
PENDAHULUAN
1.1 Latar Belakang
Besaran yang menyatakan derajat panas dan dingin suatu benda disebut suhu. Suhu juga dapat dinyatakan sebagai ukuran energi kinetik molekuler internal rata-rata sebuah benda. Sederhananya, suhu digunakan sebagai pembeda antara panas dan dingin suatu benda. Sebuah benda jika dipanaskan maupun didinginkan, akan mengalami perubahan suhu pada sebagian sifat fisisnya. Perubahan sifat fisis diakibatkan adanya perubahan suhu dinamakan sifat termometrik. Maka perubahan suhu dapat ditunjukkan melalui perubahan sifat termometrik (Tipler, 1998).
Suhu merupakan salah satu besaran yang memiliki pengaruh dalam bidang fisika, kimia dan biologi. Namun, apresiasi penuh terhadap kompleksitas suhu dan pengukurannya relatif lambat berkembang. Secara intuitif, orang sudah mengetahui tentang suhu sejak lama dengan menyatakan api itu panas dan salju itu dingin. Pengetahuan yang lebih dalam diperoleh saat manusia mencoba bekerja menggunakan logam selama zaman perunggu dan besi. Secara mikroskopis, suhu menunjukkan energi yang dimiliki oleh suatu benda. Setiap atom dalam suatu benda masing-masing bergerak, baik itu dalam bentuk perpindahan maupun gerakan di tempat berupa getaran.
Semakin tinggi energi atom-atom penyusun benda, maka semakin tinggi suhu benda tersebut (Kreith, 1991).
Termometer merupakan alat yang digunakan untuk mengukur suhu.
Untuk dapat mengkuantitatifkan hasil pengukuran suhu dengan menggunakan termometer maka diperlukan skala-skala tertentu. Penetapan skala yang terpenting adalah penetapan titik tetap bawah dan titik tetap atas sebagai titik acuan pembuatan skala-skala dalam termometer. Untuk penetapan titik tetap bawah sebuah termometer pada umumnya dipilih titik beku air murni pada tekanan normal, yaitu suhu campuran antara es dan air murni pada tekanan normal. Sedangkan penetapan titik tetap atas sebuah termometer umumnya
dipilih titik didih air murni, yaitu suhu ketika air murni mendidih pada tekanan normal (Kreith, 1991).
Terdapat empat macam skala termometer yang biasa digunakan, yaitu Celcius, Reamur, Fahrenheit, dan Kelvin. Titik tetap bawah untuk skala Celcius dan Reamur ditetapkan pada skala 0 °C dan 0 °R, sedangkan untuk Fahrenheit ditetapkan pada skala 32 °F. Adapun titik tetap atas ketiga skala ini berbeda-beda, dimana untuk Celcius ditetapkan pada 100 °C, untuk Reamur ditetapkan pada 80 °R, dan untuk Fahrenheit ditetapkan pada 212 °F.
Pada skala Kelvin, titik tetap bawah ketiga skala termometer ini bersesuaian dengan skala 273 K dan titik tetap atasnya bersesuaian dengan 373 K. Khusus untuk skala Kelvin, titik tetap bawah tidak didasarkan pada titik beku air, namun didasarkan pada ukuran energi kinetik rata-rata molekul suatu benda.
Dalam hal ini, nol Kelvin dinamakan nol mutlak, artinya tidak ada suhu-suhu di bawah suhu nol mutlak, atau ketika nilai suhu mendekati nilai nol mutlak, maka energi kinetik rata-rata partikel mempunyai suatu nilai yang minimum.
Oleh karena itu, berdasarkan fakta-fakta tersebut, maka skala Kelvin dinamakan skala suhu mutlak. Kelvin menjadi satuan Standar SI untuk besaran pokok suhu (Kreith, 1991).
Konsep suhu nol mutlak diperkenalkan oleh William Thomson (Lord Kelvin) melalui serangkaian percobaan yang telah dilakukan untuk seluruh gas, nilai yang diperoleh adalah -273,15 °C. Hal ini menunjukkan bahwa untuk menghasilkan volume gas yang bernilai nol, gas dapat didinginkan hingga -273,15 °C namun pada suhu gas yang lebih rendah volume gas akan bernilai negatif. Hal ini tentu saja tidak masuk akal, penelitian lain juga mengindikasikan hal yang demikian. Sehingga suhu nol mutlak dijadikan sebagai dasar untuk suhu yang dikenal sebagai skala mutlak atau skala Kelvin yang sampai saat ini digunakan secara luas dalam bidang sains. Dinyatakan dalam derajat Kelvin, suhu nol mutlak -273,15 °C sama dengan 0 K. Suhu nol mutlak digunakan untuk mengukur jumlah energi kinetik dalam materi tertentu. Suhu nol mutlak menunjukkan gerakan minimum dari partikel suatu zat. (Giancoli, 2001).
Suhu nol mutlak dapat diperoleh melalui beberapa metode, salah satunya dengan menggunakan Hukum Gay Lussac. Hukum Gay Lussac menyatakan jika volume gas pada sistem tertutup dibuat konstan, maka tekanan gas berbanding lurus dengan suhu gas. Apabila suhu gas semakin tinggi maka tekanan gas akan semakin besar demikian juga sebaliknya. Suhu nol mutlak tidak secara langsung dapat diperoleh melalui pengukuran. Melalui penerapan Hukum Gay Lussac, hasil pengukuran suhu gas dan tekanan gas dianalisis melalui perhitungan sehingga diperoleh nilai suhu nol mutlak.
Salah satu eksperimen pada mata kuliah praktikum Termofisika yang terkait dengan Hukum Gay Lussac adalah Percobaan Boyle-Gay Lussac.
Tujuan eksperimen tersebut dilakukan adalah untuk menentukan hubungan antara tekanan, volume, dan suhu pada gas namun tidak sampai pada pengukuran suhu nol mutlak. Dalam percobaan tersebut, dilakukan pengukuran volume, tekanan dan suhu awal dari gas dalam tabung udara.
Kemudian tabung udara dimasukkan ke dalam wadah air panas yang menyebabkan gas dalam tabung udara memuai sehingga tinggi air dalam pipa mengalami perubahan. Maka volume, tekanan, dan suhu dapat diukur.
Dengan demikian hubungan antara volume, tekanan, dan suhu dapat dianalisis (Santosa, 2017). Boyle-Gay Lussac set tidak dapat digunakan untuk mengukur suhu nol mutlak. Pada percobaan, tekanan berbanding terbalik dengan volume. Ketika tekanan semakin kecil maka volume akan semakin besar, hal ini ditandai dengan kenaikan air raksa di dalam pipa U. Karena pipa U memiliki batas volume maksimum maka tidak dapat mengukur perubahan tekanan yang terlalu kecil.
Selain itu pada penelitian lain, pengukuran suhu nol mutlak menggunakan metode Hukum Gay Lussac pernah dilakukan oleh Nelson Kilmer dan Joel D.
Krehbiel. Dengan membuat volume konstan, perubahan suhu akan mengakibatkan perubahan tekanan. Percobaan yang dilakukan menggunakan sensor tekanan dan sensor suhu. Di mana sensor tekanan dihubungkan dengan labu erlenmeyer tertutup sedangkan sensor suhu diletakkan pada beaker glass berisi air yang dipanaskan dengan mengasumsikan bahwa suhu di luar labu
erlenmeyer sama dengan suhu di dalam erlenmeyer. Kemudian dengan bantuan software Logger Pro data dapat dianalisis (Kilmer, 2019).
Dengan mengacu pada penelitian yang telah dilakukan sebelumnya, penelitian ini bertujuan untuk menentukan suhu nol mutlak dengan menganalisis hubungan suhu gas terhadap tekanan gas. Penelitian terdahulu memberikan pengalaman untuk mengembangkan penelitian dalam menentukan suhu nol mutlak. Dalam penelitian ini digunakan sensor suhu dan sensor tekanan yang berukuran relatif kecil sehingga fleksibel dalam penggunaannya dan menghasilkan nilai ukur akurat yang dapat ditampilkan langsung oleh komputer. Pengembangan penelitian ini terkait dengan ketelitian dalam menyusun rangkaian percobaan. Diawali dengan memastikan sistem tertutup tidak mengalami kebocoran, kemudian untuk menghasilkan data yang lebih akurat, sensor tekanan akan dihubungkan langsung pada labu erlenmeyer menggunakan selang, sensor suhu juga akan dihubungkan dan dimasukkan ke dalam labu erlenmeyer sebagai sistem tertutup sehingga yang diamati adalah hubungan tekanan gas terhadap suhu gas dalam sistem tertutup. Data hasil pengukuran tekanan gas dan suhu gas kemudian akan dianalisis sehingga diperoleh nilai suhu nol mutlak.
Penelitian ini dapat diterapkan dalam bidang pendidikan maupun bidang penelitian pada kalangan sekolah menengah atas dan perguruan tinggi.
Penelitian ini dapat digunakan untuk meningkatkan ketelitian dalam memahami persamaan yang digunakan terkait dengan Hukum Gay Lussac yang akan membawa pada pemahaman bahwa melalui pengukuran suhu gas dan tekanan gas kemudian dianalisis menggunakan persamaan diperoleh nilai suhu nol mutlak. Penelitian ini juga ingin menunjukkan adanya koreksi untuk nilai suhu dikarenakan adanya perbedaan suhu dalam sistem tertutup sehingga perlu memperhitungkan nilai suhu ruangan selama percobaan berlangsung.
Penerapan Hukum Gay Lussac tanpa memperhitungkan nilai suhu ruangan memiliki jumlah mol yang sama diseluruh sistem, sedangkan dengan memperhitungkan nilai suhu ruangan memiliki jumlah mol yang berbeda.
Penelitian ini juga relatif mudah untuk dilakukan karena alat dan bahan yang
digunakan umumnya tersedia di laboratorium dengan mempertimbangkan ruangan penelitian yang digunakan sebaiknya tertutup untuk meminimalisir input pengganggu seperti suhu dan tekanan dari luar sistem tertutup.
1.2 Rumusan Masalah
Berdasarkan latar belakang yang telah dijelaskan, maka permasalahan yang akan dikaji adalah :
1. Bagaimana cara menentukan suhu nol mutlak berdasar Hukum Gay Lussac menggunakan satu dan dua labu erlenmeyer?
2. Bagaimana pengaruh ketidakseragaman suhu dalam menentukan suhu nol mutlak berdasar Hukum Gay Lussac menggunakan satu dan dua labu erlenmeyer?
1.3 Batasan Masalah
Permasalahan yang diteliti pada penelitian ini, dibatasi pada : 1. Suhu air yang digunakan mencapai ± 100 °C.
2. Labu erlenmeyer yang digunakan berukuran 100 ml.
3. Software yang digunakan untuk menampilkan dan menganalisa data adalah Logger Pro.
4. Suhu ruangan yang digunakan adalah suhu ruangan selama proses pengambilan data penelitian.
1.4 Tujuan Penelitian
Tujuan dari penelitian ini adalah :
1. Menentukan suhu nol mutlak berdasar Hukum Gay Lussac menggunakan satu dan dua labu erlenmeyer.
2. Melihat pengaruh ketidakseragaman suhu dalam menentukan suhu nol mutlak berdasar Hukum Gay Lussac menggunakan satu dan dua labu erlenmeyer.
1.5 Manfaat Penelitian
Manfaat dari penelitian ini : 1.5.1 Bagi Peneliti
1. Menambah pengetahuan terkait metode yang dapat digunakan dalam menentukan suhu nol mutlak dan mengetahui cara menentukan suhu nol mutlak.
2. Menambah pengetahuan dalam mengoperasikan software Logger Pro yang digunakan dalam menganalisis data.
1.5.2 Bagi Pembaca
1. Menambah pengetahuan terkait metode yang dapat digunakan dalam menentukan suhu nol mutlak.
2. Menambah pengetahuan dalam mengoperasikan software Logger Pro yang digunakan dalam menganalisis data.
1.5.3 Bagi Pembelajaran Fisika
1. Meningkatkan motivasi belajar siswa dengan variasi metode dan analisis dalam pembelajaran fisika.
2. Menambah wawasan mengenai penggunaan software Logger Pro yang digunakan dalam menganalisis data.
1.6 Sistematika Penulisan BAB I Pendahuluan
Bab I menguraikan latar belakang masalah, rumusan masalah, batasan masalah, tujuan penelitian, manfaat penelitian dan sistematika penelitian.
BAB II Dasar Teori
Bab II menguraikan teori-teori yang membahas pengukuran suhu, persamaan gas ideal, suhu nol mutlak.
BAB III Metodologi Penelitian
Bab III menguraikan mengenai rangkaian alat yang digunakan dalam percobaan, prosedur pengambilan data eksperimen dan cara menganalisis data.
BAB IV Hasil dan Pembahasan
Bab IV menguraikan hasil pengolahan data dan pembahasan dari hasil eksperimen yang diperoleh.
BAB V Penutup
Bab V menguraikan kesimpulan dan saran
8
BAB 2 DASAR TEORI
2.1 Pengukuran Suhu
Tubuh manusia telah diketahui dapat menunjukkan peningkatan suhu yang tidak normal, hal ini biasanya didefinisikan sebagai demam. Sejak 400 SM, Hippocrates sudah menjelaskan bahwa tangan manusia dapat digunakan untuk mendeteksi demam. Demam erat kaitannya dengan suhu. Demikian pula suhu sangat erat kaitannya dengan instrumen untuk mengukur suhu.
Galileo (1564 – 1624) merupakan seorang ilmuwan Italia ternama yang pada tahun 1592 pertama kali melakukan pengukuran suhu. Alat ukur yang digunakannya terdiri dari sebuah bola udara yang terhubung dengan tabung panjang yang diisi dengan alkohol. Alat ini dikenal sebagai termometer Galileo, lebih akrabnya dikenal sebagai termoskop. Termoskop merupakan alat yang hanya dapat mengukur perubahan suhu, namun pengukurannya dikatakan tidak sepenuhnya akurat karena tidak disertai dengan skala numerik. Termoskop merupakan alat yang sederhana namun menjadi dasar dalam menggembangkan pembuatan termometer yang lebih baik.
Santorio Santorio yang merupakan seorang dari Italia, pada tahun 1612 menjadi penemu pertama yang menambahkan skala numerik pada termoskopnya. Termoskop tersebut digunakan dengan cara meletakkannya pada bagian mulut pasien untuk mengukur suhu. Pada tahun 1654, Grand Duke of Tuscany, Ferdinand II menemukan termometer dengan alkohol sebagai cairannya di dalam kaca. Namun alat tersebut belum dikatakan akurat karena tidak menggunakan skala standar. Kemudian Christian Huygens pada tahun 1665 menyampaikan sarannya agar termometer menggunakan standar yaitu titik leleh es dan titik didih air. Ole Christensen Roemer seorang astronom Denmark di Kopenhagen menggunakan batas ini sebagai standar termometer ini untuk mencatat cuaca.
Kemudian pada tahun 1694, Carlo Renaldini menyarankan agar batas titik leleh es dan titik didih air ditetapkan menjadi skala universal. Sedang, Isaac Newton pada tahun 1701 mengusulkan bahwa suhu 0 °C ditetapkan untuk es mencair dan skala 12 °C dapat ditetapkan untuk suhu tubuh.
Gabriel Fahrenheit seorang keturunan Jerman, pada tahun 1724 membuat skala suhu yang sampai saat ini menggunakan namanya yaitu Skala Fahrenheit. Ia membuat termometer menggunakan merkuri (memiliki koefisien muai tinggi) dengan kualitas tinggi. Skala Fahrenheit membagi titik beku dan titik didih air menjadi 180 °F. Titik beku air bernilai 32 °F dan titik didih air bernilai 212 °F. Dalam Skala Fahrenheit 0 °F didasarkan pada suhu campuran yang terdiri dari air, es, dan garam. Anders Celcius seorang astronom Swedia pada tahun 1742 menetapkan skala termometernya dengan titik beku adalah 0 °C dan titik didih adalah 100 °C. Skala ini mulai digunakan di Swedia dan Perancis yang disebut sebagai Skala Celcius. Pada tahun 1748 skala ini resmi dinamakan sebagai skala celcius. Pada tahun 1848, William Thomson (dikenal sebagai Lord Kelvin) (1824-1927) mengusulkan suhu termodinamika yang skalanya berdasarkan efisiensi mesin kalor ideal yang diusulkan pada tahun 1824 oleh Sadi Carnot. Ia menunjukkan bahwa suhu yang ditentukan melalui perhitungannya identik dengan yang ditentukan oleh hukum gas. Agar skalanya tetap kompatibel dengan skala yang sudah digunakan, ia menetapkan ukuran derajat suhu sama dengan skala Celsius.
Maka, Kelvin (dilambangkan dengan K, tanpa tanda derajat) memiliki besaran yang sama dengan derajat Celsius (Grodzinsky, 2019).
Hubungan skala suhu termometer Celcius, Fahrenheit, Kelvin, Reamur, dan Rankie dapat dinyatakan sebagai berikut,
Tk = Tc + 273 (2.1)
TF = 9
5 Tc + 32 (2.2)
TReamur = 4
5 Tc (2.3)
TRankie = TF + 460 (2.4)
konversi suhu Celcius, Fahrenheit, Kelvin, Reamur, dan Rankie juga dapat dinyatakan seperti gambar 2.1 sebagai berikut,
Gambar 2.1 Konversi Suhu Celcius, Fahrenheit, Kelvin, Reamur, dan Rankie
2.2 Persamaan Gas Ideal
Gas ideal merupakan gas yang memiliki sifat-sifat yang diasumsikan sebagai berikut,
1. Partikel gas memiliki volume yang dapat diabaikan.
2. Partikel-partikel gas tersebut berukuran sama dan tidak memiliki gaya antarmolekul (tarik-menarik atau tolak-menolak) dengan partikel gas lainnya.
3. Partikel gas bergerak secara acak sesuai dengan Hukum Gerak Newton.
4. Partikel gas memiliki tumbukan lenting sempurna tanpa kehilangan energi.
Pada kenyataannya, tidak ada gas ideal. Setiap partikel gas memiliki volume di dalam sistem walaupun dalam jumlah kecil. Selain itu, partikel gas dapat memiliki ukuran yang berbeda. Gas dalam suatu sistem memang memiliki gaya antarmolekul dengan partikel gas lainnya, terutama pada temperatur rendah dimana partikel-partikel tersebut tidak bergerak cepat dan saling berinteraksi. Meskipun partikel gas dapat bergerak secara acak, mereka
tidak memiliki tumbukan lenting sempurna karena kekekalan energi dan momentum di dalam sistem. Hukum Gas Ideal adalah persamaan sederhana yang menunjukkan hubungan antara suhu, tekanan, dan volume untuk gas.
Hubungan khusus ini berasal dari Hukum Boyle, Hukum Charles, dan Hukum Gay-Lussac (Tenny, 2021).
Robert Boyle (1627 – 1691) menyelidiki hubungan tekanan dan volume gas pada wadah tertutup pada suhu tetap. Ia menemukan bahwa hasil kali tekanan gas dan volume gas pada suhu tetap adalah konstan. Bila tekanan gas menjadi lebih besar maka volume menjadi lebih kecil dan sebaliknya. Hukum ini dikenal sebagai Hukum Boyle dapat dinyatakan :
𝑃 𝑉 = 𝑘𝑜𝑛𝑠𝑡𝑎𝑛 (2.5)
sebuah tabung berisi gas ideal pada tekanan P1 dan volume V1. Kemudian tabung gas ideal tersebut ditekan sehingga tekanannya menjadi P2 dan volumenya semakin kecil menjadi V2 dengan menjaga suhu konstan seperti yang ditunjukkan pada gambar 2.2 Percobaan Boyle (Suparno, 2009).
Gambar 2.2 Percobaan Boyle
Sehingga dari gambar 2.2 dapat dinyatakan dalam persamaan sebagai berikut.
𝑃1𝑉1 = 𝑃2 𝑉2 (2.6)
dengan,
𝑃1 = tekanan gas awal (𝑁 𝑚⁄ 2) 𝑉1 = volume gas awal (𝑚3) 𝑃2 = tekanan gas akhir (𝑁 𝑚⁄ 2) 𝑉2 = volume gas akhir (𝑚3)
Berdasarkan Hukum Boyle tersebut, digambarkan grafik tekanan dan volume gas pada suhu konstan pada gambar 2.3 sebagai berikut.
Gambar 2.3 Grafik hubungan tekanan terhadap volume pada suhu konstan
Jacques Charles (1747 – 1823) menyelidiki hubungan volume dan suhu gas bila tekanannya konstan. Ia menemukan bahwa jika suhu gas semakin besar maka volume gas semakin besar, demikian sebaliknya. Dengan tekanan gas dalam wadah tertutup dijaga konstan. Hukum ini dikenal sebagai Hukum Charles dapat dinyatakan :
𝑉
𝑇= 𝑘𝑜𝑛𝑠𝑡𝑎𝑛 (2.7)
Gambar 2.4 menunjukkan bahwa sebuah tabung dalam sistem tertutup berisi gas ideal dengan tekanan konstan P. Pada keadaan awal suhu T1
memiliki volume V1, kemudian tabung dipanaskan sampai pada suhu T2 dan volume gas ideal dalam tabung semakin besar menjadi V2.
Gambar 2.4 Percobaan Charles
Berdasarkan gambar 2.4 maka dapat dinyatakan dalam persamaan sebagai berikut
𝑉1 𝑇1 = 𝑉2
𝑇2 (2.8)
dengan,
𝑉1 = volume gas awal (𝑚3) 𝑇1 = suhu mutlak awal (K) 𝑉2 = volume gas akhir (𝑚3) 𝑇2 = suhu mutlak akhir (K)
Berdasarkan Hukum Charles tersebut, hubungan volume dan suhu gas pada tekanan konstan dalam gambar 2.5 adalah sebagai berikut.
Gambar 2.5 Grafik hubungan volume terhadap suhu pada tekanan konstan
Joseph Gay Lussac menyelidiki hubungan tekanan dan suhu gas pada volumenya konstan. Bila volume gas pada wadah tertutup dibuat konstan, maka semakin besar suhu maka tekananya juga semakin besar, demikian sebaliknya. Hukum ini dikenal sebagai Hukum Gay Lussac dapat dinyatakan:
𝑃
𝑇= 𝑘𝑜𝑛𝑠𝑡𝑎𝑛 (2.9)
pada gambar 2.6 menunjukkan sebuah tabung yang volumenya dijaga konstan dalam sistem tertutup yang berisi gas ideal dengan suhu awal T1 dan nilai tekanannya P1. Kemudian tabung dipanaskan pada suhu T2 sehingga nilai tekanannya semakin besar yaitu P2. Artinya ketika suhu dinaikan maka molekul-molekul gas semakin cepat.
Gambar 2.6 percobaan Gay Lussac
Berdasarkan gambar 2.4 maka dapat dinyatakan dalam persamaan sebagai berikut
𝑃1 𝑇1 = 𝑃2
𝑇2 (2.10)
dengan,
𝑃1 = tekanan gas awal (𝑁 𝑚⁄ 2) 𝑇1 = suhu mutlak awal (K) 𝑃2 = tekanan gas akhir (𝑁 𝑚⁄ 2) 𝑇2 = suhu mutlak akhir (K)
Berdasarkan Hukum Gay Lussac tersebut, digambarkan grafik tekanan dan suhu gas pada volume konstan pada gambar 2.7 sebagai berikut.
Gambar 2.7 Grafik hubungan tekanan terhadap suhu pada volume konstan
Hukum Boyle, Charles dan Gay Lussac ini dapat digabungkan dalam satu hubungan tunggal antara tekanan, volume, dan suhu mutlak dari gas :
𝑃𝑉 ~ 𝑇 (2.11)
melalui eksperimen yang telah dilakukan diperlihatkan bahwa pada suhu dan tekanan konstan, volume dari gas sistem tertutup meningkat sebanding dengan massa gas yang ada. Maka dapat dituliskan :
𝑃𝑉 ~ 𝑚𝑇 (2.12)
secara umum, jumlah mol dalam suatu sampel zat murni tertentu sama dengan massa sampel dalam gram dibagi massa molekul yang dispesifikasikan sebagai gram per mol :
n (mol) = massa (𝑔𝑟𝑎𝑚) massa molekul (𝑔
⁄𝑚𝑜𝑙) (2.13)
maka dapat dinyatakan sebagai berikut :
𝑃𝑉 = 𝑛𝑅𝑇 (2.14)
di mana n merepresentasikan jumlah mol dan R merupakan konstanta gas universal karena nilainya yang ditemukan melalui percobaan sama untuk semua gas. Nilai R, dalam beberapa kelompok satuan (hanya yang pertama dalam satuan SI yang tepat), adalah
𝑅 = 8,314 J/(mol · K)
= 0,0821 (L · atm)/(mol · K) = 1,99 kalori/(mol · K)
persamaan 2.14 disebut hukum gas ideal atau persamaan gas ideal. Istilah
“ideal” dapat digunakan karena gas nyata tidak mengikuti persamaan 2.14 dengan tepat, terutama pada tekanan tinggi atau ketika gas mendekati titik lebur (titik didih). Meskipun demikian, pada tekanan kurang dari 1 atm, dan ketika T tidak mendekati titik lebur gas, persamaan 2.14 cukup akurat dan dapat digunakan untuk gas nyata. Pada penerapan hukum gas ideal, suhu harus dinyatakan dalam kelvin (Giancoli, 2014).
2.3 Suhu Nol Mutlak
Pada tahun 1854, William Thomson (Lord Kelvin) mencoba mendefinisikan suhu nol mutlak berdasarkan termodinamika yaitu mesin panas ideal. Kedua suhu digunakan sebagai perbandingan panas yang diberikan dan diterima oleh suhu tersebut dalam siklus Carnot. Namun untuk keperluan eksperimental ada kesulitan menggunakan definisi tersebut karena pada kenyataannya hampir tidak ada suhu yang dapat mendekati mesin Carnot yang ideal (Chang, 2005).
Suhu nol mutlak merupakan dasar skala suhu yang dikenal sebagai skala mutlak atau skala Kelvin. Pada skala ini, suhu dikhususkan sebagai derajat Kelvin. Jarak skalanya sama dengan skala Celcius, namun titik nol dalam skala ini 0 K ditetapkan sebagai nol mutlak. Maka titik beku air 0 °C adalah
273,15 K dan titik didih air adalah 373,15 K. Semua suhu pada skala Celcius dapat diubah ke dalam skala Kelvin dengan menggunakan persamaan (2.15) sebagai berikut
T(K) = T(°C) +273,15 (2.15)
Hukum Gay Lussac menyatakan bahwa suhu dan tekanan gas berbanding lurus, pada massa dan volume konstan. Apabila suhu gas semakin tinggi maka tekanan gas akan semakin besar demikian juga sebaliknya.
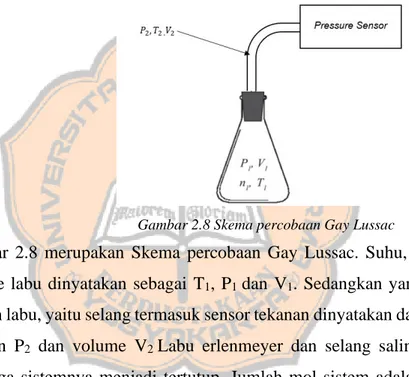
Gambar 2.8 Skema percobaan Gay Lussac
Gambar 2.8 merupakan Skema percobaan Gay Lussac. Suhu, tekanan dan volume labu dinyatakan sebagai T1, P1 dan V1. Sedangkan yang terhubung dengan labu, yaitu selang termasuk sensor tekanan dinyatakan dalam suhu T2, tekanan P2 dan volume V2 Labu erlenmeyer dan selang saling terhubung sehingga sistemnya menjadi tertutup. Jumlah mol sistem adalah n. volume sistemnya adalah volume labu erlenmeyer ditambahkan volume selang dan volume internal sensor. Sedangkan Tekanan sistemnya adalah P1 = P2 = P.
Berdasarkan persamaan gas ideal 2.14, maka dapat dinyatakan 𝑃 =𝑛 𝑅 𝑇
𝑉𝑇 (2.16)
Pada persamaan (2.16) sistemnya tertutup maka suhu sistem tersebut diasumsikan sama dengan T. Semua suhu pada skala Celcius dapat diubah ke dalam skala Kelvin dengan menambahkan 273,15 pada skala Celcius. Sesuai dengan persamaan (2.16), maka :
𝑃= 𝑛 𝑅
𝑉𝑇 (𝑇𝑐+ 𝐾) (2.17)
Untuk memudahkan menentukan nilai suhu nol mutlak, maka persamaan (2.17) dapat juga dinyatakan dalam TC terhadap P. Sehingga diperoleh 𝑇𝑐 = 𝑃
(𝑛𝑅
𝑉𝑇)− 𝐾 (2.18)
dengan,
𝑇𝑐 = Suhu labu erlenmeyer (°C) 𝑃 = Tekanan (Pa)
𝑛 = Jumlah mol (n)
𝑅 = Konstanta gas universal (8,314 J/(mol · K)) 𝑉𝑇 = Volume total sistem (m3)
𝐾 = Suhu nol mutlak (°C)
Pada persamaan (2.18) nilai n merupakan jumlah mol untuk seluruh sistem tertutup. Untuk memperoleh nilai suhu nol mutlak yang lebih akurat perlu memperhitungkan nilai n1 pada labu erlenmeyer dan nilai n2 pada selang yang terhubung dengan labu erlenmeyer. Selain itu, suhu pada selang yang terhubung juga perlu diperhitungkan. Maka persamaan (2.18) perlu dikoreksi untuk mendapatkan nilai suhu nol mutlak yang mendekati nilai teoritis.
Pada gambar 2.8 Skema percobaan Gay Lussac, suhu, tekanan dan volume labu dinyatakan sebagai T1, P1 dan V1. Sedangkan yang terhubung dengan labu, yaitu selang termasuk sensor tekanan dinyatakan dalam suhu T2, tekanan P2 dan volume V2. n1 adalah jumlah mol pada labu erlenmeyer, sedangkan n2 adalah jumlah mol pada selang. Berdasarkan hukum gas ideal pada persamaan 2.14, maka diperoleh :
P1 V1 = n1 R T1 P1 = n1 R T1
V1 (2.19)
dan
P2 V2 = n2 R T2
P2 = n2 R T2
V2 (2.20)
Labu erlenmeyer dan tekananya saling terhubung sehingga sistemnya tertutup. Maka tekanannya sama P1 = P2 = P, maka diperoleh
P1 = P2
n1 R T1
V1 = n2 R T2
V2 (2.21)
Karena sistemnya tertutup, maka jumlah mol (n), yaitu jumlah mol di dalam labu (n1) ditambahkan dengan jumlah mol dalam selang (n2).
Kemudian jumah total n, yaitu
𝑛 = n1 + n2 (2.22)
atau
n2 = 𝑛 − n1 (2.23)
Dengan mensubstitusikan persamaan (2.23) ke persamaan (2.21), maka diperoleh :
n1 R T1
V1 = (𝑛 − n1) R T2 V2 n1 = 𝑛
( T1 V2
V1 T2+1) (2.24)
Nilai n1 pada persamaan (2.24) disubstitusikan ke persamaan (2.19), sehingga diperoleh :
P = 𝑛 R T1
(T1 V2
T2 + V1) (2.25)
Untuk memudahkan menentukan nilai suhu nol mutlak, maka persamaan (2.25) dapat juga dinyatakan dalam 𝑇1 terhadap P. Sehingga diperoleh :
T1 = 𝑛 R 𝑃
V1− V2 V1
𝑃 T2
(2.26)
Jika suhu diukur dalam derajat Celcius dan K adalah perbedaan antara suhu Kelvin dan Celcius, persamaannya menjadi :
T1c+ 𝐾 = 𝑃
𝑛 R V1 − V2
V1 𝑃 T2c+ 𝐾
T1c = 𝑛 R 𝑃
V1− V2 V1
𝑃 T2c+𝐾
– 𝐾 (2.27)
dengan,
𝑇1𝑐 = Suhu labu erlenmeyer (°C) 𝑃 = Tekanan (Pa)
𝑛 = Jumlah mol (mol)
𝑅 = Konstanta gas universal (8,314 J/(mol · K)) 𝑇2𝑐 = Suhu ruangan (°C)
𝑉1 = Volume labu dipanaskan (m3) 𝑉2 = Volume selain labu dipanaskan (m3) 𝐾 = Suhu nol mutlak (°C)
Ketika menggunakan satu volume, analisis persamaan (2.18) digunakan dengan memasukkan nilai yang diketahui R dan VT. Dengan VT (Volume labu erlenmeyer, volume selang dan volume internal sensor tekanan). Untuk mengoreksi nilai suhu, analisis persamaan (2.27) digunakan dengan memasukkan nilai yang diketahui 𝑅, VT yaitu penjumlahan V1 dan V2.
dimana V1 (Volume labu erlenmeyer), V2 (volume selang dan volume sensor tekanan internal), dan T2c (Suhu ruangan) ke dalam persamaan maka akan dihasilkan nilai n (jumlah mol), dan K (suhu nol mutlak).
Ketika menggunakan dua volume, analisis persamaan (2.18) digunakan dengan memasukkan nilai yang diketahui R dan VT. Dengan VT (Volume labu erlenmeyer pertama, volume labu erlenmeyer kedua, volume selang pertama, volume selang kedua dan volume internal sensor tekanan). Untuk mengoreksi nilai suhu, analisis persamaan (2.27) digunakan dengan memasukkan nilai yang diketahui 𝑅, VT yaitu penjumlahan V1 dan V2. dimana V1 (Volume labu erlenmeyer pertama), V2 (volume labu erlenmeyer kedua, volume selang pertama, volume selang kedua dan volume internal sensor tekanan), dan T2c (Suhu ruangan) ke dalam persamaan maka akan dihasilkan nilai n (jumlah mol), dan K (suhu nol mutlak) (Kilmer, 2019).
21
BAB 3
METODOLOGI PENELITIAN
3.1 Tempat dan Waktu Penelitian
Penelitian ini merupakan jenis penelitian eksperimental yang dilakukan di ruang penelitian Laboratorium Pendidikan Fisika, Universitas Sanata Dharma, Yogyakarta.
3.2 Tahapan Penelitian
Penelitian ini bertujuan untuk menentukan suhu nol mutlak berdasar Hukum Gay Lussac pada sistem tertutup melalui pengukuran tekanan gas terhadap suhu gas menggunakan sensor suhu dan sensor tekanan. Untuk menentukan suhu nol mutlak ada beberapa tahapan yang dilakukan. Tahapan yang pertama adalah melakukan eksperimen pendahuluan, yaitu mempersiapkan alat dan bahan, mencatat suhu ruangan penelitian, dan mengukur volume labu erlenmeyer. Tahapan yang kedua adalah melaksanakan prosedur dan pengambilan data. Tahapan yang ketiga adalah menganalisis data.
3.2.1 Persiapan Alat dan Bahan
Serangkaian alat yang digunakan dalam penelitian terdiri dari beberapa komponen beserta pengertian dan fungsinya adalah sebagai berikut :
1. Komputer
Komputer merupakan perangkat digital yang digunakan untuk melakukan, menampilkan, menyimpan dan menganalisis hasil data penelitian. Aplikasi Logger Pro diinstal di dalam komputer untuk dihubungkan pada interface Lab Pro. Komputer membantu menganalisis hasil data penelitian dalam bentuk tabel dan grafik sehingga dalam penelitian ini, nilai suhu nol mutlak dapat dianalisis menggunakan persamaan Hukum Gay Lussac.
2. Labu Erlenmeyer
Labu erlenmeyer merupakan salah satu gelas laboratorium yang memiliki bentuk dengan ujung kepala yang lebih kecil, mulai melebar hingga dasarnya. Bentuknya kerucut dengan leher silinder namun dasar yang datar. Alat ini mampu bertahan dalam kondisi pemanasan suhu tinggi. Dalam penelitian ini, labu erlenmeyer berfungsi sebagai sistem tertutup.
Gambar 3.1 Labu erlenmeyer
3. Sensor tekanan
Sensor tekanan merupakan alat yang digunakan untuk mengukur perubahan tekanan. Tekanan yang dapat diukur oleh sensor tekanan adalah 0 kPa hingga 210 kPa (Vernier Software & Technology, 2016). Gas Pressure Sensor juga memiliki nilai volume internal sebesar 0,8 ml (Kennedy, 2005). Berfungsi untuk merekam variasi perubahan tekanan gas tiap waktu tertentu dan mendeteksi kebocoran yang terjadi ketika labu erlenmeyer sebagai sistem tertutup dipanaskan.
Gambar 3.2 Vernier Gas Pressure Sensor
4. Sensor suhu
Sensor suhu merupakan alat yang digunakan untuk mengukur suhu.
Surface Temperature Sensor memiliki termistor (resistor suhu sensitif) terbuka yang menghasilkan waktu respons yang sangat cepat. Desain ini memungkinkan sensor untuk digunakan di udara dan air. Suhu yang dapat diukur oleh sensor –25 °C hingga 125 °C.
Suhu maksimum yang dapat ditoleransi sensor tanpa kerusakan adalah 150 °C (Vernier Software & Technology, 2016). Berfungsi untuk mendeteksi dan merekam perubahan suhu gas tiap waktu tertentu yang terjadi dalam labu erlenmeyer sebagai sistem tertutup ketika dipanaskan.
Gambar 3.3 Surface Temperature Sensor
5. Lab Pro
Lab Pro merupakan interface yang menghubungkan sensor tekanan dan sensor suhu ke komputer. Lab Pro berfungsi untuk mentransfer
data hasil pengukuran yang dapat terlihat melalui aplikasi Logger Pro pada komputer.
Gambar 3.4 Lab Pro
6. Beaker Glass
Beaker glass merupakan salah satu alat yang digunakan untuk mengukur volume zat cair. Dalam penelitian ini, beaker glass digunakan untuk mewadahi zat cair yang dipanaskan.
Gambar 3.5 Beaker Glass
7. Pemanas listrik 10 volt
Pemanas listrik merupakan alat yang dapat mengubah energi listrik menjadi energi panas. Digunakan sebagai pemanas selama penelitian berlangsung.
Gambar 3.6 Pemanas Listrik
3.2.2 Prosedur dan Pengambilan Data
Mengukur Suhu Nol Mutlak Menggunakan Satu Labu Erlenmeyer
Langkah-langkah yang dilakukan dalam melaksanakan penelitian, diantaranya :
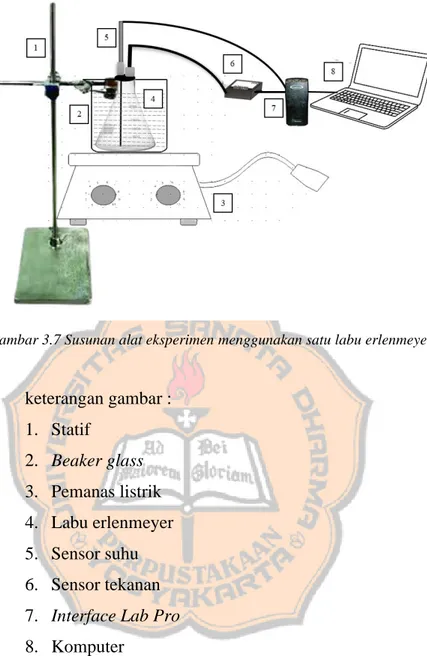
a. Mempersiapkan alat dan bahan kemudian merangkai alat dan bahan yang digunakan dalam penelitian seperti gambar 3.7 susunan alat eksperimen menggunakan satu labu erlenmeyer.
Gambar 3.7 Susunan alat eksperimen menggunakan satu labu erlenmeyer
keterangan gambar : 1. Statif
2. Beaker glass 3. Pemanas listrik 4. Labu erlenmeyer 5. Sensor suhu 6. Sensor tekanan 7. Interface Lab Pro 8. Komputer
b. Mencatat suhu ruangan ketika pengambilan data penelitian akan berlangsung.
c. Mengukur volume labu erlenmeyer dan selang yang digunakan dalam penelitian. Labu erlenmeyer yang telah diisi penuh dengan air ditekan menggunakan sumbat karet, air yang tersisa di dalam labu dapat dimasukkan ke dalam gelas ukur sehingga diperoleh volume labu tersebut. Sedangkan pada selang, air dimasukkan menggunakan jarum suntik yang langsung terhubung dengan
selang, kemudian ketika air di dalam selang sudah terisi penuh, masukkan air ke dalam gelas ukur sehingga diperoleh volume selang tersebut. Seluruh pengukuran ini dilakukan sebanyak 5 kali kemudian dicari nilai rata-rata pengukurannya.
d. Penelitian ini menggunakan labu erlenmeyer sebagai sistem tertutup yang diwadahi dengan beaker glass dan pemanas listrik 10 volt yang dirangkai sesuai Gambar 3.7. Susunan alat eksperimen menggunakan satu labu erlenmeyer. Interface Lab Pro dihubungkan pada sumber listrik dan komputer. Masing-masing sensor tekanan dan sensor suhu dihubungkan pada interface Lab Pro.
e. Memastikan bahwa setiap sambungan pada rangkaian yang sudah melekat setelah ditempelkan lem perekat sehingga sistem benar- benar tertutup.
f. Membuka aplikasi software Logger Pro pada komputer.
Memastikan bahwa interface Lab Pro sudah terkoneksi (device connected) maka tampilan pada aplikasi akan menunjukkan komputer telah terhubung dengan sensor tekanan dan sensor suhu sesuai dengan gambar. Dalam gambar, terdapat dua grafik yaitu grafik tekanan gas terhadap waktu dan grafik suhu gas terhadap waktu.
Gambar 3.8 Tampilan aplikasi software logger pro
g. Pada aplikasi software Logger Pro, waktu pengambilan data dan jumlah sampel dapat ditentukan dengan menekan icon data collection sehingga muncul tampilan sesuai gambar sebagai berikut.
Gambar 3.9 Tampilan waktu pengambilan data dan jumlah sampel
h. Labu erlenmeyer sebagai sistem tertutup dipanaskan menghasilkan perubahan suhu tiap waktu tertentu yang dideteksi oleh sensor suhu kemudian mengakibatkan adanya perubahan tekanan tiap waktu tertentu yang dideteksi oleh sensor tekanan.
i. Interface Lab Pro mentransfer data hasil pengukuran dari sensor suhu dan sensor tekanan sehingga dapat ditampilkan pada aplikasi software Logger Pro. Diperoleh dua grafik, yaitu untuk data pengukuran dari sensor suhu menunjukkan grafik hubungan suhu gas terhadap waktu. Sedangkan untuk data pengukuran dari sensor tekanan menunjukkan grafik hubungan tekanan gas terhadap waktu.
j. Grafik hubungan tekanan gas terhadap suhu gas, yang kemudian diubah menjadi hubungan suhu gas terhadap tekanan gas untuk memudahkan analisis yang dicatat dalam tabel sebagai berikut.
Tabel 3.1 Hubungan Suhu Gas (T) terhadap Tekanan Gas (P) Satu Labu Erlenmeyer
Mengukur Suhu Nol Mutlak Menggunakan Dua Labu Erlenmeyer
Langkah-langkah yang dilakukan dalam melaksanakan penelitian, diantaranya :
a. Mempersiapkan alat dan bahan kemudian merangkai alat dan bahan yang digunakan dalam penelitian seperti gambar 3.10 susunan alat eksperimen menggunakan dua labu erlenmeyer.
No Tekanan (kPa) Suhu (°𝐂)
1
2
3
4
5
6 7 8 9 10
dst.
Gambar 3.10 Susunan alat eksperimen menggunakan dua labu erlenmeyer
keterangan gambar : 1. Statif
2. Beaker Glass 3. Pemanas listrik 4. Labu erlenmeyer 5. Sensor suhu 6. Sensor tekanan 7. Interface Lab Pro 8. Komputer
9. Beaker Glass 10. Labu erlenmeyer
b. Dengan cara yang sama ulangi langkah b sampai dengan i pada percobaan menggunakan dua volume disusun seperti rangkaian pada Gambar 3.8 Susunan alat eksperimen menggunakan dua volume dengan memperhatikan tambahan volume dari menggunakan satu volume kemudian menggunakan dua volume.
c. Grafik hubungan tekanan gas terhadap suhu gas, yang kemudian diubah menjadi hubungan suhu gas terhadap tekanan gas untuk memudahkan analisis yang dicatat dalam tabel sebagai berikut.
Tabel 3.2 Hubungan Suhu Gas (T) terhadap Tekanan Gas (P) Dua Labu Erlenmeyer
3.2.3 Analisis Data
Suhu nol mutlak diperoleh melalui perhitungan dengan melihat hubungan tekanan gas terhadap suhu gas. Untuk labu erlenmeyer, pengukuran dilakukan dengan memasukkan air hingga terisi penuh kemudian menutup labu erlenmeyer menggunakan sumbat karet. Air yang tersisa dalam labu dipindahkan ke dalam gelas ukur sehingga nilai volume dapat diukur. Untuk selang, pengukuran dilakukan dengan memasukkan air menggunakan jarum suntik hingga terisi penuh kemudian air dipindahkan ke dalam gelas ukur sehingga nilai volume dapat diukur. Pengukuran dilakukan sebanyak 5 kali untuk masing-masing volume kemudian dicari nilai rata-rata pengukurannya. Dalam aplikasi Software Logger Pro, data pengukuran dihasilkan dalam bentuk grafik, yaitu grafik hubungan tekanan terhadap waktu dan grafik suhu terhadap waktu. Grafik tersebut menyatakan perubahan suhu dan tekanan setiap waktu. Dari dua grafik tersebut, dapat diperoleh grafik hubungan tekanan gas terhadap suhu gas yang dianalisis untuk memperoleh nilai suhu nol mutlak. Untuk memudahkan menganalisis data, grafik diubah ke
No Tekanan (kPa) Suhu (°𝐂)
1
2
3
4
5
6 7 8 9 10
dst.
dalam hubungan suhu gas terhadap tekanan gas. Untuk metode penelitian ini, nilai suhu nol mutlak dapat dianalisis menggunakan persamaan 2.18 dan persamaan 2.27 dari Hukum Gay Lussac.
Untuk menentukan suhu nol mutlak menggunakan satu volume, pada persamaan 2.18, nilai 𝑉𝑇 merupakan jumlah keseluruhan nilai volume yaitu penjumlahan dari volume labu erlenmeyer, volume selang, dan volume internal sensor tekanan. Pada persamaan 2.18 suhu yang diperhitungkan adalah suhu selama percobaan T1. Selain itu dapat juga dianalisis menggunakan persamaan 2.27, nilai 𝑉𝑇 merupakan penjumlahan dari V1 dan V2. Dengan V1 (volume labu erlenmeyer) dan V2 (volume selang ditambah dengan volume internal sensor tekanan). Persamaan 2.27 memperhitungkan suhu selama percobaan T1 dan suhu ruangan T2. Maka akan dihasilkan nilai n (jumlah mol), dan K (suhu nol mutlak).
Untuk menentukan suhu nol mutlak menggunakan dua volume, pada persamaan 2.18, nilai 𝑉𝑇 merupakan jumlah keseluruhan nilai volume yaitu penjumlahan dari volume labu erlenmeyer pertama, volume labu erlenmeyer kedua, volume selang pertama, volume selang kedua dan volume internal sensor tekanan. Pada persamaan 2.18 suhu yang diperhitungkan adalah suhu selama percobaan T1. Selain itu dapat juga dianalisis menggunakan persamaan 2.27, nilai 𝑉𝑇 merupakan penjumlahan dari V1 dan V2. Dengan V1 (volume labu erlenmeyer pertama) dan V2 (volume labu erlenmeyer kedua, volume selang pertama, volume selang kedua dan volume internal sensor tekanan). Persamaan 2.27 memperhitungkan suhu selama percobaan T1 dan suhu ruangan T2. Maka akan dihasilkan nilai n (jumlah mol), dan K (suhu nol mutlak).
33
BAB 4
HASIL DAN PEMBAHASAN
4.1 Hasil Penelitian
Penelitian ini bertujuan untuk menentukan suhu nol mutlak dengan melihat hubungan tekanan gas terhadap suhu gas berdasar Hukum Gay Lussac. Dengan menggunakan sensor suhu dan sensor tekanan dihasilkan dua grafik, yaitu grafik hubungan suhu gas terhadap waktu dan grafik tekanan gas terhadap waktu. Dari kedua grafik tersebut, dapat dihasilkan grafik tekanan gas terhadap suhu gas. Suhu merupakan variabel bebas yang dalam penelitian ini divariasikan kemudian tekanan merupakan variabel terikat yang berubah karena variasi suhu. Namun untuk memudahkan analisis maka grafik diubah ke dalam hubungan suhu gas terhadap tekanan gas. Metode yang diterapkan dalam percobaan menggunakan Hukum Gay Lussac. Metode tersebut dianalisis menggunakan persamaan untuk menghitung suhu nol mutlak. Persamaan (2.18) dan (2.27) digunakan untuk menyajikan dan membandingkan data dengan nilai yang sesuai secara teoritis.
Dalam melakukan penelitian, volume selang diperoleh dengan melakukan pengukuran volume sebanyak 5 kali kemudian diperoleh nilai rata-rata volume selang yang digunakan. Mengukur volume selang dilakukan dengan cara memasukkan air pada selang menggunakan jarum suntik plastik hingga air terisi penuh di dalam selang. Kemudian air tersebut dituangkan ke dalam gelas ukur dan diperoleh nilai volume selang tersebut.
Selang pertama merupakan penghubung antara labu erlenmeyer dengan sensor tekanan. Berikut merupakan hasil pengukuran volume selang yang digunakan :
Tabel 4.1 Hasil Pengukuran Volume Selang Pertama
No Volume Selang (ml)
1 4,5
2 4,5
3 4,5
4 4,5
5 4,5
Rata-rata 4,5
Mencari nilai rata-rata hasil pengukuran volume selang pertama 𝑥̅ = 𝑥1+ 𝑥2+ 𝑥3+ 𝑥4+ 𝑥5
𝑛
𝑥̅ = 4,5 + 4,5 +4,5 + 4,5 + 4,5
5
𝑥̅ = 4,5 𝑚𝑙
Mencari nilai simpangan baku hasil pengukuran volume selang pertama 𝜎 = √(𝑥̅− 𝑥1)2+ (𝑥̅− 𝑥2)2+ (𝑥̅− 𝑥3)2+ (𝑥̅− 𝑥4)2+ (𝑥̅− 𝑥5)2
𝑛−1
𝜎 = √(4,5 − 4,5 )2+ (4,5 − 4,5 )2+ (4,5 − 4,5 )2+ (4,5 − 4,5 )2+ (4,5 − 4,5 )2
5−1
𝜎 = 0
Simpangan baku rata-rata hasil pengukuran volume selang pertama 𝜎𝑚 = 𝜎
√𝑛 𝜎𝑚 = 0
√5= 0
Maka hasil pengukuran volume selang pertama adalah 𝑥 = (𝑥̅ ± 𝜎𝑚 )
𝑥 = (4,5 ± 0) 𝑚𝑙 𝑥 = (5 ± 0) 𝑚𝑙
Kemudian dengan cara yang sama dilakukan pengukuran pada selang kedua, yaitu selang yang digunakan untuk menghubungkan labu erlenmeyer pertama dan labu erlenmeyer kedua. Selain itu, sensor tekanan yang digunakan yaitu Vernier Gas Pressure Sensor juga memiliki nilai volume internal sebesar 0,8 ml (Kennedy, 2005). Berikut merupakan hasil pengukuran volume selang yang digunakan :
Tabel 4.2 Hasil Pengukuran Volume Selang Kedua
No Volume Selang (ml)
1 4
2 4
3 4
4 4
5 4
Rata-rata 4
Mencari nilai rata hasil pengukuran volume selang kedua 𝑥̅ = 𝑥1+ 𝑥2+ 𝑥3+ 𝑥4+ 𝑥5
𝑛
𝑥̅ = 4 + 4 +4 + 4 + 4
5
𝑥̅ = 4 𝑚𝑙
Mencari nilai simpangan baku hasil pengukuran volume selang kedua 𝜎 = √(𝑥̅− 𝑥1)2+ (𝑥̅− 𝑥2)2+ (𝑥̅− 𝑥3)2+ (𝑥̅− 𝑥4)2+ (𝑥̅− 𝑥5)2
𝑛−1
𝜎 = √(4 − 4 )2+ (4 − 4 )2+ (4 − 4 )2+ (4 − 4)2+ (4 − 4)2
5−1
𝜎 = 0
Simpangan baku rata-rata hasil pengukuran volume selang kedua 𝜎𝑚 = 𝜎
√𝑛 𝜎𝑚 = 0
√5= 0