C - 345
Studi Kinetika Fotoreduksi Cr(VI) terkatalisis TiO2
Rusmini1, Endang Tri Wahyuni2 1. Jurusan kimia FMIPA Unesa 2. Jurusan Kimia FMIPA UGM
Abstrak
Telah dilakukan penelitian tentang studi kinetika fotoreduksi Cr(VI) terkatalisis TiO2. Hal ini bertujuan untuk mendapatkan informasi tentang laju Cr(VI) tereduksi per satu situs aktif TiO2 tiap jam (k) dan perbandingan antara laju adsorpsi dengan laju desorpsi (K). Penelitian dilakukan dalam system batch dengan konsentrasi awal larutan Cr(VI) yaitu 0,5 ppm setiap 100 mL larutan Cr(VI) dengan pH awal 6,5, berat fotokatalis TiO2 50 mg dan diberi sinar dengan lampu UV selama 1-5 jam. Berdasarkan data hasil penelitian dan pembahasan maka dapat disimpulkan bahwa fotoreduksi Cr(VI) terkatalisis TiO2 mengikuti reaksi orde satu semu dengan harga konstanta laju reaksi (k) = 1,0687 jam -1 dan konstanta kesetimbangan reaksi (K) = 1,6677 x 106 L/mol.
Kata kunci : studi kinetika, FotoreduksiCr(VI)
PENDAHULUAN
Perkembangan industri selain menguntungkan namun secara nyata juga telah memberikan masalah besar pada lingkungan. Masalah tersebut antara lain sampah yang beracun, terkontaminasinya air, tanah dan udara. Sampah yang beracun tersebut bisa berupa sampah organik maupun sampah anorganik. Sampah organik seperti fenol, pestisida, oli dan detergen. Sampah anorganik berupa logam berat Salah satu dari logam berat itu adalah logam kromium
Logam kromium merupakan logam berat yang sulit hancur secara alami dan semakin lama akan terakumulasi serta masuk dalam rantai makanan dan dalam jumlah yang melebihi ambang batas akan menjadi toksik. Sumber utama pencemar kromium adalah dari industri logam nonbesi, pabrik baja, petrokimia, industri kertas dan pulp, penyulingan minyak, tekstil, penyamakan kulit, plating logam, kendaraan bermotor, semen, pupuk, produk asbes, cat, pewarnaan, fungisida, dan sebagainya (Radojevic’M dan Bashkin V, 1999 ).
Kromium ditemukan di lingkungan dalam tiga keadaan valensi yaitu kromium
bervalensi II (+2) kromium bervalensi III (+3), dan kromium bervalensi VI (+6). Tingkat oksidasi kromium yang stabil di alam adalah +3 dan +6. Kromium merupakan racun bagi binatang dan manusia, tetapi kurang untuk tanaman. Kedua bentuk kromium dapat memberikan efek yang berbeda pada kesehatan manusia. Cr(III) nutrisi yang esensial dibutuhkan untuk energi metabolisme glukosa, lipid dan protein. Sementara itu Cr(VI) bersifat karsinogen pada manusia. Antara lain menyebabkan iritasi, dan pada tingkat yang tinggi bisa menyebabkan bisul/borok pada kulit, iritasi pada rongga mukosa, pori-pori rongga septum, sistem gastrointestinal, serta ginjal dan hati, juga beresiko sebagai penyabab kanker paru-paru dan gangguan pernafasan. Pada binatang menunjukkan senyawa Cr(VI) dapat merusak plasenta dan kerusakan sistem saraf, kematian pada tikus dan hamster, langit-langit mulut pecah, dan ketidaknormalan embrio anak ayam yang bervariasi. Dan sebaliknya Cr(III) tidak menyebabkan kerusakan DNA walaupun dijepitkan dalam DNA (Williams, 2000; Duffus, 1997; Radojevic’M, 1999).
C - 346 Mengingat akan bahaya dari
senyawa Cr(VI) maka ambang batas yang diperbolehkan oleh Departemen Kependudukan dan Lingkungan Hidup melalui SK No 03/MENKLH/II/1991 tentang pedoman penetapan baku mutu lingkungan relatif yaitu sebesar 0,05 ppm (Anonim, 1991). Oleh karena kecilnya ambang batas ini maka keberadaan logam kromium, khususnya kromium (VI), di lingkungan perlu mendapat perhatian.
Fotoreduksi logam dengan fotokatalis semikonduktor merupakan teknologi yang relatif baru untuk menghilangkan logam terlarut dalam air limbah. Proses ini menggabungkan cahaya
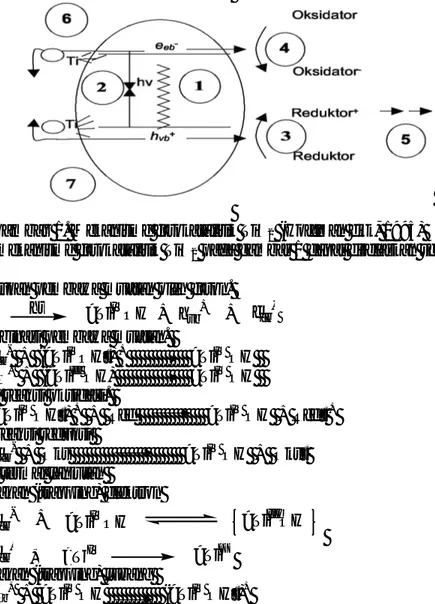
ultraviolet dengan partikel semikonduktor sebagai fotokatalis (Chen dan Ray, 2001). Salah satu jenis fotokatalis semikonduktor adalah TiO2. TiO2 ini dikenal sebagai bahan semikonduktor yang mempunyai energi celah pita (Eg) sebagai ukuran kemampuan suatu semikonduktor sebagai fotokatalis, yang tinggi, juga stabil secara kimia dan fisika, aman, serta harganya murah (Pelizetti, 1995). TiO2 juga dikenal sebagai semikonduktor tipe-n yang mudah melepaskan elektron sehingga fotokatalis ini diharapkan mampu mereduksi Cr(VI) dengan baik. Mekanisme fotokatalitik TiO2 dapat ditunjukkan pada gambar 1.
Gambar 1. Mekanisme fotokatalitik TiO2 (Hoffman dkk, 1995)
Tahapan utama mekanisme fotokatalitik TiO2 pada gambar 1 dapat dijelaskan sebagai berikut :
1.
Pembentukan pembawa muatan oleh foton.
TiO2 hv >TiIVOH + hvb+ + ecb
-2. Rekombinasi pembawa muatan.
ecb- + (>TiIVOH•) + >TiIV OH hνb+ + (>TiIII OH) >TiIV OH 3. Inisiasi reaksi oksidasi.
(>TiIV OH•) + + Red >TiIV OH + Red• + 4. Inisiasi reaksi reduksi
ecb- + Oks >TiIV OH + Oks• 5. Reaksi termal lanjutan
6. Penjebakan (trapping) elektron >TiIVOH
ecb- + >TiIIIOH
ecb- + >TiIV >TiIII
7. Penjebakan (trapping) lubang
C - 347 dengan >TiOH adalah bentuk terhidrat
dari TiO2, Red (reduktan) adalah pendonor elektron, Oks (Oksidan) adalah akseptor elektron, (>TiIV OH•) + adalah permukaan
dari penjebakan hνb+ (radikal •OH), dan (>TiIII OH) adalah permukaan dari penjebakan ecb-. (Hoffman dkk, 1995). Studi Kinetika Fotoreduksi
Cr(VI) Terkatalisis TiO2. Reaksi
fotoreduksi Cr(VI) terkatalisis TiO2 merupakan reaksi katalis heterogen unimolekuler, yaitu reaksi terkatalisis
dengan satu substrat, dimana ada perbedaan fasa antara substrat dengan katalis. Tahapan pertama di dalam reaksi katalisis adalah aktivasi reaktan dengan cara adsorpsi pada permukaan katalis .
k1 k2
Kat + A kat-A kat + hasil reaksi Laju r = k2 [kat-A] atau r = k θA
Dimana θA adalah fraksi penutupan permukaan yang merupakan rasio antara molekul reaktan terserap dengan jumlah situs aktif.
Menurut Jin et al., (1996) untuk menentukan laju adsorpsi reaksi
permukaan unimolekuler dapat menggunakan model kinetika yang diturunkan dari persamaan Langmuir dan dapat dirumuskan sebagai berikut :
ln (Co/CA) + K = k1 t Co – CA Co – CA Penerapan model kinetika tersebut pada beberapa data hasil penelitian terdahulu (Fediawati,2000; Sari, 2000; Lesbani, 2001) memberikan harga K yang bernilai negatif. Secara termodinamika hal ini tidak dimungkinkan mengingat K = e –ΔGo/RT. Oleh karena itu Santosa (2001)
mengembangkan persamaan kinetika yang diturunkan dari persamaan Langmuir tersebut yang memberikan harga K yang bernilai positif. Persamaan kinetika Langmuir yang dimodifikasi oleh Santosa (2001) dibuat berdasarkan reaksi orde 1 dan dirumuskan sebagai berikut :
[ ln (Co/Ca) ] = k t + K Ca Ca
Dengan membuat plot antara [ln (Co/Ca)]/Ca Vs t/Ca diperoleh harga slope sebagai k dan intersep sebagai K. Dalam persamaan tersebut, k adalah konstanta laju adsorpsi (menit-1); K adalah konstanta kesetimbangan adsorpsi; Ca adalah konsentrasi adsorbat dalam larutan pada saat kesetimbangan; Co adalah konsentrasi awal adsorbat; dan t adalah waktu (menit). Model kinetika usulan Santosa (2001) ini memberikan harga K dan k yang lebih realistis karena bernilai positif.
Pada reaksi fotoreduksi Cr(VI) terkatalisis TiO2 reaksi berlangsung melalui tahapan adsorpsi, reduksi dan
desorpsi. Dengan mengasumsikan bahwa semua Cr(VI) yang terserap oleh TiO2 tereduksi, maka k pada persamaan kinetika di atas adalah konstanta laju reaksi dan K adalah konstanta kesetimbangan reaksi yang dirumuskan K = k ads / k des.
Berdasarkan penelitian sebelumnya diperoleh hasil bahwa efektivitas fotoreduksi sangat dipengaruhi oleh lama penyinaran, berat fotokatalis, pH, juga konsentrasi awal dari larutan Cr(VI) itu sendiri. Fotoreduksi terbaik diperoleh dengan lama penyinaran 24 jam setiap 100 mL larutan Cr(VI) 0,5 ppm dengan berat fotokatalis 50 mg pada pH 6,5.
C - 348 Berdasarkan optimasi yang telah
diperoleh tersebut maka perlu untuk mengetahui laju fotodegradasi dari Cr(VI). Hal ini dipergunakan untuk memperkirakan seberapa cepat Cr(VI)
mampu didegradasi menggunakan sistem ini. Oleh karena itu dalam penelitian ini akan dipelajari studi kinetika fotoreduksi Cr(VI) menggunakan fotokatalis TiO2.
METODE PENELITIAN
Bahan Penelitian : Garam kristal K2Cr2O7, bubuk 1-5 difenilkarbasida, Kristal NaOH, larutan H2SO4 98 %, aseton p.a, kristal TiO2, dan aquabides.
Alat Penelitian : Alat-alat gelas laboratorium meliputi erlenmeyer, labu ukur, pipet volume, corong gelas, beker
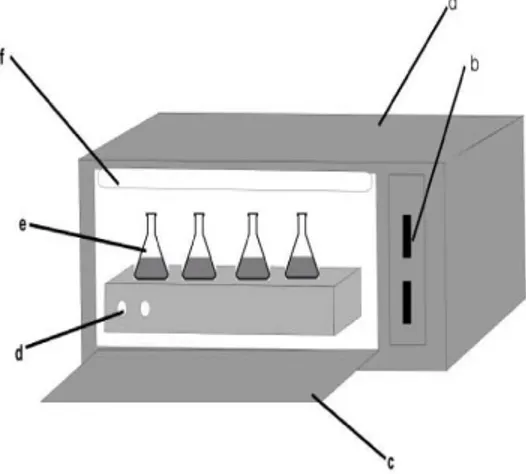
glass dan kaca arloji, reaktor yang dilengkapi dengan satu set alat pengaduk magnetik, lampu UV 40 watt merk phillip seperti pada gambar 2, pH meter OP-211, neraca analitik, Sentrifuge, Spektrofotometer UV-Vis, kertas saring Whatman 42 ashless circles 110 mm Φ. Berikut merupakan gambar dari reaktor Fotoreduksi.
Gambar 2 Reaktor fotoreduksi yang dilengkapi lampu UV Prosedur Kerja
Studi kinetika fotoreduksi Cr(VI) dilakukan dengan cara menyinari suspensi larutan Cr(VI) 0,5 ppm sebanyak 100 ml dan 50 mg TiO2 dengan lampu UV 40 watt yang disertai pengadukan selama beberapa variasi waktu tertentu (1-5 jam). Larutan hasil fotoreduksi disentrifuge dan disaring kemudian larutannya dianalisis dengan spektrofotometer UV-Vis sebagai kompleks difenilkarbasida guna penentuan konsentrasi ion Cr(VI) yang tidak tereduksi. Filtrat diukur absorbansinya menggunakan spektrofotometer UV-Vis dengan pengompleks difenilkarbasida pada panjang gelombang 540 nm, dengan
penambahan pengompleks
difenilkarbasida 0,6 mL/25 mL Cr(VI), pada pH 2 setelah dikomplekskan selama 15 menit. Langkah yang sama dilakukan pada larutan lain dengan lama penyinaran yang berbeda. Dibuat pula pengukuran terhadap satu seri larutan standar untuk membuat kurva kalibrasi. Dari absorbansi sampel diplotkan ke kurva standar maka akan diperoleh konsentrasi dari larutan sampel. Konsentrasi yang diperoleh dihitung harga ln C diplotkan dengan waktu untuk memperoleh kurva linier orde 1. Selanjutnya dibuat grafik [ln (Co/Ca)] vs t/Ca. untuk mengetahui slope dan intersepnya.
a. Kotak Tanpa celah b. Saklar
c. Jendela
d. Magnetik Stirrer
e. Erlenmeyer dan pengaduk magnet
C - 349 HASIL DAN PEMBAHASAN
Dalam penelitian ini digunakan TiO2 teknis jenis anatase sebagai fotokatalis. Diketahui ada 2 jenis TiO2 yang bisa digunakan sebagai fotokatalis yaitu anatase dan rutil, yang keduanya mempunyai fotoaktivitas yang berbeda. Dipilihnya TiO2 anatase sebagai fotokatalis karena TiO2 anatase mempunyai harga energi celah pita (Eg) 3,2 eV lebih besar daripada Eg pada TiO2 rutil 3,0 Ev. Harga Eg ini menggambarkan kemampuan suatu semikonduktor sebagai fotokatalis. Semakin besar Eg maka aktivitas fotokatalitiknya juga semakin besar.
Studi kinetika fotoreduksi Cr(VI) terkatalisis TiO2 pada penelitian ini didasarkan pada persamaan kinetika yang diturunkan dari persamaan Langmuir yang dimodifikasi oleh Santosa (2001) untuk reaksi orde 1. Persamaan kinetika tersebut dirumuskan sebagai berikut :
(ln Co/Ca) / Ca = k . t/Ca + K
Dalam penelitian ini diasumsikan semua Cr(VI) yang terserap pada permukaan TiO2 tereduksi menjadi Cr(III). Dengan demikian dalam persamaan tersebut Co adalah konsentrasi awal ion logam dalam
larutan, Ca adalah konsentrasi ion logam setelah waktu t, k adalah konstanta laju reaksi, K adalah konstanta kesetimbangan reaksi, dan t adalah waktu reaksi.
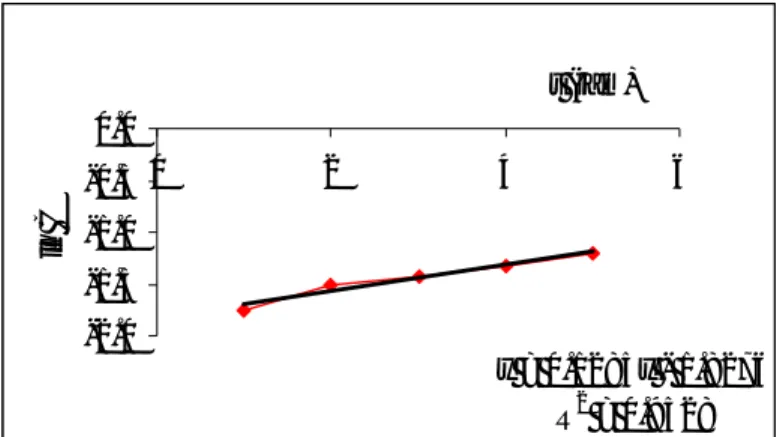
Dalam kajian ini parameter kinetika yang ditentukan antara lain harga konstanta laju reaksi (k) dan konstanta kesetimbangan reaksi (K). Karena persamaan kinetika Langmuir yang dimodifikasi oleh Santosa (2001) mengikuti reaksi orde 1, maka sebelum penentuan k dan K terlebih dahulu dibuat kurva linier untuk reaksi orde 1. Hasilnya ditunjukkan pada gambar IV.8, sedangkan hasil yang lebih lengkap disajikan sebagai lampiran 11a.
Dari gambar 3 terlihat hubungan antara t dengan ln C linier ditunjukkan dengan harga R2 = 0,9528, sehingga dapat dikatakan reaksi tersebut mengikuti reaksi orde 1. Dalam reaksi fotoreduksi Cr(VI) terkatalisis TiO2 ini reaksi yang terjadi antara Cr(VI) dengan elektron. Namun karena elektron yang tersedia sangat besar maka selama reaksi konsentrasinya dianggap konstan. Oleh karena itu laju reaksi hanya ditentukan oleh konsentrasi Cr(VI). Hal ini sesuai dengan reaksi orde satu semu atau pseudo pertama.
y = 0.1285x - 1.8276 R2 = 0.9528 -2.0 -1.5 -1.0 -0.5 0.0 0 2 4 6 t (jam) ln C
Gambar 3 Kurva linier reaksi orde 1 Untuk menentukan konstanta laju reaksi (k) dan konstanta kesetimbangan reaksi (K) maka digunakan persamaan kinetika Langmuir yang dimodifikasi oleh Santosa (2001) dengan membuat grafik
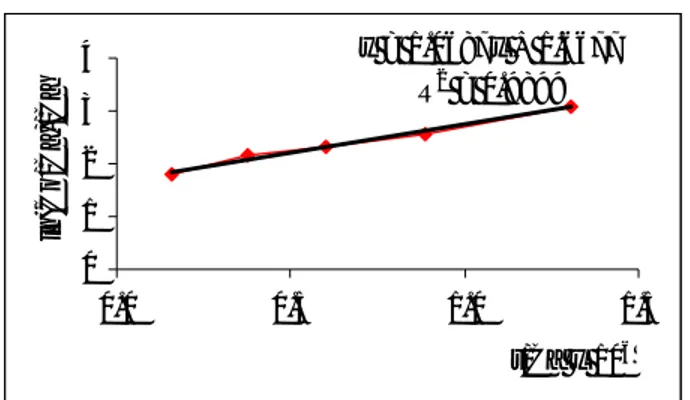
garis lurus antara [ln (Co/Ca)] vs t/Ca. Harga k dan K diperoleh masing-masing dari slop dan intersep persamaan regresi liniernya. Hasilnya ditunjukkan oleh gambar 4.
C - 350 y = 1.0687x + 1.6677 R2 = 0.9899 0 1 2 3 4 0.0 0.5 1.0 1.5 t/Ca x 106 ln (C o /C a )/ C a
Gambar 4 Kurva kinier untuk persamaan kinetika Langmuir termodifikasi
Dari gambar 4 diketahui harga konstanta laju reaksi (k) = 1,068 jam -1, dan harga konstanta kesetimbangan (K) = 1.6677 x 106 L/mol. Harga k mengindikasikan kebolehjadian jumlah Cr(VI) yang tereduksi per satu situs aktif TiO2 tiap jam sebesar 1,0687 mol atau sebesar 1,0687 x 6,02.1023 molekul Cr(VI) bereaksi dalam satu situs aktif tiap jam. Sementara itu, harga K merupakan perbandingan antara laju adsorpsi dengan laju desorpsi dan dirumuskan K = k ads/ k des. K yang diperoleh menunjukkan bahwa kecepatan adsorpsi relatif jauh lebih cepat dibandingkan kecepatan desorpsinya. Hal ini dimungkinkan karena terjadinya penjebakan (trapping) elektron pada permukaan semikonduktor. Dalam kondisi adsorpsi yang sangat kuat, maka permukaan semikonduktor akan tertutupi semua. Hal ini mengakibatkan spesies di permukaan akan sangat stabil dan sulit terdesorpsi. (Gasser, 1985)
SIMPULAN
Berdasarkan data hasil penelitian dan pembahasan maka dapat disimpulkan bahwa fotoreduksi Cr(VI) terkatalisis TiO2 mengikuti reaksi orde satu semu dengan harga konstanta laju reaksi (k) = 1,0687 jam -1 dan konstanta kesetimbangan reaksi (K) = 1,6677 x 106 L/mol.
DAFTAR PUSTAKA
Anonim, 1991, Keputusan Menteri Negara Kependudukan dan Lingkungan
Hidup, No. Kep.
03/MENKLH/1991 tentang Pedoman Penetapan Baku Mutu Lingkungan, Sekretariat Menteri Negara KLH, Jakarta
Chen, D., and Ray, A.K., 2001, Removal of Toxic Metal Ions from Wastewater by Semiconductor Photocatalysis, J. Chemical Engineering Science, 56; 1561-1570
Gasser, R.P.H., 1985, An Introduction to Chemisorption and Catalysis by Metals, Oxford University Press, New York
Gunlazuardi, Jarnuzi, 2001, Fotokatalisis pada Permukaan TiO2, Aspek Fundamental dan Aplikasinya, Prosiding Seminar Nasional Kimia Fisika II, Jurusan Kimia FMIPA, Universitas Indonesia
Hoffmann , M. R., Martin, S.T., Choi, W. and Bahnemann, D.W., 1995, Environmental Application of Semiconductor Photocatalysis, J.Chem. Rev., 95; 69-96.
Radojevic’M dan Bashkin V, 1999, Practical Environmental Analysis, The Royal Society of Chemistry, Cambridge
Rusmini, 2007, Optimasi Pengukuran Cr(VI) dengan Spektrofotometri
C - 351 Pengompleks 1,5-Difenilkarbasida,
Jurnal Penelitian Matematika dan Sains UNESA vol 14, no 1
Rusmini, 2008, Pengaruh Penambahan Fotokatalis TiO2 pada Fotoreduksi Cr(VI) menjadi Cr(III), Jurnal Penelitian Matematika dan Sains UNESA, vol 15, no 2
Rusmini, 2009, Pengaruh pH larutan pada fotoreduksi Cr(VI) terkatalisis TiO2 Jurnal Kimia Lingkungan Unair, Vol 11, no 2
Santosa, Sri Juari, 2001, Adsorption Kinetics of Cd(II) and Cr(III) on
Humic Acid, Prosiding Seminar Nasional Kimia IX, Jurusan Kimia FMIPA UGM, Yogyakarta
Smith, 1968, Semiconductors, Cambridge University Press, London
Sperling, M., Xu, S., dan Welz, B., 1992, Determination of Chromium (III) and Chromium(VI) in Water Using Flow Injection on line Preconcentration with Selective Adsorption on Activated and Flame Atomic Adsorption Spectrometric Detection, Anal. Chem. 64: 3101-3108