INFEKTIFITAS FAGE LITIK DARI
LIMBAH CAIR RUMAH TANGGA TERHADAP
Enteropathogenic Escherichia coli RESISTEN ANTIBIOTIK
RINA HIDAYATI PRATIWI
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
BOGOR
2009
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI
Dengan ini saya menyatakan bahwa tesis Infektifitas Fage Litik dari Limbah Cair Rumah Tangga terhadap Enteropathogenic Escherichia coli Resisten Antibiotik adalah karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Bogor, Agustus 2009
Rina Hidayati Pratiwi NIM P051070041
ABSTRACT
RINA HIDAYATI PRATIWI. Infectivity of Lytic Phage Isolated from Domestic Waste Water to Antibiotics Resistance Enteropathogenic Escherichia coli. Under direction of SRI BUDIARTI and IMAN RUSMANA
Diarrhea is one of the food and water borne diseases. The pediatric diarrhea cases in developing countries were mostly caused by Enteropathogenic Escherichia coli (EPEC) virotypes. Some strains of EPEC isolated from patients in Indonesia were resistant to antibiotics tetracycline and ampicilline. In order to reduce potential infection of EPEC from water, application of specific phages is an alternative solution to reduce potential infection of EPEC from water. The objective of the research was to isolate and characterize potential phages that can lyse EPEC K1.1 cells. The phages were isolated from sample of domestic waste water. All isolated phages were tested their ability to form plaques and determined the characteristics and morphology of their capsid protein. Effectiveness of phage infection and lysis impact of EPEC K1.1 cells were also observed. Four isolated phages were specific to EPEC K1.1 strain and a non pathogenic E. coli was not lysed by the phages. The phages destroyed rapidly the cells of EPEC K1.1 at 25 minutes after infection. Cell surface of EPEC K1.1 was attached by many virion (phage particles) and some of the cells was lysed. At 30 minutes after phage infection, most cells of EPEC K1.1 were lysed and cell population of EPEC K1.1 was reduced significantly after five hours of phage infection. Sodium dodecyl sulphate-polyacrylamide gel electrophoresis (SDS-PAGE) analysis showed two types of phage proteins. The proteins of FB3 and FB4 phages had molecular weights of 30-51 kDa and 35-40 kDa respectively. Electron microscope observation showed that the phages have a hexagonal head with size of 81.56 nm in width and 103.11 nm in length.
Keywords: diarrhea, Enteropathogenic Escherichia coli K1.1, bacteriophages, characterization
RINGKASAN
RINA HIDAYATI PRATIWI. Infektifitas Fage Litik dari Limbah Cair Rumah Tangga terhadap Enteropathogenic Escherichia coli Resisten Antibiotik. Dibimbing oleh SRI BUDIARTI dan IMAN RUSMANA.
Penyakit diare merupakan salah satu food borne disease dan water borne disease yang banyak menimbulkan masalah di Indonesia dan bisa menyebabkan kematian apabila tidak ditangani dengan baik. Salah satu bakteri penyebab diare yang umum ditemukan dalam tanah dan air dan dapat mencemari makanan ialah bakteri Escherichia coli Enteropatogenik (EPEC). Telah ditemukan bakteri EPEC K1.1 yang diisolasi dari anak-anak penderita diare di Depok diketahui resisten terhadap tetrasiklin dan ampisilin. Bakteri yang resisten terhadap antibiotik bila mencemari sumber air minum dan makanan dan menyebabkan diare akan menyulitkan pengobatan, sehingga diperlukan bakteriofage (fage) yang dapat melisisnya. Penelitian ini bertujuan mengetahui adanya fage litik yang mampu melisis bakteri EPEC K1.1. Hasil penelitian ini diharapkan dapat diaplikasikan sebagai biokontrol pencemaran air dan makanan.
Fage diisolasi dari limbah cair rumah tangga daerah Babakan Raya, di Darmaga Bogor. Isolat fage yang diperoleh dimurnikan dan diproduksi, ditentukan kisaran inang, dilakukan kuantifikasi, karakterisasi protein serta pengamatan morfologi pada TEM. Isolat fage yang telah dikarakterisasi diuji efektifitas dalam melisiskan sel EPEC K1.1 setiap selang waktu 5 jam selama 24 jam dan diamati morfologi lisis EPEC K1.1 oleh fage dengan SEM.
Dalam penelitian ini didapatkan 4 isolat fage yaitu FB1, FB2, FB3, dan FB4, dengan morfologi yang berbeda. Keempat fage tersebut menginfeksi EPEC K1.1 tetapi tidak menginfeksi E.coli non patogen. Berdasarkan pengamatan secara visual, ukuran dan bentuk plak yang terbentuk dari satu isolat fage tampak berbeda dengan isolat fage yang lain. Plak yang terbentuk dari suatu kultur bakteri yang ditumbuhkan di cawan petri merupakan satu parameter penting dari adanya fage pada siklus litik. Plak tersebut terlihat bening yang menandakan adanya zona kerusakan sel. Fage FB4 memiliki ukuran zona bening lebih besar dari pada ketiga isolat fage lainnya. Hal ini menandakan FB 4 memiliki kemungkinan sebagai fage infektif kuat. Kemampuan infeksi dari keempat fage menunjukkan hasil yang berbeda, FB1, 2, 3, 4 secara berurutan adalah 80; 4100; 250;16000 PFU. Dari hasil ini menunjukkan bahwa FB4 memiliki kemampuan infeksi terkuat terhadap EPEC K1.1. Penambahan FB 4 pada kultur EPEC K1.1 yang diinkubasi pada suhu 370 C selama 5 jam dapat menurunkan jumlah populasi EPEC K1.1 sebanyak 22% dan 84 % setelah inkubasi selama 24 jam. Penurunan awal terhadap jumlah sel bakteri diperkirakan merupakan akibat dari kombinasi aksi enzim polysaccharide depolymerase atau lisozim dari fage dalam mendegradasi polimer lipopolisakarida (LPS) sel EPEC K1.1 dengan proses penginfeksian terhadap suatu proporsi populasi bakteri EPEC K1.1.
Pengamatan pada SEM menunjukkan bahwa FB4 dapat memecahkan/melisiskan sel EPEC K1.1 dalam waktu 25 menit. Dalam waktu lebih lama lagi yaitu 30 menit, sel EPEC terlihat hancur. Hal ini menunjukkan bahwa FB4 secara pasti dapat melisiskan bakteri sasaran EPEC K1.1 resisten
tetrasiklin dan ampisilin. Penemuan ini merupakan titik cerah untuk pengendalian bakteri patogen pencemar makanan dan air yang ramah lingkungan. Perlu dicari konsentrasi fage yang efektif dan efisien untuk mengendalikan bakteri karena dalam proses infeksi hingga melisiskan seluruh sel bakteri perlu perbandingan yang tepat antara fage dengan bakteri. Fage yang diinfeksikan ke bakteri dikondisikan dalam siklus litik karena pada siklus litik, tahap adsorpsi, penetrasi, sintesis, dan pematangan berlangsung cepat. Pada siklus ini pula partikel fage keluar dari sel yang diserangnya dengan memecahkan sel tersebut sehingga sel inang mati (lisis).
Fage melekat ke sel yang peka rangsangan pada lokasi spesifik di dinding sel bakteri. Pada bakteri gram negatif, komponen sel yang peka rangsangan ialah protein dan lipopolisakarida yang melapisi lapisan selaput sebelah luar termasuk peptidoglikan. Fage tertentu atau sekelompok fage akan melekat ke reseptor spesifik, dan fage berbeda akan melekat ke reseptor yang berbeda. Beberapa bagian struktural bakteri seperti flagela, pilus, kapsul, teichoicacid, dan LPS dapat menyediakan reseptor spesifik pada bakteri tertentu. Spesifisitas isolat fage yang diperoleh terhadap EPEC K1.1 menunjukkan dugaan bahwa di permukaan sel EPEC K1.1 memiliki reseptor-reseptor yang spesifik terhadap fage.
Protein yang dimiliki oleh keempat isolat fage ini cenderung kecil. Dalam tiap mililiternya, FB1 hanya memiliki 97,5 µg; FB2 82,5 µg; FB3 170 µg; dan FB4 222,5 µg. Setelah dilihat pada SDS-PAGE, terdapat 2 isolat fage (FB3 dan FB4) yang menunjukkan adanya pita protein. Kisaran protein yang diperoleh antara 30-51 kDa. Konsentrasi protein yang cenderung lebih kecil diduga disebabkan oleh mudahnya protein fage terdegradasi oleh protease ekstraselular yang dimiliki sel EPEC K1.1.
Berdasarkan karakteristik isolat FB4 seperti dari ukuran lisisan yang lebih besar; kemampuan dalam menginfeksi sel EPEC K1.1 yang lebih baik; serta lebih tingginya konsentrasi protein FB4 diantara ketiga isolat fage yang lain, maka selanjutnya FB4 diidentifikasi dengan analisis morfologi fage dan pengaruh serta efektifitas fage FB4 dalam melisis sel EPEC K1.1. Analisis morfologi dengan menggunakan TEM pada FB4 menunjukkan morfologi kepala fage yang besar dan berbentuk heksagonal ikosahedral. Lebar kepala fage sebesar 81.56 nm dan panjangnya sebesar 103.11 nm.
Berdasarkan hasil penelitian dapat disimpulkan bahwa ada empat isolat fage dari sampel limbah cair rumah tangga yang spesifik terhadap EPEC K1.1. Fage FB4 merupakan fage yang paling kuat menginfeksi EPEC K1.1, memiliki berat molekul protein sebesar 40.2 kDa dan 35.8 kDa, morfologi kepala berbentuk heksagonal ikosahedral, dapat melisis sel EPEC K1.1 pada 25 menit pertama, serta dapat menurunkan populasi EPEC K1.1 setelah 1 jam dan semakin tampak menurun setelah 5 jam berikutnya.
Kata kunci: diare, Escherichia coli Enteropatogenik (EPEC) K1.1, bakteriofage, karakterisasi.
© Hak Cipta milik IPB, tahun 2009
Hak Cipta dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan yang wajar IPB
Dilarang mengumumkan dan memperbanyak sebagian atau seluruh Karya tulis dalam bentuk apa pun tanpa izin IPB
INFEKTIFITAS FAGE LITIK DARI
LIMBAH CAIR RUMAH TANGGA TERHADAP
Enteropathogenic Escherichia coli RESISTEN ANTIBIOTIK
RINA HIDAYATI PRATIWI
Tesis
sebagai salah satu syarat untuk memperoleh gelar
Magister Sains pada
Program Studi Bioteknologi
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
BOGOR
2009
Judul Tesis : Infektifitas Fage Litik dari Limbah Cair Rumah Tangga terhadap Enteropathogenic Escherichia coli Resisten Antibiotik
Nama : Rina Hidayati Pratiwi NIM : P051070041
Disetujui Komisi Pembimbing
Dr. dr. Sri Budiarti Dr. Ir. Iman Rusmana
Ketua Anggota
Diketahui
Ketua Program Studi Dekan Sekolah Pascasarjana Bioteknologi
Dr. Ir. Muhammad Jusuf Prof. Dr. Ir. Khairil A. Notodiputro, M.S
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah SWT atas segala karunia-Nya sehingga karya ilmiah ini berhasil diselesaikan. Judul yang dipilih dalam penelitian yang dilaksanakan sejak bulan Juli 2008 hingga Juni 2009 ini ialah Infektifitas Fage Litik dari Limbah Cair Rumah Tangga terhadap Enteropathogenic Escherichia coli Resisten Antibiotik. Judul ini dipilih karena EPEC K1.1 merupakan bakteri yang resisten terhadap antibiotic, penyebab diare, yang mekanisme penyebarannya secara water borne dan food borne, sehingga diperlukan alternatif pencarian fage yang infektif dan ramah lingkungan untuk digunakan sebagai biokontrol pencemaran air dan makanan.
Ucapan terima kasih penulis sampaikan kepada:
1. Ibu Dr. dr. Sri Budiarti; selaku ketua komisi pembimbing, yang telah banyak memberikan bimbingan, saran, nasihat, masukan, arahan, dan dana penelitian. 2. Bapak Dr. Ir. Iman Rusmana; selaku anggota komisi pembimbing, yang telah memberikan bimbingan, arahan, masukan, dan sebagian bahan penelitian. 3. Ibu Dr. Anja Meryandini, MS; selaku penguji di luar komisi pembimbing, yang telah memberikan bimbingan, masukan, dan penyempatan waktunya. 4. Bapak Dr. Ir. Muhammad Jusuf selaku ketua program studi atas diizinkannya penelitian di Laboratorium Bioteknologi Hewan dan Biomedis, PPSHB, IPB, Darmaga.
5. Bapak Prof. Dr. Ir. M. Zairin Junior, M.Sc; selaku Direktur Program Diploma IPB yang telah memberikan kesempatan dan rekomendasi kepada penulis untuk melanjutkan studi ke Sekolah Pascasarjana IPB.
6. DIKTI melalui DIPA-IPB yang telah memberikan beasiswa kepada penulis selama menempuh pendidikan di Sekolah Pascasarjana IPB.
7. Mbak Dewi; selaku teknisi di laboratorium Bioteknologi Hewan dan Biomedis, PPSHB IPB Darmaga.
8. Ibu Dr. Endang; selaku peneliti di laboratorium SEM, LIPI Cibinong. 9. Rusdi; selaku asisten peneliti di laboratorium TEM dan Histologi, Lembaga Eijkman.
10. Teman-teman satu program studi, beda program studi, dan satu tempat penelitian yang tidak bisa disebutkan satu-persatu.
Selaksa cinta dan terima kasih penulis persembahkan untuk ibu, bapak, kakak, adik atas perhatian, dukungan, dan doa yang senantiasa diberikan; orang tua angkatku Bapak Dr. Ir. Tri Heru Widarto, M.Sc atas doanya; serta semua pihak yang turut membantu dan mendukung atas terlaksananya penelitian dan studi penulis.
Semoga karya ilmiah ini bermanfaat.
Bogor, Agustus 2009
RIWAYAT HIDUP
Penulis dilahirkan di Jakarta pada tanggal 20 Januari 1982 sebagai anak kedua dari pasangan Muchtar Ichwan dan T. Pudjias Tuti. Pendidikan sarjana ditempuh di Program Studi Biologi, Fakultas Matematika dan Ilmu Pengetahuan Alam IPB, lulus pada tahun 2003. Pada tahun 2007, penulis diterima di Program Studi Bioteknologi pada Program Pascasarjana IPB. Beasiswa Program Pasca Sarjana (BPPS) diperoleh dari Ditjen DIKTI.
DAFTAR ISI
Halaman
DAFTAR TABEL ... vi
DAFTAR GAMBAR .. ... vii
DAFTAR LAMPIRAN ... viii
1 PENDAHULUAN ... 1 1.1 Latar Belakang ... 1 1.2 Tujuan Penelitian ... 2 1.3 Manfaat Penelitian ... 3 2 TINJAUAN PUSTAKA ... 4 2.1 Penyakit Diare ... 4 2.2 Karakteristik EPEC ... 5 2.3 Karakteristik Fage ... 7
2.4 Penelitian dan Aplikasi Fage ... 11
3 METODE ... 13
3.1 Metode Penelitian ... 13
3.2 Waktu dan Tempat ... 13
3.3 Bahan dan Alat ... 14
3.4 Peremajaan Isolat ... 14
3.5 Isolasi dan Purifikasi Fage ... 14
3.6 Penentuan Kisaran Inang Fage ... 16
3.7 Kuantifikasi Fage (Penentuan PFU) ... 16
3.8 Karakterisasi Fage Hasil Isolasi ... 17
3.9 Pengamatan Morfologi Fage dengan TEM ... 18
4.0 Efektifitas Lisis Sel EPEC K1.1 oleh Fage ... 18
4 HASIL DAN PEMBAHASAN ... 20
4.1 Hasil ... 20
4.2 Pembahasan ... 27
5 SIMPULAN DAN SARAN ... 35
5.1 Simpulan ... 35
5.2 Saran ... 35
DAFTAR PUSTAKA ... 36
DAFTAR TABEL
Halaman
1 Hasil kuantifikasi dari keempat isolat fage ... 22 2 Konsentrasi protein keempat isolat fage ... 22
DAFTAR GAMBAR
Halaman
1 Diagram alir tahapan metode penelitian ... 13
2 Pola keragaman plak fage ... 20
3 Kisaran inang fage ... 21
4 Kisaran berat molekul protein fage pada SDS-PAGE ... 23
5 Morfologi fage FB4 ... 23
6 Kurva efektifitas lisis sel EPEC K1.1 oleh FB4 ... 24
7 Morfologi kerusakan EPEC K1.1 karena infeksi FB4 selama 25 menit ... 25
8 Morfologi kerusakan EPEC K1.1 karena infeksi FB4 selama 30 menit ... 26
DAFTAR LAMPIRAN
Halaman
1 Pembuatan pereaksi Bradford untuk pengukuran konsentrasi protein ... 43
2 Komposisi bahan untuk membuat gel pengumpul dan gel pemisah ... 43
3 Komposisi larutan stok SDS-PAGE ... 44
4 Prosedur pewarnaan perak ... 45
PENDAHULUAN
Latar Belakang
Penyakit diare merupakan salah satu food borne disease dan water borne disease (Salyers & Whitt 1994) yang banyak menimbulkan masalah kesehatan di Indonesia dan bisa menyebabkan kematian apabila tidak ditangani dengan baik. Mekanisme penyebaran food borne disease dan water borne disease terjadi akibat patogen penyebab penyakit berada dalam makanan dan air yang telah tercemar sehingga dapat menyebabkan penyakit infeksi bila terminum atau termakan oleh manusia atau hewan. Salah satu bakteri penyebab diare yang umum ditemukan dalam tanah dan air dan dapat mencemari makanan ialah bakteri Escherichia coli Enteropatogenik (EPEC) (Jay 1978; Jay et al. 2005).
Di Indonesia, bakteri EPEC terdapat 55% pada sampel feses bayi dan anak-anak penderita diare yang tercuplik di daerah Purwodadi Jawa Tengah, Depok, Ciamis, dan Ciawi Jawa Barat serta Sambas Kalimantan Barat (Budiarti 1997). Diantara galur EPEC yang diisolasi, terdapat EPEC K1.1 yang memiliki serotipe O142, melekat pada sel HEp-2. Studi selanjutnya dilaporkan bahwa EPEC K1.1 menghasilkan protease ekstraseluler dan mampu mendegradasi musin (Budiarti dan Mubarik 2006). Bakteri EPEC K1.1 bersifat resisten terhadap tetrasiklin dan ampisilin (Budiarti 1998). Beberapa bakteri EPEC yang resisten terhadap antibiotik dapat mencemari sumber air minum dan makanan sehingga diperlukan pencarian biokontrol yang ramah lingkungan untuk mengatasi pencemaran air dan makanan.
Fage litik memberikan suatu metode alami dan non toksik untuk mereduksi dan mengontrol pertumbuhan bakteri patogen manusia karena fage adalah bagian dari gastrointestinal dan ekosistem lingkungan (Ackermann & Dubow 1987). Fage dapat diambil dari limbah, tinja, tanah, air, jaringan tubuh yang terserang penyakit, atau produk dari pabrik susu. Berdasarkan penelitian Ogunseitan et al. (1992), fage yang sangat umum di lingkungan dengan konsentrasi besar telah terdeteksi berada di sampel limbah cairan, yaitu sebesar 3.16 x 106 fage dalam 1 ml air. Menurut Travis (2008) dalam Curious Cat Science and Engineering Blog, rata-rata terdapat 50 juta virus dalam tiap milliliter air
limbah. Penemuan yang telah dilakukan puluhan tahun yang lalu menunjukkan bahwa jumlah virus sangat berlimpah di dalam lingkungan alami perairan sehingga pengisolasian fage dalam penelitian ini dilakukan pada lingkungan perairan terutama pada limbah. Sumber fage yang paling baik dan paling umum ialah habitat inang (Pelczar & Chan 1988). Limbah merupakan habitat bakteri fekal (coliform) dan diduga di dalam limbah juga banyak mengandung kolifage atau galur fage bakteri koliform yang berbeda.
Aplikasi fage terhadap biokontrol pencemaran makanan diantaranya fage spesifik E. coli O157 yang diberikan pada daging (Kudva et al. 1999; Flynn et al. 2004), fage spesifik Salmonella dan Campylobacter yang diberikan pada ayam (Goode et al. 2003), fage spesifik Yersinia enterocolitica yang diberikan pada babi (Skurnik 1984; Strauch et al. 2001a), fage spesifik Lactococcus garviae dan Pseudomonas plecoglossicida yang diberikan pada ikan (Park & Nakai 2003; Park et al. 2000). Sedangkan terhadap sanitasi air, secara in vivo di Bangladesh telah diaplikasikan fage spesifik E . coli patogen dalam bentuk tablet pada air minum (Ochman & Selander 1984).
Penggunaan fage litik sebagai agen biokontrol bakteri Listeria monocytogenes penyebab penyakit Listeriosis telah diaplikasikan di sejumlah negara seperti di Netherland, Eropa, dan di Amerika Serikat. Fage di negara tersebut digunakan pada produk makanan keju dan daging kemudian berlanjut produk daging unggas, ikan dan mentega (Carlton et al. 2005). Fage spesifik Listeria monocytogenes sudah ditemukan sejak tahun 2004 dan mulai digunakan serta dikeluarkan produknya oleh Exponential Biotherapies Incorporated (EBI) Food Safety pada bulan Juli 2006 dengan nama LISTEXTM P100 (Hagens & Offerhaus 2008). Selanjutnya pada tahun 2006, FDA dan USDA telah mengizinkan penggunaan produk fage LISTEXTM P100 terhadap produk makanan daging dan unggas yang terkontaminasi Listeria monocytogenes dan penggunaan fage pada kulit ternak yang terkontaminasi Salmonella (Fortuna et al. 2008).
Tujuan Penelitian
Tujuan dari penelitian ini ialah mengetahui adanya fage litik dari limbah cair rumah tangga yang mampu melisis bakteri EPEC K1.1.
Manfaat Penelitian
Hasil penelitian ini diharapkan dapat diaplikasikan sebagai biokontrol pencemaran air dan makanan sehingga dapat mencegah penyakit diare (water borne dan food borne disease).
TINJAUAN PUSTAKA
Penyakit Diare
Diare atau gastroenteritis adalah suatu masalah kesehatan di masyarakat dari keadaan tidak sehat dan dapat menyebabkan kematian apabila tidak ditangani dengan serius. Dari hasil analisis penelitian Irianto (2000), dapat diketahui bahwa rentang frekuensi diare adalah tiga hingga delapan kali dengan rata-rata 4.33 kali selama sehari semalam. Kematian akibat diare umumnya disebabkan oleh mencret yang terjadi tak berkesudahan sehingga penderita kehilangan cairan dan elektrolit dalam tubuh yang menyebabkan dehidrasi. Tingkat keparahan diare diantaranya ditunjukkan dari tingginya frekuensi mencret dalam satu hari. Ketepatan perkiraan tingkat keparahan yang akan terjadi pada penderita sangat menolong dalam upaya program pencegahan yang akan dilakukan.
Diare dipengaruhi oleh faktor-faktor seperti pendidikan para ibu, jabatan/ kedudukan, kesehatan pribadi, sanitasi lingkungan, dan status gizi anak-anak di bawah usia lima tahun atau lebih (Amhira 2004). Berdasarkan hasil analisis multivariat penelitian Waraouw (2002), faktor resiko keluhan diare seperti penghuni rumah yang berlokasi di daerah rawan banjir sebesar 1:43 kali (95% CI:1.15-1.79), kondisi fisik rumah tidak baik sebesar 1.23 kali (95% CI:1.03-1.46) dan jumlah balita lebih dari 1 sebesar 0.83 kali (95% CI:0.071-0.98).
Definisi resmi dari medis tentang diare adalah defekasi yang melebihi 200 gram per hari. Hal ini terjadi ketika cairan yang tidak mencukupi diserap oleh usus besar. Sebagai akibat dari proses digesti atau karena masukan cairan yang berlebihan sehingga membuat makanan yang dicerna terdiri atas banyak cairan sebelum mencapai usus besar. Usus besar menyerap air lalu meninggalkan material yang lain sebagai kotoran yang setengah padat. Bila usus besar rusak atau "inflame", penyerapan tidak terjadi dan hasilnya adalah kotoran yang berair atau diare (http://id.wikipedia.org/wiki/Diare). Gangguan bakteri dan parasit kadang-kadang menyebabkan tinja mengandung darah dan penderita merasakan demam tinggi.
Karakteristik EPEC
Escherichia coli Enteropatogenik (EPEC) termasuk dalam kelompok enterobacteriaceae, bersifat gram-negatif, anaerobik-fakultatif, bentuk sel batang, menghasilkan protease ekstraselular, tidak membentuk spora, metabolisme fermentatif, dan motil dengan flagella peritrikus (Pelczar & Chan 1988). Escherichia coli tersebar luas di alam sebagai parasit intestinal dan flora normal dalam mamalia dan burung. Galur-galur tertentu yang patogen jika menginfeksi manusia dan hewan maka dapat menimbulkan infeksi septikimia dan diare (Greenwood et al. 1995).
Bakteri EPEC termasuk dalam famili Enterobacteriaceae dengan habitat alami di dalam saluran pencernaan manusia dan hewan berdarah panas (Nataro & Kaper 1998). Bakteri ini merupakan salah satu dari enam virotipe E. coli yang dapat menyebabkan diare. Istilah Escherichia coli Enteropatogenik dikemukakan oleh Neter pada tahun 1950-an berdasarkan pada uji serotipe. Serotipe penting E. coli yang termasuk ke dalam EPEC ialah O26, O55, O86, O111, O119, O125, O126, O127, O128ab, dan O142 (Levine 1987). Bakteri gram negatif ini berbentuk batang, bersifat anaerob fakultatif dengan ukuran lebar 1.1 - 1.5 µm dan panjang 2.0 - 6.0 µm, motil dengan flagela peritrikus. Berdasarkan Bergey’s Manual of Determinative Bacteriology (1974) ciri biokimia dari bakteri ini ialah: memiliki kemampuan memfermentasi laktosa; dapat menghidrolisis asam amino triptofan menjadi indol dan asam piruvat melalui kerja enzim triptofanase; dapat memfermentasi glukosa dan menghasilkan banyak sekali asam laktat, asetat, suksinat, dan format disamping CO2, H2, dan etanol; tidak dapat membentuk 2,3-butanadiol dari reaksi VP (Voges-Proskauer), dan tidak dapat menggunakan sitrat sebagai sumber karbon satu-satunya. Pada media EMB (Eosin Methylene Blue) bakteri ini menunjukkan warna hijau metalik (kilap logam).
Kemampuan suatu bakteri patogen untuk menyebabkan infeksi dipengaruhi oleh faktor virulensi yang dimilikinya. Faktor virulensi merupakan kemampuan yang dimiliki oleh bakteri untuk dapat bertindak sebagai bakteri patogen (Inglis 1996). Faktor virulensi diklasifikasikan menjadi dua, yaitu: faktor virulensi yang memungkinkan bakteri untuk berkolonisasi, seperti pili; flagela;
motilitas dan kemotaksis; protease ekstraseluler; serta faktor virulensi yang mengakibatkan kerusakan pada inang diantaranya eksotoksin dan endotoksin (Levine et al. 1985). Faktor virulensi yang terlibat dalam patogenisitas EPEC meliputi adhesin (Hicks et al. 1998), intimin (Kenny et al. 1997), protein-protein sekresi (Esp) (Jarvis et al. 1995), dan bundle-forming pili (bfp) (Giron et al. 1991). Bakteri EPEC membutuhkan plasmid-borne bundle forming pili (bfp) tipe IV untuk pelekatan dan autoagglutinasi (Jay et al. 2005).
Patogenesis EPEC terdiri atas tiga tahap, tahap pertama yaitu non intimate binding yang diperantarai pili (bfp); tahap kedua, adhesi bakteri pada sel inang mencetuskan tranduksi sinyal, yang berhubungan dengan aktivasi kinase tirosin sel inang dan menyebabkan kenaikan level Ca2+ intraseluler sel inang; tahap ketiga, yaitu intimate binding dan actin rearrangement yang ekstensif di sekitar bakteri. Pada banyak penderita, apabila dilihat dengan mikroskop elektron, EPEC melekat erat dengan permukaan mukosa dan sebagian dikelilingi oleh pedestals (attaching and effacing) pada permukaan enterosit. Pada area perlekatan EPEC tersebut brush border mikrovili sel-sel mukosa menjadi hilang. Fungsi absorbsi pada sel-sel mukosa menjadi rusak sehingga akan terjadi diare (Knutton et al. 1987).
Galur EPEC bersifat patogenik (yang berarti mereka dapat menyebabkan penyakit dalam usus kecil dan usus besar). EPEC menyerang dan membuat radang lapisan dari usus kecil dan usus besar, selanjutnya membentuk luka dan menghancurkan mikrofili saluran pencernaan (Donnenberg & Whittam 2001). Penyakit ini dicirikan oleh diare tanpa darah atau lendir, muntah yang berlanjut dengan dehidrasi yang akibatnya menimbulkan kematian (Farmer III et al. 1987). EPEC menyebabkan diare berair atau berdarah. Diare berair umumnya disebabkan oleh perlekatan bakteri dan perubahan integritas usus secara fisik. Diare berdarah disebabkan oleh perlekatan bakteri dan proses perusakan jaringan yang akut, mungkin disebabkan oleh racun yang mirip dengan racun Shigella dysenteriae, yang disebut juga verotoxin.
Banyak faktor risiko yang diduga menyebabkan terjadinya penyakit diare pada bayi dan balita di Indonesia. Salah satu faktor risiko yang sering diteliti adalah faktor lingkungan yang meliputi sarana air bersih (SAB), sanitasi, jamban,
saluran pembuangan air limbah (SPAL), kualitas bakteriologis air, dan kondisi rumah. Sanitasi yang buruk merupakan penyebab banyaknya kontaminasi bakteri E. coli patogenik dalam air bersih yang dikonsumsi masyarakat. Bakteri E. coli mengindikasikan adanya pencemaran tinja manusia. Kontaminasi bakteri E. coli terjadi pada air tanah yang biasanya banyak disedot oleh penduduk di perkotaan (Adisasmito 2007).
Air merupakan suatu vektor transmisi bagi mikroorganisme dalam melakukan penyebaran penyakit. Berdasarkan hasil uji mikrobiologis, air yang digunakan untuk minum banyak menunjukkan terkontaminasi bakteri fekal. Kualitas air minum dapat dijadikan suatu standar minimal untuk air yang digunakan dalam makanan sehingga air yang telah tercemar bakteri patogen dapat mempengaruhi kualitas suatu makanan (Pawsey 2002).
Bakteri EPEC biasanya diperoleh dengan meminum air yang tercemar atau memakan makanan-makanan yang tercemar seperti sayur-sayuran, unggas, dan produk-produk susu. Air adalah media yang mempunyai resiko cukup besar terjadinya penyakit bawaan air (water borne disease) dan penyakit bawaan makanan (food borne disease). Pengolahan air harus dilakukan sebagai upaya pemutus rantai penularan penyakit khususnya yang dibawa oleh air. Makanan yang sering menjadi penyebab kasus EPEC yaitu daging sapi dan ayam mentah, namun semua makanan yang terpapar pada kontaminasi kotoran dapat sangat dicurigai terkontaminasi EPEC (http://www.cfsan.fda.gov/~mow/intro.html).
Karakteristik Fage
Bakteriofage disebut juga dengan fage, ditemukan secara terpisah oleh Frederick W. Twort di Inggris pada tahun 1915 dan Felix d’Herelle dari Pasteur Institute pada tahun 1917. Twort melihat bahwa koloni bakteri kadangkala mengalami lisis; sifat ini dapat ditularkan dari satu koloni ke koloni lainnya. Filtrat koloni yang diencerkan dan difiltrasi dengan membran filter tetap saja melisiskan koloni. Namun, bila filtrat ini dipanaskan kemampuan melisiskan ini hilang. Dari berbagai ciri ini Twort berkesimpulan bahwa agen penyebab lisis ialah virus. D’Herelle menemukan hal yang sama pada tahun 1917, sehingga diberi nama fenomena Twort-d’ Herelle (Pelczar & Chan 1988).
Fage merupakan parasit obligat intraselular yang dapat menggandakan diri di dalam bakteri dengan menggunakan beberapa atau semua mesin biosintetik sel inang. Fage juga secara metabolisme tak berdaya dan hanya dapat bereproduksi setelah menginfeksi sel inang bakteri yang cocok. Bakteriofage bersifat sangat spesifik dan tidak bersifat toksik terhadap binatang dan tumbuhan. Seperti pada virus umumnya, bakteriofage mengandung asam nukleat DNA berantai tunggal atau ganda dan RNA berantai tunggal yang diliputi selubung protein atau kapsid. Kapsid terdiri atas subunit kapsomer, sedangkan kapsomer terdiri atas subunit protomer. Fage T-genap terdiri atas kepala dan ekor. Kepala mengandung DNA disertai poliamina, protein internal, dan peptida yang sederhana. Bagian ekor terdiri atas tabung heliks yang dilalui DNA fage sewaktu proses infeksi. Tabung ini dilapisi selaput yang dapat berkontraksi. Bagian dasar tabung dihubungkan dengan lempeng dasar berbentuk heksagonal. Sudut lempeng dasar ini memiliki struktur paku ekor pada sudutnya yang dihubungkan dengan serabut ekor. Struktur ini merupakan alat untuk melekatkan diri pada dinding sel inang.
Fage khususnya kolifage dianggap merupakan indikator polusi karena sifat daya tahan virus di dalam air dan air limbah. Suatu indikator E. coli yang membawa plasmid faktor F digunakan sebagai inang. Hasilnya menunjukkan sejumlah kolifage pada makanan dapat ditentukan dalam 16 jam pengujian dan bahwa kolifage memberikan metode yang cepat dalam menandakan adanya kontaminasi fekal pada makanan (Melnick 1984 dalam Pierson & Stern 1986).
Fage mempunyai 2 bentuk yaitu kubus atau heliks. Bentuk kubus ini terlihat sebagai polihedra, sedangkan bentuk heliks terlihat sebagai batang. Fage polihedral berbentuk ikosahedral yang berarti bahwa kapsid memiliki 20 bidang permukaan berbentuk segitiga. Bila unit kapsomer pada kapsid dikelilingi oleh 5 kapsid lainnya, maka bentuk ini disebut penton. Pada fage berbentuk batang, kapsomer ditata sebagai heliks dan bukan sebagai tumpukan cincin.
Fage berdasarkan sistem klasifikasi dari the International Committee on Taxonomy of Viruses (ICTVdB Index of Viruses 2000), dimasukkan dalam kelompok/ ordo I, yaitu Caudovirales dengan ciri fage yang memiliki DNA double-strand dan berekor. Jika fage tersebut berekor kontraktil maka dimasukkan
ke dalam famili Myoviridae, jika fage tersebut berekor pendek maka dimasukkan ke dalam famili Podoviridae, dan jika fage tersebut berekor seperti tabung yang meruncing maka dimasukkan ke dalam famili Siphoviridae.
Fage merupakan virus yang menginfeksi bakteri, memiliki 2 tipe yaitu litik dan lisogenik. Cara reproduksi bakteriofage litik terdiri atas 5 tahap, yaitu tahap adsorpsi, tahap penetrasi, tahap sintesis, tahap pematangan, dan tahap lisis. Bila fage litik menginfeksi sel bakteri maka fage akan bereplikasi di dalam sel inang membentuk sejumlah fage baru kemudian akan membuat sel inang pecah dan akan menginfeksi sel inang lainnya (Tortora et al. 2006).
Pada tahap adsorpsi, ujung ekor melekat pada sel melalui reseptor khusus pada permukaan sel. Proses perlekatan ini bersifat spesifik yang berarti bahwa reseptor dan fage bersifat sebagai pasangan. Reseptor dapat berupa lipopolisakarida, flagela, pili, karbohidrat, atau protein membran dinding sel. Proses infeksi hanya dapat terjadi bila ada adsorpsi. Bila bakteri kehilangan kemampuannya untuk mensintesis reseptor, maka fage tidak dapat melekatkan dirinya, sehingga bakteri menjadi resisten terhadap infeksi fage. Adsorpsi pada tahap awal bersifat ’dapat balik’ yang berarti bahwa fage dapat terlepas bila ujung serabut ekornya saja yang melekat pada permukaan sel dan bersifat ’tidak dapat balik’ bila cengkraman ekornya yang melekatkan diri pada sel inang.
Penetrasi fage ke sel inang bersifat mekanikal. Proses ini dipermudah dengan adanya digesti struktur permukaan oleh lisozim yang terdapat dalam ekor fage atau aktivasi enzim inang oleh fage.
Pada fage T-genap penetrasi berjalan sebagai berikut:
a. Serabut ekor melekatkan dirinya pada sel dan mencengkramkan dirinya pada dinding sel.
b. Selaput pada ekor berkontraksi dan mendorong isi ekor menembus dinding sel dan membran sel.
c. Fage melepaskan DNA-nya. Proses ini dapat disamakan dengan pengeluaran vaksin melalui suntikan.
Selubung protein yang membungkus kepala dan ekor tetap berada di luar sel. Fage T1 dan T5 yang tidak memiliki selaput kontraktil juga
melepaskan asam nukleat dengan cara melekatkan diri diantara lapisan membran dalam dan lapisan membran luar.
Pada fage tahap transkripsi terjadi dalam beberapa tahap melalui gen fage yang disebut sebagai:
a. gen awal pertama (immediate early genes) b. gen awal kedua (delayed early genes) c. gen akhir (late genes)
Penamaan ini didasarkan pada kurun waktu gen berfungsi (Lay & Hastowo 1992). Pada tahap sintesis, sintesis mRNA bakteri dan protein terhenti seketika setelah DNA fage masuk. DNA bakteri didegradasikan menjadi penggalan pendek. Sintesis mRNA fage segera dimulai setelah infeksi. DNA fage meningkat setelah suatu tenggang waktu, diikuti oleh protein fage, kapsid awal dan kapsid dewasa yang infeksius. Transkripsi terjadi seketika dengan menggunakan RNA polimerase bakteri. Proses ini menggunakan gen awal pertama yang berfungsi untuk menyandi nuklease yang menguraikan DNA inang. Nukleotida hasil penguraian ini digunakan oleh fage untuk mengubah enzim polimerase RNA bakteri sehingga terjadi transkripsi gen dari fage. Perubahan RNA polimerase bakteri menghasilkan DNA fage seperti 5-hidroksilmetilsitosin (menggantikan sitosin pada DNA bakteri). Proses ini terjadi melalui gen awal kedua. Enzim yang menguraikan sitosin bakteri menyebabkan fage dapat hidup dan bertahan, karena enzim penghambat (restriction enzymes) tidak lagi dapat menguraikan DNA fage disebabkan penggantian nukleotida menjadi 5-hidroksilmetilsitosin. Pada tahap berikut nuklease fage akan menghancurkan semua DNA yang tidak mengganti sitosin DNA-nya. Gen awal kedua juga menyandi polimerase dan ligase yang berperanan dalam replikasi fage. Gen akhir berfungsi dalam pembentukan ekor, kepala, dan serabut. Selain itu gen ini menyandi pembentukan lisozim fage yang melisiskan sel bakteri sehingga fage baru dapat dilepaskan dari sel. Pembentukan kepala, ekor, dan serabut ekor diatur melalui 3 jalur yang dilaksanakan oleh runutan gen yang berlainan.
Tahap pematangan atau perakitan merupakan tahap penyusunan asam nukleat dan protein virus menjadi partikel virus yang utuh. Tahap perakitan terjadi setelah sintesis protein dan asam nukleat yang diikuti oleh lisis sel bakteri
dan pelepasan fage. Fage baru akan menginfeksi sel bakteri lainnya dan siklus litik akan diulangi kembali (Tortora et al. 2006).
Penelitian dan Aplikasi Fage
Penemuan dan penelitian fage telah banyak dilakukan sejak Ernest Hanbury Hankin melakukan pengamatan pertamakali terhadap aktivitas fage yang menginfeksi Vibrio cholerae di India pada tahun 1896 (Skurnik & Strauch 2006). Kemudian berlanjut pada tahun 1917, Felix d’Herelle secara resmi menemukan fage dan ditetapkan untuk digunakan pada terapi terhadap penyakit disentri hemorrhagic pada tahun 1919. Setelah penemuan fage pada tahun 1915-1917, penggunaan fage dalam penggunaan secara klinis pada manusia dan perlakuan terhadap infeksi bakteri telah menjadi umum di Eropa khususnya di Eropa Timur (Alisky et al. 1998; Barrow & Soothill 1997). Terapi fage telah digunakan untuk melawan penyakit infeksi pada kulit, tulang, saluran gastrointestinal, dada, abdomen, kepala, leher, dan sistem organ tubuh lainnya (Alisky et al. 1998). Pada tahun 1921, Bruynoghe dan Maisin menggunakan bakteriofage untuk perlakuan terhadap penyakit kulit staphylococcal. Pada tahun 1940-an, perusahaan Eli Lilly di US memproduksi 7 produk fage yang digunakan untuk manusia. Kemudian pada tahun 1980-an, Smith dan Huggins melaksanakan berbagai percobaan terapi fage. Berdasarkan hasil penelitian Smith et al. (1987) menunjukkan bahwa fage memiliki potensi yang cukup potensial untuk mengendalikan penyakit infeksi E. coli pada ternak. Peneliti ini telah mengobati atau mencegah infeksi enteropathogenic E. coli (109 CFU) penyebab diare pada anak sapi dengan strain fage yang spesifik yang diatur dalam dosis oral tunggal (105 PFU) atau disemprotkan (102 PFU). Kemanjurannya hanya ketika fage tersebut diberikan sebelum atau bersama-sama dengan bakteri yang infektif. Jika fage diberikan setelah serangan diare, intensitas penyakit tersebut diturunkan namun penyakit tersebut tidak terobati (Smith et al. 1987). Pada tahun 1990-an, industri yang bergerak di bidang Bioteknologi mulai menyelidiki terapi fage di negara-negara Barat. Pada tahun 2002 dan 2003, dilakukan penelitian penggunaan fage terhadap bakteri Enterococcus yang resisten terhadap vancomycin (VRE) dan bakteri
Staphylococcus aureus yang resisten terhadap methicillin (MRSA) pada hewan tikus percobaan.
Aplikasi bakteriofage sebagai biokontrol pencemaran makanan diantaranya fage spesifik E. coli O157 pada daging (Kudva et al. 1999; Flynn et al. 2004), fage spesifik Salmonella dan Campylobacter pada ayam (Goode et al. 2003), fage spesifik Yersinia enterocolitica pada babi (Skurnik 1984; Strauch et al. 2001a), fage spesifik Lactococcus garviae dan Pseudomonas plecoglossicida pada ikan (Park & Nakai 2003; Park et al. 2000). Aplikasi bakteriofage terhadap sanitasi air, contohnya fage spesifik E. coli patogen yang telah diaplikasikan dalam bentuk tablet pada air minum secara in vivo di Bangladesh (Ochman & Selander 1984). Fage spesifik Listeria monocytogenes telah ditemukan sejak tahun 2004. Dua tahun kemudian, Exponential Biotherapies Incorporated (EBI) Food Safety mengeluarkan produk pertama fage ini dengan nama LISTEXTM P100 dan penggunaannya telah diizinkan oleh Food Drug Association (FDA). Produk fage ini telah diaplikasikan di Netherland, Eropa, dan Amerika Serikat pada produk makanan keju, daging, daging unggas, ikan, sayuran, mentega serta produk makanan lain.
Selain untuk aplikasi-aplikasi terapi dan biokontrol pencemaran, fage juga dapat digunakan untuk membersihkan keracunan makanan (Randerson 2003), sebagai antibakteri, dan penggunaan partikel fage untuk mengantarkan vaksin-vaksin dalam bentuk peptida-peptida imunogenik yang ditempelkan pada protein coating fage yang dimodifikasi (Clark & March 2004).
METODE
Metode PenelitianAlur penelitian dan metode yang digunakan dalam penelitian ini terdapat pada gambar 1. Metode tersebut terdiri atas 7 tahapan.
1. Filtrasi 2. Pencawanan 3. Pemurnian Fage
4. Produksi atau Perbanyakan Fage
Gambar 1 Diagram alir tahapan metode penelitian
Waktu dan Tempat
Penelitian ini dilaksanakan mulai bulan Juli 2008 sampai dengan Juni 2009, bertempat di Laboratorium Bioteknologi Hewan dan Biomedis, Pusat Penelitian Sumber Daya Hayati dan Bioteknologi (PPSHB), IPB Darmaga;
Peremajaan Isolat EPEC K1.1 dan E. coli non patogen
A. Isolasi dan Purifikasi Fage
D. Karakterisasi Protein Fage C. Kuantifikasi Fage
B. Penentuan Kisaran Inang
E. Pengamatan Morfologi Fage dengan Transmission Electron Microscope (TEM)
Laboratorium Mikrobiologi, Departemen Biologi Fakultas MIPA IPB Darmaga; Laboratorium TEM dan Histologi Lembaga Eijkman Biologi Molekular; dan di Laboratorium SEM LIPI Cibinong.
Bahan dan Alat
Bakteri yang digunakan ialah EPEC K1.1 yang merupakan koleksi Dr. dr. Sri Budiarti dan E. coli non patogen yang merupakan koleksi dari Laboratorium Mikrobiologi, Departemen Biologi FMIPA IPB. Sampel untuk isolasi bakteriofage berupa limbah cair rumah tangga daerah Babakan Raya, di Darmaga Bogor.
Media yang dipergunakan berupa media agar Luria Bertani (LB) yang terdiri atas 1% Bacto tryptone, 0.5% Bacto yeast extract, 1% NaCl, 2.5% Agar; media kaldu Luria Bertani (LB) yang terdiri atas 1% Bacto tryptone, 0.5% Bacto yeast extract, 1% NaCl; media LB supplement, yaitu media LB yang ditambah dengan 0.4% glukosa, 10 mM MgSO4. 7H2O; media H Agar (media agar-agar cawan tanpa yeast extract) yang terdiri atas 1% Bacto tryptone, 0.8% NaCl, 1.5% Agar; dan media Molten Top Agar yang terdiri atas 1% Bacto tryptone, 0.5% NaCl, 0.6% Agar. Alat yang dipergunakan shaker bath (Certomat WR); sentrifuse ukuran besar (Beckman); sentrifuse ukuran kecil (Eppendorf Centrifuge 5417C).
Peremajaan Isolat
Isolat EPEC K1.1 dan bakteri E. coli non patogen, masing-masing ditumbuhkan dengan metode kuadran pada media agar cawan Luria Bertani (LB) dan diinkubasi pada suhu 37 0C selama 24 jam. Koloni tunggal yang terbentuk diambil dan ditumbuhkan pada media agar miring Luria Bertani (LB) lalu diinkubasi pada suhu 37 0C selama 12 jam. Hasil biakan disimpan pada suhu 4 0C untuk digunakan sebagai stok bakteri uji.
Isolasi dan Purifikasi Fage Filtrasi
Sebanyak 4.5 mL limbah dicampurkan dengan 0.5 mL dari kultur EPEC OD600=1 atau E. coli non patogen dalam media kaldu Luria Bertani (LB) dan 0.5
mL dari 10x LB. Campuran diinkubasi 24-48 jam pada suhu 37 0C. Kultur kemudian disentrifugasi dengan sentrifuse ukuran besar pada kecepatan 2500 rpm, suhu 4 0C selama 20 menit. Sebanyak 3 ml supernatan diambil dengan 5 ml syringe dan difiltrasi dengan membran millipore 0.22 mikro. Supernatan yang telah difiltrasi dimasukkan ke dalam tabung yang steril (Pitt & Gaston 1995).
Pencawanan
Koloni tunggal EPEC K1.1 dan E. coli non patogen, masing-masing ditumbuhkan ke dalam media kaldu LB supplement lalu diinkubasi pada shaker bath dengan kecepatan 150-200 rpm pada suhu 37 0C selama 5-7 jam sampai OD600=1. Sebanyak 100 mikroliter dari pertumbuhan bakteri dicampurkan dengan 100 mikroliter supernatan yang telah difiltrasi dalam tabung yang steril diinkubasi pada suhu 37 0C selama 30 menit. Campuran ditambahkan 3 ml agarose cair (molten top agar) yang bersuhu 47 0C, dicawankan pada media agar-agar tanpa yeast extract, diputar perlahan untuk meratakan sebaran dan dibiarkan memadat. Inkubasi dilakukan pada 37 0C selama 12 jam (Chibani-Chennoufi et al. 2004).
Pemurnian Fage
Beberapa fage yang menunjukkan penampakan plak berbeda, masing-masing dimurnikan dengan memindahkan plak yang terisolasi dengan baik menggunakan pipet Pasteur kemudian plak tersebut dicampurkan dengan 2-3 ml 25% pelarut Ringers. Suspensi fage divortex dan dibiarkan selama 5-10 menit pada suhu ruang. Suspensi tersebut kemudian difiltrasi menggunakan membran filter 0.45 µ. Tahap selanjutnya dilakukan penambahan 3-5 tetes kloroform yang mengandung 1% etanol dengan tujuan untuk membunuh beberapa bakteri yang masih ada. Sentrifugasi dilakukan dengan sentrifuse ukuran besar pada kecepatan 2800 rpm, suhu 4 0C, selama 20 menit. Supernatan disentrifugasi sebanyak 2 kali ulangan untuk meminimalkan adanya bakteri dan debris lainnya, kemudian supernatan hasil sentrifugasi yang mengandung fage diambil dan disimpan untuk bahan produksi.
Produksi atau Perbanyakan Fage
Kultur inang disiapkan dengan cara menumbuhkan bakteri EPEC pada 1% (v/v) media kaldu LB suhu 37 0C, 150 rpm pada shaker bath selama 3-5 jam, Sebanyak 100 µl kultur EPEC diinfeksikan dengan fage dalam jumlah yang sama
pada suhu 37 0C, 50 rpm pada shaker bath, selama 1 jam. Lima tetes kloroform yang mengandung 1% etanol ditambahkan, kemudian disentrifugasi dengan sentrifuse ukuran besar pada kecepatan 2900 rpm, suhu 4 0C, selama 30 menit. Supernatan dipisahkan dan ditambahkan PEG-8000/ 2.5 M NaCl sebanyak seperempat dari volume supernatan yang diperoleh. Selanjutnya didinginkan pada suhu 0 0C selama kurang lebih 1 jam dan disentrifugasi dengan sentrifuse ukuran besar pada kecepatan 2500 rpm, suhu ruang selama 30 menit. Supernatan dibuang, pellet fage yang berada di dasar tabung diresuspensi 500-1000 µl STE buffer (1 M Tris pH 8, 0.5 M EDTA pH 8, 5 M NaCl) lalu disentrifugasi dengan sentrifuse ukuran kecil pada kecepatan 13000 rpm, suhu ruang, selama 20 menit. Supernatan yang diperoleh dipindahkan ke eppendorf baru dan ditambahkan 100 µl EDTA 5 mM, kemudian disimpan sebagai stok.
Penentuan Kisaran Inang Fage
Sebanyak 100 µl kultur bakteri EPEC K1.1 dan E. coli non patogen yang telah ditumbuhkan di media kaldu LB selama 3-4 jam, masing-masing dicampurkan dengan stok fage dalam konsentrasi yang sama lalu diinkubasi pada suhu 37 0C selama 15-30 menit. Sebanyak 3.5ml molten top agar yang masih bersuhu 42 0C dicampurkan, selanjutnya dituang ke media agar cawan LB, ditunggu hingga molten top agar memadat, kemudian diinkubasi pada suhu 37 0C.
Kuantifikasi Fage (Penentuan PFU)
Plaque forming units (PFU/ ml) ditentukan berdasarkan metode dari Foschino et al. (1995), yaitu 100 µl larutan fage ditambahkan dengan 100 µl kultur EPEC K1.1 yang telah diinkubasi selama 3-4 jam pada media LB. Suspensi diinkubasi selama 15 menit pada suhu 37 0C, dicampurkan dengan 3 ml molten top agar yang masih bersuhu 50 0C, dituang ke atas permukaan media cawan agar-agar tanpa yeast extract. Inkubasi dilakukan pada suhu 37 0C, plak-plak yang terbentuk dihitung setelah diinkubasi selama semalam.
Karakterisasi Fage Hasil Isolasi
Karakterisasi Protein
Stok fage diukur kadar proteinnya dengan menggunakan metode Bradford (1976). Langkah awal untuk menentukan konsentrasi protein sampel ialah membuat serial konsentrasi standar protein Bovine Serum Albumin (BSA) dari 0.1 hingga 1.0 mg/ ml. Masing-masing konsentrasi standar protein dan sampel diambil sebanyak 400 µl dan ditempatkan pada tabung reaksi. Masing-masing tabung ditambahkan 4 ml pereaksi Bradford (Lampiran 1). Campuran dihomogenkan dan diinkubasi pada 37 0C selama 15 menit kemudian diukur absorbansinya dengan spektrofotometer pada λ 595 nm.
Nilai absorbansi dan konsentrasi protein dari standar BSA diplotkan pada grafik cartesius dengan konsentrasi protein sebagai absis (sumbu x) dan absorbansi sebagai ordinat (sumbu y), kemudian ditentukan persamaan garis regresinya. Kurva yang terbentuk dijadikan sebagai kurva standar untuk menentukan konsentrasi protein sampel (Lampiran 5).
Berat molekul isolat fage yang diperoleh dianalisis dengan Sodium Dodecyl Sulphate-Poly Acrilamide Gel Electrophoresis (SDS-PAGE) (Laemmli 1970). Marker yang digunakan ialah lactate dehydrogenase, ovalbumin, bovine serum albumin, dan β-galactosidase (Fermentas) dengan berat molekul berturut-turut adalah 35.0, 45.0, 66.2, dan 116.0 kDa.
Konsentrasi gel pemisah sebesar 12% poli akrilamida yang ditempatkan pada bagian bawah. Konsentrasi gel pengumpul sebesar 7.5% poliakrilamida yang diletakkan di bagian atas setelah gel pemisah sudah menjadi benar-benar padat. Komposisi bahan untuk membuat gel pemisah maupun gel pengumpul tertera pada Lampiran 2 dan komposisi larutan stok SDS-PAGE tertera pada Lampiran 3. Stok fage dan molecular weight marker, masing-masing dicampurkan dengan buffer sampel dengan perbandingan 4:1 (4 bagian sampel dan 1 bagian buffer sampel). Campuran disentrifugasi dengan sentrifuse ukuran kecil pada kecepatan 13000 rpm, suhu ruang, selama 20 menit dan dipanaskan dalam air mendidih selama 5-10 menit, dimasukkan ke dalam sumur gel dengan volume 45 µl. Elektroforesis dijalankan dengan arus 20 mA dan tegangan 75 volt selama 3 jam. Elektroforesis diakhiri pada saat pewarna sampel mencapai batas 0.5 cm
hingga 1 cm dari bagian bawah gel. Setelah elektroforesis berakhir, gel diangkat dari lempeng kaca dan dilakukan pewarnaan perak (silver stain). Bahan dan prosedur untuk pewarnaan silver stain dapat dilihat pada Lampiran 4.
Pengamatan Morfologi Fage dengan Transmission Electron Microscope (TEM)
Preparasi untuk pengamatan sampel dengan menggunakan TEM dilakukan berdasarkan metode Bozzola dan Russell (1998). Stok fage diteteskan sebanyak 5µl pada grid menggunakan mikropipet, ditunggu selama 30 detik, selanjutnya dikeringkan dengan kertas saring. Sebanyak 5µl Uranyl Acetate 2% diteteskan ke atas grid, ditunggu selama 1 menit. Grid dikeringkan dengan menggunakan kertas saring dan dibiarkan selama ± 60 menit agar benar-benar kering.
Grid-grid EM diletakkan pada holder, dibiarkan kering selama beberapa jam. Setelah spesimen kering, diperiksa dengan menggunakan Mikroskop Elektron Transmisi model JEOL JEM-1010 yang dioperasikan 80kV pada perbesaran 50000x - 85000x.
Efektifitas Lisis Sel EPEC K1.1 oleh Fage
Sebanyak 100 µl kultur bakteri EPEC K1.1 yang telah ditumbuhkan di media kaldu LB sampai OD=1 diinfeksikan dengan 100 µl stok fage. Kontrol positif ialah kultur EPEC K1.1 tanpa fage. Masing-masing kultur diamati pada masa inkubasi berturut-turut 0, 5, 10, 15, 21, dan 24 jam dengan pencawanan di media Eosin Methylene Blue (EMB), diinkubasi 24 jam pada suhu 37 0C.
Pengamatan Morfologi Lisis EPEC K1.1 oleh Fage dengan Scanning Electron Microscope (SEM)
Sebanyak 250 µl kultur EPEC K1.1 yang telah ditumbuhkan di media kaldu LB sampai OD=1 ditambah 250 µl stok fage diinkubasi 25 dan 30 menit. Sebagai kontrol positif ialah 500 µl kultur EPEC tanpa fage. Masing-masing kultur diamati dengan menggunakan SEM. Preparasi untuk pengamatan sampel dengan menggunakan SEM dilakukan dengan metode Wendelschafer-crabb et al.
(1975). Masing-masing campuran disentrifugasi hingga sel-selnya mengendap. Endapan direndam glutaraldehida 2% selama 2 jam. Glutaraldehida dipisahkan dengan cara disentrifugasi, supernatan dibuang, direndam dalam larutan dapar caccodylate. Setelah direndam selama 10 menit, larutan dapar dibuang dengan cara disentrifugasi, endapan direndam dengan osmium tetraoksida 1% selama 1 jam. Sampel disentrifugasi kembali, direndam dengan alkohol 50% selama 10 menit sebanyak 2 kali. Secara berturut-turut sampel ditambahkan alkohol 70%, 80%, 95%, dan alkohol absolut dengan perendaman masing-masing selama 10 menit. Larutan alkohol dibuang dengan cara disentrifugasi, direndam t-butanol selama 10 menit sebanyak 2 kali sampai terbentuk suspensi dalam butanol. Cover slip (cover glass yang dipotong dengan ukuran 0.25 cm2) dicuci dengan alkohol absolut, suspensi bakteri dioleskan di atasnya setelah cover slip kering. Sampel dikeringbekukan dan dilapisi ion Au. Semua tahapan sentrifugasi dilakukan pada kecepatan 4000 x g selama 5 menit. Sampel diamati menggunakan mikroskop elektron payaran bervakum rendah model JSM-5310LV pada perbesaran 10000x – 20000x.
HASIL DAN PEMBAHASAN
HasilA. HASIL ISOLASI DAN POLA KERAGAMAN PLAK FAGE EPEC K1.1
Hasil isolasi fage yang diambil dari sampel limbah cair rumah tangga di sepanjang Babakan Raya Darmaga Bogor pada mulanya diperoleh 9-18 plak serta adanya beberapa zona bening atau zona hambat lainnya di pinggir agar cawan yang ditumbuhi kultur EPEC K1.1. Plak yang terbentuk dari suatu kultur bakteri yang ditumbuhkan di cawan petri merupakan satu parameter penting dari adanya fage pada siklus litik. Plak tersebut terlihat bening yang menandakan adanya zona kerusakan sel.
(a) (b)
(c) (d)
Gambar 2 Pola keragaman plak fage. Isolat FB1 (a), FB2 (b), FB3 (c), FB4 (d) (masing-masing plak diberi tanda lingkaran).
Fage hasil isolasi dipilih menjadi 4 isolat fage secara random. Masing-masing isolat fage diberi nama FB1, FB2, FB3, dan FB4. Masing-Masing-masing isolat fage tersebut satu sama lain memiliki pola keragaman plak yang berbeda, seperti terlihat pada Gambar 2. Pola keragaman plak terlihat dari ukuran dan bentuk zona
bening dari masing-masing fage. Fage FB4 cenderung memiliki ukuran lebih besar dan lebih beragam daripada ketiga isolat fage lainnya (Gambar 2d).
B. HASIL PENENTUAN KISARAN INANG
Kisaran inang dari fage yang terisolasi spesifik terhadap bakteri EPEC K1.1. Hal ini terlihat dari pembentukan plak yang hanya tampak pada kultur EPEC K1.1 sedangkan pada E. coli non patogen tidak tampak adanya pembentukan plak (Gambar 3b).
(a) (b)
Gambar 3 Kisaran inang fage. Plak muncul pada fage yang diinfeksikan dengan EPEC K1.1 (a) (diberi tanda lingkaran); sedangkan pada E. coli non patogen tidak muncul adanya plak (b).
C. HASIL KUANTIFIKASI FAGE
Dari 100 µl kultur EPEC yang diinfeksikan dengan 100 µl fage menghasilkan plak yang terbentuk (PFU) dengan jumlah atau kuantitas seperti yang terlihat pada Tabel 1.
Tabel 1 Hasil kuantifikasi dari keempat isolat fage
Isolat Fage Jumlah Plak per 100 µl Konsentrasi Fage (PFU/ ml)
FB1 8 80 FB2 410 4100 FB3 25 250 FB4 1600 16000
D. HASIL KARAKTERISASI PROTEIN FAGE
Kadar protein masing-masing fage berbeda satu sama lain. Pada Tabel 1.. terlihat bahwa FB 4 memiliki kadar protein paling tinggi dibanding fage yang lain sebanyak 222.5 µg/ ml sedangkan FB1, FB2 dan FB3 secara berurutan memiliki konsentrasi protein sebesar 97.5; 82.5 dan 170µg/ ml.
Tabel 2 Konsentrasi protein keempat isolat fage
Isolat Fage Konsentrasi Protein (µg/ ml)
FB1 97.5 FB2 82.5 FB3 170 FB4 222.5
Analisis Bobot Molekul Protein Fage
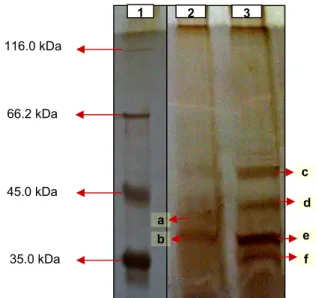
Hasil analisis bobot molekul protein fage dengan menggunakan Sodium Dodecyl Sulphate-Poly Acrilamide Gel Electrophoresis (SDS-PAGE) terlihat pada Gambar 4. Analisis pada SDS-PAGE dilakukan setelah terlebih dahulu menentukan kadar protein fage dengan menggunakan metode Bradford (1976). Dengan volume larutan fage yang sama pada masing-masing sumur gel menunjukkan bahwa FB3 menampakkan pita protein pada ukuran 51.8 kDa; 42.6 kDa; 34.6 kDa; dan 30.8 kDa sedangkan FB4 menampakkan pita protein pada
ukuran 40.3 kDa dan 35.9 kDa. Pada FB 1 dan FB2 tidak menampakkan adanya pita protein, mungkin karena rendahnya kadar protein fage tersebut.
Gambar 4 Kisaran berat molekul protein fage pada SDS-PAGE . 1) Marker. 2) Isolat FB4, dengan ukuran pita protein sebesar 40.3 kDa (a) dan 35.9 kDa (b). 3) Isolat FB3, dengan ukuran pita protein sebesar 51.8 kDa
(c), 42.6 kDa (d), 34.6 kDa (e), 30.8 kDa (f).
E. HASIL PENGAMATAN MORFOLOGI FAGE DENGAN TEM
Analisis morfologi dengan menggunakan TEM pada FB4 menunjukkan kepala fage yang berbentuk heksagonal ikosahedral. Lebar kepala fage sebesar 81.56 nm dan panjangnya sebesar 103.11 nm, seperti terlihat pada Gambar 5.
(a) (b)
Gambar 5 Morfologi fage FB 4, perbesaran 80000x (a), kepala fage yang diperbesar menunjukkan bentuk heksagonal ikosahedral (b). Tanda ( ) menunjukkan kepala.
1 2 116.0 kDa 66.2 kDa 45.0 kDa 35.0 kDa a b c d e f 3
F. EFEKTIFITAS FAGE MELISIS EPEC K1.1
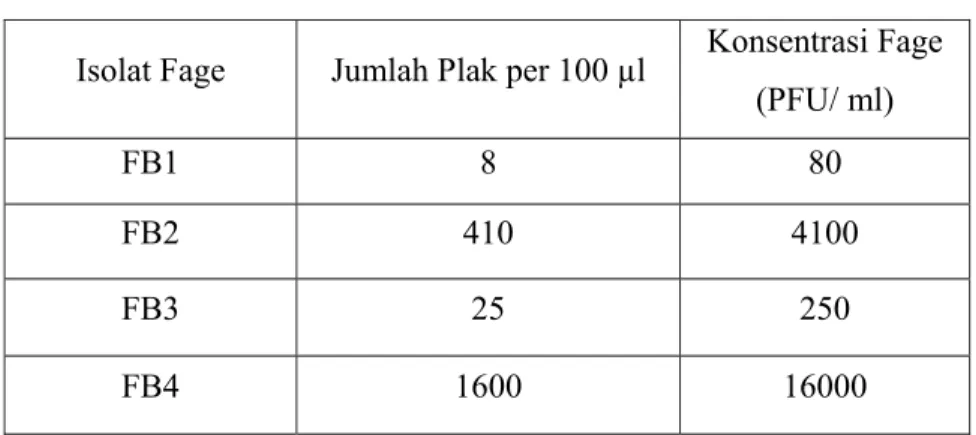
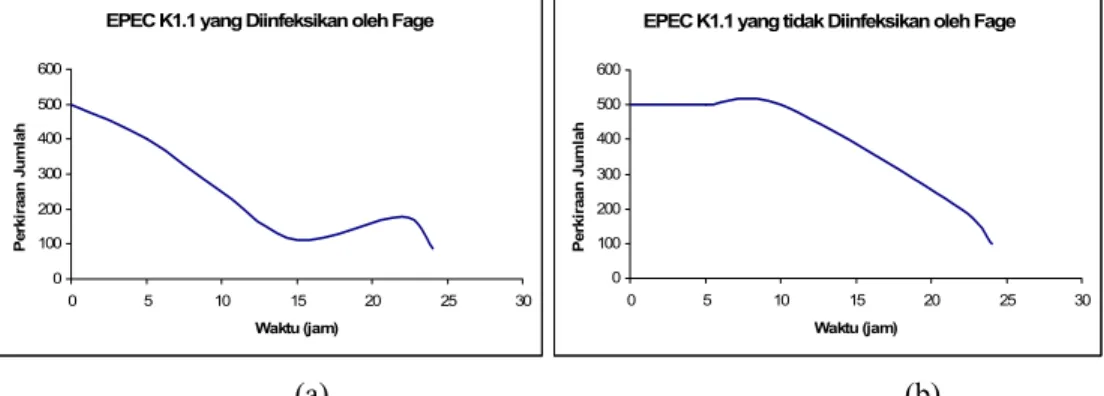
Infeksi fage terhadap jumlah pertumbuhan EPEC K1.1 selama 24 jam dengan selang waktu rata-rata 5 jam, terlihat pada Gambar 6. Kurva ini menunjukkan penurunan jumlah populasi sel EPEC K1.1 pada 1 jam pertama dan semakin tampak penurunannya setelah 5 jam berikutnya. Hal ini tampak berbeda dengan perlakuan kontrol yang baru menunjukkan penurunan jumlah populasi sel EPEC K1.1 setelah 10 jam. Penambahan FB4 pada kultur EPEC K1.1 yang diinkubasi pada suhu 370 C selama 5 jam dapat menurunkan jumlah populasi EPEC K1.1 sebanyak 22% dan 84 % setelah inkubasi selama 24 jam.
(a) (b)
Gambar 6 Kurva efektifitas lisis sel EPEC K1.1 oleh FB4. EPEC K1.1 yang diinfeksi oleh FB4 (a) dan yang tanpa fage (sebagai kontrol) (b)
selama 24 jam.
Morfologi Sel EPEC K1.1 akibat infeksi fage
Hasil pengamatan di SEM menunjukkan adanya pengaruh atau efek dari penginfeksian fage FB4 terhadap morfologi sel EPEC K1.1. Berdasarkan hasil pengamatan di SEM, tampak sejumlah besar fage yang menginfeksi sel EPEC K1.1. Fage yang menginfeksi beberapa EPEC K1.1 menyebabkan beberapa EPEC K1.1 menjadi lisis melepaskan banyak partikel fage baru. Pada sel-sel EPEC K1.1 yang tidak diinfeksi oleh fage, sebagai kontrol positifnya (Gambar 7a), tampak morfologi sel yang masih utuh dan rapat. Pengaruh penginfeksian fage FB4 terhadap morfologi sel EPEC K1.1 terlihat pada Gambar 7 dan Gambar 8.
EPEC K1.1 yang Diinfeksikan oleh Fage
0 100 200 300 400 500 600 0 5 10 15 20 25 30 Waktu (jam) P er kir aa n J u m la h K o l
EPEC K1.1 yang tidak Diinfeksikan oleh Fage
0 100 200 300 400 500 600 0 5 10 15 20 25 30 Waktu (jam) P er ki raa n Ju m la h K o l
(a)
(b)
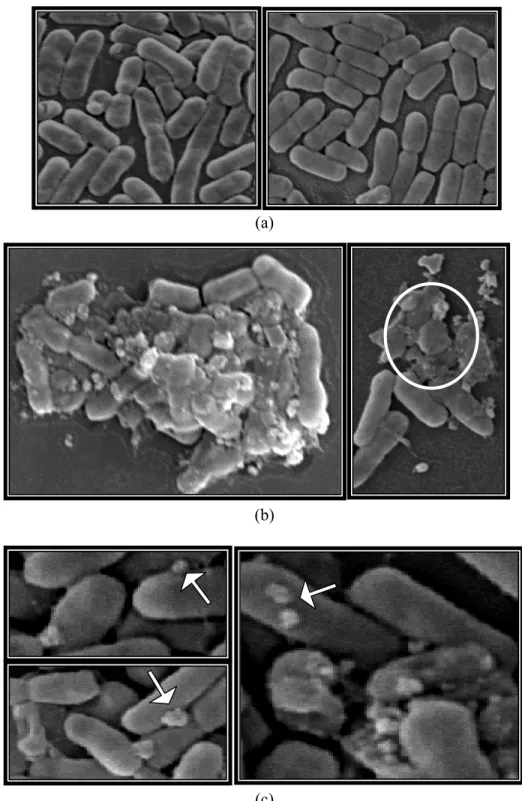
(c)
Gambar 7 Morfologi kerusakan EPEC K1.1 karena infeksi FB4 selama 25 menit. Sel EPEC K1.1 tanpa fage (a); sel EPEC K1.1 yang diinfeksi oleh fage dengan inkubasi 25 menit (b), (c). Tanda panah menunjukkan fage yang menginfeksi EPEC K1.1, tanda lingkaran menunjukkan kerusakan dan lisisnya sel EPEC K1.1.
Hasil pengamatan di SEM, terlihat bahwa FB4 dapat memecahkan/ melisiskan sel EPEC K1.1 dalam waktu 25 menit inkubasi (Gambar 7b). Dalam waktu lebih lama lagi yaitu 30 menit, morfologi sel EPEC K1.1 tampak banyak yang sudah hancur atau lisis melepaskan fage-fage baru kemudian menginfeksi bakteri-bakteri lain. Pada permukaan dinding sel terlihat sudah tidak utuh lagi atau rusak. Hancuran dari sel EPEC K1.1 tampak bergabung dengan partikel fage yang semakin banyak keluar dari sel inang (Gambar 8b).
(a)
(b)
Gambar 8 Morfologi kerusakan EPEC K1.1 karena infeksi FB4 selama 30 menit (a), (b). Tanda panah menunjukkan fage yang menginfeksi EPEC K1.1, tanda lingkaran menunjukkan kerusakan dan lisisnya sel EPEC K1.1.
Pembahasan
Fage tidak mampu bereplikasi sendiri tanpa adanya sel inang sehingga dalam melakukan pengisolasian fage perlu dicampurkan dengan bakteri sebagai inangnya virus. Metode isolasi fage yang dilakukan ialah dengan metode enrichment yaitu memperkaya nutrisi pada media pertumbuhan bakteri agar virus dapat bereplikasi di dalam tubuh bakteri dan dapat dengan mudah diperoleh dalam jumlah yang banyak. Fage dapat diisolasi dan dikultivasi pada biakan bakteri yang muda (pada fase logaritma) dan sedang tumbuh aktif dalam kaldu atau cawan agar. Penggunaan media padat memungkinkan timbulnya plak sehingga dapat dilakukan pendeteksian atau penghitungan virus bakteri (fage). Persyaratan utama bagi isolasi dan kultivasi fage ialah harus adanya kondisi optimum untuk pertumbuhan organisme inangnya (Pelczar & Chan 1988) sehingga pada penginfeksian fage dengan EPEC K1.1 dilakukan pada suhu 37 0C. Pada proses pemurnian fage dilakukan dengan penambahan kloroform yang mengandung 1% etanol. Hal ini bertujuan untuk membunuh sisa-sisa bakteri agar diperoleh fage murni tanpa adanya inang. Kennedy et al. (1984) dalam Pierson dan Stern (1986) menyebutkan bahwa penggunaan kloroform itu merugikan bagi beberapa kolifage sehingga penggunaannya bisa diminimalisir dengan memproduksi fage pada suatu media selektif. Penginfeksian terhadap inang yang selanjutnya digunakan, penting dilakukan untuk mendeteksi viabilitas fage setelah penyimpanan. Penentuan jumlah sel ekstraseluler dilakukan dengan sentrifugasi campuran bakteri dengan fage. Jika berdasarkan ukuran fage yang lebih kecil daripada bakteri maka sejumlah fage diharapkan banyak berada pada bagian supernatan.
Hasil isolasi fage dari sampel limbah cair rumah tangga daerah Babakan Raya menghasilkan 9-18 plak dan dari plak tersebut terpilih 4 isolat fage (FB1, FB2, FB3, dan FB4) secara random. Fage yang diinfeksikan ke bakteri EPEC K1.1 (bakteri uji) dikondisikan dalam siklus litik karena pada siklus litik, tahap adsorpsi, penetrasi, sintesis, dan pematangan berlangsung dengan cepat. Pada siklus ini pula partikel virus keluar dari sel yang diserangnya dengan memecahkan sel tersebut sehingga sel inang mati (lisis). Plak yang terbentuk dari suatu kultur bakteri yang ditumbuhkan di cawan petri merupakan satu parameter penting dari
adanya fage pada siklus litik. Plak tersebut terlihat bening yang menandakan adanya zona kerusakan sel. Setiap plak berasal dari satu partikel fage sama seperti setiap koloni berasal dari satu sel bakteri. Satu plak berasal dari satu partikel virus sehingga seluruh partikel virus yang terdapat pada plak tersebut seharusnya juga memiliki sifat genetik yang sama. Pada saat terbentuknya plak, bakteri yang tidak terkena infeksi tersebar di tempat lain di dalam agar cawan dan menghasilkan suatu background yang keruh.
Proses isolasi fage dilakukan dengan berbagai perlakuan sampai dengan pemurnian untuk memastikan suatu populasi fage yang murni tanpa adanya beberapa bakteri termasuk inang bakteri yang tahan fage. Hal ini juga dianggap penting karena populasi fage terdiri atas beberapa strain fage dengan satu karakteristik umum. Masing-masing fage menginfeksi pada inang tertentu sehingga sangat diperlukan tahapan untuk memperoleh strain murni (Goodridge et al. 2003).
Fage (FB1, FB2, FB3, dan FB4) yang terisolasi, spesifik terhadap EPEC K1.1 karena fage-fage tersebut mampu mereduksi jumlah EPEC K1.1. Keempat isolat fage yang spesifik terhadap bakteri EPEC K1.1 diduga merupakan isolat yang tidak serupa atau tidak identik. Berdasarkan pengamatan secara visual, ukuran plak yang terbentuk dari satu isolat fage tampak berbeda dengan isolat fage yang lain (Gambar 2). Hal ini menandakan fage-fage tersebut berbeda dalam cara melisiskan sel inang. Hasil penelitian Yoon et al. (2007) yang menggunakan fage Pediococcus juga menunjukkan perbedaan ukuran plak antara beberapa fage Pediococcus. Ukuran lisisan tersebut signifikan dengan jumlah partikel fage yang dibebaskan dari sel. Rata-rata dari setiap lisisan melepaskan lebih kurang 60 partikel fage tiap sel bakteri (Ellis & Delbruck 1938). Berdasarkan hasil penelitian tersebut, ukuran pembentukan plak masing-masing fage dari hasil menginfeksi sel inang yang sama berkaitan dengan perbedaan cara merespon sel bakteri EPEC terhadap asam nukleat fage yang disisipkan atau kemampuan fage dalam bereplikasi di dalam sel inang. Pola lisis suatu galur bakteri yang diakibatkan oleh tipe fage yang berbeda-beda memberikan petunjuk mengenai bakteri tersebut dan untuk penentuan tipe fage (phage typing) (Pelczar & Chan 1988). Fage FB4 memiliki ukuran zona bening lebih besar dan lebih beragam daripada ketiga isolat
fage lainnya. Hal ini menandakan FB4 memiliki kemungkinan sebagai fage infektif kuat.
Kepekaan galur bakteri terhadap fage yang menyerangnya berbeda-beda yang diakibatkan variasi molekul reseptor (penghalangan adsorpsi), sistem modifikasi restriksi dalam sel inang, atau sistem ketahanan fage lainnya seperti infeksi abortif (Flynn et al. 2004). Fage melekat ke sel yang peka rangsangan pada lokasi spesifik di dinding sel bakteri (Kudva et al. 1999). Di dalam bakteri gram negatif, sel yang peka rangsangan ialah komponen protein dan lipopolisakarida yang melapisi lapisan selaput sebelah luar termasuk peptidoglikan. Fage tertentu atau sekelompok fage akan melekat ke reseptor spesifik, dan fage berbeda akan melekat ke reseptor yang berbeda. Beberapa bagian struktural bakteri seperti flagella, pilus, kapsul, teichoicacid, LPS, dan OMP dapat menyediakan reseptor spesifik dalam bakteri tertentu (Gurnev et al. 2006). Penentuan kisaran inang dilakukan untuk melihat kespesifisitas inang dan derajat lisis dari fage yang diperoleh. Masing-masing isolat fage memperlihatkan spesifisitas terhadap EPEC K1.1 karena ketika fage yang diperoleh diuji dengan masing-masing isolat EPEC K1.1 dan E. coli non patogen, ternyata kisaran inangnya hanyalah pada isolat EPEC K1.1. Sel EPEC K1.1 tampak dilisiskan oleh fage (Gambar 3a) sedangkan E. coli non patogen tidak (Gambar 3b). Kespesifikan isolat fage yang diperoleh terhadap EPEC K1.1 menunjukkan dugaan bahwa di permukaan sel EPEC K1.1 memiliki reseptor-reseptor yang spesifik terhadap fage yang tidak dimiliki oleh E. coli non patogen.
Adsorpsi partikel-partikel fage terhadap sel-sel bakteri (tahap awal infeksi fage) bergantung pada kehadiran reseptor-reseptor spesifik di dinding sel bakteri (Topley & Wilson 1990). Banyak reseptor-reseptor dinding sel dimiliki oleh galur dan serotipe bakteri yang berbeda. Berdasarkan hasil penelitian Kudva et al. (1999), infeksi fage bergantung pada sifat alami LPS O157. Bakteri Escherichia coli O157 dapat menghasilkan LPS O157. Jika komplemen E. coli mutan O157-deficient yang ujung gen penyandi LPS 0157 untuk bakteri tersebut dipotong maka akan membuat bakteri resisten terhadap infeksi fage.
Cara penghitungan yang paling mudah ialah esei bercak/ plak (plaque assay), yang dapat disamakan dengan penghitungan bakteri hidup. Plak yang
terbentuk adalah unik di dalam kemampuan mereka untuk mengidentifikasi dan membeda-bedakan galur inang bakteri. Masing-Masing plak secara teoritis sesuai dengan virus tunggal yang berada pada suspensi awal. Oleh karena itu, konsentrasi suspensi virus diukur oleh banyaknya plak yang biasanya disebut plaque forming unit (PFU) (Tortora et al. 2006). Penelitian tentang fage seringkali memerlukan penghitungan fage secara cermat dan teliti. Hasil kuantifikasi atau penghitungan plak yang terbentuk (PFU) (Tabel 1) setelah dilakukan satu kali perbanyakan dalam proporsi yang sama (100 µl kultur EPEC diinfeksikan dengan 100 µl fage) menunjukkan bahwa FB4 memiliki kemampuan infeksi terkuat terhadap EPEC K1.1 dibandingkan ketiga isolat fage yang lain. Kecepatan pembentukan plak ini diduga berkaitan pula dengan kecepatan multiplikasi dari FB4 sehingga lebih efektif dalam menginfeksi sel EPEC K1.1 dibandingkan ketiga isolat lainnya. Hal ini memungkinkan peluang FB4 untuk dapat diaplikasikan dalam biokontrol pencemaran air dan makanan.
Protein yang dimiliki oleh keempat isolat fage cenderung kecil. Dalam tiap mililiternya, FB1 hanya memiliki 97.5 µg; FB2 82.5 µg; FB3 170 µg; dan FB4 222.5 µg (Tabel 2). Setelah dijalankan dengan SDS-PAGE, terdapat 2 isolat fage (FB3 dan FB4) yang menunjukkan adanya pita protein. Kisaran protein yang diperoleh antara 30-51 kDa (Gambar 4). Protein fage yang diukur kadar proteinnya tersebut merupakan hasil produksi yang dilakukan berkali-kali. Berdasarkan hasil yang telah diperoleh menunjukkan bahwa ukuran kadar protein fage tidak memberikan adanya signifikansi dengan jumlah partikel fage. Konsentrasi protein yang cenderung lebih kecil diduga disebabkan oleh mudahnya protein fage terdegradasi oleh protease ekstraselular yang dimiliki sel EPEC K1.1. Selain itu, ukuran protein yang kecil mungkin saja disebabkan oleh konsentrasi protein fage EPEC itu sendiri yang memang lebih kecil sehingga walaupun dalam penelitian ini sudah digunakan EDTA 5 mM sebagai tambahan pada media penyimpanan fage yang berfungsi sebagai antiprotease (Waturangi 1999) namun tetap saja kurang berpengaruh. Hal ini hampir serupa dengan penelitian Yoon et al. (2007), dimana setelah dianalisis dengan SDS-PAGE menunjukkan kisaran ukuran protein 33-34.5 kDa untuk fage yang menginfeksi Leuconostoc oenos dan 34-37 kDa untuk fage yang menginfeksi P. acidilactici.
Berdasarkan karakteristik isolat FB4 seperti dari ukuran lisisan yang lebih besar; kemampuan dalam menginfeksi sel EPEC K1.1 yang lebih baik; serta lebih tingginya konsentrasi protein FB4 diantara ketiga isolat fage yang lain, maka isolat FB4 yang selanjutnya diamati penampakan morfologinya.
Penampakan morfologi dari fage yang terpurifikasi diperiksa dengan menggunakan Transmission Electron Microscopy (TEM). Pemeriksaan dengan menggunakan TEM dapat memperlihatkan bentuk morfologi fage secara 2 dimensi dengan perbesaran 50000x dan 80000x. Analisis morfologi dengan menggunakan TEM pada FB4 (Gambar 5) menunjukkan morfologi kepala fage yang besar dan berbentuk heksagonal ikosahedral. Lebar kepala fage berukuran sebesar 81.56 nm dan panjang kepala fage sebesar 103.11 nm. Jika hanya berdasarkan ciri-ciri morfologi yang dimiliki isolat fage FB4, maka morfologi fage tersebut hampir serupa dengan banyak fage dari famili Siphoviridae ordo Caudovirales. Berdasarkan klasifikasi dari the International Committee on Taxonomy of Viruses (ICTVdB Index of Viruses 2000), morfologi fage yang termasuk famili Siphoviridae memiliki ekor fleksibel, tidak memiliki selaput kontraktil, panjang, heliks dan kepala heksagonal ikosahedral seperti fage λ enterobacteria pada umumnya. Menurut hasil penelitian Girons et al. (1990), berdasarkan hasil pengamatan di mikroskop elektron dengan pewarnaan negatif, fage untuk Leptospira terlihat identik secara morfologi dengan kepala polihedral dan ekor kontraktil. Rata-rata diameter kepalanya ialah 85 nm, dengan panjang ekor 100 nm, lebar 25 nm. Morfologi ini serupa dengan banyak fage eubacteria yang masuk dalam kelompok A1 famili Myoviridae (Ackermann & DuBow 1987).
Pengujian efektifitas infeksi bakteriofage terhadap sel EPEC K1.1 bertujuan agar dapat diketahui dengan tepat waktu yang dibutuhkan bakteriofage dalam mengontrol berkembangbiaknya EPEC pada tubuh inang. Sebanyak 1000 plak dalam 100 µl fage yang setara dengan 10000 PFU telah memberikan pengaruh terhadap pertumbuhan EPEC K1.1. Pengaruh pemberian fage terhadap pertumbuhan EPEC K1.1 memberikan penurunan populasi sel bakteri EPEC K1.1 pada 1 jam pertama dan semakin tampak menurun setelah 5 jam berikutnya (Gambar 6a). Hal ini berbeda dengan pertumbuhan EPEC K1.1 yang normal